Кроличья лихорадка что это
Обновлено: 25.04.2024
Туляремия. Возбудитель и механизм развития туляремии
Чумоподобная болезнь, кроличья лихорадка, лихорадка оленьей мухи, мышиная болезнь, конъюнктивит Парино.
Туляремия - острое инфекционное природно-очаговое заболевание, протекающее с интоксикацией, лихорадкой различной локализации и поражением лимфатических узлов в виде специфических лимфаденитов со склонностью к затяжному течению. Регистрируется во многих странах мира (Европы и Америки, Азии и Африки).
Природные очаги туляремии в нашей стране распространены от западных границ бывшего СССР до восточных и от полярного круга до Средней Азии и Закавказья (регистрируются в 4 странах СНГ). Известно свыше 80 видов диких и домашних животных - источников инфекции.
Начало изучения туляремии было положено в 1911 г., когда при эпизоотии чумоподобного заболевания сусликов в 9 округах штата Калифорния Мак-Кой и Чэпин выделили возбудителя болезни Bacterium tulareuze, назвав его по названию округа Туляре. Впоследствии он получил название Francisella tularensis.
Возбудители туляремии Francisella tularensis - полиморфные, в виде коккобактерий, грамотрицательные микроорганизмы диаметром от 0,1 до 0,5 мкм; имеют капсулу и не образуют спор. Дают перекрестные серологические реакции с бруцеллами и иерсиниями. Относятся к семейству Brucellaceae. Они длительно (4-6 мес) сохраняются во внешней среде при низкой температуре. Кипячение убивает их моментально; лизол, хлорамин, хлорная известь - через 2-5 мин; этиловый спирт-через 1 мин.
Возбудитель чувствителен к стрептомицину, левомицетину, тетрациклинам. В нашей стране по отношению к эритромицину выделяют два варианта возбудителя - чувствительный и устойчивый. Кроме того, выделяют три подвида: неарктический (африканский), голарктический (европейско-азиатский) и среднеазиатский. На территории России распространен голарктический вариант с двумя биоварами. У возбудителя туляремии обнаружены О и Vi-антигены.
Возбудитель проникает в организм человека через кожу и слизистые, даже неповрежденные. На месте внедрения иногда развивается первичный аффект с регионарным лимфаденитом. Размножение возбудителя происходит в лимфатических узлах. Эндотоксин возбудителя вызывает аденит и частично периаденит. Проникая в кровь, возбудитель вызывает общую интоксикацию, повышение температуры и нарушение деятельности сердечно-сосудистой, нервной и других систем.
Происходит генерализация инфекции и развитие вторичных туляремийных бубонов, которые появляются в поздние сроки и, в отличие от первичных, не нагнаиваются. Первичные бубоны проходят все стадии воспаления со всеми местными его симптомами. В лимфоузлах появляются специфические гранулемы, которые определяются во всех внутренних органах. Гранулемы подвергаются некрозу и распаду. В части случаев наблюдается некроз всего лимфоузла с инфильтратом вокруг него и образованием на коже длительно незаживающей язвы.
Нерезко выраженные дегенеративные изменения выявляются в сердечной мышце по ходу кровеносных сосудов, в эпителии извитых канальцев почек. В легких поражаются паратрахеальные и перибронхиальные лимфатические узлы, бронхи, паренхима и плевра с вовлечением доли или всего легкого в виде образования гранулем и развития фибринозного, фибринозно-гнойного или геморрагического воспаления. Большое число гранулезно-некротических фокусов образуется в печени и селезенке, размеры которых увеличиваются. Поверхностные язвы и эрозии находят в желудке, тонкой и толстой кишке. Редко наблюдаются туляремийный энцефалит и менингит.
В зависимости от глубины поражения лимфоузлов бубоны рассасываются или склерозируются.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Туляремия – это острое зоонозное природно-очаговое инфекционное заболевание характеризующееся многообразием путей заражения, соответственно механизму заражения развитием лихорадки, интоксикации, первичных очагов поражения на кожных покровах, конъюнктиве глаз, слизистой ротоглотки, в легких и кишечнике сопровождающихся развитием региональных лимфаденитов и различной степени генерализации процесса (гематогенная диссеминация).
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| А21.0 | Язвенная (кожная) форма туляремии |
| А21.1 | Глазная (глазобубонная) форма |
| А21.2 | Легочная форма туляремии |
| А21.3 | Абдоминальная (кишечная) форма |
| А21.7 | Генерализованная форма туляремии |
| А21.8 | Другие формы туляремии |
| А21.9 | Туляремия неуточненная |
Дата разработки протокола: 2017 год.
Сокращения, используемые в протоколе:
| АД | – | артериальное давление |
| АлТ | – | Аланинаминотрансфераза |
| АсТ | – | Аспартатаминотрансфераза |
| АЧТВ | – | активированное частичное тромбопластиновое время |
| в/в | – | Внутривенно |
| в/м | – | Внутримышечно |
| ВГ | – | вирусный гепатит |
| ВОП | – | врач общей практики |
| ВР | – | время рекальцификации |
| ВКА | - | Вторичный кожный аффект |
| ДВС | – | диссеминированное внутрисосудистое свертывание |
| ИВЛ | – | искусственная вентиляция легких |
| ИТШ | – | инфекционно-токсический шок |
| ИФА | – | иммуноферментный анализ |
| КИЗ | – | кабинет инфекционных заболеваний |
| КТ | – | компьютерная томография |
| КЩР | – | кислотно-щелочное равновесие |
| МНО | – | международное нормализованное отношение |
| МРТ | – | магнитно-резонансная томография |
| ОАК | – | общий анализ крови |
| ОАМ | – | общий анализ мочи |
| ОРИТ | – | отделение реанимации и интенсивной терапии |
| ОПП | – | острое повреждение почек |
| ОППН | – | острая печеночно-почечная недостаточность |
| ОЦК | – | объем циркулирующей крови |
| ПМСП | – | первичная медико-санитарная помощь |
| ПЦР | – | полимеразная цепная реакция |
| ПКА | - | Первичный кожный аффект |
| РТГА | – | реакция торможения гемагглютинации |
| РПГА | – | реакция пассивной гемагглютинации |
| УПФ | - | Условно-патогенная флора |
| СЗП | – | свежезамороженная плазма |
| СМЖ | – | спинномозговая жидкость |
| СОЭ | – | скорость оседания эритроцитов |
| СПОН | – | синдром полиорганной недостаточности |
| УЗИ | – | ультразвуковое исследование |
| ЦВД | – | центральное венозное давление |
| ЭКГ | – | Электрокардиография |
Пользователи протокола: врачи скорой неотложной помощи, фельдшеры, врачи общей практики, терапевты, инфекционисты, пульмонологи, хирурги, офтальмологи, дерматовенерологи, анестезиологи-реаниматологи, организаторы здравоохранения.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |
Классификация
Классификация [6- 18]
Классификация клинико-патогенетическая [18]:
Первично-очаговые формы:
· Язвенная (син. кожная, кожно-бубонная);
· Бубонная;
· Ангинозная (ангинозно-бубонная, ротоглоточная, фарингеальная);
· Коньюнктивальная (син. глазная, глазо-бубонная);
· Легочная (син. пневмоническая);
· Абдоминальная (син. кишечная);
· Смешанная.
Генерализованные формы:
· Первично-генерализованная (син. лихорадочная, первично-септическая, тифоидная);
· Вторично-генерализованная.
Вторично-очаговые формы (развитие вторично-очаговых форм нехарактерно для штаммов туляремии, циркулирующих в Евразии (тип B или holarctica), такое течение характерно для штаммов циркулирующих в Северной Америке (тип А или tularensis)).
· Ангинозная;
· Бубонная;
· Пневмоническая;
· Абдоминальная (кишечная);
· Менингоэнцефалитическая;
· Смешанная;
· Вторично-септическая.
Примечание: в скобках указаны синонимы клинических форм, встречающиеся в литературе.
Классификация клинических форм туляремии основана на патогенезе заболевания с учетом механизма и пути передачи инфекции (Таблица 1):
· первично-очаговые формы протекают как регионарная инфекция (воспалительный процесс) в месте внедрения возбудителя (входных ворот);
· первично-генерализованная форма – протекает в виде генерализованной инфекции (бактериемии) без эпизода первично-очаговых проявлений, когда возбудитель сразу попадает в кровь (при массивном инфицировании и/или иммунодефицитном состоянии);
· вторичная генерализация – в виде генерализованной инфекции (бактериемии) развивается на фоне любой из первично-очаговых форм;
· вторично-очаговые формы развиваются вслед за и как результат генерализации инфекции с формированием вторичных очагов в органах и тканях.
Таблица 1. Клинико-патогенетическая классификация туляремии [18]:
Ангинозная
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ 22
Диагностические критерии [19]
Жалобы и анамнез:
· Инкубационный период при туляремии длится в среднем 3 — 7 дней, но может удлиняться до 2 — 3 недель.
Для всех форм туляремии характерно повышение температуры и симптомы интоксикации разной степени выраженности.
· острое начало заболевания;
· повышение температуры тела;
· головная боль;
· общая слабость;
· отсутствие аппетита.
При развитии очаговых форм присоединяются клинические симптомы поражения соответствующих органов и систем, которые носят неспецифический характер. Поэтому диагностика предположительного случая, основанная на клинических проявлениях туляремии затруднена.
Для подтверждения подозрения на туляремию необходимо наличие соответствующего эпидемиологического анамнеза – пребывание или проживание на эндемичной территории (для родного очага) туляремии в течение максимального инкубационного периода (трех недель) перед заболеванием.
Стандартное определение случая туляремии [20]:
Предположительный диагноз (случай) язвенной (кожной, язвенно-бубонной) и бубонной форм туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого заболевания, сопровождающегося лихорадкой и интоксикацией, с одним или обоими из следующих синдромов:
Бубон (лимфаденит без периаденита) в одной из групп периферических лимфоузлов, характеризующийся как минимум тремя из следующих признаков:
− увеличение отдельного лимфоузла (лимфоузлов);
− умеренная болезненность;
− мягко-эластическая консистенция;
− подвижность при пальпации.
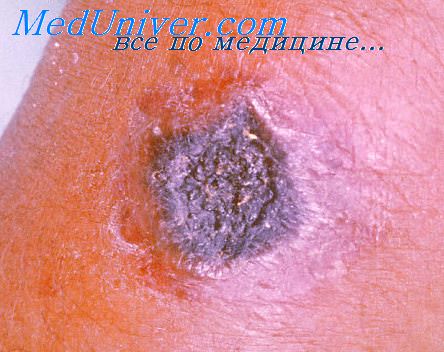
Первичный кожный аффект, болезненный, находящийся на одном из следующих этапов развития:
− папула;
− везикула;
− пустула (гнойная);
− язва (глубокая, сочная, с гнойно-геморрагическим отделяемым, на инфильтрированном основании, окруженная венчиком гиперемии).
Предположительный диагноз (случай) глазной (глазо-бубонной) формы туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого заболевания, сопровождающегося лихорадкой и интоксикацией, с первичным аффектом на конъюнктиве (в виде папулы – пустулы – язвочки), выраженного конъюнктивита, одностороннего отека лица, периорбитального отека и регионального шейного (подчелюстного) лимфаденита, характеризующегося всеми свойствами туляремийного лимфаденита.
Предположительный диагноз (случай) ангинозной (ангинозно-бубонной) формы туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого заболевания, сопровождающегося лихорадкой и интоксикацией, с первичным аффектом, проявляющимся выраженной односторонней гнойно-некротической ангиной и регионального шейного (подчелюстного) или заглоточного лимфаденита, характеризующимися всеми свойствами туляремийного бубона [21].
Предположительный диагноз (случай) легочной (пневмонической) формы туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого тяжелого заболевания без альтернативного диагноза, сопровождающегося лихорадкой, увеличением печени и/или селезенки и увеличением (на рентггенограмме) прикорневых, паратрахеальных или медиастенальных лимфоузлов [21].
Предположительный диагноз (случай) абдоминальной (кишечной) формы туляремии ставится при:
· проживании или пребывании на территории природного очага туляремии (эндемичной зоне) в течение трех недель до заболевания;
· наличии острого тяжелого заболевания, сопровождающегося лихорадкой, увеличением печени и/или селезенки и болями в области мезентериальных лимфоузлов (правая подвздошная область).
Вероятный диагноз (случай) для всех форм туляремии ставится при соответствии определению предположительного случая и наличия как минимум одного из следующего [20]:
· употребление сырого мяса животных, возможных носителей туляремии;
· употребление сырой воды из ручьев, колодцев, других открытых водоисточников;
· участие в сельскохозяйственных работах, связанных с сеном, соломой;
· укус клещей, или других кровососущих насекомых;
· охота, добыча и разделка диких и сельскохозяйственных животных, возможных носителей туляремии;
· прямой или опосредованный контакт с животными, возможными носителями туляремии;
· эпидемиологическая связь с подтвержденным случаем туляремии;
· менее чем четырехкратное увеличение титра антител к F. tularensis в сыворотке крови;
· положительная кожная аллергическая проба у не привитых лиц.
Подтвержденный диагноз (случай) для всех форм туляремии ставится при наличии как минимум одного из нижеследующего [20]:
· выделение культуры Francisella tularensis из отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений или крови;
· положительный результат ПЦР при исследовании материала от больного;
· обнаружение IgM или нарастание титра IgG к F. tularensis в ИФА [23];
· четырехкратное нарастание титров антител к F. tularensis в агглютинационных тестах при исследовании парных сывороток;
· подтверждение однократного положительного результата в агглютинационном тесте другим подтверждающим тестом.
Лабораторно-этиологические исследования:
· Бактериологическое исследование – отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений и крови;
· Биологическое исследование – отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений и крови;
· ПЦР исследование – отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений и крови;
· ИФА на антиген – отделяемого кожного аффекта, содержимого лимфоузлов, мокроты, мазков с конъюнктивы, из ротоглотки, испражнений и крови;
· ИФА на антитела (IgM и IgG) - крови;
· Серологические агглютинационные тесты на антитела (РА, РПГА) - крови.
· Коагулограмма – при развитии ИТШ и ДВС синдрома;
· Биохимическое исследование крови (глюкоза, общий белок, мочевина, креатинин, электролиты) – при развитии ИТШ и ДВС синдрома.
Следует учесть, что в крови у больного может находиться высококонтагиозный возбудитель, поэтому работа с выделениями больного, прежде всего с кровью, проводится в соответствующих средствах индивидуальной защиты, с последующим обеззараживанием объектов, соприкасавшихся с материалами от больного.
Инструментальные исследования:
· Рентгенологическое исследование и/или компьютерная томография грудной клетки – при наличии у больного легочной формы туляремии.
· Компьютерная томография брюшной полости – при наличии у больного абдоминальной формы туляремии.
· УЗИ лимфоузлов – при развитии лимфаденитов разной локализации.
· ЭКГ – при развитии явлений выраженной интоксикации и миокардита.
Показания для консультации специалистов:
При возникновении подозрения на наличии у больного туляремии, возможно провести консультацию с инфекционистом КИЗ, если такая возможность имеется, однако при использовании стандартного определения случая, можно направлять больного в региональное инфекционное отделение или больницу без дополнительной консультации инфекциониста.
Группа геморрагических лихорадок включает острые лихорадочные заболевания вирусной этиологии, в патогенезе и клинических проявлениях которых ведущую роль играет поражение сосудов, приводящее к развитию тромбогеморрагического синдрома.
Впервые в качестве самостоятельной нозологической формы геморрагическую лихорадку (геморрагический нефрозонефрит) описал в 1941 г. А. В. Чурилов (профессор кафедры инфекционных болезней Военно-медицинской академии). В последующие годы был описан целый ряд геморрагических лихорадок в различных странах мира. В группу геморрагических лихорадок были включены некоторые болезни, которые были описаны раньше (денге, желтая лихорадка).
Что провоцирует / Причины Геморрагических лихорадок:
Возбудители геморрагических лихорадок относятся к 4 семействам вирусов: тогавирусы, буньявирусы, аренавирусы и филовирусы, общим свойством которых является высокий тропизм к эндотелию сосудов.
Геморрагические лихорадки - природноочаговые инфекции, при которых основным резервуаром и источниками болезни являются различные виды животных, а переносчиками при значительной части из них - членистоногие (клещи, комары). В остальных случаях передача инфекции реализуется другими путями - воздушно-пылевым, алиментарным, водным, при зоонозном контакте, парентерально. В соответствии с особенностями передачи возбудителя болезни выделяют: клещевые (Крымская-Конго, Омская и Кьясанурского леса), комариные (желтая лихорадка, Денге лихорадка, лихорадка Чикунгунья и лихорадка долины Рифт) и контагиозные геморрагические лихорадки (геморрагическая лихорадка с почечным синдромом, лихорадки Лаоса, Аргентинская, Боливийская, Венесуэльская, Бразильская, Марбурга и Эбола). Хотя восприимчивость к этим инфекциям довольно высока, наиболее часто заболевания регистрируют среди лиц, имеющих профессиональный контакт с животным и или объектами дикой природы. В городах геморрагической лихорадкой с почечным синдромом в основном заболевают работники бытового хозяйства и лица без определенного места жительства, имеющие контакт с синантропными грызунами или их выделениями.
Патогенез (что происходит?) во время Геморрагических лихорадок:
Патогенез геморрагических состояний при геморрагических лихорадках. Тромбогеморрагический синдром (синдром Мачабели) является важным звеном патогенеза многих инфекционных болезней. Тромбогеморрагический синдром - это симптомокомплекс, обусловленный универсальным и неспецифическим свойством крови, лимфы, тканевой жидкости, клеточных и межклеточных структур обратимо и необратимо сгущаться вследствие активации их способности к коагуляции и в результате ретракции расслаиваться на компоненты различного агрегатного состояния. Тромбогеморрагический синдром в своем развитии проходит 4 стадии.
Стадия гиперкоагуляции начинается в клетках тканей поврежденного органа, что приводит к высвобождению коагуляционно-активных веществ, реакция активации коагуляции распространяется на кровь. Эта стадия обычно кратковременная.
Стадия нарастающей коагулопатии потребления, непостоянной фибриполитической активности. Она характеризуется падением числа тромбоцитов и уровня фибриногена, а также расходом других плазменных факторов коагуляционнолитической системы организма. Это - стадия начинающегося и нарастающего ДВС (неполный синдром ДВС).
Стадия дефибриногенации и тотального, но не постоянного фибринолиза (дефибриногенационно-фибринолитическая). Синоним этой стадии - полный синдром ДВС.
Восстановительная стадия или стадия остаточных тромбозов и окклюзии. При благоприятном течении синдрома отмечается возвращение к физиологическим нормам всех факторов коагуляционнолитической системы организма.
По клиническим проявлениям различают различные формы тромбогеморрагического синдрома (молниеносный, острый, хронический, латентный, геморрагический, гиперергический и др.). Тромбогеморрагический синдром наблюдается при травмах, хирургических заболеваниях, в онкологии, при акушерской патологии, при сепсисе и многих инфекционных болезнях. В настоящей главе мы рассматриваем только особенности патогенеза геморрагического синдрома при геморрагических лихорадках.
При геморрагических лихорадках первичная патология страдания развивается на клеточно-молекулярном уровне с обязательным вовлечением в инфекционный процесс эндотелиальных клеток кровеносной системы и стволовых полипотентных клеток костного мозга. Скорость развития процесса обусловлена агрессивностью патогена и его тропностью и к другим чувствительным клеткам, например, макрофагам-моноцитам, а также степенью зрелости иммунной системы пораженного конкретным возбудителем индивидуума. В итоге нормальный физиологический уровень функционирования эндотелия и кроветворных органов динамически меняется. В разгар инфекции происходит тотальное изменение анатомо-морфологической целостности и, соответственно, функций системы микроциркуляции крови. Оно сопровождается ухудшением трофики всех органов и тканей, развивается гипоксия и их функциональная недостаточность. Процесс сопровождается нарушением деятельности терморегулирующего и координирующего центров ЦНС, сердечно-сосудистой и выделительной систем, развивается легочная или иная органная патология и нередко больные погибают в коматозном состоянии. Угрожающая жизни объемная потеря крови редка, хотя повышенная кровоточивость, как признак изменения сосудистой проницаемости, выступает в качестве одного из ведущих симптомов геморрагических вирусных лихорадок.
Среди причин геморрагического синдрома, развивающегося достаточно быстро и часто заканчивающегося смертью больных, известны вирусы пяти семейств: Arena-, Bunya-, Filo-, Flavi- и Togaviridae. Они включают вирусы Ласса, Хунин, Мачупо, Гуанарито, Сэбия (семейство аренавиру-сов) - возбудители, соответственно, лихорадок Ласса, Аргентинской, Боливийской, Венесуэльской и Бразильской; лихорадки долины рифт и Крым Конго (семейство буньявирусов); желтой лихорадки (семейство флавивирусов); лихорадок Марбург и Эбола (семейство филовирусов), лихорадки денге, къясанурской лесной болезни и геморрагической лихорадки с почечным синдромом (семейства тогавирусов). Возбудители клещевых риккетсиозов, эрлихиозов и группы сыпного тифа, напротив, причастны к геморрагическому синдрому с более медленным и большей частью доброкачественным течением. Следовательно, по привязанности к возбудителю инфекционной болезни геморрагический синдром полиэтиологичен.
Широкий спектр возбудителей, вызывающих единый по клинике комплекс симптомов, обусловлен однотипным механизмом его формирования. Из данных морфологического и иммуногистологического изучения вышеуказанных заболеваний известно, что основная патология развертывается в эндотелиальных клетках микродиркуляторной системы, клетках костного мозга и для некоторых инфекций (лихорадки Марбург, денге) в процесс вовлекаются мононуклеарные фагоциты, как циркулирующие в русле крови, так и тканевые. Это находит отражение в клеточном, белковом и пептидном (кинины, лейкотриены) составе крови и балансе ее биологически активных компонентов. Затрагивается деятельность систем комплемента, кининовой, коагуляции и антикоагуляции. Последние регулируют тонус сосудов, их проницаемость, секреторную деятельность эндотелия, реологические свойства крови и ответственны за субъективные ощущения боли, усталости и другую симптоматику болезней.
Несмотря на этиологическое разнообразие патогенов, ассоциируемых с развитием геморрагического синдрома, их объединяет идентичный или весьма близкий механизм доставки возбудителя к клеткам-мишеням на начальной стадии инфекционного процесса. Возбудители лихорадок, передающиеся с участием кровососущих переносчиков, контактно через расчесы кожи или аэрогенно через альвеолярно-капиллярные мембраны легких, по существу механически переносятся к чувствительным к патогену клеткам эндотелия и тканевым оседлым макрофагам в местах микротравм, вызванных колюще-сосущим аппаратом переносчиков или повреждением эпителия. Именно в этих точках или же в альвеолярно-капиллярных мембранах, на которых произошла задержка частиц инфекционного аэрозоля, формируется первичный локальный процесс. Защитная реакция у места входных ворот сопровождается и одновременной генерализацией инфекционного процесса вследствие диссеминации возбудителя с крово-лимфооттоком с дальнейшим последовательно нарастающим поражением клеток-мишеней в органах и тканях, удаленных от места входных ворот инфекции. При этом часть частичек возбудителя поглощается макрофагами и другими клетками крови, например, эритроцитами при риккетсиозах и бартонеллезах, но не инактивируется вследствие недостаточной концентрации цитокинов, таких как интерферонгамма (ИНФ-у), фактора некроза опухоли-альфа (ФНО-а), других монокинов и отсутствия специфических нейтрализующих антител в плазме крови на момент заражения и в начальный период болезни.
Локальное повреждение физиологически высокоактивных, регулирующих гемостаз клеток в области входных ворот патогена и одновременная генерализация инфекции с трансмиссивным механизмом передачи предопределены особенностями кровососания клещей и комаров, переносчиков возбудителей большинства геморрагических лихорадок, и особенностями анатомического строения тканевых и альвеолярных капилляров. Синхронность формирования локального и генерализованного процессов объясняется тем, что кровососание у переносчиков длится долго и прерывисто, особенно у клещей (до нескольких суток). Периодический отсос крови сопровождается периодическим же вспрыскиванием в капилляр слюны, а в некоторых случаях и коксальной жидкости, содержащих патоген, антикоагулянты и ферменты кровососа.
Инфекционный процесс на уровне клетка-возбудитель начинается по обычной для внутриклеточных паразитов схеме: прикрепление к поверхностной мембране и ее разрыхление, проникновение в цитоплазму, размножение или гибель (в случае абортивной инфекции), выход в окружающее межклеточное пространство или русло крови, с инфицированием прилегающих и отдаленных интактных клеток. Последняя стадия взаимодействия клетка-патоген сопровождается либо разрушением и некролизом первой, либо усилением внутриклеточных физиологических процессов с повышенной продукцией цитокинов и других метаболитов их нормального функционирования.
Дальнейшая прогрессирующая структурно-функциональная дезорганизация эндотелия, герминтативных точек стволовых клеток костного мозга и других (при желтой лихорадке и лихорадке Марбург - гепатоцитов и мононуклеарных фагоцитов) приводит к нарастанию капилляропатии и, соответственно, токсикоза, вплоть до развития инфекционно-токсической энцефалопатии (ИТЭ) с полной утратой сознания и восприятия окружающей среды, т.е. развивается состояние комы (синоним, ИТЭ III-й степени. Динамически колеблется уровень цитокинов и медиаторов, причастных к пирогенезу (ПГЕз, ИЛ-1, лейкотриены), коагуляции - антикоагуляции, начинает снижаться синтез колониестимулирующих факторов (КСФ). Уменьшение КСФ сопровождается подавлением процесса самообновления полипотентных стволовых клеток; направление дифференциации клеток крови, в частности нейтрофилов, и их созревание меняются.
Необычное против физиологической нормы содержание продуктов распада клеток, затронутых патогеном, и усиление синтеза и секреции эйкозаноидов на начальной стадии инфекционного процесса сопровождается возрастающей недостаточностью выделительной функции почек и обезвреживающей деятельности печени из-за ишемии, а при некоторых геморрагических инфекциях и вследствие ее прямого поражения возбудителем, синхронно протекающего с затронутостью эндотелия и других клеток. Для ГЛПС с более медленным по сравнению с лихорадками Марбург и Эбола течением васкулярные тромбы и некроз клеток эндотелия нехарактерны, а клиника обусловлена генерализованным расширением капилляров, отеками, инфильтрацией крупных органов и лимфатических узлов гранулоцитами. Для данной нозоформы наиболее заметна возросшая проницаемость капилляров, в том числе и нефронов, отражающая дисфункцию эндотелия в сочетании с дисбалансом медиаторов и других регуляторных компонентов гемостаза.
На завершающей стадии вирусных геморрагических лихорадок с неблагоприятным исходом сохраняются тромбоцитопения вследствие убыли тромбоцитов в агрегаты и микротромбы, дефицит фактора Хагемана, тромбооксана А2, других медиаторов, фаза гипокоагуляции плавно переходит в состояние глубокой гипокоагуляции с развитием соответствующей симптоматики - многократно увеличивается время свертываемости крови, уровень тромбоцитов и лейкоцитов максимально низок, кровоточивость достигает максимума, тогда как температура тела снижается.
Таким образом, патогенез геморрагических состояний при геморрагических лихорадках отражает комплекс динамически протекающих сопряженных процессов, наслаивающихся друг на друга, основу которых составляет:
- разрегулирование нормального физиологического соотношения компонентов систем, обеспечивающих гемостаз (см. выше), в связи с изменением секреторной деятельности клеток, причастных к гемостазу;
- анатомо-морфологическое обнажение стенок кровеносных сосудов в наиболее активной (в аспекте ее функциональной деятельности) части, а именно - в участках микроциркуляции (артериола-капилляр-венула);
- повышение проницаемости сосудов из-за нарушения их целостности и меняющегося содержания в крови вазоактивных компонентов (тромбоцитов, эйкозаноидов, кининов, адреналина и других фармакологически активных соединений);
- отставанием иммунологически важных защитных реакций макроорганизма, в том числе и в виде формирования специфических антител, от нарастания деструктивных изменений при генерализации инфекционного процесса;
- суммарным формированием ДВС-симптоматики различной степени выраженности.
При этом изменения в крови последовательно развиваются через фазу гиперкоагуляции в стадию гипокоагуляции с обязательной тромбо- и лейкопенией потребления и сдвигом формулы нейтрофилов влево. Скорость развития симптоматики и исход болезни определяются степенью патогенности возбудителя, конституциональными особенностями и иммунным статусом заболевшего.
Симптомы Геморрагических лихорадок:
Диагностика Геморрагических лихорадок:
Диагностика геморрагических лихорадок базируется на клинико-эпидемиологических и лабораторных данных. В специфической диагностике используются серологические (РСК, РНИФ и др.), иммунохимические (ИФА), молекулярно-биологические (ПЦР, гибридизация), иногда вирусологический методы.
Дифференциальная диагностика проводится с гриппом, лептоспирозом, риккетсиозами, целым рядом арбовирусных инфекций, не относящихся к геморрагическим лихорадкам, менингококковой инфекцией, сепсисом, тромбогеморрагической пурпурой (болезнь Верльгофа), геморрагическим васкулитом (болезнь Шенлейна-Геноха) и др.
Лечение Геморрагических лихорадок:
Все больные должны быть госпитализированы и за ними необходим тщательный уход. Назначают полужидкую, легкоусвояемую и калорийную пищу с максимальным обогащением диеты витаминами, особенно С и В (свежие овощи и фрукты, натуральные фруктовые и ягодные соки, настой шиповника, дрожжи). Рекомендуется давать больному до 600-800 мг аскорбиновой кислоты внутрь ежедневно, витамин Р; ввиду наличия геморрагических явлений назначать витамин К (викасол) по 0,015 г 4 раза в день на протяжении 4 дней.
Следует иметь в виду, что геморрагические проявления могут достигнуть наибольшего развития не в лихорадочном периоде болезни, а после его окончания.
Применяют также внутривенные вливания глюкозы (40% раствор по 40-50 мл ежедневно). В лихорадочном периоде болезни рекомендуются переливания крови по 125-150 мл через день, внутримышечные инъекции камполона или антианемина (по 2 мл ежедневно на протяжении 5-7 дней), прёпараты железа внутрь. В качестве вспомогательного терапевтического средства дают внутрь десенсибилизирующий (антигистаминный) препарат димедрол по 0,08 г 4 раза в день в течение 4-6 дней. Выздоравливающий нуждается в постельном режиме до полного исчезновения клинических симптомов; после выписки необходимо медицинское наблюдение. Прогноз. Тяжесть клинического течения геморрагических лихорадок колеблется в очень широких пределах. Дальневосточный нефрозонефрит протекает значительно тяжелее, чем другие описанные здесь геморрагические лихорадки, и в отдельных случаях заканчивается летально.
Профилактика Геморрагических лихорадок:
Успех борьбы с распространением геморрагических лихорадок определяется в первую очередь результатами мероприятий по уничтожению переносчиков инфекции и по защите от их укусов здоровых людей. В местностях, где встречаются заболевания, необходима тщательная расчистка земельного участка под жилые и производственные помещения: скашивание травы, уничтожение кустарника, сжигание опавших листьев.
Лица, работающие или проживающие в местностях, где встречаются геморрагические лихорадки, должны носить сапоги, перчатки, а также специальные комбинезоны; обязательна пропитка производственной одежды препаратами, отпугивающими клещей. Необходимость проведения этих мероприятий зависит от конкретной эпидемиологической обстановки. Перечисленные средства обеспечивают защиту человека от укусов зараженных клещей, являющихся переносчиками геморрагических лихорадок.
С целью специфической профилактики омской геморрагической лихорадки в природных очагах этой болезни применяют профилактическую вакцинацию населения при помощи эмульсии вируса, убитого формалином (прививки производят по специальной инструкции).
Основная роль в профилактике геморрагических лихорадок принадлежит все же не вакцинации, а систематическому осуществлению указанных выше мероприятий.
К каким докторам следует обращаться если у Вас Геморрагические лихорадки:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Геморрагических лихорадок, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Что провоцирует / Причины Бразильской пурпурной лихорадки:
Возбудитель бразильской пурпурной лихорадки - это небольшие (диаметром 0,3-0,4x1,5 мкм) неподвижные неспорообразующие грамотрицательные коккобациллы, которые при глубоком прокрашивании полярных телец могут выглядеть как грамположительные. При окраске по Граму бактерии рода Haemophilus выглядят как мелкие бледно окрашенные грамотрицательные палочки, иногда формирующие тонкие филаменты. Небольшие размеры, клеточный полиморфизм и недостаточное прокрашивание сафранином могут существенно затруднять обнаружение гемофильной палочки, поэтому некоторые авторы предлагают наряду с окраской по Граму проводить окраску метиленовым синим. В этом случае микроорганизмы (МО) имеют синий цвет на серо-голубом фоне. Бактерии являются факультативными анаэробами. Из шести капсульных серотипов (от а до f) чаще выделяется тип b (Hib). Также выделяют некапсулированные штаммы, которые носят название нетипируемых. Гемофильные палочки, преимущественно нетипируемые штаммы, часто входят в состав нормальной микрофлоры слизистых оболочек верхних дыхательных путей у здоровых взрослых и детей. Частота назофарингеального носительства у взрослых варьирует в широких пределах, достигая в некоторых случаях 75%. В США до внедрения конъюгированной вакцины штаммы Hib обнаруживались в носоглотке 3-5% детей. В России частота носительства у детей составляет не более 5%, а нетипируемые формы колонизируют ротоглотку здоровых детей с частотой 35-78% в зависимости от возраста. Нетипируемые штаммы H. influenzae часто колонизируют нижние дыхательные пути у пациентов, страдающих ХОЗЛ и муковисцидозом. H. influenzae является патогеном исключительно человека. Инфицирование происходит воздушно-капельным путем или при контакте с контаминированным материалом. В организме человека можно выделить 8 видов гемофил, основными патогенами из которых считаются H. influenzae и H. ducreyi.
Haemophilus influenzae (палочка Афанасьева-Пфайффера) вызывает респираторные и менингеальные инфекции, эндокардиты, абсцессы, артриты, поражения кожи, ногтей и глаз.
Haemophilus influenzae биовар aegyptius (палочка Коха-Уикса) обусловливает конъюнктивит и бразильскую пурпурную лихорадку у детей.
Haemophilus ducreyi (палочка Дюкрея-Унны) – возбудитель венерической болезни, известной как мягкий шанкр.
Для улучшения выделения H. influenzae из клинического материала рекомендуется использовать шоколадный агар. Вероятность выделения МО из клинического материала нижних дыхательных путей повышается при использовании питательных сред, содержащих бацитрацин (могут применяться как готовые коммерческие среды, так и приготовленные на основе шоколадного агара). Также могут быть использованы коммерческие сапонинобацитрациновые диски или диски с бацитрацином (10 ЕД). Высокая концентрация этого антибиотика подавляет рост большинства других МО, являющихся представителями микрофлоры дыхательных путей (стафилококков, стрептококков и др.), что позволяет получить рост гемофильной палочки из сильно контаминированного клинического материала. Оптимальными условиями инкубации H. influenzae являются влажная атмосфера с повышенным содержанием СО2 (5-10%) и температура 35-37 оС. Подобные условия могут быть созданы в СО2-термостате или при инкубации чашек в эксикаторе с зажженной свечой. В результате горения свечи понижается концентрация кислорода и повышается уровень СО2, достигая 3%. Однако даже при самом строгом соблюдении рекомендаций NCCLS (National Committee on Clinical Laboratory Standards) при тестировании H. influenzae к макролидам диско-диффузионным методом обнаруживается более 50% ошибок в интерпретации результатов, поэтому рекомендуется использовать Е-тесты как наиболее достоверный и простой количественный метод. В связи с тем что гемофильная палочка отличается низкой жизнеспособностью во внешней среде, рекомендуется использовать транспортные средства и немедленно (не позднее 2 ч) доставлять материал в клиническую лабораторию.
Патогенез (что происходит?) во время Бразильской пурпурной лихорадки:
Патогенность гемофил варьирует у различных штаммов. Основными факторами патогенности H. influenzae являются: капсула (особенно у H. influenzae серотип b) и пили. Жгутики способствуют сцеплению МО с поверхностью слизистой оболочки дыхательных путей и дальнейшему проникновению в подслизистую оболочку, что и приводит к развитию воспалительной реакции. Полисахарид капсулы затрудняет поглощение бактерий фагоцитами и облегчает адгезию к слизистой оболочке верхних отделов дыхательных путей, тогда как эндотоксин (липополисахарид) повреждает клетки слизистой оболочки, вызывает воспалительный процесс в тканях центральной нервной системы и запускает механизмы развития сепсиса. Нетипируемые штаммы приводят к заболеванию, повреждая поверхность клеток респираторного эпителия. Штаммы, проявляющие повышенную вирулентность, способны мигрировать в лимфо- и кровоток.
H. influenzae вызывают большое количество различных инфекций, в том числе угрожающих жизни пациентов. В целом все инфекции, обусловленные гемофильной палочкой, можно подразделить на 2 типа: инвазивные и неинвазивные.
Неинвазивные инфекции возникают в процессе распространения МО по слизистой оболочке дыхательных путей. Острый синусит, острый средний отит и обострение хронического бронхита, как правило, являются осложнениями вирусных инфекций, которые снижают местный иммунитет и нарушают мукоцилиарный клиренс.
Большинство неинвазивных инфекций вызывают нетипируемые штаммы, для которых наличие протеина Р2 наружной мембраны является основным фактором вирулентности.
Инвазивные инфекции, особенно менингит и эпиглоттит, преимущественно продуцируются штаммами Hib и имеют гематогенное происхождение. Капсула типа b состоит из полирибозилрибитолфосфата (ПРФ), то есть содержит в качестве мономера пентозу (рибозу), в отличие от других типов, содержащих гексозу. Это, вероятно, и определяет более высокую вирулентность, является наиболее важным фактором вирулентности, так как защищает МО от фагоцитоза, опсонизации и комплементопосредованного лизиса. Низкая частота развития инвазивных инфекций у детей первых двух месяцев жизни обусловлена наличием материнских антител к ПРФ. С ростом популяции людей, обладающих антителами к ПРФ, снижается и частота инвазивных инфекций. В случае развития заболевания, вызванного M. сatarrhalis, инфицирование происходит эндогенно за счет распространения МО с прилегающих участков слизистых оболочек, однако механизмы развития этих инфекций достоверно не изучены. Наиболее часто M. catarrhalis выделяется при заболеваниях ЛОР-органов, конъюнктивитах и пневмониях у детей. Среди взрослого населения в большинстве случаев она обнаруживается при ларингитах, бронхитах и пневмониях у пациентов с ХОЗЛ. Из числа этиологических агентов при хроническом бронхите M. catarrhalis уступает лишь H. influenzae и S. pneumoniae, а у 54,6% всех больных с инфекцией, обусловленной M. catarrhalis, диагностируется ХОЗЛ. У пациентов с иммунодефицитными состояниями данный МО может вызывать эндокардит, перикардит, септический артрит.
Симптомы Бразильской пурпурной лихорадки:
Болезнь начинается с гнойного конъюнктивита. В отдельных случаях бывают высокая температура, рвота, боли в животе и пурпурная сыпь, другие симптомы похожи на менингококковую инфекцию. Если заболевание не лечить, то может развиться сепсис.
Бактерии можно обнаружить в крови и спинномозговой жидкости.
Характерны системные поражения и сыпь (без петехий). Летальность достигает 70%.
Диагностика Бразильской пурпурной лихорадки:
Принципы выделения возбудителя аналогичны таковым при инфекциях, вызванных H. Influenzae. В окрашенных мазках обнаруживаются грамотрицательные плеоморфные палочки. Окончательную идентификацию выделенной чистой культуры проводят в реакции агглютинации (РА) с сывороткой кролика, иммунизированного музейными штаммами палочки Коха–Уикса.
Лечение Бразильской пурпурной лихорадки:
Согласно результатам проведенных исследований, при инфекциях, вызванных штаммами H. influenzae, не продуцирующими β-лактамазы, надежной эффективностью обладают аминопенициллины (ампициллин, амоксициллин), которые можно считать средствами выбора, так как по эффективности они не уступают ингибиторозащищенным пенициллинам и цефалоспоринам II поколения.
Чувствительность H. influenzae к другим АМП варьирует. Высокая чувствительность сохраняется к фторхинолонам. Хотя большинство штаммов H. influenzae чувствительны к макролидным антибиотикам, эти препараты нельзя рассматривать как эффективные средства в отношении данного МО. Это связано с тем, что для макролидов характерны пограничные значения МПК в отношении H. influenzae (от 1 до 8 мг/л). Концентрации макролидных антибиотиков в крови, мокроте и тканях бронхолегочной системы, как правило, ниже значений их МПК в отношении H. influenzae, что не позволяет рассчитывать на эрадикацию возбудителя. Это характерно для всех макролидов, в том числе для азитромицина, который рассматривается как самый активный in vitro в отношении H. influenzae. Данное утверждение нашло подтверждение в клиническом исследовании, в котором было показано, что на фоне применения азитромицина не достигается эрадикация возбудителя из полости среднего уха у больных с острым отитом (R. Dagan, 1997).
В отношении штаммов, продуцирующих β-лактамазы, высокой активностью обладают защищенные аминопенициллины, цефалоспорины II поколения и другие более современные β-лактамы. Однако при легких и среднетяжелых инфекциях дыхательных путей применение цефалоспоринов III-IV поколений и карбапенемов вряд ли можно считать оправданным. По сути, выбор должен происходить между аминопенициллинами, с одной стороны, и защищенными аминопенициллинами, а также цефалоспоринами II поколения – с другой. Явными преимуществами обладают защищенные аминопенициллины и цефалоспорины II поколения ввиду достаточно высокой частоты продукции β-лактамаз (в среднем по странам Европы – 14,5%). При тяжелых инфекциях (менингите, эпиглоттите, сепсисе) наиболее надежными средствами являются цефалоспорины III поколения (цефтриаксон, цефотаксим).
Лечение инфекций, вызываемых M. catarrhalis, не связано со значительными проблемами. МО проявляет высокий уровень природной чувствительности к большинству АМП. M. catarrhalis высоко чувствителен к большинству β-лактамных антибиотиков (аминопенициллинам, цефалоспоринам, карбапенемам), однако эффективность полусинтетических пенициллинов ограничена β-лактамазой, которую продуцируют более 90% штаммов. Фермент эффективно подавляется известными ингибиторами и не способен разрушать цефалоспорины, что и определяет практически 100% чувствительность штаммов, изученных в рамках исследования Alexander Project, к амоксициллину/клавуланату и цефалоспоринам.
M. catarrhalis высокочувствителен к макролидам и фторхинолонам. Сохраняется чувствительность к тетрациклинам, ко-тримоксазолу, хлорамфениколу, причем приобретенная устойчивость к перечисленным антибиотикам (по результатам исследования Alexander Project) либо не встречается вообще, либо встречается в 2-3% случаев (к ко-тримоксазолу).
Профилактика Бразильской пурпурной лихорадки:
Для предотвращения тяжелых, угрожающих жизни инфекций, вызываемых штаммами Hib, разработаны конъюгированные вакцины, отличающиеся высокой безопасностью и иммуногенностью, в том числе у детей младше 18 мес.
В настоящее время конъюгированная Hib-вакцина внесена в календарь прививок детей в США, Великобритании, Финляндии и других странах. Новый календарь прививок Украины, утвержденный в начале 2006 г., также предусматривает троекратную вакцинацию детей против Hib-инфекции на 3-м, 4-м и 5-м месяцах жизни. Обсуждается возможность включения вакцинации против Hib в расширенную программу иммунизации ВОЗ.
В одном из номеров The Pediatric Infectious Diseases Journal опубликована статья, посвященная эпидемиологической характеристике инфекций, обусловленных H. influenzae, не относящихся к типу b. Вследствие широкого применения вакцины против гемофильной инфекции типа b в ХХ веке резко сократилось число заболеваний, вызываемых этим МО. Таким образом, H. influenzae, не относящиеся к типу b, – редкий возбудитель инфекции у детей, но в эпоху вакцинации против H. influenzae типа b этот возбудитель становится более частой причиной заболеваний у полностью вакцинированных детей.
К каким докторам следует обращаться если у Вас Бразильская пурпурная лихорадка :
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Бразильской пурпурной лихорадки, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Читайте также:

