Кукурбитин действие на токсоплазмоз
Обновлено: 11.05.2024

Доступные варианты химиотерапии токсоплазмоза ограничены. Путь фолиевой кислоты, участвующий в синтезе ДНК с ферментами дигидрофолатредуктазы (DHFR) и дигидроптероатсинтетазы (DHPS), является основной мишенью терапии этого паразитарного заболевания. Пириметамин (PYR) и триметоприм (TMP), два основных современных препарата в лечении острого токсоплазмоза, оба действуют на паразитический DHFR, но не могут отличить его от фермента человека ( хозяина ) Взятые по отдельности, они недостаточно эффективны, поэтому их нужно сочетать в комбинированных схемах с сульфонамидами, которые блокируют DHPS. Эти схемы лечения имеют побочные эффекты из-за миелотоксичности (не говоря уже о более серьезных и острых , которые могут быть опасными для жизни) и требуют прекращения терапии или, что более часто, вызывают несоблюдение режима лечения. . Это серьезный недостаток данных препаратов , поскольку пациенты (врожденно инфицированные новорожденные, пациенты с ослабленным иммунитетом) обычно нуждаются в длительных курсах лечения. Более того, ни один современный препарат не может уничтожить T. gondii.цисты инфицированного хозяина, которые остаются неподвижными при условии, что иммунная система достаточно сильна, чтобы препятствовать их реактивации в тахизоиты.
Резистентность и побочные эффекты
Устойчивость T. gondii к лекарственным препаратам считается незначительной проблемой по сравнению с плохой комплаентностью и спектром побочных эффектов. Однако, сообщалось о неэффективности длительного лечения врожденного токсоплазмоза на основе PYR, возможно, из-за развития лекарственно-устойчивого штамма T. gondii. PYR и SDZ являются ингибиторами синтеза ДНК у тахизоитов T. gondii, но также могут подавлять синтез ДНК в тканях с высокой метаболической активностью, таких как костный мозг и эпителий. Этого можно избежать, добавив фолиновую кислоту (FA), и эти побочные эффекты будут обращены вспять после прекращения лечения.
Лечение врожденного токсоплазмоза
Существует два показания для введения специфического лечения против T. gondii : 1) пренатальное лечение, направленное на предотвращение передачи паразитов от матери к плоду (MFTP) и / или уменьшение повреждений плода, и 2) послеродовое лечение с целью облегчения клинических проявлений и / или предотвращения отдаленных последствий у инфицированного новорожденного.
Однако преимущества дородового лечения по-разному оцениваются в литературе из-за смешивающих факторов ( Robert-Gangneux, 2014 ), поскольку это может зависеть, среди прочего, от типа лечения, времени введения препаратов после заражения матери, дозы, режимы и продолжительность.терапии. Таким образом, необходимо знать точное время материнского заражения, что возможно только в странах с программами серологического скрининга беременных, то есть в ограниченном числе европейских стран. Соотношение польза / риск послеродового лечения также подвергалось сомнению, особенно у бессимптомных или субклинических инфицированных пациентов, для которых продолжительность лечения и долгосрочные преимущества все еще обсуждаются в литературе.
Женщинам, инфицированным во время беременности (или в период до зачатия), обычно предлагают спирамицин (SPI) - мощный антибиотик из группы макролидов, который концентрируется в плаценте, что делает его идеальным вариантом предварительного лечения для профилактики MFTP. Из-за низкой частоты побочных эффектов SPI - удобный вариант лечения в ожидании амниоцентеза. К сожалению, SPI неэффективен для лечения установленной внутриутробной инфекции, поскольку практически не проникает через плацентарный барьер.
ПЦР-анализ образцов AF, начиная с 16-й недели гестации (gw) и далее, позволяет переключить лечение на комбинации на основе PYR, в первую очередь на комбинацию PYR-сульфадиазин (PYR-SDZ), при получении положительного результата ПЦР. Однако комбинация PYR-SDZ является тератогенной, и поэтому ее следует избегать в течение первых 14 gw, хотя это пороговое значение варьируется в зависимости от страны к стране. В любом случае, пренатальная диагностика никогда не проводится раньше 14 gw, поэтому лечение SPI является правилом в течение первого триместра беременности.
Защитный эффект SPI известен давно. В классическом исследовании Desmonts и Couvreur ( Desmonts and Couvreur, 1974 ) сообщалось о снижении MFTP более чем на 50% (45% в группе без лечения по сравнению с 22% в группе лечения), но результаты были смещены из-за того, что не учитывался срок беременности. при сероконверсии. Однако несколько обсервационных исследований, опубликованных с 1999 г., ставят под сомнение способность пренатального лечения снижать тяжесть инфекции, признавая при этом его роль в снижении материнско-фетальной передачи.
Исследование EMSCOT 2005 года показало на 72% меньшую вероятность внутричерепных поражений у младенцев, рожденных от матерей, пролеченных в течение 4 недель после сероконверсии. Мета-анализ SYROCOT 2007 среди 1438 матерей, получавших лечение, показал, что начало пренатального лечения в течение трех недель после сероконверсии привело к снижению MFTP на 52% по сравнению с лечением, введенным через 8 или более недель, но не сообщил о явном влиянии пренатального лечения на частоту. клинических проявлений у инфицированных новорожденных.
Следует отметить, что введение ежемесячного систематического скрининга на токсоплазмоз у беременных во Франции привело к общему снижению частоты MFTP с 29% до 1992 г. до 24% после 1992 г., а немедленное введение лечения PYR-SDZ повлияло на сокращение клинических случаев токсоплазмоза новорожденных с 11% до 1995 г. до 4% после 1995 г. ( Wallon et al., 2013 ). Австрия, еще одна европейская страна с многолетней национальной программой скрининга токсоплазмоза у беременных, добилась впечатляющего снижения MFTP среди пренатально диагностированных и пролеченных женщин - 9% по сравнению с 51% ранее у нелеченных женщин, согласно данным Австрийского регистра токсоплазмоза. Эффективность PYR-SDZ по сравнению с SPI была выше, когда лечение было начато в течение 3 недель после сероконверсии.
Послеродовое лечение начинается после подтверждения диагноза врожденной инфекции и направлено на предотвращение или уменьшение клинических проявлений при рождении и облегчение возможных отдаленных последствий или клинических рецидивов, в основном, глазных.
Гематологические побочные эффекты
Фолиновая кислота
Фолиновая кислота , также известная как лейковорин , - это лекарство, используемое для уменьшения токсических эффектов метотрексата и пириметамина . Он также используется в сочетании с 5-фторурацилом для лечения колоректального рака , может использоваться для лечения дефицита фолиевой кислоты, который приводит к анемии , и отравления метанолом . Его принимают внутрь, путем инъекции в мышцу или в вену . Побочные эффекты могут включать проблемы со сном, аллергические реакции или жар . Использование во время беременности или кормления грудью обычно считается безопасным. При использовании при анемии рекомендуется сначала исключить злокачественную анемию как причину. Фолиновая кислота - это форма фолиевой кислоты , которая не требует активации дигидрофолатредуктазой, чтобы быть полезной для организма.
Новые варианты лечения токсоплазмоза
Потенциальная тяжесть нежелательных явлений комбинации PYR-SDZ привела к рассмотрению альтернативных вариантов лечения токсоплазмоща , таких как PYR-клиндамицин, PYR-азитромицин, атоваквон, котримоксазол (TMP-SMX). Однако срочно необходимы клинические оценочные исследования, желательно рандомизированные; единственное на сегодняшний день исследование показало значительный эффект TMP-SMX на снижение MFTP в сочетании с SPI, который был эквивалентен эффекту PYR-SDZ. Пириметамин недоступен и / или недоступен по цене во многих странах, что объясняет широкое использование TMP / SMX в качестве лечения первой линии в этих странах. PYR / SDZ и TMP / SMX обладают хорошей биодоступностью (70% и 90% соответственно), и все эти молекулы имеют период полураспада в плазме около 10 часов, что позволяет получить пиковую концентрацию через 2-6 часов, за исключением пириметамина, который имеет длительный период полураспада. период полувыведения (около 4 дней), лежащий в основе потребности в ударной дозе. Кроме того, снижение биодоступности пириметамина у истощенных пациентов ( de Kock et al., 2018), делает TMP / SMX лучшим выбором в развивающихся странах. Кроме того, TMP / SMX - это единственная схема внутривенного введения, когда пероральный путь нецелесообразен.
Системное лечение ( Butler et al., 2013 ; Ozgonul and Besirli, 2017 ), сочетающее противопаразитарные препараты и кортикостероиды ( Holland and Lewis, 2002 ), рекомендуется при токсоплазмозе глаз у пациентов с ослабленным иммунитетом. Однако сравнительные исследования этой популяции пациентов немногочисленны.
Помимо хорошо известных мишеней для лекарств от токсоплазмоза , недавно был описан интересный новый подход с использованием морфолино для идентификации и характеристики новых мишеней T. gondii, представляющих терапевтический интерес. Lykins et al. использовали модифицированные формы морфолино с ковалентно присоединенными химическими группами для облегчения проникновения в клетки (vivoPMO), чтобы снизить экспрессию специфических ферментов T. gondii.
Артемизинин, сильнодействующее противомалярийное средство, а также его многочисленные производные, производимые в течение многих лет, показали потенциал в лечении токсоплазмоза мышей. Особый интерес представляют артемизон и артемизид, которые продлевают выживаемость и снижают нагрузку на кисты мозга у мышей, инфицированных тахизоитами штамма токсоплазмы II типа . Они также продлили выживаемость на мышиной модели реактивированного токсоплазмоза, но все животные погибли после прекращения приема лекарств, что указывает на то, что производные артемизинина действуют на тахизоиты, но не на брадизоиты.
Скрининг библиотеки химических соединений, предоставленный Инициативой по открытию лекарств (Токийский университет, Япония), выявил два эффективных ингибитора in vitro, не вызывающих токсичности для клетки-хозяина, то есть таншинон IIA (соединение, которое может подавлять рост раковых клеток) и антигистаминный препарат - гидроксизин. Что еще более интересно, эти соединения продемонстрировали ингибирующее действие на рост промежуточно дифференцированных брадизоитов - свойства, отсутствующего в современных лекарствах.
Большинство соединений, ингибирующих рост паразитов, обладают противовоспалительными и противораковыми свойствами. Это неудивительно, поскольку уже было продемонстрировано, что некоторые лекарственные препараты, используемые при лечении рака и воспалительных процессов, проявляют сильное действие на рост T. gondii in vitro. Из них милтефозин показал многообещающие результаты в лечении многочисленных протозойных инфекций и в настоящее время широко используется для лечения висцерального лейшманиоза. Его способность успешно лечить энцефалит, вызванный свободноживущими амебами, подчеркивает его способность преодолевать гематоэнцефалический барьер. Он не показал эффективности в борьбе с острым токсоплазмозом, но, наоборот, введение этого препарата через 60 дней после заражения мышей штаммом ME49 привело к уменьшению количества и размера кист головного мозга. Другая противораковая молекула (тетраоксан) была протестирована на мышиной модели острого токсоплазмоза и значительно увеличила выживаемость инфицированных мышей по сравнению с контрольными мышами.
Иммунотерапевтические стратегии
Острая инфекция токсоплазмой остается в основном бессимптомной у иммунокомпетентных хозяев благодаря соответствующему иммунному контролю, приводящему к инцистации паразитов. Однако частичное нарушение реакции хозяина паразитом позволяет цистам сохраняться на протяжении всей жизни. Это сожительство паразита и хозяина опирается на строго регулируемый баланс для контроля репликации паразита. Возникновение любого иммунного дефекта, особенно влияющего на ответ Т-клеток, в основном вторичного по отношению к ВИЧ-инфекции или иммуносупрессивной терапии, приводит к реактивации паразитов, что приводит к тяжелому энцефалиту или диссеминированной инфекции. В настоящее время ни один из описанных выше методов лечения не может уничтожить паразита у инфицированных хозяев, что делает их уязвимыми для дальнейших рецидивов. В этом контексте в течение многих лет иммунотерапия рассматривалась как многообещающий и полезный подход к лечению токсоплазмоза, позволяющий хозяевам с ослабленным иммунитетом восстановить адекватный иммунный ответ.
Непрерывный прогресс в понимании иммунопатогенеза токсоплазмоза позволил по-новому взглянуть на то, как противодействовать иммунным нарушениям при токсоплазмозе . Помимо разработки вакцины, которая вызывает множество активных исследований ( Lim and Othman, 2014 ; Rezaei et al., 2018 ) и рассматривается в специальном выпуске ( Innes et al., 2019), необходимо последовательно обсудить альтернативные стратегии иммуномодуляции, включая перенос адаптивных клеток и пассивную иммунизацию. Иммунный ответ против T. gondii включает сложные механизмы как врожденного, так и адаптивного иммунитета. В то время как врожденные эффекторы играют важную роль во время острой инфекции ( Яровинский, 2014 ), долговременная защита обеспечивается адаптивным иммунным ответом. В частности, клеточные эффекторы, в основном Т-лимфоциты, продуцирующие IFNγ, необходимы для контроля размножения и распространения T. gondii и поддержания латентного периода. В частности, CD8 + Т-клетки и NK-клетки действуют посредством лизиса инфицированных клеток и, следовательно, делают паразита доступным для других иммунологических механизмов, включая иммуноглобулины, комплемент, макрофаги и дендритные клетки.
Провоспалительный ответ Th1 с участием цитокинов, таких как IL-12, IFNγ, TNFα, а также IL-7 и IL-15, является основой адекватного антипаразитарного ответа, сначала во время острой инфекции для уменьшения количества паразитов, а затем во время хроническая инфекция для оказания иммунного давления, достаточного для поддержания инцистации паразитов. И наоборот, иммунодепрессивные цитокины, такие как IL-10, способствуют внутримозговому сохранению паразитов, а нарушение местного иммунного ответа приводит к реактивации латентных цист T. gondii в головном мозге. Во-первых, для усиления врожденного иммунитета было показано, что введение IL-18 усиливает IL-12-опосредованную устойчивость к токсоплазме у мышей SCID с сильной иммуносупрессией, что приводит к уменьшению количества паразитов и увеличению времени до смерти. Несмотря на то, что эндогенный IL-18, по-видимому, принимает ограниченное участие в врожденной резистентности, защитная роль, обеспечиваемая добавлением экзогенного IL-18, коррелировала с увеличением количества NK-клеток и цитотоксической активностью, а также с повышенными уровнями INOS в ткани селезенки.
Другая стратегия может быть направлена на противодействие биологической активности вредных цитокинов, как было предложено Deckert-Schlüter et al. (1997) , которые оценили релевантность антител против IL-10 в модели хронического энцефалита на мышах. Интересно, что это привело к снижению внутримозговой паразитарной нагрузки, связанной с повышенной экспрессией IFNγ и TNFα, и более высоким интрацеребральным рекрутированием CD4 + и CD8 + Т-клеток. Однако мыши с дефицитом IL-10 быстро умерли от некротического гепатита в результате иммунопатологии, опосредованной CD4 + Т-клетками, с избыточной продукцией IFNγ, IL-12 и TNFα.
В новую эру клеточной терапии был предложен адаптивный перенос иммунных CD8 + клеток, особенно в контексте хронической инфекции токсоплазмы . Хотя было показано, что он временно ограничивает разрушение цист и обеспечивает временную защиту от реактивации паразитов (в течение четырех недель после лечения), он не позволяет в долгосрочной перспективе спасать истощенные Т-клетки, поскольку донорские клетки не могут стать долгосрочными в своей жизни. Таким образом, эту стратегию можно рассматривать только как профилактическую терапию реактивации у пациентов с ослабленным иммунитетом высокого риска.
Кроме того, что касается иммунотерапевтических вмешательств, несмотря на многие достижения в области вакцинации, эффективность иммунизационной терапии может снижаться у хозяев с ослабленным иммунитетом из-за снижения клеточного иммунитета. Таким образом, этот вопрос вызвал интерес к методам пассивной иммунизации, которые могли бы обеспечить, по крайней мере временно, адекватную защиту от реактивации. Действительно, использование специфических рекомбинантных антител против токсоплазмы представляет собой многообещающую стратегию для блокирования на ранней стадии прикрепления паразитов и инвазии клеток-хозяев или внутриклеточной репликации тахизоитов . Среди прочего, антитела против антигена SAG1, самого распространенного и иммуногенного антигена на поверхности паразита, вызвали много ожиданий. В частности, было показано, что фрагменты Fab-антител к SAG1 увеличивают на 50% выживаемость мышей после летального заражения путем прямой блокады клеточной инвазии, а не способствуют Fc-зависимому фагоцитозу, клеточной цитотоксичности или активации комплемента. Таким образом, замедляя инвазию паразитов, такие методы лечения могут рассматриваться как профилактические или адъювантные методы лечения в сочетании с лечебными антипаразитарными препаратами у хозяев с ослабленным иммунитетом.
Слабый терапевтический ответ на обычное лечение можно было бы компенсировать добавлением альтернативной терапии, включая добавление или ингибирование определенных интерлейкинов (анти-IL-10), непрямых иммуностимулирующих препаратов, клеточного переноса или переноса антител. Таким образом, усиление иммунного ответа хозяина может быть соблазнительным терапевтическим подходом 1) для предотвращения реактивации токсоплазмоза у пациентов с ослабленным иммунитетом, если он имеет меньше побочных эффектов, чем широко используемый лекарственный препарат котримоксазол, или 2) для помощи в лечении эпизодов тяжелой реактивации в сочетании с обычные препараты, но все еще необходимы активные исследования в этой области.
Пациенты с ослабленным иммунитетом
Токсоплазмоз - это тяжелая оппортунистическая инфекция у пациентов с ослабленным иммунитетом, чаще всего возникающая в результате реактивации спящих кист у пациентов с хронической инфекцией. Токсоплазматический энцефалит (ТE) является наиболее частым клиническим проявлением, которое часто наблюдается у ВИЧ-инфицированных пациентов, но спектр заболеваний изменился с увеличением числа пациентов с иммунодефицитом, не связанным с ВИЧ. Действительно, у пациентов, не инфицированных ВИЧ, исход хуже, и токсоплазмоз чаще распространяется, чем ограничивается ЦНС. Это особенно опасно для жизни пациентов с трансплантацией костного мозга или гемопоэтических стволовых клеток, поскольку смертность здесь составляет от 38% до 67%, несмотря на лечение.
PYR / SDZ, казалось, был наиболее эффективным лечением, но мощность исследования не может показать превосходного лечения ( Katlama et al., 1996 ) с меньшим количеством рецидивов во время поддерживающей терапии, чем PYR / CLD, но вызвала больше побочных эффектов, чем PYR / CLD или TMP / SMX. Предпочтительным режимом является PYR (ударная доза 200 мг в день 1, затем 75 мг / день, если пациент весит ≥60 кг, или 50 мг / день, если пациент весит

Для простейших , Toxoplasma gondii пережила нечто вроде стремительного роста популярности за последние несколько лет. На самом деле, справедливо отметить, что T. gondii вызывала немалый интерес с 1930-х годов, когда было обнаружено, что паразит может передаваться от матери к плоду еще в утробе матери , что иногда приводит к серьезным врожденным расстройствам. Интерес по поводу T. gondii значительно повысился в начале 2000-х годов, когда было обнаружено, что заражение T. gondii мышей и крыс может изменять поведение грызунов, в частности , они начинают меньше бояться кошек. Инфицированные токсоплазмой мыши также демонстрируют нарушение способности решать задачи на память. В последнее время интерес к Т. gondii был особенно сфокусирован на гипотезе о том, что микроорганизм также может влиять на поведение человека.
Согласно гипотезе манипуляции паразитами , известно, что некоторые паразиты развили в эвролюции механизмы воздействия на своих хозяев, чтобы способствовать передаче паразита другим организмам. Считалось, что эта гипотеза особенно правомерна для описания эффектов T. gondii, поскольку T. gondii способна воспроизводить свое размножение только внутри кишечника кошек. Таким образом, кошки играют важную роль в жизненном цикле паразита. Однако, после размножения несколько миллионов ооцист (вроде протозойной паразитной версии эмбриона) они вытесняются из кишечников в фекалии. К сожалению, остается неясным , что заставляет паразита покидать предпочтительную кишечную среду кошачьих, казалось бы, без четкого пути возвращения. Многие животные и человек , которые подвергаются воздействию фекалий зараженной кошки (например, через зараженную пищу или питьевую воду), могут заразиться T. gondii . Инфекция грызунов, однако, может быть особенно полезна для T. gondii из-за роли кошек как естественных хищников грызунов.
T. gondii действительно обладает способностью проникать в мозг своего хозяина, независимо от того, является ли этот хозяин человеком или грызуном. Действительно, инвазия токсоплазмы в центральную нервную систему связана с наиболее серьезными осложнениями инфекции T. gondii у людей, и по некоторым оценкам Т. gondii может пересечь гематоэнцефалический барьер и войти в мозг через 7 дней после заражения. Как только T. gondii попадает в мозг, она может напрямую заражать нейроны. Одна из гипотез заключается в том, что заражение нейронов T. gondii может изменить метаболизм дофамина, увеличить синтез и высвобождение дофамина. Другая гипотеза утверждает, что инфекция T. gondii может влиять на каналы кальция таким образом, что делает нейроны либо гипо-, либо гиперчувствительными. Когда токсоплазма проникает в мозг, она также заражает глиальные клетки, такие как микроглия и астроциты ; активация этих клеток связана с общим воспалительным ответом в головном мозге. Это воспаление может оказывать большое влияние на нейробиологию нейронов, в том числе влияя на метаболизм нейротрансмиттеров, изменяя уровень чувствительности рецепторов нейротрансмиттеров и оказывая влияние на синаптическую морфологию или связи нейронов между собой. Таким образом, последствия воспаления, вызванные инфекцией T. gondii,также могут быть достаточно обширными и модифицировать поведение хозяина.
Связь между инфекцией T. gondii и поведением человека была предметом исследований в течение многих лет, а исследования распространенности инфекции T. gondii у психиатрических пациентов относятся к середине 20-го века. Одно исследование показало, что инфекция T. gondii ассоциируется с повышенной агрессивностью у женщин и повышенной импульсивностью у молодых мужчин. В другом исследовании выявлена корреляция между уровнями убийств и частотой заражения T. gondii у населения. Другие выводы включают ссылки на показатели самоубийств и даже дорожно-транспортных происшествий (гипотетически из-за влияния паразита на такие характеристики, как время реакции).
По-видимому, наиболее часто изучаемая связь между инфекцией T. gondii и психическими отклонениями представляет собой связь между T. gondii и шизофренией. С 1950-х годов было опубликовано более 40 исследований, посвященных изучению взаимосвязи инфекции T. gondii и шизофрении или психотических симптомов. В 2012 году группа исследователей суммировала данные из 38 из этих исследований, чтобы определить, существует ли связь между T. gondii инфекции и шизофрении. Результаты этого анализа показали, что во всех исследованиях, индивидуумы, у которых был диагностирована шизофрения, были в 2,73 раза больше инфицированными T. gondii. С точки зрения того, как это увеличение риска соотносится с другими известными факторами риска развития шизофрении то оказалось , что оно по величине аналогично увеличению риска развития шизофрении у тех, кто растет в городской среде или у тех, у кого отец, старше 55 лет при рождении , но значительно ниже, чем повышенный риск, связанный с наличием другого члена семьи с шизофренией. Однако, невозможно сказать, предшествовала ли инфекция T. gondii (и, следовательно, вызвана ) шизофренией или нет. В то же время, это позволяет сделать ряд других возможных объяснений взаимосвязи между инфекцией и шизофренией. Например, существует вероятность того, что корреляция между T. gondii инфекции и шизофрении существует, потому что инфекция становится более вероятной после начала шизофрении. Что, если, например, начало шизофрении связано с поведенческими изменениями (например, изменениями в еде и гигиене), которые увеличивают воздействие источников загрязнения T. gondii ?
Альтернативно, что, если какая-то общая переменная увеличивает риск заражения T. gondii и шизофрении? Например, что, если что-то в нейробиологии человека делает более вероятным иметь кошку (и, таким образом, подвергаться воздействию T. gondii через воздействие фекалий), а также предрасполагает к шизофрении? Или, что, если T. gondii не увеличивает риск шизофрении, но какой-то другой микроорганизм перешел от кошки к человеку? В этом случае наличие кошки заставит кого-то заразиться T. gondii и, скорее всего, сыграет роль в генезе шизофрению, но не из-за прямой связи между T. gondii и шизофренией. Действительно, одно исследование не обнаружило существенной связи между инфекции T. gondii и шизофренией , но исследователи нашли существенную связь между тесным контактом с кошками и шизофренией.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
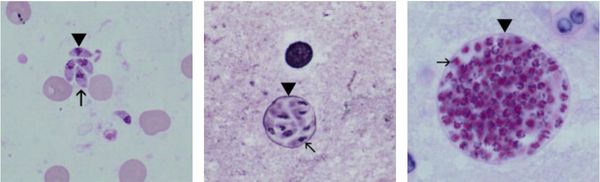
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
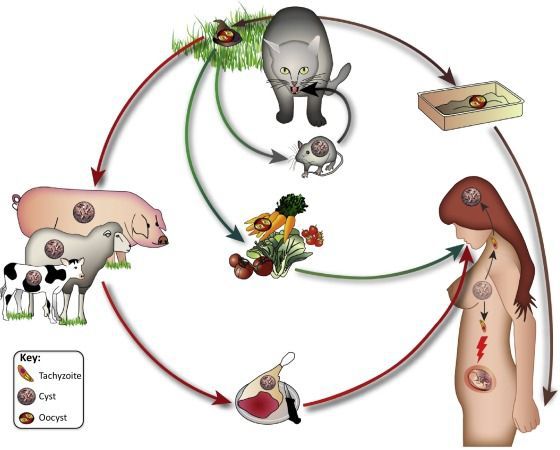
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
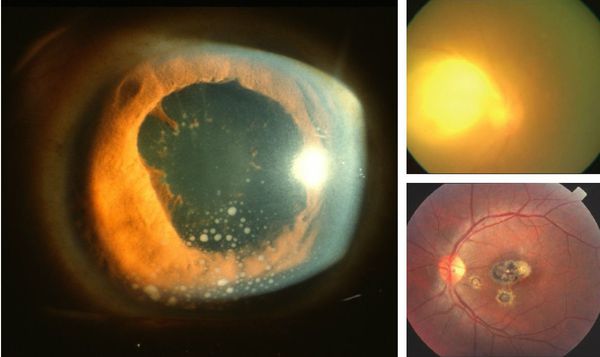
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
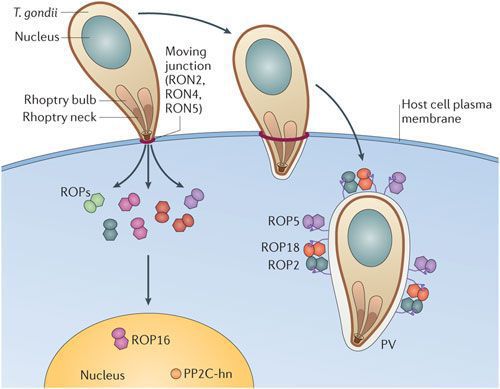
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]

Ученые выяснили, почему в ДТП попадают одни и те же люди
По разным данным, токсоплазмозом — заболеванием, вызываемым кошачьим паразитом Toxoplasma gondii — страдает от 20 до 40 процентов человечества. У большинства болезнь протекает бессимптомно. Долго считалось, что это опасно только беременным женщинам и тем, у кого снижен иммунитет. Однако сразу несколько недавних исследований связали эту инфекцию с депрессиями, шизофренией, агрессивным вождением и даже половыми извращениями.
В авариях не всегда виноваты люди
Британский художник Луис Уэйн всю жизнь рисовал кошек — разных размеров и цветов, в различных позах и часто с антропоморфными чертами. У него дома было несколько пушистых питомцев, он состоял в Обществе защиты кошек, возглавлял Английский национальный кошачий клуб. Однажды даже попытался вырвать руль у водителя автобуса, чтобы тот не задавил кота, перебегавшего дорогу. Жизнь он закончил в психиатрической больнице, где долго лечился от шизофрении.
Сегодня высказывают предположения, что психическое расстройство художника связано с его невероятной любовью к кошкам — точнее, с одноклеточным паразитом Toxoplasma gondii, которого он вполне мог подцепить от многочисленных питомцев. Ведь кошка — основной хозяин токсоплазмы. Прямых доказательств того, что художник страдал хроническим токсоплазмозом — так называется заболевание, вызываемое паразитом, — нет. Но то, что Toxoplasma gondii имеет отношение к шизофрении и влияет на поведение человека, уже не вызывает сомнений у исследователей.
Спровоцировать шизофрению
Похожее соотношение носителей Toxoplasma gondii ученые из Сеченовского университета недавно выявили и среди шизофреников. Из 155 пациентов, страдающих шизофренией, у 62 обнаружили токсоплазму — это 40 процентов. Как объяснила один из основных авторов работы, сотрудник Института медицинской паразитологии, тропических и трансмиссивных заболеваний Екатерина Степанова, несмотря на небольшую выборку, полученные результаты можно считать статистически значимыми, а связь токсоплазмы с повышенным риском развития шизофрении доказанной.
По словам Евгения Морозова, полученные ими данные полностью подтверждаются зарубежными коллегами.
Все во имя размножения
Носителей токсоплазмы также часто выявляют среди потенциальных самоубийц. Согласно исследованию американских ученых, в организме 43 процентов тех, кто пытался свести счеты с жизнью, присутствуют паразиты Toxoplasma gondii.
По мнению Екатерины Степановой, ухудшение настроения и склонность к рисковому поведению, часто характерные для носителей токсоплазмы, определяются переизбытком дофамина — нейромедиатора, регулирующего положительные эмоции. Именно на выработку этого вещества в организме хозяина способна влиять токсоплазма.
Секс, любовь и паразиты
Согласно работе сингапурских биологов, инфицированных грызунов тянет к кошачьей моче из-за того, что в их мозге активируются нейроны, отвечающие за восприятие феромонов, а не те, которые должны реагировать на опасность.
В мозге человека этот процесс (если он имеет место, потому что пока это только предположения) может приводить к неожиданным последствиям. По данным чешских исследователей, среди любителей нетрадиционных сексуальных практик — например БДСМ — высока доля носителей Toxoplasma gondii. Исследователи опросили о сексуальных предпочтениях свыше пяти тысяч человек, которые сдавали кровь на антитела к токсоплазме и наверняка знали, инфицированы они или нет.
Оказалось, что токсоплазмозников чаще, чем остальных, возбуждали сексуальные практики, связанные с насилием или нетрадиционными половыми влечениями. Правда, реального участия в таких отношениях они не принимали. Им было достаточно просто фантазировать.
Кошки ни при чем
Исследователи предупреждают: кошки — не основной источник Toxoplasma gondii. Намного больше шансов подцепить паразитов у любителей плохо прожаренного мяса или не очень чистоплотных людей.
Читайте также:

