Лечебное голодание при красной волчанке
Обновлено: 05.05.2024
Чтобы исследовать состояние у пациентов с СКВ, которые принимали или недавно прекратили принимать противомалярийные препараты, исследователи выявили 1573 потенциальных участника из долгосрочного наблюдательного когортного исследования в университетской клинике.
Из этой многочисленной группы было выделено 88 клинических случаев - пациентов, которые достигли клинической ремиссии в течение как минимум года и прекратили прием противомалярийной терапии.
Первая контрольная группа была представлена пациентами, которые достигли ремиссии и продолжали принимать лекарства. Также был произведен второй контроль, в результате чего общее количество участников исследования составило 173.
Все пациенты наблюдались не менее 2 лет.
Обострение СКВ было определено как любое увеличение показателей по шкале SLEDAI-2K, при значительном обострении – превышение нормы на 4 или более баллов.
Средний возраст исследуемых составил 44 года, средний возраст в контрольной группе - 46 лет.
Представителями обеих групп были преимущественно белокожие женщины.
Причины отмены препаратов включали собственную инициативу, ремиссию, а также токсическое повреждение сетчатки, кожи, слизистых оболочек и органов сердечно-сосудистой системы.
20 участников экспериментальной группы сообщили о неблагоприятных побочных эффектах противомалярийных препаратов, связанных с их высоким профилем токсичности.
Врачи также сравнили результаты 26 пожилых пациентов с волчанкой, которые принимали гидроксихлорохин в течение как минимум 5 лет до момента прекращения приема препарата, с 32 пациентами контрольной группы, которые продолжали принимать гидроксихлорохин на момент исследования.
Обострение СКВ произошло в 61,4% случаев по сравнению с 45,1% в контрольной группе (P = 0,002), причем наиболее распространенными вариантами обострений были обострения со стороны кожи и скелетно-мышечной системы.
После многомерного анализа риск обострения более чем в два раза возрастал у тех, кто прекратил лечение (отношение шансов, 2,26; 95% доверительный интервал, 1,24–4,11; P = 0,008).
Более чем в половине случаев (n = 46) противомалярийные препараты возобновляли после отмены, что в основном было связано с обострением заболевания.
Из группы пациентов, возобновивших лечение в связи с обострением СКВ: у 88% вновь был достигнут контроль над заболеванием \ произошло улучшение состояния, у оставшихся 12% случились новые обострения.
Из 88 пациентов 51 пациент резко прекратили прием терапии тогда, как 37 пациентов отмену препаратов производили постепенно.
У пациентов, придерживающихся постепенной отмены, было меньше обострений (45,9%) по сравнению с пациентами, прекратившими лечение внезапно (72,6%).
После многофакторного анализа риск обострения более чем в три раза увеличился для группы внезапной отмены лекарств (OR 3,42; 95% ДИ 1,26-9,26; P = 0,016).
Пациенты, снизившие дозу противомалярийных препаратов, позднее возобновили полноценную терапию по сравнению с группой резкой отмены лекарств (37,8% против 62,7%; P = 0,02).
Только у 5 пожилых пациентов из каждой группы - 19,2% в группе отмены и 15,6% в группе пролонгирования терапии произошел эпизод обострения СКВ (OR 1,28; 95% ДИ 0,31-5,30; P = 0,73). Большинство обострений были кожными и скелетно-мышечными по своей природе; ни в одной из групп не было развития серьезных патологических состояний.
Медленное снижение дозы или продолжение приема противомалярийных препаратов может помочь предотвратить обострение болезни у пациентов с СКВ, достигших клинической ремиссии в течение как минимум года.
У пожилых пациентов с СКВ, которые постепенно прекращают прием гидроксихлорохина, также отсутствует повышенный риск обострения болезни.

В журнале Rheumatology 06 октября 2017 г. опубликовано руководство по лечению системной красной волчанки у взрослых, подготовленное Британским обществом ревматологии.
Клинические и серологические признаки о вероятном диагнозе системной красной волчанки (СКВ):
1) СКВ является мультисистемным аутоиммунным заболеванием. Диагноз требует наличия комбинации клинических признаков и наличия как минимум одной связанной иммунологической патологии. При подозрении на СКВ необходимо проведение тестов крови, включая тесты на серологические маркеры.
2) Антинуклеарные антитела (ANA) присутствуют у около 95% пациентов с СКВ. Если тест негативен, то имеется низкая вероятность наличия СКВ у пациента. Положительный тест ANA имеется у около 5% взрослых и изолированно имеет низкую прогностическую ценность при отсутствии клинических признаков аутоиммунной ревматической болезни.
3) Наличие антител к двухцепочечной ДНК (анти-dsDNA), низкий уровень комплемента или анти-Sm (Smith) – антитела являются высокопрогностичным признаком диагноза СКВ у пациентов с соответствующими клиническими признаками. Анти Ro/La – антитела, и анти RNP – антитела являются менее специфичными маркерами СКВ, так как они обнаруживаются при других аутоиммунных ревматических болезнях и при СКВ.
4) Необходимо проведение теста на синдром антифосфолипидных антител у всех пациентов с СКВ изначально, особенно с отклонениями беременности в анамнезе, либо с артериальными/венозными тромботическими событиями. Подтверждающими тестами на антифосфолипидный синдром являются положительный волчаночный антикоагулянт, антитела к кардиолипину (IgG и IgM) и/или анти-бета-2 гликопротеин-1 (IgG и IgM) при проведении тестов 2 раза с как минимум 12 недель между тестированием.
Обследование пациентов с СКВ:
1) Клинические проявления у пациентов с СКВ зависят от активности болезни, поражений, токсичности препаратов или наличия сопутствующих заболеваний. По активности болезни, очень важно убедиться является ли это из-за активного воспаления или тромбоза, что и будет обусловливать стратегию лечения.
2) Клиническая оценка пациентов с СКВ должна включать тщательный анамнез и обзор систем, полный клинический осмотр и мониторинг основных показателей состояния организма, общий анализ мочи, лабораторные тесты, оценка состояния здоровья и качества жизни, и измерение активности болезни и степени повреждений с применением стандартных инструментов оценки СКВ. При наличии показаний необходимо проводить методы визуализации, биопсию почек и других тканей.
3) Активность болезни категоризуется на легкую, умеренную и тяжелую с периодами обострений. Легкой активностью болезни является клиническая стабильность без жизне-угрожающего вовлечения органов, с основным проявлением в виде артрита, кожно-слизистых поражений и легкого плеврита. У пациентов с умеренной активностью болезни имеются более серьезные проявления. При тяжелой активности болезни имеются жизне-угрожающие или орган-угрожающие проявления.
1) Пациенты с СКВ должны проходить мониторинг на регулярной основе на проявления болезни, токсичность препаратов и сопутствующие заболевания.
2) Пациенты с активной болезнью должны проходить контрольные осмотры как минимум каждые 1 - 3 месяца с измерением АД, общего анализа мочи, функции почек, анти-dsDNA антитела, уровень комплемента, С-реактивный белок, развернутый общий анализ крови, и печеночные тесты. Пациенты со стабильной болезнью с низкой активностью или в ремиссии могут проходить мониторинг менее часто, например каждые 6 - 12 месяцев.
3) Наличие синдрома антифосфолипидных антител связано с тромботическими событиями, повреждениями и неблагоприятными исходами при беременности. При отрицательном предыдущем тестировании, необходимо повторное тестирование до беременности или операции, либо при наличии новых тяжелых проявлений или сосудистых событий.
4) Анти-Ro/La антитела связаны с неонатальной СКВ (включая врожденной блокадой сердца) и должны быть проверены до беременности.
5) Пациенты с СКВ имеют повышенный риск сопутствующих болезней, таких как атеросклеротическая болезнь, остеопороз, аваскулярный некроз, злокачественных новообразований и инфекций. Необходимо проводить исходную и ежегодную оценку модифицируемых факторов риска, включая гипертонию, дислипидемию, диабет, высокий индекс массы тела и курение.
6) Иммуносупрессивная терапия может приводить к токсическим проявлениям. Необходимо проводить тщательный мониторинг препаратов путем лабораторных тестов и клинической оценки согласно руководствам по мониторингу препаратов.
Лечение легкой СКВ:
1) Лечение легкой орган-не-угрожающей СКВ включают болезнь-модифицирующие препараты гидроксихлорохин и метотрексат, и короткие курсы НПВС для контроля симптомов. Данные препараты позволяют избегать либо снижать дозу кортикостероидов.
2) Для поддерживающей терапии может понадобиться применение преднизолона в низкой дозе ≤ 7,5 мг/день . Возможно применение средств местного применения при кожных проявлениях и внутрисуставных инъекций при артритах.
3) Солнцезащитный крем с высоким SPF UV-A и UV-B является важным в лечении и профилактике вызываемых ультра-фиолетовым излучением поражений кожи. Необходимо информировать пациентов об избегании солнца и ношении соответствующей защитной одежды.
Лечение умеренной СКВ:
1) При лечении умеренной СКВ применяют более высокие дозы преднизолона (до 0,5 мг/кг/день), либо в/м иди в/в дозы метилпреднизолона. Для контроля активной болезни часто необходимы иммуносупрессивные препараты, позволяющие избежать стероиды. Данные препараты также снижают риск повреждений в длительном периоде.
2) Метотрексат, азатиоприн, микофенолата мофетил, циклоспорин и другие ингибиторы кальциневрина должны быть рассмотрены в случаях артрита, кожных поражений, серозитов, васкулите или цитопениях, если гидроксихлорохин оказался недостаточным.
3) В рефрактерных случаях можно рассмотреть возможность применения белимумаба или ритуксимаба.
Лечение тяжелой СКВ:
1) Пациенты с тяжелой СКВ, включая с поражением почек и нейро-психиатрическими проявлениями, нуждаются в тщательном обследовании для исключения других причин, включая инфекции. Лечение зависит от этиологии (воспалительной и/или тромботической) и необходимо соответствующее лечение с применением иммуносупрессии и/или антикоагуляции соответственно.
2) Иммуносупрессивные режимы при тяжелой активной СКВ включают в/в метилпреднизолон или пер-оральный преднизолон в высоких дозах (до 1 мг/кг/день) для приведения к ремиссии, либо изолированно, или как чаще бывает, в составе протокола лечения с другим иммуносупрессивным препаратом.
3) Микофенолата мофетил или циклофосфамид применяются при большинстве случаев волчаночного нефрита и при рефрактерных тяжелых случаях болезни без поражения почек.
4) Можно рассмотреть возможность применения биолоджиков белимумаба или ритуксимаба на индивидуальной основе, когда у пациентов неэффективны или непереносимы другие иммуносупрессивные препараты.
5) Внутривенные иммуноглобулины и плазмаферез могут быть рассмотрены для пациентов с рефрактерной цитопенией, тромботической тромбоцитопенической пурпурой, быстро ухудшающемся остром галлюциногенном состоянии и катастрофической формой антифосфолипидного синдрома.
По препаратам смотрите таблицу 1.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).

Когда иммунная система начинает атаковать собственные клетки, развивается аутоиммунное заболевание. Причиной служит плохая экология, регулярные стрессы, недолеченная вирусная или инфекционная болезнь, наследственный фактор. При аутоиммунном расстройстве назначается комплексная гормональная терапия и диетпитание. Чтобы составить правильный рацион, необходимо пройти обследование, в ходе которого выяснится состояние пациента. Назначение диетического питания зависит от индивидуальной особенности пациента, от того, в каком состоянии кости и мочевыводящая система.
Согласно научным данным, которые подтверждают взаимосвязь между кишечником и воспалительным процессом, выявлено, что при бактериальном росте в кишечнике начинает развиваться воспалительное и аутоиммунное заболевание. Диета aip подразумевает исключение некоторой пищи из привычного рациона, чтобы понизить интенсивность признаков аутоиммунного расстройства. Условием является прохождение дополнительного обследования, чтобы подтвердить, что нарушение работы стенок кишечника относится к главному фактору, относящемуся к развитию воспаления. Лечение аутоиммунных заболеваний диетой aip способна уменьшить потребность в приеме высоких доз медикаментозных препаратов. Диета аутоиммунного палео протокола относится к строгому режиму питания, поэтому перед началом необходимо проконсультироваться с лечащим врачом.
Специальное питание при аутоиммунном заболевании должно быть:
- Богато микроэлементами. Недостаток селена, магния, цинка связывают с некоторыми видами аутоиммунного расстройства, которое начинается при хроническом воспалительном процессе. Воспаление способно поглощать такие важные питательные вещества. Микроэлементы содержатся в орехах и семенах. Селен находится в фасоли, печени, горохе. Овсянка и гречка содержит магний. Большое количество цинка содержит ячменная крупа, кедровые орехи плавленый сыр.
- Содержать витамин А, который способен улучшить состояние иммунитета. Согласно научным исследованиям, недостаток такого витамина нарушает иммунную защиту слизистой оболочки. В результате в дыхательные пути и желудочно-кишечный тракт проникает инфекция. Высокое содержание ретинола встречается в рыбе, моллюсках, печени, молочном жиру коров, в рационе которых была только трава. Сладкий картофель, морковь содержат провитамин, но в человеческом организме он с низкой скоростью превращается в ретинол.
- Богато витаминов к2. Медицинские исследования доказывают, что наличие этого витамина оказывает положительный эффект во время лечения иммунитета и воспалительного процесса. Высокий процент витамина к2 содержит ферментированная японская соя. При отсутствии возможности употреблять такой продукт, альтернативой служит употребление паштета из куриной, гусиной печени, сыра, желтка, творога.
- Богато железом. Недостаток железа связывают с возникновением многих аутоиммунных расстройств. Чтобы восполнить баланс железа в организме, человеку необходимо употребление говядины, печени, шпината. Для приготовления еды используется чугунная посуда.
- Содержать витамин Д. Из-за отсутствия необходимого количества витамина Д в организме может начать развитие красная волчанка, ревматоидный артрит, сахарный диабет первого типа. При недостатке этого витамина увеличивается частота инфекционного проникновения в организм. Витамин Д находится в животном и молочном жире. Человеческий организм способен самостоятельно вырабатывать этот витамин. Для этого достаточно полчаса в сутки находиться под открытыми солнечными лучами.
Существует три фактора, которые способствуют возникновению аутоиммунной болезни. К первому фактору относится рацион, в котором недостает питательных веществ, вследствие чего нарушается усваивание пищи. В питании может не хватать:
- Клетчатки. Она помогает убрать воспаление, улучшить перильстатику.
- Жирорастворимых витаминов.
- Антиоксидантов. Они способны уменьшить воспалительный процесс. Антиоксиданты вырабатываются организмом, ими богаты овощи, фрукты.
- Минералов. При аутоиммунном расстройстве важно, чтобы в организме было достаточное количество меди, магния, цинка, железа, селена, йода. Необходимо следить как за дефицитом, так и переизбытком таких минералов. Стоит учесть, что положительное действие некоторых минералов возможно только в комплексе с другими минералами, которые присутствуют в еде, а не добавках.
- Качественного жира. Из-за недостатка плохо усваиваются важные жирорастворимые витамины. Чтобы уменьшить воспалительный процесс, следует соблюдать пропорцию омега6 и омега3.
Желудочно-кишечный тракт служит главным барьером между внутренней средой и внешними факторами. Это является причиной расположения около него значительной части иммунитета. Задача ЖКТ – осуществление пищеварения и всасывания полезных микроэлементов. Если присутствует синдром дырявой кишки, происходит травмирование стенок кишечника. Вместо фильтрации через кишечный барьер, в организм проникают токсические вещества, инфекция, патогенные микроорганизмы, непереваренная еда. Неспособность иммунных клеток, которые расположены возле кишечника, справляться с возбудителями оканчивается проникновением их в кровоток. Происходит активизация врожденного иммунитета и воспалительного процесса. Если желудочно-кишечный тракт функционирует нормально, такая ситуация исключается.
Выделяют список продуктов, употребляя которые, повышается риск возникновения дырявой кишки, дисбактериоза, и как следствие – аутоиммунного заболевания:
Диетическое питание, которое является противоположностью палео диеты при аутоиммунном заболевании, называется веганское. Безглютеновая диета при аутоиммунном заболевании предусматривает отказ от мяса, молочных продуктов, яиц, рыбы. Некоторые специалисты твердят, что соблюдение веганской диеты не обеспечивает достаточным количеством аминокислот, которые содержит растительная пища. Пациентам, у которых диагностирован аутоиммунный тиреоидит, трудно балансировать уровень витамина В12, Д, железа без употребления пищи животного происхождения. Однако Соблюдение такой диеты снижает воспаление, запущенное аутоиммунными процессами и нарушением в функционировании желудочно-кишечного тракта.
Определение диеты по группе крови
Способ, который позволяет определить тип диетического питания, основан на группе крови человека. Пациент, у которого первая группа крови, должен употреблять мясо. Им рекомендовано соблюдение аутоиммунной палеодиеты. Вторая группа крови у человека говорит о том, что нет необходимости кушать много мяса, им следует придерживаться веганского питания. Пациентам с 3 и 4 группой необходимо создать гибридную версию из вышеперечисленных видов диет. Независимо от выбора противовоспалительной диеты при аутоиммунном заболевании, следует максимально разнообразить питание и включить витаминные добавки.
Правила питания при тиреоидите
Сбой в работе иммунной системы сопровождается различными заболеваниями. К одному из них относится тиреоидит, когда аутоантителами повреждаются здоровые клетки щитовидной железы. В результате щитовидка перестает вырабатывать тиреоидный гормон. Диагностирование тиреоидита подразумевает лечебную терапию и определенное питание. При гипертиреозе ускоряются обменные протезы, нарастает энергозатрата, интенсивнее распадается жир, белок и гликоген, расходуется витаминный и минеральный запас. Отсюда следует, что диета при аутоиммунном заболевании должна восполнить измененную потребность организма в определенных веществах. Правила питания при тиреоидите следующие:
- Ввести дробный режим. Пищу принимать минимум пять раз в день для избегания чувства голода.
- Включить продукты, в которых содержится много калия. Это банан, абрикос, картофель, ананас, персик, крыжовник, капуста.
- Белковая квота повышается до полтора грамма на один килограмм массы тела пациента. Этому способствует мясо, рыба нежирных сортов, яйца, гречка, овсянка, кисломолочные продукты.
- Употребление нерыбных морепродуктов допустимо, но суточный показатель не должен превышать 0.1 миллиграмм.
- Суточный показатель калорий увеличить на тридцать процентов. Количество процентов зависит от индивидуальных особенностей пациента.
- Чтобы не появлялась жажда, следует часто пить. В качестве напитков служит компот, несладкий отвар шиповника, отвар из сухофруктов, морс, чай, молочный напиток с низким показателем жирности. Перерыв между питьем минимум десять минут, делать не более двух-трех глотков.
- Из рациона исключается пища и питье, способные активировать центральную нервную систему. Речь идет об употреблении спиртных напитков, крепких бульонов, рыбной и мясной подливы, крепкого черного чая, кофе, шоколада, пряностей.
Пациента, у которого понижена выработка тиреоидного гормона, необходимо ограничить количество легкоусваиваемого сахара, а именно сдобных продуктов, белого хлеба, рисовой каши, варенья, меда, манной каши, тортов. Рацион исключает сливки, маргарин, жирный творог, сметану, рыбную икру, рыбу жирных сортов, сала. Пациентам рекомендовано употребление продуктов, которые имеют послабляющий эффект (кефир, овощи, растительное масло, фрукты). При правильном подборе диеты, можно снизить интенсивность симптомов заболевания и улучшить состояние больного.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
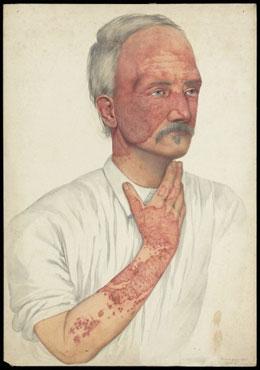
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди

Обзор
Автор
Редакторы

Эта Статья заслужила приз зрительских симпатий.
Однако есть заболевания, возможно, не столь смертельные, но куда сильнее бьющие по нам экономически. Это аутоиммунные заболевания, такие, как рассеянный склероз, системная красная волчанка или диабет 1-го типа. Если рак и инсульты чаще всего встречаются у пожилых людей, то аутоиммунные состояния обычно манифестируют (проявляются в виде симптомов) у молодых людей трудоспособного возраста и либо ложатся тяжким бременем на бюджет страны или больного (россияне, больные диабетом, если не получают инсулин от государства, тратят на поддержание собственной жизни от 1 до 5–6 тысяч рублей в месяц), либо, как в случае рассеянного склероза, просто ставят крест на карьере и жизни пациента.
Особенность аутоиммунных заболеваний состоит в том, что практически ни для одного из них мы за долгие годы исследований и экспериментов не научились достигать стойкой ремиссии. Текущие решения сводятся либо к поддерживающей терапии (как в случае с инсулинозависимым диабетом), либо к попыткам отсрочить терминальную стадию заболевания, на что нацелены препараты от рассеянного склероза. До недавнего времени ситуация выглядела довольно плачевно. Дополнительно усугубляет ее тот факт, что количество людей с аутоиммунными заболеваниями растет каждый год, и мы находимся на пороге настоящей эпидемии.
Однако там, где фармацевтическая отрасль терпит одну неудачу за другой, внезапно сама природа показала, куда смотреть исследователям и откуда брать по-настоящему работающее лекарство.
История вопроса
Чтобы понять, откуда возникла проблема с аутоиммунными заболеваниями, придется заглянуть далеко в прошлое.
Дело в изменившемся в ходе FET образе жизни человека. До этого мы жили небольшими группами, состоявшими не более чем из 50 особей, занимавшими довольно обширные пространства. К тому же мы постоянно меняли место жительства, нигде не оставались надолго. Культура гигиены была довольно низкой — зачем следить за чистотой убежища, если ты уже съел всех мамонтов вокруг и завтра надо искать новое место?
В ходе FET люди начали надолго оставаться на одном месте, формировать более крупные группы для защиты от набегов соплеменников. Скученность и загрязнение места обитания создали оптимальные условия для развития у нас инфекций. Начались эпидемии, которые были тем свирепее, чем больше был город и чем плотнее жили в нем люди.

Довольно долгое время, около 5000 лет, понадобилось человечеству, чтобы научиться справляться с инфекциями. Где-то раньше, где-то позже люди осознали важность гигиены для жизни и здоровья. Были эмпирически найдены лекарства от многих болезней. Можно сказать, весь прогресс медицины и человечества в целом происходил под постоянно довлеющим страхом новых эпидемий.

Рисунок 2. Обложка Le petit journal от 1 сентября 1912 года, посвященного эпидемии холеры в Индии и на Ближнем Востоке в начале 20-го века.
В настоящее время мы настолько чисты, насколько не были никогда в истории. Особенно хорошо это видно в развитых странах. Мы привыкли к тому, что во все дома подведена вода и всегда есть возможность принять ванную или душ. Мы пользуемся мылом, влажными салфетками, асептическими гелями. Мы даже моем наши дороги шампунем!
Казалось бы, ну чистые и чистые, что тут такого? При чем тут аутоиммунные заболевания? Оказывается, связь самая прямая.
Гигиеническая гипотеза
Этот переход стал возможен благодаря появлению антибиотиков и других высокоэффективных противопаразитических лекарств. В развитых странах он завершился к концу 20-го века. Если в середине века в Европе каждый третий житель был поражен гельминтами [1], то в настоящий момент обнаружение носителя этих паразитов скорее редкость. Россия в этом отношении практически не отстает от развитого мира благодаря нашим сильным гигиеническим традициям. Дополнительный вклад вносит городской образ жизни, централизованное снабжение очищенной водой, контроль качества пищи и так далее.

Рисунок 3. Обратное отношение между частотой инфекционных заболеваний и частотой иммунных расстройств с 1950 по 2000 годы. а — Изменение относительного количества заболевших различными инфекционными заболеваниями. б — Относительный рост заболеваемости аутоиммунными заболеваниями за тот же период.
Впоследствии многие исследователи показали то же самое на примере других аллергий и аутоиммунных реакций. К примеру, если детям из неблагополучных по гигиене регионов вроде Чили или Тайланда провести европейскую программу дегельминтизации, у них букетом высыпают аллергии [4].
Наверное, самым интересным примером тут является история с рассеянным склерозом [5–8]. Ученые решили посмотреть, что происходит, когда больной этим страшным заболеванием заражается гельминтами, и начали искать инфицированных червями пациентов с РС. Результаты были ошеломляющи. У пациентов, которые заражались определенными гельминтами (например, власоглавом Trichuris trichiura) течение заболевания практически останавливалось [6]. Во время инфекции у них на 95% снижалось количество новых бляшек в мозге (рис. 4). Результат, недостижимый ни одним современным методом терапии! Если же по каким-то причинам гельминтов требовалось удалить (например, развивалось острое воспалительное поражение кишечника), болезнь возобновлялась с той стадии, на которой остановилась при инфекции.

Рисунок 4. График появления новых бляшек в мозге (когортное исследование 2011 года). Круги — неинфицированные гельминтами пациенты, квадраты — инфицированные, треугольники — инфицированные, но вылеченные от гельминта (момент излечения показан черной стрелкой).
Иммунный ответ
Иммунная система призвана защищать организм от внутренних и внешних врагов. Внешними врагами являются вирусы, бактерии, простейшие и черви, которые постоянно попадают в наш организм и уничтожаются на дальних рубежах. Внутренними врагами являются раковые клетки, а также клетки, зараженные вирусами или внутриклеточными бактериями.
Когда паразит попадает в организм, первым делом его встречает врожденный иммунитет, клетки которого (макрофаги) есть во всех тканях. Антигеном в данном случае служат нехарактерные для нашего организма молекулы — клеточная стенка бактерий, двухцепочечная РНК некоторых вирусов, свободно плавающая в межклеточном пространстве наша ДНК и так далее. При обнаружении пришельцев, клетки врожденного иммунитета пытаются их уничтожить, параллельно выделяя провоспалительные молекулы (рис. 5). Воспаленная ткань блокирует выход паразита из места проникновения в остальной организм и привлекает новые клетки иммунитета к месту повреждения.

Рисунок 5. Фагоцит пожирает бактерии.
Если врожденному иммунитету не удается уничтожить захватчиков, в дело вступает адаптивный иммунитет. Происходит это отнюдь не сразу: активации адаптивного ответа предшествуют 3–4 дня подготовки в лимфоузлах (при этом лимфоузлы увеличиваются в размерах, что является признаком инфекционного заболевания). Начинается все с того, что некоторые из клеток врожденного иммунитета прибывают в лимфоузел, неся на себе антигены из места поражения. Антигенами в данном случае выступают короткие (от 8 до 20 аминокислот) пептиды из белков инфекционного агента и окружающих тканей. По сути, макрофаг (или специализированный активатор адаптивного иммунитета — дендритная клетка) просто захватывает из места воспаления образцы растворенных белков, ошмётков паразита и погибших клеток и приносит в лимфоузел.
В лимфоузле его встречают наивные (неактивированные) клетки адаптивного иммунитета — Т-лимфоциты. Каждый лимфоцит, выйдя из места своего формирования, несет на себе уникальный рецептор, который формируется путем направленного внесения мутаций в геном. Заранее неизвестно, может ли этот рецептор распознать какой-либо антиген, но его вариантов так много (по некоторым оценкам, у нас может быть до 10 48 разных типов этого рецептора, но большая часть их будет нефункциональна), что в течение нескольких часов в лимфоузле обнаруживается как минимум несколько клеток, способных распознать антигены паразита. Затем эти клетки делятся, активируются и отправляются в поврежденную ткань, где отыскивают свои антигены и уничтожают как самих захватчиков, так и зараженные клетки, если мы говорим о вирусе или внутриклеточной бактерии (рис. 6).

Рисунок 6. Т-лимфоциты (красные) убивают раковую клетку (синяя) своего же организма. После получения сигнала раковая клетка начинает распадаться на небольшие пузырьки, которые затем съедят клетки врожденного иммунитета.
Иммунологическая толерантность
Иммунная система — единственная из систем организма, в чью задачу входит уничтожение других живых существ — отдельных клеток или многоклеточных организмов. Причем наши собственные клетки тоже часто должны уничтожаться, если они заражены вирусом, бактерией или превратились в раковые. При этом необходимо избегать иммунного ответа на нормальные клетки. Если такой ответ развивается — возникает аутоиммунное заболевание.
Периферическая толерантность возникает, когда Т-лимфоцит распознает антиген в лимфоузлах, но никакого воспаления в месте, откуда этот антиген попал в лимфоузел, нет. Напротив, высока концентрация противовоспалительных молекул. Такой лимфоцит опять-таки или уничтожается, или превращается в регуляторный.
Паразиты и симбионты
Миллиарды лет эволюции крупные многоклеточные организмы были домом и едой для более мелких одноклеточных и многоклеточных. Человек тут не исключение — ведь мы являемся как хорошим источником пищи, так и отличным защитником для всего, что сумеет поселиться внутри нас или на нас.
Эволюция поделила этих сожителей на 2 большие группы — паразиты и симбионты. Паразиты делают ставку на быстрое размножение. У них есть возможность подавления врожденного иммунитета, а пока адаптивный активируется, они уже успевают размножиться за счет наших ресурсов и передать инфекцию дальше. Так действует, например, вирус гриппа или бактериальная пневмония.
Симбионты же научились подавлять как врожденный, так и адаптивный иммунитеты. Для этого им пришлось умерить свои аппетиты — если клетки организма постоянно повреждаются, то никакие уловки не смогут предотвратить активацию иммунитета. Потому они поселились на поверхностях нашего тела, прежде всего на поверхности ЖКТ, где они получают лишь часть нашей пищи, но не покушаются на сам организм.
Помимо этого, они научились подавлять воспаление, выделяя вещества, которые похожи на наши противовоспалительные молекулы. Макрофаги врожденного иммунитета, столкнувшись с такими бактериями, могут почувствовать антигены клеточной стенки, но не активируются, так как подавлены противовоспалительным фоном вокруг.
Третьим механизмом защиты стала антигенная мимикрия. Для адаптивного иммунитета основным антигеном являются пептиды из белков. И многие наши симбионты в ходе эволюции поменяли свой белковый состав так, чтобы в нем был максимум пептидов, похожих на наши. Таким образом они встают под защиту регуляторных лимфоцитов. Этот механизм характерен для всех видов наших сожителей — бактерий, червей (рис. 7), вирусов и так далее.

Рисунок 7. Власоглав — один из гельминтов, активно изучаемых в рамках гигиенической гипотезы.
В течение миллионов лет каждая особь нашего вида, рождаясь, сразу же вступала в контакт с симбионтами, населявшими кожу, слизистые и кишечники своих собратьев. Со временем организм научился извлекать выгоду из такого постоянного неустранимого сосуществования. В частности, способность бактерий и червей создавать сильный противовоспалительный фон в месте своего обитания стала за это время ключевым фактором создания периферической толерантности. Она распространилась как на антигены самих сожителей, так и на сопутствующие им — антигены пищи (в кишечнике), пыли и пыльцы (в легких) и собственного организма (те самые антигены, которые сожители развили в ходе антигенной мимикрии).
И снова гигиеническая гипотеза
Особенно сильно на риск развития таких заболеваний влияет первый год жизни. Если в этот период ребенок оказывается в деревне, проводит некоторое время в больших группах сверстников (в больнице или в детском саду) и вообще чаще встречается с инфекциями — риск развития аутоиммунных заболеваний серьезно снижается [11], [12].
Разумеется, не только микробиом (совокупность всех симбиотических микроорганизмов конкретного человека) [13] и гельминты влияют на риск развития аутоиммунных и аллергических реакций. Есть и генетическая предрасположенность, и условия, в которых человек впервые встречается с тем или иным внешним антигеном. Есть некоторые микроорганизмы, которые не защищают, а, напротив, провоцируют аутоиммунные заболевания. Например, стрептококк способен вызывать ревматизм, а некоторые стафилококки производят суперантиген, который неспецифически запускает все клоны Т-лимфоцитов с любым рецептором — это тоже может привести к аутоиммунным заболеваниям.
| Заболевание | Количество исследований | Общее количество пациентов | Результаты |
|---|---|---|---|
| Болезнь Крона | 6 | 543 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Неспецифический язвенный колит | 3 | 192 | Показана безопасность и статистически значимые улучшения у большинства пациентов. |
| Рассеянный склероз | 6 | 156 | Показана безопасность, статистически значимые улучшения у части пациентов. |
| Непереносимость глютена (целиакия) | 2 | 35 | Исследования только начались |
| Расстройства аутического спектра | 3 | 90 | Пилотное исследование показало эффективность, подтверждающие только начаты |
| Псориаз | 3 | 55 | Исследования только начались |
| Аллергия на арахис | 1 | 18 | Исследования только начались |
| Бронхиальная астма | 1 | 32 | Зафиксированы статистически недостоверные улучшения |
| Аллергический риноконъюнктивит | 2 | 130 | Эффективность не показана |
| Ревматоидный артрит | 1 | 50 | Исследование только началось |
Что же делать нам, простым смертным, пока ученые по кусочкам разбирают эту тайну и ищут решение? Начать стóит со снижения маниакального стремления к чистоте во всем. Я не предлагаю не мыть руки перед едой. Но довольно часто в последнее время мы перегибаем палку. Антибиотики при каждом чихе, асептические спиртосодержащие гели каждые 10 минут, антибактериальное мыло вместо обычного в ванной. Все эти меры способны спасти вас от эпидемии. Но каждодневное их применение, особенно детьми, способно нанести куда больший урон, чем грипп или пищевое отравление.
Читайте также:

