Лечение синегнойной инфекции при муковисцидозе
Обновлено: 01.05.2024
Известно, что тяжелое течение бронхолегочного процесса у больных муковисцидозом (МВ) определяется инфицированием дыхательных путей Pseudomonas aeruginosa, который в настоящее время остается ведущим патогеном, определяющим прогрессирующее поражение бронхолегочной системы и прогноз заболевания в целом. Показано, что адекватное и своевременное лечение первичного высева P. aeruginosa может препятствовать переходу инфекции в хроническую форму. Целью данной обзорной статьи явилась демонстрация современных схем антибактериальной терапии для ранней эрадикации первичного и повторного высева P. aeruginosa, а также факторов, влияющих на их эффективность. Показано, что при МВ ранняя эрадикация синегнойной инфекции при ее первичном высеве является необходимым и чрезвычайно важным мероприятием. Кроме организационной составляющей, которая должна включать раннее выявление и последующий микробиологический контроль P. aeruginosa, ведущая роль принадлежит медикаментозной агрессивной терапии. Установлено, что для эрадикации первичного высева P. aeruginosa препаратом первой линии является ингаляционный тобрамицин.
Ключевые слова
Об авторах
д. м. н., профессор, главный научный сотрудник лаборатории генетической эпидемиологии
Список литературы
1. Шагинян И.А., Капранов Н.И., Чернуха М.Ю. и др. Микробный пейзаж нижних дыхательных путей у различных возрастных групп детей, больных муковисцидозом. Журнал микробиологии, эпидемиологии и ммунобиологии. 2009; 1: 15–20.
2. Красовский С.А., Амелина Е.Л., Кондратьева Е.И. и др. Респираторная инфекция нижних дыхательных путей у больных муковисцидозом в Российской Федерации по данным Национального регистра (2014). Пульмонология. 2016; 28 (4): 421–435. DOI: 10.18093/0869-0189-2016-26-4-421-435.
3. Flume P.A., VanDevanter D.R. Clinical applications of pulmonary delivery of antibiotics. Adv. Drug Deliv. Rev. 2015; 85: 1–6. DOI: 10.1016/j.addr.2014.10.009.
5. Høiby N., Frederiksen B., Pressler T. Eradication of early Pseudomonas aeruginosa infection. J. Cyst. Fibros. 2005; 4 (Suppl. 2): 49–54. DOI: 10.1016/j.jcf.2005.05.018.
6. Taccetti G., Bianchini E., Cariani L. et al. Early antibiotic treatment for Pseudomonas aeruginosa eradication in patients with cystic fibrosis: a randomized multicentre study comparing two different protocols. Thorax. 2012; 67 (10): 853–859. DOI: 10.1136/thoraxjnl-2011-200832.
7. Lee T.W. Eradication of early Pseudomonas infection in cystic fibrosis. Chron. Respir. Dis. 2009; 6 (2): 99–107. DOI: 10.1177/1479972309104661.
8. Emerson J., Rosenfeld M., McNamara S. et al. Pseudomonas aeruginosa and other predictors of mortality and morbidity in young children with cystic fibrosis. Pediatr. Pulmonol. 2002; 34 (2): 91–100. DOI: 10.1002/ppul.10127.
9. Langton-Hewer S.C., Smyth A.R. Antibiotic strategies for eradicating Pseudomonas aeruginosa in people with cystic fibrosis. Cochrane Database Syst. Rev. 2014; (11): CD004197. DOI: 10.1002/14651858.CD004197.pub4.
10. Munck A., Bonacorsi S., Mariani-Kurkdjian P. et al. Genotypic characterization of Pseudomonas aeruginosa strains recovered from patients with cystic fibrosis after initial and subsequent colonization. Pediatr. Pulmonol. 2001; 32 (4): 288–292. DOI: 10.1002/ppul.1121.
11. Frederiksen B., Koch C., Høiby N. Antibiotic treatment of initial colonization with Pseudomonas aeruginosa postpones chronic infection and prevents deterioration of pulmonary function in cystic fibrosis. Pediatr. Pulmonol. 1997; 23 (5): 330–335.
12. Ratjen F., Comes G., Paul K. et al. Effect of continuous antistaphylococcal therapy on the rate of P. aeruginosa acquisition in patients with cystic fibrosis. Pediatr. Pulmonol. 2001; 31 (1): 13–16.
13. Ratjen F., Munck A., Kho P., Angyalosi G. Treatment of early Pseudomonas aeruginosa infection in patients with cystic fibrosis: the ELITE trial. Thorax. 2010; 65 (4): 286–291. DOI: 10.1136/thx.2009.121657.
14. Treggiari M.M., Retsch-Bogart G., Mayer-Hamblett N. Comparative efficacy and safety of 4 randomized regimens to treat early Pseudomonas aeruginosa infection inchildren with cystic fibrosis. Arch. Pediatr. Adolesc. Med. 2011; 165 (9): 847–856.
15. Valerius N.H., Koch C., Høiby N. Prevention of chronic Pseudomonas aeruginosa colonisation in cystic fibrosis by early treatment. Lancet. 1991; 338 (8769): 725–726.
16. Antibiotic Treatment for Cystic Fibrosis. Report of the UK Cystic Fibrosis Trust Antibiotic Working Group. London: UK Cystic Fibrosis Trust; 2009.
17. Smith A.L., Fiel S.B., Mayer-Hamblett N. et al. Susceptibility testing of Pseudomonas aeruginosa isolates and clinical response to parenteral antibiotic administration: lack of association in cystic fibrosis. Chest. 2003; 123 (5): 1495–1502.
18. Kenny S.L., Shaw T.D., Downey D.G. et al. Eradication of Pseudomonas aeruginosa in adults with cystic fibrosis. BMJ Open Respir. Res. 2014; 1: e000021. DOI: 10.1136/bmjresp-2014-000021.
19. Амелина Е.Л., Ашерова И.К., Волков И.К. и др. Проект Национального консенсуса Муковисцидоз: определение, диагностические критерии, терапия. Раздел Антимикробная терапия. Педиатрия. 2014; 93 (4): 107–124.
20. Brodt A.M., Stovold E., Zhang L. Inhaled antibiotics for stable non-cystic fibrosis bronchiectasis: a systematic review. Eur. Respir. J. 2014; 44 (2): 382–393. DOI: 10.1183/09031936.00018414.
21. Rosenfeld M., Emerson J., McNamara S. et al. Risk factors for age at initial Pseudomonas acquisition in the cystic fibrosis epic observational cohort. J. Cyst. Fibros. 2012; 11 (5): 446–453. DOI: 10.1016/j.jcf.2012.04.003.
22. Proesmans M., Vermeulen F., Boulanger L. et al. Comparison of two treatment regimens for eradication of Pseudomonas aeruginosa infection in children with cystic fibrosis. J. Cyst. Fibros. 2013; 12 (1): 29–34. DOI: 10.1016/j.jcf.2012.06.001.
24. Stanojevic S., Waters V., Mathew J.L. et al. Effectiveness of inhaled tobramycin in eradicating Pseudomonas aeruginosa in children with cystic fibrosis. J. Cyst. Fibros. 2014; 13 (2): 172–178. DOI: 10.1016/j.jcf.2013.09.002.
25. Cohen-Cymberknoh M., Gilead N., Gartner S. et al. Eradication failure of newly acquired Pseudomonas aeruginosa isolates in cystic fibrosis. J. Cyst. Fibros. 2016; 15 (6): 776–782. DOI: 10.1016/j.jcf.2016.04.006.
В статье приводятся данные по эффективности и безопасности применения нового режима комбинированной антибактериальной терапии с использованием раствора тобрамицина для ингаляций 300 мг / 5 мл (ТОБИ), применявшегося 15-дневным курсом у пациентов, страдающих муковисцидозом, в момент обострения бронхолегочного процесса, поступивших в отделение медицинской генетики РДКБ.
Добавление к системным антибиотикам раствора тобрамицина для ингаляций позволило добиться увеличения клинической и бактериологической эффективности терапии бронхолегочного процесса у 23 пациентов.
- КЛЮЧЕВЫЕ СЛОВА: эпидемиология, инфекционные болезни, синегнойная инфекция, муковисцидоз, антибактериальная терапия, антибиотики, клинические исследования
В статье приводятся данные по эффективности и безопасности применения нового режима комбинированной антибактериальной терапии с использованием раствора тобрамицина для ингаляций 300 мг / 5 мл (ТОБИ), применявшегося 15-дневным курсом у пациентов, страдающих муковисцидозом, в момент обострения бронхолегочного процесса, поступивших в отделение медицинской генетики РДКБ.
Добавление к системным антибиотикам раствора тобрамицина для ингаляций позволило добиться увеличения клинической и бактериологической эффективности терапии бронхолегочного процесса у 23 пациентов.
Рис. 2. Зависимость между возрастом инфицирования мукоидным штаммом Р. аeruginosa и показателями 10-летней выживаемости у больных муковисцидозом (адаптировано по [4])
Таблица 3. Спектр микрофлоры бронхиального секрета 23 больных муковисцидозом до начала лечения (n = 39)
В первые годы жизни больного наиболее часто представленным микроорганизмом является Staphylococcus aureus (S. aureus), со временем степень обсемененности мокроты им снижается и начинает превалировать Pseudomonas aeruginosa (рис. 1). При этом показано, что раннее инфицирование Pseudomonas aeruginosa приводит к достоверному снижению выживаемости [4], а дыхательная недостаточность является причиной смерти 90% больных МВ [5, 6] (рис. 2). Долгое время для лечения синегнойной инфекции у пациентов с муковисцидозом применяли комбинации пероральных и внутривенных антибиотиков (АБ) с антисинегнойной активностью: цефалоспоринов III–IV поколения (цефтазидим, цефоперазон, цефепим), фторхинолонов (ципрофлоксацин), карбапенемов (имипенем/циластатин, меропенем) и аминогликозидов (гентамицин, амикацин, тобрамицин). Однако использование таких подходов к антибактериальной терапии не всегда давало возможность эффективно подавлять инфекцию и тем самым поддерживать стабильное состояние больного. По-видимому, это обусловлено тем, что пероральный или внутривенный способы введения не дают возможность создать в мокроте, где у пациента с МВ находится очаг инфекции, нужные для подавления P. aeruginosa концентрации АБ. По этой причине особый интерес представляет появление в арсенале врача тобрамицина раствора для ингаляций 300 мг / 5 мл (ТОБИ). Его применение позволяет создавать в мокроте концентрацию тобрамицина, в 25 раз превышающую минимальную подавляющую концентрацию (МПК) P. aeruginosa [6, 7].
Материалы и методы
Для адекватного анализа была выбрана группа из 23 больных МВ в стадии обострения, в возрасте от 4 до 17 лет, поступивших в отделение в течение 2009 г. (7 мальчиков и 16 девочек). Тяжесть заболевания оценивалась по показателю форсированной жизненной емкости легких (ФЖЕЛ): тяжелое течение заболевания (ФЖЕЛ 70%) – у 16 пациентов. В динамике отслеживались клинические (одышка, характер кашля, состояние мокроты, количество хрипов) и функциональные (ФЖЕЛ, объем форсированного выдоха за первую секунду (ОФВ1)) показатели легких (аппарат Spiro analyzer ST-95). Проводился также краткосрочный бактериологический мониторинг – микробиологическое исследование мокроты (посев на стандартные среды) до назначения АБ и после окончания лечения (14–15-й день).
В соответствии с результатами микробиологического исследования (проводилось пациентам при поступлении в стационар) с учетом чувствительности выделенной флоры всем больным была назначена комбинированная антибактериальная терапия, состоящая из АБ системного действия и раствора тобрамицина для ингаляций (ТОБИ) (табл. 1). Цефтазидим (200–250 мг/кг/сут) и метронидазол (40 мг/кг/сут) вводились внутривенно в 2 инфузии по 30 минут каждая, а ципрофлоксацин в дозе 40 мг/кг/сут – перорально 2 раза в день. Ингаляции раствора тобрамицина 300 мг / 5 мл проводились 2 раза в день после ингаляции муколитиков (дорназа альфа 2,5 мг 1 раз утром и АЦЦ 300 мг 1 раз вечером) и постурального дренажа в течение 15 дней. Микробиологическая эффективность терапии отслеживалась по результатам микробиологического исследования мокроты на момент окончания лечения в стационаре (на 15-й день). Безопасность проводимой антибактериальной терапии отслеживалась с помощью активного мониторинга в отношении раствора тобрамицина для ингаляций. Определялась его возможная ототоксичность – звуковая, вызванная отоакустическая эмиссия на аппарате Echo screen до и после лечения.
В результате проведенного комбинированного антибактериального лечения все 23 пациента были выписаны домой из стационара в состоянии ремиссии. Клинически определялось полное исчезновение кашля и мокроты у больных со среднетяжелым течением заболевания и значительное урежение кашля и скудное количество посветлевшей мокроты у больных с тяжелым течением. В группе пациентов с тяжелым течением оценивались показатели функции внешнего дыхания (ФВД) – ФЖЕЛ и ОФВ1 (до и после лечения), которые свидетельствуют о функциональном состоянии легких. При сравнении этих показателей до и после лечения был обнаружен прирост ФЖЕЛ на 29% и прирост ОФВ1 на 37%, что свидетельствует о значительном улучшении функции легких у этих пациентов в результате проведенной терапии (табл. 2). На следующем этапе мы оценили бактериологическую эффективность проведенной комбинированной терапии. Для этого мы сравнили результаты микробиологического исследования мокроты пациентов до и после лечения (табл. 3, 4). В группе выбранных нами пациентов до лечения преобладающей флорой была Pseudomonas aeruginosa (29 штаммов – 49%) и S. aureus (12 штаммов – 30%). Обращает на себя внимание наличие высокой исходной чувствительности штаммов Pseudomonas aeruginosa к тобрамицину (особенно ее мукоидных форм). По количеству патогенных штаммов у одного пациента группа была распределена на 3 подгруппы: у 9 пациентов (39%) обнаруживали монокультуру Pseudomonas aeruginosa; у 12 пациентов (52%) обнаруживали культуру из двух микробов – Pseudomonas aeruginosa + другой микроб; у 2 пациентов (9%) высевали культуры 3 разных микробов, включая Pseudomonas aeruginosa.
После проведенной терапии микробный пейзаж в посевах изменился: подверглось элиминации 74% штаммов Pseudomonas aeruginosa (из 19 осталось 6 штаммов), 87% штаммов S. aureus, в том числе MRSA (methicillin-resistant Staphylococcus aureus infection – метициллин-устойчивый золотистый стафилококк) (из 15 штаммов осталось 2). Кроме того, необходимо отметить, что 4 из 6 сохранившихся штаммов Pseudomonas aeruginosa обладали необходимой чувствительностью к тобрамицину и, следовательно, можно рассчитывать на их элиминацию при продолжении антибактериальной терапии с участием ингаляционного тобрамицина. Обращает на себя внимание и отсутствие увеличения резистентных штаммов Pseudomonas aeruginosa. Однако даже при появлении этих штаммов возможно преодолеть порог их резистентности и добиться контроля над инфекцией благодаря тому, что раствор тобрамицина для ингаляций 300 мг / 5 мл создает очень высокую (1237 мкг/г) концентрацию действующего вещества в мокроте [10]. Кроме флоры, указанной в таблице 4, у пациентов высевались грибы рода Candida (в 11 случаях) и Aerococcus viridans (у 8 пациентов). Поскольку эти грибы не являются этиологически значимой флорой при муковисцидозе, этот факт представляется нам косвенным показателем успешности антибактериальной терапии. При анализе распределения по пациентам оставшихся после лечения штаммов оказалось, что у 17 человек (74%) высева в мокроте обнаружено не было, монокультура высевалась у 4 пациентов (17%), дикультура – у 1 пациента (0,04%) и трикультура – у 2 пациентов (8,96%). В микробиологических анализах мокроты пациентов после лечения были также обнаружены штаммы другой грамотрицательной флоры – Stenotrophomonas maltophilia и B. cepacia complex, что, вероятно, связано с перезаселением легких другими микроорганизмами.
Степень участия ингаляционного тобрамицина в успехе антибактериальной терапии можно условно вычислить, сравнив полученные в ходе настоящего исследования данные с результатами наших предыдущих исследований эффективности применения антибактериальной терапии при лечении синегнойной инфекции системными АБ, но без раствора тобрамицина для ингаляций [11, 12, 13, 14]. Наши работы 2002–2003 гг. показывают, что антисинегнойный эффект комбинации внутривенных и пероральных АБ позволял достичь чистого высева только у 40% пациентов в конце лечения, продолжавшегося в течение 15–21 дня. Таким образом, добавочный эффект раствора тобрамицина для ингаляций 300 мг / 5 мл составляет более 30%, поскольку именно при добавлении к терапии данного препарата чистый высев был достигнут у 74% пациентов. Безопасность раствора тобрамицина для ингаляций 300 мг / 5 мл отслеживалась прежде всего с точки зрения возможной ототоксичности. Как показали выборочные исследования аудиометрии у 11 больных, никаких дополнительных изменений слуха применение ингаляционного тобрамицина не вызвало. Среди незначительных побочных реакций можно назвать першение в горле (у 2 пациентов) и легкую бронхоспастическую реакцию – у одного больного, которая послужила причиной отмены препарата.
В процессе лечения 23 пациентов с МВ в стадии обострения был использован новый режим комбинированной антибактериальной терапии, включающий новый компонент – раствор тобрамицина для ингаляций 300 мг / 5 мл (ТОБИ). Новый режим терапии позволил выписать всех пациентов на 15-й день лечения в состоянии ремиссии. Использование нового режима терапии позволило значительно улучшить функцию легких в группе пациентов тяжелого течения с увеличением показателей ФЖЕЛ на 29% и ОФВ1 на 37%. При оценке бактериологической эффективности данного режима терапии, прежде всего против основных патогенов МВ – Pseudomonas aeruginosa (особенно его мукоидных форм) и S. aureus (в том числе MRSA), была обнаружена элиминация 74% штаммов Pseudomonas aeruginosa и 87% штаммов S. aureus, в том числе MRSA. При этом у 74% пациентов был обнаружен чистый высев в конце курса терапии, что более чем на 30% превышает результаты предыдущих лет при использовании комбинированной антибактериальной терапии с применением только системных АБ. Это доказывает высокую эффективность раствора тобрамицина для ингаляций и необходимость его введения в состав комбинированной терапии хронической легочной синегнойной инфекции даже в стационаре. Применение тобрамицина раствора для ингаляций 300 мг / 5 мл является безопасным и не сопровождается серьезными побочными эффектами.
МКБ-10
B96.5 Pseudomonas (aeruginosa) (mallei) (pseudomallei) как причина болезней, классифицированных в других рубриках
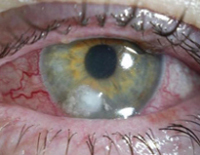
Общие сведения
Синегнойная инфекция впервые была описана в 1850 году французским хирургом Седилем. В 1882-м французскому военному фармацевту Жессару удалось выделить чистую культуру возбудителя, а в 1916 году стала известна эпидемиология данного заболевания. Болезнь распространена повсеместно, бактерий обнаруживают в почве, воде и на растениях. Четкая сезонность отсутствует. В стационарах излюбленной локализацией считается физиотерапевтическое и реанимационное оборудование. Группами риска являются недоношенные новорожденные, дети до 3-х месяцев, пожилые, пациенты отделений гемодиализа, химиотерапии, нейрохирургии и реанимации, больные с муковисцидозом и иммуносупрессией.

Причины
Возбудитель заболевания – синегнойная палочка (Pseudomonas aeruginosa) и её штаммы, представляет собой условно-патогенный микроорганизм, способный вызывать поражение только при отсутствии адекватного ответа иммунной системы. Источником инфекции служат больные люди и животные, бактерионосители, преимущественная локализация микроорганизма – кожа, кишечник. Заражение происходит воздушно-капельным и пищевым путем. Путь инфицирования при госпитальном заражении чаще контактный – через нестерильный инструментарий, руки медицинского персонала и предметы ухода за больными. Бактерия погибает при кипячении, во время автоклавирования, а также при воздействии 3% перекиси водорода и хлорсодержащих дезинфектантов.
Патогенез
При попадании микробов на поврежденную кожу или слизистую оболочку возникает массивная деструкция тканей, обусловленная воздействием экзотоксинов и продуцируемых бактериями веществ. В норме слизистая организма способна нивелировать воздействие синегнойной палочки ввиду мукоцилиарного клиренса и механического барьера. Привлечение нейтрофилов и активный фагоцитоз усиливают образование множества антибактериальных цитокинов, ферментов и свободных радикалов, служат активаторами системы комплемента и других звеньев гуморального иммунитета.
От 33 до 83% штаммов синегнойной палочки имеют эволюционно обусловленный механизм защиты от иммунной системы – образование биопленок, состоящих из скопления пораженных клеток и внеклеточного матрикса, включающего фибрин, секреторное отделяемое слизистых, альгинат, полисахариды и липиды. Известно, что бактерии лизируют нейтрофилы, усиливая рост собственных биопленок.
Классификация
Поражения, вызываемые синегнойной палочкой, можно условно разделить на местные и генерализованные (септические). Некоторые виды, в том числе инфекции ЦНС, сердца и средостения развиваются вследствие диссеминации возбудителя. В зависимости от топологии воспалительного очага различают следующие формы синегнойной инфекции:
- Инфекция респираторного тракта. Пациенты, находящиеся на длительной искусственной вентиляции легких, в 30% случаев переносят трахеобронхит и в 24% – пневмонию синегнойной этиологии.
- Инфекция ЛОР-органов. Синуситы развивается редко, при этом до 40% хронических средних отитов приходится на долю синегнойной палочки.
- Инфекция ЖКТ. Проявляется в виде тяжелой диареи, нередко с летальным исходом среди детей до года. С возбудителем связывают около 16% послеоперационных перитонитов.
- Инфекция глаз. Связана с длительным применением контаминированных контактных линз и глазных капель, часто приводит к панофтальмиту.
- Инфекция мочевой системы. Наиболее вероятно развитие катетер-ассоциированного острого пиелонефрита. С данным возбудителем связывают до 13% случаев острого простатита.
- Инфекция кожи. Возникает после пребывания в бассейне со сниженной концентрацией дезинфицирующих средств, может поражать ногти, подкожную клетчатку, мышечные фасции с формированием некрозов.
- Раневая инфекция. Составляет до 10% всех боевых инфекционных осложнений, становится причиной около 30% гнойных процессов при ожоговой болезни. Считается поддерживающим фактором формирования трофических язв.
Симптомы синегнойной инфекции
Инкубационный период патологии крайне вариабелен, может составлять от нескольких суток до десятилетий, поскольку микроорганизм является одним из условно-патогенных компонентов микрофлоры человека. Клинические проявления зависят от пораженного органа. У взрослых при инвазии пищеварительного тракта первыми симптомами являются лихорадка (не более 38,5° C), снижение аппетита, озноб, слабость, тошнота, реже рвота, вздутие и болезненность живота, частый кашицеобразный стул с кровью и слизью.
Маленькие дети при поражении ЖКТ становятся вялыми, сонливыми, отказываются от еды и питья, срыгивают, гастроэнтероколит протекает с высоким риском кишечного кровотечения. Синегнойная патология ЛОР-органов проявляется лихорадкой 37,5° C и выше, резкой болью в ухе, снижением слуха, желто-зеленым обильным отделяемым, иногда с примесью крови. Поражение дыхательного тракта протекает в форме пневмонии – с повышением температуры тела более 38° C, нарастающей одышкой, кашлем с обильной слизисто-гнойной мокротой.
Псевдомонадная инфекция мочевыводящей системы характеризуется лихорадкой, болями в пояснице, частыми болезненными мочеиспусканиями, чувством неполного опорожнения мочевого пузыря, изменением цвета и запаха мочи. Глазные симптомы инвазии синегнойной палочки чаще выявляются в области одного глазного яблока, начинаются с появления рези, болей, чувства жжения, инородного тела, слезотечения, светобоязни и слизисто-гнойного обильного отделяемого. В дальнейшем может возникать снижение и помутнение зрения.
Поражение кожи проявляется высыпаниями в виде пятен и гнойничковых элементов по всему телу, включая сыпь на ладонях, подошвах и в носоглотке, увеличением лимфоузлов, постоянными головными болями (так называемая головная боль пловцов), зеленой окраской одной, реже двух ногтевых пластин, образованием болезненных уплотнений в подкожно-жировой клетчатке. Раневая инфекция возбудителя сопровождается появлением сине-зеленого гнойного отделяемого и гнойно-геморрагических корочек, увеличением зоны покраснения вокруг раны.
Осложнения
Мультисистемность и клиническое разнообразие симптомов синегнойной инфекции отражается на количестве осложнений данного состояния. К наиболее частым негативным последствиям относят генерализацию инфекционного процесса, инфекционно-токсический шок, у грудных детей – некротический колит. Высока вероятность абсцедирования и гангренозных изменений. Вялотекущее течение инфекции на слизистых уха, ротоглотки, носа, конъюнктивы и легких приводит к хронизации воспалительного процесса, формированию мезотимпанита, бронхоэктазов, ползучей язвы роговицы, частичной или полной глухоты, односторонней слепоты.
Диагностика
Диагноз выставляется на основании данных, полученных в ходе консультации инфекциониста. При возникновении обширных гнойных поражений обязательна консультация хирурга, по показаниям приглашаются другие профильные специалисты. Наиболее распространенными диагностическими методами подтверждения псевдомонадной этиологии болезни являются следующие инструментальные и лабораторные исследования:
- Физикальное обследование. При объективном осмотре обращают внимание на цвет раневого отделяемого, наличие сыпи. Поражение наружного уха, глаз проявляется гиперемией, обильным слизисто-гнойным отделяемым. В легких при пневмонии выслушивается ослабление дыхания, при перкуссии – притупление звука. В случае гастроэнтероколита обнаруживается болезненность по ходу кишечника, урчание; обязательно проводится визуальная оценка испражнений.
- Лабораторные исследования. Общеклинический анализ крови свидетельствует о наличии лейкоцитоза, палочкоядерного сдвига влево, ускорения СОЭ. В биохимических параметрах наблюдается увеличение АЛТ, АСТ, СРБ, снижение общего белка, гипоальбуминемия. В общем анализе мочи возможна протеинурия, гематурия. Анализ мокроты подтверждает большое число бактерий и лейкоцитов. В ликворограмме при поражениях головного мозга выявляется нейтрофильный плеоцитоз, клеточно-белковая диссоциация.
- Выявление инфекционных агентов. Золотым стандартом является бактериологическое исследование, осуществляемое в современных условиях методом масс-спектрометрии с обязательным определением антибактериальной чувствительности бактерии. Обнаружение возбудителя возможно с помощью ПЦР биологического материала из патологического очага. Серологическая диагностика (ИФА) выполняется неоднократно с промежутком не менее 10-14 суток для детекции роста титра антител.
- Инструментальные методики. Рентгенография органов грудной клетки, реже МРТ или КТ проводится с целью верификации легочных поражений, дифференциального диагноза. УЗИ органов брюшной полости, мочеполовой системы, мягких тканей, костей и забрюшинного пространства позволяет установить первичный очаг воспаления. Эхо-КГ показана при подозрении на инфекционный эндокардит. Колоноскопия, ФГДС назначаются с целью исключения новообразований пищеварительного тракта.
Дифференциальная диагностика синегнойной инфекции сложна ввиду многообразия клинических форм болезни. Наиболее распространенные поражения желудочно-кишечной системы дифференцируют с сальмонеллезом, шигеллезом и псевдомембранозным колитом. Кожные проявления отличают от гнойно-некротических поражений стрептококковой и стафилококковой этиологии. Инфекции дыхательной системы могут напоминать казеозную пневмонию при туберкулезе, саркоидоз, бактериальные воспаления легких. Причинами сепсиса могут быть различные вирусы, бактерии и грибы.
Лечение синегнойной инфекции
Стационарное лечение рекомендуется пациентам с органными поражениями, среднетяжелым и тяжелым течением болезни. Больные с нозокомиальной синегнойной инфекцией продолжают лечение в том отделении, где находились до манифестации инфекционного процесса, с обязательным проведением всех противоэпидемических мероприятий и санацией аппаратуры. Постельный режим необходим до устойчивого купирования лихорадки в течение 3-5 дней, его продолжительность зависит от степени инвазии, наличия осложнений и декомпенсации сопутствующих болезней. Специальная диета не разработана, рекомендован прием пищи с достаточным количеством белка, адекватный питьевой режим.
Средствами борьбы с инфекцией считаются гипериммунная антисинегнойная донорская плазма и противосинегнойный гамма-глобулин, Перечисленные препараты применяются реже в связи с возможным развитием сывороточной болезни, показаны при вялотекущем воспалительном процессе. Симптоматическое лечение включает дезинтоксикационную терапию, противовоспалительные и жаропонижающие средства. Хирургическое вмешательство необходимо при локализованных и разлитых гнойных процессах, заключается во вскрытии и дренировании гнойников, реже – ампутации конечности. Допускается местное применение раствора перекиси водорода, мазей с антибиотиками.
Прогноз и профилактика
Специфическая профилактика (поливалентная вакцина) показана медицинским работникам, ожоговым больным, пациентам с открытыми переломами и глубокими ранами, лицам с иммунным дефицитом, людям старческого возраста. Неспецифические меры сводятся к строгому соблюдению правил обработки медицинских инструментов и оборудования, контролю контаминации синегнойной палочкой персонала. Важны общеукрепляющие методы – закаливание, нормальный сон, полноценная еда, прогулки, физическая активность, неукоснительное соблюдение личной гигиены и своевременная санация гнойных очагов.
1. Pseudomonas aeruginosa: патогенность, патогенез и патология / Лазарева А.В., Чеботарь И.В.// Клиническая микробиология и антимикробная химиотерапия – 2015 – Т.17, №3.
3. Эпидемиология и профилактика синегнойной инфекции. Федеральные клинические рекомендации / Егорова О.Н., Брусина Е.Б. и др. – 2014.
Муковисцидоз легких - клинический вариант системного муковисцидоза, протекающий с преимущественным поражением слизепродуцирующих желез респираторного тракта. Для легочного муковисцидоза типичен приступообразный кашель с вязкой мокротой, приступы удушья, одышка, рецидивирующие бронхопневмонии. По мере прогрессирования патологии у больных формируется дыхательная недостаточность и легочное сердце. Для оценки изменений в легких при муковисцидозе проводятся рентгенологические и эндоскопические исследования, спирометрия. Лечение муковисцидоза легких симптоматическое: муколитики, ингаляции, ЛФК, массаж, санационные бронхоскопии.
МКБ-10
Общие сведения
Муковисцидоз легких – респираторная (легочная) форма муковисцидоза, характеризующаяся гиперпродукцией мокроты, развитием бронхообструктивного синдрома, хронических бронхолегочных инфекций и вторичных изменений (бронхоэктазов, эмфиземы легких, пневмосклероза, сердечно-легочной недостаточности). Муковисцидоз относится к наследственной патологии и встречается примерно у 1-4 на 10 тыс. новорожденных. Заболевание может протекать в четырех клинических вариантах: кишечном, легочном, смешанном (легочно-кишечном) и в форме мекониевого илеуса новорожденных. В чистом виде легочная форма муковисцидоза встречается примерно у 15-20% пациентов, однако в той или иной степени поражение легких при муковисцидозе происходит в 95% наблюдений. Исходя из этого, муковисцидоз является междисциплинарной медицинской проблемой, находящейся на стыке генетики, педиатрии, пульмонологии, гастроэнтерологии.
Причины муковисцидоза легких
Муковисцидоз легких у ребенка может возникнуть в том случае, если оба родителя являются гетерозиготными носителями мутировавшего гена - вероятность заболевания в этом случае составляет 25%. Носители гена муковисцидоза фенотипически здоровы и в подавляющем большинстве случаев не подозревают об отягощенной наследственности до тех пор, пока у них не родится ребенок с данным заболеванием.
Патогенез муковисцидоза легких связан с невозможностью дефектного белка МВТР выполнять свою функцию хлоридного канала и, как следствие, нарушением водно-электролитного обмена в эпителиальных клетках бронхов. В клетках начинают накапливаться ионы хлора, вследствие чего меняется их электрический потенциал и внутрь клеток устремляются ионы натрия. Эти процессы сопровождаются усиленным всасыванием воды из межклеточного пространства, резким повышением вязкости бронхиального секрета и затруднением его эвакуации.
Дальнейшее прогрессирование муковисцидоза легких обусловлено обтурацией мелких бронхиол, развитием хронических воспалительных изменений в стенках бронхов. В условиях сопутствующего уменьшения продукции IgА и интерферона, а также фагоцитарной активности лейкоцитов снижается противовирусный иммунитет и местная противомикробная защита. На этом фоне быстро изменяется микробный пейзаж бронхов – в нем начинают преобладать стафилококки, а потом и синегнойная палочка. Развивается эндобронхит и панбронхит, что в дальнейшем приводит к формированию бронхоэктазов, деструкции легочной паренхимы, нарастанию гипоксемии и легочной гипертензии.
Симптомы муковисцидоза легких
Признаки респираторного муковисцидоза обычно становятся заметны уже в грудном возрасте. Наличие в анамнезе сведений о мекониевом илеусе периода новорожденности облегчает своевременное распознавание муковисцидоза легких у детей.
Типичные клинические проявления муковисцидоза легких обусловлены гиперсекрецией бронхиальной слизи, обструктивным синдромом и присоединением вторичной инфекции. Ранним признаком служит мучительный кашель, возникающий приступообразно и напоминающий кашель при коклюше. Кашлевой пароксизм может сопровождаться рвотой и приступами удушья. Мокрота откашливается с большим трудом, имеет вязкий, слизистый или слизисто-гнойный характер.
В более старшем возрасте типичны жалобы на одышку при незначительных нагрузках или в покое. В медицинской карте детей с муковисцидозом легких можно встретить указания на частые обострения хронического гнойного или обструктивного бронхита, рецидивирующие пневмонии (в т. ч. абсцедирующие), гайморит, полипы носа, бронхиальную астму. Дети с муковисцидозом легких гипотрофичны, отстают в физическом развитии, вынуждены ограничивать себя в физической активности.
Течение легочной формы муковисцидоза проходит четыре стадии. Первая стадия, длительность которой может составлять до 10 лет, характеризуется периодическим сухим кашлем и одышкой, возникающей при напряжении. На второй стадии муковисцидоза легких прогрессирует поражение бронхов, развивается клиника хронического бронхита со свойственным ему влажным кашлем, усилением одышки. Продолжительность течения этой стадии сожжет варьировать от 2 до 15 лет. Переход к третьей стадии знаменует развитие вторичных изменений: бронхоэктазов, пневмофиброза, дыхательной и сердечной недостаточности; длительность данного периода – 3-5 лет. В четвертой, терминальной стадии муковисцидоза легких за считанные месяцы наступает декомпенсация сердечно-легочной недостаточности с летальным исходом.
Диагностика
Признанным стандартом диагностики является так называемая потовая проба Гибсона и Кука (ионофорез с пилокарпином), позволяющая определить концентрацию ионов хлора и натрия в потовой жидкости (при муковисцидозе уровень хлоридов повышен в 2 - 5 раз).
Аускультативные данные при муковисцидозе легких обычно соответствуют картине обструктивного бронхита. Степень поражения бронхолегочной системы удается оценить, используя рентгенологические и эндоскопические методы визуализации. С помощью рентгенографии легких выявляется усиление легочного рисунка и его тяжистый характер, ателектазы легких, повышение прозрачности легочных полей, ограничение подвижности купола диафрагмы и т. д.
Диагностическая бронхоскопия при муковисцидозе легких выявляет картину диффузного гнойного эндобронхита: наличие густого, вязкого секрета в просвете бронхов, нередко в виде гнойных пробок. При бронхографии обнаруживаются цилиндрические или смешанные бронхоэктазы. По данным спирометрии диагностируются нарушения по обструктивно-рестриктивному типу (снижение индекса Тиффно, ОФВ1 и т. д.); в поздних стадиях – снижение ЖЁЛ.
Лечение муковисцидоза легких
Лечение легочной формы муковисцидоза включает общережимные мероприятия и симптоматическую терапию. Питание больных должно быть калорийным, богатым поливитаминами, микроэлементами, белком. Составной частью лечения пациента с муковисцидозом легких становится кинезитерапия: используется специальная дыхательная гимнастика, постуральный дренаж, перкуссионный и вибрационный массаж грудной клетки, помогающие освободить бронхи от скопления густого и вязкого секрета.
На разжижение мокроты направлена муколитическая терапия: ингаляции с дорназа альфа, ферментами, гипертоническим раствором, кортикостероидами; введение ацетилцистеина, амброксолгидрохлорида и др. Проводятся процедуры бронхиального лаважа с эндобронхиальным введением муколитиков. При муковисцидозе легких категорически противопоказаны кодеинсодержащие препараты.
Антибактериальная терапия назначается при первых признаках легочной инфекции. Выбор препарата основывается на результатах посева мокроты и антибиотикограммы; чаще всего выбор падает на аминогликозиды, цефалоспорины, азитромицин, кларитромицин и др. Для купирования обострения применяется физиотерапия (электрофорез, УВЧ, СВЧ-терапия), ЛФК. В терминальных стадиях больным муковисцидозом может производиться трансплантация легких или комплекса сердце-легкие.
Прогноз
Пациенты с муковисцидозом легких нуждаются в пожизненном наблюдении сначала педиатра и детского пульмонолога, затем – терапевта и взрослого пульмонолога, соблюдении рекомендуемой диеты и образа жизни, прохождении специальных курсов лечения. Прогноз муковисцидоза легких остается неблагоприятным, несмотря на значительные достижения в вопросе ранней диагностики и терапии заболевания. В настоящее время средняя продолжительность жизни пациентов составляет около 30 лет. Супругам, в семье которых есть больные муковисцидозом, необходима консультация генетика для прогнозирования вероятности рождения ребенка с патологией.
1. Кистозный фиброз (муковисцидоз): микробиологическая диагностика хронической респираторной инфекции: Клинические рекомендации/ Министерство Здравоохранения РФ. – 2018.
2. Муковисцидоз: генетика, клиника, патогенез, диагностика, лечение, профилактика: Методическое пособие/ Вахарловский В.Г., Гембицкая Т.Е., Двораковская И.В. и др.
3. Муковисцидоз (современные достижения и проблемы): Метод. рекомендации/ Капранов Н.И., Шабалова Л.А., Каширская Н.Ю. и др. – 2001.
4. Муковисцидоз: современный подход к диагностике и лечению/ Амелина Е.Л. , Чучалин А.Г. // Русский медицинский журнал. – 1997 - №17.
Читайте также:

