Лекарство для лечения бронхита туберкулеза
Обновлено: 25.04.2024
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению? Какова роль фторхинолонов в лечении туберкулеза легких?
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению?
Какова роль фторхинолонов в лечении туберкулеза легких?
Таблица. Стандартные концентрации ПТП, используемые для выявления лекарственной устойчивости МБТ
Первый этап характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью ПТП в течение 2-3 месяцев, что ведет к подавлению размножающейся микобактериальной популяции, уменьшению ее количества и предотвращению развития лекарственной резистентности. На первом этапе используется комбинация препаратов, состоящая из изониазида, рифампицина, пиразинамида, стрептомицина и/или этамбутола.
Второй этап — менее интенсивной химиотерапии — проводится, как правило, двумя-тремя ПТП. Цель второго этапа — воздействие на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. Здесь главной задачей является предупреждение размножения оставшихся микобактерий, а также стимуляция репаративных процессов в легких с помощью различных патогенетических средств и методов лечения.
Такой методический подход к лечению ЛЧТЛ позволяет к концу первого этапа комбинированной химиотерапии под непосредственным медицинским наблюдением абациллировать 100%, а к завершению всего курса лечения — закрыть каверны в легких у более чем 80% больных с впервые выявленным и рецидивным туберкулезом легких [5].
Намного сложнее вопрос о проведении этиотропного лечения второго варианта, к которому мы относим ЛУТЛ, вызванный лекарственно резистентными (ЛР) МБТ к одному и более ПТП и/или их сочетанию. Особенно тяжело протекает ЛУТЛ у больных с множественной ЛР МБТ к изониазиду и рифампицину, то есть к основным и самым эффективным ПТП. Поэтому поиск новых концептуальных путей повышения эффективности лечения ЛУТЛ и разработка современной методологии специфического воздействия на ЛР МБТ является одним из важнейших и приоритетных направлений современной фтизиатрии.
Развитие ЛР у МБТ к ПТП — одна из главных причин недостаточно эффективной этиотропной химиотерапии. Больные туберкулезом, выделяющие ЛР-штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих ЛР-возбудителем. Чем больше число больных, выделяющих ЛР МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной резистентностью не только к основным, но и к резервным ПТП.
Феномен ЛР МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является ЛР. В активно размножающейся бактериальной популяции всегда имеется небольшое количество ЛР-мутантов, которые практического значения не имеют, но по мере уменьшения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством ЛР и устойчивых МБТ [5]. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. Следовательно, в клинической практике необходимо исследовать ЛР МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких [5].
По определению экспертов ВОЗ [3], ЛУТЛ — это случай туберкулеза легких с выделением МБТ, резистентных к одному и более ПТП. По данным Центрального НИИ туберкулеза РАМН, у каждого второго впервые выявленного и ранее не леченного противотуберкулезными препаратами больного в мокроте выявлялись ЛР к ПТП МБТ, при этом у 27,7% из них наблюдалась устойчивость к двум основным противотуберкулезным препаратам — изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота вторичной ЛР МБТ возрастает до 95,5%.
По нашему мнению, и это составляет основу нашей концепции, для повышения эффективности лечения туберкулеза, вызванного ЛР МБТ, необходимо в первую очередь использовать ускоренные методы выявления ЛР МБТ, что позволяет своевременно изменять режим химиотерапии.
Исследование лекарственной устойчивости МБТ в настоящее время возможно по прямому и непрямому методам.
Непрямой метод определения лекарственной чувствительности МБТ требует от 30 до 60, а иногда до 90 суток, ввиду того что вначале производится посев мокроты на твердые питательные среды и только после получения культуры МБТ производят ее пересев уже на среды с добавлением ПТП. При этом коррекция химиотерапии носит отсроченный характер, как правило, уже на конечном этапе интенсивной фазы химиотерапии.
В последнее время для ускоренного определения лекарственной устойчивости нами применялся радиометрический метод с использованием автоматической системы ВАСТЕС-460 ТВ (Becton Dickinson Diagnostic Systems, Sparks, MD), которая позволяет выявлять лекарственную резистентность МБТ на жидкой среде Middlebrook 7H10 через 6-8 дней.
Не менее важно правильное лечение впервые выявленных больных туберкулезом легких и применение современных режимов химиотерапии с использованием в начале лечения комбинации из четырех-пяти основных противотуберкулезных препаратов до получения результатов лекарственной устойчивости МБТ [2]. В этих случаях существенно повышается вероятность того, что даже при наличии первичной ЛР МБТ бактериостатическое действие окажут два или три химиопрепарата, к которым чувствительность сохранена. Именно несоблюдение фтизиатрами научно обоснованных комбинированных режимов химиотерапии при лечении впервые выявленных и рецидивных больных и назначение ими только трех ПТП является грубой врачебной ошибкой, что в конечном счете ведет к формированию наиболее трудно поддающейся лечению вторичной ЛР МБТ.
Наличие у больного туберкулезом легких ЛР МБТ существенно снижает эффективность лечения, приводит к появлению хронических и неизлечимых форм, а в ряде случаев и летальных исходов. Особенно тяжело протекают специфические поражения легких у больных с полирезистентными МБТ, которые обладают множественной ЛР, как минимум к изониазиду и рифампицину, т. е. к основным и самым активным противотуберкулезным препаратам. ЛР МБТ имеет не только чисто клиническое и эпидемиологическое, но и экономическое значение, так как лечение таких больных резервными ПТП обходится намного дороже, чем больных с чувствительными МБТ к основным химиопрепаратам.
В этих условиях расширение списка резервных ПТП, воздействующих на ЛР МБТ, является актуальным и крайне важным для повышения эффективности лечения больных с ЛУТЛ. Кроме того, присоединение к ЛУТЛ неспецифической бронхолегочной инфекции существенным образом утяжеляет течение специфического процесса в легких, требуя назначения дополнительных антибиотиков широкого спектра. В этом плане применение антибиотиков, воздействующих как на МБТ, так и на неспецифическую патогенную бронхолегочную микрофлору, является научнообоснованным и целесообразным.
В этом плане хорошо себя зарекомендовал в России такой препарат из группы фторхинолонов, как офлоксацин (таривид) [3]. Мы же свой выбор остановили на ломефлоксацине, как препарате, который еще не столь широко применяется при лечении туберкулеза и у которого, судя по имеющимся данным, практически не выявляются побочные эффекты и крайне редко формируется ЛР возбудителей инфекционных заболеваний [2].
Ломефлоксацин (максаквин) — антибактериальный препарат из группы фторхинолонов. Как и все представители производных оксихинолонкарбоновой кислоты, максаквин обладает высокой активностью против грамположительных (включая метициллин-устойчивые штаммы Staphylococcus aureus и Staphylococcus epidermidis) и грамотрицательных (включая Pseudomonas) микроорганизмов, в том числе по отношению к различным типам Micobacterium tuberculosis).
Механизм действия максаквина заключается в ингибировании хромосомной и плазмидной ДНК-гиразы, фермента, ответственного за стабильность пространственной структуры микробной ДНК. Вызывая деспирилизацию ДНК микробной клетки, максаквин ведет к гибели последней.
Максаквин обладает иным механизмом действия, нежели другие антибактериальные средства, поэтому к нему не существует перекрестной устойчивости с другими антибиотиками и химиотерапевтическими препаратами [2].
Основной целью настоящего исследования явилось изучение клинической и микробиологической эффективности максаквина при комплексном лечении больных деструктивным ЛУТЛ, выделяющих ЛР МБТ к изониазиду, рифампицину и другим ПТП, а также при сочетании туберкулеза с неспецифической бронхолегочной инфекцией.
Под наблюдением находилось 50 больных деструктивным ЛУТЛ, выделяющих с мокротой ЛР МБТ к изониазиду, рифампицину и ряду других ПТП. Эти люди в возрасте от 20 до 60 лет составили основную группу.
В контрольную группу вошли также 50 больных деструктивным ЛУТЛ легких в той же возрастной группе, выделяющие ЛР МБТ к изониазиду, рифампицину и другим ПТП. Эти пациенты лечились только протионамидом, амикацином, пиразинамидом и этамбутолом.
У 47 больных основной группы и 49 контрольной в мокроте микробиологическими методами были выявлены различные возбудители неспецифической бронхолегочной инфекции.
Среди больных основной группы диссеминированный туберкулез был установлен у 5 человек, инфильтративный — у 12, казеозная пневмония — у 7, кавернозный — у 7 и фиброзно-кавернозный туберкулез — у 17 человек. Большинство больных (45 пациентов) имели распространенный туберкулез легких с поражением более двух долей, у 34 больных был двусторонний процесс. У всех больных основной группы в мокроте были обнаружены МБТ, как методом микроскопии по Цилю — Нильсену, так и методом посева на питательные среды. При этом у них МБТ были устойчивы как минимум к изониазиду и рифампицину. Необходимо отметить, что все пациенты уже ранее неоднократно и неэффективно лечились основными ПТП, и специфический процесс у них приобрел рецидивирующий и хронический характер.
В клинической картине преобладали симптомы интоксикации с высокой температурой тела, потливостью, адинамией, изменениями в крови воспалительного характера, лимфопенией, увеличенной СОЭ до 40-50 мм в час. Следует отметить наличие грудных проявлений болезни — кашель с выделением мокроты, подчас значительного количества, слизисто-гнойной, а у половины больных — гнойной, с неприятным запахом. В легких выслушивались обильные катаральные явления по типу мелко-, средне-, а подчас и крупнопузырчатых влажных хрипов.
У большинства больных преобладали клинические проявления, которые скорее укладывались в картину неспецифического бронхолегочного поражения (бронхита, острой пневмонии, абсцедирования) с частыми и практически не стихающими обострениями.
Основным возбудителем неспецифической инфекции был Streptococcus hemoliticus — у 15,3% и Staphilococcus aureus — у 15% больных. Среди грамотрицательной микрофлоры преобладал Enterobacter cloacae в 7,6% случаев. Следует отметить высокую частоту ассоциации возбудителей неспецифической бронхолегочной инфекции.
МБТ были обнаружены у всех 50 больных. У 42 человек определялось обильное бактериовыделение. У всех пациентов выделенные штаммы МБТ были устойчивы к изониазиду и рифампицину. При этом у 31 больного лекарственная устойчивость МБТ к изониазиду и рифампицину сочеталась с другими ПТП.
Определение минимальной ингибирующей концентрации (МИК) максаквина проводили на лабораторных штаммах H37Rv и Academia, а также клинических штаммах (изолятах), выделенных от 30 больных, из которых 12 изолятов были чувствительны ко всем основным химиопрепаратам и 8 обладали резистентностью к изониазиду, рифампицину и стрептомицину. В опытах in vitro подавление роста лабораторных штаммов МБТ наблюдалось в зоне 57,6±0,04 до 61,8±0,02 мкн/мл, что почти в семь раз больше, чем показатели, характерные для остальных ПТП .
Таким образом, в ходе микробиологических исследований было установлено выраженное бактериологическое действие максаквина на МБТ, при этом более выраженный эффект наблюдался при его воздействии на лекарственно чувствительные штаммы и изоляты. Однако при повышенных концентрациях максаквина эффект также заметен при воздействии на полирезистентные МБТ, устойчивые к основным ППТ.
Лечение максаквином проводилось у всех 50 больных основной группы в разработанной нами комбинации с другими резервными препаратами: протионамидом, амикацином, пиразинамидом и этамбутолом.
Максаквин назначали в дозе 800 мг в сутки перорально однократно в утренние часы сразу вместе с другими противотуберкулезными препаратами для создания максимальной суммарной бактериостатической концентрации в крови и очагах поражения. Доза максаквина выбрана с учетом микробиологических исследований и соответствовала МИК, при которой отмечалось существенное подавление роста МБТ. Терапевтический эффект определяли через месяц — для оценки воздействия его на неспецифическую патогенную бронхолегочную микрофлору и через два месяца — для оценки воздействия на полирезистентные МБТ. Длительность курса лечения резервными химиопрепаратами в сочетании с максаквином составляла два месяца.
Через месяц комплексного лечения было отмечено значительное улучшение состояния больных основной группы, что проявлялось в уменьшении количества мокроты, кашля и катаральных явлений в легких, снижении температуры тела, при этом более чем у двух третей больных — до нормальных цифр.
У всех больных к этому сроку в мокроте перестал определяться рост вторичной патогенной бронхолегочной микрофлоры. К тому же у 34 больных значительно уменьшилась массивность выделения микобактерий туберкулеза. Практически у всех больных нормализовались анализы крови.
Следует отметить, что у 28 пациентов рентгенологически через месяц лечения максаквином в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом отмечалось частичное рассасывание специфических инфильтративных изменений в легких, а также существенное уменьшение перикавитарной воспалительной реакции. Это позволило применить на данном этапе искусственный пневмоторакс, который является обязательным методом в лечении ЛУТЛ и составляет вторую и не менее важную часть нашей концепции повышения эффективности лечения больных деструктивным туберкулезом легких, выделяющих полилекарственнорезистентные МБТ.
При анализе эффективности специфического действия комбинации резервных противотуберкулезных препаратов в сочетании с максаквином на полирезистентные МБТ при лечении 50 больных основной группы мы делали основной акцент на показатель прекращения бактериовыделения, как по микроскопии мокроты по Цилю — Нильсену, так и по посеву на питательные среды через два месяца после химиотерапии.
Анализ частоты прекращения бактериовыделения у больных основной и контрольной группы через два месяца лечения показал, что у пациентов, получавших максаквин в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом, прекращение бактериовыделения было достигнуто в 56% случаях. В контрольной группе больных, не получавших максаквина, — только в 30% случаев.
Следует отметить, что у остальных больных основной группы за этот период времени существенно уменьшилась массивность выделения МБТ.
Инволюция локальных изменений в легких у 50 больных контрольной группы также шла более замедленными темпами, и только у 25 больных к концу второго месяца удалось достичь частичного рассасывания перикавитарной инфильтрации и применить к ним искусственный пневмоторакс. К 39 из 50 пациентов основной группы был применен искусственный пневмоторакс в течение 1,5-2 месяцев, и 17 из них удалось достигнуть закрытия каверн в легких. 11 оставшихся больных, имеющих противопоказания к проведению искусственного пневмоторакса, в этот период были подготовлены к плановому оперативному вмешательству.
При определении лекарственной устойчивости МБТ к максаквину через два месяца лечения у больных основной группы только в 4% случаев была получена вторичная лекарственная устойчивость, сформировавшаяся в процессе двухмесячной химиотерапии, что в конечном итоге потребовало его отмены и замены на другой химиопрепарат, к которому МБТ сохранили свою чувствительность.
К концу второго месяца у 4% больных отмечались явления непереносимости максаквина — в виде диспепсических явлений и диареи, связанной с дисбактериозом, аллергических кожных проявлений и эозинофилии до 32%, что привело к полной отмене препарата. Во всех остальных случаях при двухмесячном ежедневном применении максаквина в суточной дозе 800 мг побочных явлений не отмечалось.
Проведенная после окончания курса лечения максаквином комбинированная химиотерапия резервными препаратами и динамическое наблюдение за этими же больными показали, что достигнутый ко второму месяцу положительный результат в абациллировании мокроты оказал положительное влияние и на конечный результат излечения больных с ЛУТЛ.
Таким образом, применение максаквина в дозе 800 мг в сутки в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом у больных деструктивным ЛУТЛ с сопутствующей неспецифической бронхолегочной инфекцией показало его достаточную эффективность как антибиотика широкого спектра, воздействующего на грамотрицательную и грамположительную микрофлору, и препарата, действующего на туберкулезное воспаление.
Максаквин с полной уверенностью может быть отнесен к группе резервных ПТП. Он эффективно действует не только на МБТ, чувствительные ко всем ПТП, но и на ЛУ МБТ к изониазиду и рифампицину, что и обусловливает целесообразность его назначения таким больным. Тем не менее максаквин не следует рассматривать как основной препарат в схемах лечения больных с впервые выявленным туберкулезом легких, он должен оставаться в резерве и применяться только при ЛУТЛ и сопутствующей неспецифической бронхолегочной инфекции.
Для изониазида это составляет 1 мкг/мл, для рифампицина — 40 мкг/мл, стрептомицина — 10 мкг/мл, этамбутола — 2 мкг/мл, канамицина — 30 мкг/мл, амикацина — 8 мкг/мл, протионамида (этионамида) — 30 мкг/мл, офлоксацина (таривида) — 5 мкг/мл, циклосерина — 30 мкг/мл и для пиразинамида — 100 мкг/мл.
Литература
1. Лечение туберкулеза. Рекомендации для национальных программ. ВОЗ. 1998. 77 с.
2. Мишин. В. Ю., Степанян И. Э. Фторхинолоны в лечении туберкулеза органов дыхания // Русский медицинский журнал. 1999. № 5. С. 234-236.
3. Рекомендации по лечению резистентных форм туберкулеза. ВОЗ. 1998. 47 с.
4. Хоменко А. Г., Мишин В. Ю., Чуканов В. И. и др. Эффективность применения офлоксацина в комплексном лечении больных туберкулезом легких, осложненным неспецифической бронхолегочной инфекцией // Новые лекарственные препараты. 1995. Вып. 11. С. 13-20.
5. Хоменко А. Г. Современная химиотерапия туберкулеза // Клиническая фармакология и терапия. 1998. № 4. С. 16-20.
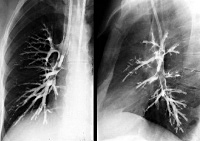
Туберкулез бронхов – это специфическое воспалительное поражение бронхиальной стенки, вызванное M. tuberculosis и обычно осложняющее течение туберкулеза внутригрудных лимфатических узлов (ВГЛУ) и легких. Для туберкулеза бронхов типичен некупируемый приступообразный кашель с выделением скудной мокроты, боль в грудной клетке, одышка, кровохарканье. Диагноз выставляется с учетом данных рентгено-томографического исследования, бронхографии и бронхоскопии, анализа лабораторного материала на ВК, туберкулинодиагностики. Лечение туберкулеза бронхов осуществляется противотуберкулезными антибиотиками, которые могут вводиться системно и местно (ингаляционно, интратрахеобронхиально).
МКБ-10
A16.4 Туберкулез гортани, трахеи и бронхов без упоминания о бактериологическом или гистологическом подтверждении
Общие сведения
Туберкулез бронхов - клинико-морфологическая форма туберкулеза органов дыхания, ведущим признаком которой служит инфильтративное, язвенное или свищевое поражение стенок бронхов. Может возникать при первичном туберкулезном процессе или развиваться вторично, как осложнение активного туберкулеза легких и ВГЛУ. Часто сочетается с туберкулезом трахеи и гортани. Половые и возрастные различия в заболеваемости туберкулезом бронхов не выражены, однако известно, что у вакцинированных детей бронхи поражаются в 2,4 раза реже, чем у непривитых.
По статистике, чаще всего (в 13-20% случаев) трахеобронхиальным туберкулезом осложняется фиброзно-кавернозный туберкулез легких, несколько реже (в 9-12%) кавернозный и диссеминированный, еще реже (в 4%-12%) – инфильтративный и очаговый туберкулез. Все это диктует повышенную настороженность в отношении возможного развития туберкулеза бронхов у лиц с другими формами туберкулеза органов дыхания.

Причины
Как самостоятельная форма, туберкулез бронхов встречается редко. Чаще им осложняется течение деструктивных форм туберкулеза легких, туберкулезного бронхоаденита и первичного туберкулезного комплекса. Инфицирование бронхиального дерева микобактериями туберкулеза может происходить следующими путями:
- контактным - при прорастании грануляций из пораженных лимфоузлов в стенку бронха;
- бронхогенным - при выделении через бронхи инфицированной мокроты у больных с деструктивными формами туберкулеза;
- лимфогенным – при рассеивании микобактерий по перибронхиальным лимфатическим путям у больных с туберкулезом ВГЛУ;
- гематогенным - при распространении микобактерий по перибронхиальным кровеносным сосудам при внелегочном или милиарном туберкулезе.
Патогенез
При перфорации бронха казеозными массами на начальном этапе отмечается инфильтрация слизистой оболочки бронхов, на фоне которой образуются специфические эпителиоидные гранулемы. Перфорация может быть столь микроскопической, что даже не визуализируется при бронхоскопии. Тем не менее, вместе с казеозными частицами в просвет бронха может попадать значительное количество МВТ, приводя к аспирации инфицированного материала и развитию аспирационной казеозной пневмонии. Излечение происходит с образованием рубцовой ткани в месте перфорации, что приводит к деформации и стенозу трахеи и бронхов, развитию пневмосклероза и нарушениям легочной вентиляции.
В случае бронхогенного заражения в первую очередь в процесс вовлекается дренирующие каверну бронхи. При этом развивается гиперемия и отек слизистой стенки бронха, отек подслизистого слоя; нарушается функция мерцательного эпителия и бронхиальных желез, в результате чего в просвете бронхов накапливается большое количество слизистого секрета. Иногда на фоне инфильтрации бронхов образуются язвенные дефекты, которые заживают с образованием рубца. При туберкулезе бронхов могут поражаться сегментарно-субсегментарные ветвления или крупные бронхи (долевые, промежуточные, главные, область бифуркации).
Классификация
Во фтизиопульмонологии различают инфильтративную, язвенную и свищевую (фистулезную) патоморфологические формы туберкулеза бронхов.
- Инфильтративная форма. Поражение стенки бронха прослеживается на ограниченном протяжении; участок утолщения и гиперемии имеет округлую или удлиненную форму; в этом месте хрящевой рисунок бронха не дифференцируется, однако просвет бронха может не изменяться. Бацилловыделение, как правило, не наблюдается.
- Язвенная форма. Чаще поражаются устья сегментарных и долевых бронхов. При продуктивных воспалительных реакциях язвенные дефекты ограниченные, поверхностные, имеющие гладкое или покрытое грануляциями дно. Если воспалительная реакция имеет экссудативно-некротической характер, язвы глубокие, кровоточащие, с дном, покрытым грязно-серым налетом. Бактериовыделение отмечается чаще.
- Свищевая форма туберкулеза бронхов формируется при прорыве лимфоузла в стенку бронха. Лимфобронхиальный свищ имеет воронкообразную форму; при нажатии на него выделяются беловато-желтые казеозные массы. Через свищ из лимфатических узлов в бронхи могут проникать кристаллы кальция. Бронхолиты могут обтурировать мелкие бронхи, способствуя развитию ателектаза легких и в перспективе - бронхогенного цирроза легкого.
Симптомы туберкулеза бронхов
В подавляющем большинстве случаев (98%) туберкулез протекает хронически, подострое и острое течение наблюдается редко (2%). Клиническая картина туберкулеза бронхов определяется его формой, локализацией, наличием осложнений, поражения легочной ткани.
В своем классическом варианте трахеобронхиальный туберкулез протекает с упорным кашлем, который не купируется после приема противокашлевых препаратов. Кашель приступообразный, лающий, беспокоит больного днем и ночью, сопровождается отделением необильной вязкой мокроты слизистого характера, без запаха. При язвенной форме может отмечаться кровохарканье. В случае присоединения стеноза бронхов дыхание становится свистящим, развивается одышка. Другими характерными признаками туберкулеза бронхов служат боль и жжение, локализующиеся за грудиной, между лопатками.
Инфильтративная форма туберкулеза бронхов может протекать бессимптомно или со скудными клиническими признаками. Общеинфекционные симптомы, сопутствующие легочному туберкулезу (лихорадка, ночная потливость, потеря веса) при туберкулезе бронхов выражены умеренно или отсутствуют. Из осложнений трахеобронхиального туберкулеза чаще всего встречаются бронхопневмония, стенозы трахеи и бронхов, бронхоэктазы. При обтурации просвета бронха бронхолитом клиника может напоминать бронхит, инородное тело, опухоль бронха.
Диагностика
Больные с туберкулезом бронхов на момент постановки диагноза, как правило, уже состоят на учете у фтизиатра. Гораздо реже туберкулез бронхов выявляется при плановой флюорографии, у длительно лихорадящих лиц, пациентов с упорным кашлем и немотивированным кровохарканьем. Целенаправленное обследование осуществляется в условиях противотуберкулезного диспансера.
- Лучевые методы обследования. Рентгенография и КТ легких обнаруживает деструктивное поражение легких, деформацию бронхов, участки гиповентиляции и ателектаза. Вторичные изменения бронхов (стенозы, бронхоэктазы) выявляются в процессе бронхографии.
- Эндоскопия бронхов.Фибробронхоскопия позволяет установить локализацию и форму процесса: катаральный эндобронхит, инфильтративное, язвенное, рубцовое поражение слизистой, фистулу бронха. Однако даже отсутствие эндоскопических признаков специфического поражения не исключает диагноза туберкулеза бронхов. Подтвердить факт бактериовыделения позволяет исследование мокроты и лаважной жидкости на наличие МБТ.
- Специфические тесты. Результаты туберкулинодиагностики чаще всего характеризуются гиперергической реакцией, однако она чаще всего отражает активность процесса в легких. Используется ИФА-диагностика - определение в крови γ-интерферона (квантифероновый тест) или сенсибилизированных Т-лимфоцитов (T-SPOT.TB).
Дифференциальную диагностику туберкулеза бронхов проходят с неспецифическим бронхитом и трахеобронхитом, саркоидозом Бека, инородными телами бронхов, силикотуберкулезом, эндобронхиальной опухолью, сифилисом бронхов. Для верификации характера изменений бронхов производится бронхоскопия с биопсией и морфологическое исследование патологических участков.
Лечение туберкулеза бронхов
При туберкулезе бронхов, кроме системного приема химиопрепаратов, используется местная терапия: при локализованном процессе – эндобронхиальное введение химиопрепаратов, при распространенном поражении - аэрозольная терапия. Методы локального воздействия также могут включать санационные бронхоскопии с удалением казеозных масс и промыванием бронхов, диатермокоагуляцию или прижигание грануляций трихлоруксусной кислотой, лазеротерапию слизистой бронхов. При развитии рубцового бронхостеноза II и III степени ставится вопрос о хирургическом лечении: стентировании, пластике бронха или резекции легкого. В период реабилитации показаны санаторно-курортное и климатическое лечение.
Прогноз
Течение и исход зависят от формы туберкулеза легких и бронхов. Более чем в 80% случаев при правильном лечении отмечается клиническое излечение туберкулеза бронхов. Для предупреждения рецидивов в течение последующих 2-х лет весной и осенью проводится специфическая химиопрофилактика.
Лекарства для лечения туберкулеза и лепры
За последние 100 лет благодаря достижениям в гигиене значительно снизилась заболеваемость туберкулезом в развитых странах. Инфекцию, вызванную Mycobacterium tuberculosis, в большинстве случаев можно устранить с помощью системной длительной терапии (6-12 мес.) эффективными химиопрепаратами.
Тем не менее во всем мире туберкулез остается одним из самых опасных заболеваний. В развивающихся странах долговременная комбинированная терапия врядли осуществима.
Успеху лечения препятствует слабая медицинская инфраструктура, отсутствие финансирования и низкая приверженность пациентов к лечению. В результате миллионы человек умирают ежегодно из-за туберкулезной инфекции. Недостаточное лечение влечет за собой дополнительное отрицательное последствие: у все большего числа штаммов микобактерий развивается резистентность, возрастающая до нескольких препаратов одновременно (туберкулез с чрезвычайной лекарственной резистентностью), в силу чего невозможно провести адекватное лечение. У пациентов с иммунодефицитом заболевание, вызванное инфекцией М. tuberculosis, протекает тяжелее.
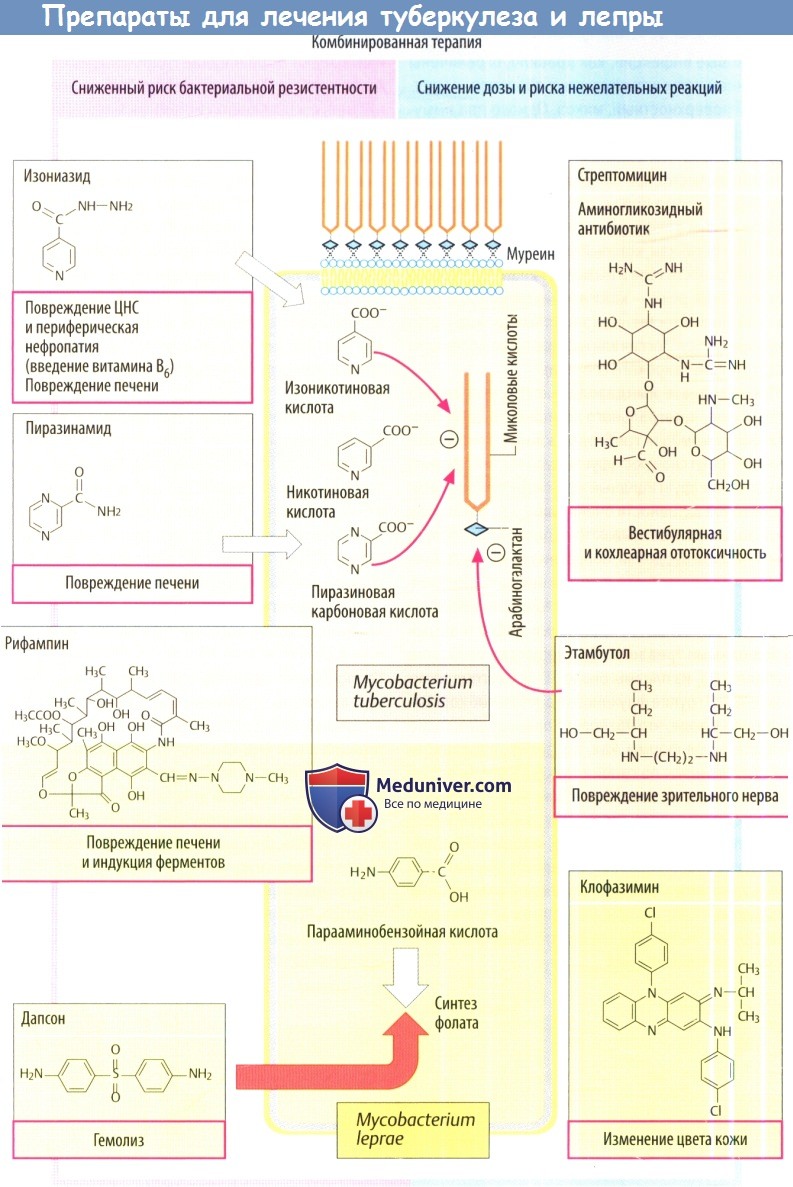
Противотуберкулезные препараты
Препаратами выбора являются изониазид, рифампицин и этамбутол, вместе со стрептомицином и пиразинамидом. Сочетания двух или трех препаратов используются в первые месяцы лечения.
а) Изониазид обладает бактерицидным свойством в отношении М. tuberculosis. Внутри бактерии он превращается каталазой/пероксидазой в изоникотиновую кислоту, накапливающуюся в клетке, где она ингибирует синтез миколовых кислот. Обычно эти кислоты образуют слой, охраняющий микроб от защитных иммунных механизмов хозяина. Миколовые кислоты связаны полисахаридом арабиногалактаном, который связывается с муреином клеточной стенки.
Изониазид быстро всасывается после введения внутрь. В печени он активируется путем ацетилирования. К значимым побочным эффектам относятся периферическая нейропатия, неврит зрительного нерва, который можно предупредить введением витамина В6 (пиридоксин), и повреждение печени.
б) Рифампин. Источник заболевания, антибактериальная активность и пути введения описаны в отдельной статье на сайте. Несмотря нехорошую в основном переносимость, данный препарат может вызывать ряд побочных эффектов, в т. ч. повреждение печени, гиперчувствительность с гриппоподобными симптомами, неприятное, но безобидное изменение цвета жидкостей организма на красный/оранжевый и индукцию ферментов (которая проявляется, например, неэффективностью пероральных контрацептивов и т. п.).
О рифабутине полдробно расписано в отдельной статье на сайте.
в) Пиразинамид тоже ингибирует синтез миколовой кислоты через активный метаболит. Он вводится внутрь. Препарат нарушает функцию печени и вызывает гиперурикемию за счет подавления выведения уратов почками.
г) Стрептомицин должен вводится в/в, как и другие аминогликозидные антибиотики. Он повреждает внутреннее ухо и лабиринт. У него сравнительно низкая нефротоксичность.
д) Этамбутол ингибирует синтез арабиногалактана. Этамбутол вводится внутрь. Обычно хорошо переносится, но может вызывать дозозависимые необратимые нарушения зрения (красно-зеленая цветовая слепота, дефекты полей зрения).
Противолепрозные препараты
Рифампицин часто применяется в сочетании с одним или двумя препаратами, указанными ниже.
а) Дапсон является сульфоном, который как и сульфаниламиды, ингибирует синтез ДГФ. Он обладает бактерицидным свойством против чувствительных к нему штаммов М. leprae. Дапсон вводится внутрь. Наиболее частой нежелательной реакцией является метгемоглобинемия с ускоренным разрушением эритроцитов (гемолиз).
б) Клофазимин — краситель с бактерицидной активностью в отношении M. leprae и противовоспалительными свойствами. Он вводится внутрь, но всасывается не полностью. Из-за высокой липофильности препарат накапливается в жировой и других тканях и достаточно медленно покидает организм (t1/2 70 дней). Красно-коричневая пигментация кожи является нежелательной реакцией, особенно у пациентов со светлой кожей.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение очагового туберкулеза. Инфильтративный туберкулез легких.
При лечении больных очаговым туберкулезом легких, как правило, используют основные антибактериальные препараты обычно на протяжении 9—12 мес. Нередко их сочетают с туберкулином и другими способами патогенетической терапии туберкулеза легких.
Скрытое или малосимптомное течение болезни побуждает применять регулярные сплошные рентгенологические обследования населения, причем не только организованного в коллективы, но и работающих на мелких предприятиях, пенсионеров, инвалидов, домашних хозяек и др.
Тщательному контролю подлежат лица с неактивным туберкулезом органов дыхания, так как у них довольно высок риск обострения процесса. В целях его предупреждения рекомендуются общеоздоровительные мероприятия, способствующие повышению резистентности организма, а при наличии факторов, ослабляющих его сопротивляемость, профилактически проводят лечение изониазидом, ПАСК.
Инфильтративный туберкулез легких.
Вторая по частоте клинически ранняя форма вторичного туберкулеза легких у взрослых—инфильтративная. Она встречается приблизительно у 25—40% впервые выявленных больных. Характерно, что этот показатель увеличивается во многих городах па протяжении последних лет. Такое явление связано не только с существующими еще недостатками в методике раннего выявления туберкулеза и с различной интерпретацией данной формы процесса, но и с некоторыми особенностями ее патогенеза и клиники.
Следует отметить, что инфильтративный туберкулез легких известен уже давно. Еще Laennec описал его на основании секционных данных как серую и желатинозную пневмонию. Однако только в конце прошлого, а главным образом в начале настоящего столетия ему стали придавать существенное значение во фтизиогенезе. Этому способствовало широкое внедрение в диагностическую практику рентгенологического способа исследования, благодаря которому открылась большая возможность обнаружения больных не только с эволютивными, но и с более ранними и, в частности, инфильтративными формами туберкулеза легких. Их патогенез длительное время вызывал дискуссию.
Инфильтрат — клинико-рентгенологическое отображение изолированного экссудативно-казеозного фокуса в легком — представляет собой начальную фазу туберкулеза, указывал один из пионеров учения об этой форме процесса Assmann (1925). У взрослых инфильтрат возникает, как правило, в неизмененной легочной ткани в результате экзогенной суперинфекции (Assmann, 1925; Hedekcr, 1926, и др.). Тех же взглядов на происхождение инфильтратов вначале придерживался А. И. Абрикосов (1904), когда говорил об ацинозной казеозной бронхопневмонии как начальной форме туберкулеза легких у взрослых. Однако эти представления в дальнейшем были поколеблены клиническими наблюдениями Б. М. Хмельницкого (1932), В. Л. Эйниса (1946), В. А. Равич-Щербо (1948), Г. Р. Рубинштейна (1948), а также патоморфологическими исследованиями В. Г. Штефко (1937), А. И. Струкова (1948), Loeschke (1928) и др. Исследования этих и ряда других авторов показали, что инфильтрат, который клинически проявляется как начальная форма легочного туберкулеза, большей частью развивается в результате обострения инкапсулированных, обызвествлепных очагов, лимфатических склерозов и остаточных гематогенных отсевов.
Эндогенным источником образования инфильтрата иногда становятся обострившиеся туберкулезные очаги во внутригрудных лимфатических узлах, из которых инфекция распространяется по лимфатическим и бронхиальным путям. Он возникает также при прогрессировании свежих очагов, если вокруг них появляется перифокальное воспаление и они сливаются между собой. Не исключается, наконец, гематогенный путь развития в легких крупных фокусов, особенно в тех сравнительно редких случаях, когда они бывают множественными и однотипными.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

