Малярийный плазмодий романовский гимза
Обновлено: 26.04.2024
Токсоплазмоз — хроническая протозойная инфекция, проявляющаяся поражениями нервной системы, печени, селезёнки, скелетных мышц и миокарда. Возбудитель токсоплазмоза — Toxoplasma gondii.
Впервые возбудителя токсоплазмоза выделили Ш. Николь и Л. Мансо (1908) у грызунов гунди (Ctenodactylus guncli). T. gondii— внутриклеточный паразит длиной 4-7 мкм, напоминающий дольку апельсина или вытянутую луковицу [от греч. toxon, лук, + plasma, имеющий форму].
По Романовскому-Гимзе цитоплазма токсоплазм окрашивается в голубой цвет, ядро — в красно-фиолетовый. Заражение человека происходит алиментарным путём при проникновении ооцист или тканевых цист (при употреблении сырых или полусырых мясных продуктов, немытых овощей и фруктов), реже через кожу (при разделке туш, работах с лабораторным материалом) или трансплацентарно.
Токсоплазмоз распространен повсеместно, инфицированность населения разных стран составляет 4-68%. Первичные и основные хозяева — домашние кошки и прочие представители семейства кошачьих. Промежуточные хозяева — человек, многие дикие и домашние животные и птицы.
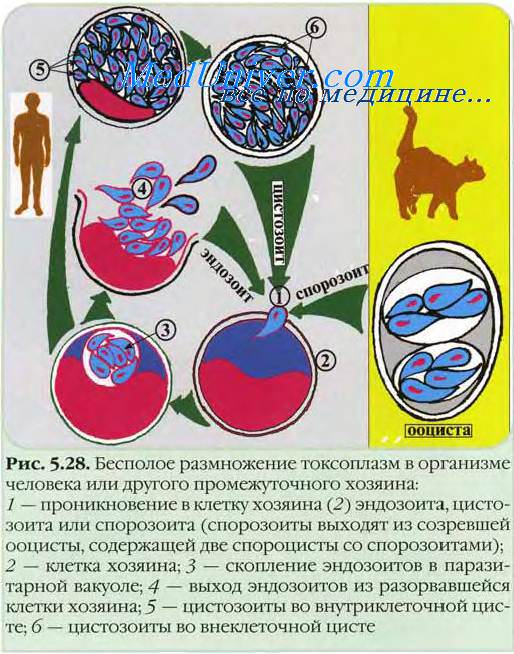
Жизненный цикл токсоплазмоза
Жизненный цикл токсоплазмоза состоит из стадий полового (гаметогония) и бесполого (шизогония, эдодиогения, спорогения) размножения. Половым путём токсоплазмы размножаются в организме кошачьих; бесполым путём — как у основных, так и промежуточных хозяев.
В организме любого теплокровного животного токсоплазмы могут достигать стадии тканевых псевдоцист, в которых бесполым путём образуются цистозоиты (мерозоиты). Первичное заражение кошачьих происходит при поедании мяса промежуточных хозяев. Паразиты проникают в клетки кишечника и превращаются в трофозоиты, размножающиеся бесполым путём. В клетках слизистой оболочки кишечника также происходит половое размножение паразита. Размножившиеся цистозоиты разрушают эпителиальные клетки и проникают в подлежащие слои кишечной стенки, где и трансформируются в гаметоциты. После слияния разнополых гаметоцитов образуется зигота-ооциста — округлое образование с плотной бесцветной двухслойной оболочкой диаметром 9-14 мкм. Из организма основных хозяев ооци-сты выделяются с испражнениями. Они хорошо сохраняются в почве, при их заглатывании происходит заражение промежуточных хозяев. Из ооцист выходят спорозбиты, активно поглощаемые макрофагами, но фагоцитоз носит незавершённый характер, благодаря чему спорозоиты диссеминируют по лимфотоку. В цитоплазме макрофагов начинается первый этап шизогонии. На более поздних этапах шизогонии макрофаги погибают, и высвободившиеся паразиты (тахизои-ты) инвазируют клетки организма (инвазии подвержены любые ядросодержащис клетки).
• В острой стадии токсоплазмоза в инфицированных клетках образуются псевдоцисты в виде скоплений токсоплазм. При их разрушении паразиты инвазируют соседние клетки, и происходит повторение цикла. Паразитемия развивается только в острой стадии.
• При хронических процессах возбудитель токсоплазмоза образует истинные цисты с плотной оболочкой (средний размер 100 мкм). Каждая циста содержит более сотни паразитов (брадизбиты), расположенных так плотно, что на препаратах видны одни ядра. В организме цисты сохраняются годами и десятилетиями.
Эта фаза конечная для паразита токсоплазмоза в организме всех животных, исключая окончательного хозяина, в котором завершается жизненный цикл.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
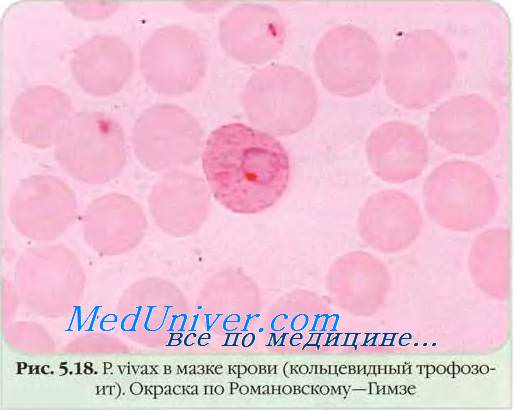
Малярию выявляют в регионах от 45° северной до 40° южной широты, чаще в тропиках и субтропиках. В странах с умеренным климатом основной возбудитель малярии — P. vivax, в тропиках — P. falciparum.
Резервуар возбудителя малярии — больной человек; основной механизм заражения — трансмиссивный. Переносчики малярии — самки комаров рода Anopheles; этиологическую роль комаров доказал Р. Росс (1897). Человек— промежуточный, а комар — окончательный хозяин паразита. Также возможно вертикальное заражение от матери к плоду.
В 104 эндемичных малярии странах регистрируют около 250 млн новых случаев заболевания; смертность от малярии достигает 1-2 млн ежегодно. Заболеваемость напрямую зависит от размеров популяции комаров и количества больных, служащих резервуаром инфекции. В связи с развитием индустрии туризма заболевание стали выявлять в странах, лежащих за пределами естественного ареала.
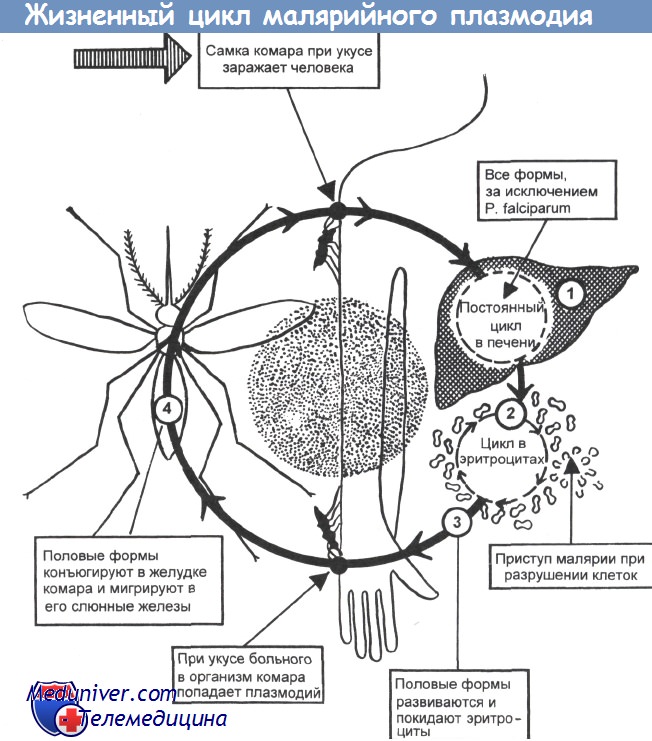
Жизненный цикл малярийных плазмодиев
У различных видов малярийных плазмодиев жизненный цикл практически одинаков, а основные различия связаны с характером поражений эритроцитов. В организме человека происходит бесполая стадия (шизогония), в организме комаров — половая стадия (спорогония).
• Спорогония малярийных плазмодиев происходит в клетках эпителия ЖКТ комара; её продолжительность 1 -3 нед. С кровью больного в организм комара проникают мужские и женские гаметы (гамонты), попарно сливающиеся в зиготы, проникающие в стенку кишки и образующие там ооцисты. Содержимое ооцист претерпевает процесс спорогонии, то есть многократного деления с образованием веретенообразных спорозоитов. Спорозоиты — подвижные клетки длиной 11-15мкм, диссеминирующие по всему организму насекомого. Часть из них проникает в слюнные железы комара, в результате чего он становится переносчиком болезни.
• Тканевая (экзоэритроцитарная) шизогония малярийных плазмодиев происходит в гепатоцитах и продолжается 1-2,5 нед. Уже через час после укуса комара спорозоиты проникают с кровотоком в клетки печени, где происходит их размножение и деление. В результате деления образуются мерозоиты (каждый спорозоит может образовать от 2000 до 40 000 мерозоитов), разрушающие гепатоциты и проникающие в кровоток.
• Эритроцитарная шизогония малярийных плазмодиев происходит после проникновения мерозоитов в эритроциты путём эндоцитоза, где образуется паразитоформная псевдовакуоль. Затем мерозоиты превращаются в трофозбиты (бесполые формы), утилизирующие гемоглобин. В ходе развития паразитов в эритроцитах происходит накопление пигмента. Юные трофозои-ты содержат ядро с одним хроматиновым зерном и внешне напоминают перстень или кольцо. Незрелые трофозоиты имеют амёбовидную форму, а трофозоиты P. vivax способны передвигаться внутри эритроцитов [от лат. vivax, живой]. У зрелых трофозоитов ядра делятся; образуются многоядерные шизонты (делящиеся формы), дающие новое поколение мерозоитов. Выход мерозоитов из эритроцита сопровождается его разрушением. Цикл развития для P. malariae составляет 72 ч, для других видов — 48 ч. В некоторых эритроцитах развиваются мужские (микрогаметоциты) и женские (макрогаметоциты) гамонты, завершающие своё развитие только в организме комара в течение 7-45 сут.
• С наступлением эритроцитарной шизогонии малярийных плазмодиев размножение P. malariae и Pj. falciparum в печени прекращается, однако у P. vivax и P. ovale часть спорозоитов (гипнозоиты) остаётся в гепатоцитах, образуя дремлющие очаги, дающие отдалённые рецидивы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Метод окраски микропрепаратов по Романовскому-Гимзе - это один из самых популярных методов окрашивания бактерий, простейших, а так же клеточных структур и тканей самых различной структуры. Данный м метод используется в том числе и для исследований крови посредством световой оптической микроскопии. Окраска по Пинчуну-Романовского-Гимзе впервые была предложена в 1904 году Густавом Гимзой.
Посредством данного метода окраске подлежат ацидофильные образования в разные оттенки красного цвета. Образования базофильного характера окрашиваются в цвет от пурпурного до синего.
Момент окрашивания:
Перед началом окрашивания готовый краситель жидкого вида разводят в дистиллированной воде в соотношении 1-2 капель красителя на 1 мг воды. Мазки окрашиваются во влажной камере при температуре 37 °C в течение 20-25 минут. После завершения окраски мазки промываются проточной водой, сушатся на воздухе, а затем исследуются с помощью масляных импрессий.
Красящую смесь Романовского-Гимзы, в основе которой имеется краска Романовского Райта, растворяют в виде порошка в смеси равноправных объемах глицерина и метилового спирта в соотношении 800 мг красителя к 100 мл растворителя.
Краситель обладает плохой растворимостью, поэтому его следует перетереть с растворителем в количественном соотношении 300мг к 100 мг, затем, добавлять краситель при этом постоянно помешивать массу до получения требуемой концентрации. На приготовление красителя требуется несколько дней. Следует акцентировать внимание на том, что в качестве растворителей нужно применять химически чистый метиловый спирт и глицерин, так как именно примеси являются причиной ухудшения свойств красителя. 100 % этиловый спирт может стать идеальной заменой метиловому спирту. Готовую красящую смесь следует хранить в плотно закрытом сосуде в прохладном сухом месте.
Специальный раствор Гимза. Составляющие красителя:
- Азур 1 — 3,772 г
- Эозин — 2,165 г
- Метиленовая синька (медиц.) — 1,563 г
- Метанол (ЧДА) — 750,0 мл
- Глицерин (ЧДА) — 256,0 мл
Метод окрашивания:
Мазки, акцентированные в метиловом спирте, окрашивают на протяжении 40-120 минут раствором, в состав которого входят 1 мл приготовленной краски жидкой формы, 2 мл главного буферного раствора и 47 мл дистиллированной воды. Используют фосфатный буфер, на рН которого оказывает влияние вид мазка:
- мазок костного мозга — 5,8 — 6,0;
- мазок крови — 6,4 — 6,5;
- выявление простейших — 6,8;
- малярийные плазмодия — 7,0 — 7,2.
Ополаскивание проводят в дистиллированной воде, затем высушивают и изучают при иммерсии.
Результаты окрашивания:
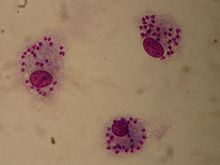
Амастиготы Leishmania tropica, находящиеся – в макрофагах. Увеличение 10×100, окрашивание по Гимзе.
Бактерии вследствие окрашивания приобретают фиолетово-красный оттенок, цитоплазма клеток — голубой цвет, ядра — красный. Вследствие окраски простейших их цитоплазма становится голубого цвета, а ядра — красно-фиолетового.

Как мы уже говорили, в микроскопы можно смотреть прозрачные и непрозрачные объекты (если микроскоп оборудован верхней подсветкой, либо при наличии яркого внешнего освещения). Однако маленькое рабочее расстояние объективов большой кратности делает невозможным исследование ряда объектов в отраженном свете, и поэтому для исследований большинства образцов необходимо готовить специальные микропрепараты.

В человеческом организме живет огромное количество микроорганизмов, немалая часть их них обитает именно у нас во рту, то есть и в слюне.

Род включен в состав типа apicomplexa класса sporozoea отряда eucoccidiida подотряда haemosporma. Род включает более 100 видов, паразитирующих в организмах рептилий птиц и животных. Четыре вида патогеннs для человека и вызывает малярию — трансмиссивное заболевание человека, характеризующееся преимущественным поражением ретикулогистиоцитарной системы и эритроцитов, приступами лихорадки, анемией и гепатоспленомегалией. Plasmodium vivax - возбудитель трехдневной малярии, Р. malariae - возбудитель четырехдневной малярии, Р. falciparum - возбудитель тропической малярии, Р. ovale - возбудитель малярии овале (типа трехдневной).
Возбудителя малярии (микрогаметы Р. falciparum) в крови человека впервые обнаружил Лаверан (6 ноября 1880 г). Принадлежность возбудителя к споровикам установил И. И. Мечников (1886). Цикл развития паразита в организме, стадии и закономерности появления приступов были установлены Гольджи (1889). Следует отметить, что известны случаи заболевания человека малярией обезьян в эндемичных очагах.
Жизненный цикл (Рис. 1) различных видов плазмодиев практически одинаковый (основные различия связаны с образованием поколений поражающих эритроциты) включает бесполую стадию (шизогония), проходящую в организме человека, и половую стадию (спорогония), проходящую в организме переносчика — самок комаров рода anopheles (цикл Росса).
Рисунок 1. Жизненный цикл различных плазмодиев
Спорогония малярийного плазмодия происходит в клетках эпителия ЖКТ комара и продолжается 1-3 нед.
Процесс начинается с проникновения мужских и женских гамет (гамонтов) в организм комара с кровью больного.
Гамонты сливаются попарно в зиготы, проникающие в стенку кишки и образующие там ооцисты.
Содержимое ооцист претерпевает процесс спорогонии — многократно делится и образует спорозоиты (веретенообразные клетки длиной 11-15 мкм), диссеминирующие по всему организму насекомого. Часть из них проникает в слюнные железы, делая комара переносчиком болезни.
Тканевая или экзоэритроцитарная шизогония плазмодия происходит в гепатоцитах человека и продолжается 1-2 нед (цикл размножения Р. falciparum и Р. malarie в печени варьирует в пределах 10-18 сут).
Через час после кровососания спорозоиты проникают с кровотоком в клетки печени где размножаются и делятся.
В результате деления образуются мерозоиты (каждый спорозоит может образовать от 2000 до 40 000 мерозоитов), разрушающие гепатоциты и проникающие в кровоток.
Эритроцитариая шизогония происходит после проникновении мерозоитов в эритроциты.

Проникшие в клетки мерозоиты превращаются в трофозоиты (растущие формы) размером 2 мкм, микроскопия пораженных эритроцитов выявляет покоящиеся формы, содержащие ядро с одним хроматиновым зерном (Рис. 2), и формы с псевдовакуолью, внешне напоминающие перстень или кольцо (Рис. 3).
Рисунок 2. Покоящиеся формы, содержащие ядро с одним хроматиновым зерном

Рисунок 3. Формы с псевдовакуолью, внешне напоминающие перстень или кольцо
Размеры трофозоитов Р. falciparum меньше половины эритроцита и не вызывают его деформации.

Трофозоиты Р. vivax больше по размерам, имеют псевдоподии и способны передвигаться внутри эритроцита (отсюда vivax — живой), вызывая увеличение и деформацию клеток (Рис. 4).
Рисунок 4. Трофозоиты Р. vivax

Несмотря на наличие нескольких псевдоподий, трофозоиты Р. malariae практически неподвижны в мазках часто выглядят как тельца включений или ленты. Пораженные эритроциты не деформированы (Рис. 5).
Рисунок 5. Трофозоиты Р. malariae

Поскольку Р. ovale занимает промежуточное положение между Р. vivax и Р. malariae, то он деформирует около 60% инфицированных эритроцитов делая их овальными (Рис. 6).
Рисунок 6. Трофозоиты Р. ovale
Трофозоиты позднее увеличиваются и образуют многоядерные шизонты (делящиеся формы).

Шизонты образуют новое поколение мерозоитов. Каждая клетка может образовывать 6-24 дочерних мерозоита инфицирующих другие эритроциты (Рис. 7, 8).
Рисунок 7. Многоядерный шизонт

Рисунок 8. Многоядерный шизонт

Выход мерозоитов из эритроцита сопровождается его разрушением (Рис. 9).
Рисунок 9. Выход мерозоитов из эритроцита
Указанный цикл развития для Р. malariae составляет 72 ч, для других видов — 48 ч.
В некоторых эритроцитах из макрогаметоцитов (Рис. 10) развиваются женские, из микрогаметоцитов (Рис. 11) мужские гамонты, завершающие своё развитие только в организме комара в течение 7-45 сут (в зависимости от температуры воздуха).

Рисунок 10. Макрогаметоцит

Рисунок 11. Микрогаметоцит
Распространение. Малярию выявляют повсеместно (Рис 12) от 45° северной до 40° южной широты (но чаще в тропиках и субтропиках) на высоте от 0 до 1 800 м над уровнем моря. В странах с умеренным климатом более часто выделяют Р. vivax, реже — Р. malariae. В тропиках основной возбудитель — Р. falciparum, и лишь спорадически в африканских странах выделяют Р. ovale. В 40-50-х гг. значительная часть очагов малярии в Европе и США была уничтожена применением инсектицидов, в частности ДДТ. теории развития заболеваний. В опубликованном в 1717 г. сочинении (mal'aria) в организм, что дало начало известной

Распространение. Малярию выявляют повсеместно (Рис 12) от 45°
Рисунок 12. Распространение малярии
Заболеваемость. Ежегодно в 104 эндемичных странах заболевают около 250 млн человек. Смертельные исходы чаще всего наблюдают среди детей, но также регистрируют среди неиммунизированных взрослых (1-2 млн ежегодно). Заболеваемость напрямую зависит от размеров популяции комаров и количества больных, служащих резервуаром инфекции. В связи с развитием индустрии туризма заболевание выявляют в странах, лежащих за пределами естественного ареала.
Анализ эпидемиологических факторов показывает, что передача инфекционного агента в большинстве случаев носит горизонтальный характер (распространение в течение эпидемического сезона возможно только через комара); что касается вертикальной передачи (наличие преемственной связи между сезонами), то она встречается редко. Подобные ситуации опосредуют лица-гамонтоносители, количество которых часто недооценивают. Следует учитывать, что в селезёнке количество гамонтов превышает таковое в периферической крови. Фактическое количество гамонтоносителей составляет 20-80% всех паразитоносителей.
Лихорадка наблюдается в момент выхода мерозоитов из разрушенных эритроцитов; интервалы между проявлениями приступов зависят от биологического цикла паразита. Начало острое, температура тела может достигать 40-41,7 °С (обычно подъём наблюдают в дневное время). Через несколько часов она литически снижается до 35-36 °С. При разрушении эритроцитов в кровь выделяется эндопироген, структура которого остаётся неидентифицированной (определённая роль может принадлежать гематину). Определённую роль в развитии лихорадочной реакции могут играть ИЛ-1 и фактор некроза опухолей, выделяемые макрофагами, активируемыми во время утилизации остатков эритроцитов.
Анемия — следствие массивного лизиса эритроцитов и фагоцитоза поражённых клеток фагоцитами. При тропической малярии, вызванной Р. falciparum черно-водная лихорадка (гемоглобинурийная лихорадка). Характерны острый массивный гемолиз, гемолитическая желтуха, боли в пояснице, гемоглобинурия. Может развиться как осложнение малярии, возникающее после приёма хинина и примахина; чаще возникает у лиц с повышенной ломкостью эритроцитов. Вследствие наследственного дефекта глюкозо-6-фосфатдегидрогеназы по типу анемии Маркиафавы-Микели, а также как реакция ГЗТ на хинин; комплексы хинин-АТ сорбируются на мембранах эритроцитов, активируют комплемент, что приводит к их генерализованному разрушению. Значительно реже и лишь при тропической малярии наблюдают внутрисосудистый гемолиз.
Нарушения кровообращения в первую очередь опосредованы подъёмами температуры тела. Дилатация сосудов приводит к снижению ОЦК и АД. Последующий спазм сосудов, повышенная вязкость крови, закупорка капилляров остатками эритроцитов приводят к ишемии органов и тканей.
Иногда тропическую (falciparum) малярию сопровождает острый гломерулонефрит.
Р. malariae может развиться прогрессирующая почечная недостаточность. Механизмы нефропатологии при малярии по большей части опосредованы аутоиммунными механизмами.
Заболевание часто сопровождают спленомегалия (увеличение не всегда соответствует тяжести заболевания) и тромбоцитопения.
Поражения органов ЖКТ достаточно многообразны — от гангренозно-язвенных до холероподобных. Печень обычно увеличена, гиперемирована и окрашена в тёмно-коричневый цвет. При хронических поражениях её масса достигает 3-5 кг. Нередки поражения поджелудочной железы вплоть до фиброзного панкреатита.
Иммунные реакции
Проникновение плазмодиев в кровоток индуцирует развитие иммунного ответа, направленного на подавление активности возбудителя и значительно смягчающего тяжесть клинических проявлений. Отмечены случаи абсолютной резистентности к инфекции, опосредованные иммунными и генетическими механизмами, передающимися по наследству.
Поскольку заболевание носит длительный циклический характер, уровень иммунного ответа постоянно нарастает. Под воздействием иммунных механизмов цикл шизогоний постепенно замещается спорогониями со смягчением симптоматики. В редких случаях возможно спонтанное выздоровление.
В подавлении размножения плазмодиев задействованы гуморальное и клеточное звенья иммунного ответа. Однако, степень их участия неопределенна.
Факторы организма, влияющие на заболеваемость
Лица, эритроциты которых не несут Аг группы duffy обладают естественной резистентностью к возбудителям малярии (отсутствуют у многих представителей негроидной расы).
Естественной резистентностью обладают лица с врождённым дефицитом глюкозо-6-дегидрогеназы, т.к. паразиты не способны использовать глюкозо-монофосфатный шунт в качестве источника энергии и в подобных условиях не могут развиваться в эритроцитах.
Лица с гемоглобинопатиями также резистентны к заражению, т.к. паразиты не способны размножаться в эритроцитах с изменённой морфологией, например при серпо-видноклеточной анемии.
Лабораторная диагностика малярии основана на выявлении паразитов в крови и соответствующей симптоматике. Некоторые отличительные признаки малярийных плазмодиев в мазке периферической крови представлены в табл. 1.
Для приготовления мазков пригодна капиллярная и венозная кровь. Мазки окрашивают по Райту или Романовскому Гимзе. Различные виды дифференцируют по морфологическим признакам.
При эпидемических обследованиях регионов более пригодна серологическая идентификация, например методом непрямой иммунофлюоресценции, выявляющим Аг в мазках. Также можно воспользоваться новокаин-формалиновой пробой Касты.
При невозможности обнаружения паразитов косвенные данные могут дать изменения лейкоцитарной формулы даже при однократном исследовании (моноцитоз, анэозинофилия, ядерный сдвиг влево в лейкоцитарной формуле).
Для экспресс-диагностики возможна микроскопия крови в толстой капле (препараты окрашиваются без фиксации). Следует помнить, что в препаратах эритроциты разрушаются, лейкоциты деформируются, а возбудитель может частично сморщиваться. Отличительные признаки приведены в табл. 2.
Отличительные признаки малярийных плазмодиев в мазке периферической крови (окраска по Романовскому-Гимза)
| Паразиты | Р. vivax | Р. ovale | Р. malariae | Р. falciparum |
| Эритроциты | ||||
| Увеличенные, бледно-розовые | + | + | - | - |
| Овоидные, края часто бахромчатые | - | + | - | - |
| Зернистость в пораженном эритроците | ||||
| Мелкая, обильная, красная (зерна Шюффнера) | + | - | - | - |
| Крупная, менее обильная (зерна Джеймса) | - | + | - | - |
| Единичные крупные розовые или фиолетовые пятна (пятна Маурера) | - | - | - | + |
| Паразит | ||||
| Наличие всех стадии шизогонии | + | + | + | + |
| Стадия кольца (количество паразитов в эритроците) | 2-3 | 2-3 | 1 | 2-3 |
| Лентовидные формы | - | - | + | - |
| Двойные пятна хроматина | - | - | - | + |
| Округлые гамонты | + | + | + | - |
| Полулунные гамонты | - | - | - | + |
| Пигмент во взрослом трофозоите | Обильный рассеянный | Более грубый, рассеянный | Более грубый, рассеянный | Компактный, в виде кучки |
Отличительные признаки малярийных плазмодиев в толстой капле крови (окраска по Романовскому-Гимзе)
| Признак | Р. vivax | Р. ovale | Р. malariae | Р. falciparum |
| Кольца | Часто разорваны, напоминают восклицательный знак или летящую птицу | Сходны с Р. vivax | Сохраняют форму, часто в виде ядра с небольшим ободком цитоплазмы | Сходны с другими видами, ядра крупные, неправильные |
| Эритроциты | Часто сохраняются в виде розоватых дисков с шизонтами и зернами Шюффнера | Не сохраняются | Не сохраняются | Сохраняются остатки эритроцитов даже на стадии кольца |
| Трофозоиты | Амебовидные содержат комочки цитоплазмы вокруг ядра, зрелые — компактные, круглые | Круглые, хорошо окрашенные | Обычно не обнаруживают | Компактные |
| Пигмент | Мелкий, палочковидны | Круглые, крупные зерна | В виде черной глыбки | Буровато-коричневый |
Лечение. История терапии малярии насчитывает более 350 лет (в 1640 г. испанцы завезли в Европу кору хинного дерева, употреблявшуюся индейцами в Эквадоре в качестве противо-лихорадочного средства). Длительное время хинин — алкалоид коры хинного дерева (cinchona) — оставался единственным средством химиотерапии. Современный арсенал препаратов позволяет ингибировать эритроцитарную шизогонию (препятствуя развитию приступов лихорадки), внеэритроцитарную шизогонию (препятствуя развитию рецидивов) и элиминировать циркулирующие гамонты (препятствуя переносу возбудителя от человека к человеку). Препараты, действующие одновременно по трем указанным направлениям, отсутствуют. Приступы лихорадки купируют многие препараты
Среди них наиболее известно производное 4-аминохинолина — хлорохин (в отечественной фармакопее — хингамин). Препарат активен против всех видов плазмодиев, однако существуют формы, резистентные к его действию.
Профилактика. Смысл профилактики сводится к разрыву биоценоза плазмодий-комар-человек, что может быть достигнуто терапевтическим уничтожением возбудителя в организме человека (метод Коха) либо бонификацией (метод Росса). Несмотря на ликвидацию малярии на территории бывшего СССР, вероятность ее возобновления в РФ постоянно возрастает. Это связано с нарушением системы контроля за местами выплода комаров рода anopheles и постоянным завозом малярии из стран юго-восточной Азии, Африки и Латинской Америки. В связи с этим необходимо проводить исследование на малярию независимо от сезона (приказ МЗ СССР № 930 от 23. 09. 76) осуществлять санацию и контроль за носителями. Несмотря на многочисленные попытки, эффективные средства вакцинопрофилактики отсутствуют.
СХЕМЫ МИКРОСКОПИЧЕСКОГО СТРОЕНИЯ РАЗЛИЧНЫХ ФОРМ ВОЗБУДИТЕЛЕЙ МАЛЯРИИ, ИДЕНТИФИЦИРУЕМЫХ В ЭРИТРОЦИТАХ

Малярию выявляют в регионах от 45° северной до 40° южной широты, чаще в тропиках и субтропиках. В странах с умеренным климатом основной возбудитель малярии — P. vivax, в тропиках — P. falciparum.
Резервуар возбудителя малярии — больной человек; основной механизм заражения — трансмиссивный. Переносчики малярии — самки комаров рода Anopheles; этиологическую роль комаров доказал Р. Росс (1897). Человек— промежуточный, а комар — окончательный хозяин паразита. Также возможно вертикальное заражение от матери к плоду.
В 104 эндемичных малярии странах регистрируют около 250 млн новых случаев заболевания; смертность от малярии достигает 1-2 млн ежегодно. Заболеваемость напрямую зависит от размеров популяции комаров и количества больных, служащих резервуаром инфекции. В связи с развитием индустрии туризма заболевание стали выявлять в странах, лежащих за пределами естественного ареала.
Жизненный цикл малярийных плазмодиев
У различных видов малярийных плазмодиев жизненный цикл практически одинаков, а основные различия связаны с характером поражений эритроцитов. В организме человека происходит бесполая стадия (шизогония), в организме комаров — половая стадия (спорогония).
• Спорогония малярийных плазмодиев происходит в клетках эпителия ЖКТ комара; её продолжительность 1 -3 нед. С кровью больного в организм комара проникают мужские и женские гаметы (гамонты), попарно сливающиеся в зиготы, проникающие в стенку кишки и образующие там ооцисты. Содержимое ооцист претерпевает процесс спорогонии, то есть многократного деления с образованием веретенообразных спорозоитов. Спорозоиты — подвижные клетки длиной 11-15мкм, диссеминирующие по всему организму насекомого. Часть из них проникает в слюнные железы комара, в результате чего он становится переносчиком болезни.
• Тканевая (экзоэритроцитарная) шизогония малярийных плазмодиев происходит в гепатоцитах и продолжается 1-2,5 нед. Уже через час после укуса комара спорозоиты проникают с кровотоком в клетки печени, где происходит их размножение и деление. В результате деления образуются мерозоиты (каждый спорозоит может образовать от 2000 до 40 000 мерозоитов), разрушающие гепатоциты и проникающие в кровоток.
• Эритроцитарная шизогония малярийных плазмодиев происходит после проникновения мерозоитов в эритроциты путём эндоцитоза, где образуется паразитоформная псевдовакуоль. Затем мерозоиты превращаются в трофозбиты (бесполые формы), утилизирующие гемоглобин. В ходе развития паразитов в эритроцитах происходит накопление пигмента. Юные трофозои-ты содержат ядро с одним хроматиновым зерном и внешне напоминают перстень или кольцо. Незрелые трофозоиты имеют амёбовидную форму, а трофозоиты P. vivax способны передвигаться внутри эритроцитов [от лат. vivax, живой]. У зрелых трофозоитов ядра делятся; образуются многоядерные шизонты (делящиеся формы), дающие новое поколение мерозоитов. Выход мерозоитов из эритроцита сопровождается его разрушением. Цикл развития для P. malariae составляет 72 ч, для других видов — 48 ч. В некоторых эритроцитах развиваются мужские (микрогаметоциты) и женские (макрогаметоциты) гамонты, завершающие своё развитие только в организме комара в течение 7-45 сут.
• С наступлением эритроцитарной шизогонии малярийных плазмодиев размножение P. malariae и Pj. falciparum в печени прекращается, однако у P. vivax и P. ovale часть спорозоитов (гипнозоиты) остаётся в гепатоцитах, образуя дремлющие очаги, дающие отдалённые рецидивы.

Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

