Менингококковый артрит у детей
Обновлено: 26.04.2024
Ключевые слова: менингококковая инфекция, дети, клиническая характеристика, вакцинация
Keywords: meningococcal infection, children, clinical characteristics, vaccination
Резюме. Менингококковая инфекция является серьезной проблемой здравоохранения, поскольку преимущественно поражает детей и подростков. Особую значимость представляют случаи генерализованной инфекции. Кроме того, высока частота инвалидизации после инфекции и доля летальных исходов. В данной статье освещены современные данные о менингококковой инфекции и представлен разбор клинического случая с летальным исходом.
Summary. Meningococcal infection is a serious public health problem due to the predominant affection of children and adolescents. Of particular importance are patients with a generalized form of infection, as well as a high proportion of disability after infection and deaths. This article highlights modern data on meningococcal infection, presents an analysis of a clinical case of meningococcal infection with a lethal outcome.
Для цитирования: Мазанкова Л.Н., Тебеньков А.В., Россина А.Л. Менингококковая инфекция у детей - новые вызовы. Практика педиатра 2021;(3):25-9.
For citation: Mazankova L.N., Tebenkov A.V., Rossina A.L. Meningococcal disease in children - new challenges. Pediatrician's Practice 2021; (3): 25-9.
Введение
Менингококковая инфекция (МИ) остается одной из актуальных проблем здравоохранения, медицинская и социальная значимость которой обусловлена преимущественным поражением молодого населения - детей, подростков и молодых взрослых, на долю которых приходится до 70% заболевших, а также развитием тяжелых генерализованных форм инфекции (ГФМИ), высокой летальностью и значительным числом случаев инвалидизации после перенесенного заболевания (20-50% больных ГФМИ) 3. Летальность при ГФМИ продолжает быть высокой: в 2019 г. в России она составила 21% [2]. По данным референс-центра по мониторингу за бактериальными менингитами, дети болели ГФМИ в 5-7 раз чаще, чем взрослые [1, 2]. Наиболее высок риск в группе детей младше 4 лет. Заболеваемость МИ детей от 0 до 4 лет превышает этот показатель у взрослых примерно в 25 раз [2, 4].
Приводим описание клинического случая заболевания МИ ребенка в возрасте 25 дней без отягощенного преморбидного фона. Случай имел летальный исход.
Жалобы при поступлении на гипертермию, рвоту, беспокойство, нарастание желтушного синдрома.
Из анамнеза заболевания известно, что за два дня до начала заболевания мать отмечала беспокойство ребенка. От грудного кормления не отказывался. 31.05.2021 отмечается подъем температуры тела до 38°C. Ребенок отказывался от еды. Мать пыталась накормить, но ребенок срыгнул трижды. Была вызвана бригада скорой медицинской помощи, которая (со слов матери) дала жаропонижающее (в листе сопровождения данных нет). Ребенок доставлен в сопровождении бригады в стационар. После выписки из роддома длительно сохранялся желтушный синдром. Но 31.05.2021 мать отметила резкое нарастание желтушности. Со слов матери, у нее были невыраженные проявления острой респираторной инфекции за 5 дней до начала заболевания у ребенка (першило в горле). Мать продолжала грудное вскармливание.
Из анамнеза жизни: ребенок от первой беременности, протекавшей без особенностей, первых срочных физиологических родов. Вес при рождении 2860 г, рост 54 см, оценка по шкале Апгар 8 из 9 баллов. Наследственность и аллергологический анамнез не отягощены, привит в роддоме. Перенесенных заболеваний, травм, операций не было.
Состояние при поступлении (31.05.2021, 12:01) тяжелое. Пациент астенического телосложения, пониженного питания. Рост 54 см, вес 3,288 кг, температура тела 36,6°C. Группа крови 0 (I). Резус-фактор положительный. Большой родничок размерами 1,5 на 1,5 см, не напряжен, не пульсирует. На осмотре ребенок кричит, крик раздраженный. Кожные покровы иктеричные с сероватым оттенком, пониженной влажности, геморрагическая сыпь.. Подкожная жировая клетчатка развита слабо. Микроциркуляторные нарушения в виде мраморности кожи. СПБ 3-4 с. Тургор мягких тканей снижен. Акроцианоз. Отеков нет. Слизистая оболочка полости рта и ротоглотки чистая, розовая. Пупочная ранка в стадии эпителизации. Периумбиликальная область без воспалительных изменений. Видимых повреждений нет. Мышцы развиты удовлетворительно, мышечная дистония с преобладанием гипертонуса сгибателей. Движения суставов в полном объеме. Частота дыхательных движений 46 в минуту, дыхание регулярное, самостоятельное. Аускультативно выслушивается пуэрильное дыхание, хрипов нет. Сатурация 92%. Гемодинамика стабильная. Систолическое давление на правой руке 90 мм.рт.ст., диастолическое -53 мм рт. ст. Частота сердечных сокращений 160 в минуту. Пульс умеренного наполнения и напряжения. Пульсация тыльных артерий стоп определяется с обеих сторон. Тоны сердца приглушенные, ритмичные, патологических шумов нет. Вазотропная (вазопрессорная) поддержка на момент осмотра не требовалась. На мониторе синусовый ритм. Язык розовый, влажный, без налета. Живот не увеличен, симметричный, вздутия нет. При пальпации мягкий, безболезненный. Аускультативно перистальтика выслушивается. Печень не выступает из-под края реберной дуги, край гладкий. Стул желтого цвета, без патологических изменений, кашицеобразный (тип 6), имеются непереваренные кусочки пищи. Мочеиспускание не нарушено. Моча без изменений, соломенно-желтого цвета. Область почек не изменена.
Неврологический статус
Сознание ясное. Глазные щели равные. Величина зрачков одинакова, симметрична. Менингеальный синдром не выявлен, очаговой симптоматики нет. Реакция зрачков на свет в норме. Мышечный тонус повышен. Оценка по шкале комы Глазго 15 баллов.
Данные лабораторного исследования
Общий анализ крови 31.05.2021: гемоглобин 160,5 г/л, эритроциты 4,9 3 х 10 12 /л, гематокрит 48,2%, тромбоциты 94,0 х 10 9 /л, лейкоциты 3,24 х 10 9 /л, лимфоциты 52%, палочкоядерные 4%, сегментоядерные 39%, моноциты 5%.
Исследование газов крови 31.05.2021: sO2 86,6%, SBC 21,4 ммоль/л, ВЕ 3,2 ммоль/л, К + 4,2 ммоль/л, Cl - 109 ммоль/л, Ca 2+ 1,24 ммоль/л, Na + 137 ммоль/л, Glu 7,3 ммоль/л, Lac 3,7 ммоль/л, рН 7,349, tHb 17,4 г/дл, осмолярность 282,1, рО2 45,9, рСО2 40,1.
Биохимический анализ крови 31.02.2021: креатинин 60,96 мкмоль/л, альбумин 24 г/л, АСТ 56 ЕД/л, АЛТ 44 ЕД/л, мочевая кислота 182 мкмоль/л, общий белок 43 г/л, мочевина 4,7 ммоль/л, С-реактивный белок 65,8 мг/л, общий билирубин 215,6 мкмоль/л, прямой билирубин 6,6 мкмоль/л, гамма-глютамилтрансфераза 136 ЕД/л, D-димер 3452 нг/мл, прокальцитонин 44,83 нг/мл.
Клинический анализ спинномозговой жидкости 31.05.2021: лимфоциты 6 кл., нейтрофилы 18 кл., белок 3,0 г/л, цитоз 24 кл. в 1 мкл, цвет желтый, мутная, удельный вес 1,015.
Коагулограмма 31.05.2021: активированное частичное тромбопластиновое время 44,0 с, протромбиновое время 22,2 с, концентрация протромбина 38%, международное нормализованное отношение 2,04, тромбиновое время 13,0 с, концентрация фибриногена 3,7 г/л.
Общий анализ мочи 31.05.2021: слизь в умеренных количествах, лейкоциты 0-2 в поле зрения, единичные клетки плоского эпителия, эритроциты 0-1 в поле зрения, кетоновые тела, глюкоза, билирубин отсутствуют, белок 1,0 г/л, рН 7,5, мутная, удельный вес 1010, цвет желтый.
Данные инструментального исследования
Нейросонография 31.05.2021: признаков острого нарушения мозгового кровообращения нет, объемных патологических образований в областях, доступных визуализации, на момент исследования не выявлено.
Ультразвуковое исследование органов брюшной полости 31.05.2021: объемных патологических образований не обнаружено. Свободная жидкость в латеральных каналах слева - 5 мм, справа - 3 мм. Визуализируются кишечные петли, заполненные жидким содержимым, перистальтика вялая. Стенки кишечных петель утолщены до 1,8 мм.
Рентгенография легких 01.06.2021: признаки отека легких. Суммарная лучевая нагрузка 0,018 мЗв.
Ребенок консультирован специалистами
Врач-невролог 31.05.2021: на момент осмотра нельзя исключить течение острой нейроинфекции.
Бактериологический посев крови и ликвора от 01.06.2021: выделена Neisseria meningitidis gr. B.
Проведенная терапия:
1. Лечебно-охранительный режим: оральные регидра тационные соли с сервоконтролем.
2. Респираторная терапия: искусственная вентиляция легких (ИВЛ) под контролем газового состава крови.
3. Энтеральная пауза, зонд на отток.
4. Антибактериальная терапия: меропенем в дозе 120 мг/кг/с в 3 введения, ванкомицин в дозе 45 мг/ кг/с в 3 введения внутривенно капельно.
5. Инфузионная терапия с коррекцией содержания электролитов + частичное парентеральное питание в дозе 170 мл/кг/сут (с коррекцией электролитных нарушений).
6. Санация трахеобронхиального дерева и верхних дыхательных путей по показаниям, смена положения каждые 3 ч, туалет глаз и венозного катетера.
7. Симптоматическая терапия.
8. Гормональная терапия: дексаметазон в дозе 0,5 мг/кг/с, солукортеф в дозе 2 мг/к/с.
9. Гемостатическая терапия: викасол, дицинон, свежезамороженная плазма 20, 15 мл/кг/с, транексам в дозе 15 мг/кг 4 р.
10. КТП: норадреналин в дозе 0,5-1,0 мкг/кг/мин, адреналин в дозе 0,5-1,0 мкг/кг/мин.
11. С целью синхронизации с аппаратом ИВЛ: мидазолам в дозе 0,5-0,3 мг/кг/ч, фентанил в дозе 5-2 мкг/кг/ч.
За время пребывания в отделении реанимации и интенсивной терапии, несмотря на проводимую терапию, состояние ребенка оставалось крайне тяжелым. Сохранялась симптоматика септического шока (резистентного к объемной жидкостной нагрузке и введению инотропных/вазопрессорных препаратов) с полиор ганной недостаточностью, что потребовало повышения доз кардиотонических/вазопрессорных и гормональных препаратов.
За время наблюдения проводилась заместительная трансфузия свежезамороженной плазмой (дважды) для коррекции гемостаза.
01.06.2021 01:15 произошло ухудшение состояния ребенка до критического уровня. На фоне прогрессирующих нарушений гемодинамики в виде артериальной гипотензии развились нарушения сердечного ритма с нарастающей брадикардией до асистолии. Начаты реанимационные мероприятия в полном объеме: непрямой массаж сердца на фоне ИВЛ в течении 5 мин с оценкой эффекта и продолжением компрессий с частотой 110-115 ударов в минуту. Эффекта не было. Вводился адреналин в дозе 10 мкг/кг внутривенно струйно каждые 5 мин. Компрессии продолжены.
Реанимационные мероприятия продолжались в течение 30 мин без эффекта. В связи с неэффективностью они были прекращены. Дыхание поддерживалось ИВЛ, пульс на крупных артериях не пальпировался, сердечные тоны не выслушивались, артериальное давление не определялось, мидриаз без фотореакции, электрической активности сердца не было.
Констатирована биологическая смерть ребенка 01:45 01.06.2021.
Таким образом, продемонстрирован случай развития гипертоксической формы генерализованной МИ у новорожденного ребенка, осложненной развитием септического шока, синдрома полиорганной недостаточности, синдрома Уотерхауза - Фридериксена, что привело к досуточному летальному исходу. Развитие заболевания отличалось фульминантностью и драматичностью, неуправляемостью, несмотря на применение современных методов стандартизированной терапии.
Менингококковая инфекция является не только серьезным бременем для системы здравоохранения, но и существенно влияет на качество жизни пациентов. Осложнения, которые возникают после перенесенной МИ, значительно снижают качество жизни пациента и членов семьи, которые о них заботятся. В подавляющем большинстве случаев причиной летальных исходов становится развитие гипертоксических форм болезни с молниеносным течением, когда смерть наступает в 1-е сутки заболевания даже при своевременной диагностике и назначении адекватной терапии. Среди выздоровевших 70% нуждается в длительной реабилитационной терапии. У 20% пациентов, выживших после перенесенной МИ, развиваются необратимые серьезные осложнения (глухота, потеря зрения, задержка умственного и физического развития, эпилепсия, некроз кожи, ампутация конечностей), которые снижают качество жизни пациента и членов семьи, которые о них заботятся [8]. Причем наиболее велик риск развития осложнений у детей младше 5 лет [9]. У пациентов, перенесших МИ, а также членов их семьи отмечаются социальные последствия перенесенного заболевания, такие как пожизненный когнитивный дефицит (снижение концентрации внимания, низкие академические способности), психологический стресс и посттравматическое стрессовое расстройство. Преодоление диагноза МИ также может создавать существенную эмоционально-психологическую нагрузку на членов семьи, когда они сталкиваются с новой реальностью экономических жертв и снижения качества жизни их близких. Бремя МИ, ложащееся на семью, включает эмоциональные нагрузки, испытываемые членами семьи, которые должны заботиться о своем близком человеке с физическими, психологическими или когнитивными нарушениями.
Самым эффективным способом контроля менингококковой инфекции на современном этапе является иммунопрофилактика!
Учитывая непредсказуемость изменений эпидемиологии МИ в России, для проведения вакцинации считается целесообразным использовать современные конъюгированные менингококковые вакцины с наиболее широким охватом серогрупп возбудителя. Такие многокомпонентные конъюгированные вакцины обладают более высокой иммуногенностью, обеспечивают длительный иммунитет, способствуют существенному снижению частоты носительства менингококков и, как следствие, формируют популяционный иммунитет в коллективах с достаточным охватом вакцинацией.
По данным ряда авторов, наиболее выраженное уменьшение числа клинических случаев заболевания МИ будет достигнуто за счет вакцинации в возрастных группах 0-1 год, 1-2 года, 3-6 лет [11]. Даже заниженная оценка выгод, не учитывающая всего объема предотвращенного ущерба, свидетельствует об очевидной важности расширения программ иммунизации против МИ и включения в них детей в возрасте 9 и 12 мес. Двукратная вакцинация детей в 9 и 12 мес, по данным российских экспертов, в сравнении с ее отсутствием наиболее сильно снизит прогнозируемое число случаев заболевания именно в этой возрастной когорте: в горизонте 15 лет -на 89%. Не менее мощный эффект ожидается в возрастных группах 1-2 года (на 84,5%) и 3-6 лет (на 73,6%) [11].
Заключение
Менингококковая инфекция остается серьезной и актуальной проблемой российского здравоохранения. Несомненно, с целью обеспечения максимальной защиты детей от летальных и инвалидизирующих случаев, обусловленных МИ, требуется совершенствование национального календаря прививок с внедрением вакцинации против МИ в наиболее уязвимых группах населения с пристальным вниманием к возрастной группе детей раннего возраста.
Литература
Осложнения острого бактериального менингита у новорожденного и детей
а) Васкулит представляет собой компонент патологического комплекса гнойного менингита. Он может привести к тромбозу вен или мелких и изредка крупных артерий с вторичными некрозами (Taft et al., 1986). Локализация ишемических очагов непостоянная, от четко отграниченных участков до диффузных некротических поражений, способных вызывать мультикистозную энцефаломаляцию. Ишемические повреждения встречаются и без тромбозов сосудов. Воспаление сосудистых стенок капилляров ЦНС может позволить микроорганизмам проникнуть в паренхиму мозга с появлением небольших очагов септических некрозов. Вероятно, такие некрозы дают начало абсцессам мозга, которые в редких случаях осложняют бактериальный менингит.
Васкулит шунтирующих вен также играет важную роль в генезе субдуральных кровоизлияний. Очаговая мозговая симптоматика, такая как гемиплегия или моноплегия, также являются следствием васкулита. Инфаркт в спинном мозге является необычным осложнением, связанным с вовлечением сосудов. Это было отмечено только в одном случае (Boothman et al., 1988). В случае появления двустороннего сенсорного или моторного дефицита в ходе течения бактериального менингита следует предположить инфаркт спинного мозга (Glista et al., 1980). Другие необычные неврологические симптомы включают в себя двигательные расстройства (Burstein и Breningstall, 1986), дисфункцию гипоталамуса и центральный несахарный диабет (Greger et al., 1986). Нейровизуализация позволяет тонкую оценку типа и локализации соответствующих поражений. Они обычно представлены участками пониженной плотности с периартериальной или более широкой локализацией. Некоторые поражения могут содержать геморрагический компонент.
Очаговая мозговая симптоматика, такая как паралич III, VI или реже VII черепных нервов, встречается при пересечении воспаленных лептоменингеальных пространств. Такие параличи обычно возникают как следствие перенесенного менингита. Ранее сообщалось об опсоклонусе (Rivner et al., 1982).
Припадки, которые встречаются у 30-40% детей, страдающих острым бактериальным менингитом, могут быть вторичными в связи с лихорадкой или возбуждением мозга при их генерализации и развитии на ранних стадиях заболевания. Парциальные припадки из-за локализованного поражения полушарий, как правило, развиваются в результате васкулита. В некоторых случаях развивается эпилептический статус, требующий незамедлительного лечения для предотвращения стойких повреждений.
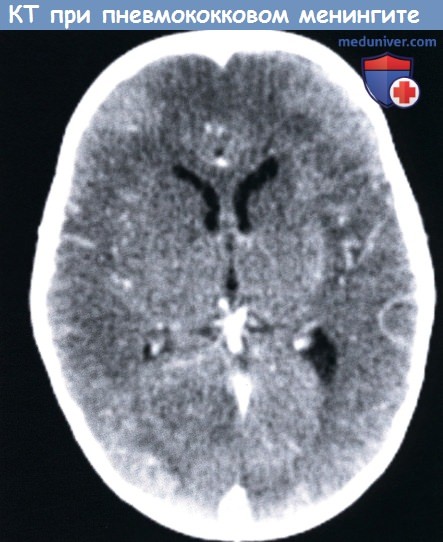
КТ с контрастным усилением у десятимесячного мальчика с пневмококковым менингитом: мозговой инфаркт вызванный васкулопатией,
небольшая левосторонняя субдуральная эмпиема и тромбоз заднего саггитального синуса.
б) Субдуральные кровоизлияния все больше признаются в качестве осложнений острого бактериального менингита и встречаются у 20-50% больных детей, но обычно в виде ограниченного слоя и объема клинически они малозначимы (Syrogiannopoulos et al., 1986, Cabral et al., 1987). Большинство кровоизлияний локализуются с обеих сторон над лобно-теменными областями. Субдуральная жидкость редко содержит кровь, но имеет непропорционально высокое соотношение альбумина с глобулином (Rabe et al., 1968). Постоянная или рецидивирующая лихорадка, очаговая неврологическая симптоматика и устойчиво положительные культуры СМЖ, вероятно, более тесно связаны с повреждениями коры, чем с наличием кровоизлияний (Syrogiannopoulos et al., 1986; Snedeker et al., 1990). Массивные кровоизлияния, сопровождающиеся увеличением окружности головы или повышением ВЧД, встречаются редко, но требуют выполнения дренирования.
Большинство субдуральных скоплений разрешается самостоятельно. Snedeker et al. (1990) обнаружили, что пациенты с кровоизлияниями более склонны к неврологическим расстройствам и судорогам на протяжении острого периода заболевания, но потеря слуха, приступы и задержка развития не встречались с большей частотой при последующем наблюдении. Субдуральная эмпиема является редкой (Jacobson и Farmer, 1981). Эмпиема часто характеризуется сохранением лихорадки и симптомов инфекции и признаков, связанных с очаговой симптоматикой, такой как судороги и гемиплегии. Диагноз устанавливается на основании методов нейровизуализации, которые показывают скопления вне ткани мозга с периферическим усилением сигнала. Диффузионно-взвешенные изображения (ДВИ) оказались эффективными для дифференциальной диагностики кровоизлияний и эмпиемы (Hunter и Morriss, 2003).
в) Повышенное внутричерепное давление (ВЧД) тяжелой степени является серьезным осложнением бактериального менингита и может возникнуть в результате разных механизмов: гидроцефалия из-за измененной абсорбции СМЖ или нарушенного тока, или в связи с отеком ткани мозга. Острая гидроцефалия вызвана повышенной резистентностью к циркуляции и резорбции ликвора из-за наличия тонкого лептоменингеального экссудата в базальных цистернах или по конвекситальной поверхности мозга вблизи пахионовых грануляций, или вследствие вентрикулита с обструкцией водопровода. Это обычно преходящее явление, но может привести к возникновению поздней гидроцефалии, если разовьется обширный менингеальный фиброз. Отек мозга., очевидно, происходит в результате нескольких механизмов. Они включают в себя цитотоксический отек, ускоренный гибелью клеток из-за инфекции, вазогенный отек из-за увеличенной капиллярной проницаемости, связанной с воспалительным ответом на инфекционный процесс, и интерстициальный отек при нарушении обычной резорбции СМЖ. SIADH может встречаться с острым бактериальным менингитом (Kaplan и Feigin, 1978) и приводить к гипонатриемии и гипотонии внеклеточной жидкости, усугубляя отек мозга.
Клинические проявления высокого ВЧД не всегда могут быть очевидны. Они включают снижение уровня сознания, головную боль и рвоту, напряжение родничка и расхождение швов, патологический зрачковый ответ и гипертензию с брадикардией (рефлекс Кушинга). Отек сосочка зрительного нерва встречается редко, особенно на ранних стадиях. Компьютерная томография может выявить исчезновение дифференцировки на серое и белое вещество, сдавление желудочков и борозд и уменьшенные базальные цистерны. МРТ может показать набухание извилин, а ДВИ поможет при различении цитотоксического отека (ограниченное распространение) от вазогенного отека. Мониторинг ВЧД может быть неотъемлемой частью лечения в случаях выраженной или устойчивой внутричерепной гипертензии (Goitein et al., 1983; Minns et al., 1989). Лечение заключается в фиксации головного конца кровати с подъемом, примерно на 30° и назначении маннитола или других гиперосмолярных веществ (для уменьшения цитотоксического отека). Более активные меры описаны в отдельной статье на сайте. Внутричерепная гипертензия связана с уменьшением мозговой перфузии и сниженной скоростью кровотока в мозге (McMenamin и Volpe, 1984), так что необходимо избегать даже незначительных эпизодов системной гипотонии, способных приводить к серьезным последствиям (Kaplan и Fishman, 1988).
в) Вентрикулиты почти постоянно встречаются у новорожденных детей с менингитом, но сравнительно редки у детей старшего возраста. Когда вентрикулит сопровождается стенозом сильвиева водопровода, инфекция становится ограниченной (пиоцефалия) и может проявляться как абсцесс мозга. В большинстве случаев диагноз вентрикулита ставится по устойчиво положительным культурам ликвора с наличием или без клинических проявлений. Сканирование мозга может позволить определить вентрикулит с аномальным расширением желудочков мозга и отеком прилежащих перивентрикулярных областей белого вещества. В полостях желудочков может появляться взвесь (Fukui et al., 2001). Вентрикулит может отреагировать на высокие дозы парентеральных антибиотиков, но может потребоваться местное лечение и дренирование. При отсроченном лечении у выживших развивается склонность к гидроцефалии.
Устойчивая лихорадка и другие септические осложнения являются результатом одновременной бактериемии. Они включают септический артрит, перикардит, пневмонию, эндофтальмит и гипопион (Kaplan и Fishman, 1988). Артрит, появляющийся через 5-7 дней антибиотикотерапии, вероятно, опосредован иммунными механизмами и часто реагирует на противовоспалительные средства (Rush et al., 1986). В тяжелых случаях могут наблюдаться гастроинтестинальное кровотечение, анемия и диссеминированное внутрисосудистое свертывание, особенно, но не исключительно при менингококковом менингите. В 13% случаев лихорадка продолжается 10 дней и более, особенно при пневмококковом менингите, и вторично рецидивирует у 16% пациентов (Lin et ah, 1984). Лихорадка может быть связана с сохранением очагов воспаления, поверхностным тромбофлебитом из-за внутривенных инфузий, нозокомиальных инфекций или септических или асептических абсцессов. Чаще всего причина не выявляется. В таких случаях показана люмбальная пункция. Если ребенок на вид здоров и показатели СМЖ приближаются к нормальным, антимикробная терапия может быть прекращена в обычные сроки.
МРТ в Т1 -режиме: билатеральные значительные экстрааксиальные скопления,
преимущественно в субдуральном пространстве, у ребенка с пневмококковым менингитом. MPT до контрастирования (слева) и после контрастирования (справа):
вентрикулит и вторичная гидроцефалия как осложнение двустороннего менингоэнцефалита.
г) Неврологические осложнения. Неврологические осложнения затрагивают почти половину пациентов, перенесших менингит, и даже у лиц с нормальными познавательными способностями в сравнении с бывшим ранее качество жизни значительно снижается. Наиболее распространенными проблемами, наблюдающимися после менингита, являются трудности с обучением и нейромоторные расстройства, потеря слуха, эпилепсия, речевые и языковые проблемы, рубцы (особенно после менингококковой инфекции), нарушения зрения и заболевания глаз, и нарушения поведения. Результаты исследований сильно варьируют, также зависящие от этиологии микроорганизмов.
Тяжелый дефицит обучения и нейромоторный дефицит обнаружены у 5-10% детей (Grimwood et ah, 1995, 2000; Bedford et ah, 2001), перенесших бактериальный менингит, немного хуже последствия среди новорожденных (11%) (Stevens et ah, 2003) и в развивающихся странах. Подавляющее большинство этих детей обучаются по специальным программам или посещают специальные школы. Эти дети с более высокой частотой осложнений имеют худший исход. Существуют некоторые расхождения между результатами различных исследований.
Feldman и Michaels (1988) сообщили, что успехи в школьном обучении 10-12-летних детей после гемофильного менингита (Н. influenzae) не имели значимых отличий от их сибсов, не отмечено неспособности к обучению, дефицита внимания или поведенческих отклонений. Pomeroy et ah (1990) и Taylor et ah (1990) также обнаружили более низкий уровень стойких осложнений (всего примерно 14%) и лишь 1% и 4% пациентов соответственно стали тяжелыми инвалидами. Baraffet ah, (1993) проанализировали исходы у 4920 детей, перенесших менингит, в 45 опубликованных работах после 1955 г. Из этих детей 1602 ребенка были включены в 19 проспективных исследований, проведенных в развитых странах, у 4,2% были выявлены расстройства обучения или умственная отсталость; у 3,5% наблюдались мышечные спазмы или парезы; у 4,2% судороги; у 16,4% отмечался минимум один основной неблагоприятный исход, включая интеллектуальные осложнения, неврологический дефицит, судороги или глухоту. Различные возбудители были связаны с разными исходами; худшие исходы наблюдались у перенесших пневмококковый менингит, 15,3% развившихся осложнений по сравнению с 7,5% у детей с менингитами, вызванными N. meningitidis и 3,8% с H. influenzae. Grimwood et ah (1995) исследовали 158 детей, выживших после менингита в период между 1983 и 1986 годами (74% с H. influenzae тип В): в 8,5% случаев дефицит был значительным (IQ
Нейросенсорная тугоухость среднетяжелой и тяжелой степени встречается у 10% детей с менингитом (Pomeroy et ah, 1990; Taylor et ah, 1990; BarafF et ah, 1993) и является двусторонней в 4-5% случаев. Потеря слуха, как полагают, развивается в результате лабиринтита, предположительно, в связи с распространением воспаления из субарахноидального пространства через водопровод улитки (Kaplan et ah, 1981;Eaveyetah, 1985).Риск развития глухоты повышается, если концентрация глюкозы в ликворе при госпитализации менее 1,1 ммоль/л (Dodge et ah, 1984), при судорогах наблюдавшихся до поступления и если стерилизация СМЖ запаздывает. Лечение цефуроксимом связано с задержкой стерилизации ликвора по сравнению с цефтриаксоном, и это могло повлиять на ранние испытания дексаметазона (Schaad et ah, 1990; van de Beek et ah, 2007). Глухота, видимо, появляется рано при менингите. Это трудно обнаружить клинически, поэтому систематическая оценка слуха должна проводиться до выписки из стационара по вызванной при аудиометрии реакции (Vienny et ah, 1984; Cohen et ah, 1988).
Повторное обследование рекомендовано после выписки, если отклонения выявлялись при первоначальной оценке. Ранние вызванные реакции могут быть с временными изменениями примерно в 20% случаев, с восстановлением за 1-2 месяца (Vienny et al., 1984). Тугоухость не связана с возрастом пациентов и продолжительностью заболевания до госпитализации, таким образом, маловероятно ее предотвращение при постановке раннего диагноза. Использование дексаметазона в лечении уменьшает частоту нарушения слуха. Глухота чаще отмечается у детей с атаксией, но встречается и при ее отсутствии у большинства пациентов. Атаксия, по всей вероятности, имеет вестибулярное происхождение, хотя в некоторых случаях возможны дисфункции мозжечка (Kaplan et al., 1981). Практически все пациенты в состоянии компенсировать дефицит баланса за несколько недель и месяцев.
Стойкая эпилепсия встречается у 2-5% пациентов (Pomeroy et al., 1990; Taylor et al., 1990; Baraff et al., 1993). Она может быть изолированной, но часто связана с трудностями в обучении и другими неврологическими осложнениями разной степени тяжести. Такие осложнения являются следствием паренхиматозных изменений в результате прямого или токсического воздействия патогенных микроорганизмов, васкулитов, и возможно, гипоксии и повышенного ВЧД.
Хроническая гидроцефалия — нетипичное последствие острого детского бактериального менингита. Она вызывается менингеальным фиброзом базальных цистерн или конвекситальной поверхности мозга, или стенозом сильвиева водопровода в результате гранулематозного эпендиматита. Хроническая гидроцефалия может быть следствием ранней обструктивной гидроцефалии. Чаще всего она развивается незаметно, оставаясь нераспознанной в течение недель и месяцев. Поэтому после перенесенного менингита у новорожденных показано систематическое ультразвуковое обследование ЦНС, так как расширение желудочков может развиться задолго до увеличения окружности головы. Ведение на ранних стадиях осуществляется путем внешнего дренажа с последующим шунтированием.
Другие неврологические осложнения включают гемиплегию, тетраплегию и слабость в конечностях, которые встречаются у 1 -4% пациентов. Слепота вследствие гнойного менингита развивается редко. Это может быть связано с внутриглазной патологией, с невритом глазного нерва или иметь кортикальное происхождение.
Клиника менингококкового менингита. Формы менингококкового менингита
Менингококковый менингит у детей раннего возраста имеет ряд клинических особенностей. Начало болезни чаще острое, однако у 8—10% детей признаки болезни нарастают постепенно. Температура в большинстве случаев не повышается. В первые дни болезни преобладают инфекционно-токсические симптомы, особенно у новорожденных и детей 1-го года жизни. Общемозговые симптомы (судороги, потеря сознания) наблюдаются лишь у 15—17% детей.
Менингеальные симптомы нерезко выражены, а у 25—30% вообще отсутствуют. У некоторых больных в первые дни заболевания на коже появляется эритематозная или кореподобная сыпь, которая держится кратковременно. На 3—4-й день болезни на коже и слизистых могут появиться герпетические высыпания. У детей 1-го года жизни они наблюдаются редко.
Изменения в спинномозговой жидкости характерны для гнойного менингита.
Сверхострые формы менингококкового менингита, часто заканчивающиеся летально, наблюдаются у 3—8% больных. Состояние больных очень тяжелое с первых часов болезни. Лицо гиперемнровано или цианотично. Сознание отсутствует. Судороги носят преимущественно тонический характер. Дыхание частое, поверхностное, с нарушением ритма; брадикардия, гипертермия. Тяжесть состояния обусловлена отеком и набуханием мозга и вклинением ствола мозга в большое затылочное отверстие. Острый отек мозга связан в основном с токсикозом, а также с аллергическими и аутоаллергическими процессами в нервной системе. Синдром отека-набухания мозга при молниеносной форме менингита иногда сочетается с острой надпочечниковой недостаточностью, приводящей к коллапсу. Смерть может наступить в 1-е сутки заболевания.
По данным С. Л. Кипнис (1979), у 72% больных, умерших при этой форме заболевания, имели место изменения в надпочечниках: кровоизлияния, дистрофия, некробиоз.
Менингококцемия — другая форма менингококковой инфекции. Основным ее проявлением является резко выраженная интоксикация. Дети бледные, вялые, отказываются от еды, много пьют; Дыхание частое, поверхностное; тахикардия, сухость кожных покровов, рвота, обложенный язык, метеоризм, частый жидкий стул.
На фоне повышенной температуры и общего токсикоза через несколько часов на коже появляется геморрагическая сыпь, сочетающаяся нередко с розеолезной или розеоло-папулезной. Сыпь располагается на ягодицах, задней поверхности бедер, веках, реже — на руках и лице. Патоморфологически кожные высыпания представляют собой бактериальные тромбы с перифокальным поражением сосудов и экстравазатами. Такие тромбы могут также быть в синовиальной оболочке суставов, сосудистой оболочке глаз, надпочечниках, реже в эндокарде, печени, почках.
У детей раннего возраста менингококцемия обычно сочетается с менингитом вследствие повышенной проницаемости гематоэнцефалического барьера и низкой иммунобиологической активности организма. При этом кроме воспалительных изменений в оболочках мозга наблюдаются множественные кровоизлияния.
В некоторых случаях менингококцемия протекает сверхостро по типу бактериального эндотоксического шока (синдром Уотерхаузена—Фридриксена). Среди полного здоровья повышается температура, ребенок резко бледнеет, становится адинамичным. На коже туловища и конечностей появляется обильная, крупная, геморрагическая сыпь с участками некроза. Местами она имеет багрово-синюшную окраску, напоминающую трупные пятна.
Тоны сердца глухие, пульс слабого наполнения, нитевидный, тахикардия. Артериальное давление катастрофически падает. Развиваются сосудистый коллапс, анурия, иногда наблюдаются профузные желудочные кровотечения. В крови отмечается метаболический ацидоз. Значительно повышена свертываемость крови, увеличено количество фибриногена, протромбина. В более поздней стадии свертываемость крови уменьшается, резко снижается количество тромбоцитов. Больные умирают через несколько часов после появления первых симптомов заболевания. При патоморфологическом исследовании определяются кровоизлияния в надпочечники и другие внутренние органы, очаги некроза в миокарде, почечных канальцах, головном мозге.
В основе механизма развития эндотоксического шока при менингококцемии лежат нарушения гемодинамики, микроциркуляции, вызывающие гипоксию. Нарушение свертываемости крови (феномен повышенной впутрисосудистой коагуляции) приводит к образованию множества мельчайших тромбов. Возникновение кровоизлияний во внутренних органах обусловлено истощением факторов свертывания (коагулопатия потребления). Частое поражение надпочечников связывают с повышенным кровенаполнением этих органов. Полагают, что основным механизмом развития шока является генерализованная анафилактическая реакция.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Среди инфекционных болезней одной из опасных для жизни и непредсказуемых по молниеносности течения является менингококковая инфекция (МИ). Актуальность проблемы заключается в том, что при возникновении МИ требуется особый подход к организации диагностики и оказания скорой и неотложной медицинской помощи, ввиду того, что генерализованные формы МИ (наиболее часто встречающиеся в детском возрасте) при поздно начатом лечении могут приводить к смертельным исходам.
Для отечественных педиатров проблема МИ имеет особо значение, так как уровень заболеваемости среди детей всегда превышает таковую у взрослых в несколько раз, достигая 8–11 случаев на 100 тыс. населения. Более 50% от общего числа заболевших составляют дети до 5 лет (табл.1) [1]. Именно у детей высока частота развития генерализованных форм МИ. В значительной степени риск летального исхода при МИ зависит от возраста ребенка: чем он младше, тем выше вероятность неблагоприятного исхода. До 75% от числа умерших при МИ составляют дети до 2 лет, при этом доля детей первого года жизни достигает 40% (табл.2) [1].
Таблица 1
Возрастное распределение заболевших 2002–2004 годы
n=4972 (36 регионов РФ)
| 1–11 мес. | 1 г. | 2–4 г. | 5–9 л. | 10–14 л. | 15–19 л. | 20–24 л. | 25–44 л. | 45–64 л. | 65 л. + | Всего | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2002 | 0,13 | 18,8 | 12,4 | 16,9 | 10,1 | 10,4 | 9,3 | 4,8 | 8,4 | 6,9 | 1,8 | 100 |
| 2003 | – | 23,5 | 11,9 | 15,2 | 9,7 | 8,3 | 8,2 | 3,8 | 8,4 | 8,6 | 2,5 | 100 |
| 2004 | 0,2 | 1,3 | 13,2 | 15,8 | 8,13 | 5,4 | 10,4 | 4,6 | 9,8 | 8,7 | 2,4 | 100 |
| Всего | 0,1 | 21,5 | 2,4 | 15,9 | 9,3 | 8,0 | 9,2 | 4,3 | 8,8 | 8,1 | 2,3 | 100 |
Таблица 2
Возрастное распределение летальных случаев 2002–2004 годы
n=582 (36 регионов РФ)
| 1–11 мес. | 1 г. | 2–4 г. | 5–9 л. | 10–14 л. | 15–19 л. | 20–24 л. | 25–44 л. | 45–64 л. | 65 л. + | Всего | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2002 | 0,6 | 28,4 | 12,3 | 16,7 | 0,7 | 3,7 | 4,9 | 1,9 | 7,4 | 14,2 | 6,2 | 100 |
| 2003 | – | 30,4 | 12,1 | 9,2 | 3,8 | 4,6 | 5,4 | 0,4 | 10,4 | 18,3 | 5,4 | 100 |
| 2004 | 0,6 | 26,1 | 17,8 | 12,2 | 3,9 | 1,7 | 5 | 1,1 | 11,1 | 14,4 | 6,1 | 100 |
| Всего | 0,3 | 28,5 | 13,9 | 12,2 | 3,8 | 3,4 | 5,2 | 1,0 | 9,8 | 16,0 | 5,8 | 100 |
Эпидемиология
С 1962 года в ряде стран Европы и Азии, Канаде и США, а с 1968 года – и в нашей стране отмечается подъем заболеваемости МИ. Данные анализа глобальной эпидобстановки в 2005 году свидетельствуют о том, что в странах субсахарной Африки показатели заболеваемости МИ в целом колеблются от 100 до 800 случаев на 100 тыс. населения, а летальности – до 14%; предоминирует серогруппа менингококка А. На Европейском континенте наиболее высокий уровень заболеваемости МИ регистрировался в Исландии и Ирландии – 5–6,6 случаев на 100 тыс. населения, где предоминирует серогруппа В. А в странах Океании (Новая Зеландия) показатель заболеваемости МИ составил в этот период 14,5 случаев на 100 тыс. населения. В России с 1999 года в Астраханской, Пермской, Челябинской, Кемеровской, Новосибирской, Омской областях, в Хабаровском крае произошел значительный прирост МИ – на 22–40% – и составил 8,2 случая на 100 тыс. населения. В целом в 40 регионах страны в последние годы наблюдается снижение показателей заболеваемости этой инфекцией (рис. 1) [2, 3]. В общей серогрупповой характеристике по стране преобладают менингококки серогруппы А.

Рисунок 1
Территориальное распространение заболеваемости 2005 год.
n=2771 на 100000 населения
МИ характеризуется периодичностью – интервалы между отдельными подъемами заболеваемости составляют от 4 до 12–15 лет. Рост заболеваемости в эти периоды регистрируется в основном среди городского населения за счет скученности в транспорте и помещениях в холодное время года. Наиболее доказательна связь периодичности МИ с эпидемическими подъемами ОРВИ и гриппа с пиком в зимне-весенний период года.
Заболевают преимущественно дети и лица молодого возраста, чаще в закрытых коллективах.
Группой риска по развитию септических и гипертоксических форм МИ являются дети раннего возраста.
Установлена генетическая предрасположенность к заболеванию МИ и ее рецидивов у лиц, имеющих HLA антигены В12, В16, дефицит факторов комплемента С2–С8, пропердина, IgG2 и IgM [Самуэльс М., 1997]. Популяционная устойчивость к МИ, по мнению ряда исследователей, связана с локусом HLA–A1 антигена гистосовместимости.
Этиология
МИ является типичным антропонозом. Возбудитель – Neisseria meningitidis, грам-отрицательный диплококк, вырабатывающий экзо-и эндотоксин, который очень неустойчив во внешней среде.
Выделяют более 13 серотипов менингококка, при этом иммунитет – типоспецифический. По капсульным полисахаридам бактерии разделяют на серологические группы А, В, С, D43, D44, X, Y, Z, 29Е, W-135. По антигенам в мембранных протеинах различают более 20 серотипов и субтипов менингококка. По иммунотипам липополисахарида – более 11 иммунотипов. Доказана способность менингококков образовывать L-формы, которые вероятно могут обусловливать затяжные варианты менингита.
Патогенез
В развитии МИ ведущую роль играют три фактора: возбудитель, его эндотоксин и аллергизирующая субстанция. В месте входных ворот чаще всего не возникают воспалительные изменения, но при этом менингококк вегетирует, возникает менингококконосительство. Лишь в 10–15% случаев при снижении резистентности организма возможно развитие воспалительного процесса в носоглотке в виде менингококкового назофарингита. Если менингококки преодолевают местные защитные барьеры, распространение их происходит по лимфатическим путям в кровь. Менингококки в виде бактериальных эмболов заносятся в различные органы и ткани. В тех случаях, когда преодолевается гемато-энцефалический барьер, развивается гнойный менингит или менингоэнцефалит. При этом возможно проникновение возбудителя в оболочки мозга, минуя гематогенное распространение – через решетчатую кость по лимфатическим путям и влагалищам нервных волокон. Такой вариант возможен в случаях дефекта решетчатой кости или черепно-мозговой травмы. Сверхострый менингококковый сепсис развивается в результате массовой бактериемии и эндотоксинемии. При массовом распаде менингококков высвобождаемый эндотоксин воздействует на эндотелий сосудов и мембраны клеток крови, приводя к расстройству микроциркуляции [8]. В результате генерализованного повреждения эндотелия сосудов происходит закрытие дефектов тромбоцитами, агрегация которых провоцирует высвобождение тромбоксана и угнетение синтеза простациклина. Нарушаются реологические свойства крови: происходит агрегация форменных элементов, на которых фиксируется фибрин. Кроме того, важное значение имеет воздействие липида А эндотоксина на моноциты макрофаги, которые активизируясь выбрасывают ФНО-α – первичный медиатор токсических эффектов при токсическом шоке. Кроме него, в развитии септического шока колоссальную роль играют оксид азота, простагландины, факторы комплемента, гистамин, лейкотриены, фактор активации тромбоцитов и ИЛ-1, 2, 6, 8. Высвобождается избыточное количество биологически активных веществ (катехоламины, серотонин, гистамин), активизируются системы фактора Хагемана, калликреин-кининовая, свертывающая и в последующем фибринолитическая. Из печени мощно выбрасываются протромбин, калликреин и др., что в конечном счете приводит к гиперкоагуляции с образованием большого количества бактериальных тромбов в мелких сосудах (тромбогеморрагический синдром с бактериальной эмболией).
Таким образом, септический шок при МИ имеет одновременно признаки гиповолемического (недостаток объема крови), распределительного (нарушение сосудистого тонуса) и кардиогенного (недостаточность сердечного выброса) шока. Существует стадийность в его развитии.
Клинические проявления
МИ представлена разнообразными клиническими формами – от локализованных (назофарингита и менингококконосительства) до генерализованных, среди которых – молниеносные, крайне тяжелые, чаще приводящие к летальному исходу в течение нескольких часов.
Диагностировать менингококковый назофарингит на основании клинической картины, без указания на соответствующий эпиданамнез, затруднительно. До 80% всех форм МИ составляет менингококковый назофарингит. В клинической картине заболевания наиболее типичными симптомами являются заложенность носа, першение в горле, гиперемия и отечность задней стенки глотки с гипертрофией лимфоидных образований на ней, отечность боковых валиков и слизь в небольшом количестве. Гиперемия имеет синюшный оттенок. Распространено мнение о легком характере течения этой формы МИ. В зависимости от уровня лихорадки и выраженности интоксикации различают легкую, среднетяжелую и тяжелую формы болезни. При тяжелой форме доминирует гипертермический синдром, менингизм, у детей первых лет жизни – судорожный синдром. Чаще такие пациенты расцениваются как больные ОРВИ с судорожным синдромом или серозным менингитом на момент госпитализации, и только высев менингококка позволяет адекватно верифицировать диагноз и проводить этиотропную терапию [9]. Нельзя забывать о том, что нередко у детей назофарингит предшествует развитию генерализованных форм болезни, в том числе и с летальным исходом.
Носительство менингококка в коллективах достигает более 40% (в зависимости от эпидситуации). У детей первых лет жизни менингококконосительство встречается редко.
Среди генерализованных форм различают менингококцемию (может протекать в легкой, среднетяжелой, тяжелой и молниеносной формах в виде менингококкового сепсиса), менингококковый менингит, менингоэнцефалит и смешанные формы (менингококцемия + менингит).
Для менингококцемии характерно острое, внезапное начало, критериями тяжести являются степень выраженности интоксикации, характер, величина, распространенность, наличие некрозов и продолжительность элементов сыпи, из которых может высеваться менингококк. При легкой форме элементы представлены розеолами, папулами, мелкими геморрагиями, которые бесследно исчезают к 3-му дню болезни. При среднетяжелой форме элементы преимущественно крупные, геморрагические, с поверхностным некрозом в центре. Сыпь более продолжительная – до 7–10 дней. Для тяжелых и септических молниеносных форм характерны обширные кровоизлияния на коже с глубокими некрозами и их отторжением, при которых могут формироваться косметические дефекты на теле. Эти формы часто сопровождаются маточными, носовыми, желудочно-кишечными кровотечениями, в том числе и на глазном дне. Отмечаются поражения сердца (эндокардит, миокардит, панкардит), суставов, легких, печени, почек, надпочечников.
На современном этапе выявлена зависимость ликворологических изменений (плеоцитоза и протеинрахии) от серогруппы. При заболевании, вызванном менингококком серогруппы С, эти показатели значительно выше, чем при МИ, вызванной менингококком В.
Среди больных МИ отдела нейроинфекций НИИ детских инфекций отмечено, что менингит развивался у лиц с дефектным преморбидным фоном со стороны ЦНС перинатального генеза [6]. Как наиболее частые неотложные состояния при менингококковом менингите в остром периоде заболевания регистрировались: отек головного мозга, внутричерепная гипертензия, инфекционно токсический шок, инфаркт мозга, субдуральный выпот, синдром неадекватной секреции антидиуретического гормона, диэнцефальная дисфункция и нейросенсорная тугоухость.
При менингоэнцефалите с первых дней болезни появляются очаговые симптомы на фоне нарушенного сознания, в виде поражения отдельных черепно-мозговых нервов, корковых и подкорковых парезов или параличей. Могут быть общие или локальные судороги. Характерны очень тяжелое течение, неблагоприятный прогноз – в исходе эпилепсия, гидроцефалия, грубая задержка психомоторного развития. Летальность высокая.
Диагностика
Верификация инфекции осуществляется бактериоскопическим (мазок и толстая капля крови, ликвор), бактериологическим (мазок слизи из носоглотки, посев крови, ликвора), серологическим (РНГА, РА, ИФА) и экспресс-методами (латекс агглютинации, ВИЭФ).
На современном этапе при менингите диагностический мониторинг включает НСГ для оценки состояния желудочков, субарахноидального пространства и цветовое доплеровское (дуплексное) картирование для дифференциации субарахноидального выпота от субдурального. Динамически оценивается ЭЭГ.
Лечебная тактика
На догоспитальном этапе при подозрении на менингококцемию (в том числе и смешанную форму МИ) терапию следует начинать немедленно, на дому, с последующей госпитализацией.
При судорожном синдроме (наряду с указанной терапией) вводят внутримышечно Реланиум из расчета 0,1 мл/кг. При отсутствии эффекта включают в терапию Дроперидол в сочетании с Ангальгином, оксибутират натрия. При дебюте менингита судорогами планово назначается длительная терапия препаратами вальпроевой кислоты (Конвулекс и др.), что снижает риск развития постменингитной эпилепсии.
Для предупреждения токсического шока вводят преднизолон (внутримышечно или внутривенно) в дозе 2 мг/кг. При выраженном менингеальном синдроме – 25% ную сернокислую магнезию (1 мл/год жизни) или Лазикс – 1–2 мг/кг внутримышечно.
Введение антибиотика в течение первого часа транспортировки не рекомендуется, а в случае длительной транспортировки стартовым препаратом является левомицетина сукцинат в разовой дозе 25 мг/кг, который вводится не более 2 суток.
Состояние больного оценивается под постоянным контролем АД, частоты пульса, дыхания, диуреза, окраски и температуры кожных покровов, нарастания количества и качества элементов экзантемы и сознания больного. При подозрении на молниеносный вариант генерализованной формы МИ госпитализация осуществляется реанимационной бригадой, которая проводит немедленные реанимационные мероприятия на дому в зависимости от степени септического шока (алгоритм действия перманентно осуществляется при транспортировке больного и продолжается в ОРИТ).
Важным в алгоритме оказания немедленной помощи при септическом шоке является нормализация гемодинамики, микроциркуляции, борьба с ацидозом и гипоксией. Противошоковый эффект достигается введением высоких доз гидрокортизона в сочетании с преднизолоном или его аналогами. Проводится инфузионная терапия, состав которой определяется показателями коллоидно-осмотического давления (альбумина 45–52 г/л и натрия 140–145 ммоль/л). Базовыми растворами являются 5% ная глюкоза, физиологический раствор или раствор Рингера. Соотношение вводимых коллоидов/кристаллоидов – 1:3. Физиологический раствор вводится с целью купирования гиповолемии, при резком падении АД – струйно, а при умеренном его снижении – внутривенно капельно. Под контролем КОС вводится 4%-ный раствор бикарбоната натрия внутривенно медленно, капельно по показателю дефицита оснований, в количестве, равном массе тела (в килограммах), умноженной на ВЕ : 2.
С учетом развития генерализованного васкулита с поражением эндотелия сосудов назначаются ангиопротекторы: Инстенон, Кавинтон, Актовегин, Весел Дуэ Ф (сулодексид).
Постоянно должна проводиться оксигенация, вплоть до ИВЛ, начиная с момента оказания помощи на дому.
После отмены левомицетина сукцината назначается пенициллин в дозе 300 тыс. ед/кг массы тела, 6 введений в сутки, а у детей до 3-месячного возраста – 500 тыс. ед/кг, 8 введений. Более комплаентным и альтернативным пенициллину препаратом является цефтриаксон (Роцефин), который вводится однократно в сутки внутривенно или внутримышечно в дозе 100–150 мг/кг массы в течение 5 дней при менингококцемии, а при менингите – до 10 дней. При тяжелом или затяжном менингите левомицетина сукцинат вводится эндолюмбально, в разовой дозе 10–15 мг.
При ДВС-синдроме назначаются при гиперкоагуляции – Трентал, реополиглюкин, коллоиды, а при гипокоагуляции – свежезаготовленная плазма, ингибиторы протеолиза. При отеке/набухании головного мозга после стабилизации центральной гемодинамики проводится постоянно дегидратационная терапия (Лазикс, Маннитол).
При клинико-ЭЭГ-мониторинге менингита с эпилептической симптоматикой проводится коррекция терапии антикольвунсантами. При неэффективности Конвулекса назначают топиромат (Топамакс).
С учетом длительности антибиотикотерапии в больших дозах, в последние годы предлагается хорошо зарекомендовавшая себя системная энзимотерапия Вобэнзимом, которая оказывает потенцирующий антибиотический, противовоспалительный, антитоксический, гепатопротективный и иммуномодулирующий эффекты, способствуя элиминации токсических субстанций, патогенных иммунных комплексов, иммунных депозитов из тканей, что укорачивает течение и уменьшает тяжесть генерализованных форм МИ [5, 6].
После выписки из стационара реконвалесценты генерализованных форм МИ находятся под диспансерным наблюдением педиатра и невропатолога, во время которого устраняются последствия болезни методами комплексной реабилитации.
При носительстве менингококка и нетяжелом назофарингите госпитализация проводится только по социально бытовым показаниям и из закрытых учреждений.
Назначаются ампициллин, левомицетин в возрастных дозировках в течение 4 дней или вводится внутримышечно Роцефин в течение 3 дней в дозе 125 мг (до 12 лет) и 250 мг у более старших. Спустя 3 дня проводится бактериологическое исследование, и при его отрицательном результате ребенок допускается в коллектив.
При длительном менингококконосительстве проводится повторный курс антибиотикотерапии в сочетании с препаратами иммунореабилитации.
С целью профилактики заболевания у лиц, контактировавших с больным МИ, проводится терапия, подобная лечению локализованных форм.
На коллектив накладывается карантин на 10 дней с момента изоляции больного, проводится наблюдение педиатра и лор-врача. В первые 5–10 дней проводится экстренная профилактика МИ вакцинами А или А+С детям старше года, подросткам и взрослым. Либо при выявлении других серогрупп менингококка в эти же сроки (не позже 7 дней от момента контакта) проводится пассивная профилактика нормальным иммуноглобулином.
После легкой формы МИ вакцинация детям согласно календарю прививок может проводиться спустя месяц после выздоровления. После тяжелых и смешанных форм МИ вакцинация (при отсутствии противопоказаний у невропатолога) может проводиться не ранее 3 месяцев после выздоровления.
Профилактика
В целях предупреждения распространения МИ необходимо проводить вакцинацию детей повышенного риска заражения в возрасте от 1,5 лет: посещающих детские дошкольные учреждения; находящихся в учреждениях с круглосуточным пребыванием (дома ребенка, детские дома); учащихся 1–2 классов общеобразовательных школ и школ–интернатов.
Читайте также:

