На начальных этапах инфекционного процесса преобладает симпатическая
Обновлено: 26.04.2024
Переборов сопротивление ослабленных ресничек, возбудитель попадает в носоглотку и поддается действию высокоактивного секрета клеток. Белки секрета слизистых желез способны неспецифически ингибировать гемагглютинирующую и инфекционную активность вируса гриппа. Это действие обусловлено наличием в секрете гликопротеидов, которые содержат значительное количество N-ацетилнейраминовой кислоты. Существуют сезонные колебания содержания ингибиторов. Наиболее активны они в летне-осенний период, а в период эпидемии гриппа (зима) содержание ингибиторов снижается. Погибшие клетки отрываются и захватываются макрофагами, а также удаляются с секретом дыхательных путей. В подслизистом слое в результате высвобождения биологически активных веществ (гистамин, серотонин, кинины, простагландины) возникает реакция сосудов, форменных элементов крови, образование мелких тромбов и кровоизлияний, диапедез мо-нонуклеаров и нейтрофильных лейкоцитов, отек, местные нарушения метаболизма, изменения рН среды в кислую сторону и тому подобное. При этом патологический воспалительный процесс наиболее выражен в трахее и бронхах.
Наличие токсикоза при гриппе является существенной особенностью патогенеза. Симптомы интоксикации являются следствием резорбции токсичных субстанций вирусов, продуктов нарушенного обмена веществ, что прямо или опосредованно влияет на органы и системы. Вирус обладает токсическим действием на сосудистую систему, значительно повышая проницаемость и ломкость сосудов, что в комплексе с расстройствами микроциркуляции может приводить к развитию геморрагического синдрома. В возникновении циркуляторных расстройств, кроме прямого действия на сосудистую стенку, большое значение имеет нейротропность вируса. Характерны фазовые повреждения вегетативной нервной системы, касающиеся двух ее частей (симпатической и парасимпатической): гипертензия изменяется гипотензией, тахикардия — брадикардией, повышается секреция слизи в дыхательных путях, появляется потливость.
Проникая в более глубокие слои эпителия, вирус встречается со второй линией специфической обороны (интерферон, циркулирующие антитела классов IgM, IgG, IgE, температурная реакция). Механизмы иммунного ответа при гриппе представлены на рис. 3.
Рис. 3. Механизмы иммунного ответа при гриппе
При гриппе в ответ на инфицирование развиваются ранние цитокиновые реакции (РЦР) как наиболее быстрый ответ на вирус. Здесь мы имеем дело с естественным (врожденным) и наиболее распространенным вариантом РЦР на вирус гриппа как на внутриклеточного паразита, когда вирус сам включает систему интерферона, играя роль природного индуктора.
Каскад внутриклеточных событий, который наблюдается после внедрения вируса, обусловлен индукцией образования ИФН и в последующем разрушением вирусных информационных РНК, благодаря действию 2'-5'-олигоаденилсинтетазы и активации эндонуклеазы. Параллельно активированная протеинкиназа фосфорилирует а-субъединицу фактора, который инициирует трансляцию, что приводит к блокировке синтеза вирусных белков. Все это приводит к угнетению репродукции широкого спектра РНК и ДНК-содержащих вирусов за счет прямого внутриклеточного антивирусного эффекта. Эти явления происходят в течение первых часов после проникновения вируса гриппа в организм.
Интерфероны (в первую очередь ИФН-b или так называемые интерфероны I типа) имеют способность к активации естественных киллеров (ЕК) и цитотоксических лимфоцитов. В результате на этом этапе вирусного инфицирования локально осуществляются три взаимосвязанных действия:
- внутриклеточная ингибиция интерферонами репродукции вирусов;
- удаление посредством ЕК и ЦТЛ инфицированного материала;
- защита вновь образованным интерфероном окружающих незараженных клеток от возможного заражения.
Интерферон распределяется по организму, связывается со специфическими рецепторами здоровых неповрежденных клеток и делает их невосприимчивыми к вирусу. С интерферонсвязанных неинфицированных клеток вокруг очага вирусной инфекции образуется заслон для последующего распространения инфекции. Кроме того, интерферон активирует почти все иммунные реакции (модуляция взаимосвязи между эндокринной и иммунной системами, активация макрофагов, повышение цитотоксичности, стимуляция экспрессии антигенов ГКГ I и II классов).
Однако описанные эффекты ИФН нередко являются недостаточными для завершения инфекционного процесса. Подобное имеет место при сниженном сопротивлении организма, дефектности системы ИФН и иммунитета, неблагоприятной экологической ситуации, действии стрессов и др.
В итоге развивается острое заболевание, которое сопровождается продукцией каскада ранних цитокинов (второй этап РЦР), активацией CD4+ и CD8+ Е-клеток с последующим развитием специфического, опосредствованного Т- и В-клеточного иммунитета. В этих случаях кроме ИФН 1-го типа синтезируются такие ранние цитокины, как фактор некроза опухоли, образуются интерлейкины (IL) 1b, 6, 10 и 15, а также трансформирующий фактор роста (TGF). На этом этапе уже отмечается вариабельность РЦР при разных вирусных инфекциях. Продукция ИФН-b считается ключевым доминантным признаком инфицирования вирусом.
ИФН а/b вызывает лейкопению, лимфаденопатию, миграцию клеток из красной пульпы селезенки в белую пульпу, то есть происходит перераспределение клеток для последующих иммунорегуляторных эффектов. ИФН а/b могут усилить специфический иммунный ответ при гриппе в период первичной инфекции за счет притягивания популяции В- и Е-клеток в места воспаления для антигенной презентации.
Первыми на инфекцию начинают реагировать макрофаги, в них происходит расщепление вирусной частицы на отдельные пептиды, которые продвигаются к поверхности клетки, здесь (на мембране макрофага) они контактируют с молекулами ГКГ I и II классов. ИФН, который секретируется ИЛ-1, усиливает экспрессию антигена ГКГ. Выраженное синергичное действие ИЛ-1 и ИЛ-2 способствует пролиферации предшественников Т-клеток в вилочковой железе. В очаг инфекции направляются Т-лимфоциты (хелперы), которым и предоставляются фрагменты антигена в комплексе с молекулами ГКГ. В активации Т-хелперов принимают участие ИЛ-4, ИЛ-6 и ФНО. Возможна ситуация, когда Т-лимфоциты способны непосредственно связывать вирусные антигены при участии антигенов II класса ГКГ. Потом подключаются ЦТЛ и NK-клетки, которые являются основными факторами ликвидации инфицированных вирусом клеток. Но роль CD8+ ЦТЛ двойственна: с одной стороны, они более эффективно по сравнению с другими субпопуляциями элиминируют вирус из отделов нижних дыхательных путей, с другой — усиливают реакции локального воспаления, вызывая в эксперименте синдром респираторного дистресс-синдрома. Результатом этого взаимодействия может стать победа вируса, тогда макроорганизм подключает факторы гуморального иммунитета (местного и общего).
Основу специфического местного иммунитета составляет секреторный IgA. В его синтезе принимают участие клетки реснитчатого эпителия, макрофаги, Т-лимфоциты, клетки секреторного эпителия. Макрофаги, локализованные в пространствах между эпителиальными клетками, захватывают обломки разрушенных вирусом клеток, метаболизируют их. Антигены, подготовленные макрофагами, активизируют Т- и В-лимфоциты, которые превращаются в плазмоциты, продуцируют антитела класса IgA. Выполняя важные эффекторные функции, IgA играет роль молекулы, которая регулирует функции клеток иммунной системы, в частности альвеолярных макрофагов, несущих рецепторы к Fc-фрагменту этого Ig. Так, иммунные комплексы, которые содержат антитела класса А, индуцируют в моноцитах-макрофагах синтез ФНО-а и СЗ-комплемента С. Секреторные IgA связывают вирус и препятствуют его выходу из организма в активной форме, что ограничивает циркуляцию вируса среди людей.
При первой встрече с вирусом через 3-5 дней образуются антитела класса IgM. Повышение их содержания свидетельствует об остроте инфекционного процесса. Высокое содержание Ig в крови является показателем устойчивости организма к инфекции. IgE — единственный тип антител, который вступает во взаимодействие с мембраной тучных клеток (в клинической картине наблюдаются приступы бронхоспазма).
Иммунные механизмы при первичной встрече с вирусом запоминаются организмом в виде информации, заложенной в клетки памяти (иммунологическая память), и при повторной встрече с вирусом той же антигенной разновидности иммунные реакции протекают быстрее и более эффективно. Создание иммунной памяти об антигене является целью применения вакцин. С их помощью создается и поддерживается защитная концентрация противогриппозных антител. Антитела, вступая во взаимосвязь с антигеном, образуют иммунные комплексы. Иногда вместе с защитными функциями они могут стать причиной тяжелых иммунопатологических состояний. Циркулируя по всему организму, они оседают в тканях, вызывая воспалительные реакции в капиллярах клубочков почек и синовиальных оболочек суставов. Частично вирус из организма выделяется почками, что, возможно, и обусловливает тот факт, что в эпителии дистальных канальцев, как и в эндотелии капилляров клубочков, оказывается значительное количество антигена вируса. Почками также выделяются иммунные комплексы, фрагменты клеток, что приводит к сенсибилизации тканей почки и впоследствии, через несколько недель и даже месяцев после перенесенного заболевания, может послужить причиной возникновения гломерулонефрита. Инициатором в этом случае может быть фактор, который имеет антигенную природу (например, переохлаждение).
Находясь в окружении антител, вирус может сохранять свою структуру и при разрушении комплекса опять поражать чувствительные клетки. Длительная циркуляция комплексов приводит к инфицированию все большего количества клеток, к поддержке инфекции и к персистенции. В данное время не исключается возможность длительной персистенции вируса гриппа в ЦНС по типу медленной инфекции с развитием впоследствии такого патологического состояния, как паркинсонизм. Это изменяет представление о гриппе как об острой инфекции. Установлено, что в 50% случаев антиген вируса гриппа сохраняется в периферических лимфоидных клетках и в крови до 120-200 и более дней.
При гриппе роль антигена могут играть не только структура вируса, но и измененные вирусом структуры клеток, и уже к ним синтезируются антитела, с которыми начинают вступать во взаимодействие нормальные клетки, в результате чего возникает угроза развития аутоиммунопатологического состояния.
Изменения во внутренних органах однотипны, обусловлены генерализованной вазодилятациеи. При массивной вирусемии, которая быстро развивается в первые часы болезни, может возникнуть инфекционно-токсический шок с развитием сердечно-сосудистой недостаточности. В его основе лежат несколько факторов: сосудистый (непосредственное действие вируса на сосуды с повышением их проницаемости, вазодилятациеи), геморрагический синдром с повреждением надпочечников и дефицитом гормонов, нарушение функции миокарда. У таких больных смерть может наступить в ближайшие часы от начала заболевания.
В результате токсического повреждения сосудистого аппарата ЦНС наступает гиперсекреция спинномозговой жидкости, нарушается ликвородинамика, что приводит к повышению внутричерепного давления, может наступить отек мозга. Чаще все-таки повреждаются мягкие мозговые оболочки, сосудистое сплетение, где можно выявить антигены вируса гриппа.
Инфекционно-алергический процесс после перенесенной гриппозной инфекции может возникнуть также в эндокарде. Изменения в миокарде, определенные на ЭКГ как миокардиодистрофия, обусловлены токсикозом и циркуляторными расстройствами.
В патогенезе отека легких имеют значение много факторов: нарушения гемодинамики, связанные с токсикозом, воспалительные процессы в бронхах и легких, снижение сократительной функции левого желудочка, что чаще развивается у лиц с сопутствующими заболеваниями сердечно-сосудистой системы. Необходимо подчеркнуть, что начальные стадии отека легких, на которых повреждается интерстициальная ткань, определяются лишь рентгенологически в виде нерезких, расплывчатых теней, которые сливаются и распространяются от корней к периферии легочных полей.
В механизмах устойчивости организма к генетически инородной информации принимают участие два основных феномена: наследственная резистентность и приобретенный иммунитет:
- природная видовая наследственная резистентность, связанная с врожденной стойкостью организма, которая развивается с возрастом, к возбудителям инфекций, основанная на отсутствии чувствительных клеток или повышении их резистентности к репродукции вируса, а также на их биологической инактивации при участии интерферона, фагоцитарных факторов, нормальной температуры тела или неспецифических ингибиторов крови;
- приобретенный иммунитет создается после болезни или искусственной иммунизации вакцинами.
Приобретенный иммунитет опирается на формирование местной секреторной защиты. Секреторный иммунитет предупреждает или смягчает тяжесть заболевания во входных воротах гриппозной инфекции при участии антител класса IgA, которые синтезированы в процессе кооперации между В-лимфоцитами и эпителиальными клетками. Секреторные антитела избирательно адсорбируются на поверхности клеток мерцательного эпителия, эффективно защищая их от инвазии вируса.
Длительность противогриппозного иммунитета ограничена не дву-мя-тремя годами, как это считалось бесспорным до 1977 г. (в этот год особенно тяжело болели молодые люди, рожденные после 1957 г., когда вирус A (H1N1) исчез из циркуляции и появился снова в 1977 г.). В случае возвращения к активной циркуляции уже известного подтипа через 20 и более лет — выявляется сохранение специфической невосприимчивости к возбудителю, который вернулся, у части населения, которая контактировала с ним раньше. Такая длительная иммунологическая память обусловлена, конечно, не антителами (их титры в крови падают ниже защитного порога через 6-12 месяцев, а в секрете дыхательных путей — еще быстрее). Длительный постинфекционный иммунитет обеспечивают клеточные механизмы (Т- и В-лимфоциты), в том числе местные, во входных воротах возбудителя инфекции. Существует четко выраженная корреляция невосприимчивости к гриппу с концентрацией антител в крови (в основном IgG) и в секрете дыхательных путей (IgA). Однако в частных случаях гриппом могут заболеть люди с высоким исходным уровнем гуморального иммунитета и не заболевают инфицированные лица с низким начальным титром антител. Такие примеры подчеркивают сложность и многогранность иммунной защиты организма, где роль отдельных факторов интегрирована в общем результате.
Между специфическими механизмами противогриппозного иммунитета существует распределение защитных функций:
- секреторные антитела, которые подавляют репродукцию вируса во входных воротах инфекции, обеспечивают противоэпидемическую защиту, направленную на ограничение рассеивания и передачи возбудителя от инфицированных лиц здоровому окружению; в связи с широким диапазоном нейтрализующего эффекта секреторные антитела способны подавлять любые антигенные варианты вируса гриппа А в пределах своего подтипа;
- сывороточные антитела нейтрализуют токсичные продукты вируса и регулируют клиническую тяжесть болезни;
- клеточно-обусловленные факторы иммунитета устраняют резервуар вируса в инфицированных клетках, малодоступных влиянию антител.
Напряженность противовирусного иммунитета зависит от уровня циркулирующих антител и образования цитотоксических лимфоцитов. Цитотоксические лимфоциты вызывают лизис инфицированных вирусом клеток.
Повторное заболевание гриппом обусловлено высокой изменчивостью вируса гриппа и формированием иммунитета только к конкретному штамму, что и объясняет необходимость ежегодной вакцинации.
Инфекционные болезни характеризуются специфичностью, контагиозностью и цикличностью.
Специфичность инфекции
Каждую инфекционную болезнь вызывает конкретный возбудитель. Однако известны инфекции (например, гнойно-воспалительные процессы), вызываемые различными микробами. С другой стороны, один возбудитель (например, стрептококк) способен вызывать различные поражения.
Контагиозность инфекционного заболевания. Индекс контагиозности инфекции.
Контагиозность (заразительность) определяет способность возбудителя передаваться от одного лица к другому и скорость его распространения в восприимчивой популяции. Для количественной оценки контагиозности предложен индекс контагиозности — процент переболевших лиц в популяции за определённый период (например, заболеваемость гриппом в определённом городе за 1 год).
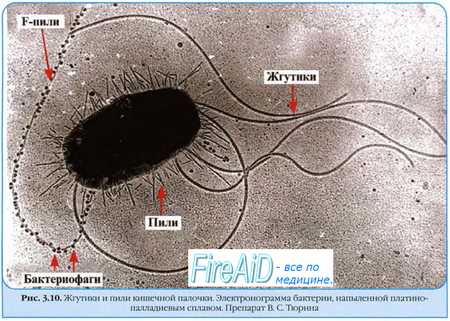
Цикличность инфекционного заболевания
Развитие конкретного инфекционного заболевания ограничено во времени, сопровождается цикличностью процесса и сменой клинических периодов.
Стадии инфекционной болезни. Периоды инфекционной болезни.
Инкубационный период [от лат. incubatio, лежать, спать где-либо]. Обычно между проникновением инфекционного агента в организм и проявлением клинических признаков существует определённый для каждой болезни промежуток времени — инкубационный период, характерный только для экзогенных инфекций. В этот период возбудитель размножается, происходит накопление как возбудителя, так и выделяемых им токсинов до определённой пороговой величины, за которой организм начинает отвечать клинически выраженными реакциями. Продолжительность инкубационного периода может варьировать от часов и суток до нескольких лет.
Период развития болезни. На этой фазе и проявляются черты индивидуальности болезни либо общие для многих инфекционных процессов признаки — лихорадка, воспалительные изменения и др. Б клинически выраженной фазе можно выделить стадии нарастания симптомов (stadium wcrementum), расцвета болезни (stadium acme) и угасания проявлений (stadium decrementum).
Реконвалесценция [от лат. re-, повторность действия, + convalescentia, выздоровление]. Период выздоровления, или реконвалесценции как конечный период инфекционной болезни может быть быстрым (кризис) или медленным (лизис), а также характеризоваться переходом в хроническое состояние. Б благоприятных случаях клинические проявления обычно исчезают быстрее, чем наступает нормализация морфологических нарушений органов и тканей и полное удаление возбудителя из организма. Выздоровление может быть полным либо сопровождаться развитием осложнений (например, со стороны ЦНС, костно-мышечного аппарата или сердечно-сосудистой системы). Период окончательного удаления инфекционного агента может затягиваться и для некоторых инфекций (например, брюшного тифа) может исчисляться неделями.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Для развития инфекционного заболевания необходимо наличие ряда факторов.
Пути передачи возбудителей инфекционных заболеваний
Существуют различные способы передачи патогенных микроорганизмов. В некоторых случаях эпидемические штаммы хорошо переносят неблагоприятные условия и способны к быстрому распространению.
Большинство патогенных микроорганизмов приспосабливаются к тем или иным способам передачи. Следует отметить, что распространение возбудителей, вызывающих поражение дыхательной системы, облегчается при помощи кашля, который они вызывают. В то же время рвота и диарея, возникающие при заболеваниях, передающихся посредством фекально-орального механизма, способствуют попаданию возбудителей (находящихся в большом количестве в желудочно-кишечном тракте) в окружающую среду.
Внедрение возбудителя инфекции в организм хозяина
Для роста и размножения микроорганизмы должны проникнуть в ткани хозяина, а потому обладают широким спектром методов и механизмов прикрепления. Выбор органов-мишеней зависит от того, с какими рецепторами может взаимодействовать тот или иной возбудитель. Так, Neisseria gonorrhoeae прикрепляется к слизистой оболочке половых органов при помощи фимбрий, а вирус гриппа взаимодействует с клетками хозяина посредством гемагглютинина.
Эти свойства учитывают при определении сродства к рецепторам и исследовании патогенности видоспецифичных (определённые штаммы поражают определённые организмы) и межвидовых патогенов.
Некоторые бактерии обладают специальными механизмами, позволяющими им достичь эпителия млекопитающих. Например, для достижения энтероцитов Vibrio cholerae вырабатывает муциназу. Взаимодействие Н. pylori с сиалированными белками слизистой оболочки желудка зависит от степени сиалирования поверхностных структур возбудителя.
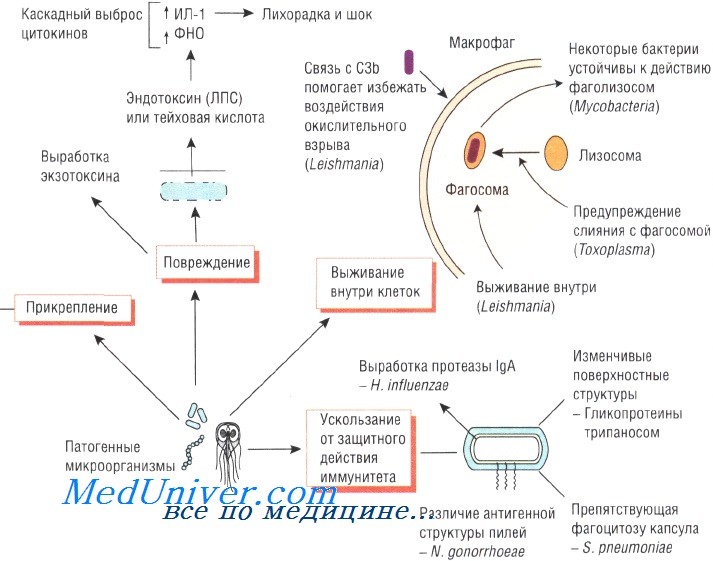
Патогенез инфекционного заболевания
Giardia lamblia прикрепляется к слизистой оболочке тощей кишки при помощи специальной присоски. Эритроциты, поражённые Plasmodium falciparum, продуцируют белок, стимулирующий адгезию к сосудам мозга, что приводит к развитию церебральной формы малярии.
Некоторые бактерии образуют полисахаридную биоплёнку, облегчающую микробное заселение искусственных протезов и имплантов (например, катетеров), постоянно находящихся в организме. Кроме того, некоторые штаммы стафилококков имеют гены, стимулирующие их прикрепление к пластиковым поверхностям и биомолекулам, покрывающим внутрисосудистые устройства.
При продолжительном повреждении тканей различные штаммы S. aureus могут связываться с некоторыми молекулами организма хозяина (фибронектин, вибронектин и коллаген). Различные штаммы Escherichia coli используют фимбрий, или пили, для прикрепления к маннозе или групповым антигенам крови и, соответственно, они вызывают инфекционные заболевания желудочно-кишечного тракта или мочевыводящих путей. ВИЧ связывается с CD4 и некоторыми другими антигенами.
Таким образом, каждый штамм обладает определёнными генами, обусловливающими его способность к внедрению в организм хозяина.
Инвазия возбудителя инфекционного заболевания
Существует множество механизмов, при помощи которых микроорганизмы преодолевают слизистые оболочки и различные типы клеточных мембран. После этого они должны закрепиться в организме хозяина и начать интенсивно размножаться.
Некоторые бактерии, например рода Helicobacter и Neisseria, продуцируют IgA-протеазу, разрушающую IgA. Таким образом, эти возбудители нейтрализуют одну из важнейших защитных систем слизистой оболочки организма.
Подвижность возбудителя инфекционного заболевания
Способность микроорганизмов передвигаться в поисках новых источников питания или в ответ на хемотаксические сигналы приводит к заметному усилению их патогенности. Например, штаммы Vibrio cholerae, обладающие жгутиками, намного более вирулентны, нежели неподвижные штаммы.
Устойчивость возбудителя инфекции к защитным механизмам иммунной системы
Для выживания в организме хозяина возбудителям необходимо противостоять защитным механизмам иммунной системы. Бактерии, поражающие дыхательную систему, продуцируют IgA-протеазу, разрушающую иммуноглобулины. Staphylococcus aureus секретирует протеин А, связывающий иммуноглобулины и препятствующий опсонизации и активации системы комплемента.
Один из важнейших механизмов противостояния иммунной системе — устойчивость к фагоцитозу. Полисахаридная капсула препятствует захвату Streptococcus pneumoniae полиморфноядерными нейтрофилами. Кроме того, некоторые микроорганизмы
Липополисахариды грамотрицательных бактерий обусловливают их устойчивость к действию комплемента, а Trypanosoma способна изменять свои поверхностные антигены во избежание их взаимодействия с антителами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Классификация ( формы ) инфекционных заболеваний. Экзогенные инфекции. Эндогенные инфекции. Регионарные и генерализованные инфекции. Моноинфекции. Микстинфекции.
Инфекционные болезни обычно сопровождаются нарушениями гомеостаза организма и его физиологических функций. Множество взаимодействующих параметров в системе конкретный возбудитель-конкретный организм находит отражение в различных формах инфекционного процесса и его вариантах. Другими словами, в зависимости от эпидемиологической ситуации, типа и свойств возбудителя (например, инфицирующей дозы, вирулентности и т.д.), состояния параметров гомеостаза человека, а также от конкретных особенностей взаимодействия возбудителя и организма инфицированного человека, инфекционный процесс может принимать различные формы (от клинически выраженных до бессимптомных, от суперинфекций до бактерионосительства). Ниже рассмотрены основные формы инфекционных процессов.
Экзогенные инфекции. Эндогенные инфекции.
Экзогенные инфекции развиваются в результате проникновения в организм патогенных микроорганизмов из внешней среды.
Эндогенные инфекции обычно развиваются в результате активации и, реже, проникновения условно-патогенных микроорганизмов нормальной микрофлоры из нестерильных полостей во внутреннюю среду организма (например, занос кишечных бактерий в мочевыводящие пути при их катетеризации). Особенность эндогенных инфекции — отсутствие инкубационного периода.

Регионарные инфекционные заболевания. Генерализованные инфекции
• Регионарные инфекционные заболевания — инфекционный процесс протекает в каком-либо ограниченном, местном очаге и не распространяется по организму.
• Генерализованные инфекционные заболевания развиваются в результате диссеминирования возбудителя из первичного очага, обычно по лимфатическим путям и через кровоток.
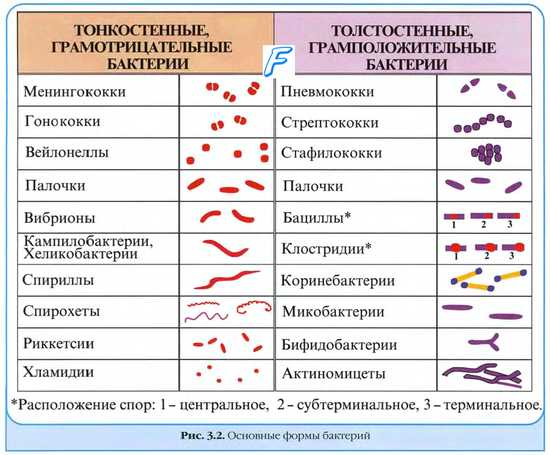
Моноинфекции. Микстинфекции ( миксты )
Моноинфекции — заболевания, вызванные одним видом микроорганизмов.
Смешанные инфекции ( микстинфекции, миксты ) развиваются в результате заражения несколькими видами микроорганизмов; подобные состояния характеризует качественно иное течение (обычно более тяжёлое) по сравнению с моноинфекцией, а патогенный эффект возбудителей не имеет простого суммарного характера. Микробные взаимоотношения при смешанных (или микст-) инфекциях вариабельны:
• если микроорганизмы активизируют или отягощают течение болезни, их определяют как активаторы, или синергисты (например, вирусы гриппа и стрептококки группы Б);
• если микроорганизмы взаимно подавляют патогенное действие, их обозначают как антагонисты (например, кишечная палочка подавляет активность патогенных сальмонелл, шигелл, стрептококков и стафилококков);
• индифферентные микроорганизмы не влияют на активность других возбудителей.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

