Онм это в инфекции
Обновлено: 01.05.2024
Понятие ОНМ соответствует сочетанному развитию двух процессов: собственно отека с накоплением жидкости в межклеточных пространствах мозга (преимущественно в белом веществе) и набухании клеток в результате задержки в них натрия, увеличивающего объем внутриклеточной жидкости (преимущественно в сером веществе). Синдром ОНМ полиэтиологичен. Он может развиваться на фоне асфиксии (гипоксический ОНМ), метаболический при острой печеночной недостаточности и, наконец, циркуляторный – на фоне тяжелого нейротоксикоза (менингиты, энцефалиты). В практике инфекциониста чаще всего регистрируется именно цир-куляторный ОНМ, патогенез которого во многом напоминает патогенез ИТШ, только нарушение микроциркуляции в этом случае не тотальное, а в основном только в сосудах оболочек мозга и вещества мозга.
Диагностика ОНМ при менингоэнцефалитах – бурно нарастающий нейротоксикоз с выраженным менингеальным синдромом, возможно судорожным синдромом, психомоторным возбуждением указывают на вероятность осложнения заболевания ОНМ. Непосредственные симптомы первой стадии ОНМ:
1. потеря сознания (кома или глубокий сопор)
2. артериальная гипертензия
3. брадикардия, сменяющаяся тахикардией
4. миоз, гипертензия, гиперемия лица с цианотичным оттенком
II стадия – вклинение мозга в большое затылочное отверстие – аритмичное дыхание, брадипное, глубокая кома, мидриаз, цианоз, непроизвольное мочеиспускание и дефекация, падение АД и ЧСС, постепенное снижение температуры, смерть от асфиксии.
1. Перевод больного на ИВЛ с миорелаксацией
2. Этиотропная терапия (меропенем 0,15х4 р или 1,0х3 р)
3. Дезинтоксикационная терапия
4. Дегидратационная терапия (в основном лазикс, допустим 1 раз – маннитол)
5. Дексаметазон, антиферменты, антиагреганты
7. Гипотермия мозга
Как профилактическое средство при угрозе развития ОНМ дренирование спинно-мозгового канала.
Острая печеночная энцефалопатия (опэп)
ОПЭП – комплексный клинико-патогенетический синдром, обусловленный нару-шением функций печени. Чаще всего это неотложное состояние развивается при тяжелом течении ВГВ или сочетании ВГВ и ВГД. Морфологическим субстратом является массивный или субмассивный некроз гепатоцитов, развивающийся в результате аутоагрессии Киллерный эффект, а также действие иммунных комплексов приводят к перекисному окислению липидов в мембранах гепатоцитов, их порозности, развитию дистрофических изменений и некрозу гепатоцитов.
Важнейшее патогенетическое значение имеют изменения, происходящие в эндотелии сосудов печени и других органов, которые вызывают нарушения кровообращения, лимфообращения, угнетение микроциркуляции, угнетение функции печеночных клеток.
Поражение печеночных клеток при ВГ характеризуется сочетанием дистрофических и некротических изменений. Морфологическим изменением гепатоцита, развитию синдрома ци-толиза, предшествует биохимическая фаза как следствие дисфункции органелл гепатоцита.
В биохимическую стадию цитолиза происходит нарушение энергетического обмена, заключающегося в уменьшении количества макроэргических фосфорных соединений (АТФ, АДФ). Это вызывает дезинтеграцию биологических мембран гепатоцитов с повышением их проницаемости, изменением состава электролитов, извращением обмена белка и выходом в кров ряда аминокислот.
Начальным звеном синдрома цитолиза является изменение мембранных липидов. Важное значение имеет в дальнейшем повреждение лизосом, что приводит к выходу в цитоплазму гидролитических ферментов, определяющих в конечном счете некроз гепатоцита.
Одним из важнейших звеньев патогенеза ОПЭ является эндотоксинемия. Образующиеся вследствие активации кишечной микрофлоры эндотоксины играют большую роль в поражении печени и других органов. Эндотоксинемия приводит к нарушению микроциркуляции в печени, почках, головном мозге, способствуя развитию отека и функциональной недостаточности органов.
В норме печень служит как бы фильтром, проходя через который портальная кровь очи-щается от токсических соединений. Благодаря различным химическим превращениям (гидроксилирование, дезаминирование, ацетилирование, образование парных соединений и др.) все эти вещества трансформируются и выводятся из организма. При выпадении нейтрализующей функции печени токсины попадают в системный кровоток.
Наиболее яркими симптомами острой печеночной недостаточности являются нарушения деятельности ЦНС. Большое значение имеет нарушение микроциркуляции в церебральном кровотоке, возникающее в результате накопления в мозговом кровотоке токсических субстанций (индолы, фенолы, аммиак, низкомолекулярные жирные кислоты, метаболитов углеводов - ацетон, бутиленгликоль, продуктов аутолиза гепатоцитов. Они вызывают нарушение нейро-синаптической передачи, мембранной функции нейронов усиленный синтез глютамина, энергетическое голодание мозга и развитие метаболического отека и набухания мозга.
Диагностика синдрома Девика (оптиконевромиелита) по МРТ
а) Терминология:
1. Сокращения:
• Оптиконевромиелит (ОНМ)
• Расстройства оптиконевромиелитического спектра (РОНМС)
2. Синонимы:
• Синдром Девика
3. Определение:
• Идиопатическое воспалительное демиелинизирующее заболевание ЦНС, характеризующееся тяжелыми атаками неврита зрительного нерва и миелита
б) Визуализация:
1. Общие характеристики оптиконевромиелита (синдрома Девика):
• Лучший диагностический критерий:
о Неврит зрительного нерва и миелит
о Поражение головного мозга, не характерное для рассеянного склероза (PC)
• Локализация:
о Наиболее часто поражаются шейный отдел спинного мозга, зрительные нервы:
- Чаще встречается одновременное двустороннее поражение прехиазмальной части зрительного нерва, а также включая хиазму
о Поражение головного мозга: глубокое белое вещество, периэпендимальная область, мозолистое тело, кортикоспинальные тракты, ствол мозга и мозжечок
• Размеры:
о Увеличивающиеся в размерах полисегментарные зоны поражения спинного мозга
о Размеры зоны поражения белого вещества головного мозга варьируют от точечных или мелких (< 3 мм) до крупных сливных
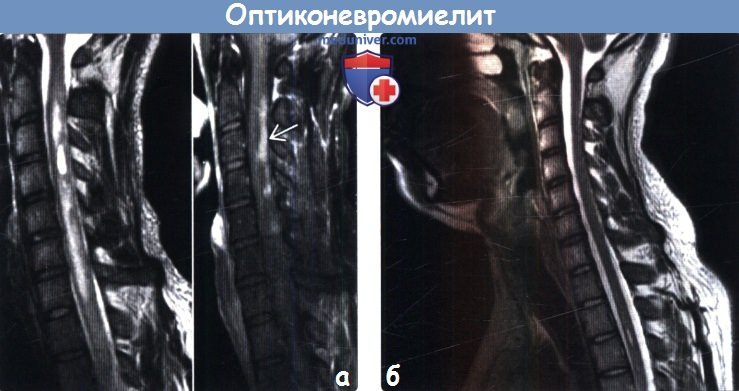
(а) МРТ, Т2-ВИ (слева) и постконтрастное Т1-ВИ в режиме подавления сигнала от жира (справа), сагиттальный срез: у пациента с невритом зрительного нерва в анамнезе на протяжении нескольких сегментов шейного отдела спинного мозга определяются зоны повышения интенсивности сигнала на Т2-ВИ, а также расположенные кзади зоны неравномерно выраженного контрастного усиления.
(б) МРТ, Т2-ВИ, сагиттальный срез: у того же пациента спустя год после лечения наблюдается практически полное исчезновение зон измененного сигнала. Зоны накопления контраста в спинном мозге также не наблюдались. Поражение спинного мозга при ОНМ обычно охватывает три и более сегментов.
3. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТ исследование головного мозга, позвоночника и глазниц с контрастным усилением
• Советы по протоколу исследования:
о Глазницы: МРТ с получением корональных или аксиальных STIR-изображений или Т2-ВИ и постконтрастных Т1-ВИ в режиме подавления сигнала от жира
о Позвоночник: MPT с получением сагиттальных STIR-изображений или Т2-ВИ и постконтрастных Т1-ВИ
о Головной мозг: МРТ с получением аксиальных и сагиттальных FLAIR-изображений, постконтрастного Т1 -ВИ
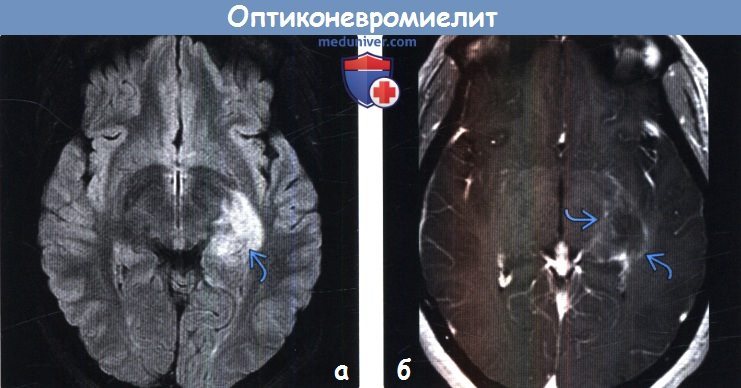
(а) MPT, FLAIR, аксиальный срез: у пациента с жалобами на изменения чувствительности наблюдается крупная гиперинтенсивная зона поражения медиального отдела левой височной доли.
(б) МРТ, постконтрастное Т1-ВИ, аксиальный срез: у того же пациента определяется фрагментарный характер накопления контраста с нечеткими контурами (облаковидное контрастирование).
У данного пациента был обнаружен ОНМ-ассоциированный иммуноглобулин G. Сообщается, что такой характер накопления контраста относительно специфичен для ОНМ.
в) Дифференциальная диагностика оптиконевромиелита:
1. Рассеянный склероз:
• Хорошо отграниченные от окружающих структур радиально ориентированные перивенулярные очаги (пальцы Доусона)
• Может наблюдаться неврит зрительного нерва и поражение спинного мозга
• Увеличивающиеся в размерах полисегментарные зоны поражения спинного мозга чаще встречаются при оптиконевромиелите
2. Неврит зрительного нерва:
• Один из компонентов ОНМ
• Рассмотрите возможность проведения исследования на ОНМ-ассоциированные IgG при впервые выявленном неврите зрительного нерва без других изменений головного мозга по данным МРТ
3. Поперечный миелит:
• Один из компонентов ОНМ
• Идиопатический воспалительный или постинфекционный миелит
• Дифференциальная диагностика между спинальной формой ОНМ и другими иммунно-опосредованными миелитами (например, болезнью Шегрена или СКВ) затруднена
4. Сирингомиелия:
• Утолщение спинного мозга и повышение интенсивности сигнала от него на Т2-ВИ
• Внешне может быть схожа с ОНМ 5. Новообразование спинного мозга:
• При астроцитоме или эпендимоме может определяться схожее мультисегментарное повышение интенсивности сигнала на Т2-ВИ от спинного мозга и его контрастирование
г) Патология:
1. Стадирование и классификация оптиконевромиелита:
• Диагностические критерии для постановки диагноза ОНМ
о Неврит зрительного нерва
о Поперечный миелит
о Как минимум два из трех нижеперечисленных дополнительных критериев:
- Сливное поражение спинного мозга по данным МРТ, которое распространяется как минимум на три позвоночных сегмента
- МР-картина при манифестации не соответствует диагностическим критериям PC
- Серопозитивный статус по ОНМ-ассоциированным IgG
2. Макроскопические и хирургические особенности:
• Формирование полостей в спинном мозге
д) Клиническая картина:
1. Проявления оптиконевромиелита:
• Наиболее частые признаки/симптомы:
о Неврит зрительного нерва: диплопия или другие нарушения зрения
о Миелит: миелопатия
о У 20% пациентов заболевание манифестирует стволовыми симптомами
- Нистагм, дизартрия, дисфагия, атаксия или офтальмоплегия
о Симптоматическая нарколепсия или острый диэнцефальный синдром
о Афазия, судорожные приступы, нарушения сознания, когнитивная симптоматика
• Клинический профиль:
о СМЖ: нейтрофильный плеоцитоз, отсутствие олигоклональных полос
2. Течение и прогноз:
• Рецидивирующее течение у 90% пациентов
• Менее благоприятный прогноз за счет более тяжелой утраты трудоспособности по сравнению с пациентами, страдающими рассеянным склерозом (PC)
• Обнаружение анти-AQP4 антител является признанным прогностическим маркером:
о Признак высокого риска рецидива неврита зрительного нерва и миелита
• Для предупреждения или снижения степени утраты трудоспособности требуется ранняя и агрессивная иммуносупрессивная терапия
• Для отслеживания осложнений иммуносупрессивной терапии необходимо наблюдение в динамике методами рутинной визуализации
3. Лечение оптиконевромиелита:
• Обострение: в/в введение метилпреднизолона, сменяемое пероральным приемом преднизолона с его последующей постепенной отменой в течение 6-12 месяцев:
о При отсутствии эффекта от кортикостероидов в период обострения-плазмаферез
• Профилактика рецидивов: прием низких доз кортикостероидов, азатиоприна, ритуксимаба, метотрексата
• Лечение симптомов и реабилитация
е) Диагностическая памятка. Обратите внимание:
• Предполагайте оптиконевромиелит (ОНМ) у пациентов с невритом зрительного нерва и миелитом
• Предполагайте РОНМС у пациентов с характерным поражением головного мозга с вовлечением периэпендимальной области, мозолистого тела, кортикоспинальных трактов, ствола мозга
Варианты течения рассеянного склероза их диагностика и лечение
а) Оптический нейромиелит (ОНМ) (болезнь Девика). Оптический нейромиелит клинически характеризуется появлением одновременно или в быстрой последовательности, неврита зрительного нерва и поперечного миелита и патологически — воспалительными и деструктивными поражениями белого вещества с некрозами, кавитацией и острым аксональным повреждением.
Периваскулярное отложение иммуноглобулинов и активация комплемента вовлекает их в патогенез ОНМ и напоминает антитело/комплемент-опосредованный характер рассеянного склероза (II тип). Диагностические критерии были сформулированы Wingerchuk (2006). Необходимыми критериями являются оптический неврит (ОН), острый миелит и отсутствие клинических проявлений вне зрительного нерва и спинного мозга.
Дополнительные критерии включают отрицательные результаты МРТ в начале заболевания, МРТ спинного мозга с распространением патологического сигнала на протяжении более трех позвоночных сегментов, и плеоцитоз в ликворе >50х10 6 /л лейкоцитов или >5х10 6 /л нейтрофилов. Минимальные дополнительные критерии включают двусторонний ОН, тяжелый ОН с фиксированной остротой зрения менее чем 20/200, по крайней мере, в одном глазу, и тяжелая, стойкая, приступообразная слабость в одной или более конечностях.
Недавно выявлены аутоантитела (OHM-IgG), специфично связанные с OHM (Lennon et al, 2004). OHM-IgG прикрепляются около или непосредственно к микрососудам гематоэнцефалического барьера, к мягкой мозговой оболочке, в субпиальном пространстве или в пространстве Вирхова-Робина в месте экспрессии аквапорина 4 (Pittock et al., 2006b). Аутоантитела OHM-IgG отличают оптический нейромиелит от рассеянного склероза. Тем не менее, установление клинического диагноза бывает очень трудным, особенно когда наблюдается рецидивирующее течение (Wingerchuk и Weinschenker, 2003; Pittock et al., 2006a).
б) Концентрический склероз Бало. Классические повреждения концентрического склероза Бало (КСБ) включают кольца миелина, разделяемые кольцами демиелинизации. Концентрический склероз Бало (КСБ) — это острое неврологическое заболевание с картиной острого рассеянного склероза (PC) у молодых взрослых. До сих пор ведутся споры, является ли КСБ вариантом PC или это разные клинические синдромы. КСБ определяется при МРТ по чередующимся слоям миелинизированной и демиелинизированной ткани. В ликворе может обнаруживаться интратекальный синтез олигоклональных полос IgG. Клинически КСБ проявляется в виде острой, иногда монофазной энцефалопатии с фульминантным течением, которое может быстро привести к смертельному исходу. Данные нейровизуализации являются патогномоничными (Caraciolo et al., 2001; Kavanaagh et al, 2006).
КСБ-подобная клиника была описана у 13-летней девочки с первичным инфицированием HHV-6 (Pohl et al., 2005). Лечение КСБ проводят с применением стероидов, с различной степенью эффективности были опробованы другие иммуносупрессанты и плазмаферез.

в) Острый рассеянный склероз типа Марбурга (encephalomyelitis periaxialis scleroticans). Острый склероз впервые был упомянут в качестве варианта PC Марбургом в 1906 г. Он сообщил о 19 случаях из литературных источников и прибавил трех собственных пациентов, описав клинические симптомы, течение и патологические особенности. У пациентов имелась тяжелая остро начавшаяся энцефалопатия с прогрессирующим течением, которое привело к ранней смерти, в основном в связи с вовлечением ствола мозга. Болезнь Марбурга проявляется как тяжелый демиелинизирующий энцефаломиелит, приводящий к смерти через год с момента начала заболевания.
Около 5% всех пациентов, страдающих PC, могут быть отнесены в группу варианта Марбурга (Mathews, 1998). Распространенность среди детей с PC не установлена.
г) Диффузный миелокластический склероз Шильдера (encephalomyelitis periaxalis diffusa). Вначале определение диффузный склероз было применено к состоянию демиелинизации как к отдельному заболеванию (Poser et al., 1986). Poser употребил термин диффузный миелокластический склероз Шильдера, основываясь на морфологическом описании в докладе первого случая Шильдера. С тех пор стало ясно, что это заболевание включает несколько различных расстройств воспалительного и метаболического характера. Признание врожденных нарушений метаболизма в качестве возможной причины демиелинизации при многих заболеваниях белого вещества головного мозга может стать объяснением при непонимании, что именно в настоящее время определяется как болезнь Шильдера, поскольку некоторые метаболические заболевания, особенно адренолейкодистрофия, вначале не распознавались.
Это состояние в настоящее время определено как приобретенное прогрессирующее подострое или хроническое демиелинизирующее заболевание неизвестной этиологии. Оно вызывает обширные демиелинизирующие повреждения белого вещества полушарий головного мозга с относительным сохранением аксонов и сохранением субкортикальных U-волокон (Mehler и Rabinowich, 1988). Гистологическая характеристика ткани мозга идентична таковым при PC (Kepes, 1993; Afifi et al., 1994). Минимум одна, но обычно две и более примерно симметричных двусторонних бляшек больших размеров (>3,2 см) обнаруживаются в овальном центре, что может быть продемонстрировано при выполнении нейровизуализации. В зоне повреждений отмечаются низкие сигналы, с периферическим усилением после контрастирования. Может возникнуть кавитация, которая имитирует мозговой абсцесс.
Часто имеются мелкие аналогичные сопутствующие повреждения. Гистологическая картина схожа с таковой при PC. Клинические особенности включают в себя очаговые неврологические признаки (особенно гемиплегию), которые могут быть связаны с мозжечковыми симптомами, прогрессирующей неуклюжестью, ухудшением зрения, головными болями, апатичностью, расстройствами в поведении и изменением личности. Может наблюдаться внутричерепная гипертензия с отеком сосочка зрительного нерва (Konkol et al., 1987).
Повреждения ткани мозга при болезни Шильдера чрезвычайно чувствительны к лечению стероидами, которые вызывают быстрое уменьшение их размеров и исчезновение повышенной контрастности. Гиперинтенсивные картины на МРТ, по всей видимости, сохраняются в течение длительного времени (несколько лет). При Т1-режиме отмечаются очаги потери миелина.
Отношение болезни Шильдера к PC остается неясным (Poser et al., 1986). Часто её считают одним из вариантов. Хотя были описаны переходные формы с небольшими бляшками-сателлитами в дополнение к крупным (Poser et al., 1986), в клинике подозрения вызывают возрастной диапазон, клинические особенности и течение заболевания и частое отсутствие олигоклональных полос IgG в ликворе в случаях болезни Шильдера.
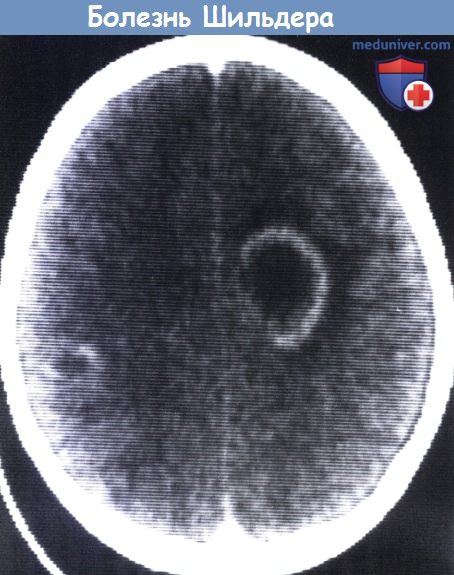
Болезнь Шильдера. 11-летний мальчик с проявлениями правосторонней гемиплегии с недавним началом, головной болью и отеком сосочка зрительного нерва.
КТ указывает на округлые очаги в левой центральной области и более мелкие повреждения в противоположной париетальной области.
При стереотаксической пункции эвакуирована только желтоватая жидкость с некоторым количеством некротического детрита.
Клинические симптомы быстро исчезли при стероидной терапии. Повторное КТ было нормальным, но МРТ в Т2-режиме показало персистенцию небольших участков повышенного сигнала.
д) Ретробульбарный неврит (PH). Ретробульбарный неврит (PH) представляет собой вовлечение нерва в воспалительный, дегенеративный или демиелинизирующий процесс, что приводит к нарушению функции (Riikonen et al., 1988а, Baker, 2006). Ретробульбарный неврит (PH) зачастую является ранним симптомом рассеянного склероза, и было высказано предположение о сходной этиологии. Это отличается от опыта Riikonen et al. (1988а), которые наблюдали развитие PC в 12 из 21 случая. Данное несоответствие остается необъясненным. Более высокий уровень заболеваемости в недавних исследованиях может отражать усовершенствование диагностических методов для PC, таких как МРТ.
Некоторые вирусные инфекции, например, корь, ветряная оспа и свинка (Kline et al., 1982, Purvin et al., 1988, Lucchinetti et al., 1997) также могут спровоцировать развитие PH, как в отдельности, так и в сочетании с другими проявлениями диссеминированного энцефаломиелита. Кроме этого, PH может возникнуть вслед за иммунизацией живыми вакцинами (Riikonen, 1989), о чем сообщалось при синдроме Миллера Фишера (Toshniwal, 1987). Интересно, что при рецидивирующем PH была обнаружена связь с ЦНС инфекцией С. pneumoniae (Pohl et al., 2006) и с инфекцией ветряной оспы (Pless и Malik, 2003).
Основным проявлением заболевания является внезапное монокулярное или бинокулярное снижение остроты зрения. Этому могут предшествовать головные боли или болезненные ощущения при движении глаз (Riikonen et al., 1988а). Вначале, зрение становится нечетким, размытым с прогрессированием на протяжении нескольких дней до частичной или полной слепоты. Двустороннее вовлечение присутствует более, чем в половине случаев и встречается как одновременно, так и последовательно. В недавнем наблюдении Wilejto et al. (2006) в США такое наблюдали у 58% пациентов. Различают ретробульбарный неврит, при котором глазное дно во время обследования оказывается в пределах нормы. У детей, однако, в 3/4 случаев в течение острой фазы отмечается отек зрительного диска (нейропапиллит) (Kriss et al., 1988).
В некоторых случаях могут выявляться сосудистые изменения в виде ретинального экссудата, очаговые деформации сосудов или утолщения вен (Riikonen et al., 1988а). Исследование зрительных полей указывает на центральные скотомы, а вызванные зрительные потенциалы замедлены. Изменения сохраняются в течение нескольких лет, даже когда отмечается полное выздоровление. Поражение зрительного перекреста может вызвать необычные дефекты зрительного поля (Newman et al., 1991).
Большинство пациентов выздоравливает с нормальным или относительно сохранным зрением, несмотря на частое присутствие атрофии зрительного нерва, но цветное и стереоскопическое зрение могут остаться нарушенными. Стойкая тяжелая потеря зрения встречается редко.
При диагностике PH важно исключить другие причины острого ухудшения зрения, особенно сдавление зрительного нерва, которое может в точности имитировать односторонний PH. Симуляцию и истерию нетрудно исключить, если есть необходимость, при проверке вызванных зрительных потенциалов. Отек сосочка зрительного нерва не сопровождается ранней потерей зрения и поэтому быстро исключается, когда проявления на глазном дне включают тяжелый отек зрительного диска с кровоизлияниями. На МРТ могут обнаруживаться участки демиелинизации в одном или обоих зрительных нервах (Miller et al., 1988а; Jacobs et al., 1991).
Появление PH повышает вероятность того, что он является первым признаком начинающегося PC. По оценкам риск ниже у детей, чем у взрослых, и в исследовании Riikonen (1989) составил 28%. Тем не менее, Wilejto et al. (2006) отметили развитие PC у 13 из 36 детей после двухлетнего наблюдения. В отличие от большинства предыдущих работ, они обнаружили более высокий риск при двустороннем поражении. Факторы, прогноза PC, включают плеоцитоз в ЦСЖ и продукцию интратекальных олигоклональных IgG антител (Riikonen et al., 1988а, b). МРТ показано во всех случаях. Wilejto et al. выяснили, что у всех их 13 пациентов с поражением мозга, видимых на МРТ, проявления PC возникли через два года наблюдения, в то время как ни в одном случае нормальных данных МРТ, заболевание не развилось.
В одном из исследований участки патологического сигнала были выявлены в 71% случаев (Riikonen et al., 1988b). Их ассоциация с олигоклональными IgG полосами в ликворе и с группой HLA Dr 2 свидетельствует об очень высоком риске развития диссеминированного заболевания (Jacobs et al, 1986). Рецидивы PH редко возникают у пациентов, у которых в итоге не развился PC (Pless и Malik, 2003). В таких случаях иммуносупрессивная терапия позволяет прекратить лечение глюкокортикоидами (Myers et al., 2006).
Кортикостероиды эффективно сокращают продолжительность атак и мало влияют на общее прогрессирование и предупреждение PC. Были рекомендованы кортикостероиды (Beck et al., 1992, 1993), особенно в форме метилпреднизолона (1 г/сутки в течение трех дней у взрослых, с дальнейшим приемом преднизолона per os в дозе 1 мг/кг/сутки в течение двух недель). Отмена стероидов может спровоцировать возврат симптомов, поэтому должна быть медленной (Pless и Malik, 2003).
Отдел респираторных инфекций Научно-исследовательского института детских инфекций ФМБА России, Санкт-Петербург, Россия, 195022;
кафедра инфекционных заболеваний у детей ФП и ДПО Санкт-Петербургского государственного педиатрического медицинского университета Минздрава России, Санкт-Петербург, Россия, 194100
Отдел респираторных инфекций Научно-исследовательского института детских инфекций ФМБА России, Санкт-Петербург, Россия, 195022;
кафедра инфекционных заболеваний у детей ФП и ДПО Санкт-Петербургского государственного педиатрического медицинского университета Минздрава России, Санкт-Петербург, Россия, 194100
Отдел респираторных инфекций Научно-исследовательского института детских инфекций ФМБА России, Санкт-Петербург, Россия, 195022
Отдел респираторных инфекций Научно-исследовательского института детских инфекций ФМБА России, Санкт-Петербург, Россия, 195022
Персистирующие инфекции у детей с хроническими заболеваниями ЛОР-органов: возможности этиотропной терапии
Журнал: Вестник оториноларингологии. 2015;80(5): 46‑50
Отдел респираторных инфекций Научно-исследовательского института детских инфекций ФМБА России, Санкт-Петербург, Россия, 195022;
кафедра инфекционных заболеваний у детей ФП и ДПО Санкт-Петербургского государственного педиатрического медицинского университета Минздрава России, Санкт-Петербург, Россия, 194100
Цель работы — этиологическая диагностика и этиотропная терапия 176 детей в возрасте от 2 до 12 лет с хронической патологией ЛОР-органов в зависимости от длительности заболевания: до 1 года (n=72), от 1 года до 2 лет (n=54) и более 2 лет (n=50). Использовались бактериологический метод для определения характера микрофлоры верхних дыхательных путей и молекулярно-биологический методы для выявления ДНК вируса Эпштейна—Барр, цитомегаловируса и вируса герпеса человека 6-го типа в крови и слюне. В терапии всех детей использовались препараты рекомбинантного интерферона курсом 1—1,5 мес, в 41% случаев в сочетании с антибактериальной терапией, с последующей иммунокорригирующей терапией индукторами интерферона (79,4% пациентов) или бактериальными лизатами (20,6%). Показана доминирующая роль герпесвирусов 4, 5 и 6-го типов в формировании хронической ЛОР-патологии у детей, постепенное снижение активности герпесвирусных инфекций у детей с длительностью процесса более 2 лет. Наиболее частыми бактериальными агентами, определяемыми из носо- и ротоглотки детей с хронической ЛОР-патологией, были Staphylococcus aureus и Streptococcus pyogenes, а также грибы рода Candida, частота выявления которых не зависела от длительности патологического процесса. Эффективность этиотропной терапии снижалась с течением времени с 78% на 1-м году заболевания до 30% при длительности процесса более 2 лет.
Отдел респираторных инфекций Научно-исследовательского института детских инфекций ФМБА России, Санкт-Петербург, Россия, 195022;
кафедра инфекционных заболеваний у детей ФП и ДПО Санкт-Петербургского государственного педиатрического медицинского университета Минздрава России, Санкт-Петербург, Россия, 194100
Отдел респираторных инфекций Научно-исследовательского института детских инфекций ФМБА России, Санкт-Петербург, Россия, 195022;
кафедра инфекционных заболеваний у детей ФП и ДПО Санкт-Петербургского государственного педиатрического медицинского университета Минздрава России, Санкт-Петербург, Россия, 194100
Отдел респираторных инфекций Научно-исследовательского института детских инфекций ФМБА России, Санкт-Петербург, Россия, 195022
Отдел респираторных инфекций Научно-исследовательского института детских инфекций ФМБА России, Санкт-Петербург, Россия, 195022
Формирование хронической патологии ЛОР-органов, распространенность которой у детей в России составляет от 181,9 до 465,0 на 1000 [1], тесно связано с частым и затяжным течением респираторных заболеваний. Доля часто и длительно болеющих (ЧДБ) в детской популяции остается стабильно высокой и составляет от 20 до 65% в разных возрастных группах. В 40% случаев к 7—8 годам у ЧДБ детей формируется хроническая патология, при этом риск хронизации прямо пропорционален увеличению кратности эпизодов острых респираторных инфекций (ОРИ) в течение года [2].
С персистенцией вирусных и бактериальных возбудителей, возникающей на фоне иммуносупрессии и усугубляющей ее, в последние годы связывают рецидивирующее течение респираторных заболеваний. По нашим данным, у ЧДБ детей в подавляющем большинстве случаев выявляются маркеры активной Эпштейна—Барр (ВЭБ), цитомегаловирусной (ЦМВ) и/или герпес-6-го типа вирусной (ВГЧ-6) инфекции. При бактериологическом исследовании из носо- и ротоглотки патогенная и условно-патогенная микрофлора в этиологически значимом количестве (>10 4 КОЕ/мл) определяется у половины ЧДБ детей [3, 4].
Наиболее часто у детей формируется хроническая аденотонзиллярная патология. Острый аденоидит является реакцией лимфоидного органа на антигенную стимуляцию (чаще вирусами) [5]. При персистенции инфекционного агента аденоидит приобретает затяжное и хроническое течение. Доля детей, больных хроническим аденоидитом и тонзиллитом, колеблется от 20 до 50% [6, 7]. Эпштейна—Барр вирусная инфекция является одной из наиболее частых причин хронического воспалительного процесса в носоглотке с выраженной гипертрофией глоточной миндалины, что приводит к формированию стойкой обструкции верхних дыхательных путей и нарушению носового дыхания [8—10].
Помимо ВЭБ, в ткани глоточной миндалины персистируют и другие вирусы. По данным S. Herberhold и соавт. [11], методом полимеразной цепной реакции (1ТДР) в образцах ткани глоточной миндалины людей, не болевших ОРВИ, в 97% случаев были обнаружены вирусы респираторной группы, при этом в 83% образцов выявлено более двух вирусов. Наиболее часто из образцов глоточной миндалины выделяли аденовирус (80%), вирус герпеса 7-го типа (51%), вирус герпеса 4-го типа (ВЭБ) (43%), энтеровирус (31%) [12].
В этиологии хронического аденоидита большую роль играет также хроническая бактериальная инфекция. При этом микроорганизмы формируют биопленку (сообщество бактериальных клеток, покрытых экзополисахаридным матриксом), которая является своеобразной защитой как от факторов неспецифического и специфического иммунитета, так и от антибактериальной активности лекарственных препаратов [13, 14].
Наиболее актуальными при хроническом воспалении в носоглотке считают S. pneumoniae и H. influenzae. У детей с хроническим аденоидитом пневмококк обнаружен в 50% случаев, гемофильная палочка — в 66,7% [15]. С поверхности глоточной миндалины наиболее часто выделяли Н. influenzae (64,4%), М. catarrhalis (35,6%) и S. aureus (33,3%). По данным отечественных авторов, основным возбудителем при хроническом аденоидите является S. aureus, высеваемый почти у 50% пациентов [17].
Цель исследования — определить частоту персистирующих инфекций у детей с хронической патологией ЛОР-органов и оценить возможности этиотропной терапии с учетом длительности заболевания.
Пациенты и методы
Под наблюдением находились 176 детей от 2 до 12 лет, обратившихся по поводу рекуррентного течения респираторных заболеваний с поражением верхних дыхательных путей в амбулаторно-поликлиническое отделение и отделение респираторных (капельных) инфекций ФГБУ НИИДИ ФМБА России. У всех детей, включенных в данное исследование, диагностировали гипертрофию аденоидов II—III степени, у 87 детей (49%) — сочетанную с гипертрофией небных миндалин II—III степени. Клиническое обследование и анализ медицинской документации показали, что в наблюдаемой группе ЧДБ детей хронический аденоидит был диагностирован у 142 (80,7%), рецидивирующий синусит — у 41 (23,3%), хронический тонзиллит — у 37 (21,0%), рецидивирующий отит у 28 (15,9%) детей.
Помимо клинико-лабораторного обследования, включавшего клинический анализ крови, общий анализ мочи, биохимический анализ крови с определением уровня аланинаминотрансферазы и антистрептолизина-О (АСЛ-О), пациентам проводили исследование крови и слюны с использованием ПЦР для выявления ДНК герпесвирусов 4-го типа — ВЭБ, 5-го типа — ЦМВ и герпеса 6-го типа (тест-системы производства ФГУН ЦНИИЭ Роспотребнадзора, Москва).
Полуколичественным бактериологическим (культуральным) методом оценивали качественный состав аэробной и факультативно анаэробной микрофлоры слизистой носо- и ротоглотки.
Дети были объединены в три группы в зависимости от длительности заболевания (табл. 1).

Таблица 1. Распределение детей с хронической ЛОР-патологией в зависимости от длительности заболевания
Высокая частота определения молекулярно-генетических маркеров герпесвирусной инфекции у детей с хронической ЛОР-патологией явилась обоснованием для назначения данной категории детей препаратов интерферона и индукторов интерферона с противовирусной, иммуномодулирующей, а также антилимфопролиферативной целью, что важно для пациентов с гиперплазией лимфоидной ткани в носо- и ротоглотке.
Терапия включала в себя поэтапное применение препаратов интерферона (ректальные или оральные формы) в течение 30—40 дней и индукторов интерферона в течение 20—50 дней. Виферон получали 56,2% детей, генферон — 11,9%, кипферон — 10,8%, реаферон-ЕС-липинт — 21,1%. При наличии гнойного процесса в носо- и/или ротоглотке или высеве β-гемолитического стрептококка группы, А противовирусная терапия интерфероном сочеталась с антибактериальной в 41,0% случаев (антибиотики и местные антисептики). В случае диагностированной стрептококковой инфекции (высев β-гемолитического стрептококка группы, А или повышение АСЛ-О) после 10—14-дневного курса антибиотика дети получали бициллинотерапию в течение полугода (15,9% пациентов). В качестве индуктора интерферона у 38,6% пациентов использовали изопринозин, у 14,7%) — амиксин, у 11,9% — циклоферон и у 14,2% — анаферон детский. 20,6% детей с диагностированной бактериальной носоглоточной инфекцией после курса интерферона получали системные лизаты (рибомунил — 13,6%), бронхомунал — 7,0% пациентов).
Эффект терапии оценивали по частоте обострений в течение года после лечения, сохранению жалоб в межрецидивный период (преимущественно на затруднение носового дыхания и храп во сне), наличию и характеру отделяемого из носа вне периода обострения, степени гипертрофии миндалин и аденоидов после лечения и через год.
Статистическая обработка материала проведена с помощью пакета программ Stat Soft Statistica for Windows XP v.7.0. Для случаев нормального распределения признака оценку значимости и достоверности различий средних значений проводили с помощью параметрического t-критерия Стьюдента.
Результаты и обсуждение
ДНК герпесвирусов 4, 5 и 6-го типов на первом году хронического заболевания ЛОР-органов выделяли у подавляющего большинства пациентов, причем как в слюне (95,8±2,3%), так и в крови (83,3±4,4%) (рис. 1). После 2 лет течения патологического процесса в носо- и ротоглотке частота выделения ДНК герпесвирусов 4, 5 и 6-го типов уменьшилась до 70,0±6,4% (p<0,001), причем в половине случаев ДНК удавалось выделить только в слюне, что свидетельствует о снижении активности вирусной инфекции.

Рис. 1. Частота выделения ДНК герпесвирусов 4, 5 и 6-го типов методом ПЦР из крови и слюны детей с хронической ЛОР-патологией в зависимости от длительности заболевания.
ДНК ВЭБ у детей с хронической ЛОР-патологией на первом году заболевания определяли в 63,9% случаев, в более поздние сроки — у 48,1±6,7%. ДНК ЦМВ выявляли на первом году заболевания у 48,6±5,9% детей, а после двух лет — только у 18,0±5,4% (p<0,001). Частота выделения ДНК герпеса 6-го типа также снижалась с 66,7±5,5% у пациентов на первом году хронического заболевания ЛОР-органов до 34,0±6,7% у детей с длительностью заболевания более двух лет (p<0,001).
Обращает на себя внимание снижение частоты выявления смешанных герпесвирусных инфекций (ГВИ). Если у детей 1-й группы смешанную ГВИ диагностировали у 70,8±5,4% пациентов, а моноинфекцию у 25,0±5,1%, то у детей с длительностью заболевания более 2 лет — смешанную ГВИ выявляли только в 24,0±6,0% случаев, а моноинфекцию — у 46,0±7,1% детей (p<0,001). Частота выделения ДНК ВЭБ, ЦМВ и ВГЧ-6 у детей с хронической патологией ЛОР-органов в зависимости от длительности заболевания представлена в табл. 2.

Таблица 2. Частота подтверждения моно- и микст-герпесвирусных инфекций (ВЭБ, ЦМВ и ВГЧ-6) методом ПЦР у детей с хронической ЛОР-патологией в зависимости от длительности заболевани, p±m% Примечание. * — достоверное отличие между показателями 1-й и 3-й групп; ** — достоверные отличия показателей 1-й и 2-й групп по сравнению с показателем 3-й группы.
При бактериологическом исследовании мазков из носо- и ротоглотки частота выделения патогенной и условно-патогенной микрофлоры в диагностически значимом количестве достоверно не отличалась в группах и отмечалась у 56,9±5,8% пациентов из 1-й группы, у 53,7±6,8% во 2-й и у 44,0±7,0% — в 3-й. Чаще других выделяли Staph. aureus, грибы рода Candida и β-гемолитический стрептококк группы, А (табл. 3).

Таблица 3. Частота выделения патогенной и условно-патогенной микрофлоры в диагностическом титре из носо- и ротоглотки ЧДБ детей с хронической патологией ЛОР-органов в зависимости от длительности заболевания, p±m% Примечание. * — достоверное отличие от частоты выделения остальных микроорганизмов, p
Анализ эффективности проведенной консервативной этиотропной и иммунотропной терапии детей с хроническими заболеваниями ЛОР-органов в зависимости от их длительности у ЧДБ детей представлен в табл. 4. Несмотря на то, что консервативная терапия во всех группах достоверно снижала частоту обострений в год, более значимый эффект был получен в группе с длительностью процесса до 1 года, в которой отмечено уменьшение гиперплазии глоточной миндалины как после курса терапии, так и через год после лечения (рис. 2).

Таблица 4. Частота обострений в год у детей с хронической патологией ЛОР-органов до и через 1 год после начала комплексной терапии в зависимости от длительности заболевания, p±m% Примечание. * — достоверное отличие от показателя до лечения, p

Рис. 2. Частота выявления гипертрофии аденоидов III степени у детей с хронической ЛОР-патологией до и после комплексной терапии в зависимости от длительности заболевания.
Нормализация носового дыхания и купирование воспалительного процесса в носо- и ротоглотке (отсутствие патологического отделяемого из носа в межрецидивный период) отмечалась у 77,8±4,9% пациентов с длительностью заболевания до 1 года, в 55,6±6,8% случаев при длительности от 1 года до 2 лет и только в 30,0±6,5% случаев при длительности более 2 лет.
Выводы
1. У ЧДБ детей с хроническими заболеваниями ЛОР-органов в 96% случаев выявлены молекулярно-генетические маркеры активной персистенции герпесвирусов 4, 5 и 6-го типов (ВЭБ, ЦМВ и ВГЧ-6), у половины пациентов — в ассоциации с бактериальными возбудителями.
2. Частота выделения ДНК герпесвирусов 4, 5 и 6-го типов из крови ЧДБ детей с хронической патологией ЛОР-органов снижается с 83% у больных с длительностью заболевания до 1 года до 34% при длительности процесса более 2 лет, однако выделение из слюны сохраняется у 70% таких пациентов.
3. Частота выделения патогенных и условно-патогенных бактериальных возбудителей в диагностически значимом количестве из носо- и ротоглотки детей с хронической патологией ЛОР-органов не зависит от длительности заболевания.
4. Эффективность консервативной этиотропной терапии детей с хронической ЛОР-патологией, сопряженной с гиперплазией аденоидов и миндалин, зависит от длительности патологического процесса и составляет 78% на первом году заболевания и 30% при длительности заболевания более 2 лет.
Персистентные инфекции в легких. Латентная инфекция в легких.
В последнее десятилетие в центре внимания исследователей различного профиля находятся сложные формы воспаления, явно отступающие от общепринятых канонов острых защитных реакций и характеризуемые своеобразными дисбалансами иммуноглобулинов и цитокинов. Эти формы воспаления характерны, прежде всего, для вирусной персистенции. Персистенция (постоянство, упорство) - понятие достаточно широкое и неоднозначное, которое, по современным представлениям, включает в себя несколько подвариантов: персистентная, латентная, хроническая и медленная инфекции, а также бессимптомное вирусоносительство.
Персистентными называют инфекции, при которых вирус либо его антигены в течение продолжительного времени обнаруживаются в организме человека. Указанное пребывание сопровождается определенными специфическими иммунологическими сдвигами. Клинические проявления заболевания могут быть выраженными, слабыми либо маскироваться симптомами общего хронического заболевания (кашель, слабость, субфебрилитет, одышка и т.д.), что нередко наблюдается у больных с хронической обструктивной болезнью легких и бронхиолите с облитерацией при нерсистенции респираторно-синцитиального вируса.
Латентная инфекция - это практически пожизненная инфекция, при которой вирус (чаще герпес) находится в наиболее тесном взаимодействии с геномом клетки и пребывает преимущественно то в дефектной (ДНК-транскрипт), то в полной инфекционной форме, что соответствует ремиссии и обострению. Активация латентной инфекции происходит, как правило, под влиянии других инфекций (чаще грипп), переохлаждения, перегрева, солнечной радиации, психических травм и т.д.
Наиболее типичным примером хронической инфекции является инфекция, вызываемая аденовирусами. Для нее характерна частая смена клинических ремиссий и обострений, но относительно благоприятный прогноз при своевременном и правильном лечении.
Медленная инфекция - имеет неизбежно летальный исход, характеризуется многомесячным или даже многолетним инкубационным периодом с последующим медленным, но неуклонным развитием симптомов заболевания (вирусы СПИД и спонгиозных энцефалитов).
Классификация вирусной персистенции весьма условна. При наличии отличительных свойств многие ее формы имеют общие черты: при всех вариантах весьма распространено формирование дефектных форм вируса, их тесное взаимодействие с геномом клетки-хозяина, чередование фаз обострения и клинической ремиссии. Вероятны переходы одной разновидности персистенция в другую, например персистентной инфекции в латентную или хроническую.
Как показали исследования, проведенные в Государственном научном центре пульмонологии (МЗ РФ), персистенция достаточно широко распространена не только при хронической, но и острой бронхолегочной патологии. При тяжелых полисегментарных пневмониях и острых абсцессах нередко отмечается замедленная элиминация респираторных вирусов и их компонентов из организма больного, что подтверждается и более длительными сроками образования специфических противовирусных иммуноглобулинов класса М и G. Персистенция сопровождается низкими показателями клеточного иммунитета (прежде всего Т-активные клетки), натуральной киллерной активности, всех видов интерферона. Иммуносупрессия, обусловленная вирусами, способствует более выраженной активации бактериальной флоры как аэробного, так и анаэробного плана.
При затяжных и рецидивирующих бронхитах, особенно с явлениями бронхоспазма, вирусы и вирусные компоненты удается обнаружить до 1,5-2 месяцев от начала заболевания. Их элиминация прямо коррелирует с исчезновением признаков воспаления бронхов.
При хронической обструктивной болезни легких и бронхиолите с явлениями облитерации у детей респираторно-синцитиальный вирус чрезвычайно часто выявляется как в период обострения, так и относительной клинической ремиссии.
У больных с ЛОР-патологией: аденоидитами, хроническими тонзиллитами и отитами основным персистирующим агентом является аденовирус. При одновременном наличии аденоидитов и шейных лимфоденитов чаще всего наблюдается ассоциация хронических аденовирусных и микоплазменных инфекций.
Особенности воспалительных реакций организма при вирусной персистенции чрезвычайно разнообразны, весьма вариабельны и зависят от громадного количества факторов, определяемых как макро-, так и микроорганизмами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

