Осложнения иммунотерапии при инфекционных заболеваниях
Обновлено: 25.04.2024
Инфекционные заболевания у пациентов со сниженным иммунитетом. Инфекции при иммунодефиците
Различные методы лечения или наследственная патология иммунной системы могут способствовать развитию инфекционного заболевания, обусловленного слабовирулентными штаммами микроорганизмов, или возникновению тяжёлых инфекций, связанных с патогенными возбудителями.
Недостаточность иммунной системы обычно возникает в результате воздействия нескольких факторов. Например, при нейтропении, развивающейся у пациентов, перенёсших пересадку костного мозга, повышена восприимчивость организма к бактериальным инфекциям, в то время как внутривенная катетеризация способствует развитию инфекции, вызванной Staphylococcus epidermidis.
Медицинские манипуляции часто нарушают физические барьеры на пути инфекции (например, катетеризация).
Нейтропения как причина инфекции при иммунодефиците
Гранулоцитопению обычно наблюдают при острой лейкемии или её лечении. Риск развития инфекции зависит от длительности и тяжести нейтропении. Бактериемию у таких больных обнаруживают в 40—70% случаев. Наиболее часто выделяют гра-мотрицательные бациллы (бактерии семейства Enterobacteriaceae и рода Pseudomonas). Они распространяются по организму в результате повреждения кишечника противоопухолевыми препаратами и облучением.
Кроме того, в этиологии сепсиса важную роль играют фамположительные микроорганизмы (S. epidermidis, S. mitis, S. oralis, S. aureus, Corynebacterium jeikeium и представители рода Enterococcus).
Несмотря на то что в большинстве случаев развитие кандидоза обусловлено приёмом антибактериальных препаратов, у пациентов с нейтропенией грибковые инфекции могут возникать de novo. В последнее время всё чаше сообщают о микозах, вызванных дрожжевыми грибами, такими как Candida krusei (характерна природная устойчивость к действию противогрибковых средств), различными видами родов Aspergillus (вызывают инвазивные заболевания) и Fusarium, а также Pseudallescheria boydii и Trichosporon beigelii.
Лечение лихорадки у пациентов с нейтропенией. Эмпирическая терапия включает карбапенем (или цефтазидим) и амикацин. Если лихорадка не исчезает, то дополнительно назначают гликопептидный антибиотик. Позже, если лихорадка сохраняется, высока вероятность развития микозов, поэтому для лечения используют амфотерицин В и итраконазол.
Профилактика инфекции у пациентов с нейтропенией. Вероятность развития инфекции у пациентов с нейтропенией заметно снижается, если в больнице их помещают в индивидуальный бокс и снабжают стерилизованной пищей и водой. Большое значение имеет соблюдение стерильного режима не только медицинским персоналом (мытьё рук и использование одноразовых резиновых перчаток), но и посетителями (ношение халатов и масок). Воздух, поступающий в палату, необходимо пропускать сквозь фильтр специальной очищающей от грибковых спор системы.
Приём нистатина и амфотерицина В внутрь позволяет снизить вероятность развития грибковой инфекции. Достаточно эффективные препараты — флуконазол и итраконазол. В некоторых медицинских центрах применяют профилактическую терапию 4-фторхинолонами, действие которых направлено против факультативных анаэробов кишечника (при сохранении анаэробной флоры).
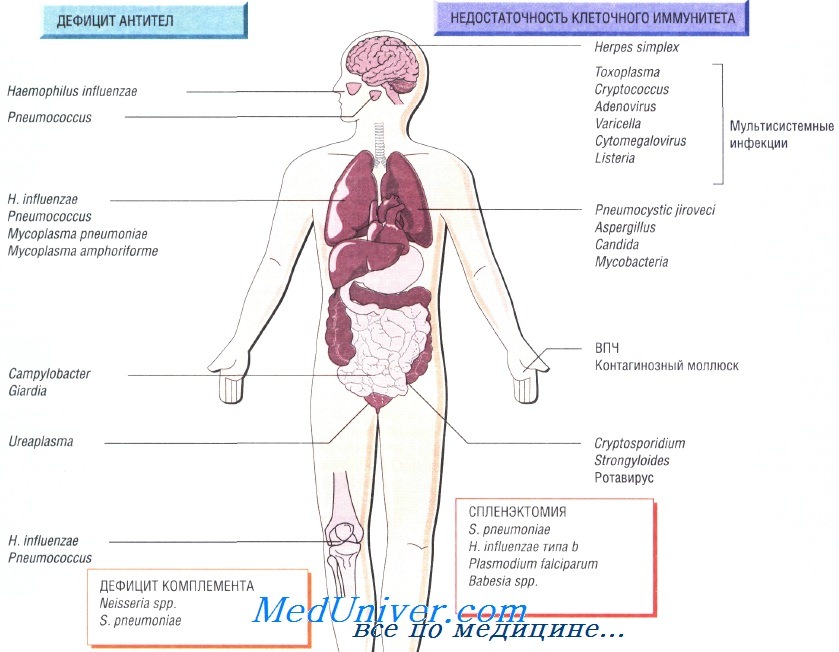
Причины инфекций при иммунодефиците
Недостаточность Т-клеточного иммунитета как причина инфекции при иммунодефиците
Недостаточность Т-клеточного иммунитета может быть обусловлена ВИЧ-инфекцией, противоопухолевой химиотерапией, приёмом глюкокортикоидных препаратов или трансплантацией органов. Врождённый дефицит обнаруживают достаточно редко. Он может быть связан только с недостаточностью функции Т-лимфоцитов или сопровождаться гипогаммаглобулинемией.
Возбудители инфекции при недостаточности Т-клеточного иммунитета. Основные возбудители — внутриклеточные патогенные микроорганизмы и паразиты:
• Toxoplasma gondii, Strongyloides stercoralis;
• Mycobacterium tuberculosis, M. avium-intracellulare;
• Listeria monocytogenes, Cryptococcus neoformans, Pneumocystis jiroveci;
• вирусы простого герпеса, цитомегаловирус, вирус опоясывающего герпеса и кори.
При осложнении кори гигантоклеточной пневмонией и энцефалитом у таких больных заболевание может приобрести угрожающий жизни характер.
Диагностика инфекции при недостаточности Т-клеточного иммунитета. Для диагностики инфекционных заболеваний применяют различные методы исследования. Для посева у пациентов отбирают не менее, чем два образца крови, взятых из разных мест.
Гиппогаммаглобулинемия как причина инфекции при недостаточности Т-клеточного иммунитета
Пациенты, страдающие сцепленной с Х-хромосомой агамма-глобулинемией, входят в группу повышенного риска заражения различными инфекциями в первые 6 мес своей жизни, в то время как люди с другим иммунодефицитом имеют повышенный риск на протяжении всей жизни. Функциональная гипогаммаглобулинемия возникает у больных с множественной миеломой.
Возбудителями рецидивирующих респираторных заболеваний у таких людей считают Streptococcus pneumoniae, недавно открытую Mycoplasma amphoriforme и не имеющего капсулы Haemophilus influenzae (вызывает бронхоэктазию). Персистирующие инфекции вызывают представители родов Giardia, Cryptosporidium и Campylobacter. Снизить частоту возникновения рецидивирующих инфекций помогает внутривенное введение иммуноглобулина.
Недостаточность комплемента как причина инфекции при недостаточности Т-клеточного иммунитета
Врождённую недостаточность комплемента наблюдают достаточно редко. Недостаточность последних компонентов системы комплемента (С7—С9) вызывает потерю способности лизировать грамотрицательные бактерии, в связи с чем повышается восприимчивость пациента к рецидивирующим инфекциям, вызванным микроорганизмами рода Neisseria. Недостаточность альтернативного пути системы комплемента приводит к развитию тяжёлых стрептококковых инфекций (S. pneumoniae), например менингита.
Приобретённая недостаточность системы комплемента часто возникает при системной красной волчанке.
Маннозасвязывающий лектин путь активации комплемента. Широкий спектр бактерий, грибов, вирусов и простейших прикрепляются к клеткам организма хозяина посредством маннозасвязывающего лектина. Есть данные, что при некоторых видах его недостаточности именно эти микроорганизмы вызывают наиболее частые и тяжёлые заболевания у людей с определёнными генотипами.
Инфекции возникающие после спленэктомии
Ежегодно после удаления селезёнки в 1% случаев наблюдают развитие тяжёлого сепсиса, при этом чаще всего заболевание возникает у младенцев и детей. Самую высокую смертность отмечают после спленэктомии, выполненной по поводу лимфомы и талассемии. У пациентов с серповидно-клеточной анемией развивается функциональная аспления. Риск развития сепсиса может со временем снизиться, но никогда не исчезнет окончательно.
Наиболее распространённый возбудитель инфекций (две трети всех случаев) — Streptococcus pneumoniae, но Н. influenzae и Е. coli также играют важную роль в этиологии инфекционных заболеваний у таких пациентов. Кроме того, спленэктомия повышает восприимчивость организма к инфекции, вызванной Capnocytophaga canimorsis (особенно после укусов собак). Малярия также может протекать крайне неблагоприятно (фульминантная форма).
Профилактика инфекции после спленэктомии. После удаления селезёнки всем пациентам необходимо провести вакцинацию, направленную против S. pneumoniae, менингококков и Н. influenzae типа В. Более эффективна иммунизация с использованием белковых конъюгированных вакцин. В некоторых случаях для профилактики применяют пенициллин V (в низких дозах).
Пациентов следует предупреждать о том, чтобы они сообщали своему лечащему врачу о любых признаках лихорадки, а также проинструктировать их относительно приёма антибиотиков (во избежание задержки лечения).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Токсичность иммунотерапии и ее последствия
Иммунотерапия подразумевает использование антител и их фрагментов в лечебных целях. Антитела представляют собой сложные гликопротеины, синтезируемые В-лимфоцитами и плазматическими клетками; они являются производными иммуноглобулинов G (IgG), М (IgM) и A (IgA). Главный иммуноглобулин в кровотоке — IgG; его же обычно применяют и в терапевтической практике.
Каждая молекула иммуноглобулина состоит из двух класс-специфичных тяжелых и двух легких цепей, соединенных таким образом, что образуется 2 участка связывания. IgG можно расщепить ферментом пепсином, получив антигенсвязывающий фрагмент F(ab)2 с двумя участками связывания и кристаллизующийся фрагмент Fc с молекулярной массой около 60 000, не участвующий в связывании антигена.
IgG можно также расщепить папаином, получив 2 идентичных фрагмента Fab с молекулярной массой у каждого примерно 50 000 и единственным участком связывания, а также константный фрагмент Fc, аминокислотная последовательность которого определяет основную функциональную активность молекулы.
а) История иммунотерапии. Антитела, полученные от лошадей, часто вызывали тяжелые, а иногда и летальные побочные эффекты. Этот риск иммунотерапии понизился с переходом на овечьи антитела и применение Fab вместо интактных IgG или F(ab)2. Потенциал иммунотерапии увеличился также благодаря получению антител против мелких молекул (гаптенов), например лекарственных средств в результате связывания гаптенов с белком-носителем.
б) Поликлональные и моноклональные антитела. Антитела, вырабатываемые животными, называются поликлональными, поскольку их дают многочисленные клоны В-лимфоцитов. Каждый из них синтезирует иммуноглобулины на "свой" участок (эпитоп) антигена, причем связываются они с ним с разной силой (аффинностью).
Большинство фирм и исследовательских групп производят моноклональные антитела, используя гибридомы, состоящие из В-лимфоцитов, слитых с опухолевыми клетками. Эти антитела связываются только с одним эпитопом и с одинаковой аффинностью, но бывают менее эффективными, чем их поликлональные аналоги.
в) Производство поликлональных антител. Поликлональные Fab против дигитоксина, трициклических антидепрессантов и некоторых змеиных ядов производятся следующим образом.
1. Выделяют или синтезируют соответствующий иммуноген.
2. Готовят водно-масляную эмульсию этого иммуногена в адъюванте Фрейнда.
3. Иммунизируют овцу 1 раз в месяц в 6 местах.
4. Регулярно берут у нее пробы крови и при достижении в ней требуемого титра (уровня) антител каждый месяц получают от овцы кровь (10 мл/кг массы тела).
5. Отделяют эритроциты от антисыворотки (сыворотки, содержащей антитела).
6. Осаждают фракцию иммуноглобулинов антисыворотки сульфатом натрия.
7. Расщепляют антитела папаином, получая специфичные и неспецифичные Fab.
8. Очищают специфичные Fab методом аффинной хроматографии.
г) Токсикокинетические критерии:
• Знание структуры активного токсина. Некоторые соединения действуют главным образом посредством своих метаболитов; нужны антитела, перекрестно реагирующие с этими активными метаболитами. У препаратов наперстянки реактивны как содержащийся в исходном лекарственном средстве дигоксин, так и его метаболиты. Сходный подход используется при отборе антител к трициклическим антидепрессантам.
• Знание молекулярного механизма действия токсина. Антитела к параквату неэффективно уменьшают его содержание в клетках легких из-за сильного связывания там этого вещества.
• Адекватные фармакокинетические параметры токсина. Если у токсина небольшой кажущийся объем распределения и высокий общий клиренс, иммунотерапия не рекомендуется. Достаточно классических методов выведения вещества из организма. Иммунотерапия наиболее эффективна в отношении токсинов с низким клиренсом и большим объемом распределения.
• Знание кривой зависимости "доза — летальность". Эта кривая нужна для оценки количества антигенсвязывающих центров (АСЦ) антител, необходимого для устранения с их помощью риска для жизни. Если кривая крутая, достаточно небольшого количества АСЦ (сердечные гликозиды, колхицин). Если вещество токсично только в высоких дозах (трицикличе-ские антидепрессанты, хлорохин), необходимо много АСЦ.
В иммунотерапии обычно используют Fab-фрагменты, поскольку они лучше диффундируют в компартментах тела и обеспечивают более высокий почечный клиренс конъюгатов токсин-АСЦ, чем IgG и (Fab)2.
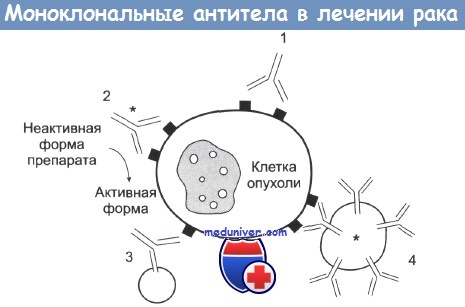
Действие mAb на клетку опухоли.
1 — антитело mAb связывается с антигеном опухолевой клетки и вызывает или ее комплемент-зависимую гибель, или гибель в результате антителозависимой атаки макрофагами.
2 — с mAb связан радиоактивный изотоп, токсин или цитокин, вызывающие гибель клетки. Также с антителами может быть связан фермент, участвующий в превращении препарата в активную форму.
3 — биспецифические mAb. Один сайт связывается с опухолевой клеткой, другой — с киллерной эффекторной клеткой.
4 — антитела mAb связаны с липосомами, которые содержат химотерапевтические препараты или токсины.
- Трициклические антидепрессанты. Токсичные дозы трициклических антидепрессантов (ТЦА) выше, чем удигоксина и колхицина. Следовательно, купирование токсичности первых может потребовать большого количества Fab. Сейчас разрабатываются антитела, распознающие главным образом трициклическое ядро, т. е. как саму молекулу ТЦА, так и ее активный деметилированный метаболит.
Исследования анти-ТЦА-препаратов на животных, похоже, говорят о нейтрализации действия ТЦА в сосудистом компартменте с уменьшением их распределения в сердце. Вероятно, это представляет интерес с точки зрения лечения острого отравления человека этими веществами.
При отравлении ТЦА (амитриптилином) в альфа-фазе периода полужизни, т. е. через 1,5—31 ч после перорального приема, возможны эпилептические припадки. Вероятно, объем распределения в этой фазе более значимо, чем другие параметры, коррелирует с симптомами острого отравления ТЦА. Он невелик, поэтому для понижения плазменных концентраций ТЦА необходимо относительно мало антидота.
При добавке бикарбоната натрия к анти-ТЦА-Fab индуцированное дезипрамином удлинение комплекса QRS у крыс, похоже, снижается сильнее, чем при использовании каждого из этих веществ по отдельности. В этой области необходимы дальнейшие исследования на животных и клинические испытания, запланированные уже на ближайшие годы.
- Колхицин. Колхицин, связываясь с тубулином, блокирует митоз в метафазе. Это связывание обратимо. Период полужизни комплекса тубулин—колхицин составляет около 36 ч. Колхицин токсичен на уровне многих органов. Тяжесть состояния и смертность четко зависят от дозы. После перорального приема от 0,5 до 0,8 мг/кг смертность колеблется в пределах 10—50 %, а если доза выше, достигает 100 %.
Летальная интоксикация отмечалась у взрослых, принявших 7—12 мг или получивших внутривенно 6 мг колхицина. В настоящее время лечение основано на очистке пищеварительного тракта путем раннего промывания желудка и интенсивной поддерживающей терапии, направленной на купирование шока, а также гематологических и коагуляционных расстройств, предупреждение сепсиса и коррекцию электролитного баланса.
Полезны бывают плазмозаменители (при шоке) и инотропные средства. Однако даже при интенсивной терапии смертность остается высокой. Антитела к колхицину, вероятно, способны удалить его из органов-мишеней еще до поражения их клеток. Эти антитела в любом случае показаны пациентам, принявшим дозу более 0,8 мг/кг, которая, скорее всего, смертельна.
Традиционная терапия малоэффективна из-за большого объема распределения колхицина и его низкой концентрации в кровотоке. У этого вещества низкий системный клиренс. Fab, полученные от коз, при введении мышам и кроликам улучшают выживаемость последних после отравления, повышают плазменную концентрацию колхицина в 10—16 раз, увеличивают площадь под кривой "плазменная концентрация — время", уменьшают свободную фракцию колхицина в плазме, в 24 раза снижают объем его распределения и увеличивают выводимое с мочой количество.
Козьи IgG-антитела к колхицину, введенные мышам, по-видимому, ослабляют токсический эффект и снижают смертность. Исследования на животных определили также особенности связывания колхицина с тубулином и антителами. Соответствующих данных по человеку пока нет. Это вещество быстро всасывается в пищеварительном тракте. Клинические испытания могли бы подтвердить пользу введения Fab в первые часы отравления. Для проведения таких испытаний надо получить на них разрешение соответствующих организаций, в частности Управления США по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA).

- Олеандр. Предварительные исследования лечения антидигоксиновыми Fab отравившихся олеандром собак наводят на мысль, что высокие дозы Fab могут устранять аритмию и гиперкалиемию. Для подтверждения этого вывода и оценки действия более низких доз Fab необходимы дальнейшие опыты.
- Паракват. Полученные от кроликов антитела к параквату вводили крысам перед внутривенной инъекцией им параквата в дозе 0,1 мг/кг. Плазменная концентрация токсина возросла, а его количество в моче снизилось. Таким образом, иммунотерапия приводит к секвестрированию параквата в плазменном компартменте, но не препятствует его накоплению в тканях. Исследования по этой проблеме продолжаются.
- Фенциклидин (РСР). Специфических антагонистов действия РСР нет. Это вещество липофильно, широко распределяется по внесосудистому компартменту и обладает низким почечным клиренсом. Такие токсикокинетические особенности говорят в пользу применения иммунотерапии. Высокоаффинные специфичные к РСР Fab-фрагменты теоретически должны привести к его перераспределению и инактивации в результате прочного связывания.
Исследования на животных высокоаффинных козьих антител продемонстрировали немедленное повышение сывороточной концентрации РСР в 11—56 раз, что говорит о необратимом удалении существенных количеств этого вещества из периферического компартмента. Наблюдалось также уменьшение объема распределения (VD) в 10 раз. Fab, по-видимому, не влияют на период полувыведения РСР (t1/2). Поскольку t1/2 = 0693VD/CLs (CLs — системный клиренс), а изменения VD и CLs одного порядка (примерно в 10 раз), это вполне естественно. Доля несвязанного РСР снижается примерно с 50 % перед применением Fab до менее 1 % после их введения.
Эффективны ли они в смысле устранения клинической картины интоксикации, еще предстоит выяснить.
- Мышьяк. Низкая молекулярная масса, большой объем распределения, антигенность и сильное действие соединений мышьяка делают их удобной моделью для изучения терапевтического применения антител. Овальбумин-азобензоларсенат индуцирует образование антител у мыши. Предварительные исследования говорят о слабом их влиянии на смертность этих животных от отравления мышьяком. Для ее заметного снижения, вероятно, потребуется дополнительная очистка антител. Определение эффективности иммунотерапии при таких отравлениях нуждается в дальнейшем изучении.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В последние годы в лечении онкологических заболеваний наибольший интерес представляют препараты, снимающие блок с иммунной системы и позволяющие ей самой работать против опухоли - ингибиторы иммунных контрольных точек (Immune checkpoint inhibitors). К ним относятся такие известные, без преувеличения совершившие революцию в онкологии, препараты, как Ipilimumab, Nivolumab, Pembrolizumab. Существует большой список онкологических заболеваний, в отношении которых уже достигнут эффект этих препаратов, и мы ожидаем расширения области их применения. Однако подобные методы лечения способны вызывать различные осложнения.

Осложнения, вызванные приемом этой группы препаратов
Первые признаки осложнений могут появляться уже после 2-3 введений препарата, как правило, на третьей неделе лечения – со стороны кожных покровов, на пятой – со стороны желудочно-кишечного тракта, позднее – со стороны эндокринной системы и печени. Очень важно как можно быстрее сообщить об этом лечащему врачу.
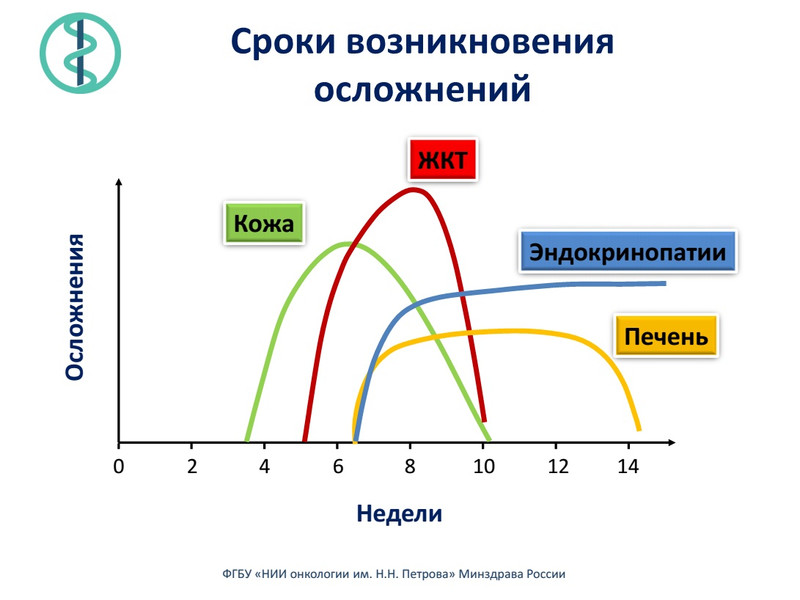
Большое значение в предупреждении появления и лечении этих симптомов имеет опыт лечебного учреждения. Данные препараты являются передовыми не только в России, но и в мире, некоторые пока еще не имеют государственной регистрации в нашей стране. Однако опыт их применения у россиян уже имеется в ряде специализированных центров. В Санкт-Петербурге к ним относятся НИИ онкологии им. Н.Н. Петрова, Ленинградский Городской онкологический диспансер, Онкоцентр. По существующей статистике, чем больше опыта у докторов, тем ниже частота проявления осложнений, особенно серьезных, у пациентов. Так же следует учитывать, что симптомы могут охватывать любую область организма и наличие в лечебном учреждении широкого спектра специалистов является весомым преимуществом. Существует определенный риск развития серьезных, даже угрожающих жизни пациента, побочных реакций. В этом случае требуется экстренная госпитализация больного и срочное начало лечения осложнений.

Действия врачей при возникновении симптомов
В первую очередь необходимо исключить другие причины, ведь симптомы, связанные с приемом ингибиторов, неспецифичны и схожи со многими расстройствами. Дальнейшие действия зависят от степени проявления осложнения. При легких проявлениях следует наблюдение, возможны такие меры, как симптоматическая терапия, отсрочка следующего введения препарата, лечение кортикостероидными гормонами. В случае тяжелых осложнений требуется госпитализация пациента. Доктор может назначить длительное (более четырех недель) лечение кортикостероидными гормонами в высоких дозах. Возможно даже применение иммуносупрессантов для прерывания побочной аутоиммунной реакции.
Симптомы осложнений
Пострадать может любой орган, но чаще всего симптомы проявляются в отношении кожи или желудочно-кишечного тракта. Симптомы можно спутать с обычными расстройствами и не придать им должного значения, что грозит серьезным ухудшением состояния пациента. Самыми распространенными осложнениями, наблюдающимися у 20-25% пациентов, являются колит (воспаление кишечника), диарея (понос), кожная сыпь, зуд. Реже страдают печень и эндокринная система.
Симптомами являются учащенный или жидкий стул с кровью или слизью. Очень важно сразу сообщить доктору о развитии этих симптомов. В тяжелых случаях, при позднем обращении и длительном течении осложнения, возможно появление язв и трещин в стенке кишки. При необходимости врач назначит эндоскопическое обследование кишечника (фиброколоноскопию). Доктор назначает диету, возможно с переходом на жидкую пищу. При эффективном лечении симптомы постепенно прекращаются, но возврат к обычному питанию происходит не сразу и только по согласованию с врачом. При колите, помимо диеты, назначается длительный прием кортикостероидов в течение 4-6 недель. В случае серьезных осложнений возможна госпитализация больного, назначение иммуносупрессантов.


Наиболее часто осложнения выражаются в виде сыпи, сопровождающейся зудом, в первую очередь на сгибательных поверхностях – локти, колени. В этом случае врач должен оценить площадь поражения, выраженность, наличие инфекции и назначить лечение.
Жалобы могут быть неспецифические: снижение аппетита, дискомфорт в правом подреберье, слабость, легкая тошнота. При тяжелом поражении печени – желтушное окрашивание кожи, склер глазных яблок. В то же время возможны такие изменения, которые можно увидеть только после проведения биохимического анализа крови, например, повышение уровня билирубина или ферментов печени (трансаминаз). Поэтому перед каждым введением препарата лечащий доктор всегда назначает контроль анализов крови.
Эндокринная система
Для контроля за состоянием эндокринной системы во время лечения доктор назначает регулярные анализы для определения уровня гормонов щитовидной железы и глюкозы в крови. Симптомы, связанные с осложнениями в работе эндокринной системы, знакомы обычному человеку: головные боли, утомляемость, снижение аппетита, легкая тошнота. Очень важно сразу сообщать доктору о наличии даже незначительных жалоб.
Дыхательная система
Значительные осложнения могут проявиться со стороны легочной системы. Может возникнуть пульмонит (или пневмонит), т.е. неинфекционное воспаление легочной ткани. При этом пациенты могут жаловаться, например, на одышку или сухой кашель. Доктор проводит дополнительное обследование, назначает рентгенограмму или компьютерную томограмму легких.
Если осложнений нет, специальная диета во время проведения иммунотерапии не требуется. Если же диета назначена, необходимо убедиться, что организм получает все необходимые витамины другими способами, например, при помощи регулярного приема поливитаминов.
Следует помнить, что осложнения, вызванные иммунотерапией, могут развиваться и в течение первых недель лечения, и через 2-3 года после его завершения.
Всем пациентам мы рекомендуем следовать несложным правилам:
- Не лечить осложнения самостоятельно
- Своевременно информировать лечащего врача обо всех изменениях самочувствия
- Не отказываться от госпитализации
Каждый пациент, получающий подобное лечение в НИИ онкологии им. Н.Н. Петрова, до его начала получает подробный инструктаж и всю необходимую информацию о возможных осложнениях. Также у нас существует круглосуточная линия поддержки, с помощью которой, в случае появления симптомов осложнений, пациент в любое время может получить грамотную консультацию по дальнейшим действиям.
Семенова Анна Игоревна – к.м.н., старший научный сотрудник отделения инновационных методов терапевтической онкологии и реабилитации НИИ онкологии им. Н.Н. Петрова
Лечение гнойных и септических осложнений ранений: иммунная терапия
Как известно, гнойно-септические процессы сопровождаются угнетением функциональной активности иммунокомпетентных клеток за счет иммуносупрессивного действия экзо- и эндотоксинов микроорганизмов, которое может усилиться под влиянием антибиотикотерапии. При этом уровень свободного эндотоксина увеличивается в плазме крови до 200 раз, вследствие его высвобождения из погибших бактерий, что, несмотря на уменьшение бактериемии, вносит свой вклад в усугубление симптомокомплекса гнойного процесса, провоцируя развитие генерализованной воспалительной реакции [Shenep J.L. et al., Talan D. A.].
Неэффективная терапия антибиотиками без учета спектра микрофлоры пострадавших и при несоблюдении оптимальных сроков ее проведения не только утяжеляет общее состояние больного и способствует формированию резистентных штаммов, но и увеличивает продолжительность лечения и его общую стоимость в среднем на 30%. По данным ВОЗ, летальность в группе больных с гнойно-септическими осложнениями значительно (в 10 и более раз) превышает летальность в группе больных с аналогичными исходными состояниями, но не имевших инфекционных осложнений.
Важную роль в предотвращении генерализации местного гнойного осложнения играет адекватная иммунная терапия. Согласно современным представлениям, используются два вида воздействия на иммунный статус пострадавшего — стимулирующая и заместительная терапия.
Что касается применения иммуностимуляторов (иммуномодуляторов) при гнойно-септических осложнениях, то рядом серьезных исследований доказано, что не всегда их включение в комплекс лечения осложнений сопровождается заметным клиническим эффектом. Как справедливо отметили И. А. Ерюхин и соавт., включение иммунокорригирующих препаратов в комплексное лечение гнойно-септических осложнений хорошо обосновано теоретически, но не всегда имеет яркое клиническое подтверждение их эффективности, особенно при лечении сепсиса. Возможно, как считают авторы, это происходит потому, что учитывается тяжесть процесса, а не его причины. Кроме того, отсутствуют простые и теоретически обоснованные лабораторные и клинические методы исследований, позволяющие идентифицировать динамику воспалительного и иммунного ответа, в том числе -динамику системной воспалительной и противовоспалительной реакций [Bone R. С.].
Более эффективными являются иммуноглобулиновые препараты и иммунные антибактериальные плазмы, целесообразность применения которых обусловлена механизмами их действия, а также патогенезом иммунодефи-цитных состояний при тяжелой травме и гнойно-септических осложнениях [Румянцев А. Г. и др., Mitov I.G., Terziiski D.G., Zanetti G. et al., Talan D.A.].
Иммуноглобулин для внутривенного введения имеет ряд существенных преимуществ по сравнению с иммуноглобулинами для внутримышечного введения, так как позволяет в течение короткого времени создать в крови эффективные терапевтические концентрации антител при минимальном риске развития побочных действий. Первичным эффектом иммуноглобулинов является их способность к специфическому распознаванию чужеродных агентов и связывание с ними. Часто само связывание антителами антигенов ведет к выраженному защитному эффекту и не требует активного подключения механизмов неспецифической защиты, как это бывает в случаях нейтрализации токсинов антитоксическими иммуноглобулинами.
Высокоэффективны также и нейтрализующие антитела, которые распознают и нейтрализуют антигены возбудителей, обеспечивающих инвазивность, т. е. способствуют прекращению распространения инфекции. Следует отметить, что не всегда специфическое взаимодействие антител с антигеном приводит к выраженному защитному эффекту. В этих случаях подключаются вторичные неспецифические механизмы, которые, в свою очередь, также стимулируются антителами.
Эффективность иммунотерапии гнойно-воспалительных осложнений в зависимости от сроков её проведения
| Сроки проведения иммунотерапии от первых признаков гнойного осложнения (недели) | % хороших и отличных результатов санации ран и полостей | % хороших и отличных результатов нормализации иммунограммы | Длительность стационарного лечения (дни) |
| 1-я | 885 | 92 | 32+1,8 |
| 3-4-я | 48 | 58 | 49+3,4 |
Вторичные (неспецифические) эффекты иммуноглобулинов — это активизация неспецифических защитных процессов, направленных на нейтрализацию и выведение чужеродных антигенов. Одним из этих механизмов является взаимодействие одного из фрагментов молекулы иммуноглобулина (Fc-фрагмент) с компонентами системы комплемента. За счет активации комплемента происходит лизис комплекса антиген-антитело.
Имуноглобулипы не только связывают генетически чужеродные организму молекулы и клетки, но и выполняют эффекторные и иммуномодулирующие функции, обусловленные усилением физиологических последствий связывания антигена. Кроме того, иммуноглобулины способны регулировать активность Т- и В-лимфоцитов, макрофагов, многократно усиливать антигенспецифический ответ, опосредованный Т-лимфоцитами и комплементом [Климович В.Б., Imbach P. et al.].
Положительный результат от включения в комплексное лечение как стандартного донорского иммуноглобулина, так и обогащенного IgM — пентаглобина — зависит от дозы и сроков их применения. Лишь при условии нейтрализации бактериальных эндотоксинов в течение первых суток после тяжелой травмы или от начала септического процесса можно рассчитывать на уменьшение биологических последствий эндотоксемии.
Одним из препаратов заместительного действия, компенсирующего функциональную недостаточность нейтрофилов у пациентов с гнойно-воспалительными осложнениями, является лейкокоицентрат донорской крови. Приемлемой считается терапевтическая доза, включающая более 1010 клеток, предпочтительнее доза, близкая к 1011 клеток. Трансфузии меньшего количества лейкоцитов не сопровождаются выраженным клиническим эффектом [Hubel K.D.C. et al., Van Buzik J.-A.H., Weisdorf D. J., Ying-Wei Lin et al.].
Несмотря на определенные успехи клинического использования лейкоцитной массы при лечении септических больных, переливание гранулоцитов не вошло в широкую практику лечения инфицированных пациентов с лейкопенией или фагоцитарной недостаточностью. Это обусловлено прежде всего тем, что имеются трудности получения этого компонента крови и его хранения. Установлено, что гранулоциты начинают терять свои функциональные свойства уже через 6 ч после их выделения, поэтому перелиты они должны быть в течение 12 ч после заготовки.
Важным условием применения лейкоцитной массы является строгое соблюдение схемы введения: интервал между трапсфузиями не должен быть более 2 сут. В противном случае можно спровоцировать иммунизирующий эффект, сопровождающийся выработкой противолсйкоцитарных антител. В то же время введение лейкоцитов иммунокомпрометированным пациентам с Т-лимфопенией и относительной недостаточностью Т-хелперов не сопровождается образованием противолейкоцитарных антител.
Суммируя накопленный опыт применения иммунных препаратов в лечении гнойно-воспалительных осложнений в послеоперационном периоде у пострадавших с множественными и сочетанными ранениями груди, следует признать, что использование иммунотропных препаратов существенно улучшает результаты лечения. Наиболее высокая эффективность лечения гнойно-воспалительных осложнений отмечена при проведении иммунотерапии на фоне адекватной антибактериальной, инфузионной, трансфузионной терапии, направленной на улучшение микроциркуляции, уменьшение интоксикации и способствующей выведению иммунных комплексов.
Сравнительный анализ таких показателей, как продолжительность периода санации гнойного очага, улучшение состояния больного, длительность стационарного лечения и положительная динамика параметров иммунограм-мы, свидетельствует о необходимости применения иммунотропных препаратов в ранние сроки развития гнойных осложнений. В наших наблюдениях при таком подходе удалось существенно сократить период купирования гнойного процесса у 88% больных, в результате чего средняя продолжительность лечения больных этой группы составила 32±1,8 дней. Назначение иммунотропных препаратов позже 20-х суток от начала гнойно-воспалительного процесса сопровождалось улучшением состояния и ускорением процесса очищения гнойных полостей только у 48 % больных. Длительность стационарного лечения у этих пациентов была значительно большей и составила в среднем 49+3,4 дня.
Положительная динамика параметров иммунограммы и клинического анализа крови выявлена у 92% больных при назначении иммунотерапии в ранние сроки и у 58% больных — при её проведении в поздние сроки от начала гнойно-воспалительного осложнения.
Необходимо отметить, что не во всех случаях применения иммунопрепаратов в оптимальные сроки были отмечены положительные сдвиги иммунного гомеостаза. В трех наблюдениях после применения тактивина и в двух - - миелопида в составе комплексного лечения пострадавших с гнойными осложнениями вопреки ожидаемому эффекту было отмечено усиление дисбаланса клеточных звеньев иммунной системы со снижением числа Т- и В-клеток и более выраженное подавление кислородного метаболизма нейтрофилов, обеспечивающего бактерицидность в процессе фагоцитоза.
Как правило, отрицательная динамика параметров иммунограммы имелась при проведении иммунотерапии на фоне сохраняющегося гнойного очага, в том числе и при его неадекватном дренировании. В таких случаях иммуносупрессивное действие гнойной интоксикации превалировало над иммуностимулирующим влиянием использованных препаратов. У этих пациентов с помощью иммунотерапии удавалось лишь предупредить развитие фатальной иммунодепрессии при продолжающейся гнойной интоксикации. Отсутствие положительной динамики иммунограммы на фоне лечения является прогностически неблагоприятным признаком и свидетельствует о том, что характер гнойного процесса приобретает признаки хронического. Это заставляет хирурга совместно с клиническим иммунологом искать причины неблагоприятного развития событий, в первую очередь — исключая наличие недренированных очагов гнойной инфекции.
Таким образом, выбор иммунопрепаратов определяется направленностью и степенью изменения параметров отдельных звеньев иммунной системы. Лейкопения и снижение фагоцитарной активности нейтрофилов при наличии гнойного процесса диктуют необходимость применения препаратов, активирующих лейкопоэз и созревание лейкоцитов, а также проведение заместительной терапии донорской лейкоцитной массой. Если на ранней стадии развития гнойного процесса имеется лимфопения и снижение фагоцитарной активности нейтрофилов, показана комбинация тимических пептидов или миелопептидов с иммуноглобулином для внутримышечного введения. При сочетанной недостаточности фагоцитарного и лимфоцитарного звеньев иммунной системы на фоне сохраняющейся интоксикации и повышения уровня циркулирующих иммунных комплексов эффективно (помимо использования иммунокорригирующих препаратов) проведение лечебного плазмафереза.
Видео иммунограмма в норме и при патологии
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Иммунотерапия при онкологии имеет определенные нежелательные явления и последствия, которые отличаются от побочных эффектов химиотерапии и таргетной терапии. Например, в некоторых случаях иммунопрепараты провоцируют иммунную систему атаковать здоровые органы и ткани пациента.

Круглова Марина Сергеевна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Ниволумаб – побочные эффекты
Ниволумаб действует на иммунную систему, и иногда она начинает атаковать не только раковые клетки, но и здоровые. Наиболее распространенные побочные действия иммунотерапии ниволумабом в большинстве случаев связаны с подобной активизацией иммунной системы. Обычно они отличаются от нежелательных явлений химиотерапии.
Поскольку интенсивность побочных действий ниволумаба, вызванных активизацией деятельности иммунной системы, в большинстве случаев можно снизить, важно вовремя их распознавать.
А так как ниволумаб непосредственно влияет на работу иммунной биосистемы, рекомендуется с осторожностью подходить к его применению.
Это связано с тем, что препарат Опдиво трансформирует работу практически всех органов: кожных покровов, печени и почек, гормональных систем (гипофиза, надпочечников, щитовидной, поджелудочной), сердечно-сосудистой системы.
Крайне важно, чтобы иммунотерапию проводил квалифицированный онколог-химиотерапевт, который имеет клинический опыт работы с ниволумабом и знает, как предотвратить и свести к минимуму возможные осложнения.
Наиболее частые побочные эффекты ниволумаба (в монотерапии или комбинации с ипилимумабом:
- Астения (повышенная утомляемость), ;
- Снижение аппетита; ;
- Озноб с лихорадочным состоянием;
- Боли в мышцах, костях и суставах, а также головные боли;
- Нефрит и нарушение функции почек;
- Нарушения в работе желудочно-кишечного тракта (запоры или диарея).
Для снижения риска возникновения нежелательных явлений мы проводим иммунотерапию под двойным контролем – лечащего врача-онколога и медсестры, а также собираем подробный анамнез на наличие аутоиммунных заболеваний, аллергических реакций и постоянного приема препаратов.
Спасибо за обращение в наш онкологический центр.
Мы свяжемся с Вами в ближайшее время.
Уварова Светлана Николаевна
Главный врач, онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Тверезовская Ирина Александровна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Буйнякова Анна Игоревна
Онколог-химиотерапевт, к.м.н., врач высшей категории, врач паллиативной медицины
Тверезовский Сергей Александрович
Хирург-онколог, онкодерматолог, маммолог, к.м.н, врач высшей категории
Круглова Марина Сергеевна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Ивченко Борис Викторович
Гастроэнтеролог-нутрициолог, терапевт, врач паллиативной медицины
Баженова Елена Анатольевна
Кардиолог, терапевт, к.м.н., врач высшей категории
Ушакова Вера Сергеевна
Ипилимумаб – побочные эффекты
Иммунопрепарат ипилимумаб (Ервой) предназначен для лечения неоперабельной метастатической меланомы. Особенности механизма действия ипилимумаба обусловливают совершенно отличный от других препаратов профиль токсичности.
Особенно осторожно он должен применяться у пациентов с тяжелыми аутоиммунными заболеваниями на интенсивной стадии развития, потому что активация иммунитета пациента может повлечь за собой реальную угрозу для организма в целом, вплоть до летальных последствий.

-
, лимфопения;
- Гипокалиемия, дегидратация; ,
- Головокружение, головные боли;
- Боль в глазах; снижение артериального давления;
- Нарушения работы ЖКТ: диарея, желудочно-кишечное кровотечение, колит, запор, гастроэзофагеальная рефлюксная болезнь, абдоминальные боли; , рповышение печеночных проб (билирубин, щелочная фосфотаза, АСТ, АЛТ);
- Тошнота, рвота; : сыпь, зуд, дерматит, эритема, витилиго, крапивница, сухость кожи;
- Миалгия, артралгия, костно-мышечная боль, мышечные спазмы;
- Реакции в месте инфузии препарата;
- Снижение массы тела.
Лечите осложнения вовремя. Нами разработаны подробные алгоритмы по выявлению и купированию данных нежелательных явлений ипилимумаба.
Пембролизумаб – побочные эффекты
Механизм действия иммунопрепарата пембролизумаб (коммерческое название Китруда) похож на ниволумаб – он помогает иммунной системе бороться с опухолевым клетками.
Как и любой препарат, пембролизумаб обладает нежелательными явлениями, но не у всех они возникают.
Основными побочными эффектами пембролизумаба являются повышенная утомляемость, сыпь, диарея, снижение аппетита, лихорадка, зуд, кашель, одышка, боль в мышцах, запор и тошнота.
Также при иммунотерапии пембролизумабом могут проявиться иммуноопосредованные побочные эффекты: пневмонит, колит, гепатит, нефрит и эндокринопатии.

Очень важно информировать своего лечащего врача обо всех симптомах и изменениях в самочувствии, которые возникают на фоне терапии Китрудой, чтобы предотвратить развитие осложнений и не прерывать лечение.
Атезолизумаб – побочные эффекты
Атезолизумаб (Тецентрик) — это гуманизированное моноклональное антитело из класса IgG1 с видоизмененным Fc-фрагментом, которое непосредственно связывается с PD-L1 и блокирует его взаимодействие с рецепторами PD-1 и B7.1. Таким образом, атезолизумаб способствует прекращению опосредованного PD-L1/PD-1 подавления иммунного ответа и вызывает реактивацию противоопухолевого иммунитета.
Вторая сторона медали современной иммунотерапии – это побочные эффекты, осложнения, иммуноопосредованные нежелательные явления. Они обусловлены избыточной активацией иммунной системы с аутоиммунным поражением нормальных тканей различных органов и систем.
Эти симптомы могут появиться уже в течение 1 недели или только через 54 недели от начала терапии, могут усиливаться в любой момент времени и приводить к фатальным последствиям.

Иммуноопосредованный пневмонит наблюдается у 2,7% пациентов. Начальные признаки и симптомы: сухой кашель, прогрессирующая одышка, хрипы на вдохе, гипоксия, лихорадка, боль в груди. Необходимо как можно раньше сообщать о симптомах, что позволит оперативно и эффективно предотвратить угрожающую жизни дыхательную недостаточность и срочного вмешательства, например, трахеостомии или интубации.
Иммуноопосредованный гепатит - у 2% пациентов. Проявляется преимущественно бессимптомным повышением активности печеночных ферментов, редко повышением общего билирубина и желтухой, потемнением мочи, посветлением кала, кожным зудом, повышением кровоточивости, иногда присутствие лихорадки. Крайне важен контроль функции печени до начала терапии и перед каждым введением, что позволит предотвратить развитие тяжелой степени гепатита и соответственно прерывание лечения.
Иммуноопосредованный колит - у 1.1%. Проявляется болями в животе, спазмы, изменения частоты и характера стула, слизь или кровь в стуле. В запущенной форме вплоть до перфорации кишечника, сепсиса, симптомов раздражения брюшины и кишечной непроходимости.
Иммуноопосредованное нарушение функции щитовидной железы:
Гипотериоз - у 5.2% в монотерапии и у 24.3% в комбинации с бевацизумабом. Признаки: низкий обмен веществ в организме-запор, холодовая непереносимость, забывчивость и изменения личности, увеличение веса, задержка жидкости, отечность лица, изменения голоса, сухость кожи.
Гипертиреоз – у 4.9% с карбоплатином и наб-паклитакселом, 6,35%- с бевацизумабом, 0.9%- в монотерапии. Признаки: внезапное снижение массы тела, несмотря на повышенный аппетит, беспокойство, раздражительность, бессонница, потливость, мелкий тремор.
Надпочечниковая недостаточность - у 0.4% может проявляться усталостью, анарексией, снижением массы тела, гиперкортезолэмией, гипонатриемией.
Развитие сахарного диабета в 0.3% случаев будет проявляться гипергликемией, заторможенностью, рвотой, болями в мышцах, полидипсией и полиурией и потребовать заместительной инсулинотерапии.
Симптомы панкреатита как осложнения иммунотерапии атезолизумабом - боли в спине/животе, анорексией, тошнотой, рвотой, отеком поджелудочной железы.
Иммуноопосредованный менингоэнцефалит встречается в 0.4% случаев и может проявляться головной болью, изменениями психического состояния, нарушеним зрения, судорогами, тошнотой, рвотой, ригидностью затылочных мышц ,ознобом, спутанностью сознания
Нейропатия может проявляться как неспецифической симптоматикой: головной болью, головокружением, парестезией (онемение, покалывание, болевые ощущения), так и расстройствами вегетативной нервной системы, птозом, двоением в глазах, дисфагией, быстро прогрессирующей мышечной слабостью, дыхательной недостаточностью.
При иммунотерапии атезолизумабом крайне важно информирование и обучение пациентов для оперативного выявления нежелательных явлений, так как своевременная диагностика и надлежащая медикаментозная терапия улучшит результаты и при этом не окажет негативного влияния на активность иммунопрепарата.
В клинике De Vita мы используем все возможности и достижения современной онкологии для лечения злокачественных опухолей, в том числе новейшие таргетную и иммунотерапию.
Мы накопили большой клинический опыт применения всех иммунопрепаратов, перечисленных в этой статье. Разработанные нами уникальные восстановительные программы, а также мультидисциплинарный подход с привлечением смежных специалистов – онкокардиолога, гастроэнтеролога-нутрициолога и онкокосметолога-дерматолога помогают делать лечение не только эффективным, но и максимально комфортным для пациента.
Читайте также:

