Отравление последствия отказали почки кома
Обновлено: 12.05.2024
Почечная недостаточность – острое или хроническое заболевание, при котором нарушаются фильтрационная, выделительная и другие функции почек с развитием многочисленных сбоев в работе всего организма. При этом происходит отравление собственными токсичными продуктами обмена веществ, попавшими в кровь – уремия. Патология, особенно при стремительном развитии, может угрожать жизни больного и требует скорейшего лечения.
Распространенность хронической болезни почек во всем мире в среднем составляет 13,4%. В России почечная недостаточность встречается у 36% лиц старше 60 лет и у 16% граждан трудоспособного возраста.
Причины
Хроническая форма заболевания чаще всего развивается как осложнение других патологий. Ранее основной причиной почечной недостаточности считался гломерулонефрит. В настоящее же время ведущее место занимают гипертоническая болезнь и сахарный диабет, приводящие к поражению мелких сосудов, питающих почки, и стойкому нарушению кровообращения в них.
Острая почечная недостаточность (ОПН) более чем в половине случаев связана с травмой или перенесенными операциями на органах малого таза. Развивается она также при неправильном приеме лекарственных препаратов, нарушении работы сердца, кровотечениях и шоке, генерализованной аллергической реакции, обезвоживании, циррозе, отравлении, аутоиммунных и инфекционных болезнях, онкологии, переливании несовместимой крови.
- плохая экология;
- особенности питания;
- мужской пол;
- возраст старше 60 лет;
- избыточный вес;
- вредные привычки – табакокурение, злоупотребление алкоголем;
- генетическая предрасположенность;
- прием некоторых медикаментов;
- инфекционные и паразитарные поражения;
- хронические заболевания сердечно-сосудистой (в том числе – повышенное артериальное давление), мочевыделительной и эндокринной систем;
- нарушение жирового обмена, дислипидемия, гиперхолестеринемия, метаболический синдром.
Симптомы почечной недостаточности
Почки не только очищают кровь от токсинов и выводят их из организма, но также регулируют водно-солевой баланс, контролируют уровень артериального давления, тонус сосудов, концентрацию гемоглобина, помогают в сохранении здоровья опорно-двигательного аппарата и сердца. Учитывая такое многообразие функций органа, почечная недостаточность проявляется многочисленными симптомами, выраженность которых зависит от стадии и формы заболевания.
При остром повреждении почек на начальной стадии имеются лишь проявления основного заболевания. Далее следует самая тяжелая, олигурическая стадия, продолжительностью до 3-х недель, со снижением суточного объема мочи менее 500 мл. Первым признаком болезни становится резкое уменьшение или прекращение мочеиспускания.
Состояние часто обратимо (если обратимо основное заболевание или состояние, приведшее к ОПН) и при правильном лечении переходит в полиурическую стадию почечной недостаточности с восстановлением объема мочи. При этом самочувствие пациента нормализуется, но может развиваться обезвоживание организма и присоединиться инфекция. Стадия полного восстановления продолжается от шести месяцев до года. При выраженных нарушениях состояние переходит в хроническую форму.
Хроническая почечная недостаточность (ХПН) развивается медленно, в течение нескольких месяцев и даже лет, и приводит к стойким изменениям в органе. На начальном этапе специфических симптомов обычно не бывает, но иногда человек может заметить снижение объема выделяемой мочи. Либо единственным проявлением патологии может быть никтурия – частое ночное мочеиспускание.
- апатия, общая слабость;
- жажда;
- неприятный вкус во рту;
- расстройство сна;
- ухудшение памяти;
- тошнота.
Осложнения
Болезнь осложняется появлением артериальной гипертензии, анемии, перикардита, аритмии и сердечной недостаточности, остеопороза, подагры, энцефалопатии, язвенной болезни желудка и двенадцатиперстной кишки, атеросклероза сосудов с развитием инфаркта и инсульта, синдрома беспокойных ног.
У детей почечная недостаточность приводит к задержке роста костной ткани.
Развитие почечной недостаточности у женщин во время беременности сопряжено с невынашиванием плода или формированием у него врожденных пороков.
Без лечения ХПН может закончиться смертью пациента от сердечно-сосудистых осложнений или уремической комы.
Диагностика
При первичном обследовании врач собирает анамнез заболевания, уточняя жалобы и давность симптомов. Далее проводятся осмотр кожных покровов, пальпация и поколачивание пальцами поясничной области.
-
. Метод позволяет установить причину заболевания. Примесь крови, наличие эритроцитов в биоматериале свидетельствуют о мочекаменной болезни, гломерулонефрите, инфекции, новообразовании или травме. Лейкоциты указывают на инфекционный либо аутоиммунный процесс. Также может снижаться плотность мочи, присутствовать белок и восковидные цилиндры в ней. . Повышение лейкоцитов и СОЭ говорит об инфекционном процессе, а уменьшение количества эритроцитов и гемоглобина в крови свидетельствует о сопутствующей почечной недостаточности анемии. . Увеличение в сывороточной крови мочевины и креатинина служит основным признаком почечной недостаточности. Эти вещества образуются в процессе распада белков и могут выводиться из организма исключительно с мочой. Прогрессирующий рост концентрации креатинина является главным диагностическим критерием тяжести заболевания. Сахарный диабет – одна из наиболее частых причин ХПН, однако и без эндокринных заболеваний при дисфункции почек есть склонность к умеренному повышению глюкозы в крови. Значительное увеличение уровня калия сопровождает выраженное нарушение функции почек, а высокая концентрация мочевой кислоты характерна для подагры и может привести к развитию мочекаменной болезни. Также в анализах крови при почечной недостаточности часто снижены альбумин, кальций, повышены триглицериды, щелочная фосфатаза, фосфор и холестерин.
- Биопсия почек. В сложных диагностических случаях может осуществляться забор небольшой части почечной ткани, которая подвергается последующему осмотру через микроскоп. Метод позволяет обнаружить характерные гистологические признаки ХПН – замещение клубочков почек рубцовой тканью.
- Ультразвуковое исследование органов малого таза. Важное место в диагностике почечной недостаточности занимает УЗИ почек. При ХПН отмечается их уменьшение (сморщивание) вместе с истончением наружного слоя. Также метод применяется для обнаружения новообразований, камней или кист.
- Компьютерная и магнитно-резонансная томография брюшной полости. Более точный способ визуализации опухолей, кист и конкрементов размером даже менее 5 мм.
Лечение почечной недостаточности
Обязательно проводятся диагностика и лечение патологии, послужившей причиной почечной недостаточности, а также устранение факторов риска.
- Ограничение потребления жидкости.
- Отказ от приема ряда медикаментов.
- Коррекция питания. Диета при почечной недостаточности предполагает ограничение продуктов и напитков с повышенным содержанием натрия, фосфора, калия. Это поваренная соль, молочные продукты, печень, бобовые, орехи. Количество потребляемого белка также строго дозируется.
При выраженном или длительном нарушении фильтрационной функции почек пациенту показано аппаратное очищение крови – гемодиализ. Процедура проводится регулярно и позволяет убрать из организма токсичные вещества. Альтернативой выступает перитонеальный диализ, при котором в брюшную полость вводится с последующим удалением специальный раствор, забирающий на себя вредные вещества.
В случае тяжелого течения хронической почечной недостаточности выполняется операция по трансплантации почки. После пересадки проводится курс терапии препаратами, подавляющими иммунитет, чтобы не произошло отторжения донорской ткани.
Токсическая нефропатия — это повреждение гломерулярного аппарата и почечных канальцев, вызванное действием экзо- и эндотоксинов, гемодинамическими и метаболическими нарушениями при отравлениях. Проявляется болями в пояснице, астеническим синдромом, отечностью, олигоанурией, которая впоследствии сменяется полиурией, полиорганными нарушениями. Диагностируется при помощи общего, биохимического анализов крови и мочи, проб Реберга, Зимницкого, УЗИ и томографии почек, УЗДГ почечных сосудов, химико-токсикологических исследований. Лечение включает проведение дезинтоксикационной терапии, инфузионной коррекции нарушений метаболизма, ЗПТ.
МКБ-10
Общие сведения
Токсическая нефропатия — собирательное понятие, объединяющее ряд нефрологических заболеваний со сходным этиопатогенезом и клинической картиной. Распространенность патологии достигает 0,04%, что составляет до 20% всех регистрируемых случаев ОПН. Рост заболеваемости связан со все более широким применением химических веществ на различных производствах и в быту: по наблюдениям, ежегодно до 10 млн. человек постоянно контактирует с нефротоксичными химикатами. Кроме того, обратной стороной успехов фармацевтической отрасли стало появление новых лекарственных средств, оказывающих влияние на почки. Актуальность своевременного выявления токсической формы нефропатий обусловлена высоким уровнем смертности и тяжелыми исходами при необратимой деструкции ткани почек.

Причины
Поражение почечной паренхимы обусловлено воздействием химических веществ, оказывающих прямой или опосредованный нефротоксический эффект. В большинстве случаев ренальную дисфункцию, а в тяжелых случаях и деструкцию тканей, вызывают экзогенные производственные и бытовые яды, хотя у некоторых пациентов заболевание вызвано эндогенной интоксикацией. Специалисты в сфере урологии и нефрологии выделяют следующих группы причин, которые приводят к развитию нефропатии:
- Прием веществ с нефротоксическим эффектом. При попадании в почки ядов этой группы возникают острая гломерулопатия или тубулярный некроз, вызванный реабсорбцией большого количества токсических веществ. Непосредственным повреждающим эффектом на почечную ткань обладают соли тяжелых металлов (кадмия, свинца, ртути, золота, мышьяка, йода, висмута, хрома и др.), этиленгликоль, щавелевая и борная кислоты, бензин, фенол, толуол, орелланиновые грибные токсины, яды некоторых животных.
- Опосредованное токсическое повреждение почек. Отравления веществами с гемолитическим эффектом (уксусной кислотой, мышьяковистым водородом, медным купоросом, змеиным ядом и др.) осложняются закупоркой нефронов гемоглобином. Аналогичное повреждение вызывают массивное размозжение тканей и синдром длительного сдавления, при которых наблюдается миоглобинурия. При токсическом поражении печени ренальная паренхима вторично повреждается ксенобиотиками и эндогенными токсинами.
- Общие клинические проявления отравления. Ряд химических веществ не оказывают прямого нефротоксического эффекта, однако системные проявления, возникающие при их приеме, приводят к тяжелой ренальной дисфункции. Чаще всего токсические формы нефропатии развиваются на фоне отравлений с клиникой шока, некомпенсированного ацидоза, выраженных метаболических расстройств. Такая же ситуация возникает под влиянием эндо- и экзотоксинов патогенной и условно-патогенной микрофлоры.
Постоянное расширение ассортимента медикаментозных препаратов, в первую очередь антибактериальных и противоопухолевых средств, привело к увеличению количества случаев токсической лекарственной нефропатии. По результатам исследований, более чем у 30% пациентов неолигурическая почечная недостаточность связана с приемом фармацевтических препаратов.
Нефротоксичные медикаменты могут прямо повреждать почечные канальцы (аминогликозиды, амфотерицины, иммуноглобулины, НПВС и др.), вызывать их закупорку (сульфаниламиды, циклоспорины, производные пуриновых нуклеозидов), системно нарушать ренальную гемодинамику (β-адреноблокаторы, некоторые диуретики) или оказывать сочетанное действие. Развитие токсической ятрогенной нефропатии также возможно при проведении лучевой терапии.
Патогенез
Механизм развития токсической нефропатии определяется причинами, спровоцировавшими почечную дисфункцию. Патогенез расстройств, вызванных нефротоксинами прямого действия, основан на нарушении биохимических процессов в нефронах, эпителиоцитах проксимальных и дистальных канальцев. После фильтрации клубочками токсическое вещество попадает в канальцевую систему, где вследствие реабсорбции воды его уровень возрастает почти в 100 раз. Возникающий градиент концентрации способствует поступлению и накоплению ксенобиотика в канальцевом эпителии до определенного критического уровня.
В зависимости от типа экзотоксина в эпителиоцитах происходят процессы деструкции клеточных и митохондриальных мембран, лизосом, компонентов цитоплазмы, гладкого эндоплазматического ретикулума, рибосом и т. п. с развитием в наиболее тяжелых случаях острого тубулярного некроза. Некоторые нефротоксины за счет инициации гипериммунных процессов разрушают гломерулярный аппарат коркового слоя. Осаждение в клубочковых структурах иммунных комплексов или образование в мембранах комплексных антигенов с последующей атакой антител провоцируют начало острого гломерулонефрита или интерстициального нефрита без повреждения канальцевых эпителиоцитов. Важным фактором прямой нефротоксичности является способность некоторых веществ стимулировать образование свободных радикалов.
Патогенез опосредованного повреждения почек при закупорке канальцев основан на развитии в их клетках некротических процессов, нарушении реабсорбционной способности. Внутриренальный застой мочи сопровождается ретроградным током гломерулярного фильтрата и последующим повреждением нефронов. При нефропатиях, возникших на фоне общих отравлений, основой патоморфологических изменений обычно становится ишемия клеток и нарушение биохимических процессов за счет кислотно-щелочного и водно-электролитного дисбаланса. На начальном этапе возникает дисфункция эпителиоцитов, которая впоследствии может осложниться токсической дегенерацией и некрозом канальцевого эпителия, деструкцией гломерулярных базальных мембран, интерстициальным отеком.
Классификация
Систематизация форм токсической нефропатии проводится с учетом особенностей этиопатогенеза заболевания и тяжести симптоматики. Такой подход позволяет выработать оптимальную тактику ведения пациента, а в ряде случаев предупредить развитие необратимой деструкции тканей. С учетом этиологического фактора и механизма повреждения почек различают следующие формы заболевания:
- Токсическая специфическая нефропатия. Развивается под влиянием экзогенных и эндогенных веществ с прямыми и опосредованным нефротоксическим эффектом. Отличается быстрым развитием тканевой деструкции, которая у части пациентов является необратимой. Чаще требует раннего начала заместительной почечной терапии.
- Токсическая неспецифическая нефропатия. Осложняет течение отравлений и заболеваний с выраженным интоксикационным синдромом, при которых ведущими становятся гемодинамические и метаболические расстройства. На начальных этапах нарушения носят функциональный характер и лишь позднее начинается разрушение тканей.
При легком течении нефропатия выявляется лабораторно: в клиническом анализе мочи определяется повышенное содержание белка, лейкоцитов, эритроцитов, появляются цилиндры. Средняя степень характеризуется уменьшением количества мочи и нарушением фильтрационной функции с увеличением уровня мочевины, креатинина, калия в сыворотке крови. Для тяжелого течения характерна клиника ОПН, вплоть до наступления уремической комы.
Симптомы токсической нефропатии
Возникают тошнота, рвота, понос. Кожные покровы и видимые слизистые становятся сухими, желтушными. Нарастание почечной недостаточности сопровождается практически полным прекращением мочевыделения, усилением отечности, ее нисходящим распространением на другие отделы тела, появлением петехиальной сыпи. При тяжелых поражениях развивается мозговая симптоматика — вялость, заторможенность, оглушенность, слуховые, зрительные, тактильные галлюцинации, судорожный синдром. Признаки выраженной ренальной дисфункции обычно сохраняются в течение 7-14 суток.
На следующем этапе развития заболевания, длящемся от 10-15 до 30 дней, олигоанурия сменяется постепенным усилением диуреза. Больной выделяет за сутки от 1,8 до 5-8 л и более мочи. Сохраняются слабость, утомляемость, мучительная жажда, уменьшается масса тела. Длительность периода реконвалесценции при интоксикационной нефропатии зависит от объема и характера поражения. Обычно для восстановления функциональной состоятельности органа требуется от 6 месяцев до 2 лет.
Осложнения
В 20-70% случаев токсическая нефропатия завершается летальным исходом из-за массивной необратимой деструкции ренальной паренхимы. Снижение фильтрационной функции у пациентов с ОПН приводит к гиперкалиемии с замедлением сердечного ритма, фибрилляцией и асистолией желудочков. Нарушение работы сердца в сочетании с гипопротеинемией повышает риск развития отека легких.
Длительная уремия сопровождается усиленным выделением азотистых метаболитов через кожу, серозные и слизистые оболочки с развитием уремического перикардита, плеврита, гастрита, энтероколита, ларинготрахеита, токсическим поражением печени, костного мозга. При нарушении секреции компонентов ренин-ангиотензиновой системы возможно развитие артериальной гипертензии. Отдаленными последствиями токсического поражения почек являются хронический тубулоинтерстициальный нефрит, хроническая почечная недостаточность, новообразования органов мочевыделительного тракта.
Диагностика
Постановка диагноза токсической нефропатии обычно не представляет сложности в тех случаях, когда заболевание возникло после отравления химическим веществом. Диагностический поиск направлен на оценку характера, объема возможного повреждения тканей, определение выраженности ренальной дисфункции. Пациентам с нефропатией рекомендованы следующие лабораторно-инструментальные методы исследований:
- Общий анализ мочи. Определяются протеинурия, лейкоцитурия, микрогематурия, цилиндрурия. Относительная плотность мочи в олигоанурической фазе превышает 1030 г/л, в полиурической составляет ниже 1003 г/л. Дополнительное проведение пробы Зимницкого при полиурии выявляет снижение концентрационной функции.
- Биохимический анализ крови. До восстановления объема диуреза повышаются сывороточные уровни креатинина, мочевой кислоты, азота мочевины, калия, кальция, неорганического фосфора. Нарушение фильтрационной способности гломерул также подтверждается результатами нефрологического комплекса и пробы Реберга.
- УЗИ почек. При эхографии нефропатия токсического типа проявляется увеличением размеров почечной паренхимы за счет интерстициального и лимфостатического отека. Участки некроза имеют вид гипоэхогенных полостей или гиперэхогенных включений. УЗДГ ренальных сосудов выявляет гемодинамические нарушения.
- Томография почек. Компьютерная томография почек позволяет получить послойное изображение ренальных тканей и обнаружить даже небольшие участки деструкции. В целях безопасности при токсических поражениях исследование рекомендуется проводить без контраста или заменить его МРТ, хотя в таком случае информативность несколько снижается.
Для подтверждения токсического характера нефрологической патологии по возможности проводятся химико-токсикологические исследования, позволяющие установить химическое вещество, которое вызвало расстройство. Контрастные методы исследований (экскреторная урография, ангиография почек) применяют с осторожностью в связи с риском усугубления клинической ситуации контраст-индуцированными деструктивными процессами. Для контроля за состоянием других органов и систем проводятся биохимические пробы печени, коагулограмма, ЭКГ. Изменения общего анализа крови неспецифичны: могут выявляться анемия, умеренный лейкоцитоз, повышение СОЭ, тромбоцитопения.
Нефропатию токсического происхождения дифференцируют со вторичными нефропатиями другого генеза (контраст-индуцированной, диабетической, дисметаболической и др.), острым гломерулонефритом, ишемическим некрозом почек, травматическими повреждениями почечной паренхимы, атероэмболической болезнью. По назначению уролога-нефролога пациента консультируют токсиколог, анестезиолог-реаниматолог, невролог, терапевт, кардиолог, пульмонолог, гепатолог.
Лечение токсической нефропатии
Больных, почки которых повреждены в результате отравления экзо- или эндотоксинами, госпитализируют в палату интенсивной терапии. Основными терапевтическими задачами являются скорейшая элиминация химического вещества, коррекция метаболических расстройств, предупреждение возможных осложнений. С учетом этапа заболевания пациентам показаны:
- Дезинтоксикационная терапия. Проводится в первые часы и сутки после отравления. Для ускоренного выведения токсина проводят промывание желудка, форсированный диурез с назначением осмотических мочегонных и салуретиков, используют адсорбенты, слабительные средства, специфические антидоты. В сложных случаях эффективны плазмаферез, гемосорбция, гемофильтрация, ультрафильтрация, гемодиализ, перитонеальный диализ. Некоторым пациентам назначают переливание крови и ее компонентов.
- Инфузионная коррекция метаболических нарушений. Начинается сразу после госпитализации и продолжается в олигоанурическом периоде ОПН. Для восстановления электролитного баланса и кислотно-щелочного равновесия применяют антагонисты калия (обычно — препараты кальция), инфузию глюкозы с инсулином, ощелачивающие полиионные растворы. Возможен дальнейший прием энтеросорбентов, связывающих токсические метаболиты. При значительной ренальной дисфункции оправдано проведение ЗПТ.
При утяжелении состояния больного проводится комплексная противошоковая терапия, купируются неотложные состояния (уремическая кома, отек легких, судорожный синдром, гипертонический криз). В полиурической фазе продолжается массивная (до 5-6 л/сут) инфузионная терапия для поддержания ОЦК и физиологической концентрации метаболитов. На этапе восстановления проводится общеукрепляющее лечение и определяется тактика дальнейшего ведения пациента с учетом степени сохранности почечных функций.
Прогноз и профилактика
Токсическая нефропатия — тяжелое, прогностически неблагоприятное расстройство с высокими показателями летальности. Своевременное установление токсина, правильная оценка морфологической сохранности и функциональной состоятельности почечной паренхимы, проведение адекватной интенсивной терапии повышают шансы благоприятного исхода нефропатии. Профилактика заболевания направлена на предупреждение попадания в организм токсических веществ: ограничение времени контакта с нефротоксичными ядами, использование средств индивидуальной защиты (респираторов, защитной одежды), отказ от употребления в пищу незнакомых грибов.
Работникам предприятий с вредными условиями производства рекомендовано прохождение профилактических медосмотров для раннего выявления почечной дисфункции. Для снижения количества случаев гемодинамического и метаболического поражения почечных клеток при системных нарушениях пациентам с отравлениями рекомендован регулярный контроль функциональной состоятельности почек и адекватное купирование острого состояния. С учетом роста распространенности лекарственных нефропатий при назначении нефротоксичных лекарственных средств необходимо тщательное обследование пациента для выявления предпосылок к токсическому повреждению ренальной паренхимы.
2. Патогенез токсических нефропатий/ Гоженко А.И. // Актуальные проблемы транспортной медицины. — 2006 — № 2.
3. Клинико-морфологические изменения при токсической нефропатии, вызванной отравлением некоторыми спиртсодержащими жидкостями: Автореферат диссертации/ Морозов В.И. – 1996.
4. Механизмы хронической токсической нефропатии у рабочих химической промышленности: Автореферат диссертации/ Письменский А.В. – 2006.
Алкогольная нефропатия – это хроническое поражение почек воспалительного характера, в основе которого лежат аутоиммунные механизмы, индуцированные воздействием на организм этилового спирта и его метаболитов. Выраженность симптомов зависит от типа патологии, преобладает бессимптомное течение до момента развития признаков хронической почечной недостаточности, при некоторых формах наблюдается прогрессирующая гематурия и гипертензия. Диагностика алкогольной нефропатии производится на основании данных физикального осмотра, лабораторных и функциональных исследований. Лечение включает в себя запрет на прием алкогольных напитков и симптоматическую терапию.
МКБ-10
Общие сведения

Причины
Существует несколько основных теорий развития алкогольной нефропатии, достоверных и однозначных данных в пользу какой-либо из них пока нет. Причины отсутствия консенсуса заключаются в разнообразных клинических и морфологических проявлениях алкогольной нефропатии, что дает основание предполагать наличие нескольких механизмов поражения мочевыделительной системы. Диапазон мнений относительно характера заболевания довольно широкий – от утверждений, что нефропатия является частью алкогольной болезни до предложений разделить АН на несколько сходных по течению патологий с различной этиологией. Наиболее признанными теориями развития данного состояния в современной урологии считаются следующие:
- Иммунологические причины. Существует ряд иммунологических механизмов повреждения тканей почек, которые могут быть связаны с алкогольной интоксикацией. В первую очередь это сенсибилизация к антигенам алкогольного гиалина с выделением иммуноглобулинов А, способных повреждать мембраны нефронов. Похожий механизм – прямое цитотоксическое воздействие этанола и продуктов его метаболизма посредством стимуляции выделения цитокинов.
- Инфекционные причины. Некоторые исследователи полагают, что алкоголь снижает уровень защиты организма от инфекций, включая вирус гепатита С и некоторые бактерии (кишечную палочку). В результате этого наряду с прямым воздействием инфекционных агентов на различные органы-мишени возникает косвенное поражение почек.
- Системные причины. Этанол является системным ядом, при продолжительном употреблении провоцирует повышение артериального давления, поражение печени, ЖКТ, поджелудочной железы, метаболические нарушения (аномалии пуринового обмена). Существует мнение, что эти факторы играют определяющую роль в патогенезе алкогольной нефропатии.
Современные исследователи склоняются к мнению, что развитие АХГН имеет многофакторную природу, в патогенезе большей или меньшей степени участвуют все вышеперечисленные процессы. Неизвестна роль генетической предрасположенности, хотя наличие широкого спектра индивидуальных особенностей заболевания указывает на ее наличие. Факторами риска могут выступать ранее перенесенные патологии почек, сахарный диабет, артериальная гипертензия, однако в подобных случаях дифференцировать алкогольный гломерулонефрит от форм вторичной нефропатии иного типа крайне сложно.
Патогенез
Механизм развития алкогольной нефропатии очень сложен из-за многочисленности патогенетических факторов, влияние каждого из которых сильно различается у разных больных. Именно это дает некоторым исследователям основание полагать, что АХГН – лишь составная часть симптомокомплекса алкогольной болезни. Практически у всех пациентов обнаруживаются антитела IgA против компонентов нефрона, что говорит об аутоиммунном механизме патогенеза. При приеме больших доз этанола последний может прямо стимулировать выделение цитокинов в почках, что приводит к разрушению нефронов.
При систематическом употреблении спиртного метаболиты этанола вызывают повреждение печени, нервной системы, поджелудочной железы, сосудов микроциркуляторного русла. Это косвенно усиливает поражение органов мочевыделительной системы. Увеличение АД, типичное для хронического алкоголизма, само по себе способно привести к вторичной нефропатии. Метаболические сбои, в особенности обмен пуринов, повышают нагрузку на органы выделения и также ведут к нарушению их функций вплоть до хронической недостаточности. Выраженность и скорость развития проявлений АХГН зависит от объемов потребляемого алкоголя – критичной дозировкой считается цифра свыше 35 мл в сутки.
Классификация
Выделяют несколько форм алкогольной нефропатии, разница между ними заключается в клиническом течении, наличии или отсутствии сопутствующих заболеваний. Некоторые типы состояния довольно легко спутать с другими видами вторичной нефропатии из-за схожих проявлений и механизмов патогенеза. Отличительной особенностью АХГН является то обстоятельство, что первопричиной всех патологических изменений в организме, прямо или косвенно ухудшающих работу почек, является злоупотребление алкоголем. Общепризнано существование следующих типов заболевания:
- Латентная форма. Является наиболее распространенной и трудно поддающейся диагностике из-за практически полного отсутствия субъективных симптомов. Возникает не только у людей, постоянно употребляющих спиртные напитки, но и у тех, кто делает это с определенной периодичностью (1-2 раза в неделю). Характерны обострения вскоре после последнего приема алкоголя, проявляющиеся уменьшением функциональной активности почек, что подтверждается лабораторными исследованиями. В патогенезе преобладает роль прямого нефротоксического воздействия этанола.
- Гипертензивная форма. Более редкий тип патологии, в основном возникающий у лиц, страдающих алкоголизмом, ожирением и артериальной гипертензией. Последнее обстоятельство обуславливает трудности различения АХГН этого типа и вторичной гипертензивной нефропатии. Повреждение нефронов происходит при развитии гемодинамических и метаболических нарушений, канальцевого ацидоза.
- Нефротическая форма. Крайне редкая и наиболее тяжелая форма хронической алкогольной нефропатии. Сопровождается прогрессирующим диффузным гломерулонефритом, достаточно быстро приводящим к ХПН. Основное звено патогенеза – резкая сенсибилизация организма и аутоиммунное поражение тканей иммуноглобулинами А.
Некоторые авторы причисляют к алкогольной нефропатии острые состояния, например, острую почечную недостаточность при отравлении спиртными напитками. Несмотря на то, что при этом наиболее ярко проявляется прямая нефротоксическая активность этанола, ОПН при алкогольной интоксикации различается по своему механизму развития от других повреждений почек на фоне АХГН. Поэтому большинство специалистов не рассматривают такое состояние как классическую нефропатию.
Симптомы алкогольной нефропатии
В большинстве случаев болезнь протекает практически бессимптомно, проявления патологии регистрируются случайно при выполнении лабораторных исследований по иному поводу. Это особенно характерно для латентной формы – нередко бессимптомное течение может длиться на протяжении многих лет. Обострения, возникающие на 1-3 сутки после употребления этанола, могут проявляться только жалобами на снижение объема мочи (олигурией) и крайне редко – слабыми тянущими болями в пояснице. При длительном течении на первый план выступают проявления алкогольной болезни: эритема ладоней, гинекомастия у мужчин, симптомы поражения поджелудочной железы и печени (боли в подреберье и животе, желтуха).
Гипертензивный вариант алкогольной нефропатии на начальных этапах развития также характеризуется слабой выраженностью собственно нефрогенных симптомов. Пациент жалуется на головные боли, приливы крови к лицу, неприятные ощущения в области сердца и другие следствия повышенного давления крови. Нередко этот тип заболевания сопровождается ожирением. Для нефротической формы АХГН типично достаточно быстрое течение – обычно после эксцесса возникает олигурия, видимая гематурия, ухудшение общего состояния. Обязательно присутствуют экстраренальные проявления хронической интоксикации этанолом.
При отсутствии лечебных мер и продолжающемся поступлении этилового спирта в организм алкогольная нефропатия неизменно сводится к возникновению ХПН. Ее признаками являются усталость, разбитое состояние, головная боль, усиливающиеся после приема этилового спирта. Затем появляется аммиачный запах изо рта, сильная жажда, рвота, сухость кожи, воспаление слизистых оболочек. Количество выделяемой мочи резко снижается, на поверхности кожных покровов образуется беловатый налет из выделяемой потовыми железами мочевины.
Осложнения
Не всегда удается строго дифференцировать осложнения собственно алкогольной нефропатии и интоксикации этиловым спиртом. При АХГН намного легче возникает алкогольное отравление, сопровождающееся острой почечной недостаточностью с анурией, головной болью, рвотой, отеками и другими признаками уремии. Учитывая прогрессирующий характер состояния, к острому отравлению могут привести ранее привычные дозировки алкоголя, что повышает риск развития осложнения. Грозным и неблагоприятным осложнением может выступать уремическая кома, обусловленная интоксикацией не выведенными через почки продуктами обмена веществ.
Диагностика
Для диагностики алкогольной нефропатии используют методы физикального осмотра, ряд лабораторных анализов и инструментальных исследований. Необходима консультация врача-нефролога, иногда к определению состояния могут подключать нарколога. Обычно алгоритм диагностики АХГН включает следующие этапы:
В редких и спорных случаях производят биопсию печени и почек для гистологического изучения данных органов. При алкогольной нефропатии в печени будут определяться признаки гиалиново-капельной дистрофии, в почках – мезангиопролиферативного нефрита диффузного или очагового характера. Рентгеноконтрастные методы исследования (например, урографию) назначают с осторожностью из-за нефротоксичности большинства контрастных препаратов. Дифференциальный диагноз осуществляют с иными типами первичных и вторичных нефропатий, определяющим фактором часто становится факт наличия длительного злоупотребления алкоголем.
Лечение алкогольной нефропатии
Главным и основополагающим назначением является полный запрет употребления алкогольных напитков. Только при отказе от спиртного более чем у половины больных латентной формой алкогольной нефропатии наблюдается стойкое улучшение лабораторных показателей мочи и почти полная ремиссия. Несоблюдение этого предписания даже при выполнении других рекомендаций и терапевтических мер лишь несколько замедляет прогрессирование состояния. При запущенных случаях АХГН и наличии сопутствующих патологий помимо отказа от спиртных напитков назначают ряд вспомогательных терапевтических мер:
- Антигипертензивная терапия. Снижение артериального давления благотворно влияет на прогноз по причине устранения гемодинамических нарушений в почках. Особенно важен этот компонент лечения при гипертензивных формах нефропатии. При нарушениях работы выделительной системы для снижения давления используют ингибиторы АПФ, блокаторы кальциевых каналов и рецепторов к ангиотензину 2.
- Нормализация метаболизма. Последствием алкогольной интоксикации часто становятся нарушения обмена веществ: пуринов, углеводов, жиров. Посредством специальных диет нужно нормализовать метаболизм и снизить нагрузку на выделительную систему. Особенно пагубно на почки действует нарушение выделения пуринов, поэтому при недостаточной эффективности диетического питания могут назначаться антиподагрические препараты (аллопуринол).
- Противовоспалительные средства. При быстром прогрессировании состояния (нефротическая форма) используют кортикостероидные и цитостатические препараты. Цель их применения – снизить активность воспалительных процессов для уменьшения степени повреждения почек. На сегодняшний день их эффективность критикуется рядом исследователей.
При диагностировании ХПН рекомендуется проведение гемодиализа, частота которого зависит от степени поражения выделительной системы. Вспомогательную роль в лечении алкогольной нефропатии может играть врач-нарколог – с его помощью больному легче избавится от зависимости. Использование фармакологических средств в борьбе с алкоголизмом следует производить с учетом пониженной скорости клубочковой фильтрации.
Прогноз и профилактика
В случае строгого соблюдения запрета на прием алкоголя и раннего выявления патологического состояния прогноз алкогольной нефропатии практически всегда благоприятный – функции выделительной системы восстанавливаются почти в полном объеме. При наличии сопутствующих нарушений, вызванных злоупотреблением спиртосодержащей продукцией, исход патологии зависит от их качественного лечения. При ХПН восстановление нормальной работы почек почти всегда невозможно, но поддерживающее лечение способно сохранить приемлемое качество жизни больного еще на многие годы. Самым неблагоприятным прогнозом обладает сочетание АХГН и тяжелых проявлений алкогольной болезни: цирроза печени, алкогольного панкреатита, кардиомиопатии. Но и в этом случае длительное комплексное лечение может значительно улучшить состояние больного.
1. Морфологические аспекты нефротоксического действия крепких алкогольных напитков/ Бабаханян Р.В., Сафрай А.Е., Шевчук М.К., Ягмуров О.Д.// нефрология.- 1998.
2. Морфофункциональные изменения в мочеполовой системе женщин при алкогольной интоксикации/ Шелудько В.В.// Астраханский медицинский журнал. - 2013.
3. Морфология острых экзогенных нефротоксических воздействий/ Ягмуров О.Д., Петров Л.В.// Нефрология. - 2011.
Острая почечная недостаточность – это потенциально обратимое, внезапно наступившее выраженное нарушение или прекращение функции почек. Характерно нарушение всех почечных функций (секреторной, выделительной и фильтрационной), выраженные изменения водно-электролитного баланса, быстро нарастающая азотемия. Диагностика осуществляется по данным клинических и биохимических анализов крови и мочи, а также инструментальных исследований мочевыделительной системы. Лечение зависит от стадии ОПН, включает симптоматическую терапию, методы экстракорпоральной гемокоррекции, поддержание оптимального артериального давления и диуреза.
МКБ-10
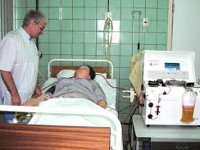
Общие сведения
Острая почечная недостаточность – внезапно развивающееся полиэтиологическое состояние, которое характеризуется серьезными нарушениями функции почек и представляет угрозу для жизни пациента. Патология может провоцироваться заболеваниями мочевыделительной системы, нарушениями со стороны сердечно-сосудистой системы, эндогенными и экзогенными токсическими воздействиями, другими факторами. Распространенность патологии составляет 150-200 случаев на 1 млн. населения. Пожилые люди страдают в 5 раз чаще лиц молодого и среднего возраста. В половине случаев ОПН требуется гемодиализ.

Причины
Преренальная (гемодинамическая) острая почечная недостаточность возникает вследствие острого нарушения гемодинамики, может развиваться при состояниях, которые сопровождаются снижением сердечного выброса (при тромбоэмболии легочной артерии, сердечной недостаточности, аритмии, тампонаде сердца, кардиогенном шоке). Нередко причиной становится уменьшение количества внеклеточной жидкости (при диарее, дегидратации, острой кровопотере, ожогах, асците, вызванном циррозом печени). Может формироваться вследствие выраженной вазодилатации при бактериотоксическом или анафилактическом шоке.
Ренальная (паренхиматозная) ОПН провоцируется токсическим или ишемическим поражением почечной паренхимы, реже - воспалительным процессом в почках. Возникает при воздействии на почечную паренхиму удобрений, ядовитых грибов, солей меди, кадмия, урана и ртути. Развивается при бесконтрольном приеме нефротоксичных медикаментов (противоопухолевые препараты, ряд антибиотиков и сульфаниламидов). Рентгенконстрастные вещества и перечисленные препараты, назначенные в обычной дозировке, могут стать причиной ренальной ОПН у больных с нарушением функции почек.
Кроме того, данная форма ОПН наблюдается при циркуляции в крови большого количества миоглобина и гемоглобина (при выраженной макрогемаглобинурии, переливании несовместимой крови, длительном сдавлении тканей при травме, наркотической и алкогольной коме). Реже развитие ренальной ОПН обусловлено воспалительным заболеванием почек.
Постренальная (обструктивная) ОПН формируется при остро возникшей обструкции мочевыводящих путей. Наблюдается при механическом нарушении пассажа мочи при двухсторонней обтурации мочеточников камнями. Реже возникает при опухолях предстательной железы, мочевого пузыря и мочеточников, туберкулезном поражении, уретритах и периуретритах, дистрофических поражениях забрюшинной клетчатки.
При тяжелых сочетанных травмах и обширных хирургических вмешательствах патология вызывается несколькими факторами (шок, сепсис, переливание крови, лечение нефротоксичными препаратами).
Симптомы ОПН
Выделяют четыре фазы острой почечной недостаточности:начальная, олигоанурическая, диуретическая, выздоровления. На начальной стадии состояние пациента определяется основным заболеванием. Клинически эта фаза обычно не выявляется из-за отсутствия характерных симптомов. Циркуляторный коллапс имеет очень малую продолжительность, поэтому проходит незамеченным. Неспецифичные симптомы ОПН (сонливость, тошнота, отсутствие аппетита, слабость) замаскированы проявлениями основного заболевания, травмы или отравления.
На олигоанурической стадии анурия возникает редко. Количество отделяемой мочи - менее 500 мл в сутки. Характерна выраженная протеинурия, азотемия, гиперфосфатемия, гиперкалиемия, гипернатиемия, метаболический ацидоз. Отмечается понос, тошнота, рвота. При отеке легкого вследствие гипергидратации появляется одышка и влажные хрипы. Больной заторможен, сонлив, может впасть в кому. Нередко развивается перикардит, уремический гастроэнтероколит, осложняющийся кровотечениями. Пациент подвержен инфекции вследствие снижения иммунитета. Возможен панкреатит, стоматит паротит, пневмония, сепсис.
Олигоанурическая фаза ОПН развивается в течение первых трех суток после воздействия, обычно длится 10-14 дней. Позднее развитие олигоанурической фазы считается прогностически неблагоприятным признаком. Период олигурии может укорачиваться до нескольких часов или удлиняться до 6-8 недель. Продолжительная олигурия чаще возникает у пожилых пациентов с сопутствующей сосудистой патологией. При продолжительности фазы более месяца необходимо провести дифференциальную диагностику для исключения прогрессирующего гломерулонефрита, почечного васкулита, окклюзии почечной артерии, диффузного некроза коры почек.
Длительность диуретической фазы составляет около двух недель. Суточный диурез постепенно увеличивается и достигает 2-5 литров. Отмечается постепенное восстановление водно-электролитного баланса. Возможна гипокалиемия вследствие значительных потерь калия с мочой. В фазе восстановления происходит дальнейшая нормализация почечных функций, занимающая от 6 месяцев до 1 года.
Осложнения
Выраженность нарушений, характерных для почечной недостаточности (задержка жидкости, азотемия, нарушение водно-электролитного баланса) зависит от состояния катаболизма и наличия олигурии. При тяжелой олигурии отмечается снижение уровня клубочковой фильтрации, существенно уменьшается выделение электролитов, воды и продуктов азотного обмена, что приводит к более выраженным изменениям состава крови.
При олигурии увеличивается риск развития водной и солевой сверхнагрузки. Гиперкалиемия вызвана недостаточным выведением калия при сохраняющемся уровне его высвобождения из тканей. У больных, не страдающих олигурией, уровень калия составляет 0,3-0,5 ммоль/сут. Более выраженная гиперкалиемия у таких пациентов может говорить об экзогенной (переливание крови, лекарственные препараты, наличие в рационе продуктов, богатых калием) или энодгенной (гемолиз, деструкция тканей) калиевой нагрузке.
Первые симптомы гиперкалиемии появляются, когда уровень калия превышает 6,0-6,5 ммоль/л. Больные жалуются на мышечную слабость. В некоторых случаях развивается вялый тетрапарез. Отмечаются изменения ЭКГ. Снижается амплитуда зубцов P, увеличивается интервал P-R, развивается брадикардия. Значительное повышение концентрации калия может вызвать остановку сердца. На первых двух стадиях ОПН наблюдаются гипокальциемия, гиперфосфатемия, слабо выраженная гипермагниемия.
Следствием выраженной азотемии является угнетение эритропоэза. Развивается нормоцитарная нормохромная анемия. Угнетение иммунитета способствует возникновению инфекционных заболеваний у 30-70% пациентов с острой почечной недостаточностью. Присоединение инфекции утяжеляет течение заболевания и нередко становится причиной смерти больного. Выявляется воспаление в области послеоперационных ран, страдает полость рта, дыхательная система, мочевыводящие пути. Частым осложнением ОПН является сепсис.
Отмечается сонливость, спутанность сознания, дезориентация, заторможенность, чередующаяся с периодами возбуждения. Периферическая нейропатия чаще возникает у пожилых пациентов. При ОПН может развиться застойная сердечная недостаточность, аритмия, перикардит, артериальная гипертензия. Больных беспокоит ощущение дискомфорта в брюшной полости, тошнота, рвота, потеря аппетита. В тяжелых случаях наблюдается уремический гастроэнтероколит, часто осложняющийся кровотечениями.
Диагностика
Основным маркером острой почечной недостаточности является повышение калия и азотистых соединений в крови на фоне значительного уменьшения количества выделяемой организмом мочи вплоть до состояния анурии. Количество суточной мочи и концентрационную способность почек оценивают по результатам пробы Зимницкого. Важное значение имеет мониторинг таких показателей биохимии крови, как мочевина, креатинин и электролиты, что позволяет судить о тяжести ОПН и эффективности проводимых лечебных мероприятий.
Главной задачей в диагностике ОПН является определение ее формы. Для этого проводится УЗИ почек и сонография мочевого пузыря, которые дают возможность выявить или же исключить обструкцию мочевыводящих путей. В некоторых случаях выполняется двусторонняя катетеризация лоханок. Если при этом оба катетера свободно прошли в лоханки, но выделение мочи по ним не наблюдается, можно с уверенностью исключить постренальную форму ОПН. При необходимости оценить почечный кровоток проводят УЗДГ сосудов почек. Подозрение на канальцевый некроз, острый гломерулонефрит или системное заболевание является показанием для биопсии почки.
Лечение ОПН
В начальной фазе терапия направлена, прежде всего, на устранение причины, которая вызвала нарушение функции почек. При шоке необходимо восполнить объем циркулирующей крови и нормализовать артериальное давление. При отравлении нефротоксинами больным промывают желудок и кишечник. Применение в практической урологии таких современных методов лечения как экстракорпоральная гемокоррекция позволяет быстро очистить организм от токсинов, которые стали причиной развития ОПН. С этой целью проводят гемосорбцию и плазмаферез. При наличии обструкции восстанавливают нормальный пассаж мочи. Для этого осуществляют удаление камней из почек и мочеточников, оперативное устранение стриктур мочеточников и удаление опухолей.
В фазе олигурии для стимуляции диуреза больному назначают фуросемид и осмотические диуретики. Для уменьшения вазоконстрикции почечных сосудов вводят допамин. Определяя объем вводимой жидкости, кроме потерь при мочеиспускании, рвоте и опорожнении кишечника, необходимо учитывать потери при потоотделении и дыхании. Пациента переводят на безбелковую диету, ограничивают поступление калия с пищей. Проводится дренирование ран, удаление участков некроза. При выборе дозы антибиотиков следует учитывать тяжесть поражения почек.
Гемодиализ назначается при повышении уровня мочевины до 24 ммоль/л, калия – до 7 ммоль/л. Показанием к гемодиализу являются симптомы уремии, ацидоз и гипергидратация. В настоящее время для предупреждения осложнений, возникающих вследствие нарушений метаболизма, врачи-нефрологи все чаще проводят ранний и профилактический гемодиализ.
Прогноз и профилактика
Летальность в первую очередь зависит от тяжести патологического состояния, ставшего причиной развития ОПН. На исход заболевания влияет возраст больного, степень нарушения функции почек, наличие осложнений. У выживших пациентов почечные функции восстанавливаются полностью в 35-40% случаев, частично – в 10-15% случаев. 1-3% больных необходим постоянный гемодиализ. Профилактика заключается в своевременном лечении заболеваний и предупреждении состояний, которые могут спровоцировать ОПН.

Студент медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 27.06.2019
- Reading time: 2 минут чтения
Интоксикация — это отравление организма, вызванное воздействием какого-либо вещества.
Стадии отравления
В зависимости от тяжести интоксикации принято выделять три стадии течения патологического процесса.
- Первая стадия (легкая степень). Симптоматика в этом случае ограничивается изменением дыхания: оно становится частым и неритмичным. Характерно появление преходящих хрипов при дыхании. Наблюдается появление немотивированной эйфории, апатии и их чередование. Такие изменения психоэмоционального фона провоцируются отёком головного мозга. Для этой стадии характерны сердечно-сосудистые нарушения в виде тахикардии и/или незначительная артериальная гипотензия.
- Вторая стадия. Такое состояние характеризуется головными болями, ознобом, мышечными спазмами и судорогами. Больной жалуется на бессонницу на фоне слабости и усталости, снижение аппетита вплоть до его отсутствия, тошноту.
- Третья стадия. Это тяжёлая лихорадка, способная привести к летальному исходу. Человека беспокоят мышечные боли, озноб, выраженная тахикардия и снижение артериального давления. Галлюцинации и бредовые состояния на этой стадии не редкость. При отсутствии адекватной терапии возможна кома.
Клиническая картина острой интоксикации
Характерная черта этого расстройства — появляется оно сразу, незамедлительно. В этом случае важно оказать помощь на ранней стадии.
Возникновение острой интоксикации связано с проникновением в организм большого количества веществ, обладающих токсическим действием, употреблением пищи или воды ненадлежащего качества или выраженной передозировкой лекарственных препаратов. Характер течения и степень тяжести интоксикации определяется разновидностью токсического вещества, попавшего в организм.
Проявления острой интоксикации
Наиболее характерные проявления острой интоксикации:
- выраженная резкая боль в области желудка;
- неудержимая рвота;
- остро появившийся жидкий стул.
Рвота и понос в этой ситуации — реакция организма на отравление, с помощью которой он старается очиститься от токсического вещества. Поэтому первое время после появления такой симптоматики нет смысла стараться ее заблокировать.
Особенности клинической картины в зависимости от происхождения интоксикации могут варьироваться. Это помогает при диагностике, когда необходимо отличить экзогенную интоксикацию от эндогенной.
Экзогенная интоксикация
Токсические вещества, вызывающие расстройства, могут проникать в организм различными способами: через пищеварительный тракт, слизистые оболочки, кожный покров, через дыхательные пути.
Заподозрить экзогенную интоксикацию помогут следующие симптомы:
- Выраженная гипертермия.
- Лихорадочное состояние.
- Острая реакция со стороны пищеварительного тракта: рвота, диарея, выраженная изжога. При отравлении растворами, имеющими щелочную или кислую реакцию, в рвоте могут присутствовать сгустки крови.
- Судорожные сокращения мышц конечностей.
- Ухудшение картины рефлексов.
В случае трансдермального проникновения яда в организм или попадания его через слизистую оболочку, в большинстве случаев наблюдается местная реакция в виде выраженных аллергических проявлений: покраснений, очагов высыпаний, напоминающих ожоги.
Важным признаком экзогенной интоксикации синдрома является острое кислородное голодание всех тканей организма. Оно обусловлено способностью токсинов блокировать возможность эритроцитов переносить кислород. Гипоксия приводит к расстройству всех систем жизнеобеспечения организма человека:
- снижается частота пульса;
- развивается распространённый отёчный синдром, наиболее опасны отёк лёгких и головного мозга.
Эндогенная интоксикация
Интоксикационный синдром эндогенного происхождения — не самостоятельное заболевание. Он сопровождает многие заболевания и является частью их патогенеза.
Эндотоксинами или аутоядами называются вещества, которые вырабатываются внутри организма в результате распада молекул или клеточных структур. Обладая токсическими свойствами, эти вещества вызывают развитие недостаточности работы жизненно важных органов: почек, печени, сердца.
Проявления эндогенной интоксикации:
- головная боль;
- нарушение сна;
- исчезновение аппетита.
Такой симптомокомплекс часто наблюдается при интоксикационном синдроме, сопровождающем инфекционно-воспалительные заболевания.
В случае более выраженной степени интоксикации добавляются следующие симптомы:
- снижение суточного объёма мочи;
- головокружение;
- ощущение прогрессирующей накопившейся хронической усталости;
- нарушение ритма работы сердца;
- галлюцинации — признак тяжёлого интоксикационного синдрома, который сопровождается лихорадкой, в частности, этот симптом характерен для ожоговых травм при поражении большой площади тела с глубиной ожогов 3–4 степени.
В некоторых случаях к указанной симптоматике общего характера добавляются специфические признаки, которые могут помочь при диагностике. Например, желтушное окрашивание склер и кожных покровов при поражении печени билирубином.
Медицинская помощь при отравлении с разными типами интоксикации
Остановить прогрессирование патологических изменений при интоксикации независимо от её характера можно, если прекратить воздействие отравляющего вещества на организм и максимально быстро провести комплекс мероприятий по выведению его из организма больного. В зависимости от механизма отравления для этого применяются следующие методы:
- промывание желудка;
- приём сорбентов;
- форсированный диурез;
- гемодиализ.
В некоторых случаях эти методы дополняют друг друга.
Одновременно необходимо принимать меры по восстановлению жизненно важных функций организма больного. Особенно это важно при тяжёлой степени отравления. Нарушение водно-электролитного баланса и обезвоживание, возникшие в результате рвоты и диареи, корректируется при помощи обильного питья и/или инфузионной терапии.
При этом существует опасность усугубления отёка головного мозга и лёгких, поэтому за больным необходимо постоянное наблюдение с целью своевременной коррекции нарушений.
На фоне адекватной инфузионной терапии сердечно-сосудистые нарушения могут начать регрессировать самостоятельно. В противном случае приходится брать под контроль давление и удерживать его с помощью соответствующих медикаментов.
При лечении интоксикации на любой стадии может понадобиться и симптоматическая терапия:
Читайте также:

