Папилломавирусная инфекция и заболевания шейки матки
Обновлено: 25.04.2024
Хронический цервицит диагностируют у 80% женщин с эктопией цилиндрического эпителия шейки матки (ШМ). Вирус папилломы человека является причиной интраэпителиальных поражений ШМ и препятствует физиологическому течению эктопии. Высокая контагиозность инфекции обусловливает в 80% случаев заражение даже при однократном половом контакте. В большинстве случаев инфекция имеет транзиторный характер, и вирус спонтанно элиминируется в последующие 12–24 мес., но у 10–20% женщин персистирующая инфекция увеличивает риск развития цервикальной эпителиальной неоплазии высокой степени тяжести, которая в 30–40% случаев прогрессирует до стадии инвазивного рака. В статье рассмотрены проблема воспалительных заболеваний ШМ, ассоциированных с папилломавирусной инфекцией (ПВИ), роль эктопии эпителия ШМ как зоны риска реализации онкогенной активности ПВИ, приведены показания к консервативному и хирургическому лечению осложненной эктопии, проведен анализ результатов сочетанной (с криодеструкцией) и монотерапии местными препаратами на основе глицирризиновой кислоты на примере российских и зарубежных исследований. Даны рекомендации по ведению женщин различных возрастных групп с эктопией эпителия ШМ в сочетании с ПВИ.
Ключевые слова: эктопия цилиндрического эпителия шейки матки, вирус папилломы человека (ВПЧ), хронический цервицит, неоплазия.
Cervicitis associated with papillomavirus infection: prediction and management strategy choice
A.V. Shargorodskaya 1 , T.N. Bebneva 1,2
1 National Medical Research Center of Endocrinology, Moscow, Russian Federation
2 Russian University of Peoples’ Friendship, Moscow, Russian Federation
Chronic cervicitis is diagnosed in 80% of women with cervical ectropion. Human papillomavirus (HPV) provokes cervical intraepithelial lesion and prevents normal course of cervical ectropion. High contagiousity provides the infection in 80% of cases even after single sexual act. In most patients, infection is transient, and HPV is spontaneously eliminated after 12 to 24 months. However, in 10% to 20% of women persistent infection increases the risk of severe cervical intraepithelial neoplasia which can progress to invasive cancer. The paper discusses cervix inflammation associated with papillomavirus and the role of cervical ectropion as a site of the realization of papillomavirus oncogenic potential. Indications to the medical treatment and surgical procedures for complicated ectropion are addressed. The authors analyze treatment outcomes of topical medications with glycyrrhizinic acid as monotherapy or in combination with cryodestruction. Recommendations on the management of cervical ectropion associated with papillomavirus infection in women of various ages are provided.
Keywords: cervical ectropion, human papillomavirus (HPV), chronic cervicitis, neoplasia.
For citation: Shargorodskaya A.V., Bebneva T.N.,Cervicitis associated with papillomavirus infection: prediction and management strategy choice. Russian Journal of Woman and Child Health. 2019;2(2):143–147.
В статье рассмотрены проблема воспалительных заболеваний шейки матки, ассоциированных с папилломавирусной инфекцией, роль эктопии эпителия, приведены показания к консервативному и хирургическому лечению осложненной эктопии. Даны рекомендации по ведению женщин различных возрастных групп.
Введение
Эктопия эпителия шейки матки как зона риска реализации онкогенной активности ПВИ
Еще в ХIХ в. немецкий паталогоанатом Рудольф Вирхов обратил внимание на тот факт, что появлению злокачественной опухоли часто предшествует хроническое воспаление в той или иной ткани. Исследования последних десятилетий не только подтвердили это наблюдение, но и выявили целый ряд иммунокомпетентных клеток и специфических факторов, способных как подавлять рост опухоли, так и стимулировать его за счет перепрограммирования иммунных клеток на фоне длительно протекающего воспалительного процесса [9, 10]. Таким образом, эктопированный эпителий ШМ является потенциальной зоной риска для реализации онкогенной активности ПВИ. Значит ли это, что наличие ПВИ на фоне эктопии всегда приводит к диспластическим изменениям ШМ и требует активной лечебной тактики в отношении таких пациенток?
Распространенность эктопии среди женщин репродуктивного возраста в среднем составляет 40% и наиболее часто встречается в возрастной группе до 30 лет [7, 11, 12]. Основными жалобами при эктопии и эктропионе ШМ могут быть обильные вагинальные выделения (лейкорея), боли в области малого таза, посткоитальные кровотечения. Но эктопия ЦЭ и эктропион ШМ могут протекать и абсолютно бессимптомно.
Отмечено, что продуктивная ПВИ возникает в базальных клетках метапластического эпителия зоны трансформации и примыкающего к ней эктоцервикса. Для трансформирующей же формы уязвимым местом являются переходная зона и зона стыка между многослойным плоским эпителием и однослойным ЦЭ ШМ. Есть данные, что повышенная предрасположенность этой области к предраку и РШМ связана с максимальной локализацией там резервных клеток, имеющих высокий потенциал последующей опухолевой трансформации при инфицировании высокоонкогенным ВПЧ [13]. Эктопия также делает эпителий более чувствительным к ИППП, например вызываемым Chlamydia trachomatis и Neisseria gonorrhoeae, на фоне которых ПВИ может протекать более злокачественно [6, 14]. Отмечены более обширная зона эктопированного эпителия и высокий инфекционный индекс на фоне хламидийной инфекции даже при бессимптомном течении эктопии [15, 16]. Таким образом, в план ведения женщин с эктопией ЦЭ ШМ необходимо включать обследование на ИППП даже при отсутствии жалоб у пациентки.
Частота интраэпителиальных поражений ШМ у женщин с эктопией ЦЭ составляет, по разным данным, от 17 до 40%, при этом в возрасте до 23 лет чаще встречается дисплазия легкой степени (CIN 1), а большинство случаев средней и тяжелой дисплазии (CIN 2–3) приходятся на возраст от 25 до 35 лет [7, 12, 17]. Отмечена более высокая распространенность ВПЧ при эктопии, а также частота CIN на фоне ПВИ [18]. В исследовании, проведенном среди девушек-студенток в возрасте до 30 лет, выяснили, что воспалительный тип мазка являлся ведущим в структуре цитологических заключений в группе с эктопией ШМ независимо от наличия ВПЧ. Однако частота CIN была достоверно выше (43,6%) на фоне ПВИ, чем у ВПЧ-негативных пациенток (17,5%) [17].
Особую озабоченность вызывают подростки, т. к. они обычно имеют обширную область эктопии [19]. Интересные данные были получены в когортном исследовании ВИЧ-инфицированных подростков 12–20 лет в 13 городах США. Количество половых партнеров было самым сильным предиктором зрелости ШМ. С увеличением зоны эктопии было связано использование оральных контрацептивов, считается, что эта связь обусловлена влиянием эстрогенов на ЦЭ [19]. Эти результаты подтверждают результаты более раннего исследования, показавшего, что девочки-подростки, начавшие половые отношения, имели более зрелые шейки матки, чем девственницы того же возраста [20].
В одном из российских исследований показано, что высокая активность ВПЧ, превышающая клинически значимые цифры по результатам Digene-теста и сопровождающаяся экспрессией онкобелка Е7, является основным инфекционным фактором, препятствующим нормальному течению физиологической эктопии шейки матки [21]. В работе Л.И. Мальцевой и соавт. выявлена корреляция между низкими показателями соотношения метаболитов эстрогена, позитивной реакцией р16ink4α и наличием длительно персистирующей ПВИ. Было показано, что оценка экспрессии белка р16ink4α и степени нарушения метаболитов эстрогена 2-ОНЕ1/16α-ОНЕ1 позволяет дифференцированно подходить к лечению ВПЧ-ассоциированных цервицитов [22].
Выбор тактики ведения пациенток
Несмотря на то, что эктопия является нормальным физиологическим процессом и не нуждается в лечении, существует несколько аргументов в пользу лечения этого состояния. Наиболее известным является тот факт, что хронический цервицит (ХЦ) на фоне эктопии ЦЭ служит мощным кофактором для персистенции ВПЧ и возникновения интраэпителиальных поражений [14]. Как уже упоминалось ранее, существует взаимосвязь между плоскоклеточной метаплазией и индукцией плоскоклеточного РШМ и клетки, подвергающиеся метаплазии, более восприимчивы к канцерогенам. Теоретически, если, удаляя эктопию, процесс эпителизации возможно ускорить и уменьшить размер метаплазии, это создает неблагоприятные условия для персистенции ВПЧ и снижает риск развития интраэпителиальных поражений, а значит, и РШМ [23, 24].
Постоянные обильные выделения (лейкорея), болевые ощущения и посткоитальные кровотечения вызывают значительный дискомфорт у женщин и могут быть показанием к лечению эктопии ЦЭ ШМ. В исследовании Y. Çekmez et al., посвященном влиянию криотерапии на симптомы эктопии, показатели успеха были в 9 раз ниже у женщин, имевших 3 и более эпизода цервицита за 6 мес. У 91,9% пациенток с эктопией ЦЭ была отмечена выраженная лейкорея. Показатель успешности в отношении этого симптома был удовлетворительным (89,5%), так же как и в отношении посткоитальных кровотечений (81,8%) и рецидивов ХЦ (80%). Наименее благоприятный результат достигнут в отношении болевого синдрома (58%). Эпителизация достигнута в 95,9% случаев. Авторы работы делают вывод, что не стоит откладывать проведение криотерапии у пациенток с ХЦ при отсутствии стойкого эффекта от консервативной терапии [25].
В Клинических рекомендациях по профилактике РШМ Минздрава России 2017 г. активное ведение женщин с CIN 1 рекомендуется в следующих случаях: неудовлетворительные данные кольпоскопии, обширные поражения, длительность течения CIN 1 более 18 мес., возраст старше 35 лет, невозможность дальнейшего наблюдения (нежелание женщины посещать врача).
У молодых женщин с LSIL (CIN 1, CIN 2, p-16-негативные), доказанными в биоптате, и удовлетворительным результатом кольпоскопии предпочтительно применение иммуномодулирующих препаратов с проведением цитологического исследования через 6, 12, 24 мес. В случае прогрессии через 12 мес. показано деструктивное или эксцизионное лечение. Выжидательная тактика ведения с цитологическим контролем и кольпоскопией при CIN 2 и 3 приемлема для беременных женщин и очень молодых пациенток с CIN [26].
Использование препаратов глицирризиновой кислоты в лечении заболеваний, ассоциированных с вирусными инфекциями
Заключение
Эктопия ЦЭ ШМ является функциональным состоянием и не требует специального лечения. Более того, грубое вмешательство в процесс метаплазии может приводить к нежелательным акушерским осложнениям. Однако нежный ЦЭ является уязвимой зоной и комфортной питательной средой для трансмиссивных бактериальных и вирусных инфекций, что способствует развитию ХЦ и препятствует нормальной эпителизации ШМ. В случае присоединения ПВИ высока вероятность развития интраэпителиальных поражений. Тем не менее в целом прогноз этого состояния благоприятный. ВПЧ-инфицированные пациентки с эктопией ЦЭ ШМ требуют дифференцированного подхода к ведению в зависимости от возраста, анамнеза и клинических проявлений. Молодым женщинам в возрасте до 25 лет, как правило, достаточно консервативного лечения и динамического наблюдения с цитологическим контролем. Возрастная группа 25–35 лет требует активной тактики при трансформирующей форме ПВИ: цитологических изменениях среднетяжелой степени в сочетании с высокой вирусной нагрузкой и/или продукцией онкобелков. В возрастной группе старше 35 лет физиологическая эктопия ЦЭ ШМ встречается редко. Тактика определяется согласно общеклиническим рекомендациям по ведению женщин с интраэпителиальными поражениями ШМ. Важным моментом является идентификация и модификация кофакторов, потому что они могут оказать существенное влияние на модулирование персистирующей инфекции и прогрессирование ПВИ до неоплазии.
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Причины дисплазии шейки матки
Папилломавирусная инфекция (ВПЧ) — основная причина дисплазии и рака шейки матки. К болезни приводит длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
К факторам риска дисплазии шейки матки относится длительный приём контрацептивов и курение. Выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Другие факторы риска — раннее начало половой жизни, большое число и частая смена половых партнеров, употребление алкоголя, сопутствующие половые инфекции, много беременностей и родов. Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
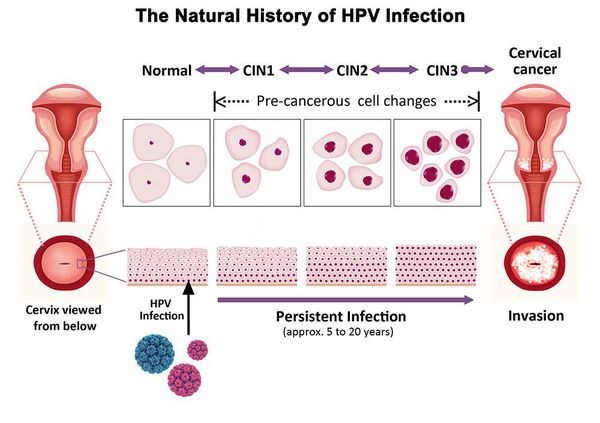
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
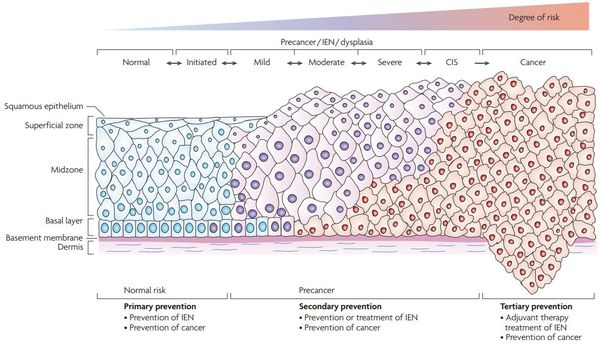
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
Классификация и стадии развития дисплазии шейки матки
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
Классификация Папаниколау
- 1-й класс — нормальная цитологическая картина (отрицательный результат);
- 2-й класс — изменение морфологии клеток, которое обусловлено воспалением во влагалище и (или) шейке матки;
- 3-й класс — единичные клетки с аномалией ядер и цитоплазмы (подозрение на злокачественное новообразование);
- 4-й класс — отдельные клетки с явными признаками озлокачествления;
- 5-й класс — много типично раковых клеток (злокачественное новообразование).
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя выделяют три степени дисплазии шейки матки:
- ЦИН 1 (дисплазия слабой степени) — признаки папилломавирусной инфекции (койлоцитоз и дискератоз). Поражение до 1/3 толщины клеточного пласта;
- ЦИН 2 (дисплазия средней степени) — поражена 1/2 толщины клеточного слоя;
- ЦИН 3 (дисплазия тяжелой степени) — поражение более 2/3 клеточного слоя. [8]
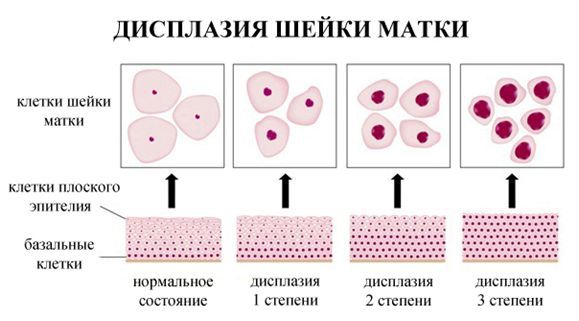
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
| Система Папаниколау | Описательная система ВОЗ | CIN | Терминологи- ческая система Бетесда (ТСБ) |
|---|---|---|---|
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
| Класс 2 (метаплазия эпителия, воспалительный тип) | Атипия, связанная с воспалением | Реактивные изменения клеток ASC: ASC - US, ASC - H | |
| Класс 3 ("дискариоз") | Слабая дисплазия | CIN 1 койлоцитоз | LSIL |
| Умеренная дисплазия | CIN 2 | HSIL | |
| Тяжелая дисплазия | CIN 3 | ||
| Класс 4 (клетки, подозрительные на рак или карцинома in situ | Карцинома in situ | ||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
Осложнения дисплазии шейки матки
Последствия дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
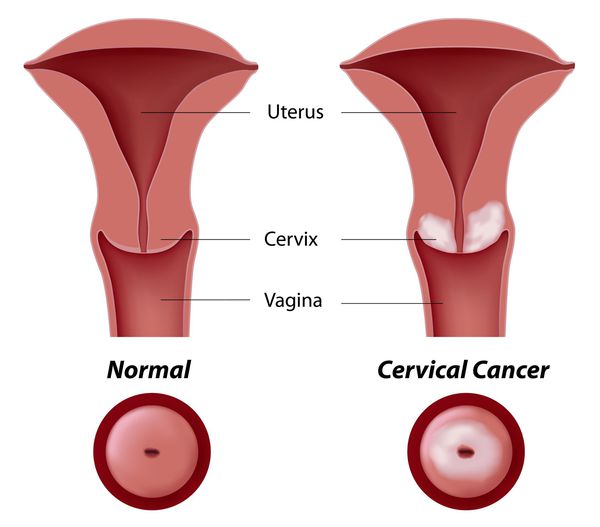
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
Методы диагностики дисплазии шейки матки
В России система цервикального скрининга включает последовательность действий:
- Цитологическое исследование: РАР-тест;
- ВПЧ-тестирование: в США и странах Евросоюза ВПЧ-тест применяется для первичного скрининга рака шейки матки (РШМ). В России его использование вариативно: при первичном скрининге в сочетании с РАР-тестом, в качестве самостоятельного теста, при ведении пациенток с неясными результатами РАР-теста (ASCUS) и для наблюдения паценток после лечения HSIL;
- Кольпоскопия: показаниями к исследованию являются положительные результаты РАР-теста (класс 2-5). Метод основан на осмотре шейки матки при помощи увеличивающих оптических систем и проведения диагностических проб с растворами уксусной кислоты и йода (Люголя). С помощью кольпоскопии определяют локализацию поражения, его размер, выбирают участок для проведения биопсии, определяют тактику лечения.
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
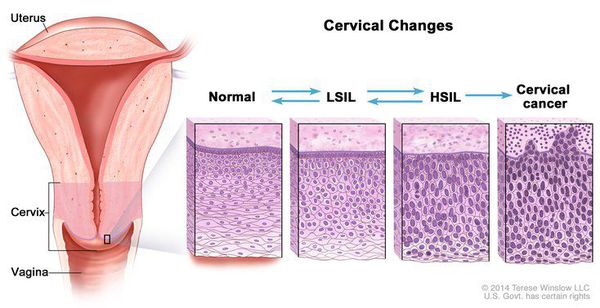
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии.
Хирургическое лечение дисплазии
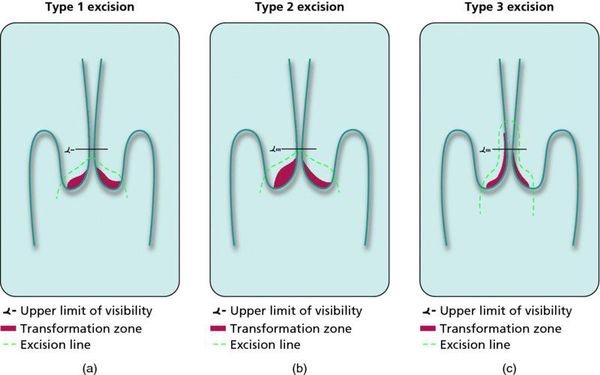
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
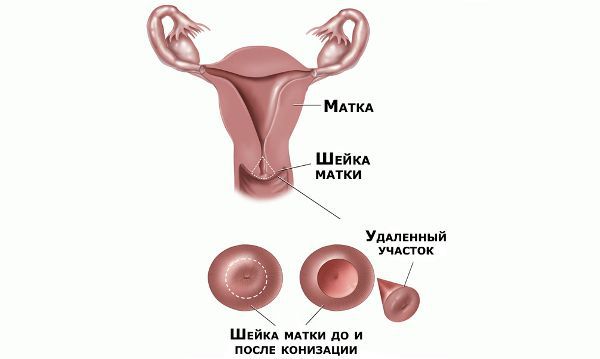
Реабилитация после хирургического лечения
В течение месяца после операции следует воздержаться от спринцеваний, половых контактов и не пользоваться тампонами. На 2–3 недели исключают тяжёлые физические нагрузки и тепловые процедуры. Незначительные сукровичные выделения, усиливающиеся иногда до менструальноподобных, в течение 10–20 дней после операции — это нормальное явление.
При реабилитации после хирургического лечения шейки матки эффективны препараты, содержащие антисептик и стимулятор регенерации эпителия.
После лечения возможен рецидив, поэтому необходимо пожизненное наблюдение: цитологический мазок через 6 и 12 месяцев после операции, затем раз в год в течение 10 лет, далее раз в 3 года.
Планировать беременность после операции на шейке матки можно не ранее, чем через 3–6 месяцев. Эти сроки будут зависеть от глубины эксцизии или конизации и длины шейки матки [9] .
Лечение дисплазии при беременности
В большинстве случаев лечение должно быть отложено на послеродовый период. При беременности на фоне дисплазии шейки матки каждые три месяца проводится кольпоскопический и цитологический контроль. При выявлении рака шейки матки пациентку консультирует онкогинеколог. Доктор подбирает тактику лечения, может потребоваться прервать беременность по онкологическим показаниям [9] .
Прогноз. Профилактика
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
- курение;
- длительное использование гормональных контрацептивов;
- многократные травматичные роды;
- ВИЧ-инфекция.
- У пациенток с ЦИН часто обнаруживают вирус простого герпеса 2 типа, цитомегаловирусную инфекцию, хламидийную урогенитальную инфекцию, бактериальный вагиноз, ассоциированный с резким снижением или отсутствием вагинальной лактофлоры, повышенным ростом во влагалище Gardnerella vaginalis и Atopobium vaginae, повышение концентрации в бакпосеве грибов рода Candida, Mycoplasma hominis.
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан "Об утверждении порядка проведения диспансеризации определенных групп взрослого населения", осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 35 лет.
Над статьей доктора Борисова Э. В. работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
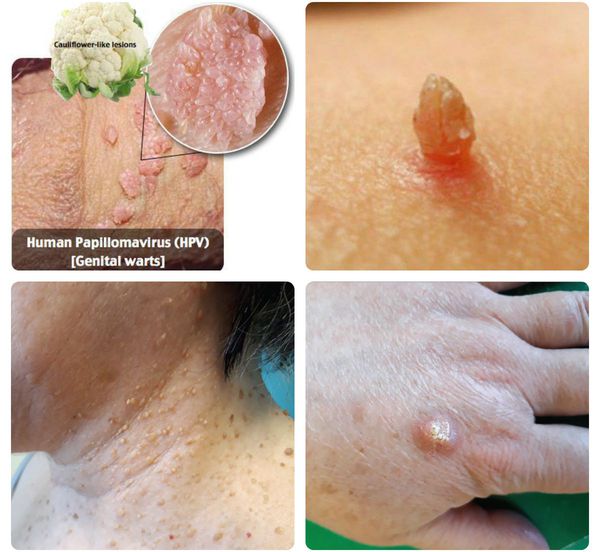
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
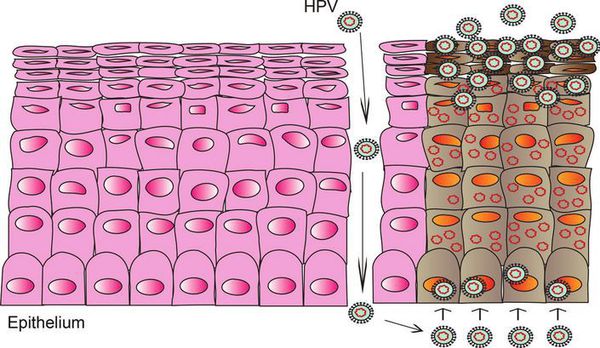
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
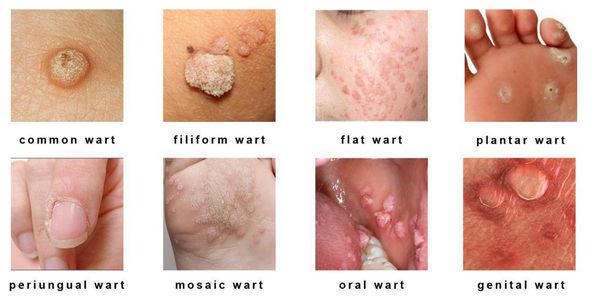
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
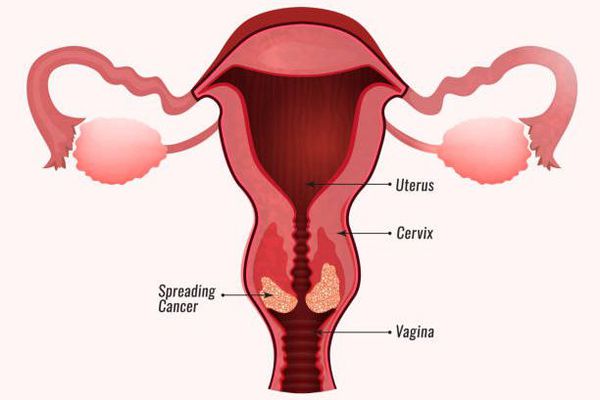
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
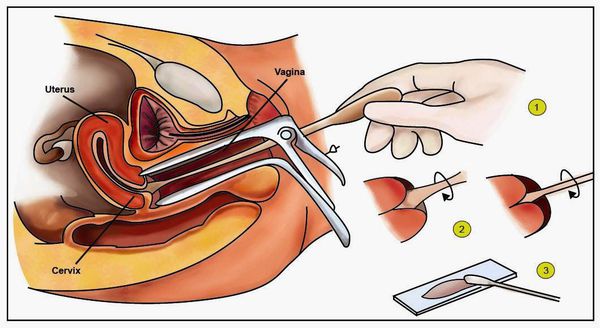
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
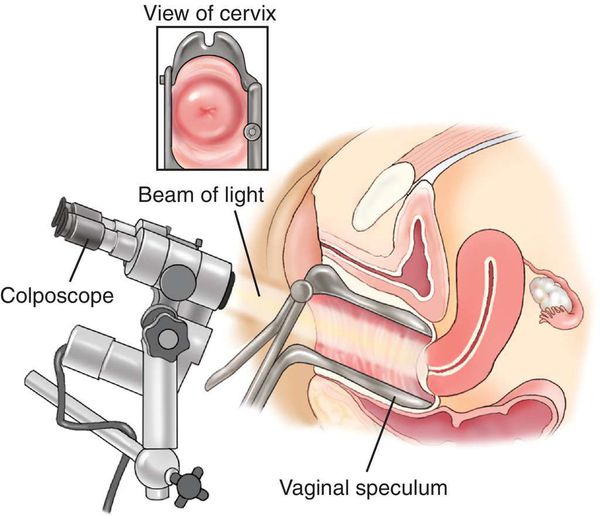
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
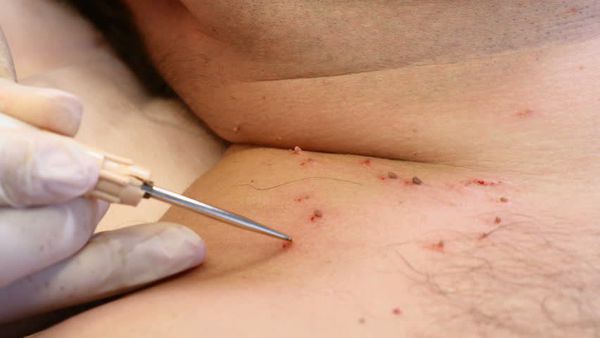
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Папилломавирусная инфекция (ПВИ) – одно из наиболее распространенных и социально значимых заболеваний в мире, поскольку большая часть сексуально активного населения в течение жизни имеет контакт с вирусом папилломы человека (ВПЧ) [1, 2, 5, 14, 16, 19, 20, 22]. По данным современных исследований, частота инфицирования ВПЧ в возрастной группе 16–29 лет составляет 45–81%.
В настоящее время известно около 200 различных генотипов ВПЧ, которые обнаруживают в тканях различных патологических образований организма человека, однако более 40 разновидностей ВПЧ выявляются преимущественно в эпителии аногенитальной области. Известно, что у большинства инфицированных ПВИ протекает бессимптомно в транзиторной форме. При этом изменения эпителия носят переходный характер и в 70% случаев разрешаются в течение 1 года, а 90% случаев — в течение лет благодаря формированию клеточного и гуморального иммунитета. Однако в ряде случаев вирус не элиминируется, а длительно сохраняется в ткани, и в результате может произойти патологическая трансформация нормального эпителия в диспластический. ВПЧ способен оказывать на эпителиальные продуктивное или трансформирующее воздействие. Итогом этих процессов становятся как доброкачественные папилломы и кондиломы кожи и слизистых оболочек, так и дисплазии различных степеней тяжести вплоть до злокачественных новообразований [2, 8, 14, 19, 20, 25].
Как показывают исследования, для развития рака шейки матки, помимо персистенции ВПЧ в интегрированной форме, необходимо наличие кофакторов (наличие онкогенного генотипа, сочетание нескольких генотипов вируса, существенная вирусная нагрузка, курение, длительный прием гормональных препаратов, сопутствующие урогенитальные инфекции, снижение неспецифической резистентности организма, влияние генетических факторов ) [1, 2, 4, 5, 9, 14, 18, 19, 26, 27, 30]. Заслуживает внимания тот факт, что рак шейки матки является вторым по распространенности онкологическим заболеванием органов репродуктивной системы в мире. По данным ВОЗ, ежегодно в мире диагностируются около 500 тыс. новых случаев рака шейки матки, из них по меньшей мере половина заканчивается летально. Важным профилактическим мероприятием в отношении цервикальной карциномы становится своевременная диагностика и адекватное лечение заболеваний шейки матки, прежде всего ассоциированных с ВПЧ [1, 2, 7, 8, 16, 17, 20].
В диагностике приоритет отдается использованию методов для обнаружения и идентификации ДНК ВПЧ. Это позволяет не только выявить инфекцию, но и выяснить, сколько генотипов представлено одновременно, какова вирусная нагрузка, а также в какой форме присутствует вирус — в эписомальной или интегрированной. По данным и соавт. (2008, 2009), в 58% случаев обнаружения ВПЧ у женщин с различной генитальной патологией присутствуют типы высокого онкогенного риска.
В настоящее время существует мнение, что диагностика, направленная на прогнозирование патологии шейки матки, должна основываться на цитологическом скрининге, подкрепленном вируса папилломы человека и внедрением специфических молекулярных маркеров [1, 2, 5, 9, 15–17, 19, 29].
Подход к ведению больных с ПВИ гениталий и заболеваниями шейки матки в практической работе имеет огромное значение, поскольку неверная тактика может способствовать прогрессированию процесса, появлению различных осложнений, возникновению ятрогенных состояний, существенным материальным затратам и снижению качества жизни пациентки. Стоит отметить, что до сих пор единого общепринятого стандарта лечения пациентов с инфекцией не существует ввиду наличия множества спорных вопросов по данной проблеме [18]. Предложено большое число методов лечения аномально измененного эпителия шейки матки, а также влагалища и вульвы, однако ни один из них не является универсальным и лишенным недостатков, среди которых вероятность развития рецидивов, формирования нарушений органа, а также неблагоприятное влияние дыма, содержащего вирусные частицы после деструкции инфицированного очага, на лечащего врача.
Выбор тактики лечения заболеваний должен основываться на правильно установленном диагнозе, особенностях морфологии, локализации и размеров поражений, технических возможностях врача, предпочтениях пациентки и ее репродуктивных планах, наличии сопутствующей патологии В последние годы достигнут значительный прогресс и существенно расширились возможности в плане лечения патологии шейки матки как основы профилактики злокачественных поражений данной локализации. При этом стоит отметить, что в целом тактика ведения пациенток стала более щадящей. Из современных технологий деструкции патологических процессов шейки матки аргоноплазменная коагуляция (АПК) является одним из наиболее перспективных, эффективных и безопасных методов [3, 11–13].
К сожалению, достичь полного излечения от ПВИ не всегда возможно, в связи с этим общепринятой целью терапии является удаление очага поражения, а не полная элиминация возбудителя, а точнее прекращение выделения его из очагов поражения (учитывая, что методология диагностики заключается в исследовании клеток соскоба, взятого из этих зон) [23]. Это обусловлено тем, что вирус находится не только в аномальном эпителии, но и во внешне здоровых тканях по периферии очага. В связи с этим оптимальным стоит считать комплексное лечение, включающее не только локальное воздействие на патологически измененные ткани, но и неспецифическую противовирусную терапию [1, 10, 18, 20].
Помимо различных методик деструкции арсенал медикаментозных средств лечения может включать в себя антисептики, антибактериальные и противовирусные препараты для ликвидации воспалительного процесса шейки матки и влагалища; гормональные препараты — при сопутствующих нарушениях функции яичников, а также иммуномодуляторы. Известно, что в основе любого хронического процесса лежат те или иные изменения в иммунной системе, являющиеся одной из причин существования этого процесса, поэтому локальное и/или системное применение иммунопрепаратов в ряде случаев может использоваться как альтернативное средство лечения при обширных поражениях и/или рецидивирующих процессах как в виде монотерапии, так и в составе комбинированного лечения [24].
Среди данной группы средств интерес представляет инозина пранобекс (Изопринозин), который является синтетическим производным пурина и обладает иммуномодулирующей активностью и противовирусным действием. Изопринозин оказывает стимулирующее влияние на активность цитотоксических и естественных киллеров, функции и , повышает продукцию и , снижает образование и , потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов. Кроме того, препарат проявляет выраженную противовирусную активность in vivo в отношении множества известных вирусов, включая ВПЧ. Механизм противовирусного действия Изопринозина связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации вирусов, усилении синтеза мРНК лимфоцитов, что сопровождается подавлением биосинтеза вирусной РНК и трансляции вирусных белков, повышает продукцию лимфоцитами обладающих противовирусными свойствами интерферонов — альфа и гамма.
Инозин пранобекс является одним из наиболее изученных системных иммуномодуляторов, он включен в Европейское руководство по лечению бородавок и кондилом, а также в Российский протокол ведения пациенток с ПВИ. Препарат способствует подавлению репликации ВПЧ в эпителиальных клетках и выведению вируса из организма [10, 16, 19, 21, 28].
По мнению (2011), оптимальным методом лечения клинической манифестации ВПЧ было бы применение лечебных вакцин, механизм действия которых основан на блокировании вирусных генов или протеинов, необходимых для инфицирования, персистенции и размножения вирионов ВПЧ в эпителиальных клетках, при этом активировалась бы клеточная иммунная реакция, которая элиминировала бы инфицированные клетки эпителия. Этот путь лечения ВПЧ обнадеживающий, но пока идет процесс разработки терапевтических вакцин. Использование данного механизма элиминации вирусов возможно на данном этапе лишь с помощью иммуномодуляции.
В условиях многопрофильного медицинского центра г. Нижнего Новгорода было обследовано и пролечено 65 пациенток репродуктивного возраста с патологией шейки матки на фоне ПВИ: эктропионом и эктопией (с обширной зоной трансформации), CIN легкой степени, плоскими кондиломами, гиперкератозом (лейкоплакией) и стойким, клинически выраженным хроническим цервицитом. Они были равномерно распределены на 2 клинические группы. В группу вошли 34 женщины, которым наряду с АПК шейки матки была назначена иммуномодулирующая терапия Изопринозином в дозе 1000 мг 3 р./ сут в течение 10 дней за 2–3 нед. до деструкции и через 2–3 нед. после нее. Ко группе отнесли 31 пациентку, которым проводилась только АПК шейки матки (контроль). Обе группы были сравнимы по возрасту, характеру менструального цикла, репродуктивному анамнезу и представленной цервикальной патологии.
Целью исследования стала оценка эффективности лечения различных заболеваний шейки матки на фоне ПВИ у женщин репродуктивного возраста на основе анализа ближайших и отдаленных результатов.
Пациенткам проведено стандартное обследование — диагностика ИППП молекулярными методами, определение ВПЧ с вирусной нагрузкой, микроскопическое и микробиологическое исследование, расширенная кольпоскопия, цитологическое исследование мазка, анализ крови на RW, антитела к ВИЧ, , , гистологическое исследование биоптата (при атипической цитологической и/или кольпоскопической картине). Во всех случаях присутствовали высокоонкогенные генотипы ВПЧ (16, 18, 31, 45, 59). При необходимости перед хирургическим вмешательством назначались санация влагалища и противовоспалительная терапия.
Контрольный осмотр, расширенная кольпоскопия, определение ВПЧ с вирусной нагрузкой проводились через 1,5–2 мес. после операции и далее в динамике через 3–6 и 12 мес. Было установлено, что в группе с комбинированным лечением (АПК и Изопринозин) средняя продолжительность заживления шейки матки после процедуры составила 44±3,2 дня, что сопоставимо со скоростью эпителизации у женщин без ПВИ [11]. В группе контроля в 68,5% случаев имела место вялая замедленная регенерация шеечного эпителия (56±2,4 дня), что, по всей видимости, было обусловлено влиянием активной вирусной инфекции и неадекватной иммунной реакцией тканей. Судя по всему, в подобной ситуации репаративный процесс может замедляться и извращаться, поэтому полноценного разрешения не происходит и нормальная структура тканей не восстанавливается в течение длительного времени.
Через 3 и 6 мес. в группе после комбинированного лечения у 94,1% пациенток по данным цитологического и кольпоскопического исследований существенных изменений на шейке матки выявлено не было. Через 3 мес. отмечен рецидив CIN1 у 1(2,94%) пациентки с гипогонадотропной аменореей и исходно высоким уровнем вирусной нагрузки (>5 Lg (ВПЧ/100 тыс. клеток), в связи с чем потребовался повторный курс лечения. Известно, что гормональный дисбаланс приводит к выраженным нарушениям в дифференцировке клеточных пластов и дистрофии эпителия, что может существенно затруднять лечение [18]. Еще в одном случае мы наблюдали кольпоскопические признаки субэпителиального асимптомного эндометриоза, не требовавшего вмешательства. Что касается обнаружения ВПЧ с помощью метода ПЦР, то выделение вируса из очага прекратилось в 91,2% случаев в течение ближайших 1,5–2 мес.; у остальных пациенток после прогрессивного снижения вирусной нагрузки через мес. молекулярные маркеры ПВИ также не определялись.
В контрольной группе клиническая эффективность лечения патологии шейки матки с помощью АПК по данным кольпоскопии и цитологии составила 87,1%, при этом прекращение вирусовыделения из очага в течение 3–6 мес. было достигнуто лишь в 61,3% наблюдений. Рецидивы в виде появления зон, мозаики, признаков гиперкератоза и дисплазии по результатам контрольных исследований в данной группе зафиксированы в течение 3–6 мес. у 4 (12,9%) пациенток. Реактивация ПВИ проявлялась не только признаками персистенции вирусной инфекции согласно результатам кольпоскопии, цитологии и детекции ДНК ВПЧ, но и повышением вирусной нагрузки в отсроченном периоде после деструкции аномальной зоны трансформации (рис. 1, 2).
Обсуждая полученные результаты, стоит отметить, что локальная деструкция очагов поражения позволяет воздействовать только на участок эпителия, где произошла клиническая манифестация инфекции, тогда как в окружающих тканях остаются в латентном состоянии резервуары ВПЧ или других возбудителей, которые могут являться основой для дальнейшего рецидива и персистенции инфекции. Учитывая, что во всех случаях у обследованных нами пациенток в качестве этиологических факторов имели место высокоонкогенные генотипы ВПЧ, длительная стойкая персистенция ПВИ могла быть ассоциирована с высокой вероятностью озлокачествления патологического процесса. В связи с этим есть основания полагать, что адекватная иммунотерапия наряду с аблацией шейки матки способствует полноценной санации инфекционного очага и эпителизации, что закономерно снижает частоту рецидивов и повышает эффективность лечения. Изопринозин прямо и косвенно, обладая противовирусным действием и оказывая влияние на противовирусный иммунитет, способен подавлять репликацию ВПЧ и образование вирусных белков. Эти эффекты могут изменять механизм взаимодействия ВПЧ и макроорганизма, препятствуя персистированию вируса, а также влияя на клиническую манифестацию инфекции.
Немаловажен и тот факт, что при использовании технологии АПК не происходит перегрева, дымообразования и обугливания тканей (карбонизации), а отсутствие задымленности способствует хорошей визуализации операционного поля и снижает негативное влияние на врача, производящего процедуру [3, 12, 13].
Таким образом, результаты проведенного исследования свидетельствуют о высокой эффективности и безопасности сочетания аблативного вмешательства с использованием аргоновой плазмы и назначения иммуномодулирующей терапии Изопринозином. При этом в большинстве случаев достигается адекватная деструкция очага, быстрейшее заживление послеоперационной раны, а также существенно снижается вероятность рецидивирования и малигнизации патологического процесса за счет прекращения выделения ВПЧ. Отдельно стоит отметить важность и необходимость соблюдения рекомендованных курсовых дозировок при назначении Изопринозина для полноценной реализации его лечебного эффекта и во избежание дискредитации метода нарушением использования препарата.
Выводы
Проблема ПВИ далека от окончательного разрешения, и многие вопросы составляют предмет проводимых в настоящее время научных работ. Сложности обусловлены значительной распространенностью инфекции, выявлением новых генотипов ВПЧ и существенными различиями в их злокачественной потенции, изменениями напряженности противовирусного иммунитета организма, который, в конечном счете, определяет стабильность излечения или время наступления рецидива. Накопленные сведения о механизме неоплазии определяют необходимость дальнейших исследований для создания надежных этиопатогенетических схем лечения [1].
Перспективные диагностические и направления в отношении ПВИ и рака шейки матки включают в себя широкое внедрение в практику метода жидкостной цитологии, оценку клинической значимости концентраций ВПЧ в тканях, дальнейшее изучение роли молекулярных биомаркеров для прогнозирования активности вируса и прогрессирования патологического процесса, разработку и использование профилактических и терапевтических вакцин и высокоэффективных противовирусных препаратов.
Читайте также:

