Парамиксовирус у цыплят лечение
Обновлено: 25.04.2024
Реовирусный теносиновит птиц (РЕО) — собирательное название нескольких заболеваний, характеризующихся поражением синовиальных оболочек, сухожильных влагалищ, высокой ранней смертностью, плохим ростом, снижением яйценоскости и выводимости.
Этиология . Возбудитель - вирус семейства Reoviridae. Известны 11 серотипов. Наиболее распространенными среди патогенных штаммов являются S1133, 1733, 2408, ERS. По одной версии, считается, что штаммы различных серотипов способны индуцировать различные формы проявления РЕО у птиц, по другой - один и тот же штамм способен инициировать синдром мальабсорбции у молодняка, а у более старших птиц вызывать теносиновит, поэтому деление РЕО на самостоятельные болезни весьма условно.
Эпизоотология. Восприимчивы куры, индейки, фазаны. Наиболее чувствительны цыплята мясного направления 1-6 дневного возраста, но характерные клинико-патоморфологические признаки болезни, как правило, проявляются в 30-35-дневном возрасте. Источник инфекции - больная и переболевшая птица. Вирусоносительство продолжается до 289 суток. Вирус передается горизонтально и вертикально в течение 14-61 суток после инфицирования кур-несушек. Чаще РЕО проявляется в условиях различных стрессовых воздействий, при ассоциированном течении с другими инфекционными болезнями.
Реовирус отличается низкой иммуногенностью. Специфические антитела появляются только к 17 дням после заражения в невысоких титрах и исчезают через 12 – 15 суток. Материнские антитела надежно защищают поголовье от инфицирования. У мясных кроссов птиц серологическая реакция на реовирус замедленная и продолжается на 1 неделю дольше чем у яйценоских.
Клинические признаки. Протекает остро, подостро у цыплят и хронически у взрослых кур. Инкубационный период при инфицировании цыплят в подошву конечностей составляет 24 ч, при других способах — от 1 до 11 суток. Первые симптомы наблюдаются у цыплят-бройлеров в возрасте 2—10 недель. Регистрируют повышенную смертность, артрит/теносиновит, неоднородность стада. Отмечают неправильное положение перьев, особенно на крыльях. При хроническом течении - разрыв голеностопных сухожилий.
У несушек яйценоскость снижается на 15-20%, развивается асептическое пролиферативное воспаление сухожилий конечностей. Поражение суставов у петухов в племенных хозяйствах вызывает снижение их половой активности и процента оплодотворяемости яиц.
Диагностика. На основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и лабораторных исследований. Положительная сероконверсия в ИФА не является доказательством диагноза, для постановки окончательного диагноза необходимо гистопатологическое исследование пораженных тканей и ПЦР.
Профилактика. Сводится к обеспечению высокого уровня биобезопасности, качественной дезинфекции между циклами и вакцинации племенных стад бройлеров. Цель иммунизации родительских стад - получение высоких титров трансовариальных антител для защиты молодняка в раннем возрасте. Практикуется комбинированное применение живых и инактивированных вакцин, но единой и универсальной программы профилактики РЕО не существует.
Пример схемы вакцинопрофилактики против REO ремонтного молодняка

Ожидаемые средние титры после вакцинации ремонтного молодняка (данные компании БиоЧек)

Обязательным является мониторинг напряженности материнского иммунитета у цыплят и его продолжительности. В случае получения неудовлетворительных результатов, целесообразно в программу профилактики реовирусной инфекции вводить дополнительную иммунизацию племенной птицы в репродуктивный период монокомпонентными инактивированными вакцинами.
Ожидаемые средние титры после вакцинации бройлеров (данные компании БиоЧек)

*REO: средние титры невакцинированной птицы, наличие их в сочетании с клиническими признаками и патологоанатомическими изменениями подозреваются на инфекцию
ПМВ-2 - высококонтагиозная болезнь домашних, синантропных и диких птиц, протекающая в виде эпизоотий, энзоотий и латентного вируносительства без проявления клинических признаков. В острых случаях болезнь, в зависимости от свойства штамма вируса и других факторов, проявляется поражением респираторных органов, ЖКТ и снижением яйценоскости.
Морфология и химический состав. Вирус парагриппа кур был изолирован и идентифицирован в 1961 г. Р.А.Банковским и др. от цыплят с поражениями органов дыхания (13). Вирионы имеют форму палочковидную, шаровидную, отростчатую и мультигеномную. Шаровидные вирионы диаметром 120-300 нм. ПМВ-2 обладают ГА-свойствами. Мол. м РНК вируса 5,6-10бД. Вирус содержит 9 структурных полипептидов размером от 0,38 до 1,39 кД.
Хорошо репродуцировался в КЭ и клетках фибробластов КЭ. Экстраэмбриональная жидкость агглютинировала эритроциты цыплят.
Вирус не имел АГ родства с возбудителем НБ. Помимо вируса НБ, в группу парагрип- позных вирусов птиц входят вирусы Jucapia; PI (Ту) Ont. 6661/68, родственные вирусу парагриппа человека 2-го типа. Недавно от зяблика выделен новый парамиксовирус Bangor, АГ- отличный от предыдущих.
Описаны штаммы парагриппозных вирусов, выделенные от попугаев: шт. 0121, Bangor finch/N 1 relang и Jucapia chicken California 160 (16).
Белок слияния F парамиксовирусов синтезируется в виде неактивного предшественника Fo, расщепляемого одной из протеаз клетки хозяина с образованием активного белка, состоящего из субъединиц F1 и F2 с дисульфидным мостиком между ними. Выявлен участок расщепления белка F вируса SV5, состоящий из аргининовых остатков (5).
Антигенная вариабельность и родство. В настоящее время известно 9 серологических вариантов парагриппа птиц: ПМВ-1 - цыпленок/Ньюкасл/27; ПМВ-2 - цыпленок /Калифор- ния/Юкейпа/56 и около 20 Юкейпа - штаммы индюков, попугаев, вьюрков, дроздов, цапель и др.; ПМВ-3 - индейка /Висконсин/68; ПМВ-4 - утка /Гонконг/ДЗ/75; ПМВ-5 - Австралийский зеленый длиннохвостый попугайчик/Япония/75; ПМВ-6 - утка/Гонконг/199/77; ПМВ-7 -
голубь/Теннеси/4/75; ПМВ-8 - гуеь/Делавер/1053/76; ПМВ-9 - утка/Нью-Йорк/22/78. Эти штаммы являются эталонными (12).
Наиболее распространенным сероваром ПМВ птиц является серовар ПМВ-1, который представлен штаммом различной инфекционности. От кур изолировано 5 штаммов ПМВ-1, различающихся по тропизму и спектру патогенности, а именно энтеротропный штамм (смертность 100%), респираторный и нейротропный (летальность 50%), нейротропный нелегальный и медленный асимптоматический, не вызывающий клинических признаков заболевания. Показана также гетерогенность популяции вирусов Юкейпа (18). В 1981 г. вирус Юкейпа (шт. В 8599) также изолирован от индюков (15). Степень АГ-родства между вирусами Сендай и паротита, Сендай и Юкейпа составляет 37 и 31% соответственно (17).
Проведенный анализ АГ- и биологических свойств 5 штаммов ПМВ-2, изолированных в СССР в 1986 г., показал их неоднородность как между собой, так и по отношению к эталонам ПМВ-2, что подтверждает происходящую эволюционную изменчивость их в современных условиях (2).
В 1956 г. в Калифорнии был выделен слабовирулентный вирус от больных цыплят, серологически отличавшихся от вируса НБ.
Новый серотип ПМВ оказался широко распространенным на территории США. В течение 1975-1978 гг. в США, Японии, Нидерландах, Гонконге и ряде других стран было выделено еще несколько серотипов ПМВ от диких и домашних птиц разных видов. От домашних птиц выделено 5 серотипов вируса (12). Локализация вируса у естественно-восприимчивой птицы и вирусовыделение не изучены.
Антигенная активность. Установлена стабильность АГ-детерминант нуклеопротеинов ПМВ птиц серотипов 1 и 2 внутри серотипа и полное отсутствие перекрестных реакций с другими серотипами ПМВ (11). При инфекции индуцирует КСА, ВНА и анти-ГА, обладает нейраминидазой и гемолитической активностью (14).
Экспериментальная инфекция. Экспериментальная инфекция на цыплятах, как правило, не сопровождалась клинически выраженным заболеванием. Однако в сыворотках на 14-й день после инфицирования независимо от пути введения вируса, обнаруживались АТ в титре 1:160. Они выявляются и у контактно подсаженных цыплят к зараженной группе, что свидетельствует о высокой контагиозности казахстанских изолятов. Последние, в отличие ог эталонного шт. СССР/86, оказались апатогенными (6).
Культивирование. Выделенный в 1960 г. от птиц в разных регионах (США, Канада, СССР, Африка, Ирландия, ФРГ, Израиль) ПМВ культивируется в КЭ и куриных фибробла- стах, клетках почки обезьяны, вызывает образование синцитиев с эозинофильными цитоплазматическими включениями, которые содержат вирусные нуклеокапсида. ПМВ-3 (индюк/Висконсин/68) хорошо размножается в 9-10-дн КЭ и накапливается в титре 6,0-7,0 lg ЭИД50/мл в течение 72-96 ч. Интерферирующая активность установлена у ПМВ-2 серова- ра в отношении репродукции вакцинного шт. La Sota (ПМВ-1) в КЭ (4).
Ингибитор-чувствительность и резистентность/ Все штаммы ПМВ-2 оказались резистентными к сывороточным ингибиторам овец, свиней, уток и куликов и чувствительны к термолабильным ингибиторам сывороток морских свинок.
ГА свойства. Все ПМВ обладают ГА активностью (ПМВ-5 ГА эритроциты кур только после очистки и концентрации).
Выделенные в 1987-1989 гг. 14 юкейпаподобных вирусов проявляли одинаковый спектр Г А активности, а именно, агглютинировали эритроциты кур, уток, морских свинок, крыс, белых мышей. Не агглютинировали эритроциты баранов, свиней, КРС и лошадей 4 полевых изолята юкейпаподобных вирусов, не связывались с эритроцитами белых мышей и крыс. Лучше всего ГА ПМВ-2 проявлялась с эритроцитами КРС, уток и морских свинок. Помимо ГА активности они различались и по скорости элюции с эритроцитов, на основании чего были разделены на 2 группы: быстроэлюцирующие (72/87, 307/88, 407/88) - характеризующиеся десорбцией 100% адсорбированного вируса, и слабо- элюцирующие (11 штаммов) с эритроцитов (лишь на 40-50%). ПМВ-3 (индюк Висконсин) агглютинирует эритроциты петуха (п-23, Р
Морфология и химический состав. Вирус парагриппа кур был изолирован и идентифицирован в 1961 г. Р.А. Банковским и др. от цыплят с поражениями органов дыхания. Вирионы имеют форму палочковидную, шаровидную, отростчатую и мультигеномную. Шаровидные вирионы диаметром 120—300 нм. ПМВ-2 обладают ГА-свойствами. Мол.м РНК вируса 5,6 х 106Д. Вирус содержит 9 структурных полипептидов размером от 38000 до 139000 Д. Хорошо репродуцировался в КЭ и клетках фибробластов КЭ. Экстраэмбриональная жидкость агглютинировала эритроциты цыплят. Вирус не имел АГ-родства с возбудителем НБ.
Помимо вируса НБ, в группу парагриппозных вирусов птиц входят вирусы Jucapia; PI (Ту) Ont. 6661/68, родственные вирусу парагриппа человека 2-го типа. Недавно от зяблика выделен новый парамиксовирус Bangor, АГ-отличный от предыдущих. Описаны штаммы парагриппозных вирусов, выделенные от попугаев: шт. 0121, Bangor finch/N I relang и Jucapia chicken California 160.
Белок слияния F парамиксовирусов синтезируется в виде неактивного предшественника Fo-цифра, расщепляемого одной из протеаз клетки хозяина с образованием активного белка, состоящего из субъединиц F1 и F2 с дисульфидным мостиком между ними. Выявлен участок расщепления белка F вируса SV5, состоящий из аргинино-вых остатков.
В настоящее время насчитывается 9 серотипов парамиксовирусов птиц. Геном ВНБ состоит из 16236 нукл, кодирует 8 белков, представляющих собой нуклеокап-сид (NP), фосфопротеин (Р), белок V, белок матрикса (М), белок слияния (F), мелкий гидрофобный белок (SH) , гемагглютинин-нейраминидазу (HN) и большой L белок с прилегающими 55 н лидера и 54 н прилегающей последовательности. Установлено близкое родство первичной структуры белков ВНБ с белками ПМВП типов 2 и 6 уток, которое составляло от 22 до 44 %. Однако ПМВП-6 способен кодировать белок SH, отсутствующий в ПМВП-1, но содержащийся в рубу-ловирусах свинки и вирусе оезьян типа 5. Филогенетический анализ показал, что проанализированные последовательности аминокислот белков F и HN штаммов ПМВП-1,2 и 6 белка HN ПМВП-4 объединены в общую группу, отличную от других типов. Считают, что ПМВП образуют новый род внутри семейства парамиксовирусов. Антигенная вариабельность и родство. В настоящее время известно 9 серологических вариантов парагриппа птиц: ПМВ-1 — цыпленок/Ньюкасл/27; ПМВ-2 — цыпленок /К.алифорния/Юкейпа/56 и около 20 Юкейпа — штаммы индюков, попугаев, вьюрков, дроздов, цапель и др.; ПМВ-3 — индейка /Висконсин/68; ПМВ-4 — утка /Гонконг/ДЗ/75; ПМВ-5 — Австралийский зеленый длиннохвостый попугай-чик/Япония/75; ПМВ-6 — утка/Гонконг/199/77; ПМВ-7 — голубь/Теннеси/4/75; ПМВ-8 — гусь/Делавер/1053/76; ПМВ-9 — утка/Нью-Йорк/22/78. Эти штаммы являются эталонными.
Наиболее распространенным сероваром ПМВ птиц является серовар ПМВ-1, который представлен штаммом различной инфекционности. От кур изолировано пять штаммов ПМВ-1, различающихся по тропизму и спектру патогенности, а именно эн-теротропный штамм (смертность 100 %), респираторный и нейротропный (летальность 50 %), нейротропный нелетальный и медленный асимптоматический, не вызывающий клинических признаков заболевания. Показана также гетерогенность популяции вирусов Юкейпа. В 1981 г. вирус Юкейпа (шт. В 8599) также изолирован от индюков. Степень АГ-родства между вирусами Сендай и паротита, Сендай и Юкейпа составляет 37 и 31 % соответственно.
Проведенный анализ АГ- и биологических свойств пяти штаммов ПМВ-2, изолированных в СССР в 1986 г., показал их неоднородность как между собой, так и по отношению к эталонам ПМВ-2, что подтверждает происходящую эволюционную изменчивость их в современных условиях.
В 1956 г. в Калифорнии был выделен слабовирулентный вирус от больных цыплят, серологически отличавшихся от вируса НБ . Новый серотип ПМВ оказался широко распространенным на территории США. В течение 1975—1978 гг. в США, Японии, Нидерландах, Гонконге и ряде других стран было выделено еще несколько серотипов ПМВ от диких и домашних птиц разных видов. От домашних птиц выделено пять серотипов вируса.
Локализация вируса у естественновосприимчивой птицы и вирусовыделение не изучены.
Антигенная активность. Установлена стабильность АГ-детерминант нуклеопротеи-нов ПМВ птиц серотипов 1 и 2 внутри серотипа и полное отсутствие перекрестных реакций с другими серотипами ПМВ. При инфекции индуцирует КСА, ВНА и анти-ГА, обладает нейраминидазой и гемолитической активностью.
Экспериментальная инфекция. Экспериментальная инфекция на цыплятах, как правило, не сопровождалась клинически выраженным заболеванием. Однако в сыворотках на 14-й день после инфицирования независимо от пути введения вируса, обнаруживались AT в титре 1:160. Они выявляются и у контактно подсаженных цыплят к зараженной группе, что свидетельствует о высокой контагиозности казахстанских изолятов. Последние, в отличие от эталонного шт. СССР/86, оказались апатогенны-ми. В ИФАс мАТ выявили антиген парамиксовируса гусей в трахее, легких, пищеводе, печени, железистом желудке, поджелудочной железе, кишечнике, тимусе, селезенки, бурсе Фабрициуса и почках. Специфическое окрашивание обнаружено в цитоплазме лимфоцитов, ретикулоцитов, макрофагов и различных типов эпителиальных клеток. В клетках обнаруживается интенсивная дегенерация и некроз.
Пятидневных гусят заражали орально и назально полевым изолятом парамиксовируса BY. Через 9—72 ч после инокуляции гусята погибали и проверялись на микроскопические и ультраструктурные повреждения. Патологические повреждения наблюдались через 6 ч, а через 48 ч они были более выраженными. Потеря ресничек и гиперплазия бокаловидных клеток происходили в трахеях; в двенадцатиперсной кишке наблюдалась потеря ресничек, митохондрии эпителиальных клеток разбухали и вакуолизировались. В цитоплазме эпителиальных клеток кишечника присутствовало много вирионов диаметром около 150 нм.
При ПМВ инфекции гусей наблюдались следующие патологические изменения: геморрагии и изъязвления слизистой оболочки кишечника, некроз селезенки и поджелудочной железы, атрофия лимфоидных органов, а также отек и гиперемия мозга. Эпителиальные клетки слизистой оболочки кишечника подвергались сильному некрозу и слущиванию. Печень, сердце, почки и другие паренхиматозные органы показывали клеточную дистрофию и некроз.
Культивирование. Выделенный в I960 г. от птиц в разных регионах (США, Канада, СССР, Африка, Ирландия, ФРГ, Израиль) ПМВ культивируется в КЭ и куриных фибробластах, клетках почки обезьяны, вызывает образование синцитиев с эозинофильными цитоплазматическими включениями, которые содержат вирусные нукле-окапсиды. ПМВ-3 (индюк/Висконсин/68) хорошо размножается в 9—10-дневных КЭ и накапливается в титре 6,0-7,0 lg ЭИД50/МЛ в течение 72—96 ч. Интерферирующая активность установлена у ПМВ-2 серовара в отношении репродукции вакцинного im\LaSota(nMB-l)BK3.
Все штаммы ПМВ-2 оказались резистентными к сывороточным ингибиторам овец, свиней, уток и куликов и чувствительны к термолабильным ингибиторам сывороток морских свинок.
Все ПМВ обладают ГА-активностью (ПМВ-5 агглютинируют эритроциты кур только после очистки и концентрации). Выделенные в 1987—1989 гг. 14 юкейпаподоб-ных вирусов проявляли одинаковый спектр ГА-активности, а именно, агглютинировали эритроциты кур, уток, морских свинок, крыс, белых мышей. Не агглютинировали эритроциты баранов, свиней, КРС и лошадей четыре полевых изолята юкейпапо-добных вирусов, не связывались с эритроцитами белых мышей и крыс. Лучше всего гемагглютинация ПМВ-2 проявлялась с эритроцитами КРС, уток и морских свинок. Помимо ГА-активности, они различались и по скорости элюции с эритроцитов, на основании чего были разделены на две группы: быстроэлюцирующие (72/87, 307/88, 407/88) — характеризующиеся десорбцией 100 % адсорбированного вируса, и слабоэлюцирующие (11 штаммов) с эритроцитов (лишь на 40—50 %). ПМВ-3 ( индюк Висконсин) агглютинирует эритроциты петуха (п-23, Р < 0,005) и морской свинки (п-7, Р < 0,005) и не вызывает гибели зараженных КЭ.
Гемадсорбирующие свойства не изучены.
Источники и пути передачи инфекции. Источник — больная птица, латентные вирусоносители. Заражение птицы происходит, в основном, контактным, аэрогенным или трансовариальным путями, не исключен алиментарный путь. Заболевание регистрируется у кур. Однако к возбудителю чувствительны индейки, воробьи, попугаи. Появление вирусов Юкейпа в Казахстане, территория которого находится на пути миграции диких птиц, возможных переносчиков данных вирусов также указывает на дрейф вирусов Юкейпа. Приведенные факты не исключают возможности появления в ближайшие годы высокопатогенного кжейпаподобного вируса и обусловливают необходимость систематического вирусологического надзора за ходом АГ-изменчивости ПМВ домашних птиц в различных регионах страны. ПМВ поражают птиц всех видов, однако распространение того или иного сероварианта в разных странах и среди птиц различных видов сильно варьирует.
Установлена одновременная циркуляция миксо- и парамиксовируса среди декоративных птиц.
Специфическая профилактика. Получена инактивированная вакцина PM-VAC против ПМВ инфекции голубей на основе шт. La Sota вируса НБ. В качестве адъюванта использовано минеральное масло. Вакцина обеспечивает продукцию анти-ГА в титрах 6,9 log2 у голубей и 7,2 log2 у цыплят. Создана инактивированная вакцина против ПМВ второго сероварианта.
Реовирусная инфекция кур
(Теносиновит Кур) [Tenosinovitis, Viral Arthritis of chickens]
Реовирусная инфекция птиц получила широкое распространение. Многообразие клинических признаков и развитие болезни связаны с антигенным различием возбудителя, патогенность которого в отношении разного вида и возраста птицы неодинакова. Для своевременной диагностики и принятия соответствующих мер борьбы в каждом конкретном случае необходимы выделение, идентификация и установление этиологической роли возбудителя в возникновении болезни.
Данные по серологическому мониторингу продемонстрировали: повсеместное распространение реовируса птицы расположенных на территории РФ птицехозяйств, что характеризовалось 100 % положительных проб сыворотки крови кур, как минимум с 200-дневного возраста; возрастание напряженности ситуации по АРВИ, что выражалось ежегодным возрастанием средних значений титров антител к реовирусу птицы; иммунологическую обусловленность существования восприимчивых к заражению АРВИ возрастных групп птицы. Реовирусы выделены как возбудители вирусного артрита у птиц в 1957 г., изолированы из содержимого кишечника бройлеров. Прямую зависимость синовиального микоплазмоза от циркуляции на птицефабри ках реовируса птицы, так как сывороточные антитела к M. synoviae появлялись в крови у птицы, уже содержащей антитела к реовирусу; эффективность применения вакцин против АРВИ и для снижения восприимчивости птицы к заражению M. sinoviae. Последний вывод становится особенно актуальным в связи с отсутствием надежных средств профилактики микоплазмоза.
Проведен эпизоотический мониторинг авиреоиирусной инфекции (теносинови-та) в птицеводческих хозяйствах РФ. Для этой цели исследованы сыворотки кур различных возрастных групп в 96 птицефабриках 37 регионов РФ. Результаты исследований показали циркуляцию специфических антител среди птицы различного возраста во всех обследованных птицехозяйствах. При этом средний показатель титров антител составлял 1:2245+1125, а наибольшие были выявлены в Волгоградской (1:6450), Архангельской (1:4900), Московской областях и в Мордовии (1:3800).
Клинические признаки и патологоанатомические изменения. Один из представителей реовирусов птиц — возбудитель ТСК, который поражает примерно 3—5 % кур. У больных птиц наблюдают снижение яйценоскости (на 15—20 %), слабость, хромоту, цианоз, обезвоживание организма, образование деформированных яиц, перитониты, асептическое пролиферативное воспаление сухожилий конечностей, тендовагиниты, артриты, гепатит и миокардит. Реовирусы могут вызывать микроскопические поражения кишечника, печени, поджелудочной железы, вызывать атрофию фабрициевой сумки и интерферировать при развитии иммунного ответа с другими вирусами.
Морфология и химический состав. Диаметр вириона 75 нм, морфологически вирусы сходны с реовирусом 3-го типа. Плавучая плотность их в хлористом цезии 1,37 г/см3. Вирус содержит 2-нитевую РНК И олигонуклеотиды, богатые аденозином. Капсид имеет 8 специфических полипептидов, из них только один с мол. м. 36 кД находится внутри капсида или в наружной мембране вириона. Вирионы с наружной оболочкой обладают транскриптазной и метилазной активностью. Описан серотип птичьего реовируса Фехи-Кроули. Вирионы имеют двухслойную оболочку, диаметр их 65-70 им. Полипептиды птичьих реовирусов, подобно реовирусам млекопитающих, могут быть разделены на три класса по размеру: большие (X), Средние (ц) и малые (а). В инфекционных вирионах обнаружены полипептиды с мол. м. 145,130 и 115 кД соответственно. Все три полипептида находятся на поверхности вириона. Установлено, что мРНК реовируса — копии полной длины геномных матриц, инициирующих кодон АУГ. На 3-конце плюс-цепи всех фрагментов обнаружена идентичная последовательность семи нуклеотидов: ААУЦАУЦ. Обработка первичных культур фибробластов цыпленка рекомбинантным интерфероном цыпленка ингибирует репликацию вируса оспо-вакцины и вируса везикулярного стоматита, но не влияет на репликацию птичьего реовируса (ПРВ) S1133. В обработанных клетках нормально синтезируются белки ПРВ. Высказано предположение, что ПРВ Экспрессирует факторы, мешающие активации и (или) активности индуцированных интерферонов, зависящих отднРНК ферментов. Показано, что экстракты зараженных ПРВ клеток устраняют способность днРНК ингибировать трансляцию в лизате ретикулоцитов. Сердцевинный белок тА ПРВ S1133 необратимо связывается с днРНК. Удаление его из экстрактов зараженных клеток устраняет способность стимулировать трансляцию. Эти данные показали, что белок противодействует вызванному интерфероном клеточному ответу на ПРВ, Устраняя внутриклеточную активацию ферментативных путей, зависящих от днРНК.
Клонирован и секвенирован целый сегмент S3 генома реовируса (РВ) мускусных уток, штамм 89026. Он имеет длину 1201 п. н., содержит такие же концевые мотивы, как и сегмент S3 генома известных штаммов РВ цыплят, а также одну открытую рамку считывания, кодирующую белок внешнего капсида длиной 367 остатков (мол. м. 40,8 кД). Этот ген клонирован набакуловирусных векторах и экспрессирован в клетках насекомых. Продемонстрирована антигенность обоих рекомбинантных белков. Иммунизация уток этими белками не вызывает появления антител и значительной защиты от РВ. Однако иммунизация предотвращает потерю массы, вызываемую заражением РВ уток.
Изучены условия инактивации реовируса птиц штамм S 1133. Установлена прямая зависимость скорости процесса инактивации вируса от времени инактивации, конечной концентрации ДЭИ в суспензии вируса и температуры реакционной смеси. При температуре 37 °С и концентрации ДЭИ 0,08 % И 0,16 % инактивация наступала через 8 и 16, соответственно. Уменьшение температуры процесса до 30 °С приводило к увеличению времени инактивации до 14 и 24 ч.
Антигенная активность, антигенная вариабельность и родство. У 15—25 % инфицированной птицы обнаруживают ПА, передаваемые потомству трансовариально. Уровень материнских AT определяет восприимчивость суточных цыплят к ТСК при оральном и контактном заражении. Материнские AT у цыплят сохраняются до 3 недель, обеспечивая невосприимчивость к пероральному инфицированию вирусом. ВНА у 14—30-дневных цыплят после заражения их в лапу шт. 58—132 появлялись на 4—6-й день в разведении 1:80 и на 12-й день достигали титра 1:640—1:2560. Инактиви-рованный вирус вызывал более интенсивное нарастание AT, но обладал незначительным протективным действием.
Различают несколько серотипов реовирусов птиц (в США — 4, в Японии — 5 вариантов). В Японии известны два штамма реовируса птиц — IR-R и вирус нефрита птиц — JR-R. Высказано предположение о существовании не менее 11 серотипов этого вируса. Прототипный uit. TS-142. Установлена связь между патогенностью реовируса птиц и его серотипом. Реовирусы, выделенные от кур, имеют групповой АГ, выявляемый в ИФ, РСК И РДП. Реовирусы птиц не связаны с таковыми млекопитающих. Антисыворотки против реовируса 3-го типа нейтрализуют птичий реовирус S1133. При наличии серологического родства между шт. Кроули (CR) и ИМ-1-203 первый оказался менее авидным к нейтрализующему действию сыворотки, чем второй. По некоторым данным, реовирусы, выделенные от индеек и кур, не отличались в АГ-отношении. Реовирус 3-го типа выделен от цыплят, больных ТСК (в США шт. ИМ-1-203, в Италии шт. 140 и 653).
Вирус локализуется, в основном, в сухожилиях разгибателей и сгибателей фаланг. Установлена трансовариальная передача вируса.
Экспериментальная инфекция. Воспроизводится на КЭ 5—7-дневного возраста, у которых появляются кровоизлияния, у 15-дневных эмбрионов развиваются некротические фокусы в печени и селезёнке. У суточных цыплят, инфицированных per os и подкожно вирусом инфекционного ТСК, развиваются патогистологические изменения в сухожилиях пальцевых сгибателей. Вирус инокулируют в подушечки лапок цыплят. Высокая смертность их от поражения печени, селезёнки и почек отмечена при введении им шт. ИМ-1-203, меньшая смертность — при инокуляции шт.140. При контактном заражении у цыплят образуются AT. При заражении цыплят американским шт. ИМ-1-203 и итальянскими шт. 140 и 653 вируса ТСК воспалительные изменения синовиальных оболочек появлялись через 22—48 ч и достигали максимума между 3—5-м дней, далее процесс стабилизировался. Через 7 дней экссудат сухожильных влагалищ превращался из серозного в серозно-гнойный. Наибольший падёж вызвал американский шт. ИМ-1-203. У заражённых 15-дневных цыплят поражаются синовиальные оболочки и периартикулярные ткани, через 35—42 дней появляются эрозии на суставном хряще. Постоянно поражается миокард. С 10-го дня начинается атрофия фабрициевой сумки. У павших цыплят макроскопически обнаруживали некротические или воспалительно-некротические фокусы в печени, селезёнке и почках. Степень поражения стопы при экспериментальном заражении (болезненность, опухание на протяжение 14 дней и более зависит от штамма.
В экспериментальных условиях заболевание можно вызвать путем интраназального и окулярного метода заражения, однако наилучший эффект достигается при заражении 2-недельных цыплят в подошву лап. При этом подошва лап цыплят и сухожильные влагалища, расположенные над голеностопным суставом и ниже, вначале отекают вследствие гиперплазии и инфильтрации клеток, в дальнейшем рыхлая соединительная ткань оболочек сухожилий заменяется волокнистой тканью, которая может проникать в сухожилия, вследствие чего они имеют тенденцию к разрыву. Поражения суставов у петухов влечет снижение половой активности и уменьшение оплодотворяемости яиц.
Культивирование. Культивирование американского и итальянского штаммов удается на КЭ. По одним данным, реовирус ТСК хорошо размножается в культуре клеток почек цыплят, но не в культуре фибробластов КЭ, по другим, птичий реовирус S-ПЗЗ хорошо растёт в культуре клеток куриных фибробластов. Он хорошо культивируется и в первичной культуре клеток почки цыплят с формированием больших син-цитиев и эозинофильных цитоплазм этических телец-включений.
Источники и пути передачи инфекции. Реовирусы чрезвычайно контагиозны для цыплят раннего возраста. Возбудитель длительное время циркулирует среди птиц неблагополучного хозяйства. Заболевание протекает в виде энзоотических вспышек, особенно среди вновь завозимого поголовья. Источник инфекции — больные и переболевшие птицы. Наибольшее количество возбудителя находится в помете. Заражение осуществляется алиментарным путем. Куры-несушки начинают нести контами-нированные яйца уже через 19 дней после заражения. Из неоплодотворенных яиц вирус удается выделить даже через 61 день. Большую опасность в распространении возбудителя представляют отходы инкубации.
Восприимчивость птиц к вирусу зависит от возраста, условий кормления, ухода, содержания и вирулентности возбудителя. Наиболее чувствительны суточные цыплята. С возрастом устойчивость цыплят к вирусу увеличивается. Инфекционные агенты, вызывающие болезни конечностей птицы, реовирусы и такие бактерии, как патогенные стафилококки (Staphylococcus aureus), микоплазмы (Mycoplasma sinoviae), иногда Escherichia coli и др., присутствующие более чем в 50 % случаев реовирусного теносиновита. Изредка из пораженных конечностей выделяют аденовирусы, ротавирусы, ретровирусы и т. д. Но подтверждений, что эти возбудители — основная причина патологии конечностей, нет. Реовирусы могут присутствовать в кишечнике птицы, не вызывая заболевания. Однако, по невыясненным причинам, некоторые штаммы индуцируют патологические изменения, характеризующиеся как артрит или теноси-новит. Индеек поражают те же реовирусы, что и цыплят, но так как индейки более устойчивы, у них реже страдают конечности (иногда наблюдается хромота, связанная с суставной патологией, но она не относится к реовирусной). Наиболее чувствительны цыплята к реовирусной инфекции в однодневном возрасте. Когда они становятся старше, то еще могут заражаться, но уже более устойчивы к болезни. Также доказано, что реовирусы из подстилки иногда проникают в организм птицы, вызывая поражения суставов. Поэтому при плохом качестве подстилки риск заболевания возрастает. Показано, что реовирусные инфекции в условиях птицефабрик часто сопровождаются бактериальными болезнями и респираторным микоплазмозом. Эти инфекции также отрицательно влияют на передачу потомству поствакцинального иммунитета против реовирусного теносиновита кур. Отмечается длительное вирусоносительство, вирус удавалось выделить от птиц через 289 суток после заражения.
Вспышка реовирусной инфекции наблюдалась с высокой смертностью в двух группах, недавно импортированных из Италии попугаев. Попугаи были двух видов: 150 африканских серых попугаев (АСП) и 10 австралийских королевских (АКП). В клинической картине и тяжести инфекции у них отмечались различия. Через 5 дней после прибытия у пяти АСП появились насморк и респираторные признаки, через 35 дней 12,6 % АСП погибло. У АКП в течение 45 дней не было признаков инфекции, но через 7 дней после гибели первого АСП начали погибать АКП без каких-либо клинических признаков, всего их погибло 4 из 10. Гистологически у всех погибших попугаев были выявлены признаки некротизируюшего гепатита, электронно-микроско-пически в некротическом детрите были найдены вирусные частицы диаметром 67 нм с морфологией реовируса. В культуре эмбриональных фибробластов цыплят были изолированы три вируса, по одному от каждого вида, они имели большое сходство в тесте перекрестной нейтрализации с антисывороткой птичьего реовируса цыплят и попугаев.
Во ВНИИЗЖ разработана экспериментальная вакцина против реовирусного теносиновита птиц. В предварительных исследованиях изучена антигенная активность живой вакцины против реовирусного теносиновита из штамма S1133, полученной в культуре клеток куриных фибробластов. С этой целью цыплятам 14-дневного возраста вводили вакцину с активностью 103-5 подкожно в дозе 0,2 мл. Сыворотки крови анализировали на наличие антител против реовируса методом ИФА. Титр антител в сыворотках крови иммунизированных цыплят против реовируса удерживался в течение 30 дней, после чего снижался. Учитывая низкий титр антител, часть цыплят ре-вакцинировали в 60 дней экспериментальной вакциной в той же дозе. Уровень антител через 30 и 60 дней после ревакцинации находился в пределах предохраняющих птиц от заболевания реовирусным теносиновитом.
Потомство иммунизированной птицы в суточном возрасте резистентно к пероральному заражению различными штаммами вируса ТСК, но очень чувствительно к подкожному заражению. Для вакцинации применяют живую вакцину на основе шт. S1133, предложенную Ван дер Хинде. Иммунизация кур-несушек только живой вакциной из аттенуированного шт. S1133 оказалась недостаточно эффективной. Она примерно в 2 раза снижала заболеваемость цыплят по сравнению с контрольными цыплятами от непривитых кур. Однако выживаемость вируса в суставах зараженных цыплят обеих групп практически не отличалась. Инактивированная вакцина используется первый раз в возрасте 8—12 недель и повторно в 18—22 недели. Её готовят на основе штаммов-изолятов из кишечного тракта: СО, 1733 и 2408. Дополнительная вакцинация может быть проведена в 40-недельном возрасте, если титр AT в ИФА снижается до 1:1000. Вакцины создают клеточно-опосредованный иммунитет. Иммуногенность вакцины оценивают по устойчивости к контрольному заражению суточных цыплят от вакцинированных кур-несушек. Установлена прямая зависимость между кратностью и схемой прививок кур-несушек инактивированными и живыми вакцинами, уровнем материнских AT, передаваемых цыплятам, и их устойчивостью к клиническому проявлению болезни после контрольного заражения вирулентным штаммом. Однократное введение курам живой вакцины с последующим 2-кратным введением инактивированной обеспечивало более высокую степень защиты потомства, чем 2-кратное введение живой вакцины, а затем однократное — инактивированной. Эффективность вакцинации кур против гетерологичных штаммов реовируса достигалась также с помощью живой вакцины, приготовленной из шт. S1133.
Что такое корь? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Корь (Measles) — острое инфекционное заболевание, вызываемое вирусом кори, который поражает эпителий верхних дыхательных путей и кожные покровы. Клинически характеризуется выраженным синдромом общей инфекционной интоксикации, патогномоничной энантемой, макуло-папулёзной сыпью, конъюнктивитом и синдромом поражения респираторного тракта (дыхательных путей).
Этиология
вид — возбудитель кори (Polinosa morbillarum)
Синдромально заболевание было описано в 1890 году доктором Бельским (Псков), в 1895 году детским доктором Филатовым и в 1898 году доктором Копликом (США).
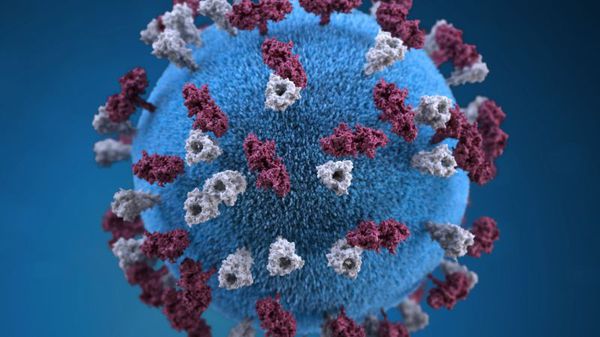
Оболочка вируса имеет 3 слоя: белковую мембрану, липидный слой и наружные гликопротеидные комплексы, образующие своеобразные выступы. Штаммы вирусов идентичны в антигенном отношении, обладают комплементсвязывающими, гемагглютинирующими, гемолизирующими свойствами и симпластообразующей активностью. СД-46 является рецептором у человека к вирусу кори.
Вирус неустойчив во внешней среде – чувствителен к ультрафиолету, в каплях слюны погибает за 30 минут, при высыхании и действии дезинфицирующих средств — мгновенно. Хорошо переносит пониженные температуры. Вирус можно выделить из различных сред организма (кровь, моча, кал, смывы со слизистых ротоглотки, конъюнктив, цереброспинальной жидкости). [2] [5]
Эпидемиология
Антропоноз. Источник заболевания – исключительно заражённый человек, также с атипичной формой заболевания кори. Инфицированный заразен с последних 2-х дней инкубации и до 4-го дня с момента появления высыпаний включительно — с 5 дня заразность пропадает.
Передача заболевания
Механизм передачи: воздушно-капельный (путь аэрозольный), редко трансплацентарный (при заболевании женщины в конце беременности). Теоретически возможно заражение от недавно привитых (но на практике такое случается чрезвычайно редко).
Существует весенне-зимняя сезонность. После перенесённой инфекции, полного курса вакцинации развивается стойкий пожизненный иммунитет.
Корь — одна из основных причин смерти среди детей раннего возраста.
В 2015 году в глобальных масштабах произошло 134 200 случаев смерти от кори. [1] [3]
Кто подвергается риску
Заразиться корью может любой человек, не имеющий иммунитета — тот, кто не был вакцинирован или тот, у кого не выработался иммунитет после вакцинации.
Самому высокому риску заболевания корью и развития осложнений, включая смертельный исход, подвергаются невакцинированные дети раннего возраста. Корь — одна из основных причин смерти среди них.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы кори
Инкубационный период
Инкубационный период при типичной форме — от 9 до 11 суток (в некоторых случая до 13).
Симптомы кори у взрослых
Начало заболевания подострое (т.е. основной синдром появляется на 2-3 сутки от начала заболевания), однако при должной подготовке врача (выявлении патогномоничной энантемы — сыпи на слизистых оболочках) можно определить острое начало (в течении первых суток). Во взрослом возрасте из-за особенностей иммунной системы эти критерии могут не соблюдаться.
- синдром выраженной общей инфекционной интоксикации;
- синдром патогномоничной энантемы (пятна Бельского-Филатова-Коплика);
- синдром макуло-папулёзной экзантемы;
- синдром конъюнктивита (выраженный);
- синдром поражения респираторного тракта (фарингит, трахеобронхит);
- синдром генерализованной лимфаденопатии (ГЛАП);
- гепатолиенальный синдром.
Описана так называемая ранняя диагностика кори, включающая:
- затруднение носового дыхания;
- покраснение правого века;
- субфебрилитет (лихорадка постоянного типа).
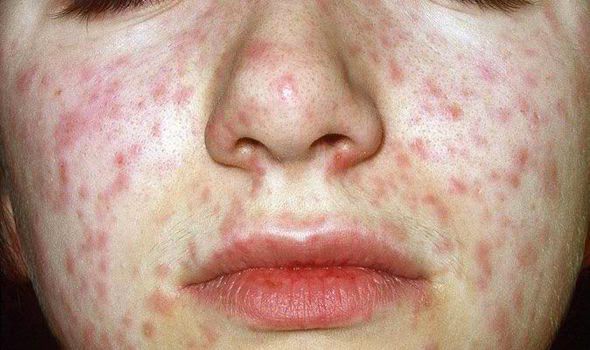
Объективно: можно отметить возникновение макуло-папулёзной сыпи, появляющейся в типичных случаях на 3-4 день болезни, с выраженной этапностью (лицо, шея; после туловище, руки, бёдра; затем олени и стопы, а на лице в этот момент бледнеет). Высыпания представляют собой папулы, окруженные красным пятном, предрасположенные к слиянию (но при наличии чистых участков), иногда появляются петехии. Спустя 3-4 дня сыпь становятся бледной и оставляет после себя бурые пятна и отрубевидное шелушение. Увеличиваются и приобретают чувствительность периферические лимфоузлы (затылочные, заднешейные и подмышечные). Ярко выражен конъюнктивит (конъюнктивы масштабно гиперемированы, отёчны, быстро присоединяется гнойное отделяемое). Характерным является вид больного: одутловатое лицо, красные (как у кролика) глаза, отёчность носа и век, сухие потрескавшиеся губы. При аускультации в лёгких прослушиваются сухие хрипы. Выражена тахикардия, снижение артериального давления. Увеличиваются размеры печени и селезёнки (генерализация инфекции).
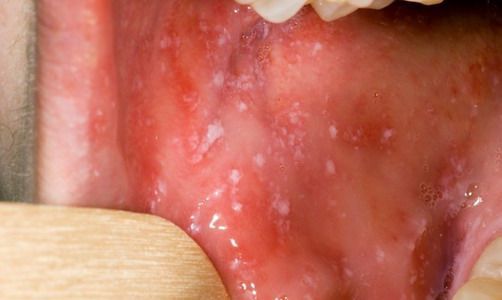
При фарингоскопии в ротоглотке визуализируется гиперемия мягкого нёба, на слизистой поверхности щёк в начале заболевания пятна Бельского — Филатова — Коплика (мелкие белесоватые пятнышки с узкой красноватой каёмкой), которые пропадают при появлении экзантемы. Иногда появляется пятнистая энантема на слизистой мягкого нёба.
Описана митигированная корь (у людей, получивших специфический противокоревой иммуноглобулин в период инкубации), характеризующаяся удлинением инкубационного периода до 21 дня, лёгким течением.
При абортивной форме заболевания характерно типичное начало, но спустя 1-2 суток клинические проявления исчезают.
Существует понятие — реакция на прививку (при первичном введении живой противокоревой вакцины), характеризующееся повышением температуры тела, катаральными явлениями (воспалениями) со стороны верхних дыхательных путей, скудной малозаметной сыпью (чаще развивается у детей и лиц с иммунодефицитом).
У больных с наличием тяжелого иммунодефицита – СПИДа (ВИЧ, онкологические больные, лица, получающие системные цитостатики после трансплантации органов) — течение заболевания крайне тяжёлое (летальность до 80%). [4] [5]
Читайте также:

