Патогенная флора это паразиты
Обновлено: 05.05.2024
Методические рекомендации предназначены для системы последипломного профессионального образования врачей. Посвящены общеклинической проблеме - дисбактериозу кишечника. Рассматриваются вопросы этиологии, патогенеза, клиники, диагностики и лечения дисбактериоза кишечника. Особое внимание уделено рациональному использованию пробиотиков и, в частности, Йогулакта в терапии данной патологии.
Количественные и качественные нарушения нормальной микрофлоры традиционно относят к понятию "дисбактериоз". В последнее время широко используется термин "дисбиоз кишечника", образованный из латинских слов "dis" - затруднение, нарушение, расстройство и "bios" - жизнь. Дисбиоз - это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Дисбактериоз кишечника всегда вторичен и представляет собой клинико-лабораторный синдром, который развивается при целом ряде заболеваний и клинических ситуаций и характеризуется изменением качественного и/или количественного состава микрофлоры определенного биотопа, транслокацией различных ее представителей в несвойственные биотопы, а также метаболическими и иммунными нарушениями, сопровождающимися у части пациентов клиническими симптомами.
Термин "дисбактериоз" был введен в клиническую практику в 1916 году немецким врачом А.Ниссле для обозначения явлений бродильной и гнилостной диспепсии. Существуют различные интерпретации этого термина.
Определение дисбактериоза.
В литературе рассматривается ряд определений дисбактериоза.
Дисбактериоз - это изменение количественного и (или) качественного состава бактериальной флоры, обусловленное динамическими нарушениями микроэкологии кишечника в результате расстройства адаптационных, защитных и компенсаторных механизмов. Микробиологически дисбиоз выражается в снижении количества облигатной флоры в кишечнике (бифидо - и лактобактерий, кишечной палочки)[Архипов Г.С., Венгеров Ю.Я., 2009].
За рубежом чаще используют термин "синдром избыточного бактериального роста" в тонкой кишке (СИБР). Его определение носит более конкретный характер, и постановка диагноза базируется на обнаружение более 10 5 микроорганизмов в одном мл аспирата из тощей кишки и/или появление флоры, характерной для толстой кишки
В последние годы проблема дисбактериоза вызывает немало дискуссий у специалистов различного профиля - клиницистов и бактериологов. Необходимо отдавать себе отчет в том, что, по мнению многих, такой нозологической единицы не существует, хотя в отечественных публикациях часто встречаются термины "дисбактериоз" или "дисбиоз кишечника". Дисбактериоз описывают даже в качестве самостоятельного заболевания, однако в существующих международных классификациях болезней он отсутствует. Некоторые авторы подчеркивают, что дисбактериоз или дисбиоз - не заболевание, а отклонение от нормы одного из параметров гомеостаза, который зачастую не требует обязательного лечения. Он всегда вторичен и причинно обусловлен. Данная точка зрения имеет важное практическое значение, так как исключает принадлежность дисбактериоза к самостоятельным болезням человека. В то же время сама возможность наличия такого патологического состояния, как дисбактериоз, никем не отрицается, так как в основе его развития лежат многообразные изменения в качественном и количественном составе микрофлоры пищеварительного тракта [Шендеров А.Б., 2000].
Эпидемиология дисбактериоза кишечника.
По данным РАМН более 90% населения России в той или иной мере страдает дисбактериозом. По данным зарубежных исследователей все жители планеты на протяжении жизни имеют те или иные отклонения от нормобиоценоза.
Роль нормальной микрофлоры кишечника в поддержании гомеостаза.
Нормальная микрофлора - эволюционно сложившаяся экологическая система симбиотических микроорганизмов, населяющих открытые полости человека и поддерживающие метаболическое, биохимическое и иммунологическое равновесие, необходимое для здоровья человека [Бондаренко В.М., 2007]. Микробиота кишечника взрослого содержит 10 - 100 триллионов микробов, общей массой от 1 до 2,5 кг. На жизнедеятельность кишечной микрофлоры расходуется до 10% поступившей энергии и 20% объема принятой человеком пищи. В толстой кишке содержится около 1,5 кг различных микроорганизмов. В 1 грамме содержимого слепой кишки обнаруживают около 2 миллиардов микробных клеток (представители 17 семейств, 45 родов, 500 видов). Плотность заселения микроорганизмами увеличивается к дистальному отделу тонкой кишки, резко возрастает в толстой кишке, достигая максимальных значений на уровне ободочной кишки. Толстая кишка человека в наибольшей степени колонизирована микроорганизмами. Количество бактерий в фекалиях может достигать 5х10 12 КОЕ/г содержимого (количество образующих колонии микроорганизмов - колониеобразующих единиц - на 1 грамм фекалий). В прямой кишке плотность обсеменения составляет до 400 миллиардов бактерий на 1 грамм содержимого.
Доминирующей группой, характерной для эубиоза здоровых взрослых людей, являются анаэробные бактерии, на долю которых приходится до 90-98% от общего количества микроорганизмов кишечника. Анаэробными являются микробы, способные существовать без свободного кислорода.
В отличие от них, жизнедеятельность аэробной флоры возможна только при наличии свободного кислорода. Аэробные и условно анаэробные бактерии, представленные кишечными палочками, стрептококками, энтерококками, составляют в сумме не более 5-10% от всей заселяющей кишечника человека аутофлоры.
Соотношение между кишечными анаэробами и аэробами в норме составляет 10:1.
В таблице 1 приведен состав представителей аэробной и анаэробной микрофлоры
Таблица 1. Состав аэробной и анаэробной микрофлоры
Классификация нормальной микрофлоры толстой кишки здорового человека
Нормальная микрофлора кишечника по количественным соотношениям представлена тремя основными группами:
1. Основная или облигатная микрофлора. Обязательная для толстой кишки. Это, преимущественно, грамположительные бесспоровые анаэробы - бифидобактерии и грамотрицательные бактероиды. Составляет 90-95% микробиоценоза человека.
2. Сопутствующая микрофлора. Представлена, в основном, аэробами - лактобактерии, кокковые формы, кишечная палочка (E.coli). В сумме эти микроорганизмы не превышают 5% микробиоценоза. Лактобактерии и E.coli являются синергистами бифидобактерий.
3. Остаточная микрофлора (условно-патогенная или факультативная микрофлора). К этой группе относятся стафилококки, кандиды, протей, синегнойная палочка, энтеробактерии, кампилобактерии. Удельный вес этой группы в норме не превышает 1% от общего количества микроорганизмов.
В зависимости от времени присутствия бактерий в кишечнике: постоянного или периодического, микрофлору здоровых людей подразделяют на несколько видов:
По локализации в кишечнике микроорганизмы можно также разделить на следующие две группы, отличающиеся друг от друга по количественной и качественной характеристикам:
В зависимости от расщепляемых микрофлорой пищевых веществ бактерии разделяют на:
Пристеночная (мукозная) микрофлора включает с себя более 395 филогенетически обособленных групп микроорганизмов [Бондаренко В.М., 2007]. Мукозная микрофлора (пристеночно) формирует микроколонии, образующие биопленку. Биопленка - микробное сообщество, которое как бактериальный газон выстилает поверхность слизистых. Генная структура микрофлоры тождественна генной структуре макроорганизма [Конев Ю.В. и соавт. , 2001]. В микробно-тканевом комплексе (биопленке) происходит распознавание и обмен генетическим материалом поступающих в желудочно-кишечный тракт (ЖКТ) микроорганизмов (в том числе, в составе пробиотиков). Распознавание молекулярного образа патогенных и симбиотических микроорганизмов - ключевой момент межмикробного взаимодействия. Он определяет молекулярно-генетическую и метаболическую биосовместимость нормофлоры с пробиотиками.
При рассмотрении многогранной функции нормальной микрофлоры кишечника необходимо использовать термин "энтеральная среда". Она представляет собой сложную систему жидкостей, включающую пищу, ее компоненты, пищеварительные секреты, кишечную микрофлору макроорганизма и ее метаболиты [Щекина М.И., 2009]. Сбалансированное существование энтеральной среды жизненно важно как для самого макроорганизма, так и симбионтной микрофлоры, присутствующей в кишечнике.
С этих позиций представляется целесообразным выделить наиболее значимые функции нормальной микрофлоры желудочно-кишечного тракта (ЖКТ) [Архипов Г.С., Венгеров Ю.Я., 2009]:
- Участие в пищеварении:
- переваривание полисахаридов (пектин, микрополисахариды, гликопротеиды);
- расщепление непереваренных азотсодержащих соединений, мочевины;
- синтез некоторых незаменимых аминокислот;
- деконьюгация желчных кислот;
- детоксикация ксенобиотиков (лекарственных веществ, токсических веществ, консервантов).
- Синтез витаминов. Микрофлора - основной источник витамина К, витаминов группы В (цианкобаламин, фолиевая кислота, биотин, рибовлавин, пантотеновая кислота).
- Защитные функции :
- колонизационная резистентность: связывание с рецепторами и заселение слизистого слоя кишечника;
- синтез бактерицидных веществ: летучих жирных кислот, перекиси водорода, сероводорода;
- конкуренция с транзиторной микрофлорой за питательные вещества;
- снижение внутриполостной рН;
- стимуляция местного иммунитета: выработка иммуноглобулинов и неспецифических факторов защиты (лизоцим, интерферон);
- поддержание реакций клеточного иммунитета.
- Расширение наследственной программы: обмен регуляторными молекулами, фрагментами структурных генов с другими представителями микробиоценоза.
- Обеспечение трофического гомеостаза. Нормальная микрофлора кишечника является клеточным, метаболическим, иммунологическим и генетическим компонентом жизнедеятельности человека.
Рассмотрим функции микрофлоры подробнее.
Известно, что основной функцией нормальной микрофлоры человека является обеспечение колонизационной резистентности (КР) пищеварительного тракта. В обычных условиях поддержание КР микрофлорой осуществляется за счет продукции антибиотических веществ, конкуренции за места адгезии, подавления адгезии условно патогенных бактерий, ингибирования транслокации и ряда опосредованных механизмов.
Участие в пищеварении является важным звеном деятельности микрофлоры кишечника. Симбионты в качестве промежуточных продуктов бактериального гидролиза пищи образуют янтарную, уксусную, масляную, пропионовую, муравьиную и другие кислоты, а также ряд газов, включая водород, диоксид углерода, метан. В норме происходит практически полная активная утилизация этих токсических метаболитов самой микрофлорой. При этом бифидо -, лактобактерии и энтерококки расщепляют целлюлозу и гемицеллюлозу с образованием короткоцепочечных жирных кислот. Кишечная палочка, бактероиды, клостридии и протей метаболизируют протеины до аммония, фенолов и меркаптопурина. При сбалансированном микробиоценозе эти процессы равновесны. Анаэробная микрофлора трансформирует пищевые волокна с образованием крайне важных для организма сахаров, аминокислот и минеральных веществ (табл. 1)
Таблица 2. Влияние продуцируемой микрофлорой низкомолекулярных метаболитов на функции организма (Щекина М.И., 2009)
| Метаболиты микрофлоры | Физиологические эффекты |
| Оксид азота | Регуляция моторной активности кишечника Регуляция нейротрасмиссии Регуляция сосудистого тонуса Антиоксидантное действие Антиапоптическое действие |
| Глутамат | Влияние на процессы нейрорегуляции |
| Изовалериановая, изокапроновая кислоты | Индукция секреции инсулина |
| Ацетат | Субстрат гипогенеза |
| Бутират | Регуляция пролиферации и дифференцировки колоноцитов Влияние на моторику толстой кишки |
| Эстрогеноподобные вещества | Влияние на пролиферацию эпителия (изменение экспрессии генов) |
| Сигнальные молекулы | Позволяют иммунной системе человека распознавать эти микроорганизмы как "свои" |
Микрофлора кишечника участвует в деконьюгации желчных кислот. 80-95% желчных кислот реабсорбируются, остальные под действием бактериальных ферментов в комплексе с холестерином превращаются в нерастворимые соединения и выделяются с каловыми массами. Выраженными холестеринснижающей активностью обладают бифидо- и лактобактерии, уменьшающие растворимость холестерина.
Нормальная микрофлора участвует в синтезе основных витаминов группы В (В1,В2,В6,В8,В12), витаминах К, С, никотиновой, фолиевой, пантотеновой, липоевой кислот. Доминирующее позиции в этом плане занимает кишечная палочка, обеспечивающая синтез 9 витаминов.
Функционирование обширной и активированной иммунной системы кишечника зависит от наличия нормальной микрофлоры. При этом иммунная система кишечника у здоровых людей регулируется таким образом, чтобы избежать чрезмерного кишечного ответа на пищевые антигены и кишечные бактерии-комменсалы. Отличительной особенностью мукозной иммунной системы пищеварительного тракта является лимфоидная ткань, представленная пейеровыми бляшками. При активации Т- и В- клетки пейеровых бляшек, мигрируют в кровь и экспрессируют α4β7-интегрин. Способность лимфоцитов мигрировать из кровеносных сосудов в собственную пластинку достигается при экспрессии лиганда к α4β7-интегрину на эндотелиальных клетках сосудов кишечника [Campbell D.J. et al.,2003]. Посредством данного механизма хемокины, вырабатываемые эпителиальными клетками, регулируют миграцию лимфоцитов в ткани кишечника.
Кишечная микрофлора обеспечивает активацию специфического клеточного и гуморального иммунитета, а также стимулирует неспецифическую резистентность организма. Сложившийся микробиоценоз кишечника стимулирует продукцию IgА и секреторного IgА, участвующего в локальной защите слизистой оболочки кишечника от патогенных вирусов, бактерий, токсинов и аллергенов. Микрофлора кишечника активирует фагоцитарную активность макрофагов и нейтрофилов. Нормофлора стимулирует созревание лимфоидного аппарата, потенцируя продукцию интерферона и лизоцима. Лакто- и бифидобактерии повышают фагоцитарную активность гранулоцитов крови, стимулируют продукцию цитокинов мононуклеарами, нормализуют иммунорегуляторный индекс, синтезируют ряд биологически активных веществ, разрушающих антигены.
Для нормального развития мукозного иммунного ответа необходимо наличие в кишечнике бактерий-комменсалов, при этом мукозная иммунная система распознает их постоянно, обеспечивая толерантность и контролируя воспаление [Broad A. et. al., 2006]. Кишечный эпителий определяет присутствие бактерий-комменсалов через паттерн-распознающие рецепторы, к которым относятся Тoll-подобные (ТПР) и внутриклеточные NOD-подобные рецепторы. Паттерн-распознающие рецепторы идентифицируют структуру бактерий и вирусов и запускают провоспалительные механизмы путем активации транскрипционного ядерного транскрипционного фактора kВ (NF-kB) [Macdonald T.T., Monteleone G., 2005].. В норме активация ТПР сопровождается усиление естественной резистентности, обеспечивающей гомеостаз желудочно-кишечного тракта и дает возможность избежать проникновения патогенных бактерий и повреждения эпителия.
Нормальная микрофлора кишечника обеспечивает трофический гомеостаз, влияя на регенераторные процессы в слизистой оболочки кишечника. Так, бифидо- и лактобактерии повышают митотическую активность энтероцитов крипт. Представители нормальной кишечной флоры синтезируют короткоцепочечные жирные кислоты, которые являясь энергетическим субстратом окисления в цикле Кребса, оказываю благотворное влияние на трофику и клеточную регенерацию слизистой оболочки кишечника и других тканей организма.
Нормальная кишечная микрофлора участвует в нейтрализации экзогенных и эндогенных метаболитов (нитратов, ксенобиотиков, мутагенных стероидов, токсичных продуктов белкового обмена - индола, скатола, фенола)

Условно-патогенные микроорганизмы (УПМ) желудочно-кишечного тракта борются за свое выживание, поэтому их поколения вырабатывают устойчивость к конкурентной нормальной флоре. Лакто– и бифидобактерии в процессе жизнедеятельности производят вещества, сходные с антибиотиками по своему действию. Кроме того, сам организм, благодаря иммунной системе сдерживает размножение болезнетворных бактерий. Прием алкоголя и табакокурение, не говоря уже о наркомании, нервные стрессы, физические перегрузки, возрастные изменения, физиологическое несовершенство лимфатической системы (у маленьких детей), различные заболевания (в первую очередь – вирусного происхождения) – все это нарушает нормальный баланс микрофлоры в желудочно-кишечном тракте, приводит к гибели полезных микроорганизмов. Природа не терпит пустоты, и на смену погибшим полезным бактериям приходят условно-патогенные. С этого момента начинается развитие дисбиоза и дисбактериоза. Если же бывшие условно-патогенными, а теперь ставшие болезнетворными, бактерии покидают свое привычное место жительства, проникая через тканевые барьеры, то развивается оппортунистическая инфекция.
Состав условно-патогенной микрофлоры
К условно-патогенным микроорганизмам желудочно-кишечного тракта относится практически все семейство Enterobacteriaceae. Сюда входят клебсиелла пневмония, энтеробактеры (аэрогенес и клоацеа), цитробактер фреунди, протеи. Предельно допустимой нормой для семейства энтеробактерий в ЖКТ является показатель в 1000 микробных единиц. Из семейства стафилококков в кишечнике обитают на постоянной основе негемолитические формы стафилококка, количество которого может достигать в норме 10 000 микроорганизмов на 1 гкала. Гемолитических форм, то есть растворяющих эритроциты, в кишечнике в норме быть не должно вообще. Из УПМ очень большое количество бактероидов (фрагилис, например), можно встретить в толстом отделе кишечника. Эти бактерии принимают участие в жировом (липидном) обмене. Но их количество не должно выходить за пределы 10 9 колониеобразующих единиц, то есть отдельных особей, в1 г кала. В кишечнике можно также встретить небольшое количество стрептококков, которые помимо антагонистических (враждебных) свойств несут также и полезную нагрузку в нашем организме – они стимулируют выработку иммуноглобулинов, а также активно подавляют патогенных бактерий типа сальмонелл, шигелл.
Среди представителей нормофлоры также есть микроорганизмы, способные вызывать дисфункции кишечника. То есть, собственно эти бактерии относят к условно-патогенным, но тем не менее, их полезные свойства преобладают над патогенными. Такими бактериями являются энтерококки фекалис и фециум.

Грибы рода Кандида, которые в больших количествах населяют окружающую нас среду, естественно прижились и в ЖКТ. Здесь допускается до 1000 КОЕ в 1 г кала (колониеобразующих единиц). К сожалению, поскольку эти грибы приспособлены не только к нашей внутренней, но и к внешней среде, они обладают большим заражающим потенциалом, и наряду со стафилококками способны нанести существенный вред детскому организму.
Из представителей условно-патогенной микрофлоры желудочно-кишечного тракта есть и такие, которые весьма редко, но все же могут вызывать заболевания. К таким можно отнести вейлонелл и фузобактерий. Их локализация, преимущественно, ограничена ротовой полостью. Но при попадании в кишечник, по данным некоторых ученых, они могут вызывать разного рода воспаления. Сведения о роли этих микробов в возникновении заболеваний ЖКТ весьма разрозненные и поэтому врачи, в лабораторных исследованиях причин дисбактериозов, особого внимания на них не обращают.
В отличие от вейлонелл и фузобактерий, хеликобактер пилори изучен довольно неплохо. Ему было отведено большое внимание в последнее время в связи с тем, что средой обитания он избрал желудок. Гастриты, язвенная болезнь желудка инфекционной природы в первую очередь связывается именно с хеликобактером. Лечение и приведение концентрации этого микроба к норме – довольно сложный процесс. Основная сложность терапии – высокая устойчивость хеликобактера к антимикробным препаратам. Еще бы – ведь он обитает в среде с повышенной кислотностью и через него проходят все лекарственные препараты. Какие должны быть защитные механизмы у бактерии, чтобы не только выживать, но и прекрасно себя чувствовать в подобных условиях!
Для того чтобы сдерживать патогенные свойства УПМ организму необходима помощь. Человек должен понимать, что его здоровье – в его же руках. Какими бы замечательными антагонистическими свойствами ни обладали наши эшерихии, бифидобактерии и лактобактерии, им нужна наша помощь, которая заключается в разумном подходе к образу жизни, и в первую очередь – к питанию.

Микроорганизмы также бывают облигатными (бифидобактерии, бактероиды, пропионовокислые бактерии, лактобактерии кишечная палочка, стрептококки) то есть являться основными представителями микрофлоры, факультативными (условно-патогенные микробы и сапрофиты) и транзиторными, которые не способны длительно жить в организме человека.
Микрофлора желудочно-кишечного тракта
Облигатная микрофлора желудочно-кишечного тракта представлена бифидобактериями, лактобактериями, кишечной палочкой, пропионобактериями, стрептококками, энтерококками, эубактериями и бактероидами. Сейчас ученые склоняются ко мнению, что хеликобактер пилори также является облигатной микрофлорой желудка.
Лактобактерии обитают во всех отделах ЖКТ и их количество так же высоко, как и у бифидобактерий. Роль этих микроорганизмов для человека трудно переоценить. Они подавляют рост и размножение патогенных и условно-патогенных микроорганизмов, стимулируют иммунную систему, участвуют в пищеварении.
Кишечная палочка, или эшерихия коли, так же как и лактобактерии заселяет организм ребенка в первые дни после рождения. Эшерихия коли образует в толстом отделе кишечника пленку, прилипая к ворсинкам эпителия. Благодаря такой пленке болезнетворным микробам очень трудно закрепиться в организме. Количество кишечной палочки в толстой кишке варьирует от 10 6 до 10 8 КОЕ/г.
Пропионобактерии обладают активными анатагонистическими свойствами против патогенных и условно-патогенных бактерий, таким образом принимая участие в иммунных процессах. Пептострептококки лизируют (расщепляют) молочные белки, а также участвуют в ферментации углеводов (сахаров).
Энтерококки относят к условно-патогенным микробам, но в то же время в организме человека они выполняют важную миссию – тренируют иммунитет. Содержание этих бактерий колеблется от 10 6 до 10 9 КОЕ/г.
Микрофлора влагалища

Колебания гормонального фона происходят у женщины на протяжение всей жизни. Поэтому колебания состава микрофлоры происходят регулярно. Эстрогены (женские половые гормоны) участвуют в образовании гликогена, который в свою очередь регулирует количество лактобактерий, а соответственно и кислотно-щелочной баланс. В зависимости от этого во время беременности, менопаузы, в разные периоды менструального цикла микрофлора может претерпевать значительные изменения.
В первые часы жизни влагалище новорожденной девочки стерильно. Затем начинает накапливаться гликоген, который является замечательным пищевым субстратом для лактобактерий. И эти бациллы начинают активно размножаться, расщепляя гликоген до молочной кислоты. В связи с увеличением концентрации молочной кислоты рН сдвигается в кислую сторону, что препятствует размножению некислотоустойчивых бактерий. Различные виды лактобактерий составляют основную массу микрофлоры влагалища (до 95%). Когда меняется гормональный фон, то и кислотность среды изменяется, предоставляя возможность другим микроорганизмам колонизировать новую среду обитания. Так во влагалище появляются стрептококки, стафилококки, дифтероиды.
Кроме вышеперечисленных бактерий во влагалище встречаются также бифидобактерии, превотеллы, пропионобактерии, клостридии, гарднереллы, кандиды и могут даже присутствовать в норме кишечные палочки (у 30-40% женщин). И если во влагалище взрослых женщин бифидобактерии высеваются приблизительно у каждой десятой, то пептострептококки обитают у каждой третей, а по некоторым данным — и у 90% женщин.

В последние годы инфекционисты отмечают рост заболеваний, обусловленных нетрадиционными микроорганизмами. Особое место занимает протейная инфекция. Ее кишечная форма, вызванная бакетриями рода Протей — P. vulgaris протекает тяжелее у детей раннего возраста. Не менее опасны гнойно-воспалительные заболевания мочевыводящей системы, вызываемые P. mirabilis, P. rettgeri и P. morganii.
В греческой мифологии Протей – божество, способное менять облик. Отсюда название полиморфных, мелких, нитевидных палочек, отличающихся активной подвижностью. Размеры клеток составляют 0,5 — 3 мкм. P. morganii, P. rettgeri — менее полиморфны и малоподвижны.
Протейная инфекция: причины, развитие, опасность для организма
Возбудителями протейной инфекции являются грамотрицательные условно-патогенные микроорганизмы семейства энтеробактерий, которые присутствуют в нормальной микрофлоре кишечника, а также повсеместно распространены в воздухе, почве и воде. Бактерии рода Proteus в течение долгого времени не причислялись к возбудителям серьезных инфекционно-воспалительных заболеваний. Однако в связи с последними достижениями в области диагностики было обнаружено, что эти микроорганизмы способны вызывать трудно поддающиеся лечению патологии (протеозы), поражающие преимущественно ЖКТ и мочеполовую систему.
Протей – факультативный анаэроб, палочковидная, неспороносная, подвижная, грамотрицательная бактерия. В микробиологическом анализе кала протей встречается в комплексе с другими условно-патогенными бактериями семейства энтеробактерий. Кроме протея, в составе нормальной микрофлоры кишечника человека определяются: клебсиелла, энтеробактер, гафния, серратия, морганелла, провиденция, цитробактер. В 1 г кала должно быть меньше 10 4 общего количества этих бактерий. Большее количество перечисленных бактерий является признаком дисбактериоза.
В природе бактерии рода Proteus обнаруживаются: в сточных водах, в земле, в водоемах, на овощах, в разлагающихся органических веществах. Эти микроорганизмы — сапрофиты, они живут на слизистых оболочках, на коже, в кишечнике человека и животных. Протеи устойчивы во внешней среде и сохраняют жизнедеятельность в слабых растворах фенола и других средств. Выявлена также резистентность ко многим антибиотикам.
Причины протейной инфекции
Протейная палочка, присутствующая в кишечной микрофлоре в небольших количествах, не причиняет организму никакого вреда. При определенных обстоятельствах (снижение иммунитета, неправильное питание, длительный прием антибиотиков) она может активизироваться и начать интенсивно размножаться. Также инфицирующее количество этих бактерий способно проникнуть в организм из внешней среды.
Основными путями передачи инфекции являются пищевой и контактно-бытовой. Чаще всего заражение происходит при употреблении белковых продуктов (мяса, рыбы, молока, колбасы), которые хранились с нарушением надлежащих сроков и условий. Значительно реже инфицирование осуществляется через немытые руки, во время купания или при употреблении зараженной воды.
Инфицирование протеем может произойти через полуфабрикаты, сырые продукты или готовые блюда из мяса, рыбы, молока, колбасы, студня. В них происходит быстрое размножение бактерий с образованием токсинов. Реже отмечают водный путь передачи: при купании в загрязненных водоемах или употреблении инфицированной воды. Возможен и контактный путь передачи на инфицированных руках зараженного человека.
Развитие патологии
При непосредственном попадании протея в ЖКТ вместе с продуктами питания инфекционное заболевание развивается очень стремительно. Первые симптомы ярко выражены, а общая клиническая картина совпадает с проявлениями сильного пищевого отравления. При контактно-бытовом способе заражения развитие признаков инфекции обычно происходит медленнее.
Если инфекционный процесс протекает в легкой форме, больной испытывает слабость, у него отмечаются повышение температуры, рвота, боль в животе, частый водянистый стул, в котором могут обнаруживаться слизь и зеленые включения. При тяжелом течении заболевания приступы рвоты случаются около 10 раз за сутки и более, а температура обычно поднимается до 40°С.
При условии своевременного и адекватного лечения вся острая симптоматика протеоза легкой или средней степени тяжести исчезает спустя несколько дней, после чего больной быстро идет на поправку.
Протеи выделяют токсические вещества — эндотоксины с гемолитическими свойствами и с различной степенью биохимической активности. У штаммов P. vulgaris обнаружена лецитиназная активность. Протеи обладают способностью адгезии к уротелию при помощи ресничек. Отмечают, что резистентность к антибиотикам связана с адгезивной способностью уропатогенных протеев.
Острой кишечной протейной инфекцией, протекающей по типу гастроэнтерита, гастрита и колиэнтерита часто болеют дети раннего возраста с пониженным иммунитетом и после бесконтрольного назначения антибиотиков. Заболевание сопровождается симптомами токсикоза — повышением температуры, рвотой, метеоризмом, схваткообразными болями в животе, нарушением аппетита, кратковременными судорогами, появлением водянистого, зловонного, учащенного стула.
В тяжелых случаях могут развиться осложнения: гемолитико-уремический синдром, а также симптомы острой гемолитической тромбопении, анемии или острой почечной недостаточности.
Клинические проявления внутрибольничной инфекции протейной этиологии весьма разнообразны: поражения мочевыводящей системы, отиты, холециститы, нагноения ран и септические состояния. Попадание протеев в пупочную ранку новорожденного может привести к бактериемии или развитию менингита.
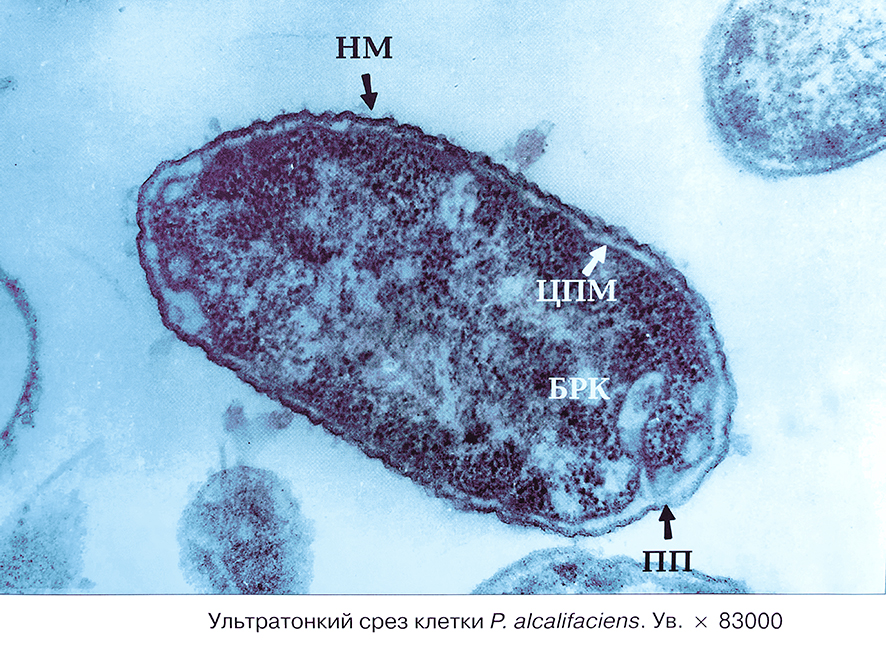
Данные заболевания могут развиться: при передаче возбудителя контактно-бытовым или воздушно-капельным путями, при заносе с катетером, другими урологическими инструментами.
Ультратонкий срез клетки Proteus alcalifaciens. Увеличение *83000
Если в мазках исследуемого материала (участки ожоговой ткани, гной, раневое отделяемое, испражнения) обнаруживаются грамотрицательные палочки, то бактериоскопический метод позволяет сделать предварительное заключение. Бактериологическим методом на средах определяют колонии протея в виде тонкого стелющегося налета. Активно размножаются протеи на белковой питательной среде вызывают гниение мяса, рыбы, других белковых продуктов.
Важнейшие профилактические меры — это соблюдение санитарного режима в детских учреждениях и стационарах, проведение общесанитарных мероприятий. Для профилактики протея каждому необходимо соблюдать правила личной гигиены, исключить потребление подозрительных продуктов в питании, избегать контактов с больными детьми и взрослыми.
При лечении протейной инфекции следует придерживаться лечебной щадящей диеты с исключением жареных, острых блюд, белковых продуктов. В острый период протейного инфицирования, при поражении желудочно-кишечного тракта — необходимо обеспечить восполнение потерянной жидкости. Полезно употреблять отвары трав – тысячелистника, алтея, зверобоя, ромашки, календулы; морсы, компоты с клюквой, черной смородиной, абрикосами, черникой, яблоками. Применять антибиотики можно только по назначению врача, в соответствии с данными анализов чувствительности бактерии протея к ним.
Обязательно нужно принимать препараты – пробиотики, пребиотики, синбиотики для восстановления нормальной флоры кишечника.
Синбиотические комплексы Нормофлорины, содержащий живые активные лакто- и бифидобактерии, секретирующие молочную, уксусную, масляную, пропионовую кислоты, оказывающие защитное, антисептическое, противовоспалительное, сорбционное действие – уменьшает интоксикацию, улучшает моторику кишечника, функцию печени, повышает иммунную реактивность. Это помогает в борьбе с протейной инфекцией, восстанавливает работу желудочно-кишечного тракта, общее самочувствие, повышает иммунитет.
Схема (возрастные дозировки для детей или взрослых): (взрослый) нормофлорин Л – 20 мл (при диарее) – 40 (при запорах) мл утром перед едой, Д — 40 мл вечером за 20 мин до еды, Б – 20-30 мл на ночь в клизме. При диарее в обед можно добавить Д – 30-40 мл, при запорах в обед + Л – 30-40 мл.
Курс приема нормофлоринов — 1 — 1,5 месяца, для выведения токсинов, патогенной микрофлоры, восстановления полезных собственных бактерий. Уникальный состав нормофлоринов, не содержащих белков коровьего молока, молочного сахара, консервантов позволяет при протейной инфекции успешно применять его у детей с первых дней жизни, беременных, кормящих, больных сахарным диабетом, аллергическими заболеваниями, т.е. у взрослых при любой сопутствующей патологии.
Опасность протейной инфекции

Протейная инфекция
Тяжелые формы патологии могут осложняться состояниями, требующими срочной госпитализации больного, такими как сильное обезвоживание, судороги, инфекционно-токсический шок.
protey_mirabilis
Помимо острых инфекций пищеварительной системы бактерии Proteus способны поражать другие органы, распространяясь через кровь или по лимфатическим сосудам. Очаг воспаления может локализоваться в мочеполовой системе, глазах, ушах, легких и даже в костной ткани или мозговых оболочках. Данные патологии достаточно часто переходят в хроническую форму с упорным рецидивирующим течением, которая тяжело поддается терапии.
Если протейная инфекция заносится на незажившие поверхности кожи и слизистых оболочек (послеоперационные раны, ожоги), вызванный ею воспалительный процесс значительно замедляет регенерацию тканей и снижает эффективность лечебных мероприятий.
Следует отметить, что даже незначительное превышение нормального количества протейной палочки в кишечной микрофлоре может негативно отразиться на состоянии здоровья. Так, если у человека имеются аутоиммунные болезни, существует высокий риск их обострения из-за возросшей активности протейной палочки. Атопический дерматит, астма, аллергические заболевания и другие иммунозависимые патологии могут впервые развиться или обостриться под воздействием бактерий Proteus.
Известно, что бактерии встречаются всюду в окружающем нас мире и за длительный эволюционный период тесного существования человека и микроорганизмов сформировались симбиотические (взаимовыгодно существующие) системы, составными частями которой являются микрофлора, макроорганизм и окружающая среда. В результате эволюционного процесса все органы человека, сообщающиеся с внешней средой, населены микроорганизмами: кожа, желудочно-кишечный тракт (ЖКТ), слизистые оболочки, вагина. В норме эта ассоциация находится в состоянии экологического равновесия - эубиоза и характеризуется единством, целостностью и способностью к саморегуляции. При различных неблагоприятных воздействиях на организм человека его микрофлора реагирует изменениями своего количественного и качественного состава, в крайних проявлениях приводя к нарушению равновесия - дисбактериозу.
Дисбактериоз (термин ввел немецкий ученый А.Нисле в 1916 г.) - качественное и количественное изменение бактериальной микрофлоры организма, главным образом кишечника. Однако следует помнить, что это состояние не является самостоятельным заболеванием и нозологической единицей.
На основании многолетних исследований, проведенных в этой области, микрофлору кишечника принято подразделять на несколько групп.
Облигатная флора, в которую входят микроорганизмы, постоянно населяющие кишечник, выполняющие как защитные функции, так и участвующие в обмене веществ.
Факультативная (условно-патогенная) флора, к которой относятся бактерии, живущие в организме человека, не вызывая заболевания при нормальном состоянии иммунной системы (рис. 1).
Рис. 1. Функции облигатной флоры кишечника.
| Защитная Иммунологический барьер, активация иммунной системы | ||||
| │ | ||||
| Участие в процессе пищеварения | ─ | Облигатная флора кишечника | ─ | Синтез витаминов и ферментов |
| │ | ||||
| Регулирует моторику ЖКТ |
Транзиторная флора, представители которой не приспособлены жить в организме человека, и их выделение носит случайный характер.
Патогенная флора - возбудители инфекционных заболеваний, которые в норме не присутствуют в организме человека.
К представителям облигатной микрофлоры относятся бифидо-, лактобактерии и кишечная палочка.
Бифидобактерии занимают доминирующее положение в кишечной флоре как у детей, так и у взрослых, составляя 90-95% от всех микроорганизмов кишечника. Они обладают высокой антагонистической активностью по отношению ко многим патогенным микроорганизмам, препятствуя их проникновению в организм человека. Выделяя молочно-кислую и уксусную кислоты, бифидобактерии способствуют усилению процессов пищеварения, участвуя в гидролизе белков, сбраживании сахара, расщеплении жиров. Также они растворяют клетчатку, усиливают всасывание в кишечнике кальция, железа и витамина D, стимулируют перистальтику кишечника, обеспечивая нормальную эвакуацию его содержимого. Биологически активные вещества, которые выделяют бифидобактерии, участвуют в обменных процессах организма, снижают токсическую нагрузку на печень. Кроме того, они участвуют в синтезе витамина К, витаминов группы В (В: - тиамина, В2 - рибофлавина, В3 - никотиновой кислоты, Вб - пиридоксина, В9 - фолиевой кислоты, В12 - цианокобаламина), а также аминокислот и белка. Одной из важнейших функций является иммуностимулирующее действие бифидобактерии. Они регулируют систему местного иммунитета кишечника, стимулируя образование интерферона и иммуноглобулинов. В клеточной стенке бифидобактерии содержится большое количество мурамилдипептида, который активирует образование В- и Т-лимфоцитов и макрофагов, обеспечивающих устойчивость иммунной системы к инфекционным заболеваниям. При снижении бифидобактерии активируется условно-патогенная флора.
В норме содержание бифидобактерии должно составлять не менее 10 9 -10 10 живых микробных тел на 1 г фекалий [1].
Лактобактерии обладают широким спектром антагонистической активности, благодаря чему подавляется рост патогенной, гнилостной и газообразующей микрофлоры: в первую очередь протеев, сальмонелл, дизентерийной палочки. В процессе своей жизнедеятельности лактобациллы синтезируют молочную кислоту, перекись водорода, лизоцим и другие вещества, обладающие антибиотической активностью. Также немаловажную роль они играют в регуляции иммунитета, стимулируя синтез иммуноглобулинов и интерферона.
Лактобактерии присутствуют в кишечнике здоровых людей в количестве 10 6 -10 8 клеток на 1 г фекалий [1].
Кишечная палочка заселяет слизистую оболочку ЖКТ в первые дни после рождения. Ее количество составляет примерно 0,01% от общего числа доминирующих бифидо- и лактобактерии, однако она незаменима. Кишечная палочка участвует в расщеплении лактозы, играет важную роль в синтезе витаминов К и группы В, выделяет колицины - антибиотикоподобные вещества, подавляющие рост энтеропатогенных штаммов кишечной палочки, активирует системный и местный иммунитет [2].
Факультативная часть нормальной микрофлоры составляет всего 0,6% от общего количества микроорганизмов, локализуется преимущественно в толстой кишке, и представлена стафилококками (золотистым и эпидермальным), бактериями семейства Enterobacteriaceae (протей, клебсиелла, клостридии, энтеробактер), некоторыми видами дрожжевых грибов. Они достаточно часто встречаются в кишечнике здоровых людей, но при снижении резистентности организма способны вызывать различные патологические состояния. Так, клостридии в кишечнике детей не должны превышать 10 3 клеток, а у взрослых - 10 5 клеток на 1 г кишечного содержимого. Если их содержание не превышает нормативные показатели, то они принимают участие в переваривании белков. В процессе расщепления животных протеинов образуются индол и скатол, стимулирующие перистальтику кишечника в умеренном количестве. Однако при их избыточном образовании возникают диспепсические явления, метеоризм и интоксикация организма этими веществами [1, 2].
Из группы условно-патогенных бактерий отдельно хочется выделить Klbsiellapneumoniae и Klbsiella oxytoca. В последнее время наблюдается тенденция к увеличению частоты встречаемости этих микроорганизмов в кишечнике, особенно у детей раннего возраста, и, как правило, они полностью вытесняют кишечную палочку и заменяют ее место. В отличие от кишечной палочки клебсиеллы не способны расщеплять лактозу. Среди таких детей высока частота встречаемости метеоризма, кишечных колик, они отказываются от грудного вскармливания и имеют плоскую кривую массы тела.
Вторыми в отношении тяжести течения дисбактериоза являются микроорганизмы рода протей - Proteus vulgaris и Proteus amirabilis. Они вызывают длительную диарею, и стул при этом носит зловонный характер. Как правило, дисбактериоз, обусловленный протеем, возникает как осложнение антибактериальной терапии. При лечении антибиотиками резко снижается численность облигатной флоры (бифидо-, лактобактерий и кишечной палочки), как следствие уменьшается иммунологическая защита и резко увеличиваются бактерии рода протей, обладающие устойчивостью к большинству антибактериальных препаратов, применяемых в амбулаторной практике.
Общее количество дрожжевых и мицелиальных грибов не должно превышать 1000 клеток на 1 г фекалий. Наиболее часто при дисбактериозе кишечника высеваются грибы рода Candida, которые вызывают бродильные процессы в кишечнике и утяжеляют течение атопического дерматита, но при этом они не являются первопричиной аллергии.
Процесс заселения организма человека бактериями начинается с момента прохождения ребенка по родовым путям матери, и в постнатальном периоде состав флоры продолжает формироваться в течение первых б мес жизни. Наиболее оптимальным и естественным для ребенка в этот период является грудное вскармливание. Как известно, грудное молоко в своем составе имеет высокое содержание олигосахаров, которые являются ценнейшим пробиотическим фактором и стимулируют образование кишечных колоний Lactobacillus bifidus - полезных молочно-кислых лактобактерий, которые подавляют рост патогенных микроорганизмов в кишечнике. А неусвоенная лактоза в просвете толстой кишки, снижая рН, препятствует росту гнилостной микрофлоры. Нежная лакто- и бифидофлора кишечника, формирующаяся в первые месяцы жизни, определяет в дальнейшем микробиоценоз и микробное равновесие ЖКТ. Поэтому основной задачей на первом году жизни ребенка должна быть поддержка грудного вскармливания, которое способствует более эффективному и качественному становлению микробиоценоза [3]. Использование антибактериальных препаратов, подавляющих рост бактерий, фагов, и обилие биопрепаратов, бесконтрольно используемых в этот период времени, могут способствовать приобретению дисбактериоза. У младенцев же, находящихся с рождения на искусственном вскармливании, создаются предпосылки для повышения активности аэробной условно-патогенной флоры, которые требуют микробиологической коррекции [4].
У детей старше 1 года после прекращения вскармливания грудным молоком постепенно исчезает лактозонегативная кишечная палочка, дрожжеподобные грибы рода Candida и другие представители семейства Enterobacteriaceae, снижается общее количество кишечной палочки и стафилококков. Доминирующей становится бифидофлора [5]. Именно эти микроорганизмы на протяжении всей жизни человека выполняют основную роль в регуляции процессов пищеварения, всасывания необходимых витаминов и незаменимых аминокислот, а также целого ряда биологически активных соединений.
В течение жизни на человека действуют различные неблагоприятные факторы, которые могут вызывать отдельные отклонения в составе кишечной микрофлоры, не являющиеся нарушениями микробиоценоза, так как они носят транзиторный характер и не требуют коррекции (рис. 2). Возникшее стойкое изменение количественного и видового состава бактерии, сопровождающееся нарушением защитных механизмов в организме, является дисбактериозом. Необходимо помнить, что дисбактериоз всегда вторичен и причинно обусловлен. Поэтому к трактовке микробиологического анализа кала и необходимости его коррекции следует подходить с большой осторожностью и делать практические выводы только после сопоставления данных анализа с клинической картиной и жалобами пациента.
Рис. 2. Факторы, влияющие на состав флоры кишечника.
- Экология
- Стресс
- Характер питания
- раннее искусственное вскармливание
- употребление в пищу рафинированных продуктов с длительным сроком хранения
- Медикаментозная терапия антибактериальными препаратами, гормонами, иммунодепрессантами
- Несовершенство защитных реакций организма
- Постнатальная гипоксия
- Морфофункциональная незрелость
- Недоношенность
- Заселение кишечника агрессивными внутрибольничными штаммами
- Соматическая патология и оперативные вмешательства
- Острые респираторные вирусные инфекции
Основные показания к исследованию микрофлоры кишечника представлены на рис. 3.
Рис. 3. Основные показания к исследованию микрофлоры кишечника.
| Показания к исследованию кала на дисбактериоз |
| Длительно протекающие кишечные расстройства, не поддающиеся коррекции |
| Неустойчивый характер стула |
| Наличие в кале слизи, крови, кусочков непереваренной пищи, неравномерная окраска |
| Метеоризм и кишечные колики, не поддающиеся коррекции |
| Анемия, рахит |
| Атопический дерматит с элементами вторичного инфицирования |
| Частые острые респираторные вирусные инфекции |
| Сепсис |
В зависимости от характера изменения микрофлоры, находящейся в просвете толстой кишки, выделяют 3 степени дисбактериоза (рис. 4).
Рис. 4. Классификация дисбактериозов.
Классификация дисбактериозов по степеням
- снижение количества бифидобактерий и/или лактобактерий менее 10 6 КОЕ/г фекалий
- повышение количества кишечной палочки более 10 8 КОЕ/г фекалий
- выявление одного вида условно-патогенных микроорганизмов 10 5 КОЕ/г фекалий
- выявление ассоциации условно-патогенных микроорганизмов 10 3 -10 4 КОЕ/г фекалий
- выявление одного вида условно-патогенных микроорганизмов или ассоциаций в высоких титрах
Лечение дисбактериоза всегда должно быть комплексным, с учетом основного заболевания и предрасполагающих факторов, характера симптомов и глубины нарушений, а также осуществляться под контролем врача.
Это комбинированный и уникальный по своим составу и функциям препарат применяется в педиатрической практике с первого года жизни (в том числе и у недоношенных младенцев), а также разрешен беременным и кормящим женщинам. После приема внутрь он действует только в просвете кишечника, не всасывается в кровь и выводится из пищеварительного тракта с калом. Выпускается в удобной лекарственной форме, которая обеспечивает легкость дозирования в зависимости от возраста ребенка.
Рис. 5. Применение препарата Хилак форте в составе комплексной терапии.
Хилак форте назначают младенцам по 15-30 капель, детям по 20-40 капель, взрослым по 40-60 капель 3 раза в сутки. После улучшения состояния первоначальная доза препарата может быть уменьшена наполовину. Принимают внутрь до или во время приема пищи в небольшом количестве жидкости, кроме молока.
Особенностью детей первого полугодия жизни является относительная функциональная незрелость органов (слюнных желез, печени, поджелудочной железы), обеспечивающих полостное переваривание пищи. Слизистая оболочка кишечника компенсирует эту недостаточность, беря на себя основные функции по пристеночному пищеварению. Однако при любых неблагоприятных условиях и повреждающем действии на слизистую оболочку кишечника поражаются ворсины кишечного эпителия, коррелирующие с ферментативной активностью, что проявляется синдромом мальабсорбции [9, 10]. Препарат Хилак форте, имея в своем составе значительную добавку биосинтетических бактериальных продуктов, способствует поддержанию физиологической функции слизистой оболочки кишечника, а также стимулирует ее регенеративные способности, а короткоцепочные жирные кислоты усиливают собственную ферментативную активность слизистой оболочки кишечника.
Доказана эффективность препарата в комплексной терапии при выхаживании недоношенных новорожденных как в стационаре, так и в течение первых 12 мес жизни, что имеет большое практическое значение. Недоношенные младенцы, оказываясь в условиях отделений интенсивной терапии и второго этапа выхаживания, получают агрессивные внутрибольничные штаммы. Кроме того, незрелые иммунная система и ЖКТ, а также длительная антибактериальная терапия приводят к стойкому нарушению микробиоценоза кишечника в постнатальном периоде, сопровождающемуся изменениями частоты и характера стула [11, 12]. В качестве селективной стимуляции облигатной микрофлоры у недоношенных новорожденных препарат Хилак форте рекомендуется использовать из расчета 5-10 капель на 1 кг массы тела 2-3 раза в сутки.
Препарат Хилак форте положительно зарекомендовал себя и в педиатрической практике, и среди взрослых пациентов. В ряде исследований показана высокая эффективность Хилака форте у больных с острыми кишечными инфекциями и хроническими заболеваниями ЖКТ. Добавление к терапии препарата Хилак форте позволяет быстрее устранить интоксикацию и диспепсические явления, нормализовать стул. В то же время он способствует уменьшению выраженности воспаления и атрофических процессов в слизистой оболочке толстой кишки [13].
Отчетливый элиминационный эффект Хилака форте получен в отношении клебсиелл, цитобактера и грибов рода Candida, что сопровождается нормализацией количественного содержания бифидобактерий, лактобактерий, кишечной палочки, энтерококков. Одновременно с восстановлением микрофлоры в копрограмме пациентов снижается количество непереваренных мышечных волокон, растительной клетчатки и зерен крахмала, устраняется йодофильная флора [14, 15].
Препарат Хилак форте рекомендовано использовать в комплексной терапии при лечении нарушений моторной функции толстой кишки, неалкогольной жировой болезни печени, желчно-каменной болезни [16, 17]. При включении Хилака форте в схему лечения синдрома раздраженной кишки отмечается положительное действие препарата на клиническую картину и микробиологический статус больных. Применение Хилака форте у пациентов с функциональными запорами, сопровождающимися значительными нарушениями структуры биоценоза толстой кишки, приводит к нормализации стула, улучшению его консистенции, оказывает выраженный бифидогенный эффект, способствует снижению рН кала с ингибированием роста условно-патогенных штаммов [18].
При развитии антибиотикоассоциированной диареи назначение Хилака форте нормализует биоценоз кишечника. Он способствует регенерации физиологической флоры кишечника биологическим путем, создает оптимальные условия для роста облигатных микроорганизмов и обеспечивает регенерацию поврежденной стенки кишечника [19].
Препарат рекомендован для восстановления микробиоценоза ЖКТ после курса эрадикационной терапии при заболеваниях верхних отделов пищеварительной системы, ассоциированных с Н. pylori [20].
Также отмечен положительный эффект препарата Хилак форте в составе комплексной терапии при длительном волнообразном течении заболеваний верхних дыхательных путей на фоне частых острых респираторных вирусных инфекций, сопровождающихся повышением активности условно-патогенной флоры на слизистой оболочке дыхательного тракта.
Таким образом, приведенные данные свидетельствуют о высокой эффективности препарата Хилак форте при лечении синдрома дисбактериоза в составе комплексной терапии основного заболевания, приводящего к нарушению микробиоценоза кишечника. Состав и свойства препарата Хилак форте позволяют применять его и для коррекции микробиологических нарушений, и для их профилактики, в частности при антибактериальной терапии. Безопасность и высокий терапевтический эффект обосновывают включение Хилака форте в терапию не только у взрослых, но и у детей всех возрастных групп, включая новорожденных и недоношенных младенцев.
Читайте также:

