Патогенные дрожжи и дрожжеподобные грибы связь с вич
Обновлено: 06.05.2024
Поражение дрожжеподобными грибами Candida ушей. Кандидамикоз
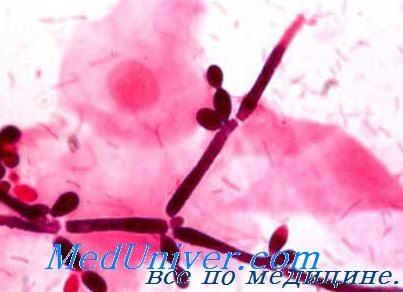
Значительную роль в патологии человека играют дрожжеподобные грибки рода Candida, которые представляют собой одноклеточные организмы. Почкование является единственной формой размножения дрожжеподобных грибков. Молодые клетки носят название бласто-спор. Кроме клеток, эти грибки образуют нити псевдомицелия, отличающиеся от истинного мицелия тем, что они не имеют общей оболочки, а состоят из вытянутых в длину дрожжевых клеток.
По исследованиям Lodder и Kreger Van Rij, некоторые виды рода Candida могут образовывать и истинный мицелий в виде цилиндрической трубки с редкими перегородками. Почковаться могут не только клетки, но и мицелий, на котором в результате почкования образуются мутовки бластоспор (вертициллы). Вторичиое почкование этих бластоспор образует большие их скопления, называемые гломерулами.
Грибки рода Candida хорошо развиваются на различных питательных средах с различными углеводами (декстрин, крахмал, моносахариды, дисахариды, многоатомные спирты и различные органические кислоты). Оптимальная кислотность среды рН от 5,8 до 6,5. Но дрожжеподобные грибки могут развиваться и в очень кислых средах (рН 2,5—3,0), правда, значительно медленнее.
Заболевания, вызванные дрожжеподобными грибками рода Candida, описаны в литературе под различными названиями: монилиазы, левурозы, эидомикозы, бластомикозы, оидиомикозы и многие другие в соответствии с прежними названиями самого грибка. На третьем Международном конгрессе микробиологов было принято название грибка Candida, а заболевания — кандидамикоз. Однако до сих пор в литературе встречаются и другие, указанные выше, названия этого заболевания, а также термины кандидозы, каидидиазы.
Из заболеваний, вызываемых дрожжеподобными грибками рода Candida, наиболее давно известны кандидамикоз, или так называемая молочница слизистой оболочки рта (Soormycosis oris).
В последние годы изучением клиники, этиологии, патогенеза, эпидемиологии и терапии заболеваний, вызываемых дрожжеподобными грибками, много занимались советские ученые: А. М. Ариевич, А. А. Бачинская, Е. С. Белостоцкий, Б. В. Груховцев, Н. П. Блинов, П. Н. Кашкин, А. А. Кондратьева, В. Я. Некачалов, В. И. Самцов, З. Г. Степанищева, И. А. Хатридзе, И. Э. Школьников и др.
Однако многие клинические формы дрожжевых поражений кожи и слизистых оболочек, так же как и вообще грибковых поражений, остаются малоизвестными практическим врачам. Таким недостаточно изученным вопросом являются кандидамикоз и другие грибковые поражения наружного слухового прохода.
Плесневый гриб Talaromyces (ранее называемый Penicillium) marneffei является причиной жизнеугрожающего микоза у иммунокомпрометированных пациентов, проживающих или путешествующих в Юго-Восточную Азию, Китай и Индию.
Таларомикоз (ранее называемый, пенициллиоз ) в эндемичных регионах является одной из основных причин смерти у пациентов с ВИЧ-инфекцией. При этом распространенность инфекции у больных ВИЧ уступает только туберкулезу и криптококкозу.
Данная грибковая инфекция является причиной госпитализацией ВИЧ-инфицированных больных в 4-15% случаях. Согласно текущим рекомендациям, инициирующей терапией является назначение амфотерицина B, однако препарат имеет большое число побочных эффектов, высокую стоимость и ограниченную доступность.
Методы
В открытое исследование noninferiority были рандомизированы 440 пациентов с ВИЧ-инфекцией и Talaromyces marneffei, подверженным по данным микроскопического и культурального методов. 219 пациентов были включены в группу амфотерицина B деоксихолата внутривенно в дозе 0,7-1,0 мг\кг в день и 221 больной - в группу итраконазола перорально в дозе 600 мг в день в течение 3 дней с последующим снижением дозы до 400 мг на протяжении 11 дней. В дальнейшем все пациенты получали итраконазол.
Первичной конечной точкой исследования была выбрана смертность от всех причин через 2 недели терапии. Вторичными конечными точками являлись: смертность от всех причин на 24 недели, время до клинического разрешения таларомикоза, рецидив грибковой инфекции, развитие воспалительного синдрома восстановления иммунной системы, частота нежелательных явлений.
Результаты
- Частота летальных исходов через 2 недели терапии составила 6,5% в группе амфотерицина и 7,4% в группе итраконазола (абсолютное различие, 0.9%; 95% CI, −3.9-5.6; P
- Терапия амфотерицином была ассоциирована с достоверно более быстрым клиническим разрешением грибковой инфекции и достоверно более низкой частотой рецидива и воспалительного синдрома восстановления иммунной системы.
- Обращало на себя внимание, что у пациентов, получавших амфотерицин, была выше частота побочных эффектов: реакций в месте инъекций, почечной недостаточности, гипокалиемии, гипомагниемии и анемии.
Заключение
Амфотерацин превосходит итраконазол по показателю 6-месячной смертности, клиническому ответу и частоте рецидива у пациентов с ВИЧ и Talaromyces marneffei.
Источник: Thuy Le, Nguyen Van Kinh, Ngo T.K. Cuc, et al. N Engl J Med 2017; 376:2329-2340.
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– Сейчас мы передаем слово профессору Юрию Павловичу Успенскому. Юрий Павлович расскажет о хеликобактер пилори и о грибах рода Candida, что их объединяет у гастроэнтерологического больного.
Юрий Павлович Успенский, профессор, доктор медицинских наук:
– Дорогие коллеги, мы с вами прекрасно знаем, что благодаря эпохальному открытию колоссальной роли пилорического хеликобактера в развитии хронического гастрита, язвенной болезни, рака желудка, уже к концу 90-х годов стало очевидным, что количество вновь выявленных случаев язвенной болезни уменьшается, что даже дало возможность гастроэнтерологам заявить о том, что XX век – это век уходящей язвенной болезни, а XXI – это век рождающейся гастроэзофагеальной рефлюксной болезни.
Однако, к сожалению, тенденции последнего времени оказались не столь оптимистичны и основные проблемы связаны все-таки с уменьшающейся эффективностью эрадикационной терапии. Причины этого лежат в плоскости возрастающей резистентности хеликобактер пилори к антибактериальным препаратам, которые входят в состав схем традиционной эрадикационной терапии.
Так один из патриархов, профессор Мегро (F.Megraud), отметил, что резистентность к кларитромицину, согласно молекулярно-генетическим методам, в Европе достигает 46%. Что же происходит при этом? При этом происходит драматическое снижение эффективности эрадикационной терапии, которая не превышает 18%. Что касается Российской Федерации, то диапазон вариаций резистентности к кларитромицину весьма широк. Почему-то в нашем северо-западном регионе наиболее высока резистентность к кларитромицину в Санкт-Петербурге. Причем это были абсолютно независимые исследования: педиатрический анклав профессора Корниенко Е.А., наши исследования доктора Барышниковой Н.В., исследования института Пастера. Причем были разные методы, и все они дали крайне высокие (более 30%) цифры резистентности к кларитромицину.
Коллеги, говоря о новых антибактериальных препаратах как варианте преодоления резистентности к антибиотикам, повышения эффективности эрадикационной терапии, хотелось бы сказать, что все-таки этот путь достаточно опасный, а может быть, даже и тупиковый, потому что тем самым мы способствуем воспитанию полирезистентных штаммов к антибиотикам хеликобактер пилори.
И на самом деле неконтролируемое потребление антибиотиков, это глобальная проблема человечества. Не столь давно, 18 ноября 2012 года, состоялся Европейский день осведомленности о проблеме резистентности и потребления антибиотиков, когда была предложена мировая стратегия борьбы с распространением резистентных форм микроорганизмов.
Непосредственное влияние препаратов висмута на хеликобактер пилори было продемонстрировано в виде целого ряда грамотно организованных исследований, и связаны были эти действия с блокированием адгезии хеликобактера с прямым ингибированием энзимов и уреазы этого микроорганизма.
Кроме того, в последние годы утвердилась концепция активно разрабатываемой школы профессора Кононова в Омске о том, что даже в случае успешно проведенной эрадикационной терапии формируется воспалительный инфильтрат (из-за продукции цитокинов, из-за продукции активных форм кислорода), и он сохраняется достаточно долго – от 1 до 12 месяцев. Поэтому и в этой связи включение препаратов висмута в комплекс эрадикационной терапии является оправданным с клинической точки зрения, потому что при этом происходит подавление ассоциированного воспаления из-за уменьшения продукции цитокинов, увеличения продукции цитопротективных простагландинов, и, соответственно, увеличение эпидермального фактора роста.
Какая же висмутсодержащая схема эрадикации является предпочтительной? Право на существование имеет и та схема, о которой мы сейчас говорили, когда висмут добавляется к стандартной терапии, и 10-дневная схема, о которой говорила Татьяна Львовна (висмут, метронидазол, тетрациклин и ингибитор протонного насоса). Все они обеспечивают достаточно высокий и эффективный уровень эрадикации.
А какая же связь между пилорическим хеликобактером и грибами рода Candida? Согласно нашим исследованиям, оказалось, что у одних и тех же больных экспрессируются гены, которые кодируют как факторы патогенности хеликобактер пилори, так и факторы адгезии и инвазии грибов рода Candida. А грибы рода Candida albicans действительно обладают факторами вирулентности, факторами адгезии, инвазии. Связь между концентрацией грибов рода Candida в толстой кишке и степенью обсемененности хеликобактер пилори антрального отдела желудка достаточно четко выражена и была продемонстрирована еще 10 лет назад в работах М.М. Захарченко.
Что происходит под влиянием антибактериальной терапии с грибами рода Candida? Их популяция неуклонно растет как следствие прямого стимулирующего действия (есть данные, что больные с кандидемией, то есть с кандидосепсисом, получали 4 и более антибиотиков), а также вследствие ингибирующего влияния на бактерии-антагонисты грибов рода Candida.
Что же такое грибы рода Candida? Посмотрите, вот эти данные показывают, что, оказывается, это транзиторные микроорганизмы, они обнаруживаются и в мороженом, и в других кисломолочных и молочных продуктах. То есть, на первый взгляд, нет ничего страшного в их присутствии, они транзитом проходят через организм человека. Но так происходит лишь тогда, когда иммунологическая реактивность макроорганизма достаточно высока. А если она низка, если это человек, страдающий иммунодефицитом, получающий гормональную терапию, если это ослабленный больной, тогда реален риск инвазии грибов рода Candida в слизистой оболочке, развития кандидоза пищевода, толстой кишки, транслокации микроба через кишечную стенку вплоть до развития кандидемии и кандидосепсиса.
В ряде случаев при пониженной иммунной резистентности макроорганизма инвазивный кандидоз не развивается, но возможно развитие неинвазивного кандидоза, когда увеличивается концентрация грибов рода Candida в просвете кишечника. Но и при этом ситуация далека от благополучной, потому что в этих условиях имеет место сенсибилизация, интоксикация организма, формирование вторичного иммунодефицита и присоединение микст-инфекции. Потому что грибы рода Candida обладают целым рядом ферментных, полисахаридных и иных факторов агрессии и патогенности.
Критерием диагностики неинвазивного кандидоза кишечника и повышенной пролиферации грибов рода Candida является снижение числа нормобиоты ниже 100 миллионов колониеобразующих единиц на грамм фекалий и рост грибов рода Candida ssp. при посеве кала выше 1000 колониеобразующих единиц на грамм фекалий.
Наличие тесной патогенетической взаимосвязи между грибами и хеликобактером подтверждает то, что в 98% образцов грибов рода Candida, выделенных из слизистой, детектируется хеликобактер пилори. И в большинстве образцов содержится ген острова патогенности cag A.
В другой работе показано, что также из грибов, выделенных из ротовой полости, идентифицируется присутствие генов хеликобактер пилори и почти в 100% случаев наблюдается гомологичность между генами грибов и генами контрольной популяции хеликобактера.
Согласно отечественной работе у детей с HP-ассоциированным гастродуоденитом с возрастом увеличивается число высокопатогенных штаммов микроорганизма хеликобактер пилори. Но при этом имеется сопряженность роста таких штаммов с увеличением гена sap2. Это ген, который кодирует синтез фактора вирулентности грибов рода Candida с 41,2% до 100% у детей, достигших 17-18 лет.
Таким образом, в последние годы сформировалась концепция, что дрожжеподобные микромицеты являются естественным биологическим резервуаром для грибов рода Candida. То есть что же при этом происходит? Татьяна Львовна уже говорила сегодня о стратегиях выживания пилорического хеликобактера. Но они не ограничиваются одной лишь уреазной активностью. Дело в том, что хеликобактер – это вообще весьма уязвимый организм, крайне чувствительный и к температурным условиям, и к пищевым, и желчным детергентам. Поэтому для своего выживания он способен пенетрировать капсулу и клеточную стенку гриба рода Candida, адгезировать плазменную мембрану гриба с образованием вакуоли и располагаться внутри этого организма, приобретая устойчивость к изменяющимся условиям среды, в том числе температурным, пищевым и желчным детергентам.
Вот и очень интересная работа, которая была выполнена 10 лет назад. Она показывает, что взаимоотношения между грибами и хеликобактером являются, по сути, эквипотенциальными. Их такая комбинация увеличивает и вирулентность грибов рода Candida. А проведенная эрадикационная терапия, даже в случае своей успешности, достоверно уменьшает частоту выявления хеликобактера в желудке, но увеличивает частоту выявления грибов рода Candida.
Что же делать в этой ситуации? По всей видимости, необходим поиск инновационных подходов к диагностике коррекции кандидозы такого рода пациентов. И сложность заключается в том, что среди традиционно принятого в гастроэнтерологии методов лечения, методы, направленные на предотвращение экспансии Candida spp., по сути, отсутствуют. Равно как и отсутствует антикандидозная активность у всех антибактериальных средств, входящих в состав классической эрадикационной терапии. А между тем такие пути необходимо искать, потому что грибы, как мы уже с вами говорили, способны помимо кишечника заселять другие анатомические и экологические ниши организма и в полной мере проявлять свои патогенные свойства.
К путям минимизации риска развития и прогрессирования кандидоза органов пищеварения при использовании эрадикационной терапии можно отнести исключение из эрадикационного комплекса антибиотика с потенциально высокой резистентностью к ним и включение в терапию первой линии препаратов висмута. Кроме того, у ряда пациентов требуется дополнительное назначение нерезорбцируемых антимикотических препаратов.
Пока же позвольте сделать заключение о том, что кандидоз органов пищеварения – это междисциплинарная проблема и для ее решения нужна интеграция усилий гастроэнтерологической и микологической службы. Высокое представительство грибов рода Candida в составе желудочно-кишечной микрофлоры связано с плотностью бактериального обсеменения и вирулентностью микроорганизма в хеликобактер пилори. Перспективным же путем повышения эффективности и безопасности эрадикационной терапии, а также элиминации грибов рода Candida и профилактики прогрессирования кандидоза органов пищеварения является дополнительное включение в схемы эрадикационной терапии тем контингентам пациентов, о которых мы с вами выше говорили, препаратов висмута и нерезорбцируемых антимикотиков.
Грибковая лимфаденопатия. Саркоидоз.
Грибковые поражения лимфатических узлов можно разделить на первичные и оппортунистические инфекции; последние развиваются у больных с иммунодефицитами.
Это деление отчасти условно, поскольку даже первичные или глубокие микозы требуют определенной степени угнетения иммунитета для развития системного инфекционного поражения. Грибковым инфекции могут вызывать различные изменения от гистиоцитоза до эпителиоидных гранулем с гнойным некрозом или без него. Точный диагноз основывается на идентификации грибов при специальном окрашивании или культивировании.
Лимфатические узлы могут поражаться при грибковых инфекциях вызываемых Cryptococcus neoformans (криптококкоз) Histoplasma capsulatum (гистоплазмоз) Cvccidioidei immitis (кокцидиодомикоз) и Blastomyces dermatitidis (бластомикоз).
При криптококкозе наиболее часто поражаются лимфатические узлы средостения; процесс развивается после перенесенных легочных инфекций. Степень гранулематозной реакции варьирует от минимальных клеточных проявлений до образования вполне зрелых гранулем, однако часто в большом количестве выявляются дрожжеподобные оргнизмы. Они рефрактильны, имеют различные размеры и светлое гало вокруг клеточной стенки.
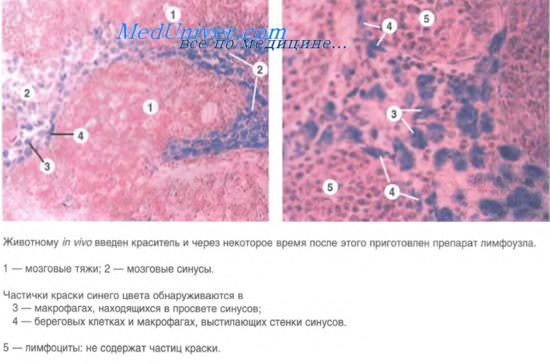
Это галя представляет собою капсул из мукополисахаридов, которая выявляется при ШИК-окрашивании или по методу Grocott.
Поражение лимфатических узлов при гистоплазмозе обычно развивается после легочной инфекции и характеризуется появлением патоморфологических признаков, похожих на туберкулезный процесс. Увеличенные лимфатические узлы содержат туберкулоидные гранулемы и часто подвергаются казеозному некрозу. Поля некроза обычно окружены зоной фиброзирования и могут обезыствляться. У больных с ВИЧ/СПИД и другими формами иммунолсфицита гистологические изменения протекают без образования гранулем.
Лимфатический узел замешается пластами гистиоцитов, содержащих многочисленные микроорганизмы. Инкапсулированные почкующиеся дрожжевые грибы лучше визуализируются при ШИК-окрашивании или по методу Grocott в зонах некроза, в гистиоцитах и гигантских клетках.
Клеточные ответы могут вызывать и другие патогенные грибы. В некоторых ситуациях в лимфатических узлах (особенно в узлах, собирающих лимфу от мест инфицирования) может развиваться неспепифическая реакция, выражающаяся в гиперплазии центров размножения и паракортикальной зоны без образования гранулемы. Несмотря на то что многие грибы видны в срезах, окрашенных гематоксилином-эозином, для их лучшей визуализации используется ШИК-окрашивание или метод Grocott. При подозрении на грибковый лимфаденит следует выполнять культурологическое исследование.
Саркоидоз
При саркоидозе гранулемы построены из групп эпителиоидных гистиоцитов с единичными гигантскими клетками, окруженных различным количеством Т-клеток.
Тенденция к слиянию гранулем менее характерна, чем при туберкулезе. Казеозный некроз в гранулемах не определяется, хотя могут выявляться небольшие поля центрального некроза. В многоядерных гигантских клетках могут определяться двоякопреломляющие округлые включении, известные как тельца Шауманна. В этих пластинчатых структурах могут обнаруживаться Са и Fe. Менее часто выявляются астероидные тельца — включения с многочисленными исходящими из центра изогнутыми отростками. Необычные сами по себе, эти включения, однако, не являются специфичными и могут быть выявлены при других реактивных состояниях. При прогрессировании заболевания гранулемы окружаются. а потом и замещаются соединительной тканью.
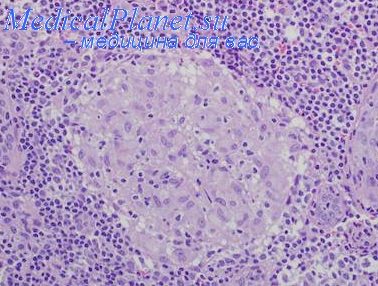
Патоморфология саркоидоза
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекции дрожжевых грибов - кандидоз: диагностика, лечение, профилактика
Грибы вызывают широкий спектр заболеваний — от кожных дерматофитных инфекций до тяжёлых заболеваний у пациентов со сниженным иммунитетом. Причиной микозов могут быть как дрожжевые, так и нитевидные формы грибов.
Грибы рода Candida, широко распространённые в окружающей среде, входят в состав условно-патогенной микрофлоры кожи, желудочно-кишечного тракта и женских половых органов. Их чрезмерное размножение, возникающее вследствие антибактериальной терапии, может привести к развитию инфекционных заболеваний.
Наиболее подвержены микозам пациенты с иммунодефицитами. Возбудитель большинства грибковых инфекций — С. albicans. Другие виды, такие как С. tropicalis, С. parapsilosis, С. glabrata и С. pseudotropicalis, представляют опасность для пациентов со сниженным иммунитетом, так как они устойчивы к действию большинства противогрибковых препаратов.
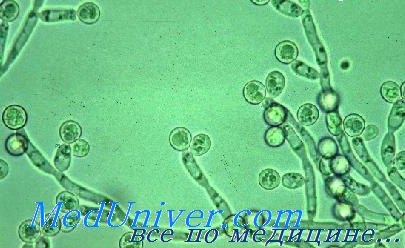
Грибы рода Candida - возбудители кандидоза
Патогенез инфекции дрожжевых грибов. Несмотря на то что грибы имеют факторы адгезии, экстрацеллюлярные липазы и протеазы, они обладают достаточно слабой инвазивностью. Инфекция обычно возникает при нарушении баланса нормальной микрофлоры (при применении антибиотиков) или снижении иммунитета.
Клинические признаки инфекции дрожжевых грибов. Кандидозы обычно сопровождаются болью, зудом и образованием творожистого налёта на поверхности слизистых оболочек, при удалении которого возникает кровоточивость. Часто возникает поражение кожи и ногтевых пластин. У пациентов со сниженным иммунитетом развивается тяжёлый фарингит и эзофагит, сопровождающийся дисфагией и снижением массы тела (часто наблюдают у больных СПИДом).
При нейтропении возникают системные микозы. Кроме того, на фоне применения антибиотиков широкого спектра действия в отделениях интенсивной терапии грибы рода Candida могут вызывать генерализованные и катетер-ассоциированные инфекции.
Лабораторная диагностика инфекции дрожжевых грибов. Поскольку грибы рода Candida — представители нормальной микрофлоры, их культивирование и выделение оправдано только на фоне уже сложившейся клинической картины. Они хорошо растут на обычных питательных средах. Методы диагностики — микроскопия, молекулярные методы исследований (у пациентов со сниженным иммунитетом), биохимические методы или секвенирование 18S рибосомальной РНК (для видовой идентификации).
Чувствительность инфекции дрожжевых грибов к препаратам. Большинство грибов чувствительны к амфотерицину В (за исключением С. lusitaniae). Кроме того, терапевтическим эффектом обладают производные имидазола (флуконазол) и 5-флуцитозин. При кандидемии рекомендовано назначение каспофунгина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

