Полиартрит при красной волчанке лечение
Обновлено: 26.04.2024
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
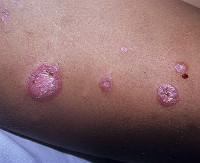
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
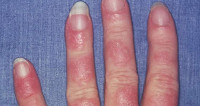
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.

Обзор
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
Автор
Редакторы


Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Лекарства, применяемые при ревматических болезнях
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.

Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).

Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.

Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.

Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
Блокаторы интерлейкиновых рецепторов
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].

Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.

Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].

Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).

Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Дискоидная красная волчанка – это хроническое воспалительное аутоиммунное заболевание кожи, развивающееся на фоне фотосенсибилизации (повышенной чувствительности к свету). Клинические проявления включают эритему, рубцовую атрофию кожи, фолликулярный гиперкератоз, выпадение волос, поражение ногтей. Диагноз ставится на основании симптоматики, анамнестических данных, наличия волчаночных клеток в крови, иммунологических тестов и гистологического исследования биоптата кожи. В качестве лечения применяются синтетические противомалярийные препараты, топические глюкокортикоиды, системные ретиноиды, солнцезащитные средства.
МКБ-10
Общие сведения
Дискоидная красная волчанка (ДКВ), или рубцующийся эритематоз – заболевание, относящееся к диффузным болезням соединительной ткани (коллагенозам). Данная патология является наиболее частой формой кожной красной волчанки. Средняя распространенность рубцующегося эритематоза составляет 1:100 000 человек. Чаще страдают представители европеоидной расы. Начало болезни приходится на молодой возраст (от 20 до 40 лет). Заболеваемости дискоидной волчанкой больше подвержены лица женского пола (соотношение с мужчинами 3:1). В редких случаях (1-5%) ДКВ может перейти в системную красную волчанку (СКВ).

Причины ДКВ
Эритематоз протекает по типу аутоиммунной реакции, точная причина возникновения которой неизвестна. Важное значение в развитии заболевания имеет наследственная предрасположенность, о чем свидетельствует большая встречаемость дискоидной волчанки среди близких родственников. В ходе исследований была установлена ассоциация ДКВ с антигенами тканевой совместимости HLA A1, A3, A10, A11, A18, B7, B8. Наиболее серьезным провоцирующим действием обладает ультрафиолетовое излучение.
К факторам, способствующим возникновению дискоидной волчанки, относятся постоянная травматизация кожи, хронические инфекции в организме, наличие аллергических болезней, прием лекарственных препаратов, повышающих чувствительность кожи к ультрафиолету (сульфаниламидов, тетрациклина, фторхинолонов, гризеофульвина, нейролептиков). В группе повышенного риска находятся люди, чей род деятельности связан с длительным пребыванием на открытом воздухе (работники сельскохозяйственной промышленности, строители, рыбаки). Также в группу риска входят лица с 1 фототипом кожи (кельтским) – это люди с нежной, тонкой, иногда веснушчатой кожей, имеющие светлый или рыжий цвет волос.
Патогенез
При дискоидной красной волчанке наблюдается патогенетическое сходство с СКВ, однако патологические реакции ограничиваются кожными покровами. В основе заболевания лежит аутоиммунное воспаление. Под действием ультрафиолетовых лучей в совокупности с другими провоцирующими факторами в клетках кожи нарушаются процессы метилирования ДНК (механизма регуляции транскрипции генов). Это приводит к повышению экспрессии белков, индуцирующих апоптоз (запрограммированную клеточную гибель) - p53, Fas и Fas-лиганда и гамма-интерферона.
Т- и В-лимфоциты стимулируют синтез цитокинов и антител к компонентам клеточных ядер (нуклеиновым кислотам, нуклеосомам). Образующиеся иммунные комплексы оседают на эндотелии сосудов, вызывая их повреждение. Выработку аутоантител у генетически предрасположенных лиц также способны вызывать антигены некоторых вирусов (Эпштейна-Барр, цитомегаловирус, парвовирус 19), имеющие сходную молекулярную структуру с белками клеточных мембран. Дополнительным повреждающим агентом выступает индукция свободнорадикального окисления липидов. Результатом этих процессов является массивное воспаление и разрушение клеток кожи.
Классификация
Традиционно дискоидную красную волчанку подразделяют на очаговую и диссеминированную (распространенную) – эти формы различаются количеством очагов поражения кожи и их локализацией. Также при диссеминированной форме отмечается наличие общей симптоматики (слабости, повышения температуры тела, болей в суставах) и высокого риска трансформации в СКВ. Помимо перечисленных форм, в ревматологии выделяют следующие виды ДКВ:
Симптомы ДКВ
Дискоидная красная волчанка характеризуется хроническим течением, рецидивы возникают в основном летом или весной, когда длина солнечного дня максимальна. Чаще всего поражаются участки тела, подвергающиеся длительному солнечному излучению. Тремя наиболее типичными симптомами считаются эритема, фолликулярный гиперкератоз и рубцовая атрофия кожи.
При локализации очагов на волосистой части головы практически всегда возникает алопеция, которая оставляет после себя рубцы. При диссеминированной дискоидной волчанке очаги располагаются на груди, спине, локтях, ладонях, подошвах, обычно не имеют признаков шелушения и атрофии. Иногда поражаются ногтевые пластины. Ногти приобретают желтый цвет, становятся ломкими, деформируются. Очень редко в патологический процесс вовлекается слизистая оболочка полости рта. Очаги склонны к эрозированию, что вызывает жжение и боли во время приема пищи.
Осложнения
Серьезные осложнения дискоидной красной волчанки возникают редко. Иногда развивается вторичный гландулярный хейлит (воспаление мелких слюнных желез красной каймы губ). Диссеминированная форма ДКВ в некоторых случаях переходит в СКВ – тяжелое системное заболевание соединительной ткани, поражающее суставы и практически все внутренние органы (сердце, почки, легкие и центральную нервную систему). СКВ характеризуется упорным течением, трудно поддается терапии и имеет высокий риск летального исхода. Также может произойти трансформации стойких очагов дискоидной волчанки в плоскоклеточный рак кожи (сквамозно-клеточную карциному).
Диагностика
Пациентов с данной патологией курируют врачи ревматологи и дерматологи. При постановке диагноза дискоидной волчанки учитывается фототип кожи. На первичной консультации уточняется профессия пациента, прием фотосенсибилизирующих лекарственных средств, наличие инфекционных или аллергических заболеваний, близких родственников с ДКВ. Для диагностики проводят следующие методы исследования:
- Общие лабораторные тесты. В клиническом анализе крови отмечается увеличение скорости оседания эритроцитов, снижение уровня лейкоцитов, тромбоцитов, при инфекционных и аллергических патологиях - высокий уровень нейтрофилов и эозинофилов. При диссеминированной ДКВ возможен ложноположительный результат анализа на сифилис.
- Специальные ревматологические тесты. Примерно у 40% пациентов ДКВ обнаруживаются антинуклеарные антитела (ANA) и антитела к нуклеопротеинам (анти-Ro/SS-A, анти-La/SS-B). Волчаночные (LE) клетки встречаются у 5-7% пациентов. При реакции иммунной флюоресценции выявляются отложения иммуноглобулинов (IgG/IgM) и комплемента (положительный тест волчаночной полоски). Последний тест может быть положительным и при других заболеваниях, поэтому не является специфичным.
- Гистологическое исследование биоптата кожи. Биопсия кожи - наиболее достоверный метод для постановки диагноза. Характерны следующие признаки – атрофия эпидермиса, утолщение рогового слоя эпидермиса в устьях волосяных фолликулов, разрушение волокон коллагена, отек дермы, отложения в ней гиалина, периваскулярный лимфоцитарный инфильтрат.
Важно отличать диссеминированную форму ДКВ от системной красной волчанки, требующей более агрессивной терапии. Помощь в диагностике СКВ оказывает определение антител к двуспиральной ДНК и экстрагируемым ядерным ангигенам в крови пациента. Также дискоидную красную волчанку дифференцируют с другими формами кожной волчанки (острая, подострая), ревматологическими (дерматомиозит), дерматологическими заболеваниями (красный плоский лишай, псориаз, себорейный дерматит, экзема, фотодерматозы, эозинофильная гранулема лица, ангиолюпоид Брока-Потрие).
Лечение ДКВ
В большинстве случаев пациенты проходят лечение амбулаторно, но при тяжелом течении может потребоваться госпитализация в отделение ревматологии или дерматологии. Важным моментом является исключение приема фотосенсибилизирующих медикаментов и лечение сопутствующих аллергических или инфекционных заболеваний. Рекомендуется носить закрытую одежду, применять солнцезащитные крема или мази, содержащие вещества, которые задерживают ультрафиолетовые лучи (мексорил, двуокись титана, оксид цинка).
Основное патогенетическое лечение включает антималярийные аминохинолиновые препараты (Гидроксихлорохин), топические глюкокортикостероиды (тГКС), производные витамина А - ретиноиды (Изотретиноин, Ацитретин). Ввиду частого развития ретинопатий на фоне приема гидроксихлорохина обязателен регулярный осмотр офтальмолога. В зависимости от локализации дискоидных очагов применяются тГКС разной активности. При расположении очагов только на коже лица используют тГКС слабой и средней степени активности (Гидрокортизона ацетат, Метилпреднизолон), при поражении кожи конечностей и туловища рекомендуются тГКС сильной активности (Бетаметазон, Триамцинолон). Если дискоидные очаги имеются на ладонях и подошвах, назначаются тГКС сверхвысокой активности (Клобетазон).
Для подавления свободнорадикального повреждения клеток кожи эффективны антиоксиданты (альфа-токоферол). При неэффективности стандартного лечения прибегают к средствам, обладающим выраженным иммуносупрессивным действием – Такролимус, Метотрексат, Азатиоприн.
Прогноз и профилактика
В подавляющем большинстве случаев дискоидная волчанка имеет благоприятное течение. При грамотном подборе терапии и соблюдении всех рекомендаций наступает стойкая ремиссия. Основную проблему представляет трансформация ДКВ в более тяжелые заболевания, имеющие достаточно высокий процент летальности – СКВ и плоскоклеточную карциному. Профилактика рецидивов дискоидной волчанки заключается в ограничении времени пребывания на солнце, ношении закрытой одежды, применении солнцезащитных препаратов, исключении приема лекарств, повышающих чувствительность кожных покровов к ультрафиолетовому излучению.
1. Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем. 2016.
3. Федеральные клинические рекомендации по ведению больных с поражениями кожи при красной волчанке/ Самцов А.В., Чикин В.В. - 2015.
Лекарственная волчанка – обратимый волчаночноподобный синдром, вызванный приемом лекарственных препаратов. Клинические проявления лекарственной волчанки сходны с СКВ и включают лихорадку, артралгии, миалгии, полиартрит, плеврит, пневмонит, гепатомегалию, гломерулонефрит. Диагноз основывается на характерных лабораторных критериях (определении в крови антинуклеарного фактора, антинуклеарных антител, LE-клеток) и связи симптоматики с приемом определенных лекарственных медикаментов. Обычно проявления лекарственной волчанки исчезают после отмены причинно значимого препарата; в тяжелых случаях назначаются кортикостероидные препараты.
Общие сведения
Лекарственная волчанка (лекарственный волчаночный синдром) – симптомокомплекс, обусловленный побочным действием лекарственных средств и регрессирующий после их отмены. Лекарственная волчанка по своим клиническим проявлениям и иммунобиологическим механизмам сходна с системной красной волчанкой. В ревматологии лекарственная волчанка диагностируется примерно в 10 раз реже, чем идиопатическая СКВ. В большинстве случаев лекарственно-индуцированный волчаночноподобный синдром развивается у пациентов в возрасте старше 50 лет, практически с одинаковой частотой у мужчин и женщин.

Причины лекарственной волчанки
Развитие лекарственной волчанки может провоцироваться длительным применением или высокими дозировками большого круга лекарственных препаратов. К медикаментам с известным побочным эффектом относятся антигипертензивные (метилдопа, гидралазин, атенолол), противоаритмические (новокаинамид), противотуберкулезные (изониазид), противосудорожные средства (гидантоин, фенитоин), сульфаниламиды и антибиотики (пенициллин, тетрациклин), нейролептики (хлорпромазин), соли лития, золота и другие препараты. Чаще всего лекарственная волчанка возникает у пациентов, страдающих артериальной гипертензией, аритмией, туберкулезом, эпилепсией, ревматоидным артритом, инфекционными заболеваниями и принимающих перечисленные препараты. Возможно развитие волчаночноподобного синдрома у женщин, длительно применяющих оральные контрацептивы.
Патогенез лекарственной волчанки связывается со способностью названных лекарственных препаратов вызывать в организме образование антинуклеарных антител (АНА). Большую роль в предрасположенности к патологии играет генетическая детерминация, а именно – ацетилирующий фенотип пациента. Медленное ацетилирование данных препаратов ферментами печени сопровождается выработкой более высоких титров AHA и более частым развитием лекарственной волчанки. Вместе с тем, у больных с волчаночным синдромом, индуцированным новокаинамидом или гидралазином, выявляется медленный тип ацетилирования.
В целом вероятность развития лекарственной волчанки зависит от дозы препарата и длительности фармакотерапии. При продолжительном приеме лекарственного средства у 10-30% пациентов, имеющих в сыворотке крови антинуклеарные антитела, развивается волчаночноподобный синдром.
Симптомы лекарственной волчанки
В клинике лекарственной волчанки преобладают общие проявления, суставной и кардио-пульмональный синдромы. Заболевание может манифестировать остро или постепенно с таких неспецифических симптомов, как недомогание, миалгия, лихорадка, незначительная потеря массы тела. 80% пациентов беспокоят артралгии, реже – полиартриты. У пациентов, принимающих противоаритмические средства (прокаинамид) наблюдаются серозиты (экссудативный плеврит, перикардит), тампонада сердца, пневмонит, асептические инфильтраты в легких. В ряде случаев возможно развитие лимфаденопатии, гепатомегалии, появление эритематозных высыпаний на коже.
В отличие от идиопатической системной красной волчанки, при лекарственно индуцированном синдроме редко встречаются бабочковидная эритема на щеках, язвенный стоматит, синдром Рейно, алопеция, нефротический синдром, неврологические и психические расстройства (судорожный синдром, психозы). Вместе с тем, для лекарственной волчанки, вызванной приемом апрессина, характерно развитие гломерулонефрита.
Диагностика лекарственной волчанки
От момента появления первых клинических симптомов лекарственной волчанки до постановки диагноза нередко проходит от нескольких месяцев до нескольких лет. В течение этого времени пациенты могут безрезультатно обследоваться у пульмонолога, кардиолога, ревматолога по поводу отдельных проявлений синдрома. Правильная постановка диагноза возможна при всесторонней оценке клинической симптоматики, сопоставлении признаков болезни с приемом определенных лекарственных средств, проведении иммунологических тестов.
Наиболее специфичными лабораторными критериями, указывающими на лекарственную волчанку, служит наличие в крови антинуклеарных антител (антител к гистонам), антинуклеарного фактора, антител к односпиральной ДНК, LE-клеток, снижение уровня комплемента. Менее специфичны для волчаночного синдрома, но высокоспецифичными для СКВ, являются антитела к ds ДНК, анти-Ro/SS-A, Ат к Sm-антигену, анти-La/SS-B. Дифференциальную диагностику лекарственной волчанки необходимо осуществлять с идиопатической СКВ, злокачественными опухолями легких и средостения.
Лечение лекарственной волчанки
Отмена лекарственного препарата, вызвавшего лекарственную волчанку, приводит к постепенному регрессу клинико-лабораторных признаков синдрома. Исчезновение клинической симптоматики обычно происходит в течение нескольких дней или недель после прекращения приема лекарственного средства. Антинуклеарные антитела исчезают медленнее - в течение нескольких месяцев (иногда до 1 года и дольше). С целью купирования суставного синдрома возможно назначение нестероидных противовоспалительных средств. При тяжелом течении лекарственной волчанки, длительной персистенции клинических симптомов обосновано назначение глюкокортикоидов.
Во избежание развития лекарственной волчанки не следует самопроизвольно и бесконтрольно принимать медикаменты; назначение фармакологических средств должно быть обоснованным и согласованным с лечащим врачом. Для предотвращения рецидива волчаночного синдрома необходима адекватная замена причинно значимого препарата альтернативным лекарственным средством.
Читайте также:

