При лепроматозном типе лепры развиваются
Обновлено: 05.05.2024
Лепроматозный тип лепры. Проявления и признаки лепры
Лепроматозный тип лепры (LL) — наиболее тяжелая форма болезни, которая в отсутствии лечения приводит к необратимой инвалидизации и нередко к гибели больных, наблюдается у 2% больных с манифестным течением инфекции М. leprae. Болезнь проявляется поражением кожи в виде пятен (более 5 очагов), инфильтратов и узлов (лепром) с последующим их изъязвлением, ранним вовлечением в процесс слизистых оболочек, внутренних органов и костей, поздним возникновением неврологических расстройств. Наблюдается преимущественно у мужчин, достигших половой зрелости.
В слизистой оболочке носа и скарификатах кожи в зонах поражения закономерно обнаруживается большое количество М. leprae (MB), лепроминовый тест отрицательный. Больные лепроматозной лепрой — наиболее активные источники инфекции.
В начальном периоде болезни на коже лица, туловища, ягодиц и разгибательной поверхности конечностей (за исключением волосистой части головы, подмышечных и подколенных ямок и области локтевых суставов, которые поражаются крайне редко при генерализованной форме болезни) появляются множественные блестящие пятна различного размера с нечеткими, размытыми краями, как бы сливающимися со здоровой кожей. Пятна могут быть гипопигментированными у лиц с темной кожей или эритема-тозными и гиперпигментированными у светлокожих пациентов (рис. 46,Г). Характерна симметричность и множественность очагов поражения и длительное сохранение в них чувствительности кожи и пушковых волос.
По мере прогрессирования болезни у нелеченных лиц спустя несколько месяцев или лет на месте пятен образуются лепрозные инфильтраты в виде бляшек без четких границ с повышеным салообразованием, придающие коже вид лимонной или апельсиновой корки. На фоне инфильтратов могут образовываться лепромы в виде бугров и узлов.
В дальнейшем, спустя 3-5 лет и более, в зоне поражения отмечается выпадение волос — ресниц и бровей, особенно с их наружной стороны, усов и бороды, а также пушковых в участках инфильтрации кожи. В случаях локализации процесса на лице прогрессирующие инфильтраты и лепромы в области надбровных дуг, подбородка, ушных раковин, придающие лицу характерный вид facies leonma. У нелеченных больных лепромы изъязвляются с последующим образованием рубцов, нередко келоидных.
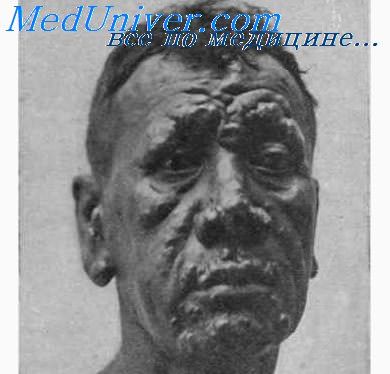
Закономерно поражение слизистой оболочки носа с перфорацией носовой перегородки, деформацией хрящей носа. Процесс может распространиться на мягкое небо, спинку языка, красную кайму губ и гортань, что приводит к осиплости голоса. В соскобе со слизистой оболочки носа обнаруживается большое количество М. leprae, определяющее контагиозность таких больных.
Характерно развитие лимфаденита паховых, подмышечных и других лимфатических узлов. У большей части больных наблюдаются орхит и орхоэпидидимит с последующим нарушением функции яичек, гинекомастией, инфантилизмом, у женщин может нарушаться менструальный цикл.
У нелеченных пациентов закономерно (более 80% случаев ZZ-лепры) возникают иридоциклит, кератит, склерит, приводящие к слепоте, конъюнктивит со скудным отделяемым, лепрозная инфильтрация век с выпадением ресниц.
В результате образовании лепром в костях наблюдаются патологические переломы костей, вывихи. Висцеральные поражения характеризуются хроническим гранулематозным гепатитом, спленомегалией, нарушением функции надпочечников, интерстициальным гломерулонефритом и пиелонефритом, инфильтратами в легких. Указанные явления могут регрессировать на фоне терапии.
Наряду с указанными различают атипичные формы лепроматозной лепры: гистоидную, лепру Lucio (лепра Lucio-Alvarado или диффузная лепра Lucio-Latapi), сливную, пятнистую, стертые и др.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В статье отражены современные представления о лепре, представлены современные данные литературы, посвященные вопросам эпидемиологии заболевания, особенностям клинической картины, диагностики, дифференциальной диагностики и лечения дерматоза.
The article summarizes information about the disease leprosy. Data of the literature on epidemiology of the disease, the features of the clinical picture, diagnosis, differential diagnosis and treatment of the dermatosis are presented.
Лепра (проказа, болезнь Хансена) — хроническое инфекционное заболевание из группы микобактериозов, характеризующееся продолжительным инкубационным периодом и рецидивирующим течением. Заболевание носит системный характер и поражает производные эктодермы — кожные покровы, слизистые оболочки и периферическую нервную систему. В настоящее время, несмотря на применение эффективной схемы антибиотикотерапии и устранение угрозы эпидемии лепры, по всему миру продолжают ежегодно выявляться новые случаи заболевания, поэтому перспектива полной ликвидации болезни ставится под сомнение [1–3].
Распространенность лепры в мире стабильно снижается из года в год. Согласно данным ВОЗ, количество новых случаев, каждый год выявляемых во всем мире, уменьшилось с 763 000 в 2001 г. до 249 000 в 2008 г. [1]. В 2013 г. было выявлено 215 656 новых случаев заболевания, в 2014 г. — 213 899, в 2015 г. — 211 973 [2, 3].
Глобальная статистика свидетельствует о том, что 96% (203 600 человек) новых случаев заражения лепрой были выявлены в 22 государствах (таких как Индия, Бразилия, Ангола, Конго, Судан, Эфиопия и др.). На долю других стран приходятся оставшиеся 4% [3].
Одной из шести стран мира с наиболее высокой распространенностью лепры является Бразилия, где ежегодно диагностируется более 30 000 новых случаев заболевания. В 2014 г. распространенность лепры в Бразилии составила 1,27 случая на 10 000 жителей. Уровень распространенности дерматоза по стране неравномерен: помимо эндемичных по лепре регионов существуют и такие, в которых отмечается низкий уровень распространенности лепры [4].
В России эндемичным регионом по лепре является Астраханская область. За последние десятилетия больные лепрой были выявлены и в других субъектах Российской Федерации: в Сибири, на Северном Кавказе и Дальнем Востоке [9, 10]. Однако стоит отметить, что, благодаря внедрению в практику целого комплекса противолепрозных мероприятий, заболеваемость лепрой в России носит устойчивый спорадический характер. В 2015 г. на учете состояло 240 больных, из них в Астраханской области — 135 [10].
Возбудителями лепры являются Mycobacterium leprae (M. leprae) и Mycobacterium lepromatosis (M. lepromatosis). M. leprae была впервые открыта норвежским врачом Герхардом Хансеном в 1873 г. [11]. Данный микроорганизм относится к семейству Mycobacteriaceae и является кислото- и спиртоустойчивой бактерией, которая представляет из себя грамположительную прямую или изогнутую палочку длиной 1–7 мкм и диаметром 0,2–0,5 мкм [12]. M. leprae может длительное время сохранять жизнеспособность при низких температурах и высушивании. Данному микроорганизму свойственен крайне медленный рост, который зачастую не характерен для бактерий (одно деление продолжается приблизительно 12 суток) [12]. Возбудитель заболевания является облигатным внутриклеточным паразитом. M. leprae способна продолжительно персистировать в макрофагах человека, что обеспечивается взаимодействием различных механизмов (антигенная изменчивость и пр.). Именно поэтому пациенты, выписанные из лепрозориев на амбулаторное лечение с персистирующими формами лепры, могут быть источником заражения [9].
В 2008 г. был открыт второй возбудитель лепры — M. lepromatosis, который, в отличие от M. leprae, является некислотоустойчивой бактерией и вызывает преимущественно тяжелый диффузный лепроматозный тип лепры [13, 14].
От других инфекционных заболеваний лепру отличает длительный инкубационный период, который варьирует от 2–3 месяцев до 50 лет (в среднем составляя 4–6 лет) [11].
Общепризнан воздушно-капельный путь передачи инфекционных агентов, однако не исключаются другие пути заражения — через укусы кровососущих насекомых и поврежденные кожные покровы. Лепра является малоконтагиозным заболеванием. Заражение микобактериями лепры происходит в результате длительного тесного общения с больным, не получающим лечения, вследствие сенсибилизации, нарастающей при повторяющихся контактах, снижения сопротивляемости организма (в результате неполноценного питания, тяжелых физических нагрузок, частых простудных заболеваний, алкоголизма и других интоксикаций) и иммуногенетической восприимчивости [11].
На восприимчивость к лепре оказывают влияние различные наборы генов, в том числе системы антигена лейкоцитов человека (HLA). В настоящее время изучаются изменения в генах-кандидатах, участвующих в ответной реакции организма хозяина на инфекционный агент. Исследования геномного сканирования выявили связывающие пики для лепры в областях хромосом 6p21, 17q22, 20p13 и 10p13 [15, 17].
Устойчивость к заражению M. leprae обеспечивается, с одной стороны, низкой вирулентностью M. leprae, с другой — индивидуальными особенностями врожденного иммунитета. Важную роль в поддержании врожденного иммунитета играет целостность эпителия, секрет желез и поверхностный иммуноглобулин A (IgA). Кроме того, уничтожать микобактерии, независимо от активации адаптивного иммунитета, могут NK-клетки, цитотоксические Т-лимфоциты и активированные макрофаги. При заражении регулирование воспалительных цитокинов и хемокинов приводит к пролиферации либо Т-хелперов 1-го типа (Th1), либо Т-хелперов 2-го (Th2) типа, что способствует активации клеточного или гуморального звена иммунитета, что определяет клиническую форму заболевания [16, 17].
Клеточный иммунитет неэффективен в отношении предотвращения развития заболевания у лиц с туберкулоидной формой лепры. Гуморальный иммунитет у лиц с лепроматозной формой заболевания, ответственный за продуцирование IgM против PGL-1 (фенольный гликолипид-1), не обеспечивает защиту и не предотвращает диссеминацию бактерий [17].
Высокий уровень ФНО-α в сыворотке крови у пациентов с туберкулоидной формой лепры свидетельствует об участии данного цитокина в деструкции M. leprae и образовании гранулемы. ФНО-α участвует в иммунной защите посредством активации макрофагов, однако гиперпродукция ФНО-α и его взаимодействие с ИФН-γ способствуют повреждению тканей и формированию узловатой лепрозной эритемы (ENL) [17].
При лепроматозной форме лепры наблюдается повышенный уровень трансформирующего фактора роста бета (ТФР-β), отсутствующего при туберкулоидной форме и проявляющегося в небольшом количестве при пограничной форме лепры. ТФР-β подавляет активацию макрофагов, что ингибирует продуцирование ФНО-α и ИФН-γ, способствуя персистенции инфекции [17].
О механизмах трансмиссии лепры известно, что микобактерии проникают в клетки эндотелия и оседают в Шванновских клетках нервов кожи, к которым имеют тропизм, где в дальнейшем происходит долговременный период их адаптации и размножения. Остается неизвестным, как колонизация Шванновских клеток микобактериями лепры приводит к распространению инфекции в другие ткани [18]. Нейронный тропизм M. leprae обусловлен его связыванием с областью G на мостике молекулы ламинина альфа-2, а альфа-дистрогликан служит рецептором для M. leprae на Шванновских клетках [18].
В работе Masaki и соавт. (2013), в исследовании in vitro и in vivo с использованием мышей, определялось взаимодействие M. leprae со Шванновскими клетками. Исследование показало, что M. leprae изменяют дифференцировку Шванновских клеток до клеток-предшественников [19]. Клеточная перестройка приводит к снижению регуляции Шванновской клеточной линии Sox10 [19]. Таким образом, M. leprae способствуют распространению инфекционного процесса через два механизма: прямая дифференцировка Шванновских клеток в мезенхимальные ткани и образование гранулемаподобных структур, которые выделяют бактерионесущие макрофаги [19]. Исследование расширяет понимание о пластичности зрелых клеток и демонстрирует свойства M. leprae, приводящих к перестройке взрослых клеток в стволовые [18]. Распространение инфекции путем дифференцировки Шванновских клеток возможно при их инфицировании большим количеством M. leprae. Методология, используемая на мышах, у которых нет Т-клеток, упрощает воспалительное микроокружение в преимущественно макрофаги [19]. Данная работа описывает перспективную in vitro модель для объяснения патогенеза M. leprae, но необходимы подробные исследования, прежде чем экстраполировать выводы на течение инфекционного процесса в организме человека [18].
Существует две классификации лепры: мадридская классификация, принятая в 1953 г., а также ее последующая модификация, предложенная Д. С. Ридли и В. Джоплингом в 1973 г. [11].
Согласно мадридской классификации выделяют два полярных типа лепры: туберкулоидный и лепроматозный и два промежуточных типа: недифференцированный и пограничный (диморфный) [11].
В классификации Ридли–Джоплинга выделяют три типа лепры — недифференцированный (I — Indeterminate), туберкулоидный (Tuberculoidtype — TT) и лепроматозный (Lepromatoustype — LL). Лепроматозный и туберкулоидный типы являются полярными. Кроме того, различают субполярные и пограничные группы заболевания. Классификация Ридли–Джоплинга не нашла широкого применения ввиду сложности, поэтому в практической деятельности различают лепроматозный и туберкулоидный тип лепры, а также пограничный тип, который в дальнейшем может трансформироваться в одну из первых двух форм [20].
При лепроматозном типе лепры поражается как периферическая, так и центральная нервная система с развитием невротических расстройств, реже — психозов и поражений по типу невритов и полиневритов. В большинстве случаев поражаются лучевые, малоберцовые и большие ушные нервы: они утолщаются и становятся доступными для пальпации. В последующем развиваются двигательные и трофические расстройства, а также нарушения чувствительности. Больным свойственны невралгии, гиперестезии, парестезии, неадекватное или замедленное реагирование на раздражение, аналгезия. На фоне трофических нарушений развивается процесс мутиляции кистей и стоп. Поражение внутренних органов характеризуется неспецифическими изменениями в печени, легких, селезенке и нарушением функции некоторых желез внутренней секреции [11].
При недифференцированной форме лепры специфические высыпания отсутствуют. Для данной формы характерно появление небольшого количества бледных пятен различной величины с нечеткими границами, а также поражение периферической нервной системы по типу полиневрита. Как правило, выявить возбудителя у этой категории лиц удается крайне редко [11].
При развитии обострений лепрозного процесса форма заболевания может меняться. Несмотря на множество клинических проявлений лепры, окончательная постановка диагноза не всегда является простой задачей, так как отсутствуют патогномоничные клинические признаки заболевания [25].
При диагностике лепры учитывают данные эпидемиологического анамнеза (пребывание в эндемичном регионе, контакты с больными лепрой), объективного осмотра (обращают внимание на характер и длительность существования высыпаний, наличие признаков нарушений периферической иннервации).
Общепринятым лабораторным методом диагностики лепры считается бактериоскопическое исследование. Соскобы для исследования берут с очагов поражения на коже и слизистой оболочке носа путем легкого поскабливания. Мазок помещают на предметное стекло и окрашивают по Цилю–Нильсену. Также исследуют пунктат из бедренных или паховых лимфатических узлов. Однако бактериоскопическое исследование имеет очень низкую чувствительность, особенно у больных с промежуточной или туберкулоидной формой поражения [26].
Лепроминовая реакция (проба Митсуды) является показателем способности хозяина поддерживать в своем организме клеточный иммунитет к M. leprae. Проба Митсуды не всегда является достоверной, так как у 10% здоровых по лепре людей может наблюдаться отрицательная реакция. Ограничивают применение лепроминового теста и технические трудности, связанные с получением лепромина и его внутрикожным введением [11].
Наиболее чувствительным методом диагностики, позволяющим определять M. leprae, является полимеразная цепная реакция (ПЦР). ПЦР на данный момент считается наиболее перспективной из прямых диагностических методик и применяется для диагностики любого типа лепры [10, 18]. Преимуществом ПЦР являются неинвазивность и простота получения клинического материала, что предоставляет возможность проведения скрининга большого количества образцов при обследовании пациентов в высокоэндемичных по этому заболеванию регионах. Применение ПЦР позволяет усовершенствовать диагностику лепры и выявлять заболевание на ранней стадии [26].
Используемые в настоящее время традиционные методы диагностики, такие как лепроминовая проба и бактериоскопическое исследование, не всегда позволяют подтвердить диагноз лепры на ранних стадиях заболевания. При этом эффективность лечебных и профилактических мероприятий определяется возможностью ранней диагностики заболевания. В мире постоянно регистрируются новые случаи лепры, поэтому актуальным вопросом остается разработка и внедрение новых, более точных, методов диагностики, которые стали бы доступными для широкого использования и позволили с высокой степенью достоверности диагностировать лепру на ранних стадиях развития заболевания.
Лечение заболевания стандартизовано ВОЗ в 1981 г. [28]. Комбинированная лекарственная терапия включает в себя использование трех основных препаратов: дапсон, рифампицин и клофазимин [28].
Дапсон — бактериостатический препарат, действующий как конкурентный ингибитор ферментов дигидрофолатсинтетазы и дигидрофолатредуктазы, которые являются ключевыми ферментами путей биосинтеза фолатов в микобактериях лепры [28].
Рифампицин — оказывает в отношении M. leprae бактерицидное действие. Является селективным ингибитором ДНК-зависимой РНК-полимеразы и блокирует синтез РНК [29].
Клофазимин — жирорастворимый кристаллический краситель красноватого цвета с бактериостатическим и противовоспалительным свойствами. Механизм антибактериального действия клофазимина изучен недостаточно. Вероятно, он связан с блокировкой матричной функции ДНК, повышением фагоцитарной активности макрофагов и синтеза лизосомальных ферментов [28]. Клофазимин и рифампицин обладают эффективностью в отношении дапсонрезистентных микроорганизмов.
В 1997 г. ВОЗ была установлена продолжительность курса лечения: 6 месяцев для мультибациллярных форм лепры и 12 месяцев для олигобациллярных. Дапсон назначается в дозировке 100 мг для взрослых один раз в день, рифампицин в дозировке 600 мг один раз в месяц, клофазимин в дозировке 300 мг один раз в месяц. Для лечения детей применяются более низкие дозы препаратов [28]. В случае невозможности применения одного или двух препаратов из вышеперечисленных существуют схемы лечения с применением фторхинолонов, которые также показали свою эффективность в отношении M. leprae [30].
Своевременная диагностика лепры, профилактика распространения лепры беженцами и вынужденными переселенцами, особенно из высокоэндемичных государств (Бангладеш, Филиппинские острова, Индия, Ангола, Бразилия, Шри-Ланка и др.), являются серьезной и актуальной проблемой для мирового здравоохранения, одной из приоритетных задач при осуществлении контроля над здоровьем иностранных граждан и лиц без гражданства, въезжающих на территорию страны. В Российской Федерации, в соответствии с существующим порядком, установленным на законодательном уровне, для контроля над распространением заболеваний среди населения, нерезидентам Российской Федерации необходимо пройти медицинское освидетельствование в медицинских организациях. Однако данная процедура освидетельствования осложнена отсутствием комплексной методологической платформы.
Таким образом, несмотря на снижение распространенности лепры, представляется актуальным усиление контроля за обязательным обследованием на лепру прибывающих в страну иностранных граждан, разработка отечественных аналогов лекарственных препаратов и поиск новых схем лечения больных лепрой.
Литература
А. А. Кубанов*, доктор медицинских наук, профессор, член-корреспондент РАН
Т. В. Абрамова**, кандидат медицинских наук
Е. К. Мураховская* , 1 , кандидат медицинских наук
В. А. Ласачко*
* ФГБОУ ДПО РМАНПО МЗ РФ, Москва
** ФГБУ ГНЦДК МЗ РФ, Москва

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Лепра диагностируется только при наличии клинических признаков болезни. Как указывалось выше, клиническая симптоматика поражения органа зрения у больных лепрой обнаруживается лишь спустя много лет после начала заболевания. Следовательно, основой для установления лепрозной этиологии заболевания глаз служат прежде всего клинические проявления болезни, выражающиеся главным образом в многообразных дерматологических и неврологических симптомах и характеризующиеся хроническим течением с периодическими обострениями.
Установлению диагноза способствуют данные эпидемиологического, рентгенологического, функционального и лабораторных исследований.
Основными рентгенологическими признаками являются очаговая специфическая воспалительная деструкция костной ткани (лепромы), наблюдающаяся при лепроматозном типе лепры, и периоститы, гиперостозы и трофические изменения (оетеопороз и остеолиз), встречающиеся при всех типах лепры.
Как известно, лепрозные моно- и полиневриты сопровождаются не только сенсорными и двигательными, но и вазомоторными, секреторными и трофическими нарушениями. С целью диагностики последних применяют функциональные и фармакодинамические пробы: с гистамином (или морфином, дионином), никотиновой кислотой, горчичником, а также пробу Минора.
Проба с гистамином выявляет поражение периферической нервной системы. На пораженный участок и на внешне не измененную кожу наносят по одной капле 0,1% раствора гистамина (или 1% раствора морфина, 2% раствора дионина) и производят поверхностный надрез кожи. В норме наблюдаются три фазы реакции (триада Льюиса): на месте надреза кожи появляется небольших размеров эритема, через 1-2 мин развивается значительно больших размеров рефлекторная эритема (диаметром в несколько сантиметров), возникающая по типу аксон-рефлекса, спустя еще несколько минут в центре ее образуется папула или везикула. На высыпаниях лепрозной этиологии (иногда и на внешне неизмененной коже) вследствие поражения нервных окончаний в коже рефлекторная эритема не развивается.
Проба с горчичником применяется у больных с гипопигментными пятнами кожи, в области которых эритема не появляется вследствие вазомоторных нарушений.
Проба на потоотделение (Минора) заключается в следующем. Исследуемый участок кожи смазывают содержащим йод реактивом Минора или 2-5% спиртовым раствором йода и припудривают крахмалом. Затем стимулируют потоотделение. На участках здоровой кожи с нормальным потоотделением появляется синее окрашивание. На лепрозных поражениях кожи вследствие ангидроза синяя окраска не возникает.
Обследование органа зрения у больных лепрой должно включать наружный осмотр глаза и его вспомогательных органов, определение подвижности глазных яблок, изучение зрачковых реакций на свет, аккомодацию и конвергенцию, исследование преломляющих сред в проходящем свете, офтальмоскопию, биомикроскопию, гониоскопию, биомикроофтальмоскопию, исследование чувствительности бульбарной конъюнктивы и роговицы, определение остроты зрения, периметрию, кампиметрию, адаптометрию и тонометрию.
Для раннего выявления утомляемости круговой мышцы век Ю. И. Гарус (1959) предложил мигательную пробу. Больному предлагают в течение 5 мин производить непрерывные мигательные движения век. В норме эти движения прекращаются через 5 мин. При поражении круговой мышцы век ее утомление, выражающееся в неполном смыкании век, наступает через 2-3 мин.
При обследовании больных с подозрением на лепру применяют бактериоскопические, гистологические и иммунологические методы исследования.
Бактериоскопическому исследованию подвергают соскобы со слизистой оболочки перегородки носа, скарификаты из пораженных участков кожи и пунктат лимфатических узлов. При поражениях органа зрения исследуют отделяемое из конъюнктивального мешка, соскоб с конъюнктивы глазного яблока и век, с роговицы, влагу передней камеры глаза. Мазки окрашивают по Цилю-Нильсену. Результаты бактериоскопических исследований зависят от типа и стадии лепры, обострений и эффективности лечения лепрозной инфекции.
Материалом для гистологических исследований обычно служат биопсированные кусочки кожи. В случае энуклеации глазного яблока исследуют его оболочки. Гистологические срезы окрашивают по Романовскому-Гимзе и Цилю-Нильсену. Результаты гистологических исследований (чаще всего биопсированных кусочков кожи) имеют значение для классификации типа лепры, изучения динамики лепрозного процесса, оценки эффективности лечения, определения сроков стационарного лечения и диспансерного наблюдения.
Серологическая диагностика лепры с использованием реакции РСК, РИГА, РНИФ и др. находится в стадии изучения.
С целью определения резистентности организма к микобактериям лепры ставят лепроминовую пробу, предложенную К. Mitsuda в 1919 г. В реакции используют лепромин-антигеп Мицуды (получаемая из лепромы автоклавирокаипая суспензии микобактерий лепры). Это так называемый интегральный антиген, применяемый чаще всего. Предложены и другие антигены. В кожу плеча или предплечья больного вводят 0,1 мл лепромина. При положительном результате па месте введения антигена через 48 ч определяются гиперемия и папула. Это ранняя реакция на лепромин (реакция Фернандеса). Через 2-4 нед развивается бугорок, иногда изъязвляющийся узелок. Это поздняя реакция на лепромин (реакция Мицуды). В течение 3-4 мес формируется рубец, обычно гипопигментированный, сохраняющийся много лет.
Положительный результат реакции Мицуды свидетельствует о выраженной способности организма к развитию ответной реакции на введение микобактерий лепры, что и наблюдается у большинства здоровых людей.
Отрицательный результат реакции Мицуды свидетельствует об угнетении клеточных реакций иммунитета.
У больных с лепроматозным типом лепры проба с лепромином отрицательная, при туберкулоидном типе - положительная, при недифференцированном - положительная примерно в 50 % случаев, при пограничном - обычно отрицательная. У детей до 3 лет реакция Мицуды отрицательная.
Таким образом, лепроминовая проба имеет значение для определения типа лепры, прогноза заболевания и состояния резистентности организма. Клеточный иммунитет при лепре изучается также в реакциях in vitro (реакция бласттрансформации лимфоцитов. ж др.).
Клинические проявления лепры многообразны и требуют тщательной дифференциации от многих заболеваний кожи, слизистой оболочки верхних дыхательных путей, периферической нервной системы, лимфатических узлов и органа зрения, имеющих ряд входных черт с проявлениями лепры (узловатая эритема, бугорковый сифилид, сифилитические гуммы, туберкулезная волчанка, саркоидоз, сирингомиелия, миелодисплазии, рассеянный и боковой амиотрофический склероз, воспалительные заболевания слизистой оболочки носа и гортани, лимфатических узлов, органа зрения туберкулезной и сифилитической этиологии и др.).

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Согласно классификации, принятой на VI Международном конгрессе по лепре в Мадриде в 1953 г., различают следующие формы лепры: лепроматозную, туберкулоидную, недифференцированную и пограничную (диморфная). Первые два типа лепры признаны полярными.
Туберкулоидный тип лепры характеризуется более легким течением заболевания, результаты лечения лучше. Поражаются кожа, периферические нервы, лимфатические узлы. Типичным поражением кожи являются туберкулоидные высыпания. В соскобах с кожных поражений и слизистой оболочки носа микобактерии лепры не выявляются. Лепроминовая проба положительная. При гистологическом исследовании очагов поражения определяется гранулема, состоящая главным образом из эпителиоидных клеток, окруженных лимфоидными. В центре гранулемы встречаются гигантские клетки типа Лангханса.
Недифференцированный тип лепры - относительно доброкачественная форма заболевания, характеризующаяся поражением кожи и периферических нервов. Поражение кожи выражается в появлении плоских эритематозных пятен. При бактериоскопическом исследовании соскобов с кожных поражений и слизистой оболочки носа, как правило, возбудитель не обнаруживается. Реакция на лепромин может быть отрицательной или положительной в зависимости от тенденции развития инфекционного процесса (тот или другой полярный тип лепры). Гистологически отмечается лимфоцитарная инфильтрация очагов поражения.
Пограничная (диморфная) лепра - злокачественная форма заболевания, характеризующаяся поражением кожи, слизистых оболочек и периферических нервов. Клинические признаки поражения кожи свойственны и лепроматозному, и туберкулоидному типам лепры. При бактериоскопическом исследовании соскобов с кожных поражений микобактерии лепры обнаруживаются в большом количестве, в соскобах со слизистой полости носа - не всегда. Лепроминовая проба обычно отрицательная. При гистологическом исследовании очагов поражения выявляется гранулема, состоящая из клеточных элементов, характерных как для одного, так и для другого полярного типа лепры.
D. Ridley и W. Jopling (1962, 1966) предложили классификацию лепры, включающую пять основных групп (туберкулоидный тип, лепроматозный тип, погранично-туберкулоидная группа, пограничная лепра, погранично-лепроматозная группа) и две дополнительные группы (субполярный лепроматоз и недифференцированная лепра). X Международный конгресс по лепре (Берген, 1973) и Комитет экспертов ВОЗ по лепре (ВОЗ, 1982) рекомендуй ют пользоваться этой классификацией. Одновременно, по мнению Комитета экспертов ВОЗ по лепре, следует широко использовать и Мадридскую классификацию лепры (ВОЗ, 1982).

[1], [2], [3], [4], [5], [6], [7], [8]
Читайте также:

