Противоэпидемические мероприятия при синегнойной инфекции
Обновлено: 11.05.2024
Стерильный фильтрат фаголизатов бактерий Pseudomonas aeruginosa до 1 мл.
Описание
Препарат представляет собой прозрачную жидкость желтого цвета различной интенсивности.
Фармакотерапевтическая группа
Фармакодинамика:
Показания:
Лечение и профилактика заболеваний вызванных синегнойной палочкой (Pseudomonas aeruginosa) у взрослых и детей.
- заболевания уха горла носа дыхательных путей и легких (воспаления пазух носа среднего уха ангина фарингит ларингит трахеит бронхит пневмония плеврит);
- хирургические инфекции (нагноения ран ожоги абсцесс флегмона фурункулы карбункулы гидроаденит панариции парапроктит мастит бурсит остеомиелит);
- урогенитальные инфекции (уретрит цистит пиелонефрит кольпит эндометрит сальпингоофорит);
- энтеральные инфекции (гастроэнтероколит холецистит) дисбактериоз кишечника;
- генерализованные септические заболевания;
- гнойно-воспалительные заболевания новорожденных (омфалит пиодермия конъюнктивит гастроэнтероколит сепсис и др.);
- другие заболевания вызванные синегнойной палочкой.
При тяжелых проявлениях синегнойной инфекции препарат назначают в составе комплексной терапии.
С профилактической целью препарат используют для обработки послеоперационных и свежеинфицированных ран а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Противопоказания:
Индивидуальная непереносимость гиперчувствительность к компонентам препарата.
Беременность и лактация:
Целесообразно применение препарата при наличии инфекций вызванных фагочувствительными штаммами синегнойной палочки (по рекомендации врача).
Способ применения и дозы:
Препарат используют для приема внутрь (через рот) ректального введения аппликаций орошений введения в полости ран вагины матки носа пазух носа и дренированные полости. Перед употреблением флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
Рекомендуемые дозировки препарата.
Доза на 1 прием (мл)
от 1 года до 3 лет
от 8 лет и старше
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно так и приемом препарата внутрь 2-3 раза в день за 1 ч до приема пищи с первого дня заболевания в течение 7-20 дней (по клиническим показаниям).
В случае если до применения бактериофага для лечения ран применялись химические антисептики рана должна быть тщательно промыта стерильным натрия хлорида раствором 09%.
В зависимости от характера очага инфекции бактериофаг применяют:
- В виде орошения примочек и тампонирования в объеме до 200 мл в зависимости от размеров пораженного участка. При абсцессе после удаления гнойного содержимого с помощью пункции препарат вводят в количестве меньшем чем объем удаленного гноя. При остеомиелите после соответствующей хирургической обработки в рану вливают бактериофаг по 10-20 мл.
- При введении в полости (плевральную суставную и другие ограниченные полости) до 100 мл после чего оставляют капиллярный дренаж через который бактериофаг вводят в течение нескольких дней.
- При циститах пиелонефритах уретритах препарат принимают внутрь. В случае если полость мочевого пузыря или почечной лоханки дренированы бактериофаг вводят через цистостому или нефростому 1-2 раза в день по 20-50 мл в мочевой пузырь и по 5-7 мл в почечную лоханку.
- 4При гнойно-воспалительных гинекологических заболеваниях препарат вводят в полость вагины матки в дозе 5-10 мл ежедневно однократно.
- При гнойно-воспалительных заболеваниях уха горла носа препарат вводят в дозе 2-10 мл 1-3 раза в день. Бактериофаг используют для полоскания промывания закапывания введения смоченных турунд (оставляя их на 1 час).
- При энтеральных инфекциях дисбактериозе кишечника препарат принимают внутрь 3 раза в день за 1 час до приема пищи. Возможно сочетание двукратного приема внутрь с однократным ректальным введением разовой возрастной дозы бактериофага в виде клизмы после опорожнения кишечника.
Применение бактериофага у детей (до 6 месяцев).
При сепсисе энтероколите новорожденных включая недоношенных детей бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки в дозе 5-10 мл. При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в виде высоких клизм) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При лечении омфалита пиодермии инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или на пораженный участок кожи).
Побочные эффекты:
Передозировка:
Симптомы передозировки меры по оказанию помощи при передозировке отсутствуют.
Взаимодействие:
Применение препарата возможно в сочетании с другими лекарственными средствами в том числе с антибиотиками.
Особые указания:
Важным условием эффективной фаготерапии является предварительное определение чувствительности возбудителя к бактериофагу и раннее применение препарата.
Не пригоден к применению препарат во флаконах с нарушенной целостностью или маркировкой при истекшем сроке годности при помутнении.
Вследствие содержания в препарате питательной среды в которой могут развиваться бактерии из окружающей среды вызывая помутнение препарата необходимо при вскрытии флакона соблюдать следующие правила:
- тщательно мыть руки;
- обработать колпачок спиртсодержащим раствором;
- снять колпачок не открывая пробки;
- не класть пробку внутренней поверхностью на стол или другие предметы;
- не оставлять флакон открытым;
- вскрытый флакон хранить только в холодильнике.
Вскрытие флакона и извлечение необходимого объема препарата может проводиться стерильным шприцем путем прокола пробки. Препарат из вскрытого флакона при соблюдении условий хранения вышеперечисленных правил и отсутствии помутнения может быть использован в течение всего срока годности.
Влияние на способность управлять трансп. ср. и мех.:
Форма выпуска/дозировка:
Раствор для приема внутрь местного и наружного применения.
Упаковка:
Раствор для приема внутрь местного и наружного применения во флаконах по 20 мл или 100 мл. 4 или 8 флаконов по 20 мл или 1 флакон по 100 мл в пачке из картона с инструкцией по применению.
Условия хранения:
Срок годности:
Срок годности 2 года. Препарат с истекшим сроком годности применению не подлежит.
Условия отпуска
Производитель
Федеральное государственное унитарное предприятие "Научно-производственное объединение по медицинским иммунобиологическим препаратам "Микроген" Министерства здравоохранения Российской Федерации (ФГУП "НПО "Микроген" Минздрава России), 450014, Республика Башкортостан, г. Уфа, ул. Новороссийская, д. 105, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
ФГУП "НПО "Микроген" Минздрава России
Бактериофаг псевдомонас аеругиноза (синегнойный) - цена, наличие в аптеках
Указана цена, по которой можно купить Бактериофаг псевдомонас аеругиноза (синегнойный) в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
МКБ-10
B96.5 Pseudomonas (aeruginosa) (mallei) (pseudomallei) как причина болезней, классифицированных в других рубриках
Общие сведения
Синегнойная инфекция впервые была описана в 1850 году французским хирургом Седилем. В 1882-м французскому военному фармацевту Жессару удалось выделить чистую культуру возбудителя, а в 1916 году стала известна эпидемиология данного заболевания. Болезнь распространена повсеместно, бактерий обнаруживают в почве, воде и на растениях. Четкая сезонность отсутствует. В стационарах излюбленной локализацией считается физиотерапевтическое и реанимационное оборудование. Группами риска являются недоношенные новорожденные, дети до 3-х месяцев, пожилые, пациенты отделений гемодиализа, химиотерапии, нейрохирургии и реанимации, больные с муковисцидозом и иммуносупрессией.

Причины
Возбудитель заболевания – синегнойная палочка (Pseudomonas aeruginosa) и её штаммы, представляет собой условно-патогенный микроорганизм, способный вызывать поражение только при отсутствии адекватного ответа иммунной системы. Источником инфекции служат больные люди и животные, бактерионосители, преимущественная локализация микроорганизма – кожа, кишечник. Заражение происходит воздушно-капельным и пищевым путем. Путь инфицирования при госпитальном заражении чаще контактный – через нестерильный инструментарий, руки медицинского персонала и предметы ухода за больными. Бактерия погибает при кипячении, во время автоклавирования, а также при воздействии 3% перекиси водорода и хлорсодержащих дезинфектантов.
Патогенез
При попадании микробов на поврежденную кожу или слизистую оболочку возникает массивная деструкция тканей, обусловленная воздействием экзотоксинов и продуцируемых бактериями веществ. В норме слизистая организма способна нивелировать воздействие синегнойной палочки ввиду мукоцилиарного клиренса и механического барьера. Привлечение нейтрофилов и активный фагоцитоз усиливают образование множества антибактериальных цитокинов, ферментов и свободных радикалов, служат активаторами системы комплемента и других звеньев гуморального иммунитета.
От 33 до 83% штаммов синегнойной палочки имеют эволюционно обусловленный механизм защиты от иммунной системы – образование биопленок, состоящих из скопления пораженных клеток и внеклеточного матрикса, включающего фибрин, секреторное отделяемое слизистых, альгинат, полисахариды и липиды. Известно, что бактерии лизируют нейтрофилы, усиливая рост собственных биопленок.
Классификация
Поражения, вызываемые синегнойной палочкой, можно условно разделить на местные и генерализованные (септические). Некоторые виды, в том числе инфекции ЦНС, сердца и средостения развиваются вследствие диссеминации возбудителя. В зависимости от топологии воспалительного очага различают следующие формы синегнойной инфекции:
- Инфекция респираторного тракта. Пациенты, находящиеся на длительной искусственной вентиляции легких, в 30% случаев переносят трахеобронхит и в 24% – пневмонию синегнойной этиологии.
- Инфекция ЛОР-органов. Синуситы развивается редко, при этом до 40% хронических средних отитов приходится на долю синегнойной палочки.
- Инфекция ЖКТ. Проявляется в виде тяжелой диареи, нередко с летальным исходом среди детей до года. С возбудителем связывают около 16% послеоперационных перитонитов.
- Инфекция глаз. Связана с длительным применением контаминированных контактных линз и глазных капель, часто приводит к панофтальмиту.
- Инфекция мочевой системы. Наиболее вероятно развитие катетер-ассоциированного острого пиелонефрита. С данным возбудителем связывают до 13% случаев острого простатита.
- Инфекция кожи. Возникает после пребывания в бассейне со сниженной концентрацией дезинфицирующих средств, может поражать ногти, подкожную клетчатку, мышечные фасции с формированием некрозов.
- Раневая инфекция. Составляет до 10% всех боевых инфекционных осложнений, становится причиной около 30% гнойных процессов при ожоговой болезни. Считается поддерживающим фактором формирования трофических язв.
Симптомы синегнойной инфекции
Инкубационный период патологии крайне вариабелен, может составлять от нескольких суток до десятилетий, поскольку микроорганизм является одним из условно-патогенных компонентов микрофлоры человека. Клинические проявления зависят от пораженного органа. У взрослых при инвазии пищеварительного тракта первыми симптомами являются лихорадка (не более 38,5° C), снижение аппетита, озноб, слабость, тошнота, реже рвота, вздутие и болезненность живота, частый кашицеобразный стул с кровью и слизью.
Маленькие дети при поражении ЖКТ становятся вялыми, сонливыми, отказываются от еды и питья, срыгивают, гастроэнтероколит протекает с высоким риском кишечного кровотечения. Синегнойная патология ЛОР-органов проявляется лихорадкой 37,5° C и выше, резкой болью в ухе, снижением слуха, желто-зеленым обильным отделяемым, иногда с примесью крови. Поражение дыхательного тракта протекает в форме пневмонии – с повышением температуры тела более 38° C, нарастающей одышкой, кашлем с обильной слизисто-гнойной мокротой.
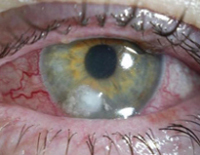
Псевдомонадная инфекция мочевыводящей системы характеризуется лихорадкой, болями в пояснице, частыми болезненными мочеиспусканиями, чувством неполного опорожнения мочевого пузыря, изменением цвета и запаха мочи. Глазные симптомы инвазии синегнойной палочки чаще выявляются в области одного глазного яблока, начинаются с появления рези, болей, чувства жжения, инородного тела, слезотечения, светобоязни и слизисто-гнойного обильного отделяемого. В дальнейшем может возникать снижение и помутнение зрения.
Поражение кожи проявляется высыпаниями в виде пятен и гнойничковых элементов по всему телу, включая сыпь на ладонях, подошвах и в носоглотке, увеличением лимфоузлов, постоянными головными болями (так называемая головная боль пловцов), зеленой окраской одной, реже двух ногтевых пластин, образованием болезненных уплотнений в подкожно-жировой клетчатке. Раневая инфекция возбудителя сопровождается появлением сине-зеленого гнойного отделяемого и гнойно-геморрагических корочек, увеличением зоны покраснения вокруг раны.
Осложнения
Мультисистемность и клиническое разнообразие симптомов синегнойной инфекции отражается на количестве осложнений данного состояния. К наиболее частым негативным последствиям относят генерализацию инфекционного процесса, инфекционно-токсический шок, у грудных детей – некротический колит. Высока вероятность абсцедирования и гангренозных изменений. Вялотекущее течение инфекции на слизистых уха, ротоглотки, носа, конъюнктивы и легких приводит к хронизации воспалительного процесса, формированию мезотимпанита, бронхоэктазов, ползучей язвы роговицы, частичной или полной глухоты, односторонней слепоты.
Диагностика
Диагноз выставляется на основании данных, полученных в ходе консультации инфекциониста. При возникновении обширных гнойных поражений обязательна консультация хирурга, по показаниям приглашаются другие профильные специалисты. Наиболее распространенными диагностическими методами подтверждения псевдомонадной этиологии болезни являются следующие инструментальные и лабораторные исследования:
- Физикальное обследование. При объективном осмотре обращают внимание на цвет раневого отделяемого, наличие сыпи. Поражение наружного уха, глаз проявляется гиперемией, обильным слизисто-гнойным отделяемым. В легких при пневмонии выслушивается ослабление дыхания, при перкуссии – притупление звука. В случае гастроэнтероколита обнаруживается болезненность по ходу кишечника, урчание; обязательно проводится визуальная оценка испражнений.
- Лабораторные исследования. Общеклинический анализ крови свидетельствует о наличии лейкоцитоза, палочкоядерного сдвига влево, ускорения СОЭ. В биохимических параметрах наблюдается увеличение АЛТ, АСТ, СРБ, снижение общего белка, гипоальбуминемия. В общем анализе мочи возможна протеинурия, гематурия. Анализ мокроты подтверждает большое число бактерий и лейкоцитов. В ликворограмме при поражениях головного мозга выявляется нейтрофильный плеоцитоз, клеточно-белковая диссоциация.
- Выявление инфекционных агентов. Золотым стандартом является бактериологическое исследование, осуществляемое в современных условиях методом масс-спектрометрии с обязательным определением антибактериальной чувствительности бактерии. Обнаружение возбудителя возможно с помощью ПЦР биологического материала из патологического очага. Серологическая диагностика (ИФА) выполняется неоднократно с промежутком не менее 10-14 суток для детекции роста титра антител.
- Инструментальные методики. Рентгенография органов грудной клетки, реже МРТ или КТ проводится с целью верификации легочных поражений, дифференциального диагноза. УЗИ органов брюшной полости, мочеполовой системы, мягких тканей, костей и забрюшинного пространства позволяет установить первичный очаг воспаления. Эхо-КГ показана при подозрении на инфекционный эндокардит. Колоноскопия, ФГДС назначаются с целью исключения новообразований пищеварительного тракта.
Дифференциальная диагностика синегнойной инфекции сложна ввиду многообразия клинических форм болезни. Наиболее распространенные поражения желудочно-кишечной системы дифференцируют с сальмонеллезом, шигеллезом и псевдомембранозным колитом. Кожные проявления отличают от гнойно-некротических поражений стрептококковой и стафилококковой этиологии. Инфекции дыхательной системы могут напоминать казеозную пневмонию при туберкулезе, саркоидоз, бактериальные воспаления легких. Причинами сепсиса могут быть различные вирусы, бактерии и грибы.
Лечение синегнойной инфекции
Стационарное лечение рекомендуется пациентам с органными поражениями, среднетяжелым и тяжелым течением болезни. Больные с нозокомиальной синегнойной инфекцией продолжают лечение в том отделении, где находились до манифестации инфекционного процесса, с обязательным проведением всех противоэпидемических мероприятий и санацией аппаратуры. Постельный режим необходим до устойчивого купирования лихорадки в течение 3-5 дней, его продолжительность зависит от степени инвазии, наличия осложнений и декомпенсации сопутствующих болезней. Специальная диета не разработана, рекомендован прием пищи с достаточным количеством белка, адекватный питьевой режим.
Средствами борьбы с инфекцией считаются гипериммунная антисинегнойная донорская плазма и противосинегнойный гамма-глобулин, Перечисленные препараты применяются реже в связи с возможным развитием сывороточной болезни, показаны при вялотекущем воспалительном процессе. Симптоматическое лечение включает дезинтоксикационную терапию, противовоспалительные и жаропонижающие средства. Хирургическое вмешательство необходимо при локализованных и разлитых гнойных процессах, заключается во вскрытии и дренировании гнойников, реже – ампутации конечности. Допускается местное применение раствора перекиси водорода, мазей с антибиотиками.
Прогноз и профилактика
Специфическая профилактика (поливалентная вакцина) показана медицинским работникам, ожоговым больным, пациентам с открытыми переломами и глубокими ранами, лицам с иммунным дефицитом, людям старческого возраста. Неспецифические меры сводятся к строгому соблюдению правил обработки медицинских инструментов и оборудования, контролю контаминации синегнойной палочкой персонала. Важны общеукрепляющие методы – закаливание, нормальный сон, полноценная еда, прогулки, физическая активность, неукоснительное соблюдение личной гигиены и своевременная санация гнойных очагов.
1. Pseudomonas aeruginosa: патогенность, патогенез и патология / Лазарева А.В., Чеботарь И.В.// Клиническая микробиология и антимикробная химиотерапия – 2015 – Т.17, №3.
3. Эпидемиология и профилактика синегнойной инфекции. Федеральные клинические рекомендации / Егорова О.Н., Брусина Е.Б. и др. – 2014.
Pseudomonas aeruginosa является одним из наиболее частых возбудителей нозокомиальных инфекций, причем инфекции, вызванные этим микроорганизмом, характеризуются тяжелым течением и ассоциируются с высокой летальностью. Исследования последних лет указывают на рост устойчивости P. aeruginosa практически ко всем антибактериальным препаратам. Среди β-лактамных антибиотиков наименьшая устойчивость P. aeruginosa отмечена к меропенему. Рассматриваются результаты анализа сравнительной активности меропенема и имипенема в отношении штаммов P. aeruginosa, выделенных в американских, западно- и восточноевропейских стационарах в рамках исследования MYSTIC с 1997 по 2005 г. Результаты мониторинга демонстрируют не только более высокую природную антипсевдомонадную активность меропенема, но и меньшую частоту приобретенной устойчивости по сравнению с имипенемом, а также способность меропенема в ряде случаев сохранять активность в отношении имипенемустойчивых штаммов P. aeruginosa. Полученные данные свидетельствуют о более высокой потенциальной эффективности меропенема при лечении псевдомонадных инфекций и о предпочтительности использования именно меропенема в качестве средства эмпирической терапии нозокомиальных инфекций в ОРИТ.
Pseudomonas aeruginosa относится к числу грамотрицательных неферментирующих микроорганизмов и является одним из наиболее частых возбудителей нозокомиальных инфекций. По данным Национальной системы контроля за нозокомиальными инфекциями США (NNIS), P. aeruginosa является самым частым возбудителем нозокомиальной пневмонии и также относится к ведущим возбудителям инфекций мочевыводящих путей и хирургических инфекций [1]. Инфекции, вызванные этим микроорганизмом, характеризуются тяжелым течением и ассоциируются с высокой летальностью [2]. В частности, при бактериемии, вызванной P. aeruginosa, атрибутивная летальность составляет от 18 до 39% [3, 4].
В связи с высокой летальностью при нозокомиальных псевдомонадных инфекциях критическое значение приобретает адекватный выбор стартового режима антибактериальной терапии. Задержка с назначением эффективного режима терапии псевдомонадных инфекций приводит к увеличению летальности [5].
Проблемы выбора адекватного стартового режима антибактериальной терапии в наибольшей степени связаны с тем, что нозокомиальные штаммы P. aeruginosa обычно характеризуются устойчивостью ко многим потенциально эффективным антибиотикам, в частности антипсевдомонадным пенициллинам и цефалоспоринам, в т.ч. ингибиторозащищенным, карбапенемам, аминогликозидам, фторхинолонам. Большинство штаммов P. aeruginosa, выделяемых у больных, находящихся в отделениях реанимации и интенсивной терапии (ОРИТ), являются полирезистентными [6], т.е. проявляющими устойчивость к трем и более потенциально эффективным антибиотикам. Панрезистентные штаммы синегнойной палочки в настоящее время уже не являются экзотическими находками, причем описаны вспышки нозокомиальных инфекций в ОРИТ, вызванных такими штаммами [7, 8].
Последние годы характеризовались увеличением устойчивости P. aeruginosa практически ко всем антибактериальным препаратам, за исключением полимиксина. Последний, к сожалению, недоступен в нашей стране.
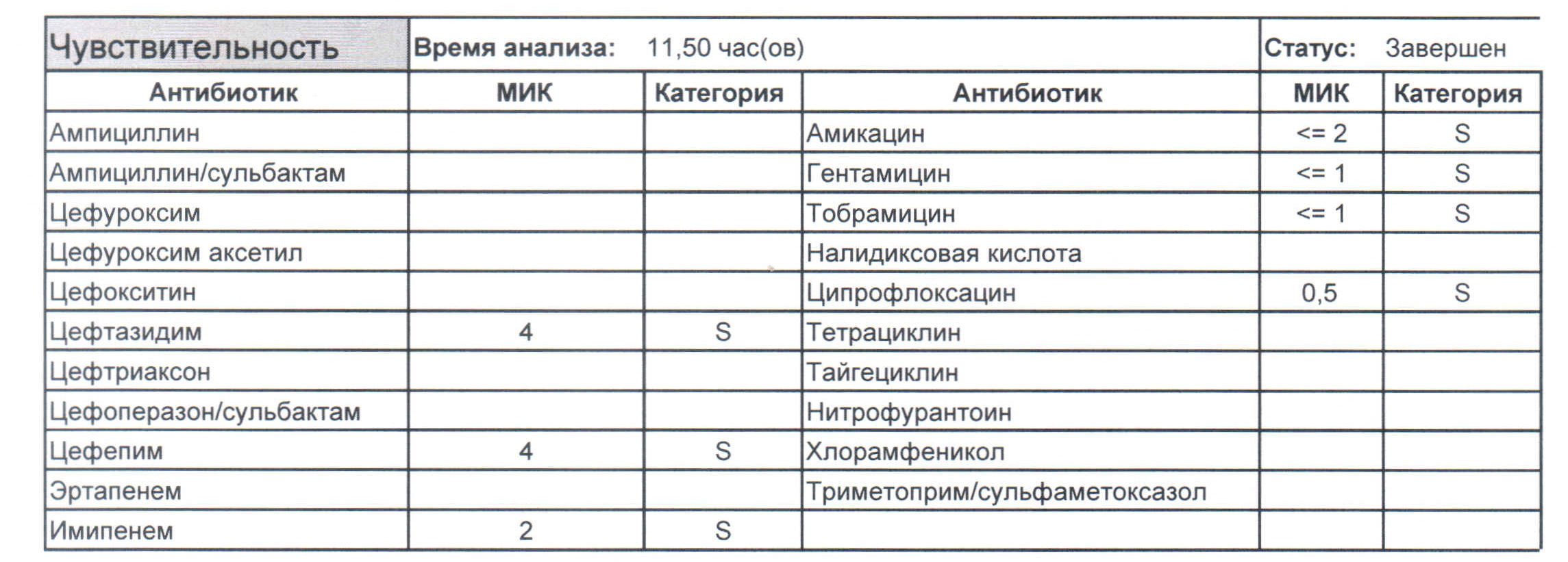
Многоцентровое исследование антибиотикорезистентности возбудителей нозокомиальных инфекций в ОРИТ стационаров Москвы, проведенное в 2003 г., показало низкую чувствительность синегнойной палочки ко всем антибиотикам со значениями МПК90 от 32 до 256 мкг/мл. Наибольшую активность в отношении P. aeruginosa проявлял меропенем (50% чувствительных штаммов). Следует отметить крайне высокий уровень нечувствительных штаммов синегнойной палочки к таким традиционным антипсевдомонадным антибиотикам, как цефтазидим (63%), цефепим (76%), цефоперазон/сульбактам (73%), амикацин (75%) и ципрофлоксацин (90%) [9]. Уровень чувствительности P. aeruginosa, оцененный по значениям МПК50 и МПК90, также был наиболее высоким к меропенему (4 и 32 мкг/мл соответственно) по сравнению с другими наиболее активными β-лактамами – цефепимом (16 и 32 мкг/мл), цефоперазоном/сульбактамом (32 и 32 мкг/мл) и цефтазидимом (32 и 128 мкг/мл).
Предварительные (неопубликованные) результаты многоцентрового исследования MASTER, проведенного в 25 ОРИТ 20 городов РФ, также демонстрируют высокий уровень антибиотикорезистентности синегнойной палочки ко всем антибиотикам. Среди β-лактамных антибиотиков наименьшая устойчивость отмечена к меропенему.
Множественная устойчивость P. aeruginosa к антибиотикам объясняется тем, что микроорганизм способен формировать резистентность с помощью разных механизмов, часто сочетающихся. Например, устойчивость к β-лактамным антибиотикам может быть опосредована нарушением проницаемости микробной клетки для антибиотика в результате утраты поринового канала OprD, активацией эффлюксных систем (MexAB-OprM, MexEF-OprN, MexXY-OprM), продукцией β-лактамаз классов А, С и D плазмидной или хромосомной локализации. Хромосомные β-лактамазы класса С (AmpC) гидролизуют цефалоспорины III поколения и антисинегнойные пенициллины, в т. ч. ингибиторозащищенные, плазмидные β-лактамазы расширенного спектра гидролизуют цефалоспорины III и IV поколения и азтреонам. Металлоэнзимы (IMP, VIM-2) способны инактивировать карбапенемы и другие β-лактамы, в меньшей степени азтреонам.
По природной антипсевдомонадной активности карбапенемы являются одними из наиболее эффективных β-лактамных антибиотиков. Учитывая, что карбапенемы традиционно рассматриваются как самые надежные средства эмпирической стартовой терапии тяжелых нозокомиальных инфекций, особый интерес представляют исследования по изучению глобального распространения устойчивости к ним P. aeruginosa, являющегося одним из самых “проблемных” нозокомиальных патогенов. К таким исследованиям относится программа мониторинга MYSTIC (The Meropenem Susceptibility Test Information Collection), в которой с 1997 г. исследуется чувствительность грамотрицательных нозокомиальных возбудителей, выделенных в разных стационарах большинства стран Америки и Европы, включая Россию, к различным антибиотикам [10]. Недавно был опубликован анализ сравнительной активности меропенема и имипенема в отношении штаммов P. aeruginosa, выделенных в рамках исследования MYSTIC с 1997 по 2005 г. [11]. За этот период был собран и проанализирован 16 881 штамм синегнойной палочки.
Результаты анализа показали, что меропенем характеризуется более высокой природной активностью в отношении P. aeruginosa по сравнению с имипенемом: наиболее частые значения МПК были в пределах 0,25-0,5 мкг/мл для меропенема и 1-2 мкг/мл для имипенема (табл. 1). Эти тенденции были характерны для всех регионов мира. Общая частота чувствительных штаммов P. aeruginosa к меропенему была выше (77,3%), чем к имипенему (69,4%). Частота высокочувствительных штаммов (МПК < 1 мкг/мл) также была выше для меропенема (47,9%), чем для имипенема (14,2%), сходные данные получены в субанализе для региона Восточной Европы - 38,7 и 12,4%.
Таблица 1. Суммарный процент чувствительных штаммов P. aeruginosa к меропенему и имипенему при возрастающих МПК: данные исследования MYSTIC 1997–2005 гг.
| МПК, мг/л | Регион | |||
| Всего | Восточная Европа | |||
| меропенем | имипенем | меропенем | имипенем | |
| ≤ 0,06 | 8,0 | 0,9 | 5,5 | 1,3 |
| 0,13 | 17,0 | 1,8 | 13,5 | 1,8 |
| 0,25 | 31,7 | 4,7 | 26,0 | 3,7 |
| 0,5 | 47,9 | 14,2 | 38,7 | 12,4 |
| 1 | 60,8 | 36,7 | 47,6 | 33,2 |
| 2 | 70,1 | 58,1 | 56,3 | 50,4 |
| 4 | 77,3 | 69,4 | 63,1 | 57,5 |
| 8 | 83,5 | 76,7 | 70,0 | 64,0 |
| 16 | 88,2 | 83,7 | 75,5 | 72,2 |
| 32 | 92,6 | 90,4 | 88,4 | 88,5 |
| ≥ 64 | 100 | 100 | 100 | 100 |
| Процент Ч | 77,3 | 69,4 | 63,1 | 57,5 |
Примечание. Ч – чувствительные штаммы на основании критериев CLSI (≤ 4 мг/л).
Всего исследован 16 881 штамм, в Восточной Европе – 2474 штамма.
Особый интерес для практической антимикробной химиотерапии представляет проблема перекрестной устойчивости синегнойной палочки к карбапенемам. В табл. 2 представлены данные по сохранению активности меропенема в отношении имипенемустойчивой P. aeruginosa и наоборот.
Таблица 2. Чувствительность меропенемрезистентных штаммов P. aeruginosa к имипенему и имипенемрезистентных штаммов к меропенему по данным исследования MYSTIC
| Штаммы | Регион | Количество штаммов | Процент чувствительных штаммов |
| Штаммы, устойчивые к меропенему | |||
| Имипенем-Ч | Всего | 2730 | 4,2 |
| Северная Америка | 260 | 5,4 | |
| Южная Америка | 808 | 2,6 | |
| Северная Европа | 597 | 5,9 | |
| Южная Европа | 256 | 7,4 | |
| Восточная Европа | 717 | 2,8 | |
| Штаммы, устойчивые к имипенему | |||
| Меропенем-Ч | Всего | 3857 | 20,4 |
| Северная Америка | 329 | 16,4 | |
| Южная Америка | 929 | 11,7 | |
| Северная Европа | 1041 | 31,3 | |
| Южная Европа | 544 | 28,5 | |
| Восточная Европа | 860 | 11,2 | |
Примечание. Ч – чувствительные штаммы на основании критериев CLSI (≤ 4 мг/л).
В отношении имипенемрезистентных штаммов меропенем проявляет активность в 11,2-31,3% случаев, в то время как в отношении меропенемрезистентных штаммов имипенем сохраняет активность только в 2,2-7,4%. Сходные результаты о перекрестной устойчивости синегнойной палочки к карбапенемам получены в другом исследовании [12]. При анализе 1014 штаммов P. aeruginosa из 136 больниц Испании 52% имипенемрезистентных штаммов были чувствительны к меропенему, в то время как только 15% меропенемрезистентных штаммов сохраняли чувствительность к имипенему. Отсутствие полной перекрестной устойчивости синегнойной палочки к меропенему и имипенему объясняется разными механизмами резистентности. Основной механизм устойчивости P. aeruginosa к имипенему связан с нарушением проницаемости микробной клетки для антибиотика вследствие утраты поринового канала OprD в результате мутации.
На фоне действия имипенема достаточно быстро происходит селекция таких мутантов.
Частота мутаций, приводящих к утрате OprD, составляет 10 -7 , причем это зачастую сочетается с гиперпродукцией хромосомных AmpC β-лактамаз. В результате значения МПК имипенема возрастают до 8–32 мкг/мл, что сопровождается клинической неэффективностью лечения [13]. Потеря порина OprD не критична для меропенема, т. к. антибиотик использует для проникновения в клетку и другие пориновые каналы. Кроме того, меропенем проявляет большую стабильность к хромосомным β-лактамазам, чем имипенем [14], поэтому указанные выше мутации не приводят к росту МПК для меропенема.
Основной механизм устойчивости P. aeruginosa к меропенему связан с активацией систем эффлюксной помпы (MexA-MexB-OprM), причем в результате такой отдельной мутации значения МПК меропенема повышаются, но незначительно (до 2–4 мкг/мл) и клиническая эффективность антибиотика сохраняется [13]. Для того чтобы значения МПК меропенема выросли значительно, необходимы одновременно две мутации – активация эффлюксной помпы и утрата поринового канала, однако вероятность такого события значительно меньше – 10 -14 . Указанные различия в механизмах устойчивости объясняют, почему резистентность P. aeruginosa к меропенему развивается медленнее, чем к имипенему, о чем наглядно свидетельствуют данные мониторинга антибиотикорезистентности во всем мире.
Таким образом, результаты многолетнего мониторинга антибиотикорезистентности MYSTIC демонстрируют не только более высокую природную антипсевдомонадную активность меропенема, но и меньшую частоту приобретенной устойчивости по сравнению с имипенемом, а также способность меропенема в ряде случаев сохранять активность в отношении имипенемустойчивых штаммов P. aeruginosa. Интересно, что указанные тенденции сохраняются в течение всего периода мониторинга. Полученные данные свидетельствуют о более высокой потенциальной эффективности меропенема при лечении псевдомонадных инфекций и о предпочтительности использования именно меропенема в качестве средства эмпирической терапии нозокомиальных инфекций в ОРИТ, учитывая во многом схожую активность двух карбапенемов в отношении других грамотрицательных микроорганизмов.


Острые кишечные инфекции широко распространены во всем мире, они поражают взрослых и детей.
Среди всех инфекционных патологий острые кишечные инфекции составляют 20%.
В 2018 году острыми кишечными инфекциями в России зафиксировано более 816 тысяч случаев заболеваний острыми кишечными инфекциями.
Профилактика инфекционных заболеваний особенно актуальна в период ухудшения паводковой ситуации.
Паводки - подъёмы уровня воды, возникающие в результате выпадения обильных осадков.
Благоприятные условия для размножения болезнетворных микроорганизмов в период паводков – угроза для здоровья большого количества людей. Подъем уровня воды – это всегда риск кишечных инфекций (бактериальных и вирусных) : дизентерии, ротавирусной, норовирусной инфекции, гепатита А и других заболеваний с фекально-оральным и водным путями распространения.
Острые кишечные инфекции - группа инфекционных заболеваний, вызванных различными микроорганизмами (бактериями, вирусами), проявляющаяся расстройствами пищеварения и симптомами обезвоживания.
Кишечные инфекции встречаются в любое время года: вирусные, чаще всего встречаются в холодное время года (с ростом заболеваемости гриппом и ОРВИ), бактериальные - в теплое время года.
В связи с благоприятным воздействием теплого климата на размножение микроорганизмов, особенно высок уровень заболеваемости острыми кишечными инфекциями в летний период времени. В этот период отмечается резкое повышение уровня инфицированности воды, почвы, продуктов питания возбудителями острых кишечных инфекций. Особенно подвержены в теплый период кишечным инфекциям дети. Это связано с низкой степенью активности защитных факторов, а так же с отсутствием сформированных гигиенических навыков у детей. Факторы иммунной защиты в желудочно-кишечном тракте у детей формируются к 5-летнему возрасту.
Практически все возбудители острой кишечной инфекции отличаются очень высокой устойчивостью. Например, возбудители паратифов и брюшного тифа продолжают свою жизнеспособность в молоке более 2 месяцев, в воде ещё дольше.
Микробы дизентерии в молоке могут жить и размножаться на протяжении 7 дней, а в речной воде - 35 дней. Свою жизнеспособность вирусы могут сохранять на различных предметах от 10 до 30 дней, а в фекалиях - более полугода.
Виды острых кишечных инфекций:
бактериальные: cальмонеллез, дизентерия, иерсиниоз, эшерихиоз, кампилобактериоз; острая кишечная инфекция, вызванная синегнойной палочкой, клостридиями, клебсиеллами, протеем; стафилококковое пищевое отравление, брюшной тиф, холера, ботулизм и прочие
ОКИ вирусной этиологи : ротавирусная, энтеровирусная, коронавирусная, аденовирусная, реовирусная инфекции
грибковые кишечные инфекции (чаще грибы рода Candida)
протозойные кишечные инфекции (лямблиоз, амебиаз) - отличаются крайне тяжелой клинической симптоматикой.
Кто является источником инфекции?
Основным источником инфекции является больной человек. Опасным является здоровый бактерионоситель и тот, у кого заболевание протекает в стертой форме, при которой он даже этого не замечает.
Как происходит заражение ?
Пути инфицирования:
В организм человека бактерии попадают через рот, вместе с пищей, водой или через грязные руки. Например, дизентерия может начаться при употреблении воды из-под крана, некипяченого молока; кишечная палочка может попасть в организм с просроченным кисломолочным продуктом; сальмонеллезом можно заразиться, употребив в пищу зараженные продукты, такие как куриное мясо и яйца, плохо промытые водой овощи и зелень.
Механизм заражения.
Основным механизмом попадания микроорганизмов в организм человека является алиментарный, но для вирусных инфекций характерен также и воздушно-капельный способ заражения.
Факторы передачи:
Пищевые продукты, предметы обихода, купание в открытых водоемах (в зависимости от инфекции). В передаче некоторых инфекций имеют значение насекомые (тараканы, мухи)
Несоблюдение правил личной гигиены
* Наиболее опасны выделения больного.
Наиболее восприимчивы к кишечным инфекциям:
Люди преклонного возраста
Лица с заболеваниями желудочно-кишечного тракта
Люди, страдающие алкоголизмом
Люди с ослабленным иммунитетом.
Инкубационный период в среднем длится от 6 часов до 2 суток.
Клиническая картина.
Как правило, острые кишечные инфекции начинаются остро с повышения температуры тела, жидкого стула, болей в животе.
Общие симптомы острых кишечных инфекций:
Интоксикация. Повышение температуры тела, слабость, головокружение, ломота в теле
* Нарушения пищеварения: боли в области желудка, тошнота, многократная рвота, учащение стула (испражнения становятся водянистыми)
Обезвоживание. Особенно опасно для детей.
Клиническая картина и профилактика некоторых инфекций.
Инфекции, вызванные бактериями.
Холера.
Вызывает холеру бактерия вида Vibrio Cholerae.
Передается инфекция с сырой водой, пищевыми продуктами, при контакте с больными.
Инкубационный период длится от нескольких часов до 6 суток, чаще 1-2 дня.
Симптомы инфекции: заостренные черты лица, сиплый голос, мучительная жажда, постоянная рвота, сухость кожи, слабость, внезапный и частый понос, напоминающий рисовый отвар, боли в мышцах и судороги.
Лечение направлено на восстановление водно-солевого баланса, введение антибиотиков и витаминов.
Профилактика холеры заключается в предупреждении заноса инфекции, в соблюдении санитарно-гигиенических мер, таких как обеззараживание воды, мытье рук, термическая обработка пищи, обеззараживание помещений общего пользования. Специфическая профилактика состоит во введении холерной вакцины и холероген-анатоксина (действует 3-6 месяцев).
Сальмонеллез
Вызывается бактериями рода Salmonella, попадающих в организм с пищевыми продуктами животного происхождения.
Основные пути заражения:
Пищевой: мясо зараженных животных и птиц, недостаточно термически обработанные; питье загрязненной воды
При купании в загрязненной воде.
Инкубационный период длится от 2 часов до 3 суток, чаще 6-24 часа.
Лечение заключается в промывании желудка и кишечника, введении солевых растворов, спазмолитиков и антибиотиков. Необходимо обильное питье.
Профилактика: тщательная тепловая обработка мяса курицы и яиц, соблюдение правил личной гигиены, раздельные хранение и разделка сырой и готовой пищи.
Дизентерия (шигеллез).
Возбудители дизентерии принадлежат к роду Shigella.
Источником инфекции является больной или бактерионоситель.
Механизм передачи - фекально-оральный.
Основные пути передачи - контактно-бытовой, водный, алиментарный.
Факторы передачи: чаще молоко. Возможно овощи, фрукты, различные предметы, обсемененные шигеллами, мухи.
Инкубационный период длится от нескольких часов до 7 суток, чаще 2-3 суток.
Заболевание начинается остро с появления болей в животе. Далее присоединяется расстройство стула. Частота стула колеблется от 10 до 20 раз в сутки. Стул сначала носит каловый характер, далее появляется слизь, кровь, уменьшается объем каловых масс, они могут приобретать вид плевка. Заболевание сопровождается повышением температуры тела, ознобом, слабостью, вялостью, снижением аппетита.
Больным дизентерией необходимо соблюдать постельный режим. Госпитализации подлежат больные со средне-тяжелым и тяжелым течением болезни. Назначается лечебное питание, антибактериальная терапия, компенсация потери жидкости, обильное питье. При болях в животе назначают спазмолитики.
Для экстренной профилактики используют дизентерийный бактериофаг. Общая профилактика - санитарно-гигиенические мероприятия.
Ботулизм.
Возбудитель болезни - Clostridium botulinum
Заражение происходит при употреблении продуктов, в которых при анаэробных условиях размножаются бактерии и в большом количестве накапливается токсин.
Инкубационный период продолжается от 2 - 4 часов до 10 суток. В среднем - 2 суток.
Болезнь начинается остро. Основные симптомы: головная боль, тошнота, рвота, боль в животе, нарушение зрения, глотания, изменение голоса. Смерть наступает от паралича дыхания.
При подозрении на ботулизм больные подлежат экстренной госпитализации в стационары, имеющие отделения реанимации. В первую очередь проводят очищение желудка и кишечника, вводят противоботулинистическую сыворотку. Наиболее эффективно её введение на первые сутки. Назначаются антибиотики. Больным с тяжелым течением болезни проводится искусственная вентиляция легких.
Строгое соблюдение технологии производства консервированных продуктов.
Домашние заготовки хранить в холодильнике.
Лицам, употребившим подозрительный продукт, вводят половину лечебной дозы противоботулинистической сыворотки.
Инфекции, вызванные вирусами.
Ротавирусная инфекция.
Возбудителем инфекции является ротавирус.
Болеют в основном дети от 6 месяцев до 4 лет.
Механизм передачи возбудителя - фекально-оральный, чаще через воду.
Источник заболевания - больной, в меньшей степени вирусоноситель.
Инкубационный период длится от 15 часов до 7 суток.
Болезнь начинается бурно, остро, появляются схваткообразные боли в животе, урчание, жидкий стул. У половины заболевших - рвота. Эти симптомы сочетаются с лихорадкой, головной болью, интоксикацией и катаральными явлениями. Отмечается снижение или отсутствие аппетита.
Госпитализации подлежат больные с выраженными признаками обезвоживания. Основная масса больных лечится на дому. Проводится регидратационная терапия. Восполнение жидкости в объемах, соответствующих потерям. Назначается щадящая диета до восстановления стула.
Выявление и изоляция больных.
Дезинфекция в очаге инфекции.
Энтеровирусные инфекции.
Возбудитель - энтеровирусы групп Коксаки А, Коксаки В, ЕСНО.
Механизм передачи - фекально-оральный. Путь передачи - алиментарный. Факторы передачи чаще всего - овощи.
Источник инфекции - больной человек, который выделяет вирусы в окружающую среду с испражнениями и отделяемым дыхательных путей.
Инкубационный период составляет от 2 до 10 суток.
Госпитализация проводится по клиническим показаниям. В частности, при наличии менингеального синдрома и других поражениях нервной системы. Проводят противовоспалительную и дегидратационную терапию.
Раннее выявление заболевших
Изоляция заболевших на 2 недели
В очаге инфекции - дезинфекция
Детям до 3 лет, имевшим контакт с больными, вводится нормальный человеческий иммуноглобулин, в нос закапывается лейкоцитарный интерферон в течение 7 дней.
Инфекции, вызванные простейшими.
Лямблиоз.
Возбудитель инфекции - Lamblia intestinalis, относится к простейшим.
Источник инфекции - больной человек или цистоноситель. Источником цист могут быть собаки и другие животные.
Механизм передачи - фекально-оральный (через воду, пищевые продукты, предметы обихода, посуду).
Инкубационный период составляет 10-15 дней.
У больных отмечаются боли в верхней части живота или в области пупка, вздутие живота, урчание, тошнота, запоры, сменяющиеся поносами (испражнения жёлтые, с незначительной примесью слизи), дискинезии желчных путей, атопический дерматит, общая слабость, утомляемость, раздражительность, снижение аппетита, головные боли, головокружение, плохой сон.
Лечение направлено на ликвидацию токсикоза, противопаразитарная терапия, диета.
Своевременное выявление больных и их лечение
Защита продуктов от загрязнения
Борьба с мухами
Не использовать воду из открытых источников без предварительного кипячения
Мытье фруктов, овощей
Соблюдение правил личной гигиены.
Диагностика острых кишечных инфекций.
Диагноз устанавливается на основании клинических признаков болезни, результатов лабораторного обследования, эпидемиологического анамнеза.
Лечение острых кишечных инфекций.
При подозрении на острую кишечную инфекцию необходимо обратиться к инфекционисту, терапевту или педиатру. При значительных болях в животе у детей необходимо вызвать скорую помощь для исключения хирургической патологии. Дети раннего возраста подлежат обязательной госпитализации.
Симптомы, с которыми необходимо обратиться к врачу незамедлительно:
Жидкий стул чаще 5 раз в сутки
Схваткообразные боли в животе
Выраженная слабость и жажда
Наличие сопутствующих хронических инфекций.
Применять болеутоляющие средства. В случае хирургической патологии это затруднит диагностику
Самостоятельно применять противодиарейные средства, так как при большинстве кишечных инфекций токсины скапливаются кишечнике, а применение таких препаратов приведет к их накоплению
Использовать грелку. Это только усилит воспалительный процесс.
Профилактика острых кишечных инфекций.
Профилактика острых кишечных инфекций включает общегигиенические и медицинские мероприятия, проводимые постоянно, вне зависимости от времени года и от уровня заболеваемости.
Необходимо выявить источник инфекции, изолировать его и начать лечение. В помещении, где находился больной, провести дезинфекцию.
Основные меры личной профилактики:
Соблюдать правила личной гигиены: тщательно мыть руки перед приемом и раздачей пищи, после посещения туалета, улицы
Следить за чистотой рук у детей, научить их соблюдать правила личной гигиены
Употреблять для питья кипяченую или бутилированную воду
Выбирать безопасные продукты
Следить за сроками годности продуктов
Тщательно мыть овощи и фрукты перед употреблением под проточной, а для детей - кипяченой водой
Проводить тщательную термическую обработку необходимых продуктов
Употреблять пищу желательно сразу после её приготовления
Готовые продукты хранить на холоде, оберегая их от мух. Не оставлять готовые продукты при комнатной температуре более чем на 2 часа
Правильно хранить продукты в холодильнике: не допускать контакта между сырыми и готовыми продуктами (хранить в разной посуде)
Содержать кухню в чистоте
Не скапливать мусор
Выезжая на отдых, необходимо брать с собой запас чистой питьевой воды. Не употреблять воду из открытых источников
Купаться только в специально отведенных для этой цели местах. При купании в водоемах и бассейнах не допускать попадания воды в рот.
Меры общественной профилактики.
В целях профилактики острых кишечных инфекций осуществляется государственный санитарно-эпидемиологический надзор за соблюдением санитарных правил и норм на объектах производства, хранения, транспортировки и реализации (оптом и в розницу) пищевых продуктов, общественного питания, водоканала, независимо от форм собственности и ведомственной принадлежности; за соблюдением персоналом санитарных правил и норм в организованных коллективах детей и взрослых, в лечебно-профилактических учреждениях, санаториях, домах отдыха, домах престарелых и др.
Проводится обязательная гигиеническая подготовка работников отдельных профессий, производств и организаций, связанных непосредственно с процессом производства, приготовления, хранения, транспортировки и реализации пищевых продуктов, питьевой воды, обучением и воспитанием детей и подростков с выдачей им личных медицинских книжек.
Знакомьтесь с героиней нашего сегодняшнего повествования – синегнойной палочкой или Pseudomonas aeruginosa (P.aeruginosa).
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач-клинический фармаколог Трубачева Е.С.
Знакомьтесь с героиней нашего сегодняшнего повествования – синегнойной палочкой или Pseudomonas aeruginosa (P.aeruginosa).
.jpg)
И, воспользовавшись ситуацией, мы поговорим о микробиологической безопасности лечебных учреждений, ведь именно этот возбудитель до сих является одним из лидеров внутрибольничных инфекций, особенно в условиях реанимационных, хирургических, онкологических и ожоговых отделений, и, казалось бы, эта проблема не решаемая. О том, как победить этого зверя-убийцу и не разорится, мы сегодня и поговорим.
Микробиологические аспекты
Pseudomonas aeruginosa – это аэробная грамотрицательная палочка, с одним или двумя полярно расположенными жгутиками, которая может расти и размножаться и в анаэробных условиях.
Это один из немногих возбудителей, который угадывается в прямом смысле носом – инфицированная рана издает совершенно неповторимое амбрэ, которое не перепутаешь ни с чем, если услышал хотя бы один раз. Причем больной обнаруживается в прямом смысле по запаху от двери не то, что палаты, а от входа в лечебное отделение. Для тех, кто пока ни разу не сталкивался, – он слышится как запах сладкой карамели с аммиаком, вызывающий отчетливые рвотные позывы (хотя последнее строго индивидуально). Некоторые ощущают его как аромат жасмина в аммиаке. Запах очень специфический и способен играть серьезную диагностическую роль, а уж если к нему в дополнение идут сине-зеленые повязки, и это не вылитый ранее флакон зеленки, то перед вами на 99,9% рана, инфицированная P.aeruginosa. Согласитесь, это важно, особенно в условиях как недостатка микробиологических лабораторий, так и широкого распространения возбудителя в стационарах.
Дикая почвенная синегнойка, являющаяся родоначальницей всех внутрибольничных форм, будет выглядеть следующим образом. Как вы можете видеть, убить ее можно абсолютно всем с применением обычных терапевтических дозировок. (картинка 1)
В природе синегнойная палочка обитает в почве и воде, при этом она непривередлива в плане питательных веществ (в дистиллированной воде растет и размножается до 2,5 месяцев, хотя и снижает свою активность в десять раз). Поэтому идеальной средой ее обитания будет та локализация в организме, где темно, тепло и сыро, а именно – раны, нижние дыхательные пути, мочевыводящие пути и все те полости, в которые можно установить катетеры. Конечно, самостоятельно палочка туда не заползет, у нее нет ножек, зато мы – медицинский персонал, не соблюдая правила обработки рук и имея единственного больного в отделении, к концу смены обсеменим всех, особенно если в ординаторских и сестринских используются общие, а не одноразовые бумажные, полотенца.
P.aeruginosa очень любит, когда вокруг нее тепло (30 – 37 0 С), темно и сыро. Соответственно, самое чистое время года с точки зрения риска принести дикую уличную палочку в стационар – это зима. И если зимой в вашем на 100% чистом стационаре с внутренним микробиологическим контролем вдруг пациент, простите, завонял – ищите любителя-огородника с рассадой на подоконнике. Достаточно такому садоводу-огороднику один раз по приходу на работу не отмыть правильно руки и пойти на перевязку – больной с синегнойной (или ацинетобактерной, а то и вообще микст) инфекцией на ровном месте будет обеспечен. А если все остальные так же правильно не помыли руки или вытерлись общим полотенцем – чистый стационар очень быстро станет стационаром с синегнойкой.
Синегнойная палочка является активным пленкообразователем. В этом процессе участвует вырабатываемая микробом внеклеточная слизь, покрывающая саму клетку тонким слоем. Процесс пленкообразования условного возбудителя наглядно показан на данном видео. Как мы обсуждали ранее, микробы – это не статичные существа, которые всю жизнь питаются и размножаются, они способны вести достаточно бурную социальную жизнь, и синегнойная биопленка тому наглядный пример, поэтому о ней стоит поговорить поподробнее. Когда палочка прикрепляется к поверхности, она тут же образует монослой из микроколоний, покрытых экзополисахаридом. Затем бактерии образуют множество пилей, которыми скрепляются в том числе и друг с другом и вся структура образует полисахаридную матрицу. Когда биопленка созреет (это занимает в среднем неделю), то она становится эластичной и упругой, напоминая резину или силиконовую стельку, и точно так же обеспечивает защиту включенных в нее микроорганизмов от воздействий антибиотиков, антисептиков, дезенфектантов и иммунных клеток организма хозяина. При этом внутри самой биопленки бактерии активно обмениваются факторами вирулентности и антибиотикорезистентности и отшнуровывающиеся в последующем от пленки новые палочки будут обладать всем набором факторов защиты, характерным для материнской биопленки. Так выглядит один из способов получения вооруженной до зубов внутрибольничной микрофлоры, которая убивает пациентов и которую фактически невозможно убить в пациентах в виду как недоступности для действующих агентов (биопленка), так и в виду наличия механизмов антибиотикорезистентности, вплоть до металло-бета-лактамаз, разрушающих все до одного существующих антибиотика и большое число антисептиков и дезенфектантов.
Почему же P.aeruginosa так полюбила больницы? Да потому что здесь, в отличие от дикой среды обитания, для нее созданы идеальные условия, как в плане климата и питательных веществ, так и в плане окружения – зверю практически не требуется бороться за свое выживание с другой микрофлорой, фактически всегда за счет своих свойств синегнойка получает селективное преимущество перед другими возбудителями, которых успешно травят антисептиками, антибиотиками, заключительной дезинфекцией и УФ-излучением, оставляя сегодняшней героине расчищенную от конкурентов территорию.
Где же в стационаре создаются условия для размножения и распространения инфекции? Для этого необходимо знать следующие свойства P.aeruginosa:
Таким образом, исходя из вышесказанного, любимыми местами обитания в стационарах являются все то, что создает оптимальную для обитания теплую и влажную среду, а именно:
- краны, раковины, кафель и стыки между ними у раковин и моек, сан. узлы, тряпочные общие полотенца ординаторских и сестринских
- медицинское оборудование, создающее теплую и влажную среду (аппараты ИВЛ, наркозные аппараты, аппараты для проведения диализа, испарители всех типов)
- кондиционеры открытого типа, хотя и за сплит-системами необходим постоянный уход и дезинфекция
- посуда для сдачи анализов
- руки мед. персонала
- общие, а не одноразовые полотенца
То есть любимыми отделениями для обитания в стационаре будут ожоговые и хирургические (практически все, а не только гнойная хирургия и травматология), отделения реанимации и интенсивной терапии и хирургический блок. Особняком стоят пульмонологические отделения с пациентами с муковисцидозом и онкологические стационары. При этом синегнойка может оказаться совершенно в любом отделении, переехав туда на руках медицинского персонала и разбежавшись по больным уже через тамошнее общее полотенце. Поэтому первый и главный шаг на пути борьбы с распространением синегнойной инфекции – это наши руки, точнее, правильная их обработка. После КАЖДОГО пациента. И не протирание полотенчиком на обходе, а полноценное мытье, после которого хотя бы самому себе можно сказать, что уж ты-то точно сделал все, что было возможно.
Клинические аспекты
Какие пациенты более всего чувствительны к P.aeruginosa и когда вообще ждать именно ее:
Какую патологию чаще всего вызывает (а лучше сказать, осложняет) P.aeruginosa
То есть почти любая область поражения и это говорит нам о крайней необходимости микробиологической диагностики, так как почти точно такой же набор может вызвать нозокомиальный золотистый стафилококк или ацинетобактер.
Эпидемиологические аспекты
Как уже выше было неоднократно сказано – P.aeruginosa умеет поражать практически все, до чего сможет добраться, а уж убивать, да в своих нозокомиальных формах, когда из биопленок вылупились и распространились супермутанты, тем более. Вопрос в том, что делать, ведь ситуация кажется безнадежной. Но это не так.
Вылечить больных мы, конечно, можем, но только в том случае, если перед нами дикая и непуганая P.aeruginosa с улицы. Если случилось так, что в вашем стационаре она живет годами и смогла инфицировать пациента (а сама она не может, ее надо донести на чьих-то медицинских руках или до пациента, или до аппарата, который используется у этого пациента), то тут фармакология почти бессильна, так как внутрибольничные палочки умеют разрушать все до одного антибиотика, имеющегося на рынке, а новых уже лет 10 не было, и неизвестно когда будут, если вообще будут. Поэтому единственным барьером встает эпидемиологический надзор. Причем синегнойку, в отличие от фекальной микрофлоры, из стационара выбить можно полностью, так как в норме она не является элементом нормальной микрофлоры человека, как та же кишечная палочка, клебсиелла или энтерококки, то есть в людях в норме она не живет.
Почему в этой статье нет антибиотикограмм устойчивых форм? Ответ до банальности прост – автор долгое время проработала в стационаре, свободном от синегнойки. Это достижимо, и от P.aeruginosa можно освободится даже в самом запущенном случае, что не будет стоить колоссальных денег, при том, что в перспективе высвобождаются действительно серьезные средства, которые ежегодно тратятся на тушение пожара антибиотиками, что в случае внутрибольничных инфекций равноценно тушению бензином. Для достижения полного антисинегнойного эффекта необходимо:
- Правильно мыть руки после каждого пациента
- Менять перчатки после каждого пациента (вместе с мытьем рук)
- Прекратить практику использования общих полотенец и полотенец на обходе
- Ввести тотальный микробиологический мониторинг
- Если есть эпидемиолог, с него требовать доступ к антисептикам и дезенфектантам нескольких видов, а также постоянное наличие одноразовых расходных материалов (это его вопрос, как он будет с начальством договариваться, но все одноразовое обязано быть одноразовым и в достаточных количествах – так как отодрать синегнойную пленку обычными методами, как вы видели, фактически нереально)
- В идеале всю группу антисинегнойных препаратов необходимо вывести из общебольничного оборота и назначать только специально обученным клиническим фармакологом. Таким образом, удастся снизить антимикробную нагрузку на внутрибольничную флору, уменьшить ее селективность и снизить вероятность селекции нозокомиальных штаммов самой P.aeruginosa
В заключении хотелось бы отметить еще раз – данная статья не про то, как победить синегнойку голыми руками антибиотиками. Этого еще пока никому не удавалось, так как проблема не в одном больном с диким возбудителем. От антибиотиков в этом деле зависит процента два в лучшем случае (приблизительно столько диких форм к вам может прийти за год). Проблема носит глубокий системный характер, и без усилий по освобождению всего стационара от P.aeruginosa, использование только и исключительно антибиотиков на каждый случай, особенно внутрибольничного инфицирования, будет сизифовым трудом с соответствующим печальным результатом.
Читайте также:

