Респираторная поддержка при септическом шоке
Обновлено: 10.05.2024
Септический шок — это системная патологическая реакция на тяжелую инфекцию. Ее характеризуют лихорадка, тахикардия, тахипноэ, лейкоцитоз при идентификации очага первичной инфекции. При этом микробиологическое исследование крови нередко выявляет бактериемию. У части пациентов с синдромом сепсиса бактериемии не выявляют. Когда составляющими синдрома сепсиса становятся артериальная гипотензия и множественная системная недостаточность, то констатируют развитие септического шока.
Причины и патогенез развития септического шока:
Частота сепсиса и септического шока неуклонно возрастает с тридцатых годов прошлого века и, по-видимому, будет продолжать возрастать.
Тому причинами являются:
1. Все более широкое использование для интенсивной терапии инвазивных устройств, то есть внутрисосудистых катетеров и др.
2. Распространенное применение цитотоксических и иммуносупрессивных средств (при злокачественных заболеваниях и трансплантациях), которые вызывают приобретенный иммунодефицит.
3. Рост продолжительности жизни больных сахарным диабетом и злокачественными опухолями, у которых высок уровень предрасположенности к сепсису.
Бактериальная инфекция — это наиболее частая, причина септического шока. При сепсисе первичные очаги инфекции чаще локализованы в легких, органах живота, брюшине, а также в мочевыводящих путях. Бактериемию выявляют у 40-60% больных в состоянии септического шока. У 10-30% больных в состоянии септического шока невозможно выделить культуру бактерий, действие которых вызывает септический шок. Можно предположить, что септический шок без бактериемии — это результат патологической иммунной реакции в ответ на стимуляцию антигенами бактериального происхождения. По-видимому, данная реакция сохраняется после элиминации из организма патогенных бактерий действием антибиотиков и других элементов терапии, то есть происходит ее эндогенизация.
В основе эндогенизации сепсиса могут лежать многочисленные, усиливающие друг друга и реализуемые через выброс и действие цитокинов, взаимодействия клеток и молекул систем врожденного иммунитета и, соответственно, иммуно-компетентных клеток.
Сепсис, системная воспалительная реакция и септический шок — это следствия избыточной реакции на стимуляцию бактериальными антигенами клеток, осуществляющих реакции врожденного иммунитета. Избыточная реакция клеток систем врожденного иммунитета и вторичная по отношению к ней реакция Т-лимфоцитов и В-клеток вызывают гиперцитокинемию. Гиперцитокинемия — это патологический рост содержания в крови агентов ауто- паракриннои регуляции клеток, осуществляющих реакции врожденного иммунитета и приобретенные иммунные реакции.
При гиперцитокинемии в сыворотке крови аномально возрастает содержание первичных провоспалительных цитокинов, фактора некроза опухолей-альфа и интерлейкина-1. В результате гиперцитокинемии и системной трансформации нейтрофилов, эндотелиальных клеток, мононуклеарных фагоцитов и тучных клеток в клеточные эффекторы воспаления во многих органах и тканях возникает лишенный защитного значения воспалительный процесс. Воспаление сопровождается альтерацией структурно-функциональных элементов органов-эффекторов.
Критический дефицит эффекторов обуславливает множественную системную недостаточность.
Симптомы и признаки септического шока:
О развитии системной воспалительной реакции говорит наличие двух или более следующих признаков:
• Температура тела более высокая, чем 38 о С, или на уровне ниже 36 о С.
• Частота дыханий выше 20/минуту. Дыхательный алкалоз при напряжении углекислого газа в артериальной крови ниже 32 мм рт. ст.
• Тахикардия при частоте сердечных сокращений большей 90/минуту.
• Нейтрофилия при росте содержания полиморфноядерных лейкоцитов в крови до уровня выше 12х10 9 /л, или нейтропения при содержании нейтрофилов в крови на уровне ниже 4х10 9/ л.
• Сдвиг лейкоцитарной формулы, при котором палочкоядерные нейтрофилы составляют более 10% общего числа полиморфноядерных лейкоцитов.
О сепсисе свидетельствуют два или более признаков системной воспалительной реакции при подтвержденном данными бактериологических и других исследований наличии патогенных микроорганизмов во внутренней среде.
Течение септического шока
При септическом шоке гиперцитокинемия повышает активность синтетазы оксида азота в эндотелиальных и других клетках. В результате снижается сопротивление резистивных сосудов и венул. Снижение тонуса данных микрососудов уменьшает общее периферическое сосудистое сопротивление. Часть клеток организма при септическом шоке страдает от ишемии, обусловленной расстройствами периферического кровообращения. Расстройства периферического кровообращения при сепсисе и септическом шоке — это следствия системной активации эндотелиоцитов, полиморфоядерных нейтрофилов и мононуклеарных фагоцитов.
Воспаление данного генеза имеет сугубо патологический характер, происходит во всех органах и тканях. Критическое падение числа структурно-функциональных элементов большинства органов-эффекторов составляет основное звено патогенеза так называемой множественной системной недостаточности.
Согласно традиционным и верным представлениям, сепсис и системную воспалительную реакцию вызывает патогенное действие грамотрицательных микроорганизмов.
В возникновении системной патологической реакции на инвазию во внутреннюю среду и кровь грамотрицательных микроорганизмов определяющую роль играют:
• Эндотоксин (липид А, липополисахарид, ЛПС). Этот термостабильный липополисахарид составляет наружное покрытие грамотрицательных бактерий. Эндотоксин, воздействуя на нейтрофилы, вызывает высвобождение полиморфноядерными лейкоцитами эндогенных пирогенов.
• ЛПС-связывающий белок (ЛПССБ), следы которого определяют в плазме в физиологических условиях. Данный протеин образует с эндотоксином молекулярный комплекс, циркулирующий с кровью.
• Рецептор клеточной поверхности мононуклеарных фагоцитов и эндотелиальных клеток. Его специфическим элементом является молекулярный комплекс, состоящий из ЛПС и ЛПССБ (ЛПС-ЛПССБ).
В настоящее время растет частота сепсиса, обусловленного инвазией во внутреннюю среду грамположительных бактерий. Индуцирование сепсиса грамположительными бактериями обычно не связано с высвобождением ими эндотоксина. Известно, что предшественники пептидогликана и другие компоненты стенок грамположительных бактерий вызывают высвобождение клетками систем иммунитета фактора некроза опухолей-альфа и интерлейкина-1. Пептидогликан и другие компоненты стенок грамположительных бактерий активируют систему комплемента по альтернативному пути. Активация системы комплемента на уровне всего организма вызывает системное патогенное воспаление и вносит свой вклад в эндотоксикоз при сепсисе и системной воспалительной реакции.
Ранее считалось, что септический шок всегда вызывается эндотоксином (липополисахаридом бактериального происхождения), который высвобождается грамотрицательными бактериями. Теперь общепризнанным является тот факт, что менее чем в 50% случаев септический шок вызывается грамположительными возбудителями.
Расстройства периферического кровообращения при септическом шоке, адгезия активированных полиморфоядерных лейкоцитов к активированным эндотелиоцитам — все это ведет к выходу нейтрофилов в интерстиций и воспалительной альтерации клеток и тканей. Одновременно эндотоксин, фактор некроза опухолей-альфа, а также интерлейкин-1 повышают образование и высвобождение эндотелиальными клетками тканевого фактора свертывания. В результате активируются механизмы внешнего гемостаза, что вызывает отложение фибрина и диссеминированное внутрисосудистое свертывание.
Артериальная гипотензия при септическом шоке в основном представляет собой следствие снижения общего периферического сосудистого сопротивления. Гиперцитокинемия и рост концентрации в крови оксида азота при септическом шоке обуславливает расширение артериол. При этом посредством тахикардии компенсаторно растет минутный объем кровообращения. Артериальная гипотензия при септическом шоке возникает, несмотря на компенсаторный рост минутного объема кровообращения. Общее легочное сосудистое сопротивление при септическом шоке растет, что можно отчасти связать с адгезией активированных нейтрофилов к активированным эндотелиоцитам легочных микрососудов.
Выделяют следующие основные звенья патогенеза расстройств периферического кровообращения при септическом шоке:
1)рост проницаемости стенки микрососудов;
2) рост сопротивления микрососудов, который усиливается клеточной адгезией в их просвете;
3) низкая реакция микрососудов на вазодилатирующие влияния;
4) артериоло-венулярное шунтирование;
5) падение текучести крови.
Гиповолемия — это один из факторов артериальной гипотензии при септическом шоке.
Выделяют следующие причины гиповолемии (падения преднагрузки сердца) у больных в состоянии септического шока:
1) дилатация емкостных сосудов;
2) потеря жидкой части плазмы крови в интерстиций из-за патологического роста проницаемости капилляров.
Можно считать, что у большинства больных в состоянии септического шока падение потребления кислорода организмом преимущественно обусловлено первичными нарушениями тканевого дыхания. При септическом шоке умеренный лактатный ацидоз развивается при нормальном напряжении кислорода в смешанной венозной крови.
Лактатный ацидоз при септическом шоке считают следствием снижения активности пируватдегидрогеназы и вторичной аккумуляции лактата, а не падения тока крови на периферии.
Расстройства периферического кровообращения при сепсисе носят системный характер и развиваются при артериальной нормотензии, которую поддерживает рост минутного объема кровообращения. Системные нарушения микроциркуляции проявляют себя снижением рН в слизистой оболочке желудка и падением насыщения кислородом гемоглобина крови в печеночных венах. Гипоэргоз клеток кишечного барьера, действие иммуносупрессивных звеньев патогенеза септического шока — все это снижает защитный потенциал кишечной стенки, что служит еще одной из причин эндотоксемии при септическом шоке.
Диагноз септического шока
- Септический шок - сепсис (синдром системной воспалительной реакции плюс бактериемия) в сочетании со снижением АД сист. менее 90 мм рт. ст. при отсутствии видимых причин для артериальной гипотензии (дегидратация, кровотечение). Наличие признаков гипоперфузии тканей несмотря на проведение инфузионной терапии. Перфузионные нарушения включают ацидоз, олигурию, острые нарушения сознания. У пациентов, получающих инотропные препараты, перфузионные нарушения могут сохраняться при отсутствии артериальной гипотензии.
- Рефрактерный септический шок - септический шок, продолжающийся более одного часа, рефрактерный к инфузионной терапии.
Лечение септического шока:
1. Инфузионная терапия
- Катетеризация двух вен.
- 300-500 мл раствора кристаллоидов в/в в виде болюса, затем 500 мл раствора кристаллоидов в/в капельно в течение 15 минут. Оценить венозную гипертензию и наличие сердечной декомпенсации.
- При наличии сердечной недостаточности целесообразна катетеризация a. pulmonalis катетером Swan-Ganz для оценки волемического статуса: оптимальное PCWP = 12 мм рт. ст. при отсутствии ОИМ и 14-18 мм рт. ст. при наличии ОИМ;
- если после инфузионного болюса величина PCWP превысит 22 мм рт. ст., то следует предположить прогрессирование сердечной недостаточности и прекратить активную инфузию кристаллоидов.
- Если, несмотря на высокие значения давления заполнения левого желудочка, артериальная гипотензия сохраняется - допамин 1-3-5 и более мкг/кг/мин, добутамин 5- 20 мкг/кг/мин.
- Бикарбонат натрия в расчетной дозе с целью коррекции метаболического ацидоза.
2. Терапия гипоксемии/РДСВ - оксигенотерапия, ИВЛ с использование PEEP.
3. Терапия сниженной контрактильной способности миокарда - строфантин К 0,5 мг 1-2 раза в сутки в/в в 10-20 мл 5- 20 %-ного раствора глюкозы или физиологического раствора; дигоксин 0,25 мг 3 раза в сутки per os в течение 7- 10 суток, затем 0,25-0,125 мг в сутки; добутамин 5- 20 мкг/кг/мин в/в.
6. Эмпирическая антибиотикотерапия (учитывается локализация источника септического процесса и предполагаемый спектр возможных микроорганизмов).
7. Хирургическое дренирование очагов инфекции.
8. Препараты, эффективность которых не подтверждена:
Септический шок является осложнением многих заболеваний, связанных с инфекцией, особенно хирургических. В нашей практике септический шок встречается при лечении больных с диабетической флегмоной, гангреной. Иногда сепсис развивается у пациентов с нагноением сосудистых протезов.
Наиболее тяжелым течением сепсис отличается при развитии госпитальной инфекции, когда процесс развивается, как осложнение после проведенных операций. Для предупреждения подобного осложнения применяются меры асептики и антисептики, профилактическое назначение антибиотиков.
Мониторинг жизненно важных функций при сепсисе. Поддержание адекватного газообмена при сепсисе.
Больные с тяжелым сепсисом или септическим шоком должны быть транспортированы в ОРИТ, так как они нуждаются не только в проведении интенсивной терапии, но и динамическом мониторинге нарушенных витальных функций. Объем мониторинга зависит от возможностей ЛПУ и, как правило, включает неинвазивное определение систолического, диастолического, среднего артериального давления, ЧСС, пульса, частоты дыхания, сатурации крови, температуры тела.
Обеспечение надежного сосудистого доступа, достигаемое катетеризацией подключичной вены, непременно должно сопровождаться оценкой ЦВД, забором крови для посева на гемокультуру и лабораторных исследован™, включающих определение уровней гемоглобина, эритроцитов, лейкоцитов с подсчетом ЛИИ, гематокрита, общего белка и его фракций, глюкозы, трансаминаз, билирубина, азотемии. Обязательным являются также исследования состояния гомеостаза (коагуло-грамма), кислотно-основного равновесия, оценка уровня содержания электролитов в крови.
Мониторинг показателей центральной гемодинамики достигается выполнением интегральной реографии тела по М. И. Тищенко или катетеризацией легочной артерии катетером Свана-Ганца, что позволяет у больного с септическим шоком в динамике оценивать ударный объем и расчетным путем определять сердечный выброс (СВ), сердечньш индекс (СИ), общее периферическое сопротивление сосудов (ОПСС) и другие показатели, давление заклинивания легочных капилляров (ДЗЛК), О ЦК, оксигенацию смешанной венозной крови (Sv02).
Контроль темпа диуреза осуществляется путем установки в мочевом пузыре катетера Фолея.
Поддержание адекватного газообмена
Адекватная и своевременная респираторная поддержка - один из основополагающих компонентов терапии сепсиса и септического шока, позволяющий наряду с поддержанием кислородного транспорта и снижением работы дыхания, уменьшить скорость реакции цитокинового каскада.
Проведение оксигенотерапии требует тщательной санации трахеобронхиального дерева и обеспечения проходимости дыхательных путей. Если после эвакуации мокроты из трахеобронхиального дерева и устранения бронхообструкции признаки ОДН сохраняются, то это указывает на паренхиматозный характер ОДН и диктует необходимость дополнительных лечебных мероприятий.
Оксигенотерапия начинается с ингаляции увлажненного кислорода через носовые катетеры или лицевую маску, что позволяет довести Fi02 до 0,4-0,6.
Ингаляция 100% кислорода может осуществляться только непродолжительное время, так как высокие концентрации кислорода за счет токсического действия способствуют развитию респираторного дистресс-синдрома.
Нарушение сознания у больного, выраженное тахипноэ (более 40 в минуту) с участием вспомогательной мускулатуры, патологические ритмы дыхания являются показанием для интубации трахеи и перевода больного на управляемую ИВЛ. Клинические показания к переводу на ИВЛ должны быть дополнены инструментальными, к которым относятся рост Р(А-а)02 выше 350 мм рт. ст., уменьшение Ра02 ниже 70 мм рт. ст., снижение отношения Pa02/Fi02 менее 180 мм рт. ст., увеличение РаС02 более 50 мм рт. ст., полученные на фоне ингаляции 100% кислорода.
Следует обратить внимание на важность инструментальных показаний к ИВЛ у больных с септическим шоком, так как респираторная поддержка должна начинаться как можно раньше, до клинических проявлений нарушения равновесия между состоянием легочного газообмена и компенсаторными возможностями /организма, нарушение которых ведет к значительному ухудшению транспорта и потребления кислорода.
ИВЛ у больных септическим шоком проводится в режиме PEEP до 5-7 см H2О, Vt = 6,0-7,5 мл/кг и частотой дыхания до 16 в минуту. В случае развития респираторного дистресс-синдрома ИВЛ осуществляется в режиме "защиты легких": Vt = 4-6 мл/кг, PEEP - 10-15 см Н2О, Ppeak -менее 35 см Н2О, FiO2 менее 0,65, частота дыхания - 18 в минуту с тем, чтобы поддерживать РаС>2 на уровне не менее 80 мм рт. ст. и Sp02 не менее 90% Синхронизация больного с респиратором достигается внутривенным введением оксибутарата натрия в дозе 100-120 мг/кг.
Нормализацию кислородного потока в организме больного необходимо сочетать со снижением повреждающего Действия тканевой гипоксии. С этой целью используются антигипоксанты, которые либо снижают потребление кислорода, либо улучшают его утилизацию. Дозировки антигипоксантов представлены в таблице.
На адекватность респираторной поддержки у больных с септическим шоком указывает стабилизация пороговых значений кислородного потока в организме: SpO2 не менее 90%, доставка кислорода на уровне 570-600 мл/мин, потребление кислорода на уровне 170— 180 мл/мин при среднем артериальном давлении более 70-75 мм рт. ст., а также энергетическая стабилизация клеток организма, оцениваемая по снижению уровней лактата (до 2,0 ммоль/л), глюкозы (5,5-7,0 ммоль/л) и пирувата (до 30-40 Ед/л).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Респираторная поддержка при сепсисе - показания к ИВЛ
Дыхательные нарушения у больных сепсисом имеют сложный комплексный характер. По современным представлениям, спектр дыхательных нарушений при сепсисе является очень широким — от острого легочного повреждения (ОЛП) до острого респираторного дистресс-синдрома (ОРДС). ОЛП развивается примерно у 40 % больных сепсисом, ОРДС — у 25—42 %, причем частота возрастает при развитии артериальной гипотензии. В 1994 г. на согласительной евро-американской конференции по ОРДС было разработано унифицированное определение ОЛП и ОРДС.
Именно снижение величины дыхательного коэффициента положено в основу разделения респираторного дистресс-синдрома и острого легочного повреждения.
Эти критерии позволяют производить более точную эпидемиологическую оценку, несмотря на варьирование абсолютного количества случаев в пределах от 5 до 71 на 100 000 населения.
В 1988 г. была опубликована шкала легочных повреждений, которая позволяет не только разделить пациентов по тяжести повреждения, но и имеет прогностическое значение. Первоначальная оценка более 3,5 балла коррелировала с выживанием только 18 % пациентов, 2,5—3,5 — 30 %, 1,1— 2,4 - 59 %, а оценка ниже 1,1 балла — 66 %.
Критерии ОЛП и ОРДС
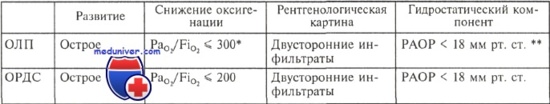
* PaО2/FiО2 — дыхательный коэффициент: отношение давления кислорода в артериальной крови к концентрации кислорода во вдыхаемом воздухе.
** РАОР —давление заклинивания в легочной артерии.
Дыхательная недостаточность является ведущим компонентом полиорганной дисфункции и недостаточности у больных сепсисом. Потребность в респираторной поддержке возникает у больных тяжелым сепсисом и септическим шоком. Сложность проблемы заключается в развитии тяжелого интерстициального отека и последующего повреждения легочной ткани, которые приводят к снижению эффективности переноса газов через альвеолярную мембрану легких.
Инсуфляция кислорода в дыхательные пути с помощью носовых катетеров или маски оказывает положительное влияние только на начальных стадиях острого легочного повреждения. Нарастание интерстициального отека легких приводит к тому, что обычно функционирующий объем альвеол оказывается недостаточным, и возникает необходимость в проведении ИВЛ с созданием положительного давления в дыхательных путях для увеличения объема участвующих в дыхании альвеол, однако создание высокого давления опасно развитием баротравмы легких.
Повышение содержания кислорода во вдыхаемом воздухе также имеет свои пределы из-за токсического действия кислорода на альвеолярную мембрану, нарушения синтеза сурфактанта (белок, поверхностно активное вещество, предупреждающее спадение альвеол) и возникновение других проблем. В тяжелых случаях респираторного дистресс-синдрома для обеспечения жизненнонеобходимых параметров вентиляции приходится прибегать к методам ИВЛ, которые находятся далеко за параметрами физиологического дыхания, требуют применения специального оборудования и тщательного многофакторного контроля.
Балльные шкалы острого легочного повреждения, респираторного дистресс-синдрома, степени легочного повреждения служат объективными показателями, на основании которых определяется тактика лечения и прогноз исхода заболевания у больных с наличием острой дыхательной недостаточности, развившейся в результате сепсиса. Рандомизированные исследования являются основой доказательной медицины. Однако проведение достаточных по репрезентативности рандомизированных исследований требует жесткой систематизации медицинских знаний. До получения данных рандомизированных исследований во многих областях медицины практические рекомендации могут содержать разделы, которые отражают мнение экспертов в определенной области, как правило, основанных на современных данных. Следование этим рекомендациям является хорошим тоном, но не обязательным с точки зрения доказательной медицины. Настоящий раздел содержит рекомендации по особенностям лечения острой дыхательной недостаточности больных сепсисом, основанные на данных нерандомизированных исследований.
Шкала легочного повреждения (общая сумма баллов делится на количество выявленных компонентов)
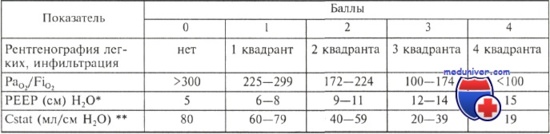
* PEEP — положительное давление в дыхательных путях в конце выдоха (произвольный параметр проведения ИВЛ).
** Cstat — растяжимость легочной ткани при определенных параметрах тестирования.
Адекватная респираторная поддержка улучшает оксигенацию и результаты лечения больных сепсисом
В некоторых случаях адекватная оксигенация (показатель сатурации О2 выше 90 %) может быть достигнута с помощью инсуфляции кислорода через назальную канюлю или лицевую маску. Эндотрахеальная интубация применяется для создания постоянного положительного давления в конце выдоха (PEEP), повышения среднего давления в дыхательных путях и снижения концентрации кислорода во вдыхаемом воздухе (FiО2
Целью респираторной терапии является достижение адекватной доставки кислорода в ткани, испытывающие гипоксию, в условиях нарушенной микроциркуляции.
При проведении ИВЛ изменением различных параметров можно добиваться различного давления на вдохе и достигать различных результатов лечения. Показатели измерения ок-сигенации методом пульоксиметрии (определение насыщения кислорода в крови с помощью специального датчика, надеваемого на ногтевое ложе пальцев рук) обычно хорошо коррелируют с насыщением артериальной крови кислородом.
Однако у 7 % пациентов такой корреляции не наблюдается из-за выраженной тахикардии, низкого сердечного индекса или высокого давления заклинивания легочной артерии (определяемого с помощью катетера Сван-Ганса, установленного в устье легочной артерии).
У таких больных необходимо проводить мониторинг оксигенации артериальной крови и поддерживать сатурацию на уровне 88—90 % (что соответствует насыщению артериальной крови кислородом на уровне 60 мм рт. ст.) с концентрацией кислорода во вдыхаемой смеси (FiО2) ниже 60 %.
Необходимо избегать применения неинвазивной вентиляции с положительным давлением у больных сепсисом
Метод неинвазивной вентиляции легких с положительным давлением заключается в применении специальной герметичной лицевой маски, позволяющей точно дозировать концентрацию кислорода во вдыхаемом воздухе и создавать положительное давление в дыхательных путях. Этот метод является эффективным у небольшой группы пациентов в сознании без увеличения бронхиальной секреции на ранних этапах развития дыхательной недостаточности (менее 72 ч), что редко бывает при ОЛП/ОРДС. Задержка дыхания с началом ИВЛ может быть причиной развития осложнений, поэтому применение этого метода не рекомендуется для больных сепсисом.
Интубация трахеи не влияет на исход лечения больных сепсисом, в то время как проведение ИВЛ достоверно улучшает результаты лечения больных с сепсисом и дыхательной недостаточностью. Показания к интубации трахеи и началу проведения ИВЛ у больных с сепсисом основаны на стандартных клинических признаках дыхательной недостаточности. Показанием для начала ИВЛ являются: тахипноэ (частота дыхания более 40 в минуту), включение в акт дыхания дополнительной мускулатуры, нарушение сознания, тяжелая гипоксемия, которая не может быть компенсирована инсуфляцией кислорода.
При ОЛП/ОРДС поддержание нормального уровня рН и содержания углекислоты в артериальной крови (Расо2) необязательно. Применение умеренной гиперкапнии позволяет снижать дыхательный объем у пациентов с ОЛП/ОРДС, которым проводится ИВЛ, что позволяет снизить высокое давление на воохе, риск баро-и волюмотравмы легких. Выбор параметров ИВЛ, который позволяет снизить дыхательный объем и объем минутной вентиляции для предотвращения чрезмерного растяжения альвеол и повреждения легочной ткани у больных сепсисом, приводит к повышению концентрации углекислоты в артериальной крови (Расо2). Безопасность и эффективность применения ИВЛ с гиперкапнией были показаны в серии некрупных исследований.
До настоящего времени допустимый верхний предел концентрации углекислоты в артериальной крови точно не определен. Накопление углекислоты приводит к пропорциональному снижению рН артериальной крови. Считается необходимым поддерживать параметры ИВЛ, которые бы обеспечивали адекватную оксигенацию крови и не способствовали снижению рН крови ниже 7,2. Применение таких параметров ИВЛ не сопровождалось развитием осложнений и приводило к снижению летальности больных сепсисом.
Применение низкого дыхательного объема улучшает результаты лечения ОЛП, а вентиляция с ограничением по давлению не способствует улучшению результатов лечения ОЛП. При применении ИВЛ у больных с ОЛП необходимо использовать небольшие дыхательные объемы (примерно 6 мл/кг идеальной массы тела) для поддержания плато давления в конце выдоха ниже 30 см Н2О. Крупные исследования по сравнению влияния разных дыхательных объемов на уровень инспираторного давления дали различные результаты, причем причина этих различий до настоящего времени непонятна. В недавнем крупном исследовании больных с ОЛП было показано, что общая летальность снизилась на 10 % в группе пациентов, которым проводилась ИВЛ с дыхательным объемом 6 мл/кг идеальной массы тела. Эта методика недавно была поддержана группой международных экспертов.
Применение ИВЛ в положении на животе позволяет улучшить газообмен пациентов с ОЛП, однако не доказано его положительного влияния на исходы лечения больных сепсисом. Применение ИВЛ в положении пациента на животе способствует дополнительному включению в дыхание задненижних отделов легких. Показанием к применению этого метода является тяжелый ОРДС с необходимостью применения высоких концентраций кислорода во вдыхаемой смеси (FiО2 > 60 %). Ограничением для его применения являются наличие противопоказаний и отсутствие опыта проведения ИВЛ в этом положении у персонала ОРИТ. В некрупных рандомизированных исследованиях были доказаны физиологические преимущества этого метода ИВЛ, заключавшиеся в повышении оксигенации крови у 65 % больных с ОЛП/ОРДС.
Улучшение газообмена наблюдалось даже спустя 18 ч после перекладывания пациента на спину. Однако ограниченное количество пациентов и отсутствие четких показаний, методики применения и оценки эффективности снижают его привлекательность.
Ингаляция оксида азота влияет на оксигенацию, но не влияет на результаты лечения больных с ОЛП/ОРДС. Оксид азота (NО) является физиологическим регулятором базального тонуса сосудов. Известно, что физиологическим ответом на гипоксию является спазм сосудов легких. Вдыхание оксида азота может оказывать мощное сосудорасширяющее действие на легочные сосуды и улучшать оксигенацию. Именно поэтому были проведены исследования, которые подтвердили, что ингаляция оксида азота улучшала оксигенацию и способствовала снижению отека легких у больных с ОЛП/ОРДС путем влияния на гидростатическое давление.
Однако улучшение оксигенации и снижение отека легких не приводило к достоверному снижению летальности, поэтому рекомендуется ограничить применение оксида азота у пациентов с тяжелой гипоксемией, представляющей угрозу для жизни, которая не может быть компенсирована применением обычных методов ИВЛ. До настоящего времени нет определенных рекомендаций по рациональному применению инфузионной терапии у больных ОЛП/ОРДС. Из-за отсутствия данных сравнительных исследований, посвященных инфузионной терапии, нет жестких правил применения кристаллоидных и коллоидных препаратов. У больных с ОЛП/ОРДС и синдромом высокой сосудистой проницаемости следует комбинировать применение кристаллоидных и коллоидных растворов во избежание избыточной гидратации легких. Коллоидные растворы рационально назначать пациентам с низким онкотическим давлением крови. Нет рекомендаций по оптимальному объему инфузионной терапии несмотря на то, что с момента открытия этого синдрома дискуссии в отношении инфузионной терапии были очень острыми. Имеются противоречивые мнения экспертов относительно пользы коллоидных и кристаллоидных растворов.
Считается, что для разрешения актуальных вопросов требуется более пристальное внимание специалистов и проведение крупных исследований в этой области.
Применение кортикостероидных гормонов не показано для профилактики и лечения ранней (экссудативной) фазы ОРДС. В отношении лечения поздней (фибропролиферативной) фазы ОРДС данных пока недостаточно. Не рекомендуется применять кортикостероидные гормоны пациентам с высоким риском или наличием критериев ОЛП/ОРДС. Не получено данных, подтверждающих пользу применения кортикостероидных гормонов для профилактики и раннего лечения ОРДС. Эффективность применения кортикостероидов в более поздней фазе ОРДС в настоящее время изучается.
Ежедневная тренировка спонтанного дыхания и следование протоколу отлучения пациентов от ИВЛ снижает продолжительность ИВЛ. Всем пациентам с приемлемым уровнем респираторной поддержки и стабильным состоянием рекомендуется ежедневно производить оценку возможности самостоятельного дыхания. Для выявления пациентов, способных к самостоятельному дыханию, необходимо проводить короткий скрининг и тренировать самостоятельное дыхание. Из процесса скрининга исключаются пациенты, нуждающиеся в проведении ИВЛ. Основными критериями, указывающими на возможность начала отлучения от ИВЛ, являются: снижение потребности в концентрации кислорода во вдыхаемом воздухе ниже 50 % (FiО2
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Читайте также:

