Ротавирус и повышен соэ
Обновлено: 25.04.2024
В статье приведен обзор существующих подходов к оценке гематологических показателей у детей с острыми респираторными вирусными инфекциями и представлен инновационный метод их оценки, позволяющий наиболее точно определить степень тяжести заболевания у дете
Characteristics of hematological indices in acute respiratory diseases in children of different age groups
The article gives a review of the present approaches to the evaluation of hematological indices in children with acute respiratory viral infections. An innovative method of their evaluation which allows to define the level of severity of the disease in children of different age groups, was presented.
С целью оптимизация тактики лечения актуальными являются: стандартизация методик оценки клинико-лабораторных показателей при ОРИ; установление особенностей лабораторных показателей при ОРИ различной этиологии; оценка риска развития бактериальных осложнений и разработка прогностических критериев.
Традиционно в клинической практике проводится оценка гематологических показателей, в том числе в динамике. Особую значимость такая оценка приобретает при ведении пациентов с инфекционной патологией, учитывая выраженную реакцию гемограммы на инфекционный процесс и ее изменчивость в процессе лечения. В остром периоде заболевания, как правило, отмечаются существенные изменения показателей лейкоцитарной формулы, некоторых биохимических и серологических данных, при этом эти изменения могут носить разнонаправленный характер в зависимости от вида возбудителя, формы тяжести заболевания и возраста пациента.
Одним из наиболее перспективных направлений анализа гематологических показателей является приведение множества отдельных параметров к единому математическому значению, что позволяет стандартизировать и унифицировать клинико-лабораторные данные. Использование интегральных оценок гематологических показателей пациентов в динамике представляется перспективным для выявления клинико-лабораторных особенностей ОРИ различной этиологии, а также для определения формы тяжести, риска развития бактериальных осложнений. При этом статистически значимые отклонения в показателях гемограммы в динамике, как полученных рутинными методами, так и интегральных, позволят оценить эффективность и безопасность терапии при ОРИ у детей, что позволит создать алгоритмы динамического мониторинга качества проводимой терапии.
Применительно к оценке результатов клинических исследований одним из направлений интегральной оценки лабораторных данных является расчет лейкоцитарных индексов. Большой научно-практический потенциал использования подобных индексов подчеркивают многие авторы [3, 6], показывая их применимость в широком диапазоне нозологических форм, от инфекционных болезней до острой хирургической патологии. Наиболее изученными являются лейкоцитарные индексы интоксикации (ЛИИ) по Я. Я. Кальф-Калифу [5], по В. К. Островскому [8, 9], по Б. А. Рейсу [10], ядерный индекс по Г. Д. Даштаянц [1], индекс сдвига лейкоцитов крови [13], интегральный коэффициент ухудшения крови [11], энтропия лейкоцитарной формулы [12]. При их расчете используют относительные (выраженные в процентах) величины компонентов лейкоцитарной формулы, определение которых входит в рутинную клинико-лабораторную практику всех лечебно-профилактических учреждений. Использование интегральных показателей лейкоцитарной формулы крови позволяет повысить информативность традиционных диагностических тестов и качество оценки эффективности терапии, а в клинической практике — оптимизировать прогнозирование исходов заболевания и индивидуализировать схемы лечения и реабилитации. Применение оптимальных стандартизированных подходов к оценке гематологических показателей перспективно при компьютерной оценке результатов клинических исследований и разработке экспертных диагностических систем.
Однако эффективность использования лейкоцитарных индексов для оценки течения заболевания, эффективности и безопасности терапии у инфекционных больных до настоящего времени в достаточной степени изучена не была. Также существует необходимость разработки границ нормальных значений показателей лейкоцитарных индексов в педиатрической практике для различных возрастных групп.
Новыми перспективными комплексными способами анализа формы тяжести заболевания, риска развития бактериальных осложнений, эффективности и безопасности терапии при ОРИ, которые требуют дальнейшего изучения, являются методы оценки динамики относительных частот отклонений гематологических показателей, расчета их Z-оценок и комплексной Z-оценки.
Таким образом, разработка алгоритмов использования адекватных оценочных критериев и маркеров течения острого респираторного заболевания, применимых в широкой лечебной практике и не являющихся экономически обременительными для лечебно-профилактических учреждений, актуальна, так как позволит повысить точность оценки формы тяжести заболевания, риска развития бактериальных осложнений, эффективности и безопасности используемой терапии острых респираторных инфекций у детей.
Целью настоящего исследования было изучение особенностей изменения и клинической значимости рутинных показателей гемограммы, лейкоцитарных индексов и современных математических методов оценки гемограммы при острых респираторных вирусных инфекциях у детей разного возраста.
Пациенты и методы исследования
В исследовании были проанализированы клинико-лабораторные данные 44 пациентов в возрасте от 1 месяца до 14 лет с ОРВИ в остром периоде (на 1–3 сутки от начала заболевания). У всех пациентов собирался клинический и эпидемиологический анамнез, проводился клинический осмотр по общепринятым методам, осуществлялась термометрия, оценка жизненно важных показателей (ЧСС, ЧД, АД). Учитывая наличие возрастных особенностей гемограммы, в частности лейкоцитарной формулы, пациенты были разделены на три группы: 13 больных в возрасте до 1 года, 15 детей от 1 до 5 лет и 16 пациентов от 5 до 14 лет. У пациентов всех групп была проведена оценка показателей гемограммы, расчет лейкоцитарных индексов (табл. 1), а также Z-оценок основных показателей гемограммы. Оценка степени корреляции показателей гемограммы, лейкоцитарных индексов и Z-оценок основных показателей гемограммы осуществлялась с уровнем лихорадочной реакции, как одного из объективных маркеров тяжести острой респираторной вирусной инфекции, и формами тяжести основного заболевания путем расчета коэффициента корреляции Пирсона (ККП). Расчет Z-оценок компонентов лейкоцитарной формулы осуществлялся по формуле:
где Z — Z-оценка, X — значение показателя, m — среднее нормальное значение показателя, σ — среднеквадратичное отклонение данного показателя.
Установление этиологии острых респираторных инфекций осуществлялось методом ПЦР на базе ФБУН ЦНИИ эпидемиологии Роспотребнадзора.
Результаты исследования и обсуждение
В табл. 2 представлены формы тяжести в группах пациентов разного возраста. В этом отношении группы были сравнимы, лишь у детей старше 5 лет преобладало развитие ОРИ в легкой форме по сравнению с группой в возрасте от 1 до 5 лет.
Было проведено изучение корреляции между степенью лихорадочной реакции в °С (одного из основных объективных маркеров тяжести острой респираторной вирусной инфекции) и значением показателей гемограммы и лейкоцитарных индексов.
Анализ показал следующие результаты:
- суммарное содержание лейкоцитов в периферической крови, процентное содержание палочкоядерных и сегментоядерных нейтрофилов, эозинофилов, моноцитов — очень слабый (ККП от 0,1 до 0,3) и слабый (ККП от 0,3 до 0,38) уровень корреляции;
- лимфоциты — средний уровень корреляции (ККП 0,53) у пациентов до 1 года;
- базофилы — высокий уровень корреляции (ККП 0,7) у детей в возрасте от 1 года до 5 лет.
Эти данные свидетельствуют о низкой чувствительности прямой оценки показателей гемограммы при установлении степени тяжести острых респираторных вирусных инфекций.
Анализ средних значений лейкоцитарных индексов выявил для большинства из них зависимость от возраста: индекс соотношения лейкоцитов и СОЭ, индекс соотношения лимфоцитов и моноцитов, индекс соотношения лимфоцитов и эозинофилов, лейкоцитарные индексы интоксикации, индексы сдвига лейкоцитов крови, индекс Кребса, кровно-клеточный показатель, индекс соотношения нейтрофилов и моноцитов — прямая зависимость; индекс аллергизации, индекс эндотоксикоза, индекс Гаркави, индекс резистентности организма, лимфоцитарно-гранулоцитарный индекс, лейкоцитарный индекс — обратная зависимость (табл. 3).
Это объясняется тем, что все лейкоцитарные индексы не учитывают особенности лейкограммы детей — наличие перекреста между нейтрофилами и лимфоцитами, а также возрастную динамичность референсных значений моноцитов, палочкоядерных нейтрофилов и эозинофилов.
Оценка корреляции лейкоцитарных индексов с уровнем лихорадочной реакции продемонстрировала умеренную чувствительность этих показателей:
- ЛИИ по Я. Я. Кальф-Калифу — средний уровень корреляции (ККП 0,5) в группе пациентов от 1 года до 5 лет;
- индекс сдвига лейкоцитарной формулы по Н. И. Яблучанскому — отрицательная корреляция (ККП 0,5) в группе детей до 1 года;
- ядерный индекс степени эндотоксикоза по Г. Д. Даштаянц был связан с уровнем лихорадочной реакции у больных первого года жизни (ККП 0,8), у пациентов от 1 года до 5 лет (ККП 0,7).
Оценка доли пациентов с отклонениями от нормальных значений Z-оценок показателей гемограммы более 2SD (в %) у пациентов разного возраста показала наличие значимых отличий от других возрастных групп в отношении:
- лейкоцитов (у пациентов до 1 года);
- сегментоядерных нейтрофилов (у пациентов от 1 года до 5 лет);
- лимфоцитов (у пациентов старше 5 лет);
- СОЭ (у пациентов до 1 года) (табл. 4).
Проведенный анализ средних значений отклонений от нормальных значений Z-оценок показателей гемограммы более 2SD у пациентов разного возраста показал, что наиболее выраженные отклонения характерны для лимфоцитов у пациентов старше 5 лет и сегментоядерных нейтрофилов у пациентов до 1 года (табл. 5).
Проведенный ранговый корреляционный анализ продемонстрировал высокий уровень прямой корреляции между формой тяжести заболевания (легкая, средняя, тяжелая) и степенью отклонений от 2SD Z-оценок показателей гемограммы (табл. 6). Оценка производилась для всех возрастных групп, вместе взятых, что диктуется сутью метода Z-оценок.
Для оценки клинической эффективности метода Z-оценок был проведен анализ специфичности, чувствительности и точности данного метода при тяжелой форме острой респираторной инфекции.
Клиническая специфичность характеризуется числом клинически истинно отрицательно классифицированных пациентов, деленных на сумму клинически правильно отрицательно классифицированных плюс клинически ложноположительно классифицированных. Специфичность теста отражает вероятность отрицательного результата в отсутствие патологии, что при высокой специфичности позволяет адекватно отсеивать здоровых из популяции с предполагаемой патологией.
Клиническая чувствительность характеризуется числом клинически истинно положительно классифицированных пациентов, деленных на сумму клинически истинно положительно классифицированных плюс клинически ложноотрицательно классифицированных. Чувствительность теста отражает вероятность его положительного результата в присутствии патологии, что при высокой чувствительности теста позволяет с его помощью эффективно выявлять больных в общей популяции.
Комбинация клинической чувствительности и клинической специфичности теста характеризует клиническую эффективность теста [7].
Установление баланса между специфичностью и чувствительностью необходимо для определения прогностической значимости теста в установлении форм тяжести острой респираторной инфекции. Максимально специфичным явилось определение степени отклонения Z-оценок лейкоцитов и палочкоядерных нейтрофилов. Высокая чувствительность метода Z-оценок выявилась в отношении сегментоядерных нейтрофилов, моноцитов и лимфоцитов, что позволяет говорить о значимости данного метода в идентификации именно вирусных инфекций (рис. 1).
Показатель точности (диагностическая эффективность теста) Z-оценок показателей гемограммы отражает клиническую значимость данных показателей для выявления тяжелой формы заболевания (рис. 2). Применительно к острым респираторным инфекциям можно сказать, что оптимальная точность расчета отклонений Z-оценок отмечена для всех показателей гемограммы (0,7 и более).
Также было установлено, что проведение анализа распределения Z-оценок показателей гемограммы позволяет оценить норму реагирования гемограммы при воздействии определенных этиологических факторов.
Как видно из рис. 3, 4 и табл. 7, экстремумы парабол распределения Z-оценок лейкоцитов при этих инфекциях достоверно отличались: при гриппе он составлял 0,32 ± 0,02 ЕД, при респираторно-синцитиальной (РС) вирусной инфекции — 0,17 ± 0,01 ЕД (р < 0,01). При этом экстремумы отличались величиной изменений, которая имела более выраженный характер при гриппе.
При рино- и аденовирусных инфекциях экстремумы парабол распределения Z-оценок лейкоцитов также достоверно отличались между собой и находились, в отличие от аналогичного распределения при гриппе и РС-вирусной инфекции, в зоне отрицательных значений Z. Установление данных закономерностей реагирования гемограммы под воздействием различных этиологических факторов позволяет установить типичность отклонений в гемограмме для каждой из данных инфекций, что имеет большое дифференциально-диагностическое значение.
Достоверных различий в распределении Z-оценок лейкоцитов при гриппе и аденовирусной инфекции выявлено не было.
Таким образом, проведение анализа Z-оценок показателей гемограммы у детей с острыми респираторными инфекциями позволяет практическому врачу определять форму тяжести заболевания и оценивать соответствие гематологических показателей пациента этиогенным особенностям гемограммы.
Литература
М. Л. Абрамович
А. А. Плоскирева 1 , кандидат медицинских наук
ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Москва
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо). Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гаст
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо).
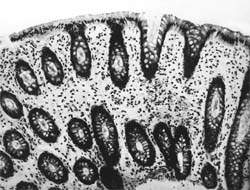 |
| Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимально выраженный катаральный колит. х 100. |
Ротавирусы представляют собой род семейства Reoviridae, который объединяет большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих гастроэнтерит у человека, млекопитающих и птиц. Систематическое изучение ротавирусов человека началось с 1973 года, когда они были обнаружены при электронной микроскопии ультратонких срезов биоптатов слизистой оболочки двенадцатиперстной кишки, полученных от больных острым гастроэнтеритом детей Австралии (Р. Бишоп и соавторы). В том же году Т. Флеветт обнаружил сходный вирус в копрофильтратах больных гастроэнтеритом методом электронной микроскопии при негативном контрастировании препаратов.
Вирусные частицы имеют диаметр от 65 до 75 нм. При проникновении контрастирующего вещества в вирион выявляется электронно-плотный центр диаметром 38 — 40 нм, который представляет собой так называемую сердцевину, окруженную электронно-прозрачным слоем. Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободом, поэтому их стали называть ротавирусами (лат. rota — колесо).
Ротавирусы имеют две белковые оболочки — наружный и внутренний капсиды. Сердцевина содержит внутренние белки и генетический материал, представленный двунитчатой фрагментированной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, которые могут быть разделены при электрофорезе в полиакриламидном геле (ПААГ) или агарозе. В составе ротавирусов обнаружено четыре антигена; основной из них — это групповой антиген, обусловленный белком внутреннего капсида. С учетом группоспецифических антигенов все ротавирусы делятся на пять групп: A, B, C, D, E. Ротавирусы одной группы имеют общий групповой антиген, который выявляется иммунологическими реакциями: иммуноферментный анализ, иммунофлюоресценция, иммунная электронная микроскопия и др. Большинство ротавирусов человека и животных относятся к группе A.
| Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями |
Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями. Вирусы в фекалиях заболевших появляются одновременно с развитием клинических симптомов, наибольшая концентрация их в кале (до 109 — 1011 вирусных частиц в 1 г) регистрируется в первые 3 — 5 дней болезни. В эти дни больные представляют наибольшую эпидемиологическую опасность для лиц, контактирующих с ними. Наиболее частым источником заболевания для детей первого года жизни являются инфицированные ротавирусом матери; для взрослых и детей более старшего возраста — дети, в основном из детских коллективов. Возможность заражения человека от животных не доказана.
Патогенез ротавирусной инфекции характеризуется проникновением вируса в эпителиоциты слизистой оболочки желудочно-кишечного тракта, преимущественно тонкой кишки, что приводит к их повреждению и отторжению от ворсинок. Вследствие этого на ворсинках тонкой кишки появляются функционально и структурно незрелые энтроциты с низкой способностью синтезировать пищеварительные ферменты. При ротавирусном гастроэнтерите это проявляется снижением уровня дисахаридаз, развивается вторичная дисахаридазная недостаточность, при которой в просвете тонкой кишки накапливаются нерасщепленные дисахариды, что создает повышенное осмотическое давление и приводит к выводу в просвет кишечника воды и электролитов из тканей организма. Это является основной причиной диареи и дегидратации и определяет основные клинические проявления болезни.
Ротавирусный гастроэнтерит как инфекционное заболевание имеет циклическое течение. Инкубационный период продолжается чаще всего от 12 — 24 часов до двух суток. Клиническая картина ротавирусного гастроэнтерита характеризуется в основном острым началом, однако в ряде случаев может иметь место продромальный период длительности от 12 до 48 — 72 часов. В этот период больные отмечают недомогание, общую слабость, повышенную утомляемость, снижение аппетита, головную боль, познабливание, урчание и неприятные ощущения в животе, умеренно выраженные катаральные явления: заложенность носа, першение в горле, легкий кашель.
В клинической картине ротавирусного гастроэнтерита в период развернутых клинических проявлений ведущими являются синдромы гастроэнтерита и интоксикации. Выраженность диареи и обусловленной ею той или иной степени дегидратации организма, а также токсикоза, продолжительность этих симптомов в значительной мере определяет тяжесть течения заболевания.
Синдром гастроэнтерита характеризуется развитием диареи, снижением аппетита, появлением урчания и болей в животе, тошноты и рвоты. Наиболее типичен для ротавирусного гастроэнтерита обильный водянистый пенистый стул желтого или желто-зеленого цвета. У больных с легким течением заболевания стул может быть кашицеобразным. Как правило, патологические примеси в стуле отсутствуют. Боль локализуется преимущественно в верхней половине живота или является диффузной, она может быть разной интенсивности. Почти всегда она сопровождается громким урчанием в животе.
Синдром интоксикации появляется в самом начале заболевания. Слабость, зачастую резкая, является наиболее частым проявлением этого синдрома; реже отмечается головная боль. При более тяжелом течении имеют место головокружение, обморочное состояние, коллапс. Обращает на себя внимание следующая особенность ротавирусного гастроэнтерита: два ведущих в клинической картине болезни синдрома развиваются в процессе заболевания не всегда однонаправленно; у некоторых больных на фоне сравнительно слабо выраженных диспепсических явлений могут наблюдаться резко выраженные симптомы общей интоксикации, особенно слабость.
Повышение температуры тела не всегда может отмечаться при ротавирусном гастроэнтерите, особенно у взрослых. У некоторых больных может быть озноб без повышения температуры. В то же время нередко в разгар заболевания выраженность лихорадочной реакции варьируется от субфебрильных цифр и выше и может достигать 38 — 39°С как у детей, так и у взрослых.
Важным в диагностическом плане для ротавирусного гастроэнтерита считается сочетание двух ведущих клинических синдромов с симптомами поражения верхних дыхательных путей. Катаральный синдром встречается приблизительно у 50% больных и проявляется в виде гиперемии и зернистости слизистых оболочек мягкого неба, небных дужек, язычка, задней стенки глотки, а также насморка, заложенности носа, кашля, болей в горле. В ряде случаев катаральные симптомы наблюдаются уже в продромальном периоде, до проявления симптомов гастроэнтерита.
В разгар болезни отмечается изменение функционального состояния сердечно-сосудистой системы, чаще у пациентов с более тяжелым течением и при наличии сопутствующих заболеваний органов кровообращения. У большинства пациентов отмечается тенденция к артериальной гипертензии, тахикардия, определяется глухость сердечных тонов при аускультации. У больных с тяжелым течением заболевания, как правило, возникают обмороки и коллапсы из-за выраженных расстройств гемоциркуляции, в генезе которых наряду с токсическими воздействиями существенное значение имеет гиповолемия. Потери жидкости и электролитов вследствие рвоты и диареи могут быть значительными и приводят к развитию дегидратации. Клинические проявления дегидратации зависят от ее степени. При легком и среднетяжелом течении ротавирусного гастроэнтерита отмечается жажда, сухость во рту, слабость, бледность (дегидратация I — II степени), при тяжелом течении наряду с этими симптомами наблюдаются также осиплость голоса, судороги мышц конечностей, акроцианоз, снижение тургора кожи, уменьшение диуреза (дегидратация III степени).
В связи с развитием при ротавирусном гастроэнтерите возможных осложнений, главным образом циркуляторных расстройств, острой сердечно-сосудистой недостаточности, нарушений гомеостаза, выделяют группы больных повышенного риска, в которые включают новорожденных, детей младшего возраста, лиц пожилого возраста, а также больных с тяжелыми сопутствующими заболеваниями. Описанные в литературе и наблюдавшиеся нами случаи ротавирусного заболевания с летальным исходом относятся именно к этим группам.
Выделяются две основные клинические формы ротавирусного заболевания — гастроэнтерическая и энтерическая. Симптомы только острого гастрита (гастритический вариант) встречаются в 3 — 10% случаев. Функциональные и морфологические нарушения со стороны желудочно-кишечного тракта, возникающие при ротавирусном гастроэнтерите в случае наличия у пациентов фоновой гастроэнтерологической патологии, нередко способствуют развитию таких осложнений основного заболевания, как обострение сопутствующих болезней: хронического гастрита, энтероколита, панкреатита, часто в сочетании с выраженными явлениями дисбактериоза кишечника, требующими коррекции при лечении.
Методы диагностики ротавирусной инфекции
При ротавирусном гастроэнтерите гемограмма изменяется следующим образом: в остром периоде заболевания с высокой частотой выявляются лейкоцитоз с нейтрофилезом и повышенная СОЭ. В периоде реконвалесценции картина крови обычно нормализуется полностью. Изменения урограммы у большинства больных имеют кратковременный характер и проявляются чаще всего небольшой протеин-, лейкоцит- и эритроцитурией; в редких случаях в моче появляются гиалиновые цилиндры в незначительном количестве. При тяжелом течении заболевания нарушения функции почек могут быть более выраженными, с повышением уровня мочевины крови, олигоурией или анурией, снижением клубочковой фильтрации. На фоне проводимой терапии указанные изменения быстро исчезают и при повторных обследованиях не отмечаются.
В качестве примера, иллюстрирующего особенности клинического течения ротавирусного гастроэнтерита, приводим выписку из истории болезни.
Лечение: обильное питье солевых растворов, парентеральная регидратационная и дезинтоксикационная терапия — трисоль 1000 мл внутривенное капельное введение, внутрь ферментные препараты: абомин, панкреатин, тансол, карболен. Течение заболевания без осложнений. На третий день болезни — субфебрильная температура, оставалась слабость; боли в животе прекратились. Стул кашицеобразный до пятого дня от начала заболевания. Полное выздоровление наступило на седьмой день болезни.
Дифференциальный диагноз у больных ротавирусным гастроэнтеритом проводят с другими острыми кишечными инфекциями как вирусной так и бактериальной этиологии, прежде всего в тех случаях, когда в клинической картине на первый план выступает синдром гастроэнтерита: с вирусными диареями различной этиологии (аденовирусы, коронавирусы, астровирусы, калицивирусы, вирус Норфолк, энтеровирусы Коксаки и ЕСНО); с гастроинтестинальной формой сальмонеллеза, с гастроэнтеритическим и гастроэнтероколитическим вариантами острой дизентерии, с пищевыми токсикоинфекциями, вызванными условно-патогенными бактериями; с холерой.
Обнаружение специфических антител и нарастание их титра в сыворотке крови больных и переболевших ротавирусным гастроэнтеритом при помощи серологических реакций с целью текущей диагностики на практике в настоящее время широкого распространения не получило и используется в основном для ретроспективного анализа различных эпидемиологических ситуаций.
Методы обнаружения вирусспецифической РНК, которые можно назвать высокочувствительными и специфичными, имеют, однако, ряд недостатков, ограничивающих их практическое применение (необходимость наличия специальной аппаратуры, реактивов, квалифицированного персонала и др.) Наиболее простой метод в этой группе — электрофорез ротавирусной РНК в полиакриламидном геле. Этот метод, позволяющий идентифицировать штаммы вирусов, вызвавшие заболевание, и дать характеристику штаммов, циркулирующих на данной территории, в основном применяется при эпидемиологических исследованиях.
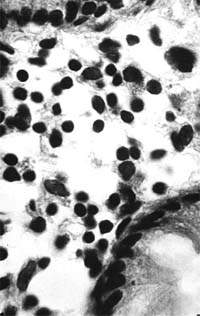 |
| Рисунок 2. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимальное содержание плазматических клеток в собственной пластинке, увеличение в ней числа макрофагов. х 400 |
В клинической практике врач нередко сталкивается с обстоятельствами (сомнительные результаты вирусологических и серологических исследований, случаи микст-инфекций), когда возникает необходимость в применении дополнительных методов для верификации диагноза. С этой целью может быть использован доступный для практического здравоохранения интрументальный метод исследования — ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки. При гистологическом, морфометрическом и гистохимическом исследованиях биоптатов при ротавирусном гастроэнтерите выявляются характерные изменения в виде поверхностного минимально выраженного катарального колита с незначительной дистрофией эпителия (рис. 1), снижения числа серотонинсодержащих желудочно-кишечных эндокриноцитов (ЕС-клетки) в эпителиальном пласте кишечных желез, умеренной инфильтрацией собственной пластинки плазматическими клетками и увеличением в ней числа макрофагов (рис. 2). Эти особенности имеют дифференциально-диагностическое значение, поскольку отличаются указанным показателем от других острых кишечных инфекций, что может быть использовано в диагностически сложных случаях.
Здравоохранение в настоящее время не располагает препаратами, обладающими специфическим антиротавирусным действием, поэтому терапия ротавирусного гастроэнтерита является патогенетической. Основные ее цели — борьба с дегидратацией, токсикозом и связанными с ними наиболее часто встречающимися при ротавирусном гастроэнтерите нарушениями функции жизненно важных органов — сердечно-сосудистой системы и органов мочевыделения, степень выраженности которых во многом определяет тяжесть течения заболевания и его прогноз.
Для правильного выбора характера и объема проводимой регидратационной терапии в первую очередь необходимо установить степень дегидратации у того или иного пациента. При эксикозе I — II степени следует ограничиваться пероральной регидратационной терапией (препараты регидрон, глюксолан и др.). При дегидратации III степени целесообразно прибегать к комбинированной парентеральной и пероральной регидратации. Для парентеральной регидратации применяют растворы трисоль, квартасоль, ацесоль и др. С целью дезинтоксикации и улучшения гемодинамики при среднетяжелом и тяжелом течении заболевания показаны коллоидные растворы (гемодез, полиглюкин и др.).
| Для ротавирусной инфекции характерно сочетание гастроэнтерита, интоксикации и симптомов поражения верхних дыхательных путей |
Современными представлениями о патогенезе диарейного синдрома при ротавирусном гастроэнтерите обусловлено и назначение соответствующих средств, способствующих нормализации состояния пищеварительного тракта, а также диеты. Учитывая нарушения активности ряда пищеварительных ферментов, в частности лактазы, рекомендуется исключить в острый период заболевания из пищевого рациона больных молоко и молочные продукты. Кроме того, по этой же причине целесообразно ограничивать и пищу, богатую углеводами. В связи с вышеизложенным, в острый период необходимы энзимные препараты (панзинорм-форте, фестал и др). Кроме того, в остром периоде заболевания могут быть использованы адсорбирующие и вяжущие средства, способствующие ускоренному формированию стула (смекта, карболен и др.) также возможно применение хилака-форте. Высокой частотой дисбактериозов кишечника различной степени выраженности у больных ротавирусным гастроэнтеритом обусловлена необходимость применения в комплексной терапии бактерийных биологических препаратов. Лучшая терапевтическая эффективность при ротавирусном гастроэнтерите отмечена при применении лактосодержащих бактерийных биологических препаратов (ацилакт, лактобактерин и др.), что, по-видимому, связано с заместительным действием бактериальной лактазы, содержащейся в лактобактериях. В последние годы в комплексной терапии ротавирусного гастроэнтерита начал применяться комплексный иммуноглобулиновый препарат (КИП), который разработан и выпускается в МНИИЭМ им. Г. Н. Габричевского. Это первый отечественный иммуноглобулиновый препарат для энтерального применения. КИП характеризуется повышенной концентрацией антител к микроорганизмам, возбудителям острых кишечных инфекций, в том числе ротавирусам, сальмонеллам, шигеллам, эшерихиям и др. Применение КИП в комплексной терапии больных ротавирусным гастроэнтеритом оказывает отчетливый положительный терапевтический эффект, существенно сокращая продолжительность интоксикации и диареи, что открывает новые возможности в лечении этого заболевания.
Литература
1. Букринская А. Г., Грачева Н. М., Васильева В. И. Ротавирусная инфекция. М., 1989.
2. Дроздов С. Г., Покровский В. И., Шекоян Л. А., Машилов В. П. и др. Ротавирусный гастроэнтерит. М., 1982.
3. Новикова А. В. и др. Архив патологии, 1989, №6.
4. Щербаков И. Т. и др. Архив патологии, 2995, №3.
5. Юшук Н. Д., Царегородцев А. Д.. Лекции по инфекционным болезням. М., 1996.

2. Мазанкова Л.Н., Ильина Н.О. Современные аспекты диагностики и лечения острых кишечных инфекций у детей // Российский вестник перинатологии и педиатрии. – 2007. – № 2. – С. 4-10.
3. Амбулаторная нефрология. Амбулаторная педиатрия. - 2-е изд., испр. и доп. – М.: ПедиатрЪ, 2016. – 200 с.
4. Парфенчик И.В., Цыркунов В.М. Острое повреждение почек у детей с острыми кишечными инфекциями: частота, характеристика, оценка тяжести // Клиническая инфектология и паразитология. – 2015. – № 3 (14). – С. 22-27.
5. Stevens L.A., Levey A.S. Measured GFR as a confirmatory test for estimated GFR // J. Am. Soc. Nephrol. – 2009. – Vol. 20. – P. 2305-2313.
6. Цыркунов В.М., Парфенчик И.В. Значение цистатина С для оценки функции почек при острых кишечных инфекциях у детей // Клиническая медицина. – 2017. – № 2 (февраль). - С. 759-763.
Значимость кишечных инфекций ОКИ у детей на сегодняшний день определяется не только их высокой распространенностью, но и частотой неблагоприятных последствий в исходе заболевания, проблемами формирования затяжных форм инфекции, смертности и значительной частоты развития тяжелых форм болезни [1, 2]. Клиническая оценка функции почек занимает центральное место в практической медицине [3, 4]. Установлено, что у детей с ОКИ до появления клинических и лабораторных признаков острого повреждения почек происходит увеличение показателей креатинина и мочевины 4, что обосновывает необходимость поиска причин и указанных расстройств [1].
Цель работы: оценить особенности клинических и лабораторных показателей у детей с ОКИ тяжелой степени тяжести.
Материалы и методы исследования
Материалы исследования. В исследование включен 61 ребенок с острыми кишечными инфекциями различной этиологии тяжёлой степени в возрасте от 2 месяцев до 5 лет (средний возраст – 21,2 ± 2,1 мес.), находившийся в стационаре за период январь 2016 - декабрь 2017 года. Возрастной состав детей был следующим: до 1 года – 25 (41%), с 1 до 3 лет – 25 (41%), с 3 до 6 лет – 11 (18%). Мальчиков – 35, девочек – 26. В первые сутки заболевания было госпитализировано 12 детей (20%), на 2-е сутки – 21 (34%), на 3-и сутки – 10 (16%), позже 3-го дня – 18 (30%), в среднем на 4,1 ± 0,8 дня болезни. Этиологическим фактором ОКИ у 41 ребёнка являлся ротавирус, из них у 6 детей в сочетании с норовирусом, у 11 - с представителями условно-патогенной флоры (у 3 детей с Pseudomonas aeroginosa, у 4 - с Enterobacter agglomerans, у 2 - с Klebsiella oxytocae, у 1 – с Кlebsiella pneumoniae, у 1 ребенка с Citrobacter freundii); у 6 детей – норовирус, из них у 2 в сочетании с Pseudomonas aeroginosa и у 2 с Staphylococcus aureus, у 2 детей - Salmonella enteritidis (у 1 - в сочетании с Staphylococcus aureus и Citrobacter freundii); у 5 детей – с Kledsiella pneumoniae, у 4 – Citrobacter freundii, у 2 - Pseudomonas aeroginosa, у 1 – Enterococcus faecalis.
Клиника ОКИ при госпитализации проявлялась повышением температуры тела у большинства детей; так, у 10 (16%) детей регистрировался субфебрилитет (37,4±0,1 о ), фебрилитет (38,4±0,1 о ) был отмечен у 22 (36%) детей и лихорадка (39,4 ± 0,1°) у 18 (30%) детей. Немногократная рвота (2,8±0,2) регистрировалась у 31 (51%) ребёнка, многократная (7,7±1,2) у 3 (5%) детей. Диарея (6,6 ± 0,7) была у 45 (74%) детей. Снижение диуреза отмечали у 25 (41%) поступивших детей.
При наблюдении в стационаре повышенная температура тела у 51 (84%) ребенка сохранялась 2,7 ± 0,2 дня, кратность рвоты составила 3,3 ± 0,3 эпизода в сутки у 34 (56%) детей и регистрировалась до 3,4 ± 0,4 дня, диарея кратностью 4,8± 0,4 эпизода в сутки у 55 (90%) детей регистрировалась до 3,5 ±0,3 дня.
Критерии включения: дети в возрасте от 2 месяцев до 5 лет с установленным диагнозом ОКИ тяжёлой степени тяжести и наличием результатов общеклинического и биохимического анализов крови. Наличие информированного согласия законных представителей пациента на участие в исследовании.
Критериями исключения служили: отказ от участия в исследовании, пациенты с недостаточным объёмом обследования.
Диагноз острой кишечной инфекции выставлялся в соответствии с клинической классификацией. При оценке тяжести инфекционного процесса учитывались частота и продолжительность диареи, рвоты, выраженность лихорадки, степень кишечного токсикоза с эксикозом.
Методы исследования. В исследовании использовались следующие методы обследования детей: общеклинические лабораторные методы исследования - общий анализ крови, общий анализ мочи, копрологическое исследование кала; биохимический анализ крови - электролиты сыворотки, мочевина, креатинин; бактериологическое исследование кала на облигатно-патогенную и условно-патогенную флору; ПЦР для выявления РНК рота-, норо- и астровирусов. Интерпретация лабораторных анализов проводилась с учётом возраста пациентов [3].
Методы статистического анализа. Статистическую обработку проводили при помощи пакета прикладных программ (ППП) StatSoftStatistica 6,1 (лицензионное соглашение BXXR006D092218FAN11). Для оценки нормальности эмпирических распределений до проведения статистического анализа использовался тест Шапиро-Уилка. Анализ полученных данных осуществляли методами вариационной статистики с вычислением средних величин (M), стандартной ошибки среднего, показателя достоверности различий при сравнении между группами (р). Достоверность различия количественных показателей, имеющих нормальное распределение, анализировали с помощью t-критерия Стьюдента. В случае ненормального (асимметричного) распределения вариационного ряда достоверность различий количественных показателей анализировали посредством U-критерия Манна–Уитни. Для анализа полуколичественных показателей использовали χ 2 – критерий Пирсона и двусторонний точный критерий Фишера (при ожидаемой частоте в подгруппах ˂5). Различие сравниваемых величин считали статистически значимыми при p
Результаты и их обсуждение
Из числа детей, поступивших в стационар с ОКИ, для проведения анализа особенностей клинических и лабораторных данных были сформированы три группы больных с учетом возраста: 1-я группа – до 1 года, 25 (41%) детей; 2-я группа - от 1 года до 3 лет, 25 (41%) детей; 3–я группа – от 3 до 5 лет, 11 (18%) детей. Соотношение мальчики/девочки в выделенных группах отображено в таблице 1.
На сервисе СпросиВрача доступна бесплатная консультация педиатра онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно. Задайте свой вопрос и получите ответ сразу же!

Добрый вечер. Сколько дней уже нет температуры? И какие препараты кроме мальтофера сейчас даете ребенку?
Людмила, днём нет, сейчас 18.00, обычно к ночи поднимается, ждём. Ничего не даю. Вопрос в том чего стоит опасаться, на что это все похоже?

Можно предположить ОРВИ с абдоминальным синдромом, но необходим осмотр врача очно. Нужно сдать общий анализ крови ( посмотреть гемоглобин, СОЭ), исключить персистирующие инфекции(ЦМВ, Эпштейн-барр, герпес 2,4,7 типа). Анемия, это синдром, который может развиваться на фоне разных заболеваний, поэтому надо обследоваться и потом решать вопрос о приема мальтофера или других препаратов.

Здравствуйте! Не давайте мальтофер. Оптимально- сидерал или ферлатум
Почему? Читайте по ссылке

Маргуба, доброй ночи. Спасибо за ответы! Сегодня дочка вроде повеселее.
Можно ещё вопрос - сегодня пятый день , у нее сыпь появилась, на теле вокруг, слегка над трусиками и практически незаметно на щеках, не чешется. Фото приложила. Вот гадаю чем мы переболели сейчас. Завтра врачу покажем горло

Екатерина, добрый вечер! Вам надо сдать самый обычный общий анализ крови, в инвитро он так и называется, там ничего не надо расписывать


Здравствуйте. Маловероятно, что это ротавирус, симптомы нехарактерные, скорее банальная ОРВИ. Если ферритин был на нижней границе, то однозначно дефицит железа присутствует. Окрашивание стула в зеленоватый цвет может быть на фоне приема мальтофера, также и разжижение стула. Вам необходимо сдать общий клинический анализ крови и пересдать ферритин, если сдавали более 1 мес назад. Также дополнительно можно посмотреть Вит Д. Если температура снижается сама, то надобности в жаропонижающих нет. Лечение уже по результатам анализов.
Ирина, спасибо
Разжижение началось до начала приема Мальтофера. Обязательно узнавать феритин? В общем анализе должен быть гемоглобин?

Если ферритин был сдан не более 1 мес назад, то можно не повторять. Латентный дефицит железа мы по гемоглобину не увидим. Лечение анемии и латентного дефицита проводится до нормализации уровня ферритина. Разжижение стула может быть и на фоне температуры и погрешностей в диете. Если нет частого жидкого стула, то достаточно скорректировать питание и больше поить ребенка.

Здравствуйте, мальтофером лихорадку 38 не лечат. На такую температуру вообще лу ше витамины не давать, а искать причину, инфекцию и лечиь правильно. Важно сдать общую кровь плюс СОЭ, анализ мочи общий, биохимию по показаниям. Ребенка должен осмотреть врпч-лтмфоузлы, горло, селезёнку, прослушать лёгкие. Учитывая зелёный жидковатый стул возможна кишечная инфекция, тогда начинать Энтерофурил.

Обидеть не хотела, но когда температура высокая малышам лишнее не назначаем, чтобы избежать полипрагмазии. Мальтофер сложный препарат по-своему и при кишечной инфекции усилит ребёночку боли в животе и вызовет ещё большие диспепсии.

Здравствуйте! Я бы рекомендовала(анемия, кожные симптомы+ непостоянная лихорадка в вечернее время они как раз и проявляют свою активность и возраст наталкивает на мысль о них)в первую очередь исключить паразитозы/гельминтозы: сдать кал методом обогащения 3хкратно с интервалом в 2-3 дня или парасепт. Желательно также ОАК, ферритин, СРБ, ОАМ и копрограмму.

По вашему описанию я определила только повышенную тревожность родителей.У ребёнка нет никаких клинически значимых проявлений. Сейчас ходит такое орви, Ходит уже давно когда определяется только гиперемия задней стенки глотки больше ничего не присоединяется. Температура спала, ребёнку лучше, сдать и просто клинический минимум кровь и мочу, для того чтобы посмотреть состояние организма. Обычно препараты железа при длительном приеме лучше убирать на время интеркуррентных заболеваний. После выздоровления продолжить курс.
Наталья, спасибо за ответ. То есть это орви? От анемии не бывает высокой температуры? Да, завтра сдадим анализы

Скорее всего вирусная инфекция. Ротавирус очень злой, при нём будет жуткий понос температура и рвота. У вас какой-то не тяжелое течение вирусной инфекции с поражением скорее всего только зева больше ничего там не находится. Но осмотр педиатра обязательно осмотр горла и послушать. Ну если не можете найти доктора, находитесь далеко, купить в аптеке стрептатест и сделать это исключение ангины
Наталья, доброй ночи. Спасибо за ответы! Сегодня дочка вроде повеселее.
Можно ещё вопрос - сегодня пятый день , у нее сыпь появилась, на теле вокруг, слегка над трусиками и практически незаметно на щеках, не чешется. Фото приложила. Вот гадаю чем мы переболели сейчас. Завтра врачу покажем горло.

Здравствуйте! Возможно ребенок переносит вирусную инфекцию. Стул может быть таким от Мальтофера. Вам стоит сдать общий анализ крови и общий анализ мочи. При высокой температуре давайте ребенку Нурофен и Фенистил. Антигистаминные средства снизят аллергизацию организма, свойственную любой инфекции.

ОРВИ и по видимому анемия.
Необходим общий анализ крови (он в Инвитро так и называется)
Важны показатели - общее количество лейкоцитов, тромбоциты, гемоглобин. Нейтрофилы, СОЭ


Слушайте, Кто такая красивая классическая вирусная экзантема. Самая безобидная сыпь. Вы действительно подхватили какую-то мерзкую герпес- подобную вирусяку. Самая хорошее в вирусных экзантемой то, что ими заканчивается Обычно вирусные инфекции. Когда высыпает сыпь, которая никогда не должна зудеть, А у вас это так, то она на пятый день максимум проходит безо всякого лечения. И вирусная инфекция в данной ситуации чаще всего уже закончена. Классический вариант такой сыпи это это розеола. Но вы великоваты для розеллы поэтому это какая-то её разновидность
На сервисе СпросиВрача доступна консультация педиатра по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Здравствуйте, вероятнее всего вирусная кишечная инфекция.
Энтерофурил( применяется при бактериальных инфекцичх)и анаферон ( не доказана эффективность)не нужны.
Диета с исключением молочных продуктов(можно кисломолочные - кефир, ацидофиллин), свежих фруктов и овощей не менее 10-14 дней.
Обильное питьё, не менее 30 мл/кг в сутки( лучше использовать специальные растворы- регидрон, адиарин-регидро, нормобакт аквабаланс)
Мотилиум по 5 мл 3 р. д. до прекращения рвоты.
Энтеросгель по чайной ложке 3 р. д. 5 дней, можно оставить смекту, если хорошо её пьет.
Аципол по 1 к. 3 р.д. 10 дней( или любой другой пробиотик: баксет, линекс, бифиформ)
Температуру сбиваем выше 38,5 чередуя нурофен(5-7 мг/кг)с парацетамолом(10-15 мг/кг) . Если руки и ноги холодные к жаропонижающему добавляем ношпу( 1/2 таб.)
Если боли в животе будут усиливаться, то необходим осмотр хирурга.
Ангелина, сколько дней может длится такое состояние?Днем ,когда нет температуры он играет ,активный.Почему на третий день вырвало?Смекту пьёт ,но плохо,энтеросгель даже не глотает(вызывает рвотный рефлекс).Из фруктов бананы ест,читала вроде можно.

Банан можно зелёный, рвота и жидкий стул могут быть до 5-7 дней.
Слабость и тошнота до 10-14 дней
Если дольше, то нужно обследование- УЗИ органов брюшной полости, ОАК, ОАМ, копрограмма
Ангелина, добрый вечер.Сегодня утром ребёнка вырвало сразу после пробуждения,и изо рта запах ацетона.Температура весь день 37.7-38.3.Выпили за день полторы порции регидрон био,больше не получилось рвотный рефлекс какой то.Сегодня смекту не пили ни разу,его сразу начинает тошнить.Два раза сходил в туалет по большому.Сдали кровь на общий анализ,результаты только завтра.У меня паника уже .Может что то обследовать или нужны антибиотики?Сегодня уже четвёртый день. Вызывали сегодня врача,назначили арбидол и бифидумбактерин.И толком не сказала ничего.

Здравствуйте, а мотилиум принимаете?
Сорбенты ни какие ребенок не может выпить? Может полисорб получится?
Нужно выводить токсины
Читайте также:

