Септические процессы в печени
Обновлено: 26.04.2024
Для цитирования: Сандлер Ю.Г., Винницкая Е.В., Хайменова Т.Ю., Бордин Д.С. Клинические аспекты повреждения печени при COVID-19 // Эффективная фармакотерапия. 2020. Т. 16. № 15. С. 18–23.
- Аннотация
- Статья
- Ссылки
- Английский вариант
SARS-CoV-2 – COVID-19 представляет серьезную угрозу для мирового общественного здравоохранения. В настоящее время COVID-19 рассматривается как системное заболевание с нарушением функции иммунной системы, поражением в первую очередь легких, а также сердца, почек, кишечника, печени и селезенки. Повреждение печени происходит в основном при тяжелом течении COVID-19. Сегодня не до конца понятно, относятся ли изменения лабораторных показателей печени у пациентов с COVID-19 к диагностированным ранее заболеваниям печени, или они отражают повреждение печени при COVID-19. В статье приведены работы, посвященные изучению поражений печени в период заболевания COVID-19 у пациентов без предшествующей патологии или с уже существующей патологией печени. Проанализированы и обобщены потенциальные механизмы поражения печени, обусловленного вирусом SARS-CoV-2, что расширяет наши знания о COVID-19.
- КЛЮЧЕВЫЕ СЛОВА: SARS‐CoV‐2, COVID-19, печень, дисфункция, сердечно-сосудистые заболевания, гипертензия, болезнь Крона, язвенный колит
SARS-CoV-2 – COVID-19 представляет серьезную угрозу для мирового общественного здравоохранения. В настоящее время COVID-19 рассматривается как системное заболевание с нарушением функции иммунной системы, поражением в первую очередь легких, а также сердца, почек, кишечника, печени и селезенки. Повреждение печени происходит в основном при тяжелом течении COVID-19. Сегодня не до конца понятно, относятся ли изменения лабораторных показателей печени у пациентов с COVID-19 к диагностированным ранее заболеваниям печени, или они отражают повреждение печени при COVID-19. В статье приведены работы, посвященные изучению поражений печени в период заболевания COVID-19 у пациентов без предшествующей патологии или с уже существующей патологией печени. Проанализированы и обобщены потенциальные механизмы поражения печени, обусловленного вирусом SARS-CoV-2, что расширяет наши знания о COVID-19.
В настоящее время COVID-19 рассматривается как системное заболевание с нарушением функции иммунной системы, поражением в первую очередь легких, а также сердца, почек, кишечника. Тяжелые формы заболевания сопровождаются гипериммунным воспалением, дисбалансом ренин-ангиотензин-альдостероновой системы, развитием эндотелиальной дисфункции и особых форм васкулопатий (тромботическая микроангиопатия и внутрисосудистая коагулопатия). Это состояние, по мнению ряда экспертов, следует именовать тромбовоспалительным процессом, или COVID-19-ассоциированной коагулопатией [1, 2].
- легкая (без пневмонии или легкая пневмония) – 81% случаев;
- тяжелая (например, одышка, гипоксия или > 50% поражения легких при визуализации в течение 24–48 часов) – 14%;
- крайне тяжелая (с развитием острого респираторного синдрома, дыхательной недостаточности или полиорганной дисфункции) – 5%.
Общий коэффициент летальности составил 2,3%; в некритических ситуациях летальные исходы не зафиксированы [4].
К факторам риска развития тяжелого течения COVID-19 относятся преимущественно возраст (старше 65 лет) и коморбидные состояния [3]:
- сердечно-сосудистые заболевания, прежде всего артериальная гипертензия;
- сахарный диабет;
- хроническая болезнь легких;
- рак (в частности, гематологические злокачественные новообразования, рак легкого и метастазирование);
- хроническое заболевание почек;
- ожирение;
- курение;
- иммунодефицитные состояния;
- хронические заболевания печени [5].
Вероятно, у некоторых пациентов с хроническими заболеваниями желудочно-кишечного тракта (ЖКТ) (болезнь Крона, язвенный колит) или печени (цирроз печени) могут наблюдаться повышенный риск возникновения COVID-19 и более тяжелые формы заболеваний [6].
Восприимчивость ЖКТ к инфекции SARS-CoV-2 может быть обусловлена наличием рецепторов ангиотензинпревращающего фермента 2 (АПФ2) в кишечнике. Как известно, АПФ2 является рецептором вируса SARS-CoV-2. Пищеварительные симптомы, связанные с инфекцией SARS-CoV-2, могут быть вызваны прямой вирусной атакой, а также повреждением тканей и органов вследствие иммунного ответа [7]. Вирусный нуклеокапсидный белок был обнаружен в цитоплазме эпителиальных клеток желудка, двенадцатиперстной и прямой кишок. Понимание патогенеза заболеваний органов пищеварения, связанных с вирусом SARS-CoV-2, расширяется, но его влияние на существующие хронические заболевания ЖКТ остается неясным.
Частота повреждений печени у пациентов с COVID-19, по данным различных исследований, варьируется от 14 до 53% [8].
Рассматривается несколько возможных механизмов повреждающего воздействия коронавирусной инфекции на печень [9–13].
Прямое воздействие SARS-CoV-2 на печень
Механизмы прямого воздействия вируса SARS-CoV-2 на печень (прямая цитотоксичность вследствие активной репликации вируса в клетках печени) недостаточно изучены. В более ранних исследованиях, связанных с инфицированием коронавирусами рода Betacoronavirus (SARS-CoV (2002–2003 гг.) и MERS-CoV (2012 г.)), повреждение печени встречалось достаточно часто и ассоциировалось с тяжестью заболевания [14, 15].
Как известно, SARS-CoV, равно как и SARS-CoV-2, используют АПФ2 в качестве рецепторов для внедрения в клетку, которые широко распространены в клетках сердца, почек, кровеносных сосудов, особенно альвеолярных эпителиальных клетках, а также печени, поджелудочной железы, эпителия кишки, что обеспечивает системность повреждения [16].
Однако не до конца ясно, может ли повреждение печени вызываться непосредственно коронавирусом SARS-CoV-2. Предыдущие данные по секвенированию RNA-seq в базе данных атласа белка человека подтверждают экспрессию АПФ2 в печени SARS-CoV [17]. При этом низкая частота экспрессии АПФ2 наблюдается только в холангиоцитах, но не в гепатоцитах, клетках Купфера или эндотелиальных клетках. Кроме того, SARS-CoV через специфический белок 7a способен индуцировать апоптоз в клеточных линиях различных органов (включая легкие, почки, печень) каспазозависимым путем. Это свидетельствует о возможности непосредственного воздействия SARS-CoV на ткань печени.
Экспрессия АПФ2 в ткани печени в отношении нового коронавируса проанализирована на основании данных секвенирования РНК. Объективная оценка специфической экспрессии АПФ2 в здоровой ткани печени на основании данных RNA-seq двух независимых когорт позволила идентифицировать специфическую экспрессию АПФ2 на холангиоцитах и минимально в гепатоцитах. Результаты показали, что вирус способен напрямую связываться через АПФ2 с холангиоцитами, но не обязательно с гепатоцитами [16]. Уровень экспрессии АПФ2 в клетках желчных протоков значительно выше, чем в гепатоцитах, но сопоставим с уровнем в альвеолярных клетках 2-го типа в легких, что делает печень потенциальной мишенью для вируса [16].
Исходя из этих данных, можно предположить, что нарушения в биохимических показателях печени у пациентов с COVID-19 связаны не с повреждением гепатоцитов, а с дисфункцией холангиоцитов и другими причинами, такими как лекарственная гепатотоксичность и системная воспалительная реакция, вызывающими повреждение печени.
Метод RNA-Seq также использовали для анализа экспрессии АПФ2 и факторов транскрипции, связанных с его экспрессией в тканях печени в различные периоды после гепатэктомии на мышиной модели острого повреждения печени с частичной гепатэктомией [18]. Экспериментальные результаты продемонстрировали, что повышенная регуляция экспрессии АПФ2 при остром повреждении печени может быть вызвана компенсаторной пролиферацией гепатоцитов. При этом, как правило, у пациентов с COVID-19 повышаются в основном уровни аминотрансфераз, но не щелочной фосфатазы [19].
При аутопсии пациентов с SARS-CoV методом ОТ-ПЦР геном SARS-CoV был обнаружен не только в легких, но также в паренхиматозных клетках, в том числе гепатоцитах, эндотелии сосудов различных органов. При биопсии печени у пациентов с атипичной пневмонией с SARS-CoV выявлены выраженные митозы, ацидофильные тела, клетки Купфера, баллоноподобные гепатоциты. Это позволило предположить, что SARS-CoV индуцирует апоптоз клеток печени и тем самым способствует ее повреждению [14].
Результаты посмертных биопсий у пациентов с COVID-19 показали умеренный микровезикулярный стеатоз, умеренную лобулярную и портальную активность. Это говорит о том, что повреждение могло быть вызвано инфекцией SARS-CoV-2, но не позволяет исключить и лекарственное повреждение печени, а также развитие гипоксических состояний. Результаты аутопсии печени включают гепатомегалию, дегенерацию гепатоцитов, очаговый некроз, нейтрофильную, лимфоцитарную и моноцитарную инфильтрацию, синусоидальную дилатацию, застой и микротромбозы. Однако гистологических признаков повреждения печени, приводящих к печеночной недостаточности, повреждений желчных протоков не наблюдалось [20–22].
Иммуноопосредованное повреждение печени
Иммуноопосредованное повреждение печени может быть связано с синдромом активации макрофагов, в контексте гипервоспалительного синдрома, характеризуемого цитокиновым штормом COVID-19-ассоциированной коагулопатии и полиорганной недостаточности в рамках тяжелого и крайне тяжелого течения COVID-19 [23–25].
Нередко системные вирусные инфекции сопровождаются транзиторным повышением трансаминаз, что отражает общую иммунную активацию, гипериммунное воспаление на фоне циркулирующих цитокинов в отсутствие нарушения функции печени. Этот феномен называется bystander hepatitis [26].
Более высокая частота повреждений печени отмечается у тяжелых пациентов с инфекцией SARS-CoV2. Крайне тяжелый COVID-19 служит независимым фактором риска повреждения печени. В случаях COVID-19 с летальным исходом частота поражений печени может достигать 58,1–78% [20].
Цитокиновый шторм характеризуется синтезом значительного количества биомаркеров воспаления, в частности С-реактивного белка, сывороточного ферритина, лактатдегидрогеназы, D-димера, интерлейкинов 1-бета, 6, 2, фактора некроза опухоли альфа, хемокинов, и сопровождается снижением содержания Т-лимфоцитов в крови [23, 27].
Недавние исследования показали, что инфекция SARS-CoV-2 может в первую очередь поражать Т-лимфоциты, особенно CD4+ и CD8+ Т-клетки, которые активно вовлекаются в патологический процесс COVID-19 [28].
Синдром системной воспалительной реакции и сепсис – явления не редкие при крайне тяжелом течении COVID-19. Известно, что сепсис определяется как нерегулируемый иммунный ответ на инфекцию, которая приводит к полиорганной дисфункции [30].
При сепсисе печень играет важную роль в иммунной защите и метаболической адаптации к воспалению. При этом печень служит мишенью для сепсис-индуцированной полиорганной недостаточности. Патофизиология связанных с сепсисом повреждений печени включает гипоксическое повреждение из-за ишемии и шока, холестаз из-за изменения метаболизма желчи, гепатоцеллюлярное повреждение из-за лекарственной токсичности [31]. Следовательно, сепсис у пациентов с COVID-19 может быть одной из причин поражения печени и существенно ухудшает прогноз COVID-19.
Тяжелая гипоксия (аноксия)
Отличительной чертой COVID-19 является дыхательная недостаточность. Поэтому гипоксический гепатит из-за аноксии часто встречается в тяжелых случаях. Тяжелая гипоксия, аноксия, гиповолемия считаются основной причиной ишемического/гипоксического повреждения печени в случаях COVID-19 с острой легочной недостаточностью и/или шоком. Данное повреждение печени связано с метаболическим ацидозом, перегрузкой кальцием и изменениями проницаемости митохондриальной мембраны и обычно проявляется высоким цитолизом [32].
Кроме того, предполагают, что неструктурные белки SARS-CoV-2 видоизменяют структуру гемоглобина в эритроците, что приводит к нарушению транспорта кислорода, диссоциации железа, образованию порфирина, повышению уровня ферритина. Такое воздействие может привести к усилению воспалительных процессов в легких, развитию окислительного стресса, гипоксемии, гипоксии, симптомов острого респираторного дистресс-синдрома и полиорганной кислородной недостаточности [33].
Лекарственное повреждение печени
Наиболее частая причина развития повреждений печени при COVID-19 ассоциируется с лекарственно-индуцированными повреждениями печени, которые являются следствием применения этиотропного лечения инфекции SARS-CoV-2 и патогенетической терапии COVID-19 [19, 20].
В период пандемии в первоначальных клинических руководствах рекомендовались препараты для лечения SARS-Cov-2-инфекции, причем некоторые из них, в том числе лопинавир/ритонавир, гидроксихлорохин, азитромицин, умифеновир, фамипиравир, рекомбинантный интерферон бета-1b, обладают потенциальной гепатотоксичностью [26].
Гепатотоксичность гидроксихлорохина описана в единичных клинических наблюдениях при лечении больных системной красной волчанкой, поздней кожной порфирией, ревматоидным артритом, малярией. По данным регистра LiverTox, гидроксихлорохин относится к категории С и, вероятно, способен вызывать идиосинкразическое поражение печени [34].
Лопинавир/ритонавир – антиретровирусный препарат с известным и хорошо изученным межлекарственным взаимодействием с препаратами иммуносупрессивного действия. Его не следует назначать одновременно с ингибиторами mTOR (сиролимус, эверолимус). При одновременном использовании с ингибиторами кальциневрина (циклоспорин, такролимус) необходимо тщательно контролировать концентрацию лопинавира/ритонавира. Имеются данные о применении препарата у пациентов с циррозом печени. Риск гепатотоксичности низкий у пациентов с хроническими заболеваниями печени (ХЗП). Не рекомендуется применение у пациентов с декомпенсированным циррозом печени. По данным регистра LiverTox, лопинавир – категория D, ритонавир – категория C [26, 34].
Вероятно, помимо прямой лекарственной гепатотоксичности следует отдельно выделить возможность развития идиосинкразического (иммуноопосредованного) повреждения печени, наиболее частой причиной которого являются антибиотики [35].
Следует помнить о межлекарственном взаимодействии у коморбидных пациентов и чаще пользоваться Ливерпульской базой данных по применению препаратов, которые могут использоваться при лечении COVID-19 [36].
Соответственно все пациенты, получающие этиотропную и патогенетическую терапию по поводу COVID-19, нуждаются в мониторировании печеночных показателей для предотвращения тяжелого лекарственного гепатита на этапе как стационарного лечения, так и последующего амбулаторного наблюдения.
Реактивация ранее существовавшего заболевания печени
С учетом высокого бремени ХЗП в мире: неалкогольная жировая болезнь печени (НАЖБП) в рамках метаболического синдрома (сахарный диабет, ожирение), цирроз печени в исходе хронических вирусных гепатитов B, C – данные заболевания могут быть основными причинами повреждения печени у пациентов с COVID-19. Не исключено, что пациенты с ХЗП более восприимчивы к повреждению печени от SARS-CoV-2. Однако в настоящее время сведения о наличии прямого влияния ранее существовавшего заболевания печени на течение COVID-19 и наоборот ограниченны. В ряде исследований у 2–11% пациентов с COVID-19 имели место ХЗП [8, 13].
Пациенты с ХЗП могут быть более уязвимы к тяжелым клиническим последствиям COVID-19, включая гипоксию и гипоксемию из-за тяжелой пневмонии или цитокиновго шторма [28, 29, 37].
Следует отметить, что все пациенты с уже установленным циррозом печени (ЦП) по любой причине декомпенсации подвержены высокому риску заболеваемости и смертности независимо от вирусной эпидемии. Пациенты с ЦП могут быть более восприимчивы к инфекциям из-за системного иммунодефицита, поэтому предотвращение инфицирования SARS-CoV-2 имеет первостепенное значение. Так, Y. Xiao и соавт. отмечали декомпенсацию ЦП у 17% больных COVID-19, не соблюдавших профилактические мероприятия [38].
До настоящего времени не получено однозначных данных относительно возникновения печеночной недостаточности у пациентов с хроническим гепатитом B (ХГВ) или C (ХГС) на фоне SARS-CoV-2. Пациенты с атипичной пневмонией (SARS-CoV-инфекция 2002 г.), имевшие ХГВ или ХГС, были более склонны к развитию повреждения печени и тяжелого гепатита, что, вероятно, связано с усилением репликации вируса гепатита во время инфекции SARS-CoV [39].
Скорее всего ни ХГВ, ни ХГС не увеличивают риск тяжелого течения COVID-19 [19]. Так, ХГВ, распространенность которого в Китае выше, чем в Европе, по-видимому, не влияет на исход COVID-19.
Не следует забывать, что биологические препараты, которые могут использоваться в патогенетической терапии COVID-19, такие как тоцилизумаб, сарилумаб, способны также вызывать реактивацию скрыто протекающего гепатита B или E, а следовательно, ухудшать функцию печени.
Достоверных данных о том, что пациенты с аутоиммунными заболеваниями печени (АИЗП) имеют более высокий риск инфицирования или развития тяжелого течения COVID-19, не получено. Как показывает предварительный опыт (Бергамо, Ломбардия), пациенты со стабильным течением АИЗП при длительной поддерживающей иммуносупрессивной терапии имеют низкий риск осложнений и/или прогрессирования [40]. Однако не исключено, что обострение аутоиммунного гепатита может потребовать более высокой дозы ГКС, а следовательно, потенциально увеличит риск инфекции.
Что касается холестатических повреждений печени, пока не доказано, что инфекция SARS-CoV-2 обостряет холестаз [13].
1. Cuker A., Peyvandi F. Coronavirus disease 2019 (COVID-19): Hypercoagulability. Literature review, 2020.
Приведены данные литературы, посвященные изучению роли печени в развитии и прогрессировании сепсиса. Отмечено, что печень выполняет функции детоксикации и элиминации циркулирующих микроорганизмов и эндотоксинов, но клетки печени способны вырабатывать и разнообразные провоспалительные цитокины и биологически активные вещества, усугубляющие повреждение ткани печени и прогрессирование сепсиса. Клиническими вариантами развития печеночной дисфункции при сепсисе считаются гипоксический гепатит и сепсис-индуцированный холестаз. Приведены основные звенья их патогенеза и критерии диагностики. Подчеркнуто наличие относительно малого количества работ, посвященных морфологическому изучению органов и тканей, включая печень, у больных, страдающих и / или погибших от сепсиса. Сделан вывод о необходимости проведения полноценных клинико-патологоанатомических сопоставлений для выяснения звеньев патогенеза печеночной и полиорганной недостаточности при сепсисе.

1. Гельфанд Б.Р., Руднов В.А., Проценко Д.Н. и др. Сепсис в начале XXI века. Классификация, клинико-диагностическая концепция и лечение. Патологоанатомическая диагностика. Практическое руководство. – М.: Издательство НЦССХ им. А.Н. Бакулева РАМН, 2004. – 130 с.
2. Лысова Н.Л., Гуревич Л.Е., Трусов О.А. и др. Иммуногистохимическая характеристика печени у больных перитонитом (на материале ранних вскрытий) // Бюллетень экспериментальной биологии и медицины. 2001. – № 11. – С. 596.
3. Малкова О.Г., Лейдерман И.Н., Левит А.Л. Взаимосвязь стрессовой гипергликемии и расстройств липидного обмена у больных с тяжелым сепсисом // Вестник Уральской медицинской академической науки. – 2011. – № 1. –
5. Мишнёв О.Д., Гринберг Л.М., Зайратьянц О.В. и др. Современная клинико-диагностическая концепция и патологоанатомическая диагностика сепсиса // Материалы V съезда Российского общества патологоанатомов. – М.: Группа МДВ, 2017. – С. 209–211.
6. Савельев В.С., Гельфанд Б.Р., Мишнёв О.Д., Щеголев А.И. Хирургический сепсис: клинико-патологоанатомические аспекты // Архив патологии. – 2007. – № 4. – С. 59–63.
7. Светухин А.М., Жуков А.О., Щеголев А.И., Мишнёв О.Д. Хирургический сепсис: клинико-патологоанатомические сопоставления // Чтения, посвящённые памяти академика РАМН Д.С. Саркисова / Под ред. В.Д. Фёдорова, А.И. Щеголева. – М., 2008. – С. 43–57.
8. Angus D.C., Linde-Zwirble W.T., Lidicker J. et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care // Crit. Care Med. – 2001. – V. 29. – P. 1303–1310.
9. Bakker J., Grover R., McLuckie .A et al. Administration of the nitric oxide synthase inhibitor NG-methyl-L-arginine hydrochloride (546C88) by intravenous infusion for up to 72 hours can promote the resolution of shock in patients with severe sepsis: results of a randomized, doubleblind, placebo-controlled multicenter study (study no. 144-002) // Crit. Care Med. – 2004. – V. 32. – P. 1–12.
10. Blanco J., Muriel-Bombín A., Sagredo V. et al. Incidence, organ dysfunction and mortality in severe sepsis: a Spanish multi-centre study // Crit. Care. – 2008. – V. 12. –
11. Dhainaut J.F., Marin N., Mignon A. et al. Hepatic response to sepsis: interaction between coagulation and inflammatory processes // Crit. Care Med. – 2001. – V.29. –
12. Fuhrmann V., Kneidinger N., Herkner H. et al. Hypoxic hepatitis: underlying conditions and risk factors for mortality in critically ill patients // Intensive Care Med. – 2009. – V.35. –
13. Geier A., Fickert P., Trauner M. Mechanisms of disease: mechanisms and clinical implications of cholestasis in sepsis // Nature Clin. Pract. Gastroenterol. Hepatol. – 2006. – V.3. –
15. Levy M.M., Fink M.P., Marshall J.C. et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference // Crit. Care Med. – 2003. – V. 31. – P. 1250–1256.
16. Marshall J.C. Inflammation, coagulopathy, and the pathogenesis of multiple organ dysfunction syndrome // Crit. Care Med. – 2001. – V.29. – P. 99–106.
17. Nakatani Y., Fukui H., Kitano H. et al. Endotoxin clearance and its relation to hepatic and renal disturbances in rats with liver cirrhosis // Liver. – 2001. – V. 21. – P. 64–70.
18. Sands K.E., Bates D.W., Lanken P.N. et al. Epidemiology of sepsis syndrome in 8 academic medical centers // JAMA. – 1997. – V. 278. – P. 234–240.
19. Singer M., Deutschman C.S., Seymour C.W. et al. The third international consensus defini-tions for sepsis and septic shock (sepsis-3) // JAMA. – 2016. – V. 315. – P. 801–810.
20. Spapen H. Liver Perfusion in Sepsis, Septic Shock, and Multiorgan Failure // Anat Rec. – 2008. – V. 291. – P. 714–720.
21. Spitzer J.A. Cytokine stimulation of nitric oxide formation and differential regulation in hepatocytes and nonparenchymal cells of endotoxemic rats. // Hepatology. – 1994. – V.19. – P. 217–228.
22. Szabo G., Romics L.Jr., Frendl G. Liver in sepsis and systemic inflammatory response syndrome // Clin. Liver. Dis. – 2002. – V.6. – P. 1045–1066.
23. Whitehead M.W., Hainsworth I., Kingham J.G. The causes of obvious jaundice in South West Wales: perceptions versus reality // Gut. – 2001. – V.48. – P. 409–413.
Сепсис и септический шок закономерно относятся к наиболее тяжелым заболеваниям, показатели смертности при которых варьируют от 30 % до 50 % [10]. Эволюция взглядов на причины, механизмы развития, клинические проявления и формы сепсиса служит поводом для проведения регулярных согласительных конференций и выполнения дальнейших клинико-экспериментальных исследований. Согласно решениям третьего международного консенсуса по определению сепсиса и септического шока (сепсис – 3), сепсис является опасной для жизни дисфункцией органов, развившейся вследствие дизрегуляторной реакции макроорганизма на инфекцию [19]. То есть в настоящее время основным проявлением сепсиса считается наличие органной недостаточности.
Среди основных органов-мишеней, поражаемых при сепсисе, особое место занимает печень, обеспечивающая защиту организма от развития инфекционных заболеваний и являющаяся важным звеном формирования синдрома полиорганной недостаточности [5, 11].
Цель работы: анализ данных литературы о роли печени в развитии и прогрессировании сепсиса.
Как известно, печень участвует в регуляции практически всех основных путей метаболизма, что обеспечивается наличием различных типов клеток. Паренхима органа представлена гепатоцитами, составляющими порядка 60 % от общего количества клеток. Остальные – это в основном так называемые синусоидальные клетки, представленные, в частности, эндотелиальными клетками, звездчатыми макрофагоцитами (клетками Купфера) и перисинусоидальными (звездчатыми) клетками (клетками Ито).
И гепатоциты и клетки Купфера могут быть активированы при помощи патоген-ассоциированных молекулярных паттернов (PAMPs) (в частности, эндотоксином), вследствие чего запускается секреция ряда провоспалительных цитокинов, обеспечивающих повышенное поступление нейтрофилов для обезвреживания бактерий и / или бактериальных продуктов, циркулирующих в кровотоке. В условиях инфекции и при развитии сепсиса гепатоциты участвуют в регуляции иммунного ответа и сдвига метаболизма в сторону глюконеогенеза [3, 11]. В результате взаимодействия рецепторов гепатоцитов с растворимыми медиаторами сепсиса, включая эндотоксин, цитокины, вазоактивные вещества, происходит изменение их метаболизма в сторону повышения захвата аминокислот, мочевинообразования, увеличения синтеза факторов свертывания крови, системы комплемента, а также белков острой фазы воспаления. Паренхиматозные клетки печени являются также продуцентами и реактивных радикалов кислорода.
Клетки Купфера, составляющие порядка 25 % от всех резидентных макрофагов организма человека, осуществляют элиминацию циркулирующих бактерий и эндотоксина. В этой связи пациенты с хроническими заболеваниями печени характеризуются не только нарушенным клиренсом эндотоксина, но и более высокой восприимчивостью к инфекции [17].
Установлено, что клетки Купфера способны продуцировать целый ряд провоспалительных медиаторов, включая фактор некроза опухоли альфа (ФНО-α), известный как ключевой цитокин развития синдрома системной воспалительной реакции, а также белки острой фазы и оксид азота (No). Взаимодействие клеток Купфера с циркулирующими клетками крови (лейкоцитами, тромбоцитами, эритроцитами) приводит к развитию так называемых лейкостазов в печеночных синусоидах и усилению провоспалительных реакций. Так, в печени пациентов без признаков инфекционного поражения лейкоциты составляют порядка 1–2 % от общего числа непаренхиматозных клеток, а при сепсисе их количество увеличивается в 10–20 раз в течение нескольких часов. Эндотелиальные клетки печеночных синусоидов регулируют обмен веществ и молекул между циркулирующей кровью и перисинусоидным пространством Диссе. В условиях же сепсиса эндотелиоциты приобретают прокоагулянтную способность, обеспечивающую адгезию, активацию и миграцию лейкоцитов [16]. Одновременно с этим в эндотелиоцитах отмечается секреция провоспалительных цитокинов (интерлейкинов 1 и 6), а также оксида азота и оксида углерода, что приводит к нарушениям системной и внутрипеченочной гемодинамики.
К сожалению, развивающиеся при сепсисе нарушения функции печени не однозначны, в связи с чем выделяют два основных варианта клинических проявлений [12, 23]. Первый – это гипоксический гепатит, развивающийся главным образом в результате нарушений кровотока в магистральных сосудах. Второй – это желтуха или сепсис-индуцированный холестаз, обусловленный преимущественно внутрипеченочными повреждениями.
Частота выявления гипоксического гепатита при септическом шоке составляет, по данным [12], 32 % от всех случаев его развития у пациентов отделений реанимации и интенсивной терапии, в ряде наблюдений он может привести к фульминантной печеночной недостаточности. При кардиогенном шоке гипоксический гепатит считается вторичным, поскольку развивается из-за уменьшения сердечного выброса и снижения доставки кислорода. Вместе с тем нарушения гемодинамики в печени не всегда приводят к развитию гипоксического гепатита. Важную роль в его развитии отводят зндотоксину и провоспалительным цитокинам. Авторами в экспериментах по моделированию системной эндотоксинемии у собак было установлено снижение напряжения кислорода в ткани печени. Имеются также указания о роли реоксигенации в развитии гипоксического гепатита, обусловленного процессами ишемии / реперфузии, а также окислительного стресса, ранней активации клеток Купфера и вторичной активации циркулирующих нейтрофилов [23].
Клинико-биохимические проявления гипоксического гепатита характеризуются первоначальным (в первые 24 часа) повышением в сыворотке крови уровней активности трансаминаз и лактатдегидрогеназы с последующим снижением их уровней через 2–3 дня и нормализацией показателей примерно через две недели.
Согласно данным литературы [12], в основе диагностики гипоксического гепатита лежат три критерия:
● клинические признаки сердечной, сосудистой или дыхательной недостаточности;
● длительное или транзиторное повышение в сыворотке крови активности амино-трансфераз (в 20 раз по сравнению с верхней границей нормальных показателей);
● исключение других возможных причин развития некроза ткани печени.
В качестве характерного признака используется и значительное снижение количества протромбина, ответственного за развитие геморрагического синдрома [14]. У 65 % пациентов отмечается повышение в сыворотке крови концентрации креатинина (более 20 мг/л или 177 мкмоль/л), которое, скорее всего, связано с формированием уже почечной недостаточности в условиях нарушения системного кровообращения. Несомненно, что при гипоксическом гепатите может наблюдаться и повышение уровня билирубина, но в большинстве случаев без визуальных признаков желтухи.
Признаки желтухи выявляются примерно у 20 % больных, страдающих сепсисом и / или внепеченочными инфекциями [23]. Кроме того, она может наблюдаться у пациентов, перенесших тяжелую травму и имеющих признаки синдрома системной воспалительной реакции. Считается, что любая разновидность системной инфекции (бактериальная, вирусная, простейшими) может привести к развитию желтухи, но чаще всего она проявляется при грамотрицательной бактериальной инфекции. Наиболее часто желтуха отмечается при внутрибрюшных инфекциях, в частности при перитоните, дивертикулите, аппендиците. Такие заболевания, как пневмония, инфекционный эндокардит, менингит и инфекции мочевыводящих путей, также способствуют ее развитию.
Обычно признаки желтухи определяются через 2–7 дней после начала бактериемии [13]. Тем не менее бактериемия не является четким предвестником развития печеночной дисфункции или холестаза. Так, примерно одна треть пациентов с сепсисом имеет признаки холестатической желтухи за 1–9 дней до первых положительных результатов посева крови. Наиболее часто такое наблюдается у пациентов с недостаточностью кишечного барьера (из-за сепсиса, шока, воспалительных или инфекционных поражений кишечника), что приводит к развитию бактериальной транслокации из просвета кишечника в систему воротной крови при отсутствии клинически выявляемой бактериемии.
Наиболее характерным биохимическим показателем считается гипербилирубинемия (75–80 % конъюгированного) по сравнению с небольшим повышением уровней щелочной фосфатазы и трансаминаз в сыворотке крови. Концентрация билирубина в сыворотке крови составляет, как правило, от 85 до 170 ммоль/л, но может превышать и 500 ммоль/л. Повышение уровня билирубина в сыворотке крови при сепсисе отмечается, как правило, в случаях развития уже полиорганной недостаточности, при этом высокие его концентрации сочетаются с плохим прогнозом. Однако следует добавить, что в подобных случаях должны быть исключены другие причины нарушения функций печени, в частности ишемический и медикаментозный гепатит.
Согласно данным литературы, сепсис-индуцированную дисфункцию печени подразделяют на раннюю и позднюю [20] или первичную и вторичную [21]. Ранняя (первичная) печеночная дисфункция возникает в первые часы сепсиса и связана с гипоперфузией гепатоспланхнической области. Важную роль при этом играют нарушения микроциркуляции, в том числе вследствие развития синдрома диссеминированного свертывания крови [11]. Именно ишемия и гипоксия вызывают повреждение клеток печени, проявляющееся повышением концентрации сывороточных маркеров повреждения печени (трансаминаз, лактатдегидрогеназы, билирубина). При этом развивающиеся нарушения способны к восстановлению при адекватной интенсивной терапии. Поздняя печеночная дисфункция считается более тяжелым и коварным процессом. Она обусловлена синергическим действием микроорганизмов, эндотоксинов, медиаторов воспаления и характеризуется выраженными нарушениями структуры и функции печени с формированием полиорганной недостаточности [22]. В качестве подтверждения G. Szabo с соавт. [22] приводят данные о нарушении функций печени после инфузии эндотоксина или фактора некроза опухоли при отсутствии выраженных изменений циркуляции крови.
Вместе с тем из анализа данных литературы можно заключить, что на сегодняшний день не существует четкого однозначного критерия развития печеночной дисфункции и ее недостаточности, что, соответственно, не позволяет провести и объективный анализ частоты ее развития при сепсисе. Так, K.E. Sands c соавт. [18] определяют печеночную недостаточность при наличии комплекса изменений: увеличения в сыворотке крови содержания общего билирубина более 2 мг/дл (> 34 мкмоль/л) и повышения уровня щелочной фосфатазы или аминотрансфераз более чем в два раза по сравнению с нормальными показателями. При изучении 1342 наблюдений сепсис-синдрома печеночная недостаточность отмечалась у 12 % больных в течение 28 дней от начала заболевания [18]. В то же время, согласно данным D.C. Angus с соавт. [8], печеночная недостаточность фигурировала лишь в 1,5 % наблюдений при анализе кодов патологических состояний и заболеваний, согласно МКБ-9, выявленных у 192980 больных с тяжелым сепсисом в семи штатах США.
При обследовании 312 пациентов с септическим шоком [9] установили развитие печеночной недостаточности в 20 % наблюдений в течение 72 часов от начала лечения. Печеночная недостаточность определялась по наличию как минимум двух из трех критериев:
● содержание общего билирубина более 2,5 мг/ дл (> 43 мкмоль/л),
● уровень аланинаминотрансаминазы в сыворотке в крови более чем в два раза превышает верхнюю границу нормы,
● протромбиновое время или международное нормализованное отношение более чем в 1,5 раза превышает контрольные значения [9].
Согласно решениям Международной конференции по определению сепсиса [15], для диагностики полиорганной недостаточности рекомендуется использовать шкалу Sepsis-related Organ Failure Assessment (SOFA) и Logistic Organ Dysfunction System (LODS) шкалу. Рекомендованные системы основаны на количественной оценке степени выраженности дисфункции отдельных органов, в том числе и печени. В шкале SOFA в качестве маркера используется билирубин, в системе LODS – билирубин и протромбин.
Другим важным моментом, сдерживающим выяснение роли печени в развитии сепсиса, является, на наш взгляд, относительно малое количество работ, посвященных морфологическому изучению органов и тканей, включая печень, у больных, страдающих и / или погибших от сепсиса. Более того, большинство работ по патологии сепсиса в последнее время выполнены в экспериментах на животных либо посвящены молекулярным исследованиям.
Тем не менее при аутопсийном исследовании тел больных, погибших от сепсиса и особенно от септического шока, наблюдается увеличение размеров и массы печени. В случае присоединения ДВС-синдрома печень, как со стороны капсулы, так и на разрезе, имеет пёстрый вид за счёт множественных кровоизлияний. При микроскопическом изучении препаратов ткани печени отмечаются отложения фибрина и скопления нейтрофилов в синусоидах [6]. Повреждения и некрозы гепатоцитов локализуются преимущественно в III зоне ацинусов (центральных отделов долек) [5]. К характерным признакам также относятся повреждения и уменьшение количества эндотелиоцитов и клеток Купфера, что более наглядно проявляется при иммуногистохимических исследованиях с антителами к CD 31, CD 34 и CD 68 [1, 2]. Наличие явлений холестаза при отсутствии внепеченочной обструкции служит дополнительным критерием поражения печени при сепсисе [7].
Таким образом, печень играет важную роль в развитии и прогрессировании сепсиса. Выполняя функции детоксикации и элиминации циркулирующих микроорганизмов, клетки печени способны вырабатывать разнообразные провоспалительные цитокины и биологически активные вещества, усугубляющие повреждение ткани печени и прогрессирование заболевания. Клиническими вариантами развития печеночной дисфункции при сепсисе считаются гипоксический гепатит и сепсис-индуцированный холестаз. Относительно малое количество работ, посвященных морфологическому изучению органов и тканей, включая печень, у больных, страдающих и / или погибших от сепсиса, свидетельствует о необходимости проведения полноценных клинико-патологоанатомических сопоставлений для выяснения звеньев патогенеза печеночной и полиорганной недостаточности.
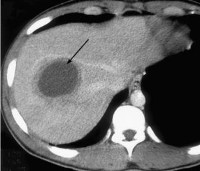
Амебный абсцесс печени – это отграниченное от окружающих тканей скопление гнойного экссудата в печени вследствие патогенного воздействия дизентерийной амебы Патология проявляется болью в правом подреберье различной интенсивности, гепатомегалией, лихорадкой, ознобом, потливостью, желтушностью кожи и склер, тошнотой и рвотой. Диагностика основывается на данных осмотра, УЗИ печени, анализа кала, серологического исследования крови. Консервативно назначают противопротозойные, антибактериальные препараты. По показаниям выполняют чрескожную или открытую аспирацию и санацию полости абсцесса.
МКБ-10
K77.0 Поражения печени при инфекционных и паразитарных болезнях, классифицированных в других рубриках
Общие сведения

Причины
Амебный абсцесс печени вызывается одноклеточным паразитом – дизентерийной амебой Entamoeba histolytica. Патогенный микроорганизм попадает в желудочно-кишечный тракт человека энтеральным путем при употреблении инфицированной воды, продуктов растительного происхождения, при контакте с загрязнёнными предметами обихода (тарелки, ложки и др.). Источником инфекции служит больной человек или носитель амебиаза. В кишечнике паразит переходит в активную фазу, размножается и питается биологическим материалом хозяина (бактериями, клетками крови). После достижения своей высшей формы развития (тканевой) амеба через подслизистый слой кишечника по системе воротной вены попадет в печень, где продолжает свой жизненный цикл и размножение.
По наблюдениям специалистов в сфере гепатологии и абдоминальной хирургии, развития патологии возрастает у лиц, злоупотребляющих алкоголем, принимающих глюкокортикоидные препараты, прошедших курс химиотерапии и лучевой терапии и имеющих онкологические заболевания. В большей степени болезни подвержены люди молодого возраста и беременные женщины.
Патогенез
Попав с током крови в печень, паразиты посредством выделения протеолитических ферментов оказывают токсическое действие на гепатоциты, вызывая их распад и разрушение. В результате возникает расплавление и некроз ограниченного участка паренхимы с образованием единичных или множественных обособленных полостей, заполненных некротическими массами и продуктами жизнедеятельности микроорганизма. При дальнейшем течении заболевания содержимое абсцесса может инфицироваться (чаще кишечной палочкой) с развитием гнойно-воспалительного процесса и окрашиванием содержимого в желто-зеленый цвет. В редких случаях происходит самостерилизация амебного абсцесса, при которой экссудат приобретает пастообразную консистенцию и темно-коричневую окраску.
Классификация
Амебные абсцессы печени могут быть одиночными и множественными. Одиночный (солитарный) гнойник, увеличиваясь в размерах, иногда достигает 10-15 см в диаметре. Множественные абсцессы возникают редко и имеют малый диаметр (от 0,5 до 2 см). Выделяют острое и хроническое течение заболевания. Острая форма возникает внезапно и сопровождается лихорадкой гектического типа, выраженными признаками интоксикации. При хроническом течении температура чаще субфебрильная, патология протекает без ярких клинических проявлений с периодами обострения и ремиссии.
Симптомы амебного абсцесса
Клиническая картина абсцесса печени зависит от остроты процесса, расположения абсцесса и выраженности интоксикационного синдрома. В некоторых случаях на первый план выступают симптомы амебного колита, на фоне которого развивается поражение печени. Клинические проявления заболевания могут возникать как через несколько дней, так и месяцев/лет от момента инфицирования. Острое течение болезни характеризуется повышением температуры тела вначале до субфебрильных, а после присоединения вторичной инфекции − до фебрильных значений, выраженной слабостью, обильным потоотделением, тошнотой, рвотой, снижением аппетита, резкой потерей веса, иктеричностью склер и кожных покровов.
В дебюте заболевания возникает тупая, ноющая боль и чувство тяжести в правой половине живота. По мере увеличения размеров печени возрастает интенсивность и частота болевых приступов, которые постепенно переходят в острую боль, стихающую при смене положения тела. При абсцессе правой доли органа боль локализуется в зоне правого подреберья и иррадиирует в правое плечо, лопатку, правую часть спины и шеи. При расположении гнойника в левой доле болевой синдром возникает в зоне эпигастрия и отдает в левую лопатку, околопупочную и левую боковую области живота.
Одним из основных признаков амебного абсцесса является гепатомегалия. Данный синдром наблюдается при больших размерах гнойника. Во время физикального исследования печень пальпируется и выступает из-под края реберной дуги на 3-6 см, а при огромных размерах абсцесса возможно выпячивание органа в области правого подреберья. Гепатомегалия приводит к сдавлению близлежащих органов (кишечника, диафрагмы), что может вызывать запоры, повышенное газообразование, затруднение дыхания, одышку. Хроническая форма амебного абсцесса отличается незначительной гипертермией, которая может сохраняться в течение долгого времени (недели, месяцы), слабостью и недомоганием.
Осложнения
Наиболее опасные осложнения связаны с нарушением целостности оболочки амебного абсцесса. При прорыве гнойника в брюшную полость развивается перитонит, в плевральную полость ‒ амебная эмпиема плевры. Попадание инфекции в кровоток приводит к сепсису, инфекционно-токсическому шоку. При проникновении патогенных микроорганизмов в легочную ткань возникает пневмония, абсцесс легкого, гепатобронхиальный свищ. Попадание паразитов в полость перикарда осложняется развитием сдавливающего перикардита, который может вызывать нарушение сердечного ритма, сердечную недостаточность и тампонаду сердца. В результате гематогенной диссеминации возбудителя возможно формирование абсцессов головного мозга.
Диагностика
В связи с длительным бессимптомным периодом и частым отсутствием специфических проявлений верификация диагноза амебный абсцесс печени может вызывать значительные трудности. Часто заболевание обнаруживается на поздних стадиях при развитии осложнений. При подозрении на патологию назначаются следующие обследования:
- Осмотр врача. При расспросе важную роль играет эпидемиологический анамнез (пребывание в жарких странах, употребление воды из непроверенных источников, немытых фруктов и овощей). Во время пальпации живота специалист (гастроэнтеролог, абдоминальный хирург, инфекционист) обращает внимание на увеличенные границы печени и боль в подреберье справа.
- УЗИ печени. Проведение ультразвукового исследования позволяет определить локализацию, размеры и структуру амебного абсцесса. При исследовании визуализируется округлое гипоэхогенное подкапсульное образование в печёночной паренхиме с неоднородным содержимым.
- Лабораторная диагностика. В общем анализе крови отмечается лейкоцитоз, ускорение СОЭ, в биохимическом анализе - повышение уровня АЛТ, АСТ, щелочной фосфатазы, билирубина, общего белка. Для выявления тканевой формы возбудителя назначают исследование кала. Серологические тесты (РГА, РНИФ, ИЭФ, РСК и др.) проводятся для определения специфических антител в сыворотке крови.
В сложных и спорных ситуациях для более детального изучения структуры органа выполняют МСКТ печени. Дифференциальная диагностика заболевания проводится с абсцессами другой этиологии (бактериальной, туберкулезной, эхинококковой и др.), доброкачественными и злокачественными новообразованиями печени.
Лечение амебного абсцесса печени
Лечение патологии направлено на угнетение тканевых форм паразитов и прекращение гнойного процесса. Все пациенты с подозрением на амебный абсцесс подлежат госпитализации в профильное отделение. Основу консервативной терапии составляет комбинированное назначение противопротозойных, противомикробных, антибактериальных препаратов. Наряду с этиотропным лечением проводят дезинтоксикационную и симптоматическую терапию противовоспалительными, обезболивающими средствами.
Тяжелым коморбидным пациентам, не ответившим на начальный терапевтический курс, под контролем УЗИ осуществляют тонкоигольную аспирацию содержимого абсцесса с целью взятия материала для исследования и санации очага. После удаления содержимого в полость вводят растворы антибиотиков или антисептиков. Открытое хирургическое вмешательство проводится при неэффективности консервативной терапии в течение 2-3 суток, при множественных и огромных гнойниках. В этом случае выполняют вскрытие, дренирование, тщательную обработку полости антисептическим раствором, после чего санируют брюшную полость и ушивают рану.
Прогноз и профилактика
Прогноз заболевания зависит от величины амебного абсцесса и наличия осложнений. При своевременной диагностике и грамотном лечении прогноз благоприятный. Развитие осложнений может привести к тяжелым жизнеугрожающим последствиям вплоть до летального исхода (20% при легочных осложнениях, 40-70% при кардиальных осложнениях). Профилактические мероприятия направлены на обеспечение населения качественной питьевой водой, соблюдение правил личной гигиены (мытье рук, овощей и фруктов). Большое значение имеет раннее выявление больных и носителей инфекции, их лечение и предупреждение заражения здоровых людей. После выздоровления пациенты в течение года подлежат диспансерному наблюдению. Медицинский контроль заключается в ежеквартальном прохождении лабораторных исследований (анализ кала, серологические реакции).
3. Абдоминальная хирургия. Национальное руководство / под ред. Затевахина И.И., Кириенко А.И., Кубышкина В.А. – 2017
Абсцесс печени – это ограниченная полость, расположенная в печени и заполненная гноем. Развивается вследствие других заболеваний либо первичного поражения. Проявляется болями в правом подреберье, повышением температуры, желтушностью кожи. Диагноз ставится путем сбора анамнеза, осмотра, проведения УЗИ печени, применения вспомогательных методов исследований. Лечение может быть консервативным (антибиотикотерапия) или хирургическим (вскрытие абсцесса). Прогноз заболевания при своевременном начале лечения благоприятный.
МКБ-10

Общие сведения
Абсцесс печени – это деструктивное заболевание, при котором в ткани печени формируется полость с гнойным содержимым. На сегодняшний день определено множество причин возникновения абсцессов в печени, но наиболее значимыми из них являются аппендицит, желчнокаменная болезнь и сепсис. Такие абсцессы достаточно сложны в диагностике, поэтому постоянно разрабатываются новейшие методики определения и лечения данного состояния. Применяются более современные методики лечения – все чаще при обнаружении гнойника в печени хирурги прибегают к его лапароскопическому или тонкоигольному дренированию, а расширенные лапаротомические операции постепенно уходят в прошлое.
Причины
Основное условие образования гнойника в печени – снижение общего и местного иммунитета. Формирование абсцесса может быть вызвано различными возбудителями, чаще всего это гемолитический стрептококк, золотистый стафилококк, энтеробактерии, кишечная палочка, клебсиелла, анаэробные микроорганизмы. Нередко при посеве гноя выделяется смешанная флора. Заболеванием чаще страдают мужчины. Амебная этиология преобладает в возрастной группе 20-35 лет, а бактериальная – после 40 лет. Абсцессы печени разделяются по пути распространения инфекции:
- по желчным путям при холецистите, холангите, желчнокаменной болезни, раке желчных путей;
- контактно при возникновении воспалительных процессов в брюшной полости: аппендицит, дивертикулит, неспецифический язвенный колит у лиц с иммунодепрессией;
- по кровеносным сосудам при сепсисе.
Также инфекционный агент может попасть в орган при травмах печени, во время операции на печени, при инфицировании различных кист печени (паразитарных и непаразитарных), из очагов распада опухолей и специфических гранулем. Иногда причину возникновения патологии установить не удается.
Классификация
В абдоминальной хирургии существует несколько классификаций абсцесса печени:
- По количеству: единичный и множественные абсцессы.
- По месту возникновения: поражение левой или правой доли печени.
- По этиологии: бактериальные и паразитарные абсцессы.
По причине развития патология может быть первичной или вторичной. Разные авторы трактуют это разделение по-разному – ряд специалистов говорит о первичном очаге инфекции, другие – о наличии или отсутствии изменений в ткани печени до возникновения абсцесса. Сходятся они в одном: причину возникновения первичного абсцесса обычно определить не удается (такие абсцессы называют криптогенными).
Симптомы абсцесса печени
Формирование абсцесса обычно характеризуется возникновением болей в правом подреберье, которые могут иррадиировать под лопатку или в плечо справа. Пациент отмечает усиление болей в положении на левом боку. Интенсивность боли может снижаться в положении на правом боку с подтянутыми к груди коленями. Боль тупая, ноющая, постоянная. Также отмечается чувство тяжести в правом подреберье. Печень увеличена в размерах, выступает из-под реберной дуги. При пальпации печени или при надавливании на подреберья в проекции абсцесса отмечается значительная болезненность.
Могут беспокоить диспепсические явления: снижение или отсутствие аппетита, тошнота, метеоризм, жидкий стул (диарея). Повышается температура до фебрильных цифр (выше 38°С), возникает озноб с похолоданием ног, появлением на них гусиной кожи. Отмечаются явления тяжелейшей интоксикации, тахикардия, проливные поты.
Потеря веса – зачастую единственная жалоба на первых этапах развития абсцесса, в связи с чем диагностика на ранних стадиях затруднительна. На более поздних стадиях появляется желтушность слизистых и кожи. При компрессии сосудов печени или их тромбировании вследствие воспалительного процесса может появиться асцит (скопление жидкости в брюшной полости).
Главная особенность течения абсцессов печени заключается в том, что клиника часто маскируется основным заболеванием, на фоне которого и развился абсцесс, поэтому от начала формирования патологического процесса до его диагностирования зачастую проходит длительное время.
Осложнения
Абсцесс печени может осложняться прорывом гноя в брюшную или плевральную полости, полость перикарда, соседние органы (кишечник, желудок). При разрушении стенки сосуда возможно сильное кровотечение. Также возможно распространение инфекции с формированием поддиафрагмального абсцесса, развитием сепсиса с образованием абсцессов в других органах (легкие, головной мозг, почки и др.).
Диагностика
Для своевременной диагностики абсцесса печени большое значение имеет правильный и подробный сбор анамнеза. При этом выясняется наличие в организме больного хронических очагов инфекции, а в анамнезе - тяжелых инфекционных заболеваний, опухолей, операций, травм. Следует выяснить, с чем сам пациент связывает возникновение жалоб, когда они появились и как изменился их характер с момента возникновения.
- УЗИ печени. По данным УЗИ гепатобилиарной системы также возможно обнаружение в печени полости, заполненной жидкостью и сгустками гноя, определение ее размеров и топографии. Одновременно под контролем УЗИ возможно проведение тонкоигольной биопсии абсцесса с определением характера выпота, чувствительности флоры к антибиотикам. Эта процедура является лечебно-диагностической, так как одновременно производится дренирование абсцесса печени.
- Рентгенография ОБП. Для уточнения диагноза используются классические и современные методики. При проведении рентгенографии можно обнаружить участок просветления в печени с уровнем жидкости, жидкость в плевральной полости (реактивный плеврит), ограничение подвижности диафрагмы справа.
- Томография. МРТ или МСКТ брюшной полости позволяют определиться с количеством и расположением абсцессов, их размерами, помогают разработать оптимальную тактику лечения и план операции. При сложностях в диагностике или невозможности проведения указанных исследований можно выполнить ангиографию и радиоизотопное сканирование печени – оба этих метода могут выявить дефект кровоснабжения и накопления изотопа в печени, соответствующий расположению и размерам абсцесса.

- Лабораторные исследования. В лабораторных анализах обычно отмечаются изменения, характерные для воспалительных заболеваний (снижение уровня гемоглобина и эритроцитов, увеличение пула лейкоцитов, изменения в лейкоформуле). В биохимическом анализе крови повышаются показатели, свидетельствующие о повреждении ткани печени (АСТ, АЛТ, ЩФ, билирубин).
В самых сложных случаях прибегают к диагностической лапароскопии. При этом в брюшную полость вводится специальный видеоинструментарий, позволяющий рассмотреть органы, определиться с диагнозом, а при возможности провести дренирование абсцесса. Дифференциальная диагностика абсцесса печени проводится с поддиафрагмальным абсцессом, гнойным плевритом, гнойным холециститом.
Лечение абсцесса печени
Тактика лечения в каждом конкретном случае разрабатывается индивидуально. При наличии небольшого единичного или множественных мелких абсцессов тактика будет консервативной.
Консервативное
Назначается антибиотик в соответствии с посевами и чувствительностью микрофлоры (при амебной этиологии абсцесса назначают противопаразитарные препараты). Так как посев гноя позволяет выделить возбудителя только в трети случаев, эмпирически назначаются цефалоспорины третьего поколения, макролиды и аминогликозиды. Если возможно проведение чрескожного дренирования полости, в ней устанавливают дренажные трубки, через которые в полость также вводится антибиотик, антисептические растворы.
Хирургическое
При необходимости хирургического лечения стараются прибегать к малоинвазивным методикам (эндоскопическое дренирование), однако при трудной локализации процесса предпочтение отдается классической лапаротомии с вскрытием абсцесса печени. Всем пациентам с перенесенным абсцессом назначается специальная диета №5, восстановительная терапия. Обязательно проводится соответствующее лечение заболевания, приведшего к образованию гнойника. Больные этого профиля наблюдаются хирургом-гепатологом. При необходимости привлекается инфекционист.
Прогноз и профилактика
Прогноз при своевременно начатом и адекватном лечении одиночного абсцесса печени благоприятный – до 90% пациентов выздоравливают. При множественных мелких гнойника или отсутствии лечения одиночного очага летальный исход весьма вероятен. Профилактикой данного заболевания является предотвращение заражения амебиазом (в первую очередь соблюдение личной гигиены), своевременное выявление и лечение заболеваний, которые могут привести к образованию гнойников в печени.
1. Абсцессы печени / Ахаладзе Г.Г., Церетели И.Ю. // Анналы хирургической гепатологии - 2006 - Т.11, №1
2. Абсцессы печени: выбор метода лечения / Пащина С.Н., Благитко Е.М., Беспалов А.А. // Медицинские и фармацевтические науки - 2014 - №4
3. Современная тактика в лечении бактериальных абсцессов печени / Овчинников В.А., Малов А.А. и др. // Медицинский альманах - 2013 - №5
4. Абсцессы печени: причины, диагностические ошибки и лечение. Автореферат диссертации / Церетели И.Ю. - 2005
Читайте также:

