Стеноз бдс на почве аскаридоза
Обновлено: 25.04.2024
Рассмотрены классификация, клиническая картина и клинические типы дисфункции большого дуоденального сосочка (БДС), методы диагностики, включая дифференциальную диагностику функциональных и органических поражений сфинктера БДС, и подходы к лечению.
An examination was provided on classification, clinical picture and clinical types of dysfunction of major duodenal papilla (MDP), the methods of diagnostics, including differential diagnostics of the functional and organic failures of sphincter MDP, and approaches to the treatment.
Дисфункции большого дуоденального сосочка (БДС) — функциональные заболевания, проявляющиеся нарушением механизмов расслабления и сокращения сфинктера Одди с преобладанием повышения тонуса и спазма (гипермоторная, гиперкинетическая) или расслабления и атонии (гипомоторная, гипокинетическая), без органических и воспалительных изменений, вызывающие нарушение поступления желчи и панкреатического сока в двенадцатиперстную кишку.
Дискинезия желчных протоков обычно возникает в результате нарушения нейрогуморальной регуляции механизмов расслабления и сокращения сфинктеров Одди, Мартынова–Люткенса и Мирицци. В одних случаях преобладают атония общего желчного протока и спазм сфинктера Одди вследствие повышения тонуса симпатического отдела вегетативной нервной системы, в других — гипертония и гиперкинезия общего желчного протока при расслаблении упомянутого выше сфинктера, что связано с возбуждением блуждающего нерва. В клинической практике чаще встречается гипермоторная дискинезия. Причина — психогенное воздействие (эмоциональные перенапряжения, стрессы), нейроэндокринные расстройства, воспалительные заболевания желчного пузыря, поджелудочной железы, двенадцатиперстной кишки. Дисфункции БДС часто сочетаются с гипермоторными и гипомоторными дискинезиями желчного пузыря.
Классификация:
1. Дисфункция по гипертоническому типу:
- с гипермоторной, гиперкинетической дискинезией желчного пузыря;
- с гипомоторной, гипокинетической дискинезией желчного пузыря.
2. Дисфункция по гипотоническому типу (недостаточность сфинктера Одди):
- с гипермоторной, гиперкинетической дискинезией желчного пузыря;
- с гипомоторной, гипокинетической дискинезией желчного пузыря.
Клиника:
- тупая или острая, выраженная, устойчивая боль в эпигастральной области или правом подреберье с иррадиацией в правую лопатку, левое подреберье, может носить опоясывающий характер с иррадиацией в спину;
- не сопровождается повышением температуры, ознобом, увеличением печени или селезенки;
- боль связана с приемом пищи, но может появляться ночью;
- может сопровождаться тошнотой и рвотой;
- наличие идиопатического рецидивирующего панкреатита;
- исключение органической патологии органов гепатопанкреатической области;
- клинический критерий: рецидивирующие приступы сильных или умеренных болей продолжительностью более 20 минут, чередующиеся с безболевыми интервалами, повторяющиеся на протяжении не менее 3 месяцев, нарушающие трудовую деятельность.
Клинические типы дисфункции БДС:
1. Билиарный (встречается чаще): характерны боли в эпигастрии и правом подреберье, иррадиирующие в спину, правую лопатку:
- вариант 1 — болевой синдром в сочетании со следующими лабораторно-инструментальными признаками:
- повышение аспартатаминотрансферазы (АСТ) и/или щелочной фосфатазы (ЩФ) в 2 и более раз при 2-кратном исследовании;
- замедленное выведение контрастного вещества из желчных протоков при эндоскопической ретроградной панкреатохолангиографии (ЭРПХГ) более 45 мин;
- расширение общего желчного протока более 12 мм;
2. Панкреатический — боли в левом подреберье, иррадиируют в спину, уменьшаются при наклоне вперед, не отличаются от болей при остром панкреатите, могут сопровождаться повышением активности панкреатических ферментов при отсутствии причин (алкоголь, желчнокаменная болезнь):
- вариант 1 — болевой синдром в сочетании со следующими лабораторно-инструментальными признаками:
- повышение активности сывороточной амилазы и/или липазы в 1,5–2 раза выше нормы;
- расширение панкреатического протока при ЭРПХГ в головке поджелудочной железы свыше 6 мм, в теле — 5 мм;
- превышение времени выведения контрастного вещества из протоковой системы в положении лежа на спине на 9 мин по сравнению с нормой;
3. Смешанный — боли в эпигастрии или опоясывающие, могут сочетаться с признаками как билиарного, так и панкреатического типа дисфункции.
Недостаточность БДС — чаще всего бывает вторичной, у больных желчнокаменной болезнью, хроническим калькулезным холециститом, вследствие прохождения конкремента, воспаления поджелудочной железы, слизистой двенадцатиперстной кишки, при дуоденальной непроходимости. При дуоденальном зондировании сокращается фаза закрытого сфинктера Одди менее 1 мин или отмечается отсутствие фазы закрытия сфинктера, отсутствие тени желчного пузыря и протоков при холецистохолангиографии, заброс контрастного вещества в желчные протоки при рентгеноскопии желудка, наличие газа в желчных протоках, снижение показателей остаточного давления при холангиоманометрии, уменьшение времени поступления радиофармпрепарата в кишку менее 15–20 мин при гепатобилисцинтиграфии.
Диагностика
1. Трансабдоминальная ультрасонография. Ультразвуковой скрининговый метод обследования занимает ведущее место в диагностике дискинезий (табл.), позволяет с высокой точностью выявить:
- особенности структурных изменений желчного пузыря и желчных протоков, а также печени, поджелудочной железы (форму, расположение, размеры желчного пузыря, толщину, структуру и плотность стенок, деформации, наличие перетяжек);
- характер гомогенности полости желчного пузыря;
- характер внутрипросветного содержимого, наличие внутриполостных включений;
- изменение эхогенности паренхимы печени, окружающей желчный пузырь;
- сократительную способность желчного пузыря.
Ультразвуковые признаки дискинезий:
- увеличение или уменьшение объема;
- неоднородность полости (гиперэхогенная взвесь);
- снижение сократительной функции;
- при деформации желчного пузыря (перегибы, перетяжки, перегородки), которые могут быть следствием воспаления, дискинезии встречаются значительно чаще;
- остальные признаки свидетельствуют о воспалительном процессе, перенесенном воспалении, желчнокаменной болезни, служат для дифференциальной диагностики.
2. Ультразвуковая холецистография. Дает возможность исследовать моторно-эвакуаторную функцию желчного пузыря в течение 1,5–2 часов от момента приема желчегонного завтрака до достижения первоначального объема. В норме через 30–40 мин после стимуляции желчный пузырь должен сократиться на 1/3–1/2 объема. Удлинение латентной фазы более 6 мин свидетельствует об усилении тонуса сфинктера Одди.
3. Динамическая гепатобилисцинтиграфия. Основана на регистрации временных показателей пассажа короткоживущих радионуклидов по билиарному тракту. Позволяет оценить поглотительно-выделительную функцию печени, накопительно-эвакуаторную функцию желчного пузыря (гипермоторная, гипомоторная), проходимость терминального отдела общего желчного протока, выявить обструкцию желчных путей, недостаточность, гипертонус, спазм сфинктера Одди, стеноз БДС, дифференцировать органические и функциональные нарушения при помощи пробы с Нитроглицерином или Церукалом. При гипертонусе сфинктера Одди отмечается замедление поступления препарата в двенадцатиперстную кишку после желчегонного завтрака. Этот метод наиболее точно позволяет установить тип дискинезии и степень функциональных нарушений.
4. Фракционное хроматическое дуоденальное зондирование. Дает информацию о:
- тонусе и моторике желчного пузыря;
- тонусе сфинктера Одди и Люткенса;
- коллоидной стабильности пузырной и печеночной фракции желчи;
- бактериологическом составе желчи;
- секреторной функции печени.
5. Гастродуоденоскопия. Позволяет исключить органические поражения верхних отделов желудочно-кишечного тракта, оценить состояние БДС, поступление желчи.
6. Эндоскопическая ультрасонография. Позволяет более четко визуализировать терминальный отдел общего желчного протока, БДС, головку поджелудочной железы, место впадения вирсунгова протока с целью диагностики конкрементов, дифференциальной диагностики органических поражений БДС и гипертонуса.
7. Эндоскопическая ретроградная холангиопанкреатография. Метод прямого контрастирования желчных путей, позволяет выявить наличие конкрементов, стеноз БДС, расширение желчных путей, произвести прямую манометрию сфинктера Одди, играет большое значение в дифференциальной диагностике органических и функциональных заболеваний.
8. Компьютерная томография. Позволяет выявить органическое поражение печени и поджелудочной железы.
9. Лабораторная диагностика. При первичных дисфункциях лабораторные анализы не имеют отклонений от нормы, что имеет значение для дифференциальной диагностики. Транзиторное повышение уровня трансаминаз и панкреатических ферментов может отмечаться после приступа при дисфункции сфинктера Одди.
Лечение
Основная цель — восстановление нормального оттока желчи и панкреатического сока в двенадцатиперстную кишку.
Основные принципы лечения:
1) нормализация процессов нейрогуморальной регуляции механизмов желчевыделения — лечение неврозов, психотерапия, устранение гормональных расстройств, конфликтных ситуаций, отдых, правильный режим питания;
2) лечение заболеваний органов брюшной полости, которые являются источником патологических рефлексов на мускулатуру желчного пузыря и желчных протоков;
3) лечение дискинезии, которое определяется ее формой;
4) устранение диспептических проявлений.Лечение при гипертонической форме дискинезии
1. Устранение невротических расстройств, коррекция вегетативных нарушений:
- седативные препараты: настои трав валерианы и пустырника, Корвалол, Ново-пассит — оказывают седативный эффект, нормализуют сон, расслабляют гладкую мускулатуру;
- транквилизаторы: Рудотель (медазепам) — утром и днем по 5 мг, вечером — 5–10 мг; Грандаксин — 50 мг 1–3 раза в сутки;
- психотерапия.
- режим питания с частыми (5–6 раз в сутки), дробными приемами пищи;
- исключают алкогольные и газированные напитки, копченые, жареные, жирные, острые, кислые блюда, приправы, животные жиры, масла, концентрированные бульоны (диета № 5);
- исключают или ограничивают употребление яичных желтков, сдобы, кремов, орехов, крепкого кофе, чая;
- показаны гречневая каша, пшено, пшеничные отруби, капуста.
- Но-шпа (дротаверин) — 40 мг 3 раза в сутки в течение 7–10 дней до 1 месяца, для снятия болевого приступа — 40–80 мг, или 2–4 мл 2% раствора внутримышечно, внутривенно капельно в физиологическом растворе хлористого натрия;
- Папаверин — 2 мл 2% раствора внутримышечно, внутривенно капельно; в таблетках 50 мг 3 раза в сутки;
- Дюспаталин (мебеверин) — 200 мг 2 раза в сутки за 20 мин до еды.
4. Прокинетики: Церукал (метоклопрамид) — 10 мг 3 раза в сутки за 1 час до еды.
5. Одестон (гимекромон) — обладает спазмолитическим действием, расслабляет сфинктер желчного пузыря, желчных протоков и сфинктер Одди, не влияя на моторику желчного пузыря — 200–400 мг 3 раза в сутки в течение 2–3 недель.
Лечение при гипотонической форме дискинезии
- дробное питание — 5–6 раз в сутки;
- в состав диеты входят продукты, оказывающие желчегонное действие: растительное масло, сметана, сливки, яйца;
- в меню должно входить достаточное количество клетчатки, пищевых волокон в виде фруктов, овощей, ржаного хлеба, так как регулярное опорожнение кишечника действует тонизирующим образом на желчевыводящие пути.
2. Холеретики — стимулируют желчеобразовательную функцию печени:
- Фестал — 1–2 таблетки 3 раза в сутки после еды;
- Холосас, Холагол — 5–10 капель 3 раза в сутки за 30 мин до еды, отвар желчегонных трав — 3 раза в сутки — 10–15 дней.
3. Оказывающие спазмолитическое и желчегонное действие:
- Одестон — 200–400 мг 3 раза в сутки — 2–3 недели. Эффективен в случаях одновременного наличия гипомоторной дисфункции желчного пузыря и гипермоторной дисфункции сфинктера Одди;
- Эссенциале Форте Н — 2 капсулы 3 раза в сутки.
4. Холекинетики — повышают тонус желчного пузыря, снижают тонус желчных путей:
- 10–25% раствор магния сульфата по 1–2 столовые ложки 3 раза в сутки;
- 10% раствор сорбита по 50–100 мл 2–3 раза в сутки за 30 мин до еды;
- средства растительного происхождения.
- Церукал (метоклопрамид) — 10 мг 3 раза в сутки за 1 час до еды;
- Мотилиум (домперидон) — 10 мг 3 раза в сутки за 30 мин до еды.
Одестон эффективен в случаях одновременного наличия гипомоторной дисфункции желчного пузыря и гипермоторной дисфункции сфинктера Одди. При сочетании гиперкинетической, нормокинетической дисфункции желчного пузыря и гиперкинетической дисфункции сфинктера Одди эффективность терапии Но-шпой достигает 70–100%. При сочетании гипокинетической дисфункции желчного пузыря и гиперкинетической сфинктера Одди показано назначение Церукала или Мотилиума, возможно в сочетании с Но-шпой. При сочетании гипермоторной дисфункции желчного пузыря и гипомоторной сфинктера Одди эффективно назначение экстракта артишоков 300 мг 3 раза в сутки.
Спазмолитики являются основным медикаментозным средством для лечения гипертонических, гиперкинетических дисфункций желчного пузыря и сфинктера Одди при остром болевом приступе и болях в межприступный период. Миотропные спазмолитики оказывают целенаправленное воздействие на гладкую мускулатуру всей желчевыводящей системы. Результаты многочисленных исследований показали, что дротаверин (Но-шпа) является препаратом выбора из группы миотропных спазмолитиков, позволяет купировать болевой синдром, восстановить проходимость пузырного протока и нормальный отток желчи в двенадцатиперстную кишку, устранить диспептические нарушения. Механизм действия — ингибирование фосфодиэстеразы, блокирование Ca2+-каналов и кальмодулина, блокирование Na+-каналов, в результате снижение тонуса гладкой мускулатуры желчного пузыря и желчных протоков. Лекарственные формы: для парентерального применения — ампулы 2 мл (40 мг) дротаверина, для приема внутрь — 1 таблетка препарата Но-Шпа (40 мг дротаверина), 1 таблетка препарата Но-Шпа форте (80 мг дротаверина).
Преимущества препарата Но-Шпа:
- Быстрая абсорбция: пик концентрации препарата в плазме наступает через 45–60 минут, 50-процентная абсорбция достигается за 12 минут, что характеризует дротаверин как быстро всасывающийся препарат.
- Высокая биодоступность: при приеме внутрь составляет 60%, после однократного приема внутрь 80 мг дротаверина гидрохлорида максимальная концентарация в плазме достигается через 2 часа, хорошо проникает в сосудистую стенку, печень, стенку желчного пузыря и желчных протоков.
- Главный путь метаболизма — окисление дротаверина до монофенольных соединений, метаболиты быстро конъюгируются с глюкуроновой кислотой.
- Полная элиминация: период полувыведения составляет 9–16 часов, около 60% при пероральном приеме выделяется через желудочно-кишечный тракт и до 25% — с мочой.
- Наличие лекарственной формы Но-шпы как для перорального, так и парентерального введения делает возможным широкое использование препарата в неотложных ситуациях.
- Препарат Но-шпа может применяться в период беременности (после тщательного взвешивания соотношения преимущества и риска).
- Быстрое начало действия, продолжительный эффект: парентеральное введение дротаверина (Но-Шпы) обеспечивает быстрый (в течение 2–4 мин) и выраженный спазмолитический эффект, что особенно важно для купирования острых болей.
- Таблетированная форма характеризуется также быстрым началом действия.
- Высокая клиническая эффективность в небольших дозах: составляет 70%, у 80% больных отмечается купирование симптомов спазма и боли в течение 30 мин.
- Отсутствие существенной разницы в скорости достижения спазмолитического эффекта между монотерапией препаратом Но-шпа и комбинированной терапией.
- Проверенная временем безопасность, отсутствие серьезных побочных эффектов за период более 50 лет. Отсутствие антихолинергической активности сказывается на безопасности дротаверина, расширяя круг лиц, которым он может быть назначен, в частности, у детей, у мужчин пожилого возраста с патологией предстательной железы, при сопутствующей патологии и совместно с другими препаратами при одновременном приеме двух и более препаратов.
Таким образом, обзор результатов многочисленных клинических исследований свидетельствует, что Но-шпа является эффективным препаратом для быстрого купирования спазмов и болей при гипертонических, гиперкинетических формах дискинезии желчного пузыря и сфинктера Одди.
Литература
А. С. Воротынцев, кандидат медицинских наук, доцент
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Эндоскопические способы лечения рубцовых стенозов трахеи применяются с начала XXв. , однако широкое распространение они получили в последние 20 лет. Это произошло благодаря внедрению в клиническую практику электрохирургической техники, ультразвуковой и лазерной деструкции.
Кроме бужирования, стенозированный участок может быть расширен с помощью электрокоагуляции, лазерного излучения или радиоволны.
С появлением оптических квантовых генераторов большие надежды на успех в лечении больных со стенозами трахеи или крупных бронхов связаны с использованием лазерного луча. При воздействии на рубцы лазерного излучения происходят выпаривание и коагуляция поверхностного слоя облучаемой ткани (Чирешкин Д. Г. и соавт. , 1990; Овчинников А. А. и соавт. , 1996, 1999). При использовании HAr-Nd-лазера с контактным
световодом удается добиться минимального повреждения окружающих тканей. Однако при угрозе кровотечения лучше использовать HAr-Nd-лазер с бесконтактным световодом для достижения лучшего коагуляционного эффекта. В настоящее время, подавляющее большинство эндоскопических лазерных вмешательств производят СОг-лазером с экспозицией 0, 1, 0, 2 или 0, 5 с и мощностью 20 - 30 Вт. Лазерное выпаривание рубцовых тканей производят по периметру трахеи с постепенным смещением вниз. Данная методика показана при непротяженных стенозах. При восстановлении просвета трахеи протяженностью более 2 см после лазерного воздействия образуется большая зона некроза. Образующаяся раневая поверхность длительно заживает, и протяженность стеноза увеличивается.
Учитывая эти отрицательные моменты, А. Я. Самохин и М. А. Русаков предложили методику выпаривания рубцов в проекции 4, 8 и 12 часов с постепенным продвижением световода к каудальной границе сужения. Глубина рассечения составляет 4 - 5 мм. Затем выполняют бужирование трахеи.
Оперативные бронхоскопические вмешательства чреваты такими тяжелыми осложнениями, как кровотечение в просвет дыхательных путей, перфорация стенки трахеи или бронха.
Главным критерием хорошего результата лазерной фотокоагуляции у трахеотомированных больных является деканюляция, у нетрахеотомированных - стойкое расширение просвета дыхательной трубки при благоприятных функциональных показателях.
Широкое применение нашла методика электрорассечения суженного участка трахеи (Лукомский Г. И. и соавт. , 1986). Чаще процедуру выполняют игольчатым инъектором. После рассечения тканей возможно дополнительное расширение просвета трахеи бужами или интубационными трубками. Преимуществом этого способа лечения по сравнению с лазерным лечением являются его общедоступность и низкая стоимость. Недостатком
электрохирургического метода является приваривание электрода к ткани, отрыв образовавшегося струпа и возникновение кровотечения.
Однако, независимо от метода эндоскопического воздействия на рубцовые ткани, просвет трахеи вновь суживается в сроки от 7 - 14 дней до нескольких месяцев. Предупредить повторное сужение можно введением в трахею стентов. В литературе их называют по-разному: протезы, эндопротезы, протекторы, стенты.
На первых этапах эндопротезы вводили в просвет трахеи через трахеостому. В дальнейшем были разработаны и применены в клинике эндоскопические способы введения эндопротезов. Одни авторы фиксировали протез с помощью нити (Amemiya R. и
соавт. , 1985; Temes R. T. и соавт. , 1995). Другие авторы устанавливали в бронхах самофиксирующиеся силиконовые стенты, предложенные DumonJ. F. (1989).
Самофиксирующиеся эндопротезы представляют собой трубку из силиконовой резины с наружным диаметром 11, 5 -16, 0 мм и толщиной стенки 1, 0 - 1, 5 мм. На наружной поверхности трубки в шахматном порядке расположены выступы цилиндрической формы высотой 2 мм. Вначале во время эндоскопического исследования проводят
расширение стенозированного участка с помощью электрохирургической техники, лазера или бужа. Однако ни один из способов разрушения рубцовой ткани не является абсолютно надежным. Успех эндоскопического вмешательства в большей степени зависит от протяженности стеноза, степени зрелости фиброзной ткани и наличия сохранных хрящевых полуколец в стенозированном сегменте. Затем тубус ригидного бронхоскопа устанавливают над зоной стеноза. Эндопротез проводят в зону стеноза через просвет эндоскопа с помощью биопсийных щипцов таким образом, что его дистальный и проксимальный концы располагаются с захватом 5 мм интактной стенки трахеи. Для
профилактики смещения стента в течение 5-7 дней назначают препараты, подавляющие кашлевой рефлекс. На протяжении этого времени расширенный просвет трахеи сокращается, выступы на наружной поверхности эндопротеза погружаются в слизистую оболочку трахеи и он плотно фиксируется в стенозированном участке.
Дилатация стеноза с помощью стента проводится в сроки от 1 мес до 4 лет. Во всех случаях, независимо от вида стеноза, показан периодический эндоскопический контроль с интервалом 1-2 мес. Это позволяет вовремя диагностировать и устранить возможные осложнения, связанные с нахождением инородного тела в просвете трахеи.
Положительные результаты отмечены у 49% больных. У остальных развивается рестеноз после удаления стента.
М.А. Евсеев, А.Л. Владыкин, Ю.А. Бирюкова, В.Е. Никитин. Представлено клиническое наблюдение рецидивного холедохолитиаза, связанного с развитием опухоли большого дуоденального сосочка на фоне суб- декомпенсированного рубцового стеноза пилоробульбарного сегмента; описаны этапы инструментальной диагностики и интраоперационная тактика в процессе лечения. Хирургическая практика. 2015, №1.
![]()
Рецидивный и резидуальный холедохолитиаз как много десятилетий назад, так и сегодня является по-прежнему трудным для диагностики и лечения осложнением желчнокаменной болезни (ЖКБ). По сводным данным литературы частота резидуальных и вновь сформированных камней желчных протоков с течением времени не уменьшается и может достигать 29%. Причины возникновения рецидивного и резидуального холедохолитиаза разнообразны. Тем не менее ведущим этиопатогенетическим фактором данной патологии по всеобщему мнению является недостаточный объем до- и интраоперационного обследований желчных путей и, как следствие, не диагностированные в предоперационном периоде и на операции холедохолитиаз, патология терминального отдела холедоха, большого дуоденального сосочка и головки поджелудочной железы. Последние три причины определяют возникновение, как правило, не резидуальных, а рецидивных конкрементов в желчевыводящих протоках. В качестве примера рецидивного холедохолитиаза, обусловленного развитием злокачественной опухоли большого дуоденального сосочка, приводим следующее клиническое наблюдение.
Пациентка Р. , 62 лет, поступила во 2 хирургическое отделение Городской клинической больницы № 52 Департамента здравоохранения города Москвы в экстренном порядке 06. 01. 15 с клинической картиной механической желтухи, холангита.
Из анамнеза известно, что в 2013 году пациентка находилась на лечении в ГКБ № 5х города Москвы по поводу хронического калькулезного холецистита, холедохолитиаза, субкомпенсированного рубцово-язвенного стеноза пилоро-бульбарной зоны. В период госпитализации после безуспешных попыток выполнения ретроградной холангиопанкреатографии (РХПГ), эндоскопической папиллосфинктеротомии (ЭПСТ) и литоэкстракции пациентка была оперирована. Произведены срединная лапаротомия, холецистэктомия, холедохолитотомия, дренирование холедоха по Керу, пилоропластика по Гейнеке — Микуличу. Послеоперационный период протекал гладко, пациентка была выписана в обычные сроки, дренаж Кера удален через три недели.
Повторное возникновение желтухи с эпизодами гипертермии пациентка отметила в последней декаде декабря 2014 года, по поводу чего в срочном порядке 31. 12. 14 была госпитализирована в ГКБ № 1х города Москвы, где диагноз механической желтухи был верифицирован, но активных хирургических действий не предпринималось.
Пациентка покинула ГКБ № 1х и самостоятельно обратилась в хирургическое отделение ГКБ № 52. На момент госпитализации в ГКБ № 52 06. 01. 15 факт механической желтухи и холангита был подтвержден клинически, данными УЗИ (билиарная гипертензия, холедохолитиаз), лабораторно (прямой билирубин 432 мкмоль/л, общий билирубин 464 мкмоль/л), гектической лихорадкой, лейкоцитозом (до 14, 6 х 109/л) ; кроме того пациентка периодически отмечала возникновение чувства переполнения в эпигастрии при приеме твердой пищи, редко — рвоту съеденной пищей.
Пациентке выполнена фиброэзофагогастроскопия, при которой выявлен суб- декомпенсированный стеноз пилоробульбарного сегмента (аппарат 9 мм через зону стеноза провести не удалось, просвет двенадцатиперстной кишки не визуализирован), органической патологии со стороны пищевода и желудка выявлено не было. При экспертном УЗИ гепатобилиопанкреатической зоны наряду с дилатацией холедоха и множественным холедохолитиазом в области головки поджелудочной железы, но не в ее ткани, нечетко лоцировалось мягкотканное образование 2 х 2 см.
В экстренном порядке 06. 01. 15 пациентке под УЗ-контролем произведена чрезкожная чреспеченочная холангиостомия (ЧЧХС), дренаж 12 Fr через левый долевой проток установлен в гепатикохоледох, получена темная желчь с хлопьями фибрина. Пациентке проводилась комплексная дезинтоксикационная, антибактериальная терапия, дозированная билиарная декомпрессия, сбалансированная энтральная и парентеральная нутритивная поддержка. Через 7 суток на фоне снижения гипербилирубинемии до 62 мколь/л пациентке проведена чрездренажная холангиография, при которой выявлены множественные крупные конкременты общего желчного протока, дислоцированные от супрадуоденального до терминального его отделов, блок поступления контраста в двенадцатиперстную кишку; оценить состояние стенок интрапанкреатического и интрадуоденального отделов холедоха не представлялось возможным. В удовлетворительном состоянии без явлений интоксикации с функционирующим наружным желчным свищом (дебит желчи 600 мл/сут) пациентка была выписана для проведения амбулаторной реабилитации с рекомендацией последующей госпитализации через 14 суток для проведения радикального хирургического лечения.
25. 01. 15 пациентка вновь самостоятельно обратилась в ГКБ № 52 и была госпитализирована в хирургическое отделение. На момент повторной госпитализации состояние пациентки клинически и по данным лабораторных исследований было расценено как удовлетворительное, явления желтухи и холангита клинически регрессировали полностью. Дополнительно в плане обследования больной выполнена рентгеноскопия желудка с контрастом, при которой контраст задерживался в желудке более 6 часов, опрдлялись признаки суб- декомпенсированного стеноза пилоробульбарной зоны, вследствие чего добиться тугого заполнения контрастом просвета двенадцатиперстной кишки и оценить состояние ее слизистой не удалось.
При проведении компьютерной томографии органов брюшной полости и забрюшинного пространства визуализирован умеренно дилатированный холедох с равномерно утолщенными стенками и множественными крупными конкрементами в просвете, расширение вирсунгова протока на всем протяжении до 0, 9 см, мягкотканное образование стенки двенадцатиперстной кишки в области интактной головки поджелудочной железы 2, 5 х 2, 5 см с тенденцией к накоплению контраста в артериальную фазу.
Таким образом на основании комплексного обследования у пациентки диагностированы рецидивный холедохолитиаз, суб-декомпенсированный рубцовый стеноз пилоро-бульбарного сегмента, состояние после наружного дренирования желчных протоков, полный наружный желчный свищ, опухоль большого дуоденального сосочка (?). Учитывая установленный клинический диагноз, включающий как рецидивный холедохолитиаз, так и стеноз пилоробульбарного сегмента при невозможности консервативного разрешения данных патологических состояний, а также невозможность неинвазивной оценки состояния терминального отдела холедоха и исключения опухолевого процесса в данной зоне, принято решение о необходимости проведения оперативного вмешательства. Предполагаемый объем вмешательства: дистальная резекция 2/3 желудка по Ру с холедохолитотомией и билиодигестивным анастомозом — минимальный, гастропанкреатодуоденальная резекция (ГПДР) — максимальный.
После подписания информированного согласия пациентка была оперирована в плановом порядке. При выполнении верхне-срединной лапаротомии, проведения адгезиолизиса, ревизии органов брюшной полости и выполнении диагностической дуоденотомии установлен следующий интраоперационный диагноз: Рак большого дуоденального сосочка oT3N1M0 (IIB стадия), регионарная лимфаденопатия ретропанкреатических узлов; рецидивный холедохолитиаз, состояние после холецистэктомии, дренирования холедоха от 2013 года, состояние после ЧЧХС от 06. 01. 15; суб- декомпенсированный рубцовый стеноз пилоро-бульбарного сегмента, состояние после пилоропластики по Гейнеке-Микуличу от 2013г.
Учитывая интраоперационный диагноз принято решение о выполнении вмешательства в объеме ГПДР. Произведена гастропанкреатодуоденальная резекция с регионарной лимфаденэктомией. Реконструкция производилась с формированием панкреатико-гастроанастомоза, гепатико-энтероанастомоза на выключенной по Ру петле и поперечного функционального полуклапанного гастро-энтероанастомоза.
При морфологическом исследовании операционного препарата диагностирована низкодифференцированная аденокарцинома большого дуоденального сосочка с инвазией стенки ДПК и головки поджелудочной железы, метастазы опухоли в 3 из 6 ретропанкреатических узлов, в других регионарных лимфоузлах метастазов не выявлено, радикальность резекции — R0, стадия онкопроцесса - рT3N1M0 (IIB стадия).
Ведение пациентки в послеоперационном периоде проводилось по программе ERAS (Enhansed Rehabilitation After Surgery) с ранним (на 2-е сутки) началом энтерального питания и активизацией больной. Ранний послеоперационный период у пациентки протекал гладко. На 7-е сутки послеоперационного периода пациентка после проведения контрастного исследования пищеварительного тракта и удаления холангиостомического дренажа выписана на амбулаторную послеоперационную реабилитацию с полным восстановлением пищеварительной функции. Рекомендовано проведение адъювантной полихимиотерапии под наблюдением врача-онколога, а также опроеделение возможности проведения таргетной биотерапии после иммуногистохимического анализа на р53 и KRAS.
Таким образом, причиной возникновения рецидивного холедохолитиаза у пациентки Р. послужило длительное и прогрессирующее нарушение пассажа желчи в терминальном отделе холедоха вследствие развития опухоли большого дуоденального сосочка. Интересность данного клинического наблюдения, на наш взгляд, обусловлена редким сочетанием трех патологических процессов — опухоли большого дуоденального сосочка, рецидивирующим холедохолитиазом и рубцовым стенозом пилоро-бульбарного сегмента. Последний сделал очевидно невозможной дооперационную верификацию опухолевого процесса и определения первопричины рецидива патологии билиарного тракта.
Проведенное в объеме гастропанкреатодуоденальной резекции оперативное вмешательство явилось радикальным методом лечения как с точки зрения имеющегося онкологического процесса, так и с точки зрения обеспечения максимально адекватного функционирования желудка, билиарного тракта и поджелудочной железы (рис. 7). Последний момент особенно интересен, поскольку формирование именно панкреатико-гастроанастомоза имеет целый ряд позитивных особенностей, среди которых наиболее важными являются: возможность сохранения большей части желудка (выполняется антрумрезекция) без опасности развития его острого эрозивно-язвенного поражения вследствие защитного ощелачивающего действия бикарбонатов панкреатического сока; отсутствие активации панкреатических ферментов в кислой среде желудка при отсутствии энтерокиназы; пространственное разделение билио- и панкреатикодигестивного анастомозов, что принципиально уменьшает риск несостоятельности последнего. Мы полагаем, что именно такой вариант реконструкции позволяет добиться максимально быстрой и эффективной реабилитации пациента в послеоперационном период, в том числе после вмешательств большого объема, что и продемонстрировало приведенное клиническое наблюдение.
Алибегов Р. А. , Касумьян С. А. , Борсуков А. В. , Сергеев О. А. и др. Панкреатодуоденальная резекция в лечении рака головки поджелудочной железы и периампулярной зоны // Хирургия. 2003. - № 6. - С. 32-35.
Бахтин В. А. , Янченко В. А. , Аракелян С. М. Хирургическая тактика лечения больных со злокачественными опухолями внепеченочных желчных протоков, осложненными механической желтухой. Вестник Ивановской медицинской академии 2007; 12: 3: 4: 77 — 78.
Гарипов Р. М. , Латыпов Р. З. , Тигов А. Р. Диагностиченский алгоритм при рецидивном и резидуальном холедохолитиазе. Медицинский вестник Башкыртостана, 10, 2012, 9-17.
Данилов М. В. , Фёдоров В. Д. Хирургия поджелудочной железы. М. , Медицина. 1995; 512.
Касаткин В. Ф. Пути улучшения непосредственных результатов панкреатодуоденальной резекции при периампулярном раке. Хирургия. 2008; 10; 10–15.
Кубачев К. Г. , Борисов А. Е. , Изудинов А. С, Хромов В. В. , Сагитова Д. С. Выбор способа дренирования желчных протоков при механической желтухе опухолевого генеза //Анналы хирургической гепатологии, 2009. — Т. 14. — № 3. — С. 56 — 59.
Кубышкин В. А. , Вишневский В. А. Рак поджелудочной железы. М: Медицина. 2003.
Михалева Л. М. , Грачева Н. А. Клиническая морфология стеноза большого дуоденального сосочка. Успехи современного естествознания. – 2006. – № 2 – С. 57-58
Патютко Ю. И. , Котельников А. Г. Хирургия рака органов билиопакреатодуоденальной зоны. М: Медицина. 2007.
Bologna A. Sülle stenosi benigne del coledoco terminale / A. Bologna, N. Dei Poli // Minerva Chir. 2009. - Vol. 24, N 22. - P. 1291-1311.
Bang BW, Lee TH, … Jeong S. Twenty-Second versus Sixty-Second Dilation Duration in Endoscopic Papillary Balloon Dilation for the Treatment of Small Common Bile Duct Stones: A Prospective Randomized Controlled Multicenter Trial. Clin Endosc 2015; 48 (1): 59-65
Griffith C. F. Diagnosis of papillary stenosis by calibration. Follow -up 15 to 25 years after sphincteroplasty // Amer. J. Surg. 2007. -Vol. 143, N6. -P. 717-720.
Komarovska M. , Snarska J. , Troska P. Recurrent residual choledocholithiasis after cholecystectomy. Polish Annals of Medicine. Volume 18, Issue 1, 2011, P. 118–124.
Parra-Membrives P, Díaz-Gómez D, Vilegas-Portero R, et al. Appropriate management of common bile duct stones: a RAND Corporation/UCLA Appropriateness Method statistical analysis. Surg Endosc 2010 May; 24 (5): 1187-94.
В чем заключаются трудности диагностики гельминтозов? Какова терапия гельминтозов? На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов
В чем заключаются трудности диагностики гельминтозов?
Какова терапия гельминтозов?На фоне глобальных экологических изменений, широкого применения иммунных, антибактериальных и прочих лекарственных препаратов, частых нарушений адаптационных процессов (болезни адаптации), постоянного стресса, повышения уровня образованности и культуры населения многие давно известные заболевания человека изменили свою клиническую картину. Некоторые симптомы практически перестали встречаться, другие, наоборот, стали выходить на первый план. Это относится и к заболеваниям, вызываемым гельминтами, в частности, круглыми паразитическими червями (нематодами). В умеренном поясе наиболее широко распространенные нематоды — аскарида и острицы.
Гельминты могут вызывать нарушения функции желудочно-кишечного тракта (ЖКТ), быть причиной аллергических (или псевдоаллергических) реакций или усугублять их, вызывать интоксикацию, а также быть фактором, ослабляющим иммунитет [2]. В настоящее время редко встречаются случаи массивной инвазии, когда диагностика не вызывает затруднений, а клубки гельминтов вызывают обтурации кишечника, — значительно чаще гельминты стали являться причиной развития аллергических проблем. При этом гельминтозы относятся к тем заболеваниям, которые трудно диагностировать в связи с объективными и субъективными трудностями (длительные периоды отсутствия яйцекладки, возможность отсутствия среди паразитирующих особей самок, вероятность технических ошибок). Поэтому важно знать клиническую картину данных заболеваний, чтобы иметь возможность назначать углубленное обследование или эффективную терапию по совокупности косвенных признаков, даже не имея прямых доказательств наличия гельминтоза.
С целью оценить клиническую картину при нематодозах проанализированы жалобы, анамнез и результаты осмотра 150 детей, у которых были обнаружены аскариды (116 детей), острицы (27 детей), аскариды и острицы (7 детей). Гельминты выявлены стандартными методами: обнаружение яиц аскарид в фекалиях методом мазка или яиц остриц в соскобе на энтеробиоз, а также визуальное обнаружение аскарид или остриц в фекалиях, рвотных массах или при оперативном или эндоскопическом вмешательстве в брюшной полости или в области прямой кишки [3].
Среди детей было 67 мальчиков, 83 девочки. Распределение по возрасту представлено в табл. 1. Преобладали дети младшего дошкольного возраста (от одного до трех лет), их количество составило 63%. Именно в этом возрасте — наибольшие эпидемиологические предпосылки появления нематодозов.
У 150 детей с доказанными инвазиями аскаридами и/или острицами отмечались следующие клинические проявления.
У 107 детей (71,3%) были аллергические проблемы: кожные высыпания, диатез, атопический дерматит, нейродермит — у 99 (66%), из них у 18 эти проблемы носили периодический характер, у двух детей, кроме кожных высыпаний, отмечались конъюнктивиты; у десяти (6,7%) отмечалась доказанная пищевая аллергия на какие-то продукты с высоким уровнем специфических IgE в сыворотке крови; у шести детей (4%) отмечался астматический компонент или был установлен диагноз бронхиальная астма.
Бруксизм (скрежетание зубами) — симптом, который часто связывается с глистными инвазиями, но фактически является неспецифическим признаком интоксикации центральной нервной системы и может сопровождать любые хронические интоксикации — отмечался у 25 детей (16,7%).
Нарушения ночного сна отмечались у 81 ребенка (54%): беспокойство к вечеру, затруднения засыпания — у 15 детей (10%); беспокойный ночной сон (вскрикивания, постанывания, метания во сне, пробуждения, плач, бессонница, кошмарные сновидения) — у 76 (50,7%). Некоторые родители старших детей затруднялись охарактеризовать ночной сон ребенка, т. к. ребенок спит в другой комнате. Проблемы с засыпанием и ночным сном — важный симптом глистных инвазий, т. к. известно, что кишечные нематоды (в том числе аскариды и острицы) часто активизируются именно ночью.
У 54 детей (36%) отмечались зуд и/или покраснения в области заднего прохода (анальная эскориация) — у 43 детей (28,7%); зуд — у 38 (25,3%); оба симптома — у 27 (18%). Анальная эскориация и зуд считаются симптомами энтеробиоза (острицы), но при этом из 54 детей, у которых отмечались данные симптомы, энтеробиоз был доказан у 17 детей (31,5% от числа детей с этими симптомами). У других 37 детей (68,5% от числа детей с данными симптомами) было доказано наличие аскаридоза, но ни визуально, ни в анализах не были обнаружены острицы. Это может свидетельствовать либо о том, что в данных случаях присутствовали острицы, которые не были диагностированы, т. е. гельминтоз был смешанным, либо о том, что анальная эскориация и зуд — симптомы, характерные не только для энтеробиоза, но и аскаридоза.
У 29 детей (19,3%) отмечались признаки общего ослабления иммунитета: часто или длительно болеющие дети (по общепринятой классификации Monto J. et al., 87) — 18 детей (12%); рецидивирующие стоматиты, гингивиты отмечались у 13 детей (8,7%); кариес зубов — у шести (4%); рецидивирующие гнойные заболевания кожи или слизистых — у трех (2%).
У 15 детей (10%) имелись результаты исследования иммунного статуса по крови: у 13 детей было снижено количество Т-клеток; у всех 15 детей было снижено количество Т-хелперов, причем у шести из них — существенно; у 12 детей было снижено хелперно-супрессорное соотношение; у семи детей отмечалось снижение уровня IgA (секреторный иммуноглобулин), в том числе у трех — существенное, у остальных же восьми детей уровень IgA в сыворотке крови был либо нормальным, либо повышенным; у шести детей отмечалось снижение количества лимфоцитов, в том числе у одного ребенка была выраженная лимфо- и нейтропения. Эти результаты подтверждают известные данные о том, что аскариды и острицы угнетающе влияют на функции иммунитета, а также что у людей с ослабленным иммунитетом большая вероятность появления гельминтоза [1].
У большинства детей отмечалось более одного симптома. Обобщенные данные по клинической картине представлены в табл. 2.
Терапия во всех случаях состояла из двух этапов: сначала — антигельминтная терапия, причем назначались два разных препарата (декарис и вермокс) с интервалом три — пять дней между ними, чтобы максимально охватить различные стадии жизни гельминтов; через некоторое время после антигельминтной терапии — препараты для микробиологической и функциональной коррекции. Соответственно оценивались результаты противоглистной терапии, результаты всего лечения, а также катамнез в течение шести месяцев после терапии. В большинстве случаев улучшение наступало быстро в процессе лечения. У 36 детей только после антигельминтной терапии существенно уменьшились или полностью исчезли аллергические проявления, у 39 детей после первого этапа терапии нормализовалась работа ЖКТ, у 41 ребенка сразу прекратились боли в животе, по остальным симптомам также наступало улучшение после противоглистных препаратов. Это подтверждает то, что симптомы были вызваны наличием гельминтов.
У 92 детей после всего лечения не было никаких жалоб; о 37 нет данных об изменениях состояния в процессе и после лечения; у 16 детей эффект был неполным, т. е. какие-то симптомы сохранялись и после окончания лечения; у четырех детей эффект от терапии оказался нестойким, поскольку возникли рецидивы после окончания лечения; у трех детей эффекта от терапии не было.
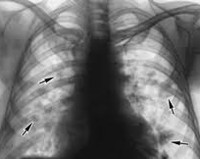
Аскаридоз лёгких – это патологическое состояние, обусловленное механическим повреждением органов дыхания личинками круглых гельминтов – аскарид, а также токсическим и аллергическим действием продуктов их жизнедеятельности. Проявляется кашлем с небольшим количеством слизистой мокроты, бронхоспастическим синдромом, может протекать по типу бронхопневмонии или серозного плеврита. Диагноз устанавливается на основании клинических симптомов, рентгенологических и лабораторных данных, результатах серологических исследований. Лечение осуществляется эффективными в отношении аскарид противогельминтными препаратами и патогенетическими средствами.
МКБ-10
![Аскаридоз легких]()
Общие сведения
Аскаридоз лёгких является острой стадией антропонозного геогельминтоза, вызываемого аскаридами. Согласно статистическим данным, аскаридозом страдает более 1 миллиарда человек в мире, ежегодному заражению подвергаются 100-200 тысяч. Заболеванию подвержены лица всех возрастных категорий, 65-70% заразившихся составляют дети. По частоте встречаемости данный гельминтоз занимает второе место среди всех глистных инвазий, уступая только энтеробиозу. Аскаридоз наиболее распространён в странах с жарким и влажным субтропическим и тропическим климатом. В некоторых государствах Средней и Юго-Восточной Азии, африканского континента аскаридами заражено более 50% населения.
![Аскаридоз легких]()
Причины
Возбудителем аскаридоза лёгких является представитель семейства нематод аскарида человеческая в личиночной стадии развития. Взрослая особь паразитирует в тонком кишечнике исключительно человека, который становится источником инвазии. Аскариды двуполы. Самки почти вдвое крупнее самцов и могут достигать 40 см в длину, откладывают до 250 000 оплодотворённых и неоплодотворённых яиц ежедневно. С каловыми массами больного яйца попадают в почву. Эпидемиологическую опасность представляют только оплодотворённые яйца. При достаточной температуре, влажности и аэрации почвы в них вызревают личинки. Проглатывание таких яиц вызывает аскаридоз. При неблагоприятных условиях развитие личинок приостанавливается, но их жизнеспособность внутри яиц длительно сохраняется. Гельминты пребывают в кишечнике на протяжении года, затем при отсутствии повторной инвазии происходит самоизлечение. Факторами риска развития болезни являются:
- Метеоклиматические условия. В некоторых регионах с жарким влажным климатом при массовом скрининге аскаридоз выявляется у 95-98% населения. Личинки гельминтов в таких климатических зонах вызревают в течение всего календарного года, тогда как в умеренном климате заражение человека аскаридами происходит с апреля по октябрь. В жарких сухих регионах заболеваемость гельминтозом значительно ниже. В условиях вечной мерзлоты аскаридоз не встречается.
- Антисанитария. Распространению глистной инвазии способствует скученность населения, отсутствие водопровода и канализации, нехватка воды. Часто аскаридоз развивается в результате употребления в пищу немытых овощей и ягод, выращенных с применением необеззараженных человеческих фекалий в качестве удобрения.
- Детский возраст.Гельминтоз у детей дошкольного и младшего школьного возраста встречается в 1,5 раза чаще, чем у взрослых. Дети раннего возраста пробуют предметы на вкус, берут в рот грязные пальцы, много контактируют с домашними животными, играют в песочнице, не соблюдая правила гигиены в силу возрастных особенностей.
- Профессиональная деятельность. Заболеванию больше подвержены лица, вынужденные постоянно контактировать с почвой. Аскаридоз обнаруживается у полеводов, агрономов и других работников сельскохозяйственных предприятий. Среди городских жителей чаще болеют сотрудники озеленительных служб, овощных магазинов и баз.
Патогенез
Яйца гельминтов попадают в человеческий организм фекально-оральным путём с загрязнёнными продуктами питания, водой. Заболевание начинается с острой миграционной фазы. Личинка выходит из яйца и крючкообразными отростками прикрепляется к внутренней стенке тонкой кишки. Ротовым отверстием она перфорирует слизистую оболочку и проникает в кишечные вены. С током крови через воротную и нижнюю полую вены гельминт мигрирует в правые отделы сердца, затем – в лёгочные артерии, капилляры, альвеолы, бронхиолы. В респираторном тракте личинки развиваются в течение 20-21 дня.
Паразитируя в лёгких, гельминты блокируют мелкие сосуды. Нарушается питание лёгочной паренхимы. Образуются микроинфаркты альвеолярной ткани. Продукты жизнедеятельности аскарид оказывают мощное сенсибилизирующее действие на человеческий организм. Развивается воспалительная реакция. Вокруг гельминта образуется инфильтрат, состоящий из лимфоцитов, эозинофилов, плазматических клеток, иногда гистиоцитов. Впоследствии такие инфильтраты либо полностью разрешаются, либо на их месте формируются участки фиброза. Сенсибилизация организма метаболитами аскарид нередко приводит к возникновению бронхообструкции. С кашлевыми толчками личинки нематод забрасываются в глотку, заглатываются и повторно попадают в тонкий кишечник. Заболевание переходит в хроническую кишечную стадию.
Симптомы аскаридоза лёгких
Первые клинические признаки поражения лёгких аскаридами появляются на 7-10 день глистной инвазии. Симптомы болезни многообразны. Пациента беспокоит приступообразный кашель со скудным отделением светлой мокроты, изредка возникает кровохарканье. Эозинофильная пневмония сопровождается субфебрильной лихорадкой. Иногда (чаще – в детском возрасте) температура тела поднимается выше 38°C. Для такой формы гельминтоза лёгких характерен неправильный тип лихорадки. При повышении температуры выявляется озноб. Выражены и другие симптомы интоксикации: общая слабость, головная боль, снижение аппетита, неустойчивое настроение.
Интенсивные, усиливающиеся при глубоком вдохе, кашле, чихании и движении боли в правой или левой половине грудной клетки свидетельствуют о развитии плеврита. Позднее присоединяется смешанная одышка, выраженность которой зависит от количества экссудата в плевральной полости. Токсико-аллергическое действие метаболитов аскарид провоцирует бронхоспазм. Пациента беспокоят приступы удушья с затруднением выдоха, сопровождающиеся сухим кашлем и свистом в груди. Наряду с лёгочной симптоматикой часто присутствуют уртикарные кожные высыпания, гепатоспленомегалия. Иногда аскаридоз лёгких протекает скрыто.
Осложнения
Тяжёлые осложнения аскаридоза обычно возникают в хронической кишечной фазе болезни. Наиболее часто страдают органы желудочно-кишечного тракта – развивается холецистохолангит, аппендицит, кишечная непроходимость. Смертельную опасность представляет проникновение взрослых особей в правый желудочек и лёгочные артерии, а также заползание аскарид через пищевод и глотку в дыхательные пути, приводящее к гибели больного от асфиксии. Появляющийся в остром периоде респираторный аллергоз может сохраняться длительное время после элиминации гельминтов.
Диагностика
Диагностику гельминтоза осуществляют инфекционисты-паразитологи. В фазе поражения лёгких в диагностическом поиске часто принимает участие пульмонолог. При сборе анамнеза у пациентов с подозрением на лёгочный аскаридоз уточняют профессиональный маршрут, наличие контакта с почвой (возделывание земли на приусадебном участке, сезонные сельхозработы). При осмотре можно обнаружить кожную сыпь. Аускультативно выслушиваются рассеянные сухие свистящие хрипы, локальные влажные хрипы, при плеврите – шум трения плевры, резкое ослабление дыхания с одной стороны. Выявить аскаридоз на стадии миграции аскарид помогают следующие методы исследования:
- Рентгенография лёгких. На рентгенограмме легких часто просматриваются летучие инфильтраты Леффлера. Затенения сохраняются в течение 2-3 дней, затем полностью разрешаются и появляются в другом сегменте, доле или лёгком. Изредка инфильтрация лёгочной ткани персистирует на протяжении 20-30 дней. Иногда при рентгеновском исследовании визуализируются признаки наличия экссудата в полости плевры.
- Лабораторные анализы. В периферической крови, мокроте, плевральной жидкости определяется высокий уровень содержания эозинофилов. При исследовании бронхиального секрета также можно обнаружить спирали Куршмана и кристаллы Шарко-Лейдена, характерные для респираторного аллергоза. ПЦР мокроты позволяет выявить ДНК гельминтов.
- Серологическая диагностика. Методы серологической диагностики (РНГА, РИФ, ИФА) основаны на обнаружении антител к аскаридам в сыворотке крови. Чаще всего используется иммуноферментный анализ. Антитела к гельминтам начинают вырабатываться на 5-10 сутки от начала инвазии. Определение титров иммуноглобулинов класса М и G даёт возможность диагностировать аскаридоз в период пребывания личинок аскарид в лёгких.
Длительно не разрешающиеся эозинофильные инфильтраты лёгочной ткани следует дифференцировать с бактериальной пневмонией, онкологической патологией лёгких, туберкулёзом. Летучие инфильтраты иногда появляются в приступном периоде бронхиальной астмы и при других аллергических болезнях. Для уточнения диагноза может понадобиться участие онкологов, фтизиатров, аллергологов-иммунологов и дерматологов.
Лечение аскаридоза лёгких
Лёгочный аскаридоз является ранней стадией глистной инвазии и хорошо поддаётся консервативной терапии. При этом многие специалисты в сфере паразитологии и инфектологии считают, что противогельминтные препараты более эффективны в кишечную фазу развития болезни. Кроме того, токсическое действие продуктов распада личинок при их массовой гибели может вызвать тяжёлый пульмонит. Лечение противопаразитарными средствами осуществляется в несколько (2-3) этапов. В стадию миграции личинок можно назначать тиобендазол, мебендазол или албендазол. Большое значение на данном этапе имеет купирование патологических состояний. Применяются антигистаминные препараты, кортикостероиды, бронходилататоры. Через 10-14 дней курс противогельминтной терапии повторяют.
Прогноз и профилактика
Прогноз при адекватном лечении благоприятный. Аскаридоз лёгких обычно полностью излечивается. При повторных инвазиях, например, у лиц, проживающих в эндемичных очагах, к данному гельминтозу постепенно формируется иммунитет. Специфической профилактики аскаридоза не существует. Чтобы избежать инвазии, необходимо соблюдать правила личной гигиены, не использовать воду из открытых водоёмов для питья и приготовления пищи, не есть немытые овощи, фрукты, зелень. Общественная профилактика включает в себя строительство очистных сооружений, безопасное в отношении паразитов удобрение сельскохозяйственных угодий, массовую профилактическую дегельминтизацию населения неблагополучных по аскаридозу регионов.
2. Клинические рекомендации (протокол лечения) оказания медицинской помощи взрослым больным аскаридозом. - 2016.
3. Глистная инвазия в структуре респираторных аллергозов: бронхиальная астма и симндром Леффлера/ Восканян А.Г., Восканян А.// Международный журнал прикладных и фундаментальных исследований. – 2016 – №4.
Читайте также: