Стерильный инфекционный иммунитет может быть
Обновлено: 11.05.2024
Взаимодействие между системой иммунитета и микроорганизмом может либо не иметь последствий, либо привести к колонизации им тканей, что проявится широким спектром клинических вариантов инфекционного процесса – от манифестной формы инфекционного заболевания, до бессимптомного микробного носительства
Инфекционные болезни – это обширная группа заболеваний человека, вызываемых патогенными вирусами, бактериями, риккетсиями, грибами и простейшими у чувствительных макроорганизмов. Инфекционные болезни – ведущая причина смертности в мире: ежегодно погибает около 17 млн. человек. Появились новые инфекции – ВИЧ-инфекция, лихорадка Эбола, атипичная пневмония и др. Отмечается активация ранее известных болезней – туберкулеза, гепатитов, малярии в связи с изменчивостью микроорганизмов и модуляцией иммунореактивности людей в сторону повышения их чувствительности.
Следовательно, главной стратегией борьбы с инфекциями в 21-м веке должно быть иммунопрофилактическое повышение популяционной и индивидуальной неспецифической и специфической резистентности – иммунитета у людей.
Противобактериальный иммунитет
Факторы, определяющие форму и тяжесть течения инфекционного процесса, зависят от микроорганизмов (доза, патогенность, вирулентность и т.д.) и от состояния макроорганизма (возраст, общее состояние здоровья, состояние иммунокомпетентных систем и т.д.).
Результатом взаимодействия микробов и макроорганизма может быть нестерильный иммунитет, когда факторы патогенности и иммунитет уравновешены, стерильный иммунитет – освобождение от инфекта и инфекция – размножение вирулентного микроба.
Неспецифическая резистентность и местный иммунитет
Возбудители заболеваний часто проникают в организм через слизистые оболочки носа, дыхательных путей, глаз, мочеполовых путей и кишечного тракта. Реже это происходит через кожу, преимущественно при повреждении эпителия.
На пути проникновения микробов находятся местные факторы защиты. Неповрежденные кожа и слизистые оболочки непреодолимы для многих микроорганизмов. Кроме механического барьера, кожа обладает значительными бактерицидными свойствами, которые связаны с выделением молочной и жирных кислот, ферментов, пота, сального секрета и т.д. Слизистые оболочки носоглотки и дыхательных путей обладают выраженными защитными свойствами. Секреты, выделяемые слизистыми, слюнными и пищеварительными железами, не только смывают микроорганизмы с поверхности слизистых оболочек, но и оказывают существенное бактерицидное действие за счет содержащихся в них лизоцима, различных ферментов, кислой среды желудочного содержимого, а также нормальной микрофлоры организма и др.
Нормальная бактериальная флора слизистых оболочек, особенно кишечника, препятствует развитию патогенных микроорганизмов. Ее нарушение при антибиотикотерапии ведет к дисбактериозам и инфекции.
Неспецифическая защита организма в значительной мере контролируетcя генетическими механизмами, которые обеспечивают видовой иммунитет – невосприимчивость организмов одного вида к инфекционным заболеваниям другого вида вследствие исключения возможности размножения возбудителей. Имеются данные о генетически наследуемой невосприимчивости в отдельных популяциях людей к ряду инфекционных заболеваний (малярия, туберкулез, корь, полиомиелит и др.).
Тяжелое течение инфекционного процесса или фатальный для хозяина исход может наблюдаться при снижении уровня неспецифической защиты и иммунологической реактивности хозяина, большой дозе и высокой вирулентности возбудителя, а также при неестественных путях его проникновения. Хронизация инфекционного процесса, как правило, определяется несостоятельностью иммунного ответа к возбудителю. Чувствительность к менингококкам повышена при дефиците терминальных компонентов комплемента, а тяжелое течение менингококковой инфекции ассоциировано с определенным аллотипом FcRIIa рецептора.
Комплекс факторов естественного врожденного иммунитета может полностью элиминировать микроорганизмы без развития специфического иммунного ответа. В этот комплекс входят гуморальные факторы: лизоцим, СРБ, маннансвязывающий белок, комплемент (альтернативный путь активации), трансферрин, а также лейкоциты (нейтрофилы, макрофаги), которые выделяют ранние цитокины – ФНО, ИЛ-1, ИНФ и др., активирующие все клетки СИ.
Антитела В1-лимфоцитов серозных полостей – важный фактор естественного иммунитета. Антитела классов IgM и sIgA, образуемые ими, осуществляют врожденный антибактериальный иммунитет, в первую очередь, против бактерий кишечника, а также капсулообразующих микробов (пневмококков, гемофильной палочки). IgM-антитела оказывают комплементзависимую цитотоксичность, а sIgA опсонируют до 90% бактерий тонкого кишечника, препятствуя их адгезии к эпителию. Эти антитела исходно специфичны к распространенным антигенам бактерий: фосфорилхолину, полисахаридам и ЛПС.
-Т-клетки, представляющие врожденный клеточный иммунитет, во многом определяют резистентность мышей к M.tuberculosis, так дефицитные по ним мыши быстро погибают от этой инфекции.
В некоторых ситуациях микроорганизмы персистируют без явного иммунного ответа на фоне полезной ареактивности организма. Однако существуют механизмы, сдерживающие их размножение. К такой ситуации можно отнести бактерионосительство.
Факторы естественного иммунитета служат первым этапом защиты, а затем они включают механизмы адаптивного (приобретенного) иммунитета.
Формирование противобактериального иммунитета
Специфический иммунный ответ развивается в макроорганизме против антигенов возбудителя, его токсинов и других продуктов жизнедеятельности или против антигенов вакцин и анатоксинов. В результате такого взаимодействия клетки СИ, в первую очередь макрофаги, дендритные клетки, распознают чужеродные антигены уже в местах их первичного внедрения и запускают иммунный ответ. На клетках усиливается экспрессия адгезинов и интегринов.
Сила и специфичность этого ответа зависит от совокупности генов, контролирующих систему главного комплекса гистосовместимости (МНС) или HLA-антигенов у человека. Кроме того, весьма важную роль в распознавании липидных, например, микобактериальных антигенов, играют CD1-молекулы.
Наконец, важнейшую роль в индукции антимикробного иммунитета с дальнейшим перенаправлением его по клеточному или гуморальному пути играет система Toll-like рецепторов (TLR), распознающих молекулярные структурные образы патогенов (подробнее – см. гл. 1).
Для каждого конкретного возбудителя имеются свои условия и особенности развития инфекции или иммунитета, зависящие от его вирулентности, пути проникновения и других свойств. Проникновение многих возбудителей в организм сопровождается фазой бактериемии и антигенемии, когда бактерии и их антигены циркулируют в крови (брюшной тиф, сальмонеллезы и др.). Часто она сопровождается началом клинических проявлений, потому что часть бактерий распадается и их эндотоксин – ЛПС – вызывает клинические синдромы (лихорадку и др.).
В зависимости от химической природы антигенов возбудителя, внутри- или внеклеточной его локализации и других факторов, иммунный ответ макроорганизма может происходить с преобладанием Т-клеточного или антительного В-клеточного иммунитета с образованием вначале IgM, а затем IgG и IgA антител. После элиминации возбудителя клоны эффекторных клеток под влиянием супрессии иммунного ответа уменьшаются и остаются долгоживущие клетки памяти, обеспечивающие длительный, а при отдельных инфекциях – пожизненный иммунитет. Приобретенный антибактериальный иммунитет и антивирусный имеют много общего.
При повторной встрече макроорганизм за счет даже небольшого фонового количества антител, а также способности быстрого размножения Т- и В-лимфоцитов с вовлечением клеток памяти способен нейтрализовать возбудителя. Феномен развития иммунологической памяти после первичной встречи с антигенами возбудителя служит основой приобретенного иммунитета, а феномен усиления иммунологической памяти после повторных встреч с антигенами используется при ревакцинации – повторном введении вакцин с целью поддержания достаточно напряженного иммунитета.
Специфический иммунитет у части компактно проживающего населения (коллектива) составляет основу коллективного иммунитета: 80% иммунных людей достаточно для прекращения эпидемического распространения самых контагиозных инфекционных заболеваний. Однако в связи с тем, что не все вакцинированные отвечают достаточным иммунитетом, на практике для прекращения эпидемического процесса при различных инфекциях требуется прививать не менее 95% населения. Для объективного контроля за уровнем индивидуального и коллективного иммунитета определяют титры протективных антител в крови.
Способность к иммунному ответу изменяется с возрастом. В организме новорожденного функционируют уже все механизмы системы иммунитета, однако дети первых месяцев и даже первых лет жизни иначе чем взрослые реагируют на антигены. Защита новорожденных от микроорганизмов обеспечивается антителами –иммуноглобулинами класса G, проходящими трансплацентарно от матери. Существенный вклад в поддержание иммунологической реактивности детей вносит поступление секреторных иммуноглобулинов А, лизоцима и даже иммунокомпетентных клеток с молоком матери. У многих пожилых людей, особенно на фоне вирусных инфекций и других заболеваний, наблюдается снижение иммунологической реактивности и повышение чувствительности к инфекции.
Варианты приобретенного антибактериального иммунитета
Приобретенный иммунитет к бактериальным инфекциям различается по механизмам в зависимости от факторов патогенности возбудителя. В одних случаях, когда бактерии выделяют токсины, или чувствительны к антителам, он эффективен, в других – неэффективен, например, при индукции антител к внутриклеточным бактериям, в третьих – при выделении избытка цитокинов, иммунный ответ повреждает собственные ткани.
Бактериальные инфекции, которые зависят от продукции экзотоксинов, индуцируют антитоксический иммунитет (дифтерия, столбняк, ботулизм и др.). Ведущая роль в нейтрализации токсинов принадлежит IgM- и IgG-антителам. IgM-антитела в крови выявляются уже через 48 часов после заражения и достигают пика через 7-10 дней (при инфекциях – позже). Затем преобладают IgG-антитела. Молекула антитела, присоединившись вблизи активного центра токсина, может стереохимически блокировать его связь с рецептором. В комплексе с антителами токсин теряет способность к диффузии в тканях и может стать объектом фагоцитоза.
Основным механизмом антибактериальной защиты является фагоцитоз (рис. 3.1). В иммунном организме эффективность фагоцитоза повышается за счет опсонизирующего действия специфических IgM- и IgG-антител, взаимодействующих Fab-фрагментами с антигенами на поверхности бактерий и одновременно с Fc-рецепторами на мембранах фагоцитов. Это приводит к окислительному взрыву и активации других бактерицидных систем фагоцитирующих клеток.
Инфекционные заболевания у пациентов со сниженным иммунитетом. Инфекции при иммунодефиците
Различные методы лечения или наследственная патология иммунной системы могут способствовать развитию инфекционного заболевания, обусловленного слабовирулентными штаммами микроорганизмов, или возникновению тяжёлых инфекций, связанных с патогенными возбудителями.
Недостаточность иммунной системы обычно возникает в результате воздействия нескольких факторов. Например, при нейтропении, развивающейся у пациентов, перенёсших пересадку костного мозга, повышена восприимчивость организма к бактериальным инфекциям, в то время как внутривенная катетеризация способствует развитию инфекции, вызванной Staphylococcus epidermidis.
Медицинские манипуляции часто нарушают физические барьеры на пути инфекции (например, катетеризация).
Нейтропения как причина инфекции при иммунодефиците
Гранулоцитопению обычно наблюдают при острой лейкемии или её лечении. Риск развития инфекции зависит от длительности и тяжести нейтропении. Бактериемию у таких больных обнаруживают в 40—70% случаев. Наиболее часто выделяют гра-мотрицательные бациллы (бактерии семейства Enterobacteriaceae и рода Pseudomonas). Они распространяются по организму в результате повреждения кишечника противоопухолевыми препаратами и облучением.
Кроме того, в этиологии сепсиса важную роль играют фамположительные микроорганизмы (S. epidermidis, S. mitis, S. oralis, S. aureus, Corynebacterium jeikeium и представители рода Enterococcus).
Несмотря на то что в большинстве случаев развитие кандидоза обусловлено приёмом антибактериальных препаратов, у пациентов с нейтропенией грибковые инфекции могут возникать de novo. В последнее время всё чаше сообщают о микозах, вызванных дрожжевыми грибами, такими как Candida krusei (характерна природная устойчивость к действию противогрибковых средств), различными видами родов Aspergillus (вызывают инвазивные заболевания) и Fusarium, а также Pseudallescheria boydii и Trichosporon beigelii.
Лечение лихорадки у пациентов с нейтропенией. Эмпирическая терапия включает карбапенем (или цефтазидим) и амикацин. Если лихорадка не исчезает, то дополнительно назначают гликопептидный антибиотик. Позже, если лихорадка сохраняется, высока вероятность развития микозов, поэтому для лечения используют амфотерицин В и итраконазол.
Профилактика инфекции у пациентов с нейтропенией. Вероятность развития инфекции у пациентов с нейтропенией заметно снижается, если в больнице их помещают в индивидуальный бокс и снабжают стерилизованной пищей и водой. Большое значение имеет соблюдение стерильного режима не только медицинским персоналом (мытьё рук и использование одноразовых резиновых перчаток), но и посетителями (ношение халатов и масок). Воздух, поступающий в палату, необходимо пропускать сквозь фильтр специальной очищающей от грибковых спор системы.
Приём нистатина и амфотерицина В внутрь позволяет снизить вероятность развития грибковой инфекции. Достаточно эффективные препараты — флуконазол и итраконазол. В некоторых медицинских центрах применяют профилактическую терапию 4-фторхинолонами, действие которых направлено против факультативных анаэробов кишечника (при сохранении анаэробной флоры).
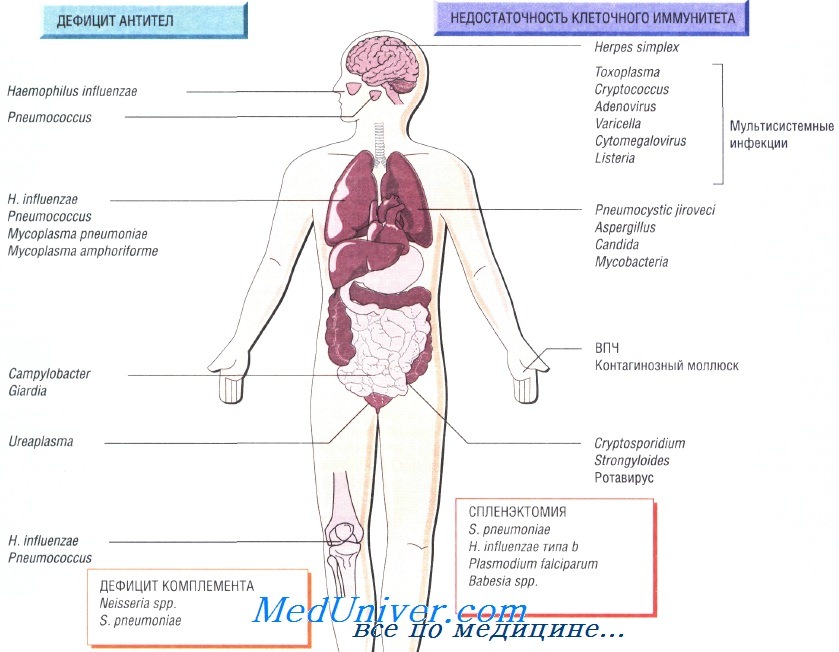
Причины инфекций при иммунодефиците
Недостаточность Т-клеточного иммунитета как причина инфекции при иммунодефиците
Недостаточность Т-клеточного иммунитета может быть обусловлена ВИЧ-инфекцией, противоопухолевой химиотерапией, приёмом глюкокортикоидных препаратов или трансплантацией органов. Врождённый дефицит обнаруживают достаточно редко. Он может быть связан только с недостаточностью функции Т-лимфоцитов или сопровождаться гипогаммаглобулинемией.
Возбудители инфекции при недостаточности Т-клеточного иммунитета. Основные возбудители — внутриклеточные патогенные микроорганизмы и паразиты:
• Toxoplasma gondii, Strongyloides stercoralis;
• Mycobacterium tuberculosis, M. avium-intracellulare;
• Listeria monocytogenes, Cryptococcus neoformans, Pneumocystis jiroveci;
• вирусы простого герпеса, цитомегаловирус, вирус опоясывающего герпеса и кори.
При осложнении кори гигантоклеточной пневмонией и энцефалитом у таких больных заболевание может приобрести угрожающий жизни характер.
Диагностика инфекции при недостаточности Т-клеточного иммунитета. Для диагностики инфекционных заболеваний применяют различные методы исследования. Для посева у пациентов отбирают не менее, чем два образца крови, взятых из разных мест.
Гиппогаммаглобулинемия как причина инфекции при недостаточности Т-клеточного иммунитета
Пациенты, страдающие сцепленной с Х-хромосомой агамма-глобулинемией, входят в группу повышенного риска заражения различными инфекциями в первые 6 мес своей жизни, в то время как люди с другим иммунодефицитом имеют повышенный риск на протяжении всей жизни. Функциональная гипогаммаглобулинемия возникает у больных с множественной миеломой.
Возбудителями рецидивирующих респираторных заболеваний у таких людей считают Streptococcus pneumoniae, недавно открытую Mycoplasma amphoriforme и не имеющего капсулы Haemophilus influenzae (вызывает бронхоэктазию). Персистирующие инфекции вызывают представители родов Giardia, Cryptosporidium и Campylobacter. Снизить частоту возникновения рецидивирующих инфекций помогает внутривенное введение иммуноглобулина.
Недостаточность комплемента как причина инфекции при недостаточности Т-клеточного иммунитета
Врождённую недостаточность комплемента наблюдают достаточно редко. Недостаточность последних компонентов системы комплемента (С7—С9) вызывает потерю способности лизировать грамотрицательные бактерии, в связи с чем повышается восприимчивость пациента к рецидивирующим инфекциям, вызванным микроорганизмами рода Neisseria. Недостаточность альтернативного пути системы комплемента приводит к развитию тяжёлых стрептококковых инфекций (S. pneumoniae), например менингита.
Приобретённая недостаточность системы комплемента часто возникает при системной красной волчанке.
Маннозасвязывающий лектин путь активации комплемента. Широкий спектр бактерий, грибов, вирусов и простейших прикрепляются к клеткам организма хозяина посредством маннозасвязывающего лектина. Есть данные, что при некоторых видах его недостаточности именно эти микроорганизмы вызывают наиболее частые и тяжёлые заболевания у людей с определёнными генотипами.
Инфекции возникающие после спленэктомии
Ежегодно после удаления селезёнки в 1% случаев наблюдают развитие тяжёлого сепсиса, при этом чаще всего заболевание возникает у младенцев и детей. Самую высокую смертность отмечают после спленэктомии, выполненной по поводу лимфомы и талассемии. У пациентов с серповидно-клеточной анемией развивается функциональная аспления. Риск развития сепсиса может со временем снизиться, но никогда не исчезнет окончательно.
Наиболее распространённый возбудитель инфекций (две трети всех случаев) — Streptococcus pneumoniae, но Н. influenzae и Е. coli также играют важную роль в этиологии инфекционных заболеваний у таких пациентов. Кроме того, спленэктомия повышает восприимчивость организма к инфекции, вызванной Capnocytophaga canimorsis (особенно после укусов собак). Малярия также может протекать крайне неблагоприятно (фульминантная форма).
Профилактика инфекции после спленэктомии. После удаления селезёнки всем пациентам необходимо провести вакцинацию, направленную против S. pneumoniae, менингококков и Н. influenzae типа В. Более эффективна иммунизация с использованием белковых конъюгированных вакцин. В некоторых случаях для профилактики применяют пенициллин V (в низких дозах).
Пациентов следует предупреждать о том, чтобы они сообщали своему лечащему врачу о любых признаках лихорадки, а также проинструктировать их относительно приёма антибиотиков (во избежание задержки лечения).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Приобретённый иммунитет. Естественно приобретённый иммунитет. Инфекционный ( нестерильный ) иммунитет. Активно приобретённый иммунитет. Пассивно приобретённый иммунитет.
Приобретённый иммунитет формируется в течение жизни индивидуума и не передаётся по наследству; может быть естественным или искусственным.
Естественно приобретённый иммунитет развивается после перенесённого инфекционного заболевания, протекавшего в клинически выраженной форме, либо после скрытых контактов с микробными Аг (так называемая бытовая иммунизация). В зависимости от свойств возбудителя и состояния иммунной системы организма невосприимчивость может быть пожизненной (например, после кори), длительной (после брюшного тифа) или сравнительно кратковременной (после гриппа).
Инфекционный ( нестерильный ) иммунитет — особая форма приобретённой невосприимчивости; не является следствием перенесённой инфекции, обусловлен наличием инфекционного агента в организме. Невосприимчивость исчезает сразу после элиминации возбудителя из орга низма (например, туберкулёз; вероятно, малярия).
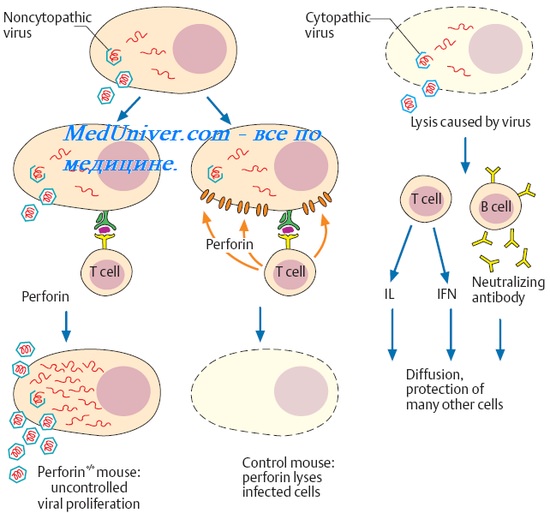
Искусственно приобретённый иммунитет
Состояние невосприимчивости развивается в результате вакцинации, серопрофилактики (введения сывороток) и других манипуляций.
• Активно приобретённый иммунитет развивается после иммунизации ослабленными или убитыми микроорганизмами либо их Аг. В обоих случаях организм активно участвует в созда-нии невосприимчивости, отвечая развитием иммунного ответа и формированием пула клеток памяти. Как правило, активно приобретённая невосприимчивость устанавливается через не- сколько недель после иммунизации, сохраняется годами, десятилетиями или пожизненно; по наследству не передаётся. Вакцино- или иммунопрофилактика — важнейший инструмент в борьбе с инфекционными заболеваниями — преследует создание активно приобретённой невосприимчивости.
• Пассивно приобретённый иммунитет достигается введением готовых AT или, реже, сенсибилизированных лимфоцитов. В таких ситуациях иммунная система реагирует пассивно, не участвуя в своевременном развитии соответствующих иммунных реакций. Готовые AT получают иммунизацией животных (лошадей, коров) или людей-доноров. Препараты представлены чужеродным белком, и их введение нередко сопровождается развитием неблагоприятных побочных реакций. По этой причине подобные препараты применяют только с лечебными целями и не используют для плановой иммунопрофилактики. Б целях экстренной профилактики применяют столбнячный антитоксин, антирабический Ig и др. Широкое распространение нашли антитоксины — AT, нейтрализующие токсины микроорганизмов.
Пассивно приобретённая невосприимчивость развивается быстро, обычно через несколько часов после введения препарата; сохраняется недолго и исчезает по мере удаления донорских AT из кровотока.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
И., обусловленный наличием в организме живого инфекционного агента и утрачиваемый при удалении последнего; наблюдается при туберкулезе, бруцеллезе и некоторых гельминтозах.
ПРЕМУНИЦИЯ (от лат. praemunio — предохраняю, защищаю), нестерильный, инфекционный иммунитет, состояние невосприимчивости, при к-ром в организме сохраняется вирулентный возбудитель, не способный в данный момент обусловить специфич. болезнь хозяина. Инфекции, сопровождающиеся П., протекают без клинич. признаков (кровепаразитарные болезни, спирохетозы и др.). Обязательное условие развития П.— наличие в организме хозяина возбудителя от предыдущего заражения. Развившийся частичный иммунитет предохраняет животное от заражения лишь той расой или штаммом возбудителя, к-рый обитает в его органах и тканях, но не предохраняет от заражения др. расами или штаммами того же вида. Животные, у к-рых развивается П., представляют опасность как источники возбудителя инфекции.
Важно! Как уже упоминалось выше, состояние иммунитета (то есть невосприимчивости к определенному типу антигена) возникает после перенесенной инфекции. В результате иммунного ответа большая часть микроорганизмов, поникнувших в организм, разрушается. Однако полное выведение микробов из организма происходит не всегда. При некоторых инфекционных заболеваниях (например, при туберкулезе), часть микробов остаются блокированными в организме. При этом микробы теряют агрессивность и способность активно размножаться. В таких случаях возникает, так называемый нестерильный иммунитет, который поддерживается постоянным присутствием в организме небольшого количества микробов.
Значение в защищенности организма от инфекций: При нестерильном иммунитете существует возможность реактивации инфекции (так происходит в случае герпеса), на фоне временного снижения функции иммунной системы. Однако в случае реактивации болезнь быстро локализуется и подавляется, так как организм уже приспособился бороться с ней.
Стерильный иммунитет характеризуется полным устранением микробов из организма (например, при вирусном гепатите А). Стерильный иммунитет возникает также при вакцинации.
Примеры: В организме больного сифилисом развивается нестерильный инфекционный иммунитет, возникающий через 10—14 дней после появления твердого шанкра. И пока бледная трепонема находится в организме больного, он практически не восприимчив к новому заражению.
Иммунитет существует до тех пор, пока в организме имеется возбудитель, и исчезает, как только наступает выздоровление. В литературе описаны случаи многократного заражения сифилисом. Вместе с тем следует иметь в виду, что при поздних формах сифилиса иммунитет иногда выражен настолько слабо, что, несмотря на гуммозные проявления или симптомы спинной сухотки, прогрессивного паралича и др., у больного на месте повторного внедрения трепонем развивается твердый шанкр и иные симптомы ранних форм сифилиса. Так, Н. А. Черногубов и В. А. Рахманов (1931) описали проявления активного сифилиса на коже при прогрессивном параличе и спинной сухотке; Г. И. Мещерский и С. И. Богданов (1933) сообщили о редких случаях повторного заражения при третичном, врожденном и позднем скрытом сифилисе; И. Т. Акопян (1950) сообщил о больных (вторичный свежий и вторичный рецидивный сифилис), у которых имелась реинфекция на фоне симптомов нелеченой спинной сухотки.
Нестерильный иммунитет сопровождается аллергической реакцией. С исчезновением инфекционного иммунитета пропадает инфекционная аллергия. Следовательно, при сифилисе реактивность организма меняется в двух направлениях: повышенная (аллергия) и пониженная (иммунитет).
Антитоксический иммунитет формируется при заболеваниях, возбудители которых продуцируют и выделяют в окружающую среду экзотоксины (возбудители дифтерии, ботулизма, столбняка, газовой раневой инфекции, стафилококки, стрептококки).
В процессе эволюции макроорганизм при заражении токсигенными микробами выработал способность обезвреживать не только микробные клетки, но и их токсины. Обезвреживание экзотоксинов обуславливается антитоксинами в результате реакции нейтрализации.
Антитоксичские сыворотки (дифтерийная, столбнячная, ботулиновая, газовогангренозная) применяются с лечебной целью при токсикоинфекциях. При введении антитоксических сывороток создается искусственный пассивный приобретенный иммунитет.
Особенности антибактериального иммунитета.
Для этого вида иммунитета особое значение имеет уровень циркулирующих антител, комплемента и функциональное состояние лейкоцитов. Дефекты синтеза антител класса IgG, особенно IgG1 и IgG3, С3-компонента комплемента и неспособность лейкоцитов к завершенному фагоцитозу значительно усиливают риск заболевания бактериальными инфекциями. Антитела в сочетании с комплементом могут оказывать прямое повреждающее действие на бактерии. Особенно чувствительна к литическому действию антител внешняя липидная оболочка грамотрицательных бактерий.
Специфический иммунитет против инфекций, вызванных инкапсулированными бактериями (пневмококки, стрептококки гр. А, менингококки, клебсиелла и др.), зависит от уровня антител против макромолекул клеточной капсулы (капсулярного полисахарида). У грамотрицательных бактерий хорошим иммуногеном является соматический полисахарид.
Любой инфекционный возбудитель - это сложный антигенный комплекс, включающий множество антигенных компонентов, которые можно разделить на фракции - полипептиды, определяющие иммунный ответ к данному полипептиду. Таким образом, иммунный ответ развивается не на микроб или микробный полипептид, а на отдельные пептиды, составляющие низкомолекулярные эпитопы возбудителя.
Ведущую роль в иммунитете к бактериям, образующим экзотоксин, играют антитоксины, нейтрализующие его и препятствующие повреждению тканей. Антитоксический иммунитет развивается при столбняке, ботулизме, дифтерии, газовой гангрене и др.
Различают 3 способа действия антитоксина:
1. Прямая реакция антител с группами, ответственными за токсичность бактерийного продукта;
2. Взаимодействие антитоксина с рецепторными участками токсина, что препятствует фиксации токсина на специфических рецепторах клеток-мишеней;
3. Образование иммунных комплексов, их активный фагоцитоз и, следовательно, ограничение проникновения токсина в ткани.
И тем не менее, напряженный антитоксический иммунитет сам по себе еще не обеспечивает полную защиту и не предотвращает размножение возбудителя в организме реконвалесцента или здорового носителя.
В процессе формирования антибактериального иммунитета отмечается усиление фагоцитоза благодаря:
Опсонизации бактерий антителами с последующим взаимодействием антител с Fc-рецепторами макрофагов;
Нейтрализации антифагоцитарных веществ возбудителя (например, М-белка стрептококка или капсулярных субстанций многих видов бактерий);
Нейтрализации веществ, секретируемых некоторыми бактериями и предотвращающих скопление макрофагов в местах проникновения возбудителя;
Опсонизации самого фагоцита.
Клеточный иммунитет является основой устойчивости против инфекций, возбудители которых имеют внутриклеточный путь размножения (туберкулез, листериоз, сальмонеллез, туляремия, бруцеллез, токсоплазма). Для этих же инфекций характерно появление гранулематозных изменений в инфицированной ткани и развитие ГЗТ, наличие которой служит одним из признаков появления клеточного иммунитета. Кожные реакции ГЗТ на введение микробного аллергена появляются на ранней стадии заболевания, их интенсивность достигает максимума в разгар болезни.
В механизме антибактериального иммунитета существенную роль играют цитотоксические Т-лимфоциты, оказывающие киллинг-эффект на клетки, содержащие паразитирующие в них микробы. Одни субпопуляции иммунокомпетентных клеток (Т-хелперы, Т-эффекторы, ГЗТ, цитотоксические Т-лимфоциты) распознают комплекс, состоящий из фрагментов бактериального антигена и антигенов HLA класса I или II, а другие группы клеток (В-клетки, Т-супрессоры) могут реагировать на непроцессированный антиген.
Многие возбудители инфекций и вакцины способны неспецифически стимулировать антителообразование, фагоцитоз, цитотоксические и другие реакции клеточного иммунитета. Эндотоксины преимущественно усиливают антиинфекционный иммунитет, а экзотоксины во многих случаях подавляют его.
Нестерильным называют такой иммунитет, который действует на находящихся в организме возбудителей. Стерильный иммунитет – это устойчивость к возбудителю инфекционного заболевания, выработанная в процессе болезни и оставшаяся после излечения. К стерильному относят также иммунитет, появившийся в результате вакцинации. То есть в случае стерильного иммунитета к какому-либо возбудителю, самого возбудителя в организме нет.
Читайте также:

