Стрептококк фэциум что это
Обновлено: 06.05.2024
В этой статье мы поговорим о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: Трубачева Е.С., врач – клинический фармаколог
Почему за исключением S. pyogenes? Да потому что данного возбудителя мы рассмотрели в отдельной статье. Кроме того, мы уже говорим практически на одном языке, а потому можем себе позволить поговорить о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Микробиологические аспекты
Для начала разберемся с классификациями, чтобы понимать принципы разнесения стрептококков по группам. Так сложилось, что для классификации стрептококков используются их фенотипические характеристики, а именно характеристики по гемолитическим свойствам:
- β-гемолитические стрептококки вызывают полный гемолиз эритроцитов питательной среды с формированием прозрачной зоны вокруг колоний на кровяном агаре
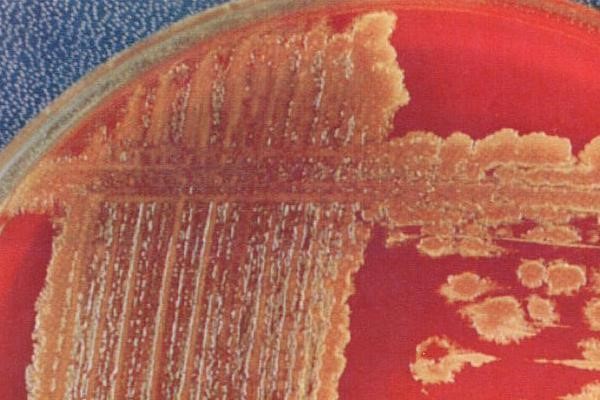
- α-гемолитические (зеленящие) образуют зеленоватый ореол вокруг колоний в результате неполного разложения гемоглобина
- γ-гемолитические по-другому именуются негемолитическими, то есть ничего никуда из крови не разлагают.
Собственно, почему кровь? Дело в том, что стрептококки крайне требовательны к питательным средам и к условиям, в которых их растят. И чтобы они выросли, в питательные среды (в основном, жидкие) необходимо или добавлять мясной экстракт, или использовать коммерческие питательные среды с добавлением крови барана, или 5%-й кровяной агар – и все это с большим количеством дополнительных компонентов. Для определения характера гемолиза традиционно используется среда с 5%-й дефибринированной кровью барана.
Подобное разделение по группам и типам гемолиза является решающим для деления стрептококков, имеющих медицинское значение, позволяя разделить патогенные и условно-патогенные микроорганизмы. Про патогенные мы уже поговорили ранее, теперь будем вести разговор о более обширной группе условно-патогенных представителей и начнем со стрептококков групп A, C, D и F, оставив для отдельного разговора группу В и единственного ее представителя – S. agalactiae.
Основными характеристиками представителей этих групп является то, что все они:
- Обладают β-гемолитической активностью
- Относятся к нормальной микрофлоре человека и животных
- Могут вызывать оппортунистические инфекции в различных локализациях
- Fc-антиген, способный взаимодействовать с Fc-фрагментом IgG, тем самым угнетая систему комплемента и подавляя активность фагоцитов. Кроме того, он же активирует выработку аутоиммунных антител, которые в дальнейшем участвуют в развитии иммунного воспаления;
- Р-антиген, обладающий иммуносупрессивной активностью и являющийся общим для всех стрептококков. Он подавляет выработку антител и усиливает реакции гиперчувствительности замедленного типа.
Кроме того, стрептококки имеют такой фактор патогенности, как М-протеин, который нарушает фагоцитарную активность путем маскировки рецепторов для комплемента, что очень затрудняет борьбу с этими возбудителями.
Клинические аспекты
1. Streptococcus dysgalactiae – объединяет двух представителей Streptococcus dysgalactiae subsp. dysgalactiae и Streptococcus dysgalactiae subsp. equisimilis. Первый живет на животных (и вызывает маститы у коров, на человеке в качестве возбудителя пока не ловили), второй на человеке – в верхних дыхательных путях и влагалище – и может быть причиной менингита, септических артритов и инфекций кожи (при условии наличия соответствующей симптоматики и в отсутствии других вероятных возбудителей).
2. Стрептококки группы Anginosus (S. anginosus, S. constellatus, S. intermedius) относятся к представителям нормальной флоры человека. Обрести зубы и стать возбудителями инфекции их могут заставить травмы, оперативные вмешательства, сахарный диабет, онкологические заболевания и иммунодефициты различной этиологии. Сами по себе на человека не бросаются и обнаружение оных вне клинической картины истребления не требует.
- S.anginosus – в норме обитает в полости рта, верхних дыхательных путях и влагалище. При патологии может быть высеян из урогенитальной и желудочно-кишечной локализаций.
- S. constellatus – в норме живет в верхних дыхательных путях и ЖКТ. При патологических процессах могут быть обнаружены где угодно.
- S. intermedius – в норме обитает в полости рта и верхних дыхательных путях. При патологических процессах в основном высевается из мозга, из крови при эндокардитах и из печеночных абсцессов (проще говоря оттуда, где в норме все должно быть стерильно).
3. S. equi клинического значения не имеет, так как является зоонозом и вызывает ветеринарные проблемы у коров, лошадей, морских свинок, овец и коз. Иногда – при употреблении зараженных молочных продуктов – может быть обнаружен у людей, больных нефритом.
4. S. canis, как понятно из названия, выделяют от собак. У людей могут вызывать инфекции мягких тканей, пневмонии, сепсис, остеомиелит.
5. S. iniae – обнаруживается у дельфинов и рыб. А также у людей, занятых на обработке замороженной рыбы. Крайне редко вызывает заболевание (описаны всего несколько случаев), хорошо лечится бета-лактамами и макролидами.
6. И несколько чисто зоонозных представителей, не имеющих медицинского значения, но иногда сеющихся с людей, которые за этими животными ухаживают или лечат:
- S. porcinus – вызывает абсцессы глотки свиней, пневмонию и аборты;
- S. didelphis – вызывает инфекции кожи, печени, легких и селезенки у опоссумов;
- S. phocae – выделяется у морских котиков при пневмонии у оных.
Как мы увидели, в большинстве своем перечисленные возбудители относятся к нормальной микрофлоре верхних дыхательных путей, кожи, ЖКТ и урогенитального тракта, а чтобы они вызвали заболевание, во внутреннюю среду организма должно проникнуть очень большое количество оных, при этом иммунная система должна быть подавлена тем или иным образом. Чаще всего такую роль играют медицинские вмешательства (инъекции, операции, катетеризация сосудов, гемодиализ и т. п.) на фоне тяжелых основных или сопутствующих заболеваний. Тогда стрептококки способны вызвать инфекции кожи и мягких тканей, верхних дыхательных путей, эндокардиты и сепсис, инфекции урогенитального тракта, при этом строгой локализации процесса соответствующим возбудителем уже не будет, а будет инфекция, связанная с медицинским вмешательством.
Что делать?
Как можно раньше провести бактериологическую диагностику и главным в ней будет правильная техника взятия биологического материала, чтобы точно исключить его контаминацию ни в чем не повинными мирными соседями, просмотрев истинного возбудителя. Техника взятия материала и правила транспортировки в лабораторию подробно расписаны здесь.
Чем лечить?
Этот вопрос мы можем задать только тогда, когда точно понимаем, что именно вышеуказанные зверушки являются возбудителями и никто за ними не прячется. Хорошая новость в том, что стрептококки до сих пор сохранили высокую чувствительность к бета-лактамам вообще и к пенициллинам в частности, то есть лечить их дешево. Плохая новость в том, что фактически утеряна чувствительность к макролидам, и поэтому они не могут быть препаратами выбора – это обязательно надо учитывать при назначении стартовой терапии.
Кроме того, стрептококки продолжают демонстрировать высокую чувствительность к ванкомицину, но в виду неоднозначности самого препарата в плане безопасности его применения, им тоже не следует злоупотреблять и включать его в схему лечения только в случае наличия аллергии к пенициллиновому ряду.
Итак, мы закончили краткое рассмотрение представителей стрептококков групп A, C, D, F и G, и нам осталось рассмотреть только одного представителя из группы В, а именно S.agalactiae, чем мы и займемся в следующей статье.

Enterococcus faecium (энтерококки фэциум) — вид энтерококков, входящий в состав нормальной микрофлоры пищеварительного тракта человека, а также некоторых млекопитающих.
Энтерококки — молочнокислые грамположительные бактерии, не образующие спор и капсул, факультативные анаэробы (способные использовать энергию брожения и поэтому, жить и при больших и при ничтожных количествах кислорода). Оптимальная температура культивирования энтерококков от 35 до 37° С. Энтерококки осуществляют метаболизм бродильного типа, ферментируют разнообразные углеводы с образованием в основном молочной кислоты, но не газа, снижая кислотность среды до 4,2–4,6 pH. Энтерококки высокорезистентны к различным факторам внешней среды и дезинфицирующим средствам, могут длительное время сохранять жизнеспособность на предметах домашнего обихода, выдерживают нагревание до 60° С в течение 30 минут.
Энтерококки E. faecium колонизируют преимущественно тонкую кишку. Они обладают высокой ферментативной активностью, выраженным антагонизмом по отношению к условно-патогенным микробам (вырабатывают энтероцины), выживают в желчи.
Enterococcus faecium также является условно-патогенным микробом. С одной стороны, он необходимый для человека микроорганизм (в опытах на животных было доказано, что отсутствие Enterococcus faecium в кишечнике может привести к гибели животного от инфекции), но, с другой, может быть причиной различных заболеваний.
Энтерококки, в том числе Enterococcus faecium, всё чаще становятся причиной внутрибольничных инфекций. В течение последних десятилетий отмечен рост резистентности энтерококков к ванкомицину. В клиническом материале от человека, кроме Е. faecium, встречаются также Е. faecalis, Е. gilvus и E. pallens. E. faecium составляло 5–10 % от всех выделенных у человека энтерококков, 80–90% — E. faecalis (Бондаренко В.М. Суворов А.Н. Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции). Частота резистентности к ванкомицину у штаммов Enterococcus faecium достигает 50 %, что гораздо выше, чем у штаммов наиболее часто встречающегося у человека Enterococcus faecalis (5%).
Enterococcus faecium могут быть причиной спонтанного бактериального перитонита.
Enterococcus faecium участвуют в реакции трансплантат против хозяина (Карпеева Ю.С. и др.).

В состав лекарственных средств-пробиотиков (Бифиформ, Линекс и другие) входит специально подобранный, отличающийся высоким уровнем антибиотикорезистентности и непатогенности штамм Enterococcus faecium SF68. В геноме этого штамма отсутствуют известные для патогенных клинических изолятов энтерококков гены вирулентности: gelE (gelatinize), sprE (serine protease), esp (extracellular surface protein), fsrB (virulence factor regulator), asa1 (aggregation substance). Enterococcus faecium SF68 чувствителен к ванкомицину, ампициллину, пиперациллину, хлорамфениколу, эритромицину, имипенему, ципрофлоксацину и фузидиевой кислоте и устойчивы к метициллину, цефуроксину, азтреонаму, мипрамину, тобрамицину, стрептомицину (Бондаренко В.М. Поликомпонентные пробиотики: терапевтический эффект при дисбиозах кишечника и механизм действия).

Беззародышевый водный субстрат продуктов обмена веществ Enterococcus faecium входит в состав противодиарейного лекарственного препарата Хилак форте.
Enterococcus faecium заселяет кишечник человека в первые дни жизни. Заселение энтерококками происходит более активно у детей, находящихся на грудном вскармливании.
Антибиотики, активные в отношении Enterococcus faecium
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении Enterococcus faecium: ванкомицин, нифурател, доксициклин (не ко всем штаммам).
Для лечения энтерококковых инфекций, в том числе вызванных резистентными к ванкомицину штаммами Enterococcus faecium, применяется антибактериальный препарат линезолид.
Не активен в отношении Enterococcus faecium линкомицин.
Публикации и видео для профессионалов здравоохранения, затрагивающие роль Enterococcus faecium в заболеваниях ЖКТ и их лечении

Enterococcus faecium в систематике бактерий
По современным представлениям вид Enterococcus faecium относится к роду Enterococcus (энтерококки), который входит в семейство Enterococcaceae, порядок Lactobacillales, класс Bacilli, тип Firmicutes, Terrabacteria group, царство Бактерии.
По принятой ранее классификации энтерококки относились к стрептококкам группы D и Enterococcus faecium назывались Streptococcus faecium (стрептококки фэциум).

Энтерококк фекальный или энтерококк фекалис (лат. Enterococcus faecalis) — вид энтерококков, входящий в состав нормальной микрофлоры пищеварительного тракта человека, а также некоторых млекопитающих.
Фекальные энтерококки — самые часто встречающиеся в организме человека и домашней птицы энтероккоки. Фекальные энтерококки также колонизируют кишечник крупного рогатого скота, свиней, собак, лошадей, овец и коз.
Фекальный энтерококк может являться возбудителем различных инфекций: мочевыводящих путей, интраабдоминальных, органов малого таза, раневых, эндокардита. Фекальные энтерококки, наряду с энтерококками вида фэциум являются наиболее патогенными видами среди энтерококков, они составляют 80–90% от всех выделенных в клиническом материале человека энтерококков. Фекальные энтерококки часто бывают причиной внутрибольничных инфекций (Бондаренко В.М., Суворов А.Н. Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции).
Enterococcus faecalis участвуют в реакции трансплантат против хозяина (Карпеева Ю.С. и др.).
В то же время, фекальные энтерококки входят в состав нормальной микрофлоры желудочно-кишечного тракта человека и многих позвоночных, играют важную роль в обеспечении колонизационной резистентности слизистой оболочки. Основное место обитания фекального энтерококка в организме — тонкая кишка, но он также встречается в толстой кишке, губчатой части мочеиспускательного канала, в половых органах, и, иногда, в полости рта. Фекальные энтерококки присутствуют в кале 90 % взрослых людей. Количество фекальных энтерококков во внешней среде является значимым санитарным и эпидемиологическим показателем ее фекальной загрязненности.
Фекальные энтерококки в пищевой промышленности
- штамм Enterococcus faecalis B114 используется при приготовлении сыра "камамбер"
- штамм Enterococcus faecalis INIA 4 — сыры Taleggio, Manchego, Hispano
- штамм Enterococcus faecalis TAB 28 — творог
Инфекция мочевых путей и фекальные энтерококки
Бактериурия — наличие бактерий в моче может является признаком воспаления в мочевыводящих путях, мочевом пузыре, почках. При отсутствии каких-либо симптомов, истинная бактериурия (инфекция мочевых путей) диагностируется при наличии не менее 10 5 микробных тел в 1 мл свежевыпущенной мочи, иначе предполагается, что загрязнение мочи происходит при ее заборе. При наличии симптомов или при заборе мочи катетером диагностический порог может быть значительно уменьшен. Часто бактериурия не сопровождается какими-либо симптомами, тогда она называется бессимптомной или асимптоматическая бактериурией. В то же время, бактериурия нередко сочетается с симптомами цистита, пиелонефрита, простатита, уретрита, а также встречается у беременных. Бессимптомная бактериурия не всегда требует немедленного лечения.
Одним из возбудителей воспалений мочевыводящих путей (ВМП) является фекальный энтерококк, на долю которого приходится от 1 до 18 % (в зависимости от типа заболевания) всех выявленных при бактериурии патогенных микроорганизмов. Остальные виды энтерококков практически не встречаются среди возбудителей ВМП.
Активность антибиотиков в отношении Enterococcus faecalis
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении Enterococcus faecalis: левофлоксацин, норфлоксацин, офлаксацин, рифаксимин, нифурател, доксициклин (не ко всем штаммам). Enterococcus faecalis умеренно чувствителен к ципрофлоксацину. 74 % штаммов Enterococcus faecalis не чувствительны к тетрациклину. Не активны в отношении Enterococcus faecalis линкомицин и клиндамицин. Чувствительные к ванкомицину и гентамицину штаммы Enterococcus faecalis чувствительны также к моксифлоксацину.
Для лечения острых неосложненных инфекций мочевыводящих путей, вызванных Enterococcus faecalis могут быть рекомендованы нитрофураны, цефалоспорины III поколения, гентамицин, фторхинолоны, последние — с оговоркой о неблагоприятных тенденциях к росту устойчивости. Следует отметить, что цефалоспорины лишены активности против энтерококков, а ранние фторхинолоны (ломефлоксацин, норфлоксацин, офлоксацин, пефлоксацин, ципрофлоксацин) обладают слабой активностью против Enterococcus faecalis.
Enterococcus faecalis в систематике бактерий
По современным представлениям вид Enterococcus faecalis относится к роду Enterococcus (энтерококки), который входит в семейство Enterococcaceae, порядок Lactobacillales, класс Bacilli, тип Firmicutes, Terrabacteria group, царство Бактерии.
По принятой ранее классификации энтерококки относились к стрептококкам серогруппы D и Enterococcus faecalis назвался Streptococcus faecalis. Традиционно он иногда называется фекальным стрептококком.
Ю.О. Шульпекова
Кафедра пропедевтики внутренних болезней лечебного факультета ММА им. И.М. Сеченова, Москва Рассматриваются особенности состава и роль кишечных бактерий-симбионтов в поддержании состояния здоровья. Обсуждается корректность применения термина “дисбактериоз” в клинической практике; указаны заболевания и состояния, которые нередко ошибочно трактуют как дисбактериоз. Приведен краткий обзор заболеваний, при которых эффективность некоторых пробиотиков подтверждена результатами сравнительных исследований. Представлены показания к применению современного комбинированного пробиотического препарата Линекс, его преимущества и режимы дозирования.
История изучения роли кишечной микрофлоры в поддержании здоровья человека берет свое начало в конце XIX века, когда получили развитие представления о болезни как следствии кишечной “аутоинтоксикации”.
Но и сегодня приходится признать, что мы еще мало знаем о взаимодействии нашего организма и населяющих его бактерий, и очень трудно оценить состав микрофлоры, населяющей желудочно-кишечный тракт (ЖКТ), с позиций “нормы” и “патологии”.
Состав и физиологическое значение микрофлоры кишечника
В ЖКТ человека обитают микроорганизмы более 400 видов. Содержание колониеобразующих единиц (КОЕ) в 1 мл внутрипросветного содержимого по мере продвижения от желудка к толстой кишке увеличивается с 10 2–3 до 10 11–12 . Одновременно возрастает доля анаэробных микроорганизмов и снижается их окислительный потенциал.
Кишечные бактерии представлены основной (доминирующей, или резидентной), сопутствующей и остаточной популяциями.
Доминирующая популяция состоит главным образом из бактерий семейств Lactobacillus, Bifidobacteria и бактероидов.
Сопутствующая популяция представлена кишечной палочкой, эубактериями, фузобактериями, энтерококками и пептококками.
В остаточную популяцию входят дрожжеподобные грибы, бациллы, клостридии, протей и др. Часть указанных микроорганизмов обладает более или менее выраженными патогенными свойствами. Принято считать, что у здорового человека характеристики патогенных или условнопатогенных имеют не более 15% кишечных микробов.
В верхних отделах ЖКТ состав микрофлоры сходен с таковым ротоглотки; заметная доля ее представлена стрептококками. В дистальном направлении постепенно возрастает содержание лактобацилл, а в толстой кишке преобладают бифидобактерии.
По современным представлениям, основную роль в поддержании нормального физиологического состояния микрофлоры ЖКТ играют бактерии семейств Lactobacillus и Bifidobacteria, которые представляют собой грамположительные неспорообразующие анаэробы, не обладающие патогенными свойствами. Важной характеристикой этих микроорганизмов служит сахаролитический тип метаболизма. В процессе сбраживания углеводов под действием ферментов лактобацилл и бифидобактерий образуются короткоцепочечные жирные кислоты – молочная, уксусная, масляная, пропионовая. В присутствии этих кислот тормозится развитие условно-патогенных штаммов, которые в большинстве своем обладают протеолитическим типом метаболизма. Подавление протеолитических штаммов сопровождается угнетением гнилостных процессов и подавлением образования аммиака, ароматических аминов, сульфидов, эндогенных канцерогенов. Благодаря выработке жирных кислот происходит регуляция рН внутрикишечного содержимого.
Короткоцепочечные жирные кислоты играют важную роль в регуляции метаболизма. Поступая в системный кровоток, они обеспечивают до 20% ежедневной энергетической потребности организма, а также служат главным поставщиком энергии для эпителия кишечной стенки.
Масляная и пропионовая кислоты повышают митотическую активность и регулируют дифференцировку эпителия. Молочная и пропионовая кислоты регулируют всасывание кальция. Большой интерес вызывает их роль в регуляции обмена холестерина и метаболизма глюкозы в печени.
Лактобациллы и бифидобактерии синтезируют аминокислоты, белки, витамины В1, В2, В6, В12, К, никотиновую и фолиевую кислоты, вещества с антиоксидантной активностью.
Бактерии основной популяции играют важную роль в переваривании компонентов молока. Лактобациллы и энтерококк способны расщеплять лактозу и молочные белки. Выделяемая бифидобактериями фосфопротеинфосфатаза участвует в метаболизме казеина. Все эти процессы протекают в тонкой кишке.
Виды лактобацилл, населяющих кишечник, включают: L. acidophilus, L. casei, L. bulgaricus, L. plantarum, L. salivarius, L. rhamnosus, L. reuteri. Среди бифидобактерий выделяют B. bifidum, B. longum, B. infantis.
Из аэробных микроорганизмов, относящихся к сопутствующей популяции, серьезная роль в микробном биоценозе кишечника принадлежит негемолитической кишечной палочке – Escherichia coli, которая вырабатывает витамины (В1, В2, В6, B12, К, никотиновую, фолиевую, пантотеновую кислоты), участвует в обмене холестерина, билирубина, холина, желчных и жирных кислот, опосредованно влияет на всасывание железа и кальция.
По мере расширения знаний об особенностях жизнедеятельности кишечной микрофлоры становится все более отчетливым представление о ее важной роли в поддержании напряженности местного и системного иммунитета.
В кишечнике существуют защитные механизмы, препятствующие избыточному размножению и внедрению микрофлоры. К их числу относят целостность эпителия и щеточную каемку (расстояние между микроворсинками которой меньше размеров бактерии), продукцию иммуноглобулина А, присутствие желчи, наличие пейеровых бляшек и пр.
Благодаря выработке веществ с антибактериальной активностью (бактериоцинов, короткоцепочечных жирных кислот, лактоферрина, лизоцима) нормальная микрофлора обеспечивает местную защиту от избыточного размножения условно-патогенных и внедрения патогенных микроорганизмов. Присутствие постоянного микробного раздражителя и контакт с макрофагами и лимфоцитами в области пейеровых бляшек обеспечивают достаточную напряженность местного иммунитета, выработку иммуноглобулина А и высокую фагоцитарную активность. В то же время постоянный контакт с иммунными клетками лежит в основе иммунологической толерантности.
Компоненты кишечных бактерий проникают в системный кровоток, поддерживая таким образом необходимую степень напряженности системного иммунитета и обеспечивая его “знакомство” с микрофлорой окружающей среды.
Однако даже те кишечные бактерии, которые рассматриваются как непатогенные, не обладающие отчетливой способностью к адгезии, инвазии и продукции токсинов, при несостоятельности местных механизмов защиты теоретически способны вызывать повреждение стенки кишечника, а, возможно, также системную инфекцию. Поэтому назначение лекарственных препаратов на основе кишечных бактерий (пробиотиков) всегда должно быть обоснованным.
Причины нарушений состава кишечной микрофлоры
Состав микробной популяции кишечника даже у здорового человека подвержен изменчивости и, по-видимому, отражает способность приспособления организма к особенностям питания и образа жизни, климатическим факторам.
Следует признать, что общее понятие “дисбактериоз”, до недавнего времени широко применявшееся для обозначения нарушений состава кишечной микрофлоры, не отражает в полной мере сути подобных изменений, не позволяет отчетливо сформулировать диагноз и определить тактику лечения.
Так, можно выделить отдельные заболевания и синдромы, которые нередко ошибочно трактуются как дисбактериоз:
- синдром избыточного бактериального роста;
- антибиотико-ассоциированная диарея;
- инфекция Clostridium difficile (псевдомембранозный колит);
- синдром раздраженного кишечника;
- “диарея путешественников”;
- дисахаридазная недостаточность;
- кандидоз кишечника на фоне иммунодефицитных состояний;
- стафилококковый энтерит и пр.
Каждое из этих заболеваний имеет свою причину, определенные факторы риска, клиническую картину, диагностические критерии и тактику лечения. Безусловно на фоне этих заболеваний могут развиваться вторичные нарушения микробного состава кишечника.
Пожалуй, наиболее часто в клинической практике встречается синдром избыточного бактериального роста, характеризующийся уменьшением количества анаэробов (особенно бифидобактерий), увеличением общего числа функционально неполноценных форм E. coli (“лактозо-”, “маннит-”, “индолоотрицательных”), содержания гемолитических форм E. coli и созданием условий для размножения Candida spp.
Синдром избыточного бактериального роста развивается на фоне нарушений просветного или пристеночного пищеварения (врожденный дефицит ферментов, панкреатит, глютеновая энтеропатия, энтериты), пассажа кишечного содержимого (межкишечные свищи, “слепые петли” кишечника, дивертикулы, нарушения перистальтики, кишечнаянепроходимость); снижения защитных свойств слизистой оболочки (анацидные состояния, иммунодефициты); ятрогенных воздействий на микрофлору кишечника (применение кортикостероидов, цитостатиков, особенно у ослабленных и пожилых пациентов).
Избыточное размножение бактерий наблюдается главным образом в тонкой кишке, поскольку здесь создается наиболее благоприятная питательная среда. Проявления синдрома избыточного бактериального роста, такие как метеоризм, урчание, переливание в животе, жидкий стул, гиповитаминоз, похудание, нередко выходят на первый план в клинической картине основных заболеваний, перечисленных выше.
Тесты, подтверждающие наличие патологических нарушений состава микрофлоры
Как и в диагностике других заболеваний, для оценки изменений кишечной микрофлоры необходимо применять адекватные методы.
Посев кала на дисбактериоз, распространенный в России, нельзя признать информативным тестом, тем более что патологические изменения микрофлоры в основном затрагивают тонкую кишку. Этот метод представляет ценность с точки зрения исключения кишечных инфекций, а также инфекции C. difficile.
Весьма высокой точностью обладает микробиологическое исследование посева аспирата содержимого тонкой кишки.
Дыхательный тест с 14С-ксилозой, водородные тесты с лактулозой и глюкозой позволяют выявлять наличие избыточного бактериального роста в кишечнике, однако не дают представлений о составе микрофлоры.
Определение спектра жирных кислот в кале методом газожидкостного хроматографического анализа дает возможность приблизительно оценить количественное соотношение различных типов кишечных бактерий.
Применение пробиотиков
В начале XX столетия великий русский ученый Мечников И.И. выдвинул гипотезу о том, что высокое содержание лактобацилл в кишечном биоценозе является необходимым условием здоровья и долголетия человека. Мечников И.И. проводил опыты по использованию в лечебных целях живой культуры бифидобактерий.
В последующие годы продолжались разработки лекарственных препаратов на основе микроорганизмов, обладающих полезными свойствами, – так называемых пробиотиков.
В качестве потенциального лечебного средства лактобациллы первоначально привлекали к себе наибольшее внимание как бактерии с наиболее хорошо изученными полезными свойствами. С 1920-х гг. культура L. acidophilus стала использоваться в форме ацидофильного молока для лечения заболеваний ЖКТ, сопровождающихся запорами. С 1950-х гг. накапливается опыт использования L. acidophilus и других культур для предупреждения антибиотико-ассоциированной диареи.
По мере развития микробиологии были получены новые сведения о позитивных свойствах бифидобактерий, кишечной палочки, нетоксигенного молочнокислого стрептококка – Streptococcus (или Enterococcus) faecium. Определенные штаммы этих микроорганизмов и их комбинации стали включать в состав препаратов пробиотиков.
При изучении способности микробов к адгезии к эпителиоцитам тонкой кишки показано, что применение микроорганизмов в сочетании повышает их способность фиксироваться в зоне щеточной каемки.
Механизмы лечебного действия пробиотиков включают: подавление роста патогенных микроорганизмов, восстановление целостности эпителия, стимуляцию секреции иммуноглобулина А, подавление выработки провоспалительных цитокинов, нормализацию метаболических процессов.
Современный подход к разработке подобных препаратов подразумевает, во-первых, применение микроорганизмов в сочетаниях и, во-вторых, выпуск их в капсулированной форме, допускающей длительное хранение при обычной температуре. Клиникоэкспериментальные исследования показали, что под действием желудочного сока и желчи пробиотики теряют до 90% своей активности до момента попадания в кишечник. Разрабатываются способы повышения выживаемости бактерий – за счет их иммобилизации на пористых микроносителях, включения в состав препарата компонентов питательной среды.
Несмотря на “теоретически” грамотную разработку пробиотических препаратов, далеко не все из них оказываются эффективными на практике. К настоящему времени накоплены данные множества открытых и слепых контролируемых исследований, по результатам которых сделаны некоторые выводы о перспективах применения тех или иных видов микроорганизмов при различных заболеваниях кишечника.
Показано, что наибольшим эффектом в лечении инфекционного гастроэнтерита у детей обладают L. rhamnosus штамма GG, у взрослых – E. faecium SF68.
По некоторым данным, в период восстановления после вирусного гастроэнтерита целесообразно назначение препаратов, содержащих лактобактерии или их комбинации с бифидобактериями и энтерококком; скорейшему разрешению после бактериальных кишечных инфекций способствуют подвиды бифидобактерий.
Способность к снижению частоты развития антибиотико-ассоциированной диареи установлена для следующих бактерий в составе пробиотиков:
- L. rhamnosus штамма GG;
- комбинация L. acidophilus и L. bulgaricus;
- E. faecium SF68;
- B. longum;
- комбинация Lactobacillus и B. longum;
- лечебные дрожжи Saccharomyces boulardii.
Для снижения частоты побочных эффектов антихеликобактерной терапии рекомендуется одновременный прием пробиотиков, содержащих L. rhamnosus и S. Boulardii, или комбинацию L. acidophilus с Bifidobacterium lactis.
В профилактике развития диареи путешественников эффективной оказалась комбинация L. acidophilus, L. Bulgaricus и Streptococcus thermophilus.
По данным мета-анализа, в лечении рецидивирующей инфекции C. Difficile (псевдомембранозного колита) наиболее эффективным является пробиотик, содержащий S. boulardii.
Следует понимать, что назначение пробиотиков редко бывает эффективным в отсутствие этиотропного и патогенетического лечения основного заболевания. В зависимости от конкретной ситуации может потребоваться хирургическое лечение (например, при синдроме приводящей петли, межкишечных свищах), назначение противовоспалительных и антибактериальных препаратов, регуляторов моторики ЖКТ (например, при синдроме раздраженного кишечника).
Характеристика и применение Линекса
В последние годы в практике российских гастроэнтерологов заслуженным признанием пользуется Линекс, комбинированный препарат, содержащий бактерии – представители естественной микрофлоры кишечника: Bifidobacterium infantis v. liberorum, Lactobacillus acidophilus и нетоксигенный молочнокиcлый стрептококк группы D – Streptococcus (Enterococcus) faecium. Как было отмечено выше, эти виды бактерий продемонстрировали клиническую эффективность в лечении ряда заболеваний кишечника и входят в число микроорганизмов, с которыми связываются особые “надежды” на включение в будущем в схемы терапии хронических воспалительных заболеваний кишечника. Культуры микроорганизмов, входящие в состав Линекса, получены выращиванием на средах с добавлением антибиотиков, поэтому обладают устойчивостью к большинству антибактериальных средств и способны размножаться даже в условиях антибактериальной терапии. Устойчивость полученных штаммов к антибиотикам настолько высока, что сохраняется при повторных инокуляциях 30 поколений, а также in vivo. При этом не отмечено переноса генов антибактериальной резистентности к другим видам микроорганизмов. Это очень важно с точки зрения последствий применения Линекса: как на фоне приема, так и после отмены препарата нет опасности выработки резистентности к антибиотикам со стороны патогенных бактерий и собственной микрофлоры.
Лечебное действие Линекса заключается во временном замещении функций собственной кишечной микрофлоры пациента в условиях ее подавления, в частности на фоне применения антибиотиков. Включение в состав Линекса лактобацилл, S. Faecium и бифидобактерий обеспечивает поступление “лечебной” микрофлоры в разные отделы кишечника в количественно и качественно сбалансированных соотношениях.
В плацебо-контролируемом исследовании с участием 60 взрослых пациентов, страдающих антибиотико-ассоциированной диареей или диареей неустановленной этиологии, прием Линекса уже в течение 3–5 дней сопровождался нормализацией стула. У детей продемонстрирована высокая эффективность Линекса в предотвращении и лечении уже развившейся антибиотико-ассоциированной диареи.
Применение Линекса на фоне эрадикационной антихеликобактерной терапии улучшает переносимость антибиотиков: снижает частоту развития метеоризма, диареи.
В кишечнике микробные компоненты Линекса оказывают не только эубиотическое действие, но и выполняют все функции нормальной кишечной микрофлоры: участвуют в синтезе витаминов В1, В2, В3, В6, В12, Н (биотина), РР, К, Е, фолиевой и аскорбиновой кислот. Снижая рН кишечного содержимого, они создают благоприятные условия для всасывания железа, кальция, витамина D.
Лактобактерии и молочнокиcлый стрептококк осуществляют ферментативное расщепление белков, жиров и сложных углеводов, в т. ч. оказывают заместительный эффект при лактазной недостаточности, которая в большинстве случаев сопутствует заболеваниям кишечника.
Линекс выпускается в капсулах, содержащих не менее 1,2×10 7 живых лиофилизированных бактерий.
Фармакокинетика препарата мало изучена в связи с тем, что в настоящее время отсутствуют фармакокинетические модели для исследования у человека сложных биологических веществ, состоящих из компонентов с различной молекулярной массой.
Грудным детям и детям до 2 лет Линекс назначают по 1 капсуле 3 раза в сутки, детям 2–12 лет – по 1–2 капсулы 3 раза в сутки, детям старше 12 лет и взрослым – по 2 капсулы 3 раза в сутки. Препарат принимают после еды, запивая небольшим количеством жидкости. Нельзя запивать горячими напитками во избежание гибели живой микрофлоры.
Заключение
Таким образом, пробиотики, особенно их комбинированные препараты, постепенно занимают все более прочное место в гастроэнтерологии.
По мере накопления доказательной базы, они, возможно, предоставят врачам способ лечить больного, искусно влияя на его симбиоз с миром бактерий и минимальным риском для организма человека.
Читайте также:

