Суставная форма иерсиниоза лечение
Обновлено: 11.05.2024
Иерсиниозный артрит - заболевание суставов, вызваное возбудителем Yersinia enterocolitica.
Что провоцирует / Причины Иерсиниозного артрита:
Yersinia enterocolitica - микроорганизм, который привлек к себе внимание ревматологов сравнительно недавно. Он входит в один ряд с возбудителями чумы и псевдотуберкулеза, но заболевания, вызываемые им, не относятся к числу особо опасных инфекций,
Инфекция, обусловленная иерсиниями, встречается у животных и людей, причем из 30 известных серотипов микроба для человека являются патогенными лишь немногие.
Симптомы Иерсиниозного артрита:
У человека основные симптомы иерсиниоза связаны с поражением кишечника, которое проявляется обычно острым энтероколитом. Может иметь место диарея, иногда с примесью крови и слизи. В таких случаях обычно подозревают дизентерию, которая не находит, однако, бактериологического подтверждения. Иногда может иметь место неопределенный болевой абдоминальный синдром или клиника аппендицита, вернее, псевдоаппендикулярного синдрома, обусловленного терминальным илеитом, воспалением брыжеечных лимфатических узлов (мезаденит) или комбинацией этих процессов. Желудочнокишечные проявления могут быть легкими, стертыми, кратковременными, но иногда крайне выраженными, сопровождаясь септицемией, обезвоживанием организма и приводя больных к гибели.
Артрит длится 1-5 мес и заканчивается полным выздоровлением, но может рецидивировать или даже приобретать хроническое течение. При иерсиниозном артрите описано развитие триады Рейтера: конъюнктивит, уретрит, артрит.
Диагностика Иерсиниозного артрита:
Диагноз иерсиниозного артрита основывается на анамнестических данных, бактериологическом исследовании кала, обнаружении антител к иерсиниям в сыворотке крови (в диагностическом титре 1:200 и более) или синовиальной жидкости.
Основными диагностическими признаками иерсиниозного реактивного артрита являются следующие проявления.
Лабораторные данные
- Общий анализ крови: повышение СОЭ, возможны признаки анемии, лейкоцитоз.
- Биохимический анализ крови: повышение уровня альфа-2- и у-глобулинов, фибрина: серомукоида, сиаловых кислот, появление СРП.
- Бактериологическое и серологическое подтверждение инфекции. Диагностические критерии иерсиниозной инфекции - выделение копрокультуры и возрастающий титр антител к иерсиниям, определяемый методом РПГА (диагностический титр 1:160 и выше), дизентерии - выделение копрокультуры шигелл, реакция непрямой гемагтлютинации со стандартными эритроцитарными диагностикумами в титре 1:200 и выше (установлено, что артритогенными свойствами обладает штамм Флекснера), сальмонеллезного и кампилобактериального реактивного артрита - определение титров антител в крови, реже - исследование копрокультуры (ко времени развития реактивного артрита она может быть отрицательна).
- Исследование синовиальной жидкости: воспалительный характер - жидкость мутная, желтоватая, вязкость низкая, количество лейкоцитов (2-100)×10 9 /л, нейтрофилов более 50%, муциновый сгусток хлопьевидный, выявление специфических антител.
Лечение Иерсиниозного артрита:
Иерсинии чувствительны к тетрациклину. Этот антибиотик рекомендуется назначать в остром периоде процесса (1-2 г/сут), добавляя и негормональные антивоспалительные препараты. К кортикостероидным препаратам следует прибегать лишь при крайней выраженности воспалительной активности суставного процесса, значительном поражении глаз или при прогрессировании инфекционноаллергического миокардита.
В данном разделе перечислены далеко не все артриты, которые могут сочетаться с разнообразными инфекциями, но уже . изложенное свидетельствует о широком спектре подобных заболеваний суставов. Некоторые из этих артритов встречаются достаточно часто (например, иерсиниозный, бруцеллезный, гонококковый, острый инфекционный, туберкулезный), другие являются редкостью (лаймовская болезнь, Уиппла болезнь). Выделение группы артритов, связанных с инфекцией, диктует необходимость поиска конкретных этиологических факторов заболеваний суставов и дальнейшего уточнения механизмов их патогенеза.
К каким докторам следует обращаться если у Вас Иерсиниозный артрит:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Иерсиниозного артрита, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Олигоартрит – это одновременное воспаление 2-3 суставов из одной или разных анатомических областей тела. Патологический процесс возникает при ревматических заболеваниях, инфекционных процессах различной локализации, аллергических и метаболических нарушениях. Олигоартрит проявляется болями в пораженной зоне, покраснением и отечностью суставов, уменьшением объема активных движений. Диагностика требует проведения УЗИ и рентгенографии суставов, исследования синовиальной жидкости, клинического и иммунологического анализов крови. Лечение проводится комбинацией медикаментозных, физиотерапевтических и хирургических методов.
МКБ-10
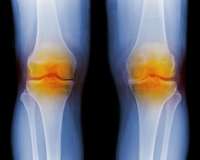


Общие сведения

Причины олигоартрита
Суставное поражение является синдромальным диагнозом, возникает на фоне широкого спектра заболеваний. Формируется как следствие воспалительных и дегенеративных процессов. К факторам риска относят тяжелую физическую работу, генетическую предрасположенность, нарушения обмена веществ и избыточный вес. Олигоартикулярный вариант патологии развивается при таких группах болезней:
- Ревматические болезни. К основным этиологическим факторам относят ревматоидный артрит, остеоартроз, серонегативные спондилоартропатии и артрит при ревматизме. Олигоартрит способны вызывать диффузные заболевания соединительной ткани.
- Инфекции. Реактивные олигоартриты развиваются при туберкулезе, ИППП (гонорея, хламидиоз), кишечных инфекциях (иерсиниоз, сальмонеллез, кампилобактериоз и дизентерия). Изредка причиной болезни становится боррелиоз, бруцеллез, вирусные инфекции.
- Метаболические нарушения. Классическим примером является подагрический артрит, который возникает при нарушении обмена мочевой кислоты. К редким формам относят пирофосфатную артропатию, охронотическую артропатию, суставной синдром при гемохроматозе.
- Аллергические реакции. Вовлечение в процесс суставов наблюдается при разных типах аллергозов, в том числе при пищевой аллергии и аллергодерматозах. Провоцирующими антигенами выступают компоненты продуктов питания, домашней пыли, пыльцы растений и шерсти животных.
- Травмы.Травматический олигоартрит возникает как следствие механического воздействия на суставы. Хроническая микротравматизация связана с профессиональными вредностями и наблюдается у швей, массажистов, офисных работников.
Патогенез
Механизм развития заболевания определяется этиологическим фактором. При аутоиммунных процессах происходит цепочка патологических изменений, которая начинается с воспаления синовиальной мембраны и разрастания грануляционной ткани. Исходом заболевания служит необратимая деструкция суставных хрящей, развитие анкилозов и хронического воспаления околосуставных тканей.
Реактивные артриты возникают при поражении тканей аутоантителами, которые синтезируются в ответ на проникновение инфекционных возбудителей. Антигены микробов сходны с антигенами собственных тканей организма, поэтому иммунная система начинает атаковать суставы. При реактивных олигоартритах возникает асептическое воспаление, микробы в синовиальной полости отсутствуют.

Классификация
Олигоартрит относится к категории полиартритов и отличается от них небольшим числом одновременно пораженных суставов. По клиническому течению он бывает острым, подострым и хроническим. Для систематизации разных вариантов заболевания используют этиопатогенетическую классификацию. Согласно ей, все олигоартриты подразделяются на две категории:
- Первичные. Представляют собой самостоятельные нозологические единицы. К самым частым вариантам принадлежит ревматоидный артрит, болезнь Сокольского-Буйо, анкилозирующий спондилоартрит. Большую группу составляют инфекционные олигоартриты, в том числе болезнь Рейтера.
- Вторичные. Поражение суставов развивается как осложнение других соматических заболеваний. Появление олигоартритов типично для системных аллергических процессов, коллагенозов, метаболических артропатий (подагра) и паранеопластического синдрома.
Симптомы олигоартрита
Олигоартрикулярный тип поражения имеет характерную клиническую картину. Независимо от этиологии, при олигоартрите возникают боли в зоне двух-трех воспаленных суставов. Пациенты описывают свои ощущения как жгучие, режущие, изнуряющие и выкручивающие. Болевой синдром усиливается при движениях, механическом сдавлении, прикосновениях к коже в проекции суставной сумки. Боли снижают двигательную активность и работоспособность пациента.
Локализация поражений зависит от типа нозологии. Для остеоартроза характерно симметричное поражение мелких суставов кисти и стопы при отсутствии утренней скованности. При ревматоидном артрите патология также возникает симметрично, однако присутствует утренняя скованность длительностью более 30 минут. Спондилоартриты характеризуются асимметричным поражением, при вирусных олигоартритах воспаляются лучезапястные и межфаланговые суставы.
Пациенты жалуются на быструю утомляемость, общее недомогание, повышение температуры тела при остром течении процесса. Симптоматика беспокоит от нескольких недель до нескольких месяцев, волнообразно усиливаясь. При внешнем осмотре обнаруживается покраснение и припухлость кожи вокруг суставной сумки. При длительном существовании заболеваний возникают деформации, которые наиболее выражены на пальцах кистей, большом пальце стопы и в области коленей.
Осложнения
Олигоартрит сопровождается поражением околосуставных тканей с развитием тендинитов, бурситов и периоститов. При реактивной форме суставного воспаления возможны изменения кожи и слизистых оболочек по типу язвенного стоматита, кератодермии. Поражение позвоночника чревато нарушениями осанки. Хронический нелеченый артрит вызывает стойкие контрактуры, нарушающие подвижность и приводящие к инвалидизации пациентов.
При аутоиммунных формах заболевания на первый план могут выходить внесуставные поражения, которые признаны неблагоприятными прогностическими факторами. Чаще всего в процесс вовлекается сердечно-сосудистая система (перикардиты, васкулиты), нервная система (полинейропатия, множественный мононеврит), зрительный анализатор (кератоконъюнктивит, эписклерит).
Диагностика
Обследование пациента проводится под руководством врача-ревматолога и ортопеда-травматолога. По показаниям к диагностике привлекают хирурга. Первичный осмотр выявляет неспецифические признаки воспаления суставов и сокращение объема движений в области поражения. Для выяснения причины, характера и степени повреждения суставов используются следующие методы:
- УЗИ суставов. Эхосонография – базовое исследование, которое назначается для первичной диагностики суставной патологии. УЗИ показывает наличие воспалительной жидкости в синовиальной сумке, сужение суставной щели, деструктивные изменения хрящевой ткани.
- Рентгенография суставов. По данным рентгенограммы определяются признаки воспалительной деструкции и дегенеративных повреждений хрящевой ткани. Для уточнения диагноза используется КТ суставов. На ранних стадиях проводится МРТ, которая более четко визуализирует мягкие ткани и внутрисуставные структуры.
- ЭхоКГ. Учитывая ассоциацию суставной и кардиоваскулярной патологии, всем пациентам требуется УЗИ сердца для оценки фракции выброса и состояния клапанного аппарата. Дополнительно выполняют ЭКГ для изучения работы проводящей системы сердца.
- Диагностический артроцентез. Пункция суставной полости проводится для уточнения диагноза и определения первопричины олигоартрита. При анализе синовиальной жидкости диагностическую ценность имеет наличие бактерий, повышение уровня лейкоцитов, белка и фагоцитов.
- Анализы крови. В гемограмме определяется лейкоцитоз, повышение СОЭ, эозинофилия при инфекционно-аллергической природе заболевания. Биохимический анализ показывает возрастание С-реактивного белка. Обязательно назначается исследование ревматоидного фактора, антител к циклическому цитруллинсодержащему пептиду, антинуклеарных антител.
Дифференциальная диагностика
Типичная клиническая картина не оставляет у врача сомнений в синдромальной диагностике олигоартрита. Большие сложности возникают при уточнении этиологического фактора, поскольку многие инфекционно-аллергические и аутоиммунные патологии сходны между собой. Для дифференциальной диагностики имеет значение симметричность и локализация воспаления, серопозитивность, результаты анализов на ИППП и другие инфекции.

Лечение олигоартрита
Консервативная терапия
Базовое лечение воспалительных процессов в суставах включает НПВС и глюкокортикостероиды. Препараты обладают противовоспалительным и анальгезирующим эффектом, способствуют быстрому облегчению болевого синдрома. При тяжелой форме олигоартрита используется внутрисуставное и периартикулярное введение гормонов, чтобы усилить эффект и снизить системные побочные эффекты.
При ревматоидном олигоартрите базисная терапия дополняется генно-инженерными биологическими препаратами: моноклональными антителами к фактору некроза опухолей, химерными белками в лимфотоксину, блокаторами рецепторов интерлейкина-6. Для эффективной терапии параинфекционных артритов используют противомикробные препараты согласно типу возбудителя, которые уничтожают первичный очаг инфекции.
Одновременно с системным лечением проводится местная терапия, которая направлена на ликвидацию болевого и воспалительного синдрома. В остром периоде используются компрессы с димексидом, обезболивающие мази, кремы с глюкокортикоидами. В подостром периоде хороший эффект показывает физиолечение: холодовые процедуры, электрофорез с лекарственными препаратами, ультразвуковая терапия и лазеротерапия.
Хирургическое лечение
Помощь хирургов-ортопедов требуется при значительном ограничении подвижности в суставах, выраженной деформации конечностей, резистентных синовитах и тендосиновитах. При олигоартритах выполняют эндопротезирование – реконструктивную операцию, которая восстанавливает объем движений и улучшает качество жизни пациента. По показаниям проводят артродез, синовэктомию.
Реабилитация
Для восстановления функции суставов назначается индивидуальная программа лечебной физкультуры (ЛФК). Укрепить мышцы, снять отечность и подготовить тело к нагрузкам позволяет лечебный массаж. Для метаболизма и регенерации суставных тканей важна сбалансированная диета с большим количеством жирных омега-кислот, которые содержатся в морской рыбе, рыбьем жире, оливковом масле. После улучшения самочувствия показано санаторно-курортное лечение.
Прогноз и профилактика
При реактивных артритах суставные изменения обратимы и подлежат консервативной терапии. Менее оптимистичный прогноз при дегенеративных олигоартритах, которые нарушают двигательную активность пациента и сокращают продолжительность жизни на 3-7 лет из-за внесуставных осложнений. Для профилактики заболевания рекомендован активный образ жизни, минимизация профессиональных вредностей, своевременное лечение урогенитальных и кишечных инфекций.
3. Реактивный артрит/ Е.В. Кундер// Международные обзоры: клиническая практика и здоровье. – 2015. – №6.
Иерсиниоз (син.: кишечный иерсиниоз, англ. Yersiniosis) — зоофильный сапроноз с фекально-оральным механизмом передачи возбудителя. Характеризуется развитием интоксикационного синдрома, преимущественным поражением ЖКТ, при генерализованной форме — полиорганным поражением. Имеет склонность к обострениям, рецидивам и хронизации.
Классификация
Из-за полиморфизма клинических проявлений до сих пор нет общепринятой классификации иерсиниоза. Как правило, используется клиническая классификация Н.Д. Ющука и соавт., в основу которой положен синдромальный принцип.
Клиническая классификация иерсиниоза
| Форма заболевания | Клинический вариант | Степень тяжести | Характер течения |
| Гастроинтестинальная | Гастроэнтерит, энтероколит, гастроэнтероколит | Лёгкая | Острое |
| Абдоминальная | Мезентериальный лимфаденит, терминальный илеит, острый аппендицит | Средняя | Затяжное |
| Генерализованная | Смешанный, септический | Тяжёлая | Хроническое |
| Вторично-очаговая | Артрит(ы), узловая эритема, синдром Рейтера и др. |
Этиология и патогенез
В развитии заболевания ведущую роль отводят факторам патогенности Y. enterocolitica: адгезии, колонизации на поверхности кишечного эпителия, энтеротоксигенности, инвазивности и цитотоксичности. Большинство штаммов не инвазивны. Не все инвазивные штаммы способны к внутриклеточному размножению. Этим объясняют разнообразие форм и вариантов болезни.
Возбудитель погибает при высыхании, кипячении, воздействии солнечного света и различных химических веществ (хлорамин, сулема, пероксид водорода, спирт). Пастеризация и кратковременное воздействие температуры до 80 °С не всегда приводят к гибели Y. enterocolitica.
Патогенез
Характер взаимодействия иерсиний с макроорганизмом зависит от иммунологической реактивности второго, набора факторов патогенности штамма, дозы инфекта и пути введения. Основная масса бактерий преодолевает защитный барьер желудка. Развивается катарально-эрозивный, реже катарально-язвенный гастродуоденит. Затем развитие патологического процесса может пойти в двух направлениях: либо возникнут воспалительные изменения только в кишечнике, либо разовьётся генерализованный процесс с лимфо- и гематогенной диссеминацией возбудителя.
Для иерсиниоза, вызванного слабоинвазивными штаммами Y. enterocolitica с выраженной энтеротоксигенностью, характерен, как правило, локализованный процесс, клинически проявляющийся интоксикацией и поражением ЖКТ (катарально-десквамативный, катарально-язвенный энтерит и энтероколит). Проникновение иерсиний в мезентериальные узлы вызывает развитие абдоминальной формы с мезентериальным лимфаденитом, терминальным илеитом или острым аппендицитом. Гастроинтестинальная и абдоминальная формы заболевания могут быть или самостоятельными, или одной из фаз генерализованного процесса.
Инфекция распространяется инвазивным и неинвазивным путём. При первом способе иерсиний проникают через эпителий кишки, и тогда развивается циклическое заболевание с гастроинтестинальной, абдоминальной и генерализованной фазами болезни. Второй путь, осуществляемый через слизистую оболочку кишки внутри фагоцита, возможен, если заражение вызвано цитотоксическим и инвазивным штаммом. Зачастую он приводит к быстрой диссеминации возбудителя.
В период реконвалесценции организм освобождается от иерсиний и восстанавливаются нарушенные функции органов и систем. При адекватном иммунном ответе заболевание заканчивается выздоровлением. Механизмы формирования затяжного течения и вторично-очаговых форм иерсиниоза недостаточно изучены. Ведущую роль отводят формирующимся уже в остром периоде болезни иммунопатологическим реакциям, длительной персистенции Y. enterocolitica и наследственным факторам. В течение 5 лет после острого иерсиниоза у части больных формируются системные заболевания (аутоиммунный тиреоидит, болезнь Крона, синдром Рейтера, ревматоидный артрит и др.).
Эпидемиология
Естественный резервуар для иерсиний — почва. Животным и птицам отводят роль вторичного резервуара и источника инфекции. Основные из них — грызуны, сельскохозяйственные животные (например, свиньи, рогатый скот, кролики), птицы и домашние животные (кошки, собаки).
Основной механизм передачи заболевания — фекально-оральный. Человек инфицируется при употреблении воды и продуктов, контаминированных иерсиниями (овощи, молоко, молочные продукты). На территориях с жарким климатом около 80% всех вспышек связано с питьём заражённой воды. Описаны случаи иерсиниоза после переливания инфицированной крови.
Восприимчивость высокая. К группам риска относят лиц, работающих в животноводстве, птицеводстве и на пищеблоках. ИИП среди населения в разных регионах составляет 10-20%. Постинфекционный иммунитет внутривидовой.
Иерсиниоз регистрируют повсеместно. Наиболее часто — в странах Западной и Северной Европы, в Великобритании, США, Канаде, Японии и России, реже — в Африке, Азии, Южной Америке и Восточной Европе. Фактическая заболеваемость в России значительно выше, чем официально регистрируемая. Подъём начинается в марте и продолжается 4 - 5 мес, резко снижаясь к августу и повторно возрастая в конце года.
Клиническая картина
Cимптомы, течение
В большинстве случаев заболевание начинается с симптомов острого гастроэнтерита, а затем протекает либо как острая кишечная, либо как генерализованная инфекция. Для всех форм иерсиниоза характерны острое начало, лихорадка, симптомы интоксикации, боли в животе, расстройство стула, экзантема, миалгия, артралгия, лимфоаденопатия и склонность к волнообразному течению. Кроме манифестных форм встречаются стёртые. Течение болезни может быть острым (до 3 мес), затяжным (3-6 мес) и хроническим (свыше 6 мес).
Заболевание чаще протекает в среднетяжёлой форме. Иногда единственный клинический симптом болезни — диарея. Выздоровление наступает в большинстве случаев через 1-2 нед. Возможны волнообразное течение, рецидивы и обострения.
Абдоминальная форма развивается у 3,5-10% больных (мезентериальный лимфаденит, терминальный илеит, острый аппендицит). Наиболее частый вариант - острый аппендицит. Начало болезни сходно с гастроинтестинальной формой. Однако через 1-3 дня появляются (или усиливаются) боли в правой подвздошной области или вокруг пупка. Заболевание может начинаться с интенсивных болей в животе. Аппендикулярная симптоматика сопровождается лихорадкой и лейкоцитозом. Формы аппендицита: катаральный, флегмонозный или гангренозный.
Мезентериальный лимфаденит может развиться при любой форме иерсиниоза, однако его симптомы преобладают при абдоминальной форме. Больных беспокоят нерезкие боли в правой подвздошной области, возникающие на 2 - 4 - й день на фоне лихорадки и диареи и сохраняющиеся до 2 мес. Иногда справа от пупка удаётся пропальпировать болезненные мезентериальные лимфатические узлы.
Для терминального илеита характерны лихорадка, постоянная ноющая боль в правой подвздошной области и явления энтероколита. При лапароскопии в правом нижнем квадранте живота обнаруживают воспалённый и отёчный дистальный отдел подвздошной кишки с брыжеечным аденитом. Обычно явления терминального илеита исчезают через 2 - 6 нед. Прогноз благоприятный.
У больных с абдоминальной формой возможны экзантема, артралгия и миалгия, шелушение кожи ладоней, пальцев рук и стоп, полиаденопатия, гепато- и гепатоспленомегалия.
Абдоминальная форма может осложниться перитонитом, стенозом терминального отдела подвздошной кишки и спаечной болезнью. Возможно длительное течение (несколько месяцев и даже лет) с рецидивами и обострениями.
При длительном течении генерализованной формы возможны колющая боль в области сердца, сердцебиение, тахикардия (даже при нормальной температуре). Пульс и АД лабильные. На ЭКГ — признаки инфекционной кардиопатии или миокардита. Возможно развитие специфической мелкоочаговой пневмонии, увеита, иридоциклита и усиление симптомов поражения ЦНС (головокружение, нарушение сна, вялость, адинамия, негативизм). В редких случаях обнаруживают менингеальный синдром. Некоторые больные жалуются на рези при мочеиспускании.
Течение заболевания в большинстве случаев благоприятное. Наблюдают рецидивы и обострения, протекающие легче, чем первая волна болезни, с преобладанием симптомов локальных поражений: артралгии (артрит) и боли в животе.
Период реконвалесценции обычно длительный. Вначале нарастают астеновегетативные расстройства. При генерализованной форме возможны развитие иерсиниозного миокардита, гепатита, пиелонефрита, менингита (менингоэнцефалита) и поражение нервной системы (синдром вегетативной дисфункции), характеризующиеся доброкачественным течением и благоприятным исходом.
Септический вариант генерализованной формы встречается редко и, как правило, у лиц с тяжёлыми сопутствующими заболеваниями и иммунодефицитными состояниями. Течение не отличается от течения при сепсисе другой этиологии. Летальность, достигающая 60%, обусловлена ИТШ, диффузным илеитом с перфорацией кишечника, перитонитом. Период реконвалесценции длительный.
Вторично-очаговая форма может развиться после любой другой формы иерсиниоза. Предшествующее ей заболевание либо протекает субклинически, либо первые проявления и возникшие затем очаговые поражения отделены друг от друга длительным периодом (до нескольких лет), в течение которого самочувствие пациента остаётся удовлетворительным. В этих случаях первым клиническим признаком иерсиниоза будет поражение какого-либо одного органа (сердце, печень и др.).
Симптомами вторично-очаговой формы иерсиниоза могут быть артрит, синдром Рейтера, узловатая эритема, затяжной или хронический энтероколит, шейный лимфаденит, офтальмит, конъюнктивит и остеит. Наиболее частый вариант — артритический, отличающийся от смешанного варианта генерализованной формы более интенсивными и продолжительными артралгиями (артритами), которым в большинстве случаев предшествуют диспепсические явления и симптомы интоксикации. У большинства больных развивается полиартрит. Чаще поражаются межфаланговые, лучезапястные, межпозвоночные, лопаточно-ключичные и тазобедренные, при моноартрите — коленный, голеностопный или локтевой суставы. Характерно асимметричное поражение суставов нижних конечностей и односторонний сакроилеит. В гемограмме — эозинофилия и увеличение СОЭ. Иерсиниозный артрит часто сочетается с кардитом.
У большинства больных со вторично-очаговой формой иерсиниоза развиваются трудно поддающиеся купированию астенические и вегетоневротические реакции.
Диагностика
Диагностика сложна при любой форме и основывается на характерной клинической картине и лабораторной диагностике.
В гемограмме при генерализованной форме обнаруживают лейкоцитоз, палочкоядерный сдвиг, эозинофилию (до 7%), лимфопению и увеличение СОЭ; в биохимическом анализе крови увеличение активности ферментов, реже — гипербилирубинемию.
Для диагностики и выбора тактики ведения больных рекомендуют следующие инструментальные методы: рентгенографию грудной клетки, поражённых суставов и сакроилеальных сочленений, ЭКГ, ЭхоКГ, УЗИ брюшной полости, ректороманоскопию, колоноскопию, КТ, диагностическую лапароскопию и сонографию.
Лабораторная диагностика
Специфическая лабораторная диагностика включает бактериологические, иммунологические и серологические методы. Основной метод — бактериологический. Материал от больного, полученный не позднее 7-го дня болезни, материал из внешней среды и от животных вначале высевают на среды накопления — фосфатно-буферный раствор и среду с бромтимоловым синим, затем на плотные питательные среды (желательно на две одновременно): на среду Эндо и буферно-казеиново-дрожжевую среду — с последующей идентификацией культуры. Одновременно исследуют не менее четырёх субстратов (например, фекалии, мочу, кровь, смыв с задней стенки глотки).
Иммунологические методы позволяют обнаружить антигены Y. enterocolitica в клиническом материале до 10-го дня от начала болезни (ИФА, РКА, РИФ , РНИФ, РАЛ, ПЦР, иммуноблоттинг).
Серологические методы используют, чтобы определить специфические антитела к антигенам Y. enterocolitica (ИФА, РА, РСК, РПГА). Исследование проводят со второй недели болезни в парных сыворотках с интервалом 10-14 дней одновременно 2 - 3 методиками.
Дифференциальный диагноз
Осложнения
Лечение
При тяжёлом течении режим постельный, в остальных случаях — палатный. Для диетического питания назначают столы № 4, 2 и 13.
Антибактериальную терапию начинают с 10 - 14 - го дня всем больным, независимо от формы болезни, в максимально ранние сроки (желательно до третьего дня болезни). Выбор препарата зависит от чувствительности штаммов иерсиний, циркулирующих на данной территории. Препараты выбора — фторхинолоны и
цефалоспорины III поколения. Хлорамфеникол рекомендуют для лечения иерсиниозного менингита (в/м, 70-100 мг/кг в сутки). Тактику ведения больных с абдоминальной формой вырабатывают совместно с хирургом. Для восстановления кишечной флоры рекомендуют пробиотики (бифиформ и др.) и эубиотики (аципол, линекс, бифилонг, ацидофильные лактобактерии, бифидобактерии бифидум и другие препараты) в сочетании с ферментными препаратами (панкреатин, абомин \ панкреофлат).
Лечение больных со вторично-очаговой формой иерсиниоза проводят по индивидуальной схеме. Антибактериальная терапия самостоятельного значения не имеет и показана при активизации инфекционного процесса и отсутствии в анамнезе сведений о приёме антибиотиков. При необходимости лечение согласовывают с узкими специалистами.
Лечение больных иерсениозом
При развитии симптомов острого живота при абдоминальной форме проводят аппендэктомию. Выбор физиотерапевтических и санаторно-курортных методов лечебно-реабилитационных мероприятий зависит от формы иерсиниоза и основного синдрома.
При иерсиниозе человек остаётся нетрудоспособным в среднем 14-21 день; при вторично-очаговых формах и волнообразном течении этот период может составить 4 - 6 мес.
Продолжительность диспансерного наблюдения реконвалесцентов должна составлять не менее одного года через 1, 3, 6 и 12 мес после острого периода. При наличии клинико-лабораторного неблагополучия — более часто, по мере необходимости.
Иерсиниоз и псевдотуберкулез продолжают оставаться одной из наиболее значимых медико-социальных проблем, в связи с их распространенностью, проблемами лабораторной диагностики и исходами.
Иерсиниоз и псевдотуберкулез продолжают оставаться одной из наиболее значимых медико-социальных проблем, в связи с их распространенностью, проблемами лабораторной диагностики и исходами. Доказана триггерная роль Yersinia enterocolitica в формировании хронической патологии кишечника, почек, щитовидной железы и коллагенозов [1–7]. По мнению некоторых исследователей это объясняется наличием перекрестно реагирующих детерминант у иерсиний и некоторых тканевых антигенов человека, в частности, белков клеток щитовидной железы, желудочно-кишечного тракта (ЖКТ), клеток соединительной ткани и тубулярного эпителия почек [4, 5, 8, 9–12]. Некоторые авторы рассматривают такие заболевания, как гломерулонефрит, тиреоидит, болезнь Грейвса–Базедова, тромбоцитопению и гемолитическую анемию, как закономерный исход иерсиниоза [7, 8, 13]. После адекватного по современным представлениям лечения затяжное и хроническое течение иерсиниозной инфекции наблюдается у 10–55% больных, у 9–25% из них формируются системные заболевания (болезнь Рейтера, Крона, Гужеро–Шегрена, хронические заболевания соединительной ткани, аутоиммунные гепатиты, эндо-, мио-, пери- и панкардиты, тромбоцитопении и др.) [14]. По данным J. A. Hoogkamp-Korstanje (1996), иерсиниоз заканчивается хронизацией в 6–35% случаев.
Нормативных документов, регламентирующих сроки и объем диспансерного наблюдения пациентов, перенесших иерсиниоз, в настоящее время нет. В практическом здравоохранении диспансерное наблюдение за реконвалесцентами осуществляется обычно в течение 1–3 месяцев после выписки из стационара [15–18]. Однако неблагоприятные исходы иерсиниозной инфекции нередко дебютируют клинически спустя некоторое время (от нескольких месяцев до нескольких лет) после острого периода болезни, причем с полиморфной симптоматикой. В большинстве случаев пациенты с формирующейся постиерсиниозной патологией обращаются за медицинской помощью не к инфекционистам, а к врачам смежных клинических дисциплин, которые зачастую расценивают клиническую картину как проявление самостоятельной нозологии, не связанной с иерсиниозом. Как показывает практика, такой подход оказывается не всегда верным. Залогом выздоровления лиц, переболевших иерсиниозом и псевдотуберкулезом, является рациональная диспансеризация [19]. Однако сроки и объем диспансерного наблюдения реконвалесцентов не индивидуализированы и, как правило, определяются врачом в ходе наблюдения.
Целью нашего исследования явилось изучение особенностей течения и отдаленных исходов генерализованной и вторично-очаговой формы иерсиниоза и псевдотуберкулеза для дальнейшей оптимизации системы диспансерного наблюдения больных.
Материалы и методы
Наблюдали 295 больных (198 мужчин и 97 женщин) в возрасте от 16 до 65 лет (49,2% в возрасте 19–25 лет и 38% в возрасте 26–45 лет), находившихся в 1995–2005 гг. под динамическим наблюдением с иерсиниозом (206 больных) и псевдотуберкулезом (89 больных). Из них 256 больных были госпитализированы в ИКБ № 2 г. Москвы и 39 наблюдались амбулаторно. Критерии включения больных: верифицированный диагноз иерсиниоза или псевдотуберкулеза; генерализованная и вторично-очаговая форма псевдотуберкулеза и иерсиниоза средней степени тяжести; возраст от 15 до 65 лет; отсутствие острой и хронической внебольничной микст-инфекции, тяжелых сопутствующих заболеваний, указаний на аутоиммунные заболевания в анамнезе больного и его кровных родственников и заболеваний, сопровождающихся иммунодефицитным состоянием (вирусные гепатиты, ВИЧ-инфекция, первичные иммунодефицитные состояния (ПИДС), вторичные иммунодефицитные состояния (ВИДС)), и алкоголизма; информированное согласие больного на длительное амбулаторное наблюдение. Большинство больных (62,4%) были госпитализированы в поздние сроки — после 6–10 дня от начала болезни. Диагноз был верифицирован у 92,5% больных бактериологическими (посев кала, крови, мочи и мазка с задней стенки глотки на диагностические среды для выявления роста и идентификации иерсиний (ФГУН ГНЦ ПМБ, п. Оболенск) и серологическими (РА и РНГА (НИИЭМ им. Пастера, СПб), ИФА (IBL, Germany) методами. У 7,5% больных ни один из использованных методов не позволил подтвердить клинический диагноз, что может объясняться сроками проведения обследования (более 3 лет от дебюта болезни). Однако типичная клиническая картина и наличие специфических антител в анамнезе позволили нам включить этих больных в разработку. Несмотря на преобладание молодого возраста, подавляющее большинство больных (69,5%) имели сочетанную хроническую патологию ЖКТ и желчевыводящих путей, ЛОР-органов, мочеполовой системы, опорно-двигательного аппарата, сердечно-сосудистой системы и щитовидной железы в стадии ремиссии.
В работе была использована клиническая классификация, предложеная Н. Д. Ющуком и Г. Н. Кареткиной в 1988 г. В соответствии с ней 184 пациента переболели генерализованной формой иерсиниоза (101 больной) и смешанной формой псевдотуберкулеза (83 больных); 111 больных — вторично-очаговой формой (ВОФ) иерсиниоза (105 больных) и псевдотуберкулеза (6 больных).
Продолжительность диспансерного наблюдения у большинства больных составила от 1 года до 5 лет, у пациентов с хроническим течением (49 больных) — до 10 лет. В течение первого года после острого периода пациентов обследовали комплексно каждые 2–3 месяца, затем 1 раз в 6 месяцев при отсутствии жалоб и отклонений в состоянии здоровья. При наличии клинико-лабораторного неблагополучия — более часто, по мере необходимости. По показаниям во время диспансерного наблюдения больные проходили обследование у ревматолога, гастроэнтеролога, эндокринолога, кардиолога, окулиста, дерматолога, гинеколога и гинеколога-эндокринолога с проведением необходимых лабораторно-инструментальных исследований.
Статистическая обработка результатов исследования проведена с помощью метода непараметрической статистики с использованием критерия Манна–Уитни и c2 для сравнения средних величин. Стадийная оценка клинических признаков в зависимости от исхода болезни проводилась с использованием регрессионного анализа с составлением уравнений регрессии. Математическая и статистическая обработка данных проводилась при помощи пакета статистических программ SPSS (9-я версия, допустимая ошибка Е = 5%).
Результаты и обсуждение
Длительное диспансерное наблюдение за переболевшими иерсиниозом и псевдотуберкулезом позволило нам разделить исходы иерсиниозной инфекции на несколько групп:
неблагоприятные исходы: (а) формирование хронического течения иерсиниозной инфекции, (б) формирование патологических состояний и заболеваний, имеющих аутоиммунную природу;
относительно неблагоприятные исходы с преобладанием инфекционно-воспалительного компонента: (а) обострение хронических сопутствующих воспалительных заболеваний, (б) формирование новых заболеваний с преобладанием инфекционно-воспалительного компонента;
Полученные данные показывают, что большинство больных (55,2%) после перенесенной иерсиниозной инфекции выздоравливали, при этом наилучший прогноз имели больные, принадлежащие к возрастной группе 19–25 лет (табл.). В то же время у 44,7% переболевших сформировались различные по генезу патологические состояния, входившие в категорию неблагоприятных исходов заболевания и наблюдавшиеся с довольно высокой частотой в возрастной группе 26–45 лет. Среди неблагоприятных исходов ведущее значение приобретало хроническое течение инфекционного процесса — 16,6%, а формирование этого исхода отмечалось чаще в возрасте старше 25 лет. В группу риска по развитию заболеваний и состояний, имеющих аутоиммунную и аллергическую природу, наоборот, входили преимущественно пациенты моложе 26 лет. Относительно неблагоприятные исходы несколько чаще были отмечены примерно в равной степени у больных 16–18 лет и 26–45 лет, особенно с формированием новых заболеваний с преобладанием инфекционно-воспалительного компонента (64,5% от числа случаев с относительно неблагоприятным прогнозом). Что касается резидуальных явлений, то общая частота их развития была относительно небольшой и составляла 5,1% с явным преобладанием в этой группе больных старше 45 лет.
Изменения гемограммы в период рецидива при генерализованной форме иерсиниоза/псевдотуберкулеза носили непостоянный характер. У большинства больных (65,2%) количество лейкоцитов в периферической крови оставалось в пределах нормы, у 34,8% — повышалось умеренно (до 10·109/л). У 73,9% больных за 7–10 дней до появления клинических признаков рецидива наблюдалось увеличение относительного числа лимфоцитов (в пределах 43%) или тенденция к их увеличению, выявляемая при динамическом контроле. Лишь у 17,4% пациентов зарегистрировали эозинофилию (до 7%). СОЭ оставалась в пределах нормы у 14 (60,9%) больных, у остальных — в пределах 25 мм/ч. Из биохимических показателей наиболее часто перед рецидивом и во время него наблюдали повышение уровня активности лактатдегидрогеназы (в пределах 650 МЕ/л), степень повышения которой зависела от варианта течения и продолжительности рецидивной волны.
В отличие от генерализованной формы при рецидивирующем течении ВОФ не было ни одного случая рецидива в течение первого месяца болезни. Самые ранние рецидивы регистрировались у 9 (22,5%) больных на 2–3 месяце от начала болезни, в среднем на 58,6 ± 5,7 дня болезни. У большинства пациентов (72,5%) первая рецидивная волна наблюдалась спустя 6 месяцев — 1 год после манифестации ВОФ иерсиниозной инфекции, а у 2 больных — спустя 1,5 года. Течение рецидива было схоже с рецидивными волнами, развивающимися у больных с генерализованной формой иерсиниоза. У большинства больных с рецидивирующим течением ВОФ в крови длительно сохранялся относительный лимфоцитоз (до 45%); число лейкоцитов, эозинофилов и СОЭ оставались в пределах нормы.
У 19,8% пациентов с генерализованной формой иерсиниоза/псевдотуберкулеза регистрировали обострение болезни, характеризующееся ухудшением самочувствия, нарастанием лихорадки и симптомов периода разгара, реже — присоединением новых симптомов. В 65% случаев обострение развивалось в конце второй — начале третьей недели, в среднем на 17,5 ± 1,9 дня болезни; в 35% случаев — в более поздние сроки: 62,6 ± 8,9 дня болезни.
У 28 (26,7%) больных с ВОФ иерсиниоза наблюдали волнообразное течение болезни с чередованием периодов обострений и относительных ремиссий. Лишь у 18 (42,9%) впервые обострения регистрировались на 2–3 месяце от начала ВОФ, в среднем на 53,8 ± 5,2 дня болезни. Большинство пациентов (64,9%) отмечали ухудшение самочувствия первые полгода от начала болезни, в среднем на 71,1 ± 6,8 дня болезни. Каждый третий пациент (35,7%) с волнообразным течением ВОФ отмечал ухудшение самочувствия с определенной периодичностью (от 2 до 5 раз в год на протяжении 1–5 лет), проявляющееся усилением симптомокомплекса вторично-очаговых проявлений. Как правило, обострения протекали у каждого пациента по-разному (или только с развитием артритического варианта, или только обострения энтероколита и т. п.). У 16 (57,1%) больных наблюдали несколько волн обострений (3 и более за год). У этих пациентов лабораторные показатели не отличались постоянством. Общее число лейкоцитов, как правило, оставалось в пределах нормы или с тенденцией к лейкопении, у 22 (78,6%) сохранялась стойкая лимфопения или тенденция к снижению относительного числа лимфоцитов периферической крови. У 17 (60,7%) больных наблюдали ускорение СОЭ до 30 мм/ч, величина которого соответствовала активности воспалительного процесса со стороны опорно-двигательной системы.
У большинства пациентов, переболевших генерализованной формой иерсиниозной инфекции, заболевание продолжалось до 3–4 недель. На момент выписки из стационара их самочувствие расценивалось как удовлетворительное, жалоб не было. Однако у 11 пациентов (13,3%) с псевдотуберкулезом и 23 (22,8%) с иерсиниозом регистрировали непостоянный субфебрилитет (в пределах 37,1–37,3 °С) во второй половине дня, как правило, не ощущаемый пациентами и выявляемый при измерении температуры каждые 2–3 часа в течение 5–7 дней.
После генерализованной формы иерсиниозной инфекции полное клинико-лабораторное выздоровление наблюдается у половины больных — 97 (52,7%) (рис. 2). Хронический характер течение генерализованной формы иерсиниоза/псевдотуберкулеза приобрело у 24 (13,0%) пациентов. Из них у 11 (45,8%) больных регистрировали длительную (более двух лет) циркуляцию в крови специфических IgA, что расценивалось как косвенный признак продолжающейся персистенции в организме Y. enterocolitica. Двое из них (18,2%) через 3–5 лет получили 2 группу инвалидности. Хроническое течение псевдотуберкулеза с длительным выделением Y. pseudotuberculosis I серотипа наблюдали у 1 (1,2%) больного, у которого в течение последующих 5 лет диагностировали анкилозирующий спондилит. В течение 1–5 лет заболевания с аутоиммунным компонентом сформировались у 17 (9,2%) больных (15 — с иерсиниозом и 2 с псевдотуберкулезом). У большинства из них диагностировали аутоиммунный тиреоидит и серонегативную спондилоартропатию, реже — синдром Рейтера, ревматоидный артрит и анкилозирующий спондилит. У 20 (10,9%) больных в течение первого года после перенесенного иерсиниоза наблюдали дебют воспалительных заболеваний, чаще ЖКТ и мочевыводящих путей (гастрит, гастродуоденит, панкреатит, энтероколит, пиелонефрит и др.). 11 (6,0%) больных стали жаловаться на участившиеся случаи обострения сопутствующих заболеваний, чаще желудочно-кишечных, почек и приступов нейроциркуляторной дистонии. У 8,2% больных с генерализованной инфекцией в анамнезе наблюдались резидуальные явления. Резидуальными явлениями считали сохраняющиеся до 6 месяцев клинические проявления патологических изменений в различных органах и системах пациента (опорно-двигательного аппарата, нервной ткани, эндокринной системе и др.) при отсутствии изменений лабораторных показателей. По нашему мнению, резидуальные явления имеют частично деструктивный, дистрофический, дисциркуляторный или репаративный характер и характеризуются динамическими фазами компенсаций и декомпенсаций, исход которых зависит от многочисленных факторов (генетических, множественности поражений, особенностей применяемого лечения, присоединения вторичных инфекций, осложнений и др.). К резидуальным проявлениям мы отнесли непродолжительную субфебрильную лихорадку, периодические миалгии и артралгии, неврологические симптомы с вовлечением нервных сплетений и корешков, вегетативные реакции, астенический и ипохондрический синдромы, феномен интероцепции и др.
Длительное диспансерное наблюдение за больными, перенесшими ВОФ иерсиниозной инфекции, показало, что они в 4,5 раза реже выздоравливают по сравнению с больными, переболевшими острой циклической формой иерсиниоза/псевдотуберкулеза, соответственно 12,6% и 52,7% (p < 0,05) (рис. 3). Частота развития неблагоприятных и относительно неблагоприятных исходов после ВОФ иерсиниозной инфекции значительно выше, чем после генерализованной формы болезни (p < 0,05).
Заключение
Исходя из вышеизложенного можно сделать следующие выводы:
Для выработки адекватной каждому периоду болезни тактики ведения больного и прогноза исхода практикующему врачу целесообразно учитывать форму и вариант течения острого иерсиниоза и псевдотуберкулеза (циклическое, рецидивирующее, затяжное и хроническое).
Выраженность и продолжительность клинических симптомов не являются объективными критериями, позволяющими в ранние сроки прогнозировать исход болезни. Так, у некоторых больных при затяжном и рецидивирующем течении иерсиниозная инфекция завершается выздоровлением, а у других при доброкачественном течении начального периода реконвалесценции развиваются иммунопатологические процессы, исходом которых являются хронические заболевания, в том числе аутоиммунные.
Диспансерное наблюдение пациентов, переболевших иерсиниозом, должно быть активным, индивидуальным и систематизированным. Сроки диспансерного наблюдения за лицами, перенесшими иерсиниоз, должны быть дифференцированными с учетом формы, особенностей течения болезни и сопутствующей патологии. Мы рекомендуем обследовать реконвалесцентов через 1, 3 и 6 месяцев в течение первого полугодия, затем 1 раз в 6 месяцев при отсутствии жалоб и отклонений в состоянии здоровья. При наличии клинико-лабораторного неблагополучия — более часто, по мере необходимости, до трех лет после острого периода иерсиниоза и псевдотуберкулеза.
Литература
Белая О. Ф., Ручкина И. Н., Ганюшкина Н. Н. Значение иерсиний при синдроме раздраженного кишечника. В кн. Инфекции, обусловленные иерсиниями (иерсиниоз, псевдотуберкулез), и другие актуальные инфекции. СПб; 2000: 6.
Сидельникова С. М., Ющенко Г. В., Асеева Э. И. Иерсиниозы как терапевтическая проблема // Тер. архив. 2000; 11: 27–30.
Рябчук Ф. Н., Пирогова З. И. Рецидивы иерсиниозной инфекции как фактор формирования хронической гастроэнтерологической патологии у детей // Гастробюллетень. 2000; 1–2: 81.
Сапега Е. Ю. Нефропатии у детей с иерсиниозными инфекциями. Автореф. дисс. … канд. мед. наук. Хабаровск, 2001.
Treacher D. F. Yersinia colitis associated with Crohn’s disease // Postgrad. Med. J. 1985; 61 (712): 173–174.
Granfors K., Merilahti-Palo R., Luukkainen R. et al. Persistence of Yersinia antigens in peripheral blood cells from patients with Yersinia enterocolitica O:3 infection with or without reactive arthritis // Arthr. and Rheum. 1998; 41: 855.
Zhang H., Kaur I., Niesel D. W. et al. Lipoprotein from Yersinia enterocolitica contains epitopes that cross-react with the Human Thyrotropin Receptor // J. Immunol. 1997; 158: 1976–1983.
Saebo A., Lassen J. Yersinia enterocolitica: an inducer of chronic inflammation // Int. J. Tissue React. 1994; 16 (2): 51–57.
O’Connor S. M., Taylor Ch. E., Hughes J. M. Emerging infectious determinants of chronic diseases // Emerg. Infect. Dis. 2006; 12 (7): 1051–1057.
Di Genaro M. S., Caragnelutti D. E., Castro D. O. et al. Yersinia-triggered arthritis in IL-12 p40-deficient mice: relevant antigens and local expression of Toll-like receptor mRNA // Scand J. Rheumatol. 2007; 36 (1): 28–35.
Wildner G., Diedrichs-Mohring M. Autoimmune uveitis induced by molecular mimicry of peptides from rotavirus, bovine casein and retinal S-antigen // Eur. J. Immunol. 2003; 33 (9): 2577–2587.
Санитарные и ветеринарные правила. Профилактика инфекционных болезней. Профилактика и борьба с заразными болезнями, общими для человека и животных. Иерсиниозы. СП 3.1, 094–96. ВП 13.3.1318–96.
Шестакова И. В., Ющук Н. Д., Балмасова И. П., Попова Т. И. Медицинская реабилитация и диспансерное наблюдение больных с иерсиниозом // Тер. архив. 2008; 80 (1): 28–32.
Ключевые слова: иерсиниоз, псевдотуберкулез, варианты течения, отдаленные исходы, диспансерное наблюдение.
Н. Д. Ющук, доктор медицинских наук, профессор, академик РАМН
И. В. Шестакова, кандидат медицинских наук
МГМСУ, Москва
Иерсиниоз является серьезной проблемой для многих регионов России. На клиническом примере рассматриваются отличия желтушной формы иерсиниоза от типичной формы вирусного гепатита, показана роль современных методов лабораторной диагностики и лечения иерсини
Yersiniosis is a serious problem in many regions of Russia. The differences in icteric forms of yersiniosis from the typical forms of viral hepatitis are shown in the clinical case. The role of modern methods of laboratory diagnosis and treatment of yersiniosis in children are discussed.
Заболеваемость иерсиниозом в Российской Федерации в течение 2010–2015 гг. стабильно высокая с неравномерным распределением по отдельным территориям. Более высокие показатели заболеваемости от 50 до 150 и более на 100 000 детей регистрируются в северных регионах России. Показатели на юге России значительно ниже — от 6 до 10 на 100 000 детского населения [1].
Возбудитель заболевания Yersinia enterocolitica длительно сохраняется в окружающей среде (до нескольких месяцев), что определяет его эпидемическую значимость.
Основным источником инфекции являются животные, больные иерсиниозом люди и бактериовыделители, что подтверждается ростом инфицированных лиц при осложнении эпидемической ситуации и возможностью внутрибольничного заражения иерсиниозом.
В естественных условиях возбудители иерсиниоза существуют как паразиты грызунов и выделяются во внешнюю среду с испражнениями и мочой. Наиболее обсемененными иерсиниями являются длительно хранящиеся овощи, в которых обнаружение возбудителя может составлять 10–20% и более [2].
Клиническая диагностика иерсиниоза затруднена в связи с полиморфизмом симптоматики, которую можно принять за различные заболевания инфекционной и не инфекционной природы. Выделяют следующие клинические формы иерсиниоза: гастроэнтероколитическую, желтушную, артралгическую, экзематозную, менингеальную, катаральную, смешанную и септическую.
Клиническая картина иерсиниоза характеризуется острым началом, токсикозом, повышением температуры тела до 39–40 °C, симптомами поражения желудочно-кишечного тракта (тошнота, рвота, боли в животе схваткообразного или постоянного характера, жидкий стул). С первого дня заболевания у больных могут отмечаться мышечные и суставные боли, инъекция сосудов склер и конъюнктивы, катаральные явления в ротоглотке, экзантема и др. При развитии желтушной формы иерсиниоза на первый план выступают симптомы поражения печени: боли в правом подреберье, увеличение размеров печени и ее болезненность при пальпации, иктеричность кожи и склер, потемнение мочи, обесцвеченный кал [3, 4]. Общая клиническая картина желтушной формы иерсиниоза мало похожа на вирусный гепатит, но среди ошибок диагностики иерсиниоза, протекающего с желтухой, данная форма заболевания чаще всего трактуется как вирусный гепатит.
Следует отметить, что при желтушной форме иерсиниоза и вирусного гепатита есть много общих симптомов: иктеричность кожи и склер, увеличение печени и ее болезненность, изменение цвета кожи и кала. Вместе с этим в клинике этих заболеваний есть отличия, имеющие решающее значение для диагностики иерсиниоза даже на стадиях анамнестического и клинического обследования.
Приводим одно из наших наблюдений.
При осмотре в приемном отделении состояние тяжелое, температура 38 °C. Выраженная иктеричность кожи и склер. Пульс 90 в 1 минуту, ритмичный, удовлетворительного наполнения и напряжения, АД 90/60 мм рт. ст. Тоны сердца приглушены, чистые. Над легкими перкуторный тон ясный, дыхание везикулярное. Живот мягкий, не вздут, безболезненный при пальпации. Нижний край печени пальпируется на 6 см ниже реберной дуги, поверхность ее гладкая, эластичная, пальпация безболезненная. Селезенка не пальпировалась. Кал окрашен, моча насыщенная. Из эпидемического анамнеза выяснилось, что больной контактов с больными желтухой не имел, никаких инъекций в течение последних 6 месяцев не получал. Все члены семьи здоровы.
Анализ крови при поступлении: эритроциты — 3,5 × 10 12 /л, гемоглобин — 122 г/л, лейкоциты — 5,9 × 10 9 /л, эозинофилы — 2%, палочкоядерные лейкоциты — 3%, сегментоядерные лейкоциты — 46%, лимфоциты — 43%, моноциты — 2%, СОЭ — 6 мм/час. Общий билирубин крови — 68 мкмоль/л с преобладанием прямой фракции. Показатель аланинаминотрансферазы (АЛТ > 31 мкмоль/л). Протромбиновый индекс — 70%.
Несмотря на проводимую дезинтоксикационную и антибактериальную терапию (Цефотаксим в суточной дозе 2 г) с последующей его заменой на амикацин в суточной дозе 10 мг/кг массы тела сохранялась лихорадка на фебрильных цифрах. Желтуха нарастала, и к 11-му дню заболевания общий билирубин крови повысился до 129 мкмоль/л, прямой — 97 мкмоль/л, непрямой 32 мкмоль/л, сохранялась ферментемия: АЛТ — 24,8 мкмоль/л, холестерин — 5,14 мкмоль/л, ЩФ — 0,60 мкмоль/л. В общем анализе крови при нормальном числе лейкоцитов появился нейтрофилез с палочкоядерным сдвигом, СОЭ до 60 мм/час. Печень увеличилась до 8 см ниже края реберной дуги, стала более плотной. Моча оставалась темной, обесцветился кал. Смена антибактериальной терапии на Левомицетин сукцинат натрия из расчета 50 мг/кг массы тела (суточная доза) позволила добиться купирования лихорадки в течение первых 3 дней применения данного препарата до субфебрильных цифр и ее нормализации на 10-й день лечения Левомицетином (21-й день заболевания). Одновременно шло уменьшение иктеричности кожи и склер. К 22-му дню заболевания показатель общего билирубина составлял 47 мкмоль/л, АЛТ — 16,5 мкмоль/л, холестерина — 1,7 мкмоль/л, ЩФ — 0,60 мкмоль/л. К 30-му дню заболевания показатели общего билирубина и его фракций полностью нормализовались. Показатель АЛТ снизился до 2,38 мкмоль/л, показатели гемограммы соответствовали норме. Размеры печени уменьшились. Полная нормализация АЛТ достигнута на 37-й день заболевания.
Проведенное дополнительное обследование крови на маркеры вирусных гепатитов, гемокультуру, определение титра антител в парных сыворотках крови с помощью РНГА с иерсиниозным антигеном, обследование на лептоспироз, псевдотуберкулез дали отрицательный результат. Иммуноферментный анализ крови на иерсиниоз положительный (IgM). На 17-й день заболевания из крови больного выделена Yersinia enterocolitica серовар 03, биотип 4. На 19-й день заболевания данный возбудитель выделен из кала. На 24-й день заболевания титр антител в реакции непрямой гемагглютинации (РНГА) 1:50 с последующим нарастанием титра антител к иерсиниозному антигену в 3 раза. Выделенный возбудитель оказался чувствительным к Левомицетину.
Заключительный клинический диагноз: иерсиниоз, желтушная форма.
Особенностями данного клинического наблюдения является высокая активность гепатоцеллюлярных ферментов, что считается не характерным для иерсиниозных гепатитов.
Комплекс анамнестических, клинических и лабораторных данных, полученных при обследовании больного, позволил с большей степенью достоверности предположить иерсиниоз. Специфические методы обследования лишь подтвердили установленный диагноз.
Анализируя приведенный клинический пример, можно привести убедительный и простой довод отвергнуть вирусный гепатит.
Как мы видели, больной заметил желтуху кожных покровов и потемнение мочи в тот день, когда температура тела поднялась до максимальных цифр, а самочувствие его оставалось плохим. При вирусном гепатите в подавляющем большинстве случаев с появлением желтухи самочувствие и состояние больных заметно улучшаются: нормализуется температура (если она была повышенной), появляется аппетит, уменьшается слабость, т. е. многие симптомы преджелтушного периода ослабевают или исчезают совсем. Лишь при самом тяжелом течении вирусного гепатита появление желтухи не сопровождается улучшением самочувствия больных, напротив, симптомы интоксикации могут нарастать, но на фоне нормальной или, реже, субфебрильной температуры.
Распознавание желтушной формы иерсиниоза с тяжелым течением заболевания может быть простым или, напротив, нелегким, а на стадии амбулаторного обследования и невозможным делом. Диагноз прост во время вспышки иерсиниоза и весьма сложен при спорадических случаях инфекции, как в нашем примере.
Дифференциация иерсиниоза от тифопаратифозных заболеваний, лептоспироза, вирусного гепатита, псевдотуберкулеза и т. д. в условиях инфекционного стационара не представляет затруднений и базируется на изучении динамики основных проявлений инфекции, различий в гематологических сдвигах и, самое важное, — на выделении возбудителя и результатах серологического обследования. Следует помнить, что отрицательные результаты серологического обследования на иерсиниоз еще не исключают диагноз. Для повышения достоверности диагноза необходимо использование бактериологического и серологического методов.
Бактериологический метод позволяет определить возбудитель у больных людей, животных, а также на объектах окружающей среды. Материалом для исследования являются: смывы из носоглотки, кровь, суставная жидкость, ликвор, операционный материал, испражнения, моча. Целесообразно проводить бактериологическое исследование до начала антибактериальной терапии, на первой неделе заболевания, трехкратно. Результат данного исследования получают через 2–3 недели.
Для ранней диагностики используются иммунологические методы выявления антигенов возбудителя: иммуноферментный анализ, реакция непрямой иммунофлюоресценции, реакция латекс-агглютинации и др. Материалом для данных исследований являются слюна, кровь, копрофильтраты, органы животных, смывы из объектов внешней среды. Исследования лучше проводить в первые 10 дней заболевания, используя не менее 2 видов материалов от больных.
Для серологической диагностики с целью выявления специфических антител используются реакция агглютинации (диагностический титр 1:160), РНГА. Доступным для большинства лабораторий инфекционных стационаров является определение антител к Yersinia enterocolitica 03 и 09 методом РНГА. Диагностическим считается титр 1:400. Исследования проводят с 5–7 дня болезни в парных сыворотках крови, взятых с интервалом 10–14 дней. В последние годы чаще стала использоваться генетическая диагностика — полимеразная цепная реакция [5].
Литература
Г. А. Харченко 1 , доктор медицинских наук, профессор
О. Г. Кимирилова, кандидат медицинских наук
Читайте также:

