Типичное морфологическое проявление при септицемии
Обновлено: 25.04.2024
Патологоанатомическая диагностика сепсиса : методические рекомендации / О.Д.Мишнёв, А.И.Щёголев, О.А.Трусов. — Москва, 2004.
библиографическое описание:
Патологоанатомическая диагностика сепсиса : методические рекомендации / Мишнёв О.Д., Щёголев А.И., Трусов О.А. — 2004.
код для вставки на форум:
Российское общество патологоанатомов
О.Д.Мишнев, А.И.Щеголев, О.А.Трусов
ПАТОЛОГОАНАТОМИЧЕСКАЯ ДИАГНОСТИКА СЕПСИСА
Введение
Сепсис – полиэтиологическое инфекционное заболевание, характеризующееся генерализованным характером, ацикличностью течения и особым образом измененной реактивностью. Сепсис развивается из местных очагов инфекции и рассматривается, как правило, в качестве осложнения заболеваний, послуживших причиной генерализации инфекции. Последние годы, несмотря на интенсивную терапию, характеризуются ростом числа больных сепсисом и высокой летальностью.
Сепсис представляет собой заболевание, в отношении этиологии, патогенеза, патологической анатомии, диагностики, лечения которого всегда были и ещё будут проводиться дискуссии. Клиницисты обращаются к патологоанатомам в надежде получить желаемое и в то же время, по их мнению, объективное и адекватное объяснение летального исхода при сепсисе. Однако, справедливости ради, следует констатировать, что, как правило, такое объяснение для них a priori, до вскрытия, в современных клиниках уже имеется, и оно может быть получено на основании комплекса клинических и лабораторных признаков доказательной медицины.
Именно эти показатели, очевидно, следует использовать и патологоанатому при анализе истории болезни и результатов вскрытия для решения своих диагностических проблем. Многие клиницисты интересуются на вскрытии, т.е. a posteriori, не столько познанием на морфологическом субстрате причины и действия, сколько прагматичным согласованием формальных параметров, определяемых при сличении клинического и патологоанатомического диагнозов. Это определяет первоочередную задачу совместной междисциплинарной работы – нахождения общих точек соприкосновения клиницистов и патологоанатомов для полноценного и современного анализа результатов патологоанатомического исследования умерших от сепсиса.
Теоретические аспекты проблемы сепсиса, представленные в мировой литературе конца ХХ – начала нынешнего века и воспринимаемые как революционные и во многом совершенные, дающие основания для разработки оптимальных методов лечения и недопущения летальных исходов при сепсисе, не были неожиданными для патологоанатомов России. В этом заслуга наших Учителей и в первую очередь И.В. Давыдовского, а также А.В.Смольянникова, Д.С.Саркисова, А.П.Авцына, Н.К.Пермякова и других, которые первоочередное внимание уделяли макробиологической составляющей сепсиса, не забывая при этом об этиопатогенетической роли возбудителей инфекции.
Принятие и выполнение решений Согласительной конференции пульмонологов и специалистов по интенсивной терапии (ACCP/SCCV), состоявшейся в 1991 году в Чикаго, привело к унификации терминологии и к упрощению клинической диагностики сепсиса. Однако отсутствие рандомизированных патологоанатомических исследований и, соответственно, клинико-морфологических сопоставлений является одной из важных причин неполного взаимопонимания клиницистов и патологоанатомов при оценке формы и танатогенеза заболевания, а также при обсуждении расхождений клинического и патологоанатомического диагнозов. К сожалению, до настоящего времени предметом дискуссий является отнесение тех или иных клинических и морфологических признаков к проявлениям сепсиса.
Также следует остановиться на распространённой ныне тенденции считать условным выделение разновидностей сепсиса по входным воротам, поскольку генерализованная реакция организма на инфекцию по своей сути является единой и требует незамедлительного лечения, а в Международной классификации болезней отсутствует подразделение сепсиса на разновидности по данному основанию. Возможно, что такой прагматичный подход является обоснованным, однако мы рекомендуем патологоанатомам не забывать о морфологических особенностях различных форм сепсиса в зависимости от входных ворот.
Действительно, для патологоанатома и клинициста не будет представлять большой сложности достижение взаимопонимания при анализе результатов секции больного, погибшего от сепсиса при наличии типичных морфологических признаков и соответствующих клинических данных. Гораздо большие трудности возникнут в том случае, когда больного лечили от сепсиса (и по результатам вскрытия довольно успешно – именно так!), а смерть наступила от другой причины, видимо не связанной с сепсисом. В этом случае необходимо учитывать не только медицинские составляющие (организационные, научно–практические), но также социальные и экономические вопросы, которые в настоящее время никогда не следует упускать из вида. Также сложными для патологоанатомической диагностики являются наблюдения лечённого сепсиса в плане танатогенеза и установления непосредственной причины смерти. Наконец, наблюдения посмертно диагностированного сепсиса, который не был выявлен в клинике, должны стать предметом обсуждения на клинико–патологоанатомических конференциях.
Определения терминов и понятий
Сепсис (в переводе с греческого sēpsis – гниение) – представляет собой особую форму тяжелой генерализованной инфекции, при которой макроорганизм не способен локализовать инфекционный процесс (Белянин В.Л., Рыбакова М.Г., 2004).
Бактериемия – симптом, обозначающий наличие в крови живых микроорганизмов (не обязательно только при сепсисе).
Диссеминация – употребляется, как правило, для характеристики распространения поражений при инфекционном процессе в пределах одного органа (например, диссеминированный туберкулез легких).
Генерализация – обозначает, как правило, поражение многих органов и систем (например, генерализованная вирусная, туберкулезная инфекция).
Синдром системного воспалительного ответа (ССВО) (Systemic Inflammatory Response Syndrome (SIRS), синдром системной воспалительной реакции (ССВР)) патологическое состояние, обусловленное одной из форм хирургической инфекции или альтерации ткани неинфекционной природы (травма, панкреатит, ожог, ишемия или аутоиммунные повреждения тканей и др.). Это понятие предложено классификацией ACCP/SCCV, что привело к существенному пересмотру концептуальных положений о патогенезе, клинике, лечении, профилактике возникновения сепсиса и его осложнений. ССВР (SIRS) характеризуется наличием более чем одного из четырёх следующих основных клинических признаков: гипертермия, тахикардия, тахипноэ, лейкоцитоз (или лейкопения). Подобные клинические признаки встречаются при сепсисе, но при этом обязательным является наличие инфекционного очага поражения в тканях или органах. Патологоанатомическая характеристика SIRS является объектом перспективных научных исследований.
Септицемия – клинико–патологоанатомическая форма сепсиса, при которой отсутствуют метастатические септические очаги. Септицемия – это сепсис без гнойных метастазов. По поводу правомочности применения этого понятия в качестве диагноза одной из форм сепсиса до сих пор продолжается дискуссия. Некоторые клиницисты и патологоанатомы советуют вообще отказаться от этого термина (Пермяков Н.К., 1992). Этот термин не представлен и в классификации ACCP/SCCV. Тем не менее, он рекомендован МКБ-10 как унифицированный для всех разновидностей сепсиса, и вплоть до нового пересмотра он должен применяться клиницистами и патологоанатомами при определении шифра большинства клинико–патологоанатомических форм сепсиса.
Септикопиемия – клинико–патологоанатомическая форма сепсиса. Для неё характерно наличие гнойного воспаления (абсцессов, апостем, флегмон, интерстициального гнойного воспаления) в различных органах и тканях, возникающего в результате гематогенного распространения микробных эмболов из септического очага. Септикопиемия – это сепсис с гнойными метастазами.
Термин септикопиемия не представлен в МКБ–10.
Термин сепсис носит обобщающий характер, как и термин септический процесс. Классификация ACCP/SCCV рекомендует в клинике использовать термин сепсис, а не септицемия или септикопиемия. В настоящее время не рекомендуется использовать термин септическое состояние, лишенный конкретной основы.
Тяжёлый сепсис (или сепсис-синдром) – форма сепсиса, предложенная в классификации ACCP/SCCV, при котором отмечаются признаки полиорганной недостаточности. В.Л.Белянин и М.Г.Рыбакова (2004) считают, что с точки зрения патоморфолога понятие тяжёлый сепсис (сепсис–синдром) нельзя признать удачной терминологической находкой.
Септический шок – другая форма тяжёлого сепсиса в классификации ACCP/SCCV, сопровождающаяся артериальной гипотонией, не устраняющейся с помощью инфузионной терапии и требующей назначения катехоламинов.
Септический (бактериальный, инфекционный) эндокардит (острый и подострый) характеризуется, прежде всего, воспалительными поражениями клапанного аппарата сердца, развивающимися наряду с септическими проявлениями. Представляет собой самостоятельное заболевание (первоначальную причину смерти) и имеет собственный шифр. Следует отличать от поражений эндокарда при других формах сепсиса.
Септический очаг – различают первичный и метастатические септические очаги. Первичный септический очаг представляет собой фокус воспаления, преимущественно гнойного, в котором происходит накопление микроорганизмов, распространяющихся затем гематогенно и лимфогенно по тканям и органам. Метастатические септические очаги (вторичные септические очаги, метастатические очаги при сепсисе, септические метастазы, метастатические гнойники, гнойные метастазы) представляют собой очаги воспаления, возникающие вследствие гематогенного перемещения септического процесса в ткани и органы из другого очага.
Системный инфекционный процесс – поражение какой-либо системы органов (например: нервной при клещевом энцефалите; пищеварительной при шигеллезе и т.д.).
Гнойно-резорбтивная лихорадка. Понятие гнойно-резорбтивной лихорадки предложено И.В.Давыдовским для обозначения клинических и патологоанатомических проявлений местного гнойно-некротического процесса, морфологически ограниченного демаркационным валом (в отличие от септических очагов) от окружающих тканей. В настоящее время этот термин почти не используется, а состояние больного обозначается как интоксикация или разновидность эндотоксикоза.
Эндотоксикоз – очень широкое понятие для обозначения осложнений и проявлений заболеваний и состояний организма. Основным фактором патогенеза эндотоксикоза является воздействие на организм токсических продуктов, образующихся в нем в результате нарушения тех или иных функций.
Этиология
Возбудителями сепсиса могут являться многие микроорганизмы (табл. 1). Это многочисленные бактерии: стрептококки, стафилококки, менингококки, пневмококки, кишечная палочка, синегнойная палочка, клебсиеллы, протей, сальмонеллы, а также грибы преимущественно Кандида и аспергиллус. Сепсисом может осложниться течение туберкулеза, сыпного тифа, брюшного тифа и других инфекционных заболеваний, возбудителями которых являются патогенные микроорганизмы. Генерализованные вирусные инфекции не принято рассматривать в качестве сепсиса, хотя об этом имеются указания в современных зарубежных клинических исследованиях.
Таблица. 1. Наиболее вероятная этиология сепсиса в зависимости от локализации первичного очага инфекции
Патологоанатомическая диагностика сепсиса : методические рекомендации / О.Д.Мишнёв, А.И.Щёголев, О.А.Трусов. — Москва, 2004.
библиографическое описание:
Патологоанатомическая диагностика сепсиса : методические рекомендации / Мишнёв О.Д., Щёголев А.И., Трусов О.А. — 2004.
код для вставки на форум:
Российское общество патологоанатомов
О.Д.Мишнев, А.И.Щеголев, О.А.Трусов
ПАТОЛОГОАНАТОМИЧЕСКАЯ ДИАГНОСТИКА СЕПСИСА
Введение
Сепсис – полиэтиологическое инфекционное заболевание, характеризующееся генерализованным характером, ацикличностью течения и особым образом измененной реактивностью. Сепсис развивается из местных очагов инфекции и рассматривается, как правило, в качестве осложнения заболеваний, послуживших причиной генерализации инфекции. Последние годы, несмотря на интенсивную терапию, характеризуются ростом числа больных сепсисом и высокой летальностью.
Сепсис представляет собой заболевание, в отношении этиологии, патогенеза, патологической анатомии, диагностики, лечения которого всегда были и ещё будут проводиться дискуссии. Клиницисты обращаются к патологоанатомам в надежде получить желаемое и в то же время, по их мнению, объективное и адекватное объяснение летального исхода при сепсисе. Однако, справедливости ради, следует констатировать, что, как правило, такое объяснение для них a priori, до вскрытия, в современных клиниках уже имеется, и оно может быть получено на основании комплекса клинических и лабораторных признаков доказательной медицины.
Именно эти показатели, очевидно, следует использовать и патологоанатому при анализе истории болезни и результатов вскрытия для решения своих диагностических проблем. Многие клиницисты интересуются на вскрытии, т.е. a posteriori, не столько познанием на морфологическом субстрате причины и действия, сколько прагматичным согласованием формальных параметров, определяемых при сличении клинического и патологоанатомического диагнозов. Это определяет первоочередную задачу совместной междисциплинарной работы – нахождения общих точек соприкосновения клиницистов и патологоанатомов для полноценного и современного анализа результатов патологоанатомического исследования умерших от сепсиса.
Теоретические аспекты проблемы сепсиса, представленные в мировой литературе конца ХХ – начала нынешнего века и воспринимаемые как революционные и во многом совершенные, дающие основания для разработки оптимальных методов лечения и недопущения летальных исходов при сепсисе, не были неожиданными для патологоанатомов России. В этом заслуга наших Учителей и в первую очередь И.В. Давыдовского, а также А.В.Смольянникова, Д.С.Саркисова, А.П.Авцына, Н.К.Пермякова и других, которые первоочередное внимание уделяли макробиологической составляющей сепсиса, не забывая при этом об этиопатогенетической роли возбудителей инфекции.
Принятие и выполнение решений Согласительной конференции пульмонологов и специалистов по интенсивной терапии (ACCP/SCCV), состоявшейся в 1991 году в Чикаго, привело к унификации терминологии и к упрощению клинической диагностики сепсиса. Однако отсутствие рандомизированных патологоанатомических исследований и, соответственно, клинико-морфологических сопоставлений является одной из важных причин неполного взаимопонимания клиницистов и патологоанатомов при оценке формы и танатогенеза заболевания, а также при обсуждении расхождений клинического и патологоанатомического диагнозов. К сожалению, до настоящего времени предметом дискуссий является отнесение тех или иных клинических и морфологических признаков к проявлениям сепсиса.
Также следует остановиться на распространённой ныне тенденции считать условным выделение разновидностей сепсиса по входным воротам, поскольку генерализованная реакция организма на инфекцию по своей сути является единой и требует незамедлительного лечения, а в Международной классификации болезней отсутствует подразделение сепсиса на разновидности по данному основанию. Возможно, что такой прагматичный подход является обоснованным, однако мы рекомендуем патологоанатомам не забывать о морфологических особенностях различных форм сепсиса в зависимости от входных ворот.
Действительно, для патологоанатома и клинициста не будет представлять большой сложности достижение взаимопонимания при анализе результатов секции больного, погибшего от сепсиса при наличии типичных морфологических признаков и соответствующих клинических данных. Гораздо большие трудности возникнут в том случае, когда больного лечили от сепсиса (и по результатам вскрытия довольно успешно – именно так!), а смерть наступила от другой причины, видимо не связанной с сепсисом. В этом случае необходимо учитывать не только медицинские составляющие (организационные, научно–практические), но также социальные и экономические вопросы, которые в настоящее время никогда не следует упускать из вида. Также сложными для патологоанатомической диагностики являются наблюдения лечённого сепсиса в плане танатогенеза и установления непосредственной причины смерти. Наконец, наблюдения посмертно диагностированного сепсиса, который не был выявлен в клинике, должны стать предметом обсуждения на клинико–патологоанатомических конференциях.
Определения терминов и понятий
Сепсис (в переводе с греческого sēpsis – гниение) – представляет собой особую форму тяжелой генерализованной инфекции, при которой макроорганизм не способен локализовать инфекционный процесс (Белянин В.Л., Рыбакова М.Г., 2004).
Бактериемия – симптом, обозначающий наличие в крови живых микроорганизмов (не обязательно только при сепсисе).
Диссеминация – употребляется, как правило, для характеристики распространения поражений при инфекционном процессе в пределах одного органа (например, диссеминированный туберкулез легких).
Генерализация – обозначает, как правило, поражение многих органов и систем (например, генерализованная вирусная, туберкулезная инфекция).
Синдром системного воспалительного ответа (ССВО) (Systemic Inflammatory Response Syndrome (SIRS), синдром системной воспалительной реакции (ССВР)) патологическое состояние, обусловленное одной из форм хирургической инфекции или альтерации ткани неинфекционной природы (травма, панкреатит, ожог, ишемия или аутоиммунные повреждения тканей и др.). Это понятие предложено классификацией ACCP/SCCV, что привело к существенному пересмотру концептуальных положений о патогенезе, клинике, лечении, профилактике возникновения сепсиса и его осложнений. ССВР (SIRS) характеризуется наличием более чем одного из четырёх следующих основных клинических признаков: гипертермия, тахикардия, тахипноэ, лейкоцитоз (или лейкопения). Подобные клинические признаки встречаются при сепсисе, но при этом обязательным является наличие инфекционного очага поражения в тканях или органах. Патологоанатомическая характеристика SIRS является объектом перспективных научных исследований.
Септицемия – клинико–патологоанатомическая форма сепсиса, при которой отсутствуют метастатические септические очаги. Септицемия – это сепсис без гнойных метастазов. По поводу правомочности применения этого понятия в качестве диагноза одной из форм сепсиса до сих пор продолжается дискуссия. Некоторые клиницисты и патологоанатомы советуют вообще отказаться от этого термина (Пермяков Н.К., 1992). Этот термин не представлен и в классификации ACCP/SCCV. Тем не менее, он рекомендован МКБ-10 как унифицированный для всех разновидностей сепсиса, и вплоть до нового пересмотра он должен применяться клиницистами и патологоанатомами при определении шифра большинства клинико–патологоанатомических форм сепсиса.
Септикопиемия – клинико–патологоанатомическая форма сепсиса. Для неё характерно наличие гнойного воспаления (абсцессов, апостем, флегмон, интерстициального гнойного воспаления) в различных органах и тканях, возникающего в результате гематогенного распространения микробных эмболов из септического очага. Септикопиемия – это сепсис с гнойными метастазами.
Термин септикопиемия не представлен в МКБ–10.
Термин сепсис носит обобщающий характер, как и термин септический процесс. Классификация ACCP/SCCV рекомендует в клинике использовать термин сепсис, а не септицемия или септикопиемия. В настоящее время не рекомендуется использовать термин септическое состояние, лишенный конкретной основы.
Тяжёлый сепсис (или сепсис-синдром) – форма сепсиса, предложенная в классификации ACCP/SCCV, при котором отмечаются признаки полиорганной недостаточности. В.Л.Белянин и М.Г.Рыбакова (2004) считают, что с точки зрения патоморфолога понятие тяжёлый сепсис (сепсис–синдром) нельзя признать удачной терминологической находкой.
Септический шок – другая форма тяжёлого сепсиса в классификации ACCP/SCCV, сопровождающаяся артериальной гипотонией, не устраняющейся с помощью инфузионной терапии и требующей назначения катехоламинов.
Септический (бактериальный, инфекционный) эндокардит (острый и подострый) характеризуется, прежде всего, воспалительными поражениями клапанного аппарата сердца, развивающимися наряду с септическими проявлениями. Представляет собой самостоятельное заболевание (первоначальную причину смерти) и имеет собственный шифр. Следует отличать от поражений эндокарда при других формах сепсиса.
Септический очаг – различают первичный и метастатические септические очаги. Первичный септический очаг представляет собой фокус воспаления, преимущественно гнойного, в котором происходит накопление микроорганизмов, распространяющихся затем гематогенно и лимфогенно по тканям и органам. Метастатические септические очаги (вторичные септические очаги, метастатические очаги при сепсисе, септические метастазы, метастатические гнойники, гнойные метастазы) представляют собой очаги воспаления, возникающие вследствие гематогенного перемещения септического процесса в ткани и органы из другого очага.
Системный инфекционный процесс – поражение какой-либо системы органов (например: нервной при клещевом энцефалите; пищеварительной при шигеллезе и т.д.).
Гнойно-резорбтивная лихорадка. Понятие гнойно-резорбтивной лихорадки предложено И.В.Давыдовским для обозначения клинических и патологоанатомических проявлений местного гнойно-некротического процесса, морфологически ограниченного демаркационным валом (в отличие от септических очагов) от окружающих тканей. В настоящее время этот термин почти не используется, а состояние больного обозначается как интоксикация или разновидность эндотоксикоза.
Эндотоксикоз – очень широкое понятие для обозначения осложнений и проявлений заболеваний и состояний организма. Основным фактором патогенеза эндотоксикоза является воздействие на организм токсических продуктов, образующихся в нем в результате нарушения тех или иных функций.
Этиология
Возбудителями сепсиса могут являться многие микроорганизмы (табл. 1). Это многочисленные бактерии: стрептококки, стафилококки, менингококки, пневмококки, кишечная палочка, синегнойная палочка, клебсиеллы, протей, сальмонеллы, а также грибы преимущественно Кандида и аспергиллус. Сепсисом может осложниться течение туберкулеза, сыпного тифа, брюшного тифа и других инфекционных заболеваний, возбудителями которых являются патогенные микроорганизмы. Генерализованные вирусные инфекции не принято рассматривать в качестве сепсиса, хотя об этом имеются указания в современных зарубежных клинических исследованиях.
Таблица. 1. Наиболее вероятная этиология сепсиса в зависимости от локализации первичного очага инфекции
Что такое многоформная экссудативная эритема (МЭЭ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Фоминых С.Ю., дерматолога со стажем в 23 года.
Над статьей доктора Фоминых С.Ю. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Многоформная экссудативная эритема (МЭЭ) — это острое аллергическое заболевание, при котором на коже и слизистых оболочках появляются различные по виду высыпания — пятнистые, папулёзные и пузырные.
МЭЭ обычно болеют люди молодого и среднего возраста. У пациентов мужского пола это заболевание встречается несколько чаще, чем у женщин.
Известны две основные разновидности МЭЭ:
- инфекционно-аллергическая (идиопатическая или истинная) — составляет около 80 % всех случаев МЭЭ и является следствием аллергической реакции на хронический очаг инфекции в организме;
- токсико-аллергическая — развивается, как правило, на фоне применения некоторых лекарственных средств, таких как амидопирин, барбитураты, сульфаниламиды и тетрациклины [7] .
Для инфекционно-аллергической МЭЭ характерна весенне-осенняя сезонность. Одного очага хронической инфекции недостаточно, чтобы данное заболевание развилось или обострилось. Для этого необходимо определённое сочетание триггерных, т. е. провоцирующих факторов, например:
- иммунодефицит (обратимый, преходящий, циклический);
- переохлаждение;
- ультрафиолетовое облучение;
- некоторые консерванты в составе пищевых продуктов (бензоаты, формальдегид и т. д.);
- психоэмоциональный стресс;
- патология пищеварительного тракта (хронический гастрит, дисбактериоз);
- аутоиммунные заболевания и онкопатология; , ангина и другие заболевания.
Не исключается и наличие наследственной предрасположенности к ММЭ.
Причиной инфекционно-аллергической МЭЭ, которая приводит к развитию болезни, чаще всего является герпесвирус человека, вирус Эпштейна — Барр, цитомегаловирус, а также возбудители вирусных гепатитов, микобактерии, микоплазменная, стрептококковая и грибковые инфекции, паразиты. Наиболее распространённый вид инфекционно-аллергической МЭЭ — герпес-ассоциированная МЭЭ [4] [12] [13] .
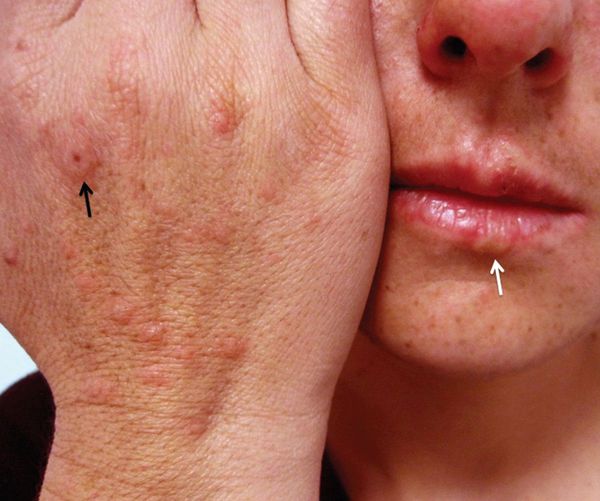
Считается, что герпесвирусная инфекция [1] [2] [5] становится причиной подавляющего большинства случаев МЭЭ. Чаще всего обнаруживается связь с вирусом простого герпеса первого типа [8] [10] [11] , реже — второго.
В пользу инфекционно-аллергической формы МЭЭ свидетельствует наличие продромального периода (предшествующего болезни), склонности к сезонности высыпаний и хроническое рецидивирующее течение.
Эксперты ВОЗ отмечают, что рост заболеваемости простым герпесом в настоящий момент заставляет рассматривать его в числе первоочередных проблем, наряду с ВИЧ-инфекцией и гриппом.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы многоформной экссудативной эритемы
Для инфекционно-аллергической МЭЭ, включая герпес-ассоциированную [13] , характерно острое начало заболевания. Оно может проявляться повышением температуры, общей слабостью, ломотой в теле, головной болью, болезненными ощущениями в горле и другими симптомами.
Нередко за несколько дней до обострения МЭЭ у пациентов активируется герпетическая инфекция — проявляется герпес на губах или возникает рецидив генитального герпеса [8] .
Высыпания, характерные для МЭЭ, обычно начинают появляться через 1-2 дня после начала продромальных явлений. При этом общие симптомы обычно идут на спад.
Локализация сыпи весьма разнообразна. Она может появиться как на коже, так и на слизистых оболочках.
Кожные проявления
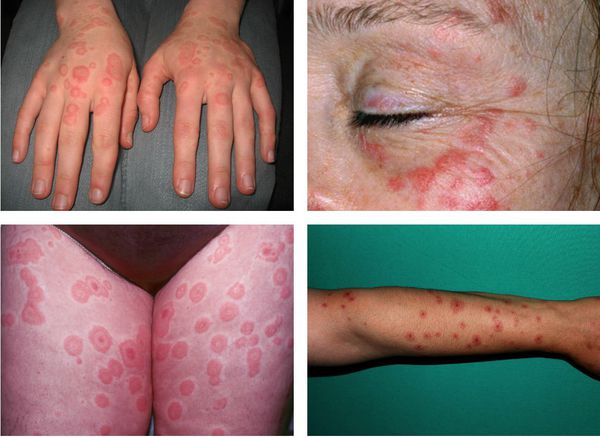
На коже обычно отмечаются чётко очерченные округлые красно-розовые пятна и плоские отёчные папулы, которые увеличиваются в размерах от 2-3 мм до 3 см в диаметре. При инфекционно-аллергической форме пятна обычно несколько мельче и не склонны к слиянию. Они могут доставлять зуд и жжение.
Преимущественная локализация высыпаний — на разгибательной стороне рук и ног, тыльной стороне стоп и кистей, на лице и в области гениталий. В основном они располагаются на теле симметрично, часто группами в виде дуг, гирлянд.
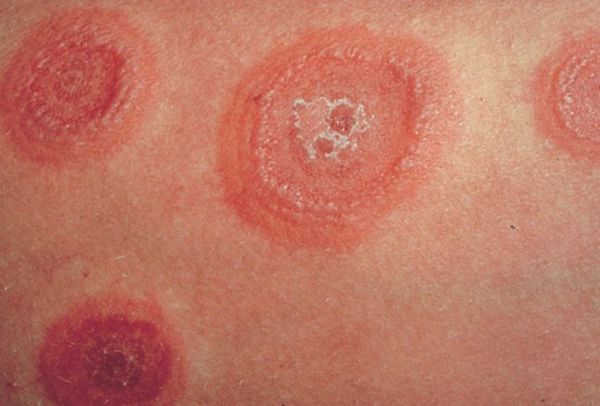
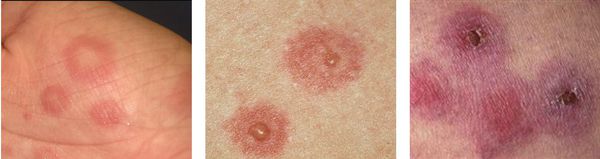
По мере роста папулы её центр начинает западать и менять окраску на более синюшную, по периферии остаётся красно-розовый ободок — таким образом элементы сыпи приобретают характерный вид "мишени" (иногда их сравнивают с "бычьим глазом" или "кокардой") [4] .
После в их центре образуются пузыри — везикулы и буллёзные элементы. Они содержат серозный или кровянистый экссудат. Лопаясь, пузыри формируют желтоватые или коричнево-бурые корочки, эрозированные поверхности.
В итоге на теле пациента одновременно присутствуют элементы разной степени развития — пятна, папулы и пузыри, переходящие в корочки и эрозии. Именно поэтому эритема именуется многоформной.
С интервалами в несколько дней могут образовываться новые группы высыпаний. Это может затянуть процесс. Но обычно окончательный регресс наступает приблизительно в течение двух недель.
Частота обострений может варьировать от 1-2 до 5-12 раз в год. В редких тяжёлых случаях одно обострение может переходить в другое, практически без светлого промежутка. За это время предыдущие высыпания полностью не разрешаются.
Высыпания на слизистых оболочках
Могут появляться единичные элементы на слизистой полости рта, который не причиняют особого беспокойства. В более тяжёлых случаях поражения бывают настолько обширными и болезненными. Они затрудняют речь и приём даже однородной и жидкой пищи [12] [13] .
Образующиеся пузыри лопаются довольно быстро, поэтому пациент не успевает их заметить — обычно обнаруживаются уже эрозии, на которых иногда можно увидеть плёнчатые фибринозные налёты светлого или бурого оттенка.
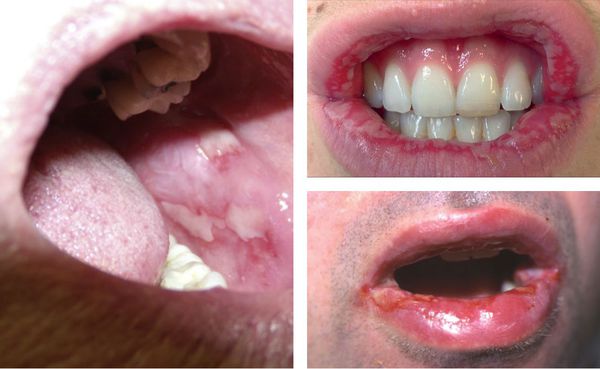
В области красной каймы губ могут возникнуть весьма болезненные, растрескивающиеся кровянистые корки, которые не позволяют больному полноценно открывать рот.
Реже высыпания обнаруживаются на слизистых глаз и половых органов. В осложнённых случаях возможно присоединение вторичной инфекции, образование рубцов и синехий (спаек).
Патогенез многоформной экссудативной эритемы
На современном этапе любая разновидность мультиформной экссудативной эритемы рассматривается как сдвиг адаптации защитных механизмов в сторону гиперчувствительности [4] .
МЭЭ — это смешанная аллергическая реакция, в которой просматриваются особенности, характерные для гиперчувствительности как немедленного, так и замедленного типа. Зачастую у пациента явно прослеживается так называемая общая атопическая предрасположенность — исходно у него могут отмечаться, к примеру, признаки пищевой аллергии, атопический ринит, бронхиальная астма и дерматит.
При герпес-ассоциированной МЭЭ у пациентов резко повышается уровень иммуноглобулинов класса Е (IgE) и снижается продукция иммуноглобулинов класса А (IgA), которые обеспечивают "первую линию" защиты кожи и слизистых оболочек. Также отмечается понижение выработки альфа- и гамма-интерферона и образование циркулирующих иммунных комплексов с вирусом простого герпеса.
Вирус повреждает генетический аппарат не только клеток эпидермиса, но и иммунокомпетентных клеток, изменяет состояние их рецепторов, выработку специфических ферментов и провоспалительных цитокинов. В то же время может наблюдаться Т-клеточный и нейтрофильный иммунодефицит, повышение количества В-лимфоцитов. Всё это нарушает связь между различными звеньями иммунитета, искажает нормальный иммунный ответ, заставляет организм проявлять агрессию к собственным тканям, в данном случае — к клеткам эпидермиса и эндотелия сосудов кожи.
Всё вышеперечисленное приводит к образованию лимфоцитарного инфильтрата вокруг кровеносных сосудов кожи, иногда с признаками геморрагии. В базальном слое эпидермиса развивается внутри- и внеклеточный отёк. Сам слой расслаивается, в нём возникают некротические изменения с образованием толстостенных булл.
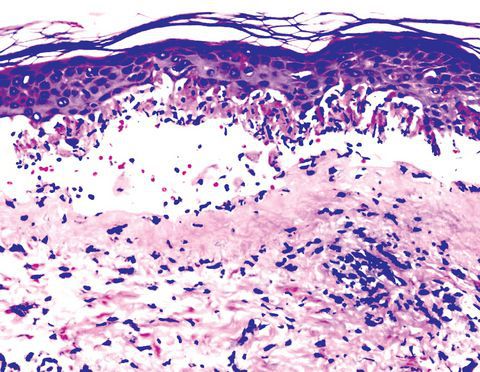
Степень тяжести патологических проявлений при герпес-ассоциированной МЭЭ во многом зависит от выраженности имеющихся иммунных сдвигов, которые, в свою очередь, могут являться причиной наличия хронического инфекционного очага в организме.
Классификация и стадии развития многоформной экссудативной эритемы
В зависимости от степени выраженности симптомов [3] [12] выделяют две формы МЭЭ:
- малая — поражений слизистых нет или они очень слабо выражены, почти нет общих симптомов;
- большая — протекает с тяжёлым поражением слизистых оболочек, ярко выраженными общими симптомами.
По первичным элементам сыпи, преобладающим в клинической картине МЭЭ, различают пять форм заболевания:
- эритематозная — ограниченное покраснение кожи;
- папулёзная — появление красноватых плотных узелков;
- эритематозно-папулёзная — образование папул с ярко-красными краями и потемневшим центом;
- везикуло-буллёзная — формирование эритематозных бляшек с пузырьком в центре;
- буллёзная — превращение пузырьков в эрозии, которые покрываются корочками.
Воспалительный процесс в зависимости от гистопатологической картины поражения кожи разделяют на три типа [3] :
- эпидермальное воспаление — нарушается наружный слой кожи;
- дермальное воспаление — изменяется толстый слой кожи под эпидермисом;
- смешанное (эпидермо-дермальное) воспаление.
По степени тяжести МЭЭ может быть лёгкой, средней, среднетяжёлой и тяжёлой. В качестве критериев тяжести рассматривают количество и размер буллёзных элементов, наличие поражений слизистых оболочек полости рта и гениталий, температуру тела. Отдельно выделяют часто рецидивирующую форму.
Общепринятой классификации герпес-ассоциированной МЭЭ в настоящее время не существует. В её развитии, как и в развитии МЭЭ, различают два периода:
- продромальный — период активации вирусного процесса;
- буллёзный — период разгара заболевания.
Осложнения многоформной экссудативной эритемы
Осложнения чаще всего развиваются при тяжёлых формах заболевания, а также у людей, организм которых по различным причинам ослаблен [12] [13] .
При обширных поражениях слизистой полости рта резкая болезненность высыпаний затрудняет нормальный гигиенический уход. Когда во рту изначально присутствовали очаги инфекции, возможно развитие такого осложнения, как фузоспирохетоз. Это стоматологическое заболевание характеризуется образованием толстого желтоватого дурно пахнущего налёта на слизистой полости рта, языке и зубах.
Затруднённый приём пищи при генерализованном поражении слизистой полости рта может приводить к истощению пациента.
При локализации высыпаний на слизистой носа возможно развитие ринита с носовыми кровотечениями.
Эрозии на слизистой половых органов могут заживать с образованием синехий (спаек, сращений).
В 22% случаев через эрозивные дефекты покровов проникает вторичная бактериальная инфекция. Это чревато гнойно-септическими осложнениями, образованием более глубоких поражений, на месте которых в редких случаях могут образовываться рубцы.
Поражение слизистой оболочки глаз может осложняться конъюнктивитом и кератитом (кератоконъюнктивитом) [3] .
К числу редких и наиболее серьёзных осложнений можно также отнести постгерпетическую невралгию, пневмонию, почечную недостаточность.
Диагностика многоформной экссудативной эритемы
Для постановки диагноза "МЭЭ" в типичном случае врачу-дерматологу достаточно характерной клинической картины и данных опроса пациента. Имеют значение сведения о хронических очагах инфекции, недавних рецидивах герпетических высыпаний и провоцирующих факторах.
Лабораторные анализы (например, общий анализ крови) в нетяжёлых случаях могут не показать никаких отклонений. При тяжёлых формах отмечается повышение СОЭ и умеренный лейкоцитоз — небольшое повышение уровня лимфоцитов в крови.
Для уточнения диагноза нужно исключить другие, схожие по симптоматике заболевания — пузырчатку, узловатую эритему, системную красную волчанку, вторичный сифилис и другие. С этой целью выполняют цитологическое исследование мазков-отпечатков, взятых с поверхности высыпаний, а также изучение клеток поражённой ткани под микроскопом.
Наличие герпетической инфекции в организме при необходимости можно подтвердить несколькими способами:
- ПЦР-диагностика на инфекции, передающиеся половым путём;
- серологическое обследование на наличие антител к вирусу простого герпеса;
- оценка иммунного статуса.
Дифференциальную диагностику герпес-ассоциированной МЭЭ необходимо проводить с узловатой и кольцевидной эритемой Дарье, токсидермиями, вторичным сифилисом, системной красной волчанкой, герпетическим стоматитом, болезнью Кавасаки, уртикарным васкулитом, красным плоским лишаем (эрозивной формой).
Лечение многоформной экссудативной эритемы
Основные задачи лечения:
- уменьшить тяжесть общих проявлений и количество высыпаний во время обострений;
- сократить длительность рецидивов;
- предотвратить осложнения;
- в межрецидивный период повысить сопротивляемость организма, сократить частоту рецидивов.
При любой форме МЭЭ используют десенсибилизирующую терапию и антигистаминные (противоаллергические) препараты.
При поражении слизистых оболочек рта и половых органов назначаются орошения и полоскания составами, успокаивающими воспаление и подавляющими инфекцию — "Ротокан", настой ромашки и т. п.
Ускорить очищение эрозий от налётов и некротических тканей помогают местные ферментные препараты. Также применяются кератопластические средства и препараты, способствующие регенерации и ускорению эпителизации повреждений.
Показаниями для госпитализации может послужить тяжёлое течение заболевания, а также неэффективность амбулаторного лечения. В нетяжёлых случаях вполне допустимо лечение в домашних условиях, без особых ограничений.
Изоляции больного не требуется, так как он не представляет опасности для здоровья окружающих. Пациенту рекомендуется гипоаллергенная диета, химически и термически щадящая, гомогенная пища (особенно при высыпаниях на слизистой рта), пить достаточное количество воды.
Лечение герпес-ассоциированной МЭЭ
Тактика лечения при герпес-ассоциированной МЭЭ зависит от степени выраженности тех или иных симптомов, стадии развития процесса, частоты и тяжести обострений [3] [4] . Например, если рецидивы возникают часто, высыпания обильны и им характерны некротические изменения, то нередко применяются глюкокортикоиды [14] .
Когда в возникновении заболевания очевидна роль герпесвируса, показан приём синтетических ациклических нуклеозидов — ацикловир, валацикловир [14] , фамцикловир.
В случае торпидного (вялого) течения герпес-ассоциированной МЭЭ рекомендовано профилактическое, противорецидивное и превентивное (предупреждающее) лечение. Для этого длительными курсами применяют препараты, содержащие ацикловир.
Применение антибиотиков в лечении герпес-ассоциированной МЭЭ оправдано лишь при наличии признаков вторичной бактериальной инфекции — нарастание интоксикации и появление гнойного отделяемого.
Чтобы предупредить присоединение вторичной инфекции, эрозированные участки и пузыри обрабатывают растворами антисептиков, например, фукорцином, фурацилином или хлоргексидином.
Прогноз. Профилактика
В большинстве случаев МЭЭ прогноз для жизни и здоровья благоприятный, за исключением редких особо тяжёлых форм болезни у людей с пониженной резистентностью организма.
Рубцы при заживлении повреждений не образуются, за редким исключением. Иногда на месте бывших элементов сыпи изменяется окрас кожи.
Рецидивировать МЭЭ может приблизительно в 30 % случаев. Особое внимание следует уделять тяжёлым поражениям слизистой оболочки и бактериальной суперинфекции [15] .
В качестве первичной профилактики рекомендуется минимизировать риск заражения герпетической инфекцией:
- соблюдать нормы личной гигиены;
- избегать случайных половых связей;
- практиковать защищённый секс.
Чтобы сохранить сопротивляемость организма инфекциям в норме, нужно рационально питаться, соблюдать оптимальный режим труда и отдыха, полноценно спать, регулярно закаляться, отказаться от вредных пристрастий.
Меры неспецифической вторичной профилактики формируются с учётом возможных триггерных факторов. Целесообразно обратить внимание на следующие моменты:
- регулярное прохождение профилактических осмотров и своевременная санация (очищение) хронических очагов инфекции, при ассоциации с герпесвирусной инфекцией — противовирусная терапия;
- защита от избыточного облучения солнечным светом и ультрафиолетового облучения;
- уменьшение вероятности переохлаждения;
- исключение стрессовых воздействий и т. п.
Для предупреждения рецидивов герпес-ассоциированной МЭЭ применяется герпетическая поливакцина, которая вводится по особой схеме. Её эффективность достигает более 70 %: она в 2-4 раза уменьшает частоту рецидивов.
Сокращению числа рецидивов также способствует длительный превентивный приём синтетических ациклических нуклеозидов, препаратов интерферона [6] , его индукторов и целого ряда неспецифических иммуномодуляторов [9] .
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Рожа: причины появления, симптомы, диагностика и способы лечения.
Определение
Рожа – это инфекционное заболевание, возбудителем которого чаще всего становится β-гемолитический стрептококк группы А. Болезнь протекает с выраженными симптомами интоксикации и очаговым поражением кожи.
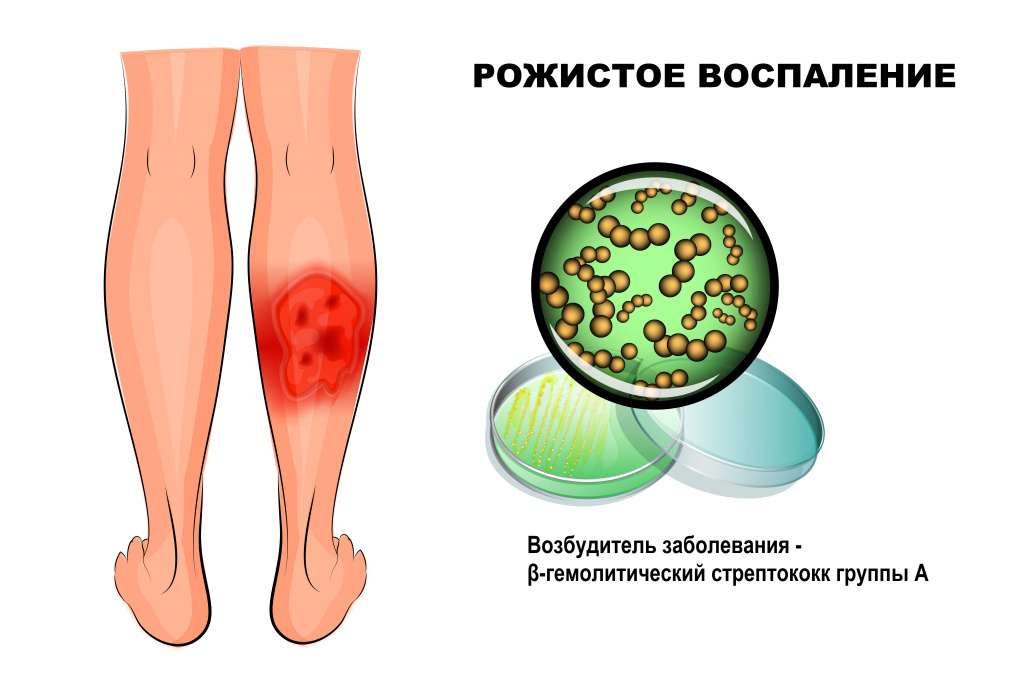
Причины появления рожистого воспаления
Стрептококк группы А (Streptococcus pyogenes) широко распространен в окружающем мире, может являться возбудителем инфекций мягких тканей (импетиго, рожи), верхних дыхательных путей (фарингита, тонзиллита), инфекционных заболеваний (скарлатины), ревматической болезни сердца, постстрептококкового гломерулонефрита и др.
Занос возбудителя на кожу происходит через руки из первичного источника инфекции (например, из носоглотки) при наличии любых (даже минимальных) нарушениях целостности кожного покрова. Инкубационный период составляет от 2 до 7 дней.
Из очагов стрептококковой инфекции процесс может распространяться лимфогенно (по лимфатическим путям) или гематогенно (с током крови). Наличие в крови бактерий и их токсинов приводит к интоксикации (повышению температуры тела, ознобу, слабости и др.).
Предрасполагающими факторами развития рожи могут быть:
- сопутствующие заболевания (микозы стоп, сахарный диабет, ожирение, хроническая венозная недостаточность при варикозной болезни вен, хроническая недостаточность лимфатических сосудов (лимфостаз), экзема и др.);
- наличие очагов хронической стрептококковой инфекции (тонзиллита, отита, синусита, кариеса, пародонтоза, остеомиелита, тромбофлебита, трофических язв);
- профессиональные вредности, связанные с повышенной травматизацией, загрязнением кожных покровов, ношением резиновой обуви и др.;
- хронические соматические заболевания со снижением иммунитета;
- пожилой возраст.
Классификация заболевания
По кратности течения выделяют следующие виды рожистого воспаления:
- первичное;
- повторное (через два года и более после первого случая заболевания или в более ранние сроки, но при иной локализации процесса);
- рецидивирующее (рецидивы возникают в период от нескольких дней до 2 лет при одной и той же локализации процесса).
- эритематозная рожа;
- эритематозно-буллезная рожа;
- эритематозно-геморрагическая рожа;
- буллезно-геморрагическая рожа.
- рожистое воспаление на лице;
- на волосистой части головы;
- на верхних конечностях;
- на нижних конечностях;
- на туловище;
- на половых органах.
- легкая рожа;
- средней тяжести рожа;
- тяжелая рожа.
- локализованное рожистое воспаление - местный процесс захватывает одну анатомическую область (например, голень или лицо);
- распространенное (мигрирующее) рожистое воспаление - местный процесс захватывает несколько смежных анатомических областей;
- метастатическое рожистое воспаление с возникновением отдаленных друг от друга очагов (например, голень и лицо и т.д.).
На участках кожи, где впоследствии возникают локальные поражения, некоторые пациенты ощущают расстройство чувствительности, распирание, жжение, болезненность.
Увеличиваются и становятся болезненными регионарные лимфатические узлы. Затем на коже появляется небольшое красное или розовое пятно, которое превращается в эритему – четко отграниченный участок покрасневшей кожи с неровными границами в виде зубцов, языков. Кожа в области эритемы уплотнена, напряжена, горячая на ощупь, умеренно болезненная при пальпации, напоминает кожуру апельсина.
При эритематозно-буллезной и буллезно-геморрагической форме воспаления происходит отслойка эпидермиса с образованием пузырей. При буллезно-геморрагической роже пузыри (буллы) разных размеров заполнены геморрагическим (кровянистым) или фиброзно-геморрагическим содержимым, имеются обширные кровоизлияния в кожу.
Для эритематозно-геморрагической формы рожи характерны кровоизлияния различных размеров (от небольших до обширных сливных) в кожу на фоне рожистой эритемы.
По выраженности симптомов интоксикации, распространенности и характеру местного процесса определяют тяжесть течения рожи.
Легкая форма рожистого воспаления протекает с субфебрильной температурой тела (не выше 38°С), слабо выраженными симптомами интоксикации. Температура держится 1-2 дня. Чаще всего наблюдается эритематозный характер поражения кожи.
Для тяжелого течения характерно повышение температура тела до 40°С и выше более 4 дней, выраженные симптомы интоксикации, сходные с симптомами менингита (сильная головная боль, рвота, иногда бред, спутанность сознания, судороги). Местный процесс – выраженный и распространенный, часто с наличием обширных булл и геморрагий.
При своевременно начатом лечении и неосложненном течении заболевания продолжительность лихорадки составляет не более 5 суток.
Лихорадка, длительность которой превышает 7 суток, свидетельствует о генерализации процесса и неэффективности терапии.
Выздоровление начинается с нормализации температуры и исчезновения симптомов интоксикации. Острые местные проявления рожи сохраняются при эритематозной форме до 5-8 суток, а при геморрагических - до 12-18 суток и более.
До нескольких недель и даже месяцев после выздоровления могут сохраняться застойная гиперемия, пастозность и пигментация кожи в местах поражения рожей, плотные сухие корки на месте булл, отечный синдром.
Диагностика рожистого воспаления
Рожа подозревается при наличии у пациента следующих проявлений:
- острого начала заболевания с повышением температуры тела;
- выраженной интоксикации;
- локального чувства жжения и распирания в пораженной области;
- характерного поражения кожи (эритемы с четкими границами, краевым валиком и отеком);
- регионального лимфаденита.
-
Клинический анализ крови с определением концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоформула и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов).
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

