Туберкулез и рак шейки матки
Обновлено: 12.05.2024
В начале 90-х годов рак шейки матки был ведущей причиной смертности женщин от злокачественных новообразований. Начиная с 1950-1960 гг., широкое распространение получило цитологическое исследование эпителия шейки матки по Папаниколау в качестве скринингового теста, что привело к значительному уменьшению заболеваемости раком шейки матки в развитых странах мира.
Большинство случаев заболевания сегодня обнаруживают на премалигнизирующих (преинвазивных) или нелетальных стадиях. Доказано, что ежегодное цитологическое исследование эпителия шейки матки по Папаниколау позволяет снизить риск смерти от рака шейки матки на 90%.
Но, несмотря на уменьшение заболеваемости и смертности, рак шейки матки продолжает занимать одно из первых мест среди причин смертности женщин от рака, особенно в развивающихся странах. Ежегодно во всем мире выявляется свыше 500 тысяч новых случаев рака шейки матки, и каждая вторая пациентка с этим заболеванием умирает.
Цервикальная интраэпителиальная неоплазия
Патогенез. Рак шейки матки и премалигнизирующая дисплазия шейки матки коррелируют с сексуальной активностью женщин. Частота этих заболеваний возрастает при раннем начале половой жизни, при значительном количестве половых партнеров, избежании барьерных методов контрацепции и наличии в анамнезе ЗППП. Факторы риска дисплазии и рака шейки матки включают также курение и инфицирования вирусом иммунодефицита человека.
Сегодня единственным доказанным фактором риска рака шейки матки является инфицирование вирусом папилломы человека (ВПЧ). ДНК вируса папилломы человека проявляется в пораженных клетках в 90% случаев. Кроме того, половые партнеры женщин с раком шейки матки в большинстве случаев также имеют субклиническую ВПЧ-инфекцию. Хотя серотипы ВПЧ 6 и 11 считают причастными к развитию кондилом, серотипы 16, 18, 31 и 45 считаются высокоонкогенными, и их идентификация коррелирует с увеличением риска рака шейки матки.
Онкопротеины ВПЧ Е6 и Е7 являются основными трансформириющими генами ВПЧ-индуцированного онкогенеза. Тестирование на ВПЧ при аномальных данных цитологического исследования является важным для оптимизации лечения больных с преинвазивными заболеваниями шейки матки. В случае сопутствующей ВПЧ-инфекции цервикальная интраэпителиальная неоплазия (СИМ) имеет больший риск прогрессии в инвазивный рак шейки матки при отсутствии лечения.
Эпидемиология. Ежегодно в США, например, диагностируется 15000 случаев рака шейки матки и 4600 женщин с этим заболеванием умирают.
Скрининг и диагностика. Скрининг преинвазивным заболеваний и рака шейки матки заключается в исследовании клеток эпителия шейки матки в области наружного зева в зоне трансформации шейки матки с помощью плоского шпателя. Учитывая, что плоскоклеточно-цилиндрическое соединение может быть в эндоцервикальном канале, важно также принять материал с эндоцервикального канала с помощью щеточки. Взятый материал затем переносится на предметное стекло или в жидкостную среду и исследуется цитопатологом.
Современные рекомендации заключаются в ежегодном исследовании мазка шейки матки по Папаниколау во всех сексуально активных женщин или достигших 18 лет. Анализ по Папаниколау интерпретируется следующим образом:
- нормальный клеточный материал;
- инфекция;
- воспалительные изменения;
- дисплазия;
- рак;
- инвазивный рак.
Цитологическое исследование может дать предварительные данные относительно возможного рака шейки матки, но окончательный диагноз рака определяется только при биопсии.
Другая классификация включает 4 варианта плоскоклеточных аномалий:
1. Атипичные плоские клетки, атипичные плоские клетки с неопределенным значением, атипичные плоские клетки, не исключают плоскоклеточное интраэпителиальное поражение высокой степени риска.
2. Плоскоклеточное интраэпителиальное поражение низкой степени риска.
3. Плоскоклеточное интраэпителиальное поражение высокой степени риска.
4. Плоскоклеточный рак.
Клеточные изменения при А8С могут возникать вследствие воспалительной реакции в ответ на инфекцию или травму, но могут свидетельствовать и о неинвазивном неопластическом заболевании.
Кольпоскопия
Неудовлетворительная кольпоскопия чаще имеет место при воспалении или атрофии. Аномальный эпителий содержит большее количество клеток с крупными ядрами и отражает свет, поэтому имеет непрозрачный вид после аппликации уксусной кислоты. Атипичный эпителий эктоцервикса с проявлениями СОК может характеризоваться как ацетобелый эпителий, мозаика, пунктация. Лейкоплакия и атипичные кровеносные сосуды более часто имеют место при эндоцервикальных поражениях.
Фокусы инвазивного рака могут иметь вид атипичных сосудов. Распространенный рак может быть представлен в виде большого поражения с язвами, увеличенной васкуляризацией, могут проявляться и другие клеточные типы. Подозрительными по аденокарциноме могут быть ацетобелый эпителий, сосочки неправильной формы, слиты сосочки, глубокие отверстия крипт с избыточной продукцией слизи.

Лечение цервикальной интраэпителиальной неоплазии
Цервикальная интраэпителиальная неоплазия считается предшественником рака шейки матки, то есть предраковым заболеванием. При определении диагноза ведения пациенток обычно включает контрольное кольпоскопическое исследование каждые 4-6 мес. При регрессии этих состояний, через 2 года после нормализации цитологической и гистологической картины, пациентка подвергается обычному ежегодному профилактическому скрининговому обследованию.
Хирургическая эксцизия (конизация шейки матки) включает следующие методики:
- конизацию шейки матки скальпелем с удалением ее конусообразной части, с захватом стромы шейки матки и эндоцервикального канала;
- электрохирургическую петельную эксцизию;
- широкую петельную эксцизию зоны трансформации;
- СО2-лазерную конусообразную эксцизию шейки матки.
При маленьких поражениях, ограниченных экзоцервиксом, при условии исключения инвазивного заболевания, выполняются петельная эксцизия, криодеструкция или лазерная вапоризация видимых поражений без экстенсивного повреждения шейки матки. Если поражение локализуется в эндоцервикса, выполняется хирургическая эксцизия зоны трансформации и дистальной части эндоцервикального канала. Это достигается путем двух процедур:
1) при первой конизации удаляют экзоцервикс;
2) при второй небольшой конизации удаляют дистальную часть эндоцервикального канала.
Поражение, которое локализуется в эндоцервикальной канале, может также быть удалено с помощью СО2-лазера или скальпеля. Конизация шейки матки удаляет ткань шейки матки без экстенсивного повреждения стромы шейки матки, хотя в эндоцервикальном канале может образоваться рубец. Осложнения конизации шейки матки также могут включать цервикальный стеноз, истмико-цервикальную недостаточность, инфекцию или кровотечение.
Рак шейки матки
Патофизиология. Плоскоклеточный рак составляет 90% всех случаев рака шейки матки и делится на следующие основные клеточные типы:
- крупноклеточный ороговевающий;
- крупноклеточный неороговевающий;
- мелкоклеточный.
Аденокарцинома составляет оставшиеся 10% случаев рака шейки матки. Светлоклеточный рак шейки матки — разновидность аденокарциномы — ассоциируется с экспозицией диэтилстильбэстрола (ДЭС). Редкими вариантами неопластических процессов шейки матки является саркома и лимфома.
Пути распространения. Рак шейки матки имеет три пути распространения:
1) прямая инвазия в строму шейки матки, тело матки, влагалище и параметрии;
2) лимфогенное распространение и метастазы;
3) гематогенная диссеминация.
Симптомы рака шейки матки
При исследовании шейки матки в зеркалах оказывается экзофитная опухоль, которая выпячивается во влагалище и легко кровоточит. При бимануальном исследовании пальпируется опухоль шейки матки, инвазивное поражение верхней части влагалища, часто имеет место инфильтрация параметральной клетчатки, распространение опухоли на дугласовое пространство и стенку таза.
Диагностика. При аномальных данных цитологического исследования (Папаниколау) выполняют биопсию шейки матки под контролем кольпоскопии. При визуальном поражении шейки матки выполняют биопсию видимой опухоли, ультрасонографию или компьютерную томографию для оценки распространенности заболевания и наличия метастазов в лимфоузлы.
Клиническое стадирование. Рак шейки матки является одним из типов гинекологического рака, который имеет клиническое стадирование. Такая система классификации основана на том факте, что рак шейки матки является основной причиной смерти женщин от рака в развивающихся странах. Клиническое стадирование рака шейки матки базируется на определении количества структур, в которые произошла инвазия и метастатических поражений.
Дополнительными методами диагностики, помогающими определению распространения болезни, является ультрасонография, рентгенография органов грудной клетки, экскреторная урография (внутривенная пиелография), цистоскопия, проктоскопия и колоноскопия, магнитно-резонансная томография и компьютерная томография.
Стадия І рака шейки матки ограничена шейкой. Стадия II распространяется за пределы шейки, но не на стенку таза и не на нижнюю 1/3 влагалища. Распространение за пределы таза, инвазия смежных структур (мочевого пузыря, прямой кишки) или отдаленные метастазы свидетельствуют о четвертой стадии заболевания.
Лечение рака шейки матки
Преинвазивный и микроинвазивный рак шейки матки. В случае преинвазивного рака (стадия 0) или микроинвазивного рака (стадия 1а-1) стандартом лечения является простая гистерэктомия. Оофоректомия при раке шейки матки не является обязательной. Конусообразная биопсия (конизация) шейки матки может быть выполнена только у пациенток, желающих сохранения фертильности (за исключением случаев аденокарциномы шейки матки).
Ранний рак шейки матки. При ранних стадиях рака шейки матки (стадия 1а2-2а) лечение заключается в радикальной гистерэктомии (с двусторонней тазовой лимфаденэктомией) или лучевой терапии, способствует низкой частоте рецидивов и выживанию больных, как в случае преинвазивного или микроинвазивного рака.
Радикальная гистерэктомия включает удаление первичного рака и проксимальной части лимфатического дренажа шейки матки. Для достижения этой цели удаленный препарат должен содержать параметрии с обеих сторон, верхний купол влагалища, крестцово-маточные и кардинальные связки и локальный сосудистый комплекс. Оофоректомия не является обязательной. Препарат удаленных лимфоузлов должен включать запирательного, внешние и внутренние (гипогастральные) и мочеточниковый лимфоузлы. Осложнения радикальной гистерэктомии чаще включают дисфункцию мочевого пузыря вследствие нарушения чувствительности сенсорных и моторных нервов детрузора.
Современные позиции по лечению рака шейки матки основаны на том положении, что первичное хирургическое лечение проводится только в тех случаях, когда опухоль может быть полностью удалена (то есть до стадии 2а), а также при центральных рецидивах заболевания. Выживаемость больных после хирургического лечения является эквивалентным таком после химиолучевой терапии. Выбор метода лечения зависит также от возраста больных, принятия ими хирургического или лучевого лечения.
Преимущества хирургического лечения рака шейки матки включают:
1) презервацию яичников;
2) возможность более оптимальной сексуальной функции;
3) уменьшение случаев цистита и энтерита.
Но если интраоперационные данные свидетельствуют о том, что поражение не может быть удалено в пределах здоровых тканей, большинство специалистов рекомендуют отказаться от хирургии в пользу лучевой терапии.
Молодым пациенткам обычно выполняют хирургическое лечение для поддержания функции яичников, которая может быть уменьшена или исключена после лучевой терапии. Во многих современных клиниках проводится лапароскопическое лечение рака шейки матки, в том числе лапароскопическая тазовая и парааортальная лимфаденэктомия.
Лучевая терапия является показанной в следующих случаях:
1) опухоль ограничена тазом, обычно в стадиях Іб-III;
2) локальное распространение болезни на стенки таза и лимфатические узлы;
3) при ранних стадиях рака шейки матки у пациенток, которым не может быть выполнено хирургическое вмешательство;
4) у пациенток старшего возраста, которые не заинтересованы в сохранении функции яичников и сексуальной функции;
5) в качестве симптоматической терапии метастатических поражений или контроль кровотечений из центральной опухоли.
Лучевая терапия при лечении рака шейки матки обычно выполняется в два этапа.
На первом этапе выполняется внешнее тазовое облучение с целью уменьшения объема опухоли и стерилизации региональных лимфоузлов. На втором этапе выполняется брахитерапия (введение катетера через шейку в полость матки и облучение непосредственно опухолевой ткани через катетер).
Осложнения лучевой терапии обычно не являются тяжелыми и включают диарею, радиационный цистит, кожную эритему. Отдаленные последствия включают бесплодие вследствие токсического воздействия на яичники, обструкцию тонкой кишки (при облучении парааортальных лимфоузлов), стриктуры толстой кишки, хронический энтерит и цистит, атрофию влагалища. Атрофию влагалища можно уменьшить путем регулярного использования дилататора.
Многочисленные исследования показывают, что выживаемость больных увеличивается при сочетании лучевой терапии с химиотерапией на основе цисплатина (химиотерапия используется как сенситизирующий агент). Введение цисплатина проводят 1 раз в неделю в течение 2-6 нед. К сожалению, плоскоклеточный рак шейки матки имеет низкую чувствительность к химиотерапии (10-25% случаев).
Распространенный рак шейки матки. При более распространенных стадиях рака шейки матки, распространении опухоли на параметрии. Лечение заключается в комбинированной химиолучевой терапии. Внешнее и внутреннее (брахитерапия) облучение сочетают с химиотерапией на основе цисплатина. Целью комбинированной химиолучевой терапии является эрадикация локального поражения и предупреждение метастазами. Такой совмещенный химиолучевой вид лечения способствует значительному продлению жизни без рецидивов болезни, чем применение одной лучевой терапии.
Рецидивирующий рак шейки матки. Если рецидивирующий рак шейки матки имеет место у пациенток, получавших только хирургическое лечение, им показана лучевая терапия. Если центральные рецидивы рака шейки матки имеют место у пациенток, получавших лучевую терапию, проводят хирургическое лечение в объеме экзентерации таза, экзентерация таза заключается в удалении тазовых органов, включая все мюллеровы структуры, мочевой пузырь, дистальную часть мочеточников, прямую кишку, сигмовидной кишки, влагалище, клетчатку, связи таза и мышцы тазового дна. Выживаемость больных после экзентерации таза в течение 5 лет колеблется от 20 до 60%.
Паллиативное лечение. Паллиативная лучевая терапия с внешним и внутренним облучением может быть использована с целью контроля кровотечений или уменьшение болевого синдрома. С целью паллиативного лечения может использоваться химиотерапия с цисплатином, а также экзентерация таза в случае возникновения послелучевых фистул или кровотечений из опухоли. Пациенткам с рецидивами рака шейки матки после экзентерации таза можно рекомендовать химиотерапию, но частота смертности до 1 года превышает 90%.
Лечение аденокарциномы шейки матки обычно проводится по тем же принципам, но имеет тенденцию к манифестации в более распространенных стадиях. При аденокарциноме шейки матки консервативное лечение стадии 1а не рекомендуется. Выживаемость больных с раком шейки матки уменьшается в соответствии со стадией болезни.
Что такое рак эндометрия (рак тела матки)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ильина Антона Алексеевича, онколога-гинеколога со стажем в 13 лет.
Над статьей доктора Ильина Антона Алексеевича работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Рак эндометрия (endometrial cancer) — это злокачественная опухоль, которая развивается из клеток внутреннего слоя матки. Основным симптомом, который появляется уже на начальной стадии болезни, являются кровянистые выделения из половых путей.
Рак эндометрия ещё называют раком тела матки и аденокарциномой эндометрия.
Распространённость
Рак эндометрия — это самая частая злокачественная опухоль женских половых органов. Но если болезнь выявлена своевременно и проведено адекватное лечение, большинство пациенток выздоравливает [1] .
В основном раком эндометрия заболевают женщины в постменопаузе: более 90 % случаев диагностируются после 50 лет. Чаще всего болезнь встречается среди пациенток в возрасте 65–69 лет — заболеваемость среди них составляет 98,1 на 100 тыс. женщин. Средний возраст на момент начала болезни — 63 года. До 49 лет рак эндометрия встречается относительно редко: в 4–5 % от всех случаев [11] .
Факторы риска
Около 5 % случаев рака эндометрия имеют наследственный характер. Злокачественная опухоль эндометрия может развиться при наследственном неполипозном колоректальном раке (синдроме Линча) [12] . Болезнь возникает из-за поломки генов MLH1, MSH2, MSH6 или PMS2. При таких мутациях риск развития рака эндометрия и колоректального рака составляет 24–51 %, рака яичников — 11–15 % [13] .
Помимо генетической предрасположенности, на заболеваемость влияют следующие факторы:
- лишний вес (риск развития рака эндометрия повышается в 1,32 раза); (в 2,54 раза); (в 2,1 раза);
- раннее начало и позднее прекращение менструаций: до 10–12 и после 55 лет (в 2,1 раза); (в 2,9 раза);
- приём Тамоксифена — гормонального препарата для лечения рака молочной железы (в 2,5 раза);
- монотерапия эстрогенами более пяти лет (в 10–30 раз); ;
- лучевая терапия на органы малого таза.
Ожирение является одним из основных факторов риска. Жировая ткань преобразует в эстрогены другие гормоны — андрогены. Если уровень эстрогенов значительно повышен, то риск развития опухолей эндометрия также увеличивается. Получается, чем больше жировой ткани, тем выше вероятность заболеть раком эндометрия.
Тамоксифен — это препарат, который используется при лечении рака груди. В ткани молочной железы он действует как антиэстроген, но в матке механизм действия иной, аналогичный гормону эстрогену. При лечении Тамоксифеном рекомендуется ежегодно наблюдаться у гинеколога.
При синдроме поликистозных яичников значительно повышается уровень андрогенов и эстрогена, а также снижается уровень прогестерона. Изменение соотношения эстрогена и прогестерона является одной из основных причин развития рака эндометрия.
Предшествующая лучевая терапия. Радиация используется для лечения некоторых типов опухолей. При облучении сложно, а иногда невозможно не затронуть смежные органы. Радиация повреждает ДНК здоровых тканей и может приводить к развитию рака в прежде здоровых органах.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы рака эндометрия
Эффективных программ скрининга рака эндометрия пока не существует. Единственный способ обнаружить заболевание на ранней стадии — это ежегодно посещать гинеколога. Также к доктору нужно обратиться, если болит низ живота или появились кровянистые выделения из половых путей между менструациями или в постменопаузе. Кровянистые выделения при раке эндометрия встречаются у 90 % пациенток. Чаще всего выделения слабые или умеренные, их характер зависит от распространения опухоли.
Признаком злокачественной опухоли также может быть изменение характера выделений, даже без примеси крови [2] . Боль, потеря веса и тяжесть в животе появляются уже на поздних стадиях болезни.
Патогенез рака эндометрия
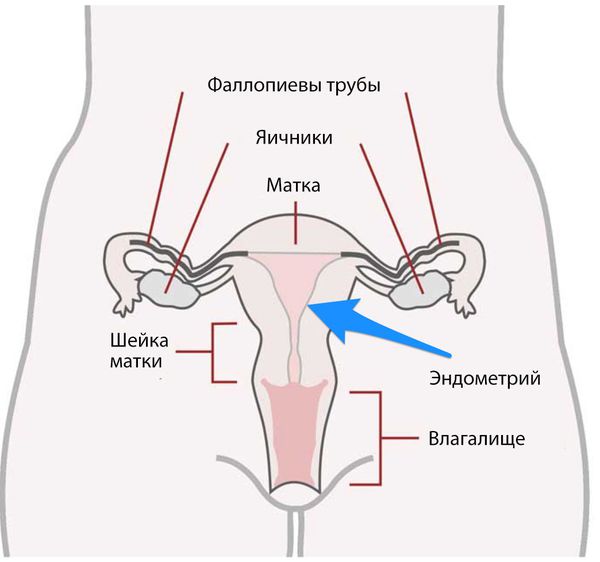
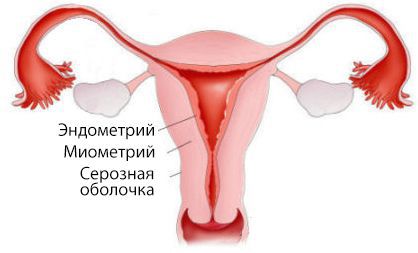
Матка состоит из двух частей: тела и шейки. В теле матки выделяют три слоя:
- наружный — серозная оболочка;
- средний — миометрий, или мышечный слой;
- внутренний — эндометрий, который частично отторгается вместе с кровью при каждой менструации.
Аденокарцинома развивается непосредственно из эндометрия.
В 1963 году была предложена и обоснована теория о двух основных типах аденокарциномы матки. Первый вариант наблюдается у 60–70 % пациенток и протекает с нарушениями углеводного и жирового обмена на фоне избыточного количества эстрогенов [14] [15] . Женщины с этим типом рака страдают маточными кровотечениями, бесплодием, ожирением и сахарным диабетом. У них поздно наступает менопауза и развиваются гиперпластические процессы в эндометрии (качественно-количественное изменение его клеток).
Второй патогенетический вариант болезни встречается у 30–40 % пациенток. У них описанные выше нарушения выражены слабо или отсутствуют [14] [15] . Изменения в эндометрии носят атрофичный характер, развиваются полипы, атипическая гиперплазия и рак.
Отнести заболевание к первому типу можно в следующих случаях:
- присутствует более половины перечисленных признаков;
- симптомы гиперэстрогении (болезненные менструации и маточные кровотечения вне их) сочетаются с обменными нарушениями, например с ожирением и сахарным диабетом.
Согласно другому разделению, к первому типу рака эндометрия относят эндометриоидный рак, ко второму — неэндометриоидный (серозный или светлоклеточный). Они встречаются в 80–90 % и 10–20 % случаев соответственно [3] . Такое разделение связано с различиями в молекулярном профиле опухолей, методах лечения и прогнозе.
Чаще всего раковые опухоли образуются из-за повреждения гена-супрессора PTEN, который подавляет развитие и рост раковых клеток. Данная аномалия встречается у 83 % пациенток с раком эндометрия [4] .
Болезнь также может развиваться при поломке в системе репарации (т. е. исправления) ошибок спаривания нуклеотидов. Эта система отвечает за важный этап нормального деления здоровых клеток. Рак эндометрия первого типа, как правило, связан с мутациями в генах KRAS и CTNNB. Второй тип часто протекает на фоне хромосомной нестабильности, генетических расстройств и мутации в гене р53.
Классификация и стадии развития рака эндометрия
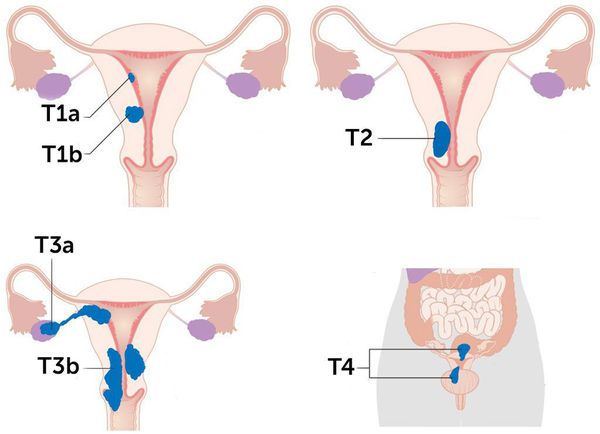
В онкологии существуют две системы TNM, т. е. стадирования рака — FIGO (International Federation of Gynecology and Obstetrics) и AJCC (American Joint Committee on Cancer). Обе системы используют следующие ключевые параметры для описания рака и установки стадии:
- размер опухоли (Tumor);
- наличие или отсутствие опухоли в лимфатических узлах (Node);
- наличие или отсутствие метастазов опухоли (Metastasis) [5] .
Исходя из этих признаков, выделяют четыре основные стадии. Чем меньше стадия, тем лучше прогноз. Рак обычно стадируется дважды. Первый раз — до лечения, такое стадирование называется клиническим. Второй раз — после операции, такое стадирование называется патологоанатомическим и считается более точным и окончательным. Со временем опухоль может расти или распространяться на органы, в которых её раньше не было, а также повторно развиваться после полного излечения. В этом случае стадия, установленная однажды, меняться не будет.
Стадии рака эндометрия по системе TNM
Более схематично стадии рака эндометрия отражены на рисунке:
Согласно международной гистологической классификации рака тела матки, выделяют несколько видов опухолей:
- Злокачественные эпителиальные опухоли. В эту группу входят различные виды рака, среди которых эндометриальная аденокарцинома, серозный и светлоклеточный рак.
- Злокачественные смешанные эпителиальные и мезенхимальные опухоли — аденосаркома и карциносаркома.
- Мезенхимальные опухоли — леймиосаркома, эпителиоидная и миксоидная леймиосаркома, эндометриальная стромальная саркома низкой и высокой степени злокачественности.
Лучший прогноз имеет эндометриоидная форма, худший — серозная и светлоклеточная, но основным прогностическим критерием является стадия заболевания. Например, выживаемость с IV стадией эндометриоидного рака ниже, чем с I стадией светлоклеточного.
Рак тела матки также классифицируется на основании вида клеток, из которых он развился. Чтобы установить разновидность рака и его дифференцировку, исследуются удалённые органы или их части. Тип опухоли устанавливает эксперт-патолог, работающий с тканями под микроскопом.
Дифференцировка — это схожесть раковой клетки со здоровой. Она отражает, насколько быстро опухоль может расти и распространяться. Описаны три степени дифференцировки: G1, G2, G3, где G3 — самая неблагоприятная с быстрым ростом опухоли. Сейчас чаще выделяют только два класса: низкой злокачественности (low grade) и высокой (high grade). Low grade включает G1 и G2, a high grade — G3.
Осложнения рака эндометрия
Без специализированного лечения рак эндометрия неизбежно прогрессирует: боль и кровотечение из половых путей усиливаются, мочевой пузырь и прямая кишка сдавливаются, их функции нарушаются. У пациенток учащается мочеиспускание и стул либо, наоборот, возникают запоры.
Если опухоль проросла в мочевой пузырь и кишку, в моче и кале может появиться кровь. Очаги опухоли могут также образоваться в других органах и тканях: печени, лёгких и брюшной полости. При метастазах в лёгких появляется кашель, боль в грудной клетке и одышка; метастазы в печени проявляются болью в правом подреберье [6] .
Диагностика рака эндометрия
В отличие от рака шейки матки для рака эндометрия не существует программ скрининга. Диагноз устанавливается после комплексного обследования, которое включает:
- осмотр на гинекологическом кресле;
- подтверждение наличия опухолевых клеток;
- магнитно-резонансную томографию (МРТ) с контрастированием;
- ультразвуковое исследование (УЗИ);
- компьютерную томографию (КТ).
Осмотр на гинекологическом кресле позволяет оценить, где расположена и насколько распространилась опухоль, а также выявить, поражены ли смежные органы малого таза.
Подтверждение наличия опухолевых клеток, или верификация, — это необходимый компонент обследования. Получить клетки можно двумя способами:
- Пайпель-биопсия — процедура, при которой эндометрий забирается из полости матки с помощью тонкого зонда. Не требует общего наркоза и специальных условий.
- Гистерорезектоскопия — операция, при которой перед забором эндометрия врач может осмотреть полость матки. Гистероскопия предпочтительна при безоперационном лечении, проводится под наркозом и редко занимает более 15 минут. Точность гистероскопии выше, чем пайпель-биопсии, и составляет около 72 % [7] .
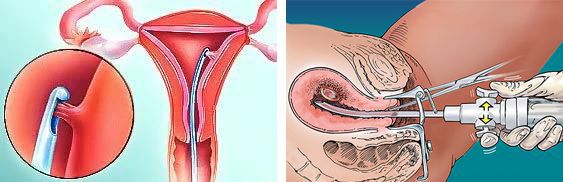
Ультразвуковое исследование может быть выполнено через брюшную стенку и интравагинально, т. е. через влагалище. Интравагинальное УЗИ позволяет лучше оценить состояние эндометрия, аномальное утолщение которого может косвенно указывать на онкологическое заболевание. Данная процедура является относительно простой и не требует специальной подготовки, поэтому часто назначается пациенткам на первом этапе диагностики. Правильно интерпретировать результаты УЗИ может только врач-онкогинеколог.
Магнитно-резонансная томография с контрастированием является более точным методом диагностики по сравнению с УЗИ. МРТ назначается при планировании лечения и позволяет определиться с объёмом операции.
Компьютерную томографию (КТ) с контрастированием применяют, чтобы определить, есть ли метастазы в органах грудной клетки и брюшной полости.
Специфических онкомаркеров для диагностики рака эндометрия не существует. Один из немногих маркеров с относительной чувствительностью — Са-125, но такой анализ не входит в стандартное обследование. Этот онкомаркер выявляется при лимфоме, раке яичников, поджелудочной и молочной железы. Также его уровень может повышаться при беременности, различных воспалительных заболеваниях или доброкачественных образованиях, например кистах яичников и миоме матки.
Лечение рака эндометрия
Основной метод лечения рака эндометрия — это операция, при которой удаляются тело и шейка матки с придатками.
Операция может проводиться через три вида доступа:
- лапаротомный (разрез передней брюшной стенки);
- лапароскопический (через проколы 5–10 мм);
- влагалищный.
Чаще всего применяется лапароскопия, так как после неё пациентки быстрее всего восстанавливаются.
Необходимость лимфодиссекции (удаления лимфатических узлов) зависит от наличия факторов риска метастазирования опухоли, результатов морфологического заключения и данных инструментальной диагностики. При удалении лимфатических узлов важно оценить, есть ли в них опухолевые клетки, что имеет решающее значение при планировании лечения после операции.
Чем больше объём операции, тем выше риски послеоперационных осложнений. При удалении лимфоузлов примерно в половине случаев образуются лимфокисты — отграниченные скопления лимфатической жидкости в малом тазу [8] . Чтобы минимизировать риски их развития и избежать лимфодиссекции, в некоторых клиниках используется технология определения сигнальных лимфоузлов (СЛУ). Во время процедуры в шейку матки вводится краситель, который по лимфатическим сосудам попадает в лимфоузлы. Затем хирург находит лимфоузлы, в которых накопился краситель, и удаляет узел, расположенный ближе всего к матке. Далее, непосредственно во время операции, проводится гистологическое исследование, позволяющее подтвердить или исключить наличие метастазов в СЛУ и избежать их полного удаления.
Если женщина планирует беременность, то в некоторых случаях допустимо безоперационное лечение. Оно возможно при эндометриоидном типе рака, стадии IA и высокой дифференцировке. Лечение проводится гормональными препаратами, которые блокируют работу яичников и оказывают терапевтический эффект на опухоль. Применяются два основных препарата: Мегестрола ацетат и Медроксипрогестерон.
Продолжительность гормонального лечения, как правило, составляет 6–12 месяцев. Затем при хорошем эффекте врач может разрешить беременность. После родов зачастую рекомендуется удалить матку, так как опухоль часто развивается повторно.
Лучевая терапия или химиотерапия на первом этапе менее эффективны, чем хирургическое лечение. Они назначаются, если нельзя провести операцию, например при тяжёлых хронических заболеваниях, распространённости опухоли и лечении рецидивов.
Чтобы предотвратить повторное появление опухоли, после операции могут проводиться дистанционное облучение малого таза и брахитерапия (контактная лучевая терапия, при которой источник излучения вводится внутрь поражённого органа).
Метод подбирается врачом в зависимости от типа и стадии рака, состояния лимфатических узлов. Например, при неэндометриоидном раке после операции назначается химиотерапия в сочетании с брахитерапией, а при эндометриальном раке I стадии может быть достаточно брахитерапии или наблюдения.
Прогноз. Профилактика
Без лечения рак эндометрия неизбежно прогрессирует и со временем приводит к гибели пациентки.
При своевременном выявлении и лечении рак эндометрия имеет самые благоприятные прогнозы среди всех злокачественных опухолей женских половых органов:
- для I стадии пятилетняя выживаемость составляет 85–95 %;
- для II — 65–70 %;
- для III — 29 % [9] .
Стадия болезни является самым значимым фактором при определении прогноза, но далеко не единственным. Онкологи оценивают гистологический тип опухоли, её дифференцировку, размеры, расположение в матке, прорастание или метастазирование в другие органы и лимфатические узлы. Точный прогноз врач сможет дать только после всестороннего анализа этих параметров.
Туберкулез - инфекционное заболевание, вызываемое микобак-терией. Генитальный туберкулез, как правило, развивается вторично в результате заноса инфекции из первичного очага поражения (чаще из легких, реже из кишечника). Несмотря на прогресс медицины, заболеваемость туберкулезом в мире увеличивается, особенно в странах с низким уровнем жизни. Поражение мочеполовых органов стоит на первом месте среди внелегочных форм туберкулеза. Вероятно, поражение туберкулезом половых органов происходит значительно чаще, чем официально регистрируется, поскольку прижизненная диагностика не превышает 6,5%.
Что провоцирует / Причины Генитального туберкулеза:
Из первичного очага при снижении иммунной резистентности организма (хронические инфекции, стрессы, недостаточное питание и др.) микобактерии попадают в половые органы. Инфекция распространяется в основном гематогенным путем, чаще при первичной диссеминации в детстве или в периоде полового созревания. При туберкулезном поражении брюшины возбудитель попадает на маточные трубы лимфогенно или контактным путем. Прямое заражение при половых контактах с больным генитальным туберкулезом партнером возможно только теоретически, поскольку многослойный плоский эпителий вульвы, влагалища и влагалищной порции шейки матки устойчив к микобактериям.
В структуре генитального туберкулеза первое место занимает поражение маточных труб (90-100%), второе - эндометрий (25- 30%). Реже встречается туберкулез яичников (6-10%) и шейки матки (1-6%), совсем редко - туберкулез влагалища и наружных половых органов.
В очагах поражения развиваются типичные для туберкулеза морфогистологические изменения: экссудация и пролиферация тканевых элементов, казеозные некрозы. Туберкулез маточных труб часто заканчивается их облитерацией, экссудативно-пролиферативные процессы могут привести к образованию пиосальпинкса, а при вовлечении в специфический пролиферативный процесс мышечного слоя маточных труб в нем образуются туберкулы (бугорки), что носит название нодозного воспаления. При туберкулезном эндометрите также преобладают продуктивные изменения - туберкулезные бугорки, казеозные некрозы отдельных участков. Туберкулез придатков матки нередко сопровождается вовлечением в процесс брюшины с асцитом, петель кишечника с образованием спаек, а в некоторых случаях и фистул. Генитальный туберкулез часто сочетается с поражением мочевых путей.
Патогенез (что происходит?) во время Генитального туберкулеза:
Клинико-морфологическая классификация различает:
- • хронические формы с продуктивными изменениями и нерезко выраженными клиническими симптомами;
- • подострую форму с экссудативно-пролиферативными изменениями и значительными поражениями;
- • казеозную форму с тяжелыми и острыми процессами;
- • законченный туберкулезный процесс с инкапсулированием обызвествленных очагов.
Симптомы Генитального туберкулеза:
Первые симптомы заболевания могут появиться уже в периоде полового созревания, но в основном генитальным туберкулезом болеют женщины 20-30 лет. В редких случаях заболевание встречается у более старших пациенток и даже у женщин в постменопаузе.
Генитальный туберкулез имеет в основном стертую клиническую картину с большим разнообразием симптомов, что объясняется вариабельностью патологоанатомических изменений. Снижение генеративной функции (бесплодие) является основным, а иногда и единственным симптомом заболевания. К причинам бесплодия, чаще первичного, следует отнести эндокринные нарушения, поражения маточных труб и эндометрия. Более чем у половины пациенток нарушается менструальная функция: аменорея (первичная и вторичная), олигоменорея, нерегулярные менструации, альгоменорея, реже мено- и метроррагии. Нарушения менструальной функции связаны с поражением паренхимы яичника, эндометрия, а также с туберкулезной интоксикацией. Хроническое заболевание с преобладанием экссудации обусловливает субфебрильную температуру и тянущие, ноющие боли внизу живота из-за спаечного процесса в матом тазу, поражения нервных окончаний, склероза сосудов и гипоксии тканей внутренних половых органов. К другим проявлениям болезни относятся признаки туберкулезной интоксикации (слабость, периодическая лихорадка, ночные поты, снижение аппетита, похудание), связанные с развитием экссудативных или казеозных изменений во внутренних гениталиях.
Диагностика Генитального туберкулеза:
Ввиду отсутствия патогномоничных симптомов и стертости клинической симптоматики диагностика генитального туберкулеза затруднена. На мысль о туберкулезной этиологии заболевания может навести правильно и тщательно собранный анамнез с указаниями на контакт пациентки с туберкулезным больным, перенесенные в прошлом пневмонии, плеврит, бронхоаденит, наблюдение в противотуберкулезном диспансере, экстрагенитальные очаги туберкулеза в организме. Большую помощь могут оказать данные анамнеза заболевания: возникновение воспалительного процесса в придатках матки у молодых пациенток, не живших половой жизнью, особенно в сочетании с аменореей и длительный субфебрилитет. При гинекологическом исследовании иногда выявляют острое, подострое или хроническое воспалительное поражение придатков матки, наиболее выраженное при преобладании пролиферативных или казеозных процессов, признаки спаечного процесса в малом тазу со смещением матки. Однако данные гинекологического исследования обычно неспецифичны.
Для уточнения диагноза используют туберкулиновые пробы. Подкожно вводят 20 или 50 ТЕ туберкулина, после чего оценивают общую и очаговую реакции. Общая реакция проявляется повышением температуры тела (более чем на 0,5 °С), в том числе и в области шейки матки (цервикальная электротермометрия), учащением пульса (более 100 в минуту), увеличением числа палочкоядерных нейтрофилов, моноцитов, изменением числа лимфоцитов, повышением СОЭ. Для оценки общей реакции определяют уровни гаптоглобина, малонового диальдегида в крови, для выявления функционального состояния нейтрофильных лейкоцитов проводят НСТ-тест (с нитрасиним тетразолием), что повышает диагностическую ценность туберкулиновой пробы. Общая реакция возникает независимо от локализации туберкулезного поражения, очаговая - в его зоне. Очаговая реакция выражается появлением или усилением болей внизу живота, отечности и болезненности при пальпации придатков матки. Туберкулиновые пробы противопоказаны при активном туберкулезном процессе, сахарном диабете, выраженных нарушениях функции печени и почек.
Наиболее точными методами диагностики генитального туберкулеза остаются микробиологические методы, позволяющие обнаружить микобактерию в тканях. Исследуют выделения из половых путей, менструальную кровь, соскобы эндометрия или смывы из полости матки, содержимое воспалительных очагов и т.д. Посев материала производят на специальные искусственные питательные среды не менее 3 раз. Однако высеваемость микобактерий невелика, что объясняется особенностями туберкулезного процесса. Высокочувствительным и специфичным методом выявления возбудителя является полимеразная цепная реакция (ПЦР), позволяющая определить участки ДНК, свойственные микобактерий туберкулеза. Однако материал для исследования может содержать ингибиторы ПЦР, что приводит к ложноотрицательиым результатам.
Лапароскопия позволяет выявить специфические изменения органов малого таза - спаечный процесс, туберкулезные бугорки на висцеральной брюшине, покрывающей матку и трубы, казеозные очаги в сочетании с воспалительными изменениями придатков. Кроме того, при лапароскопии можно взять материал для бактериологического и гистологического исследования, а также при необходимости провести хирургическую коррекцию: лизис спаек, восстановление проходимости маточных труб и др.
Гистологическое исследование тканей, полученных при биопсии, раздельном диагностическом выскабливании (лучше проводить за 2-3 дня до менструации), выявляет признаки туберкулезного поражения - периваскулярные инфильтраты, туберкулезные бугорки с признаками фиброза или казеозного распада. Применяют также и цитологический метод исследования аспирата из полости матки, мазков с шейки матки, который обнаруживает специфические для туберкулеза гигантские клетки Лангханса.
Диагностике генитального туберкулеза помогает гистеросальпин-гография. На рентгенограммах выявляются характерные для туберкулезного поражения половых органов признаки: смещение тела матки из-за спаечного процесса, внутриматочные синехии, облитерация полости матки, неровность контуров труб с закрытыми фимбриальными отделами, расширение дистальных отделов труб в виде луковицы, четкообразное изменение труб, кистозные расширения или дивертикулы, ригидность труб (отсутствие перистальтики), кальцинаты. На обзорных рентгенограммах органов малого таза выявляются патологические тени - кальцинаты в трубах, яичниках, лимфатических узлах, очаги казеозного распада. Чтобы избежать обострения туберкулезного процесса, гистеросальпингографию проводят при отсутствии признаков острого и подострого воспаления (повышение температуры, болезненность при пальпации придатков матки, III-IV степень чистоты мазков из влагалища и цервикального канала).
Диагностику дополняет ультразвуковое сканирование органов малого таза. Однако интерпретация полученных данных весьма затруднена и доступна только специалисту в области генитального туберкулеза. Меньшее значение имеют другие методы диагностики - серологические, иммунологические, метод флотации. Иногда диагноз туберкулезного поражения внутренних гениталий ставят при чревосечении по поводу предполагаемых объемных образований в области придатков матки.
Лечение Генитального туберкулеза:
Лечение генитального туберкулеза, как и туберкулеза любой локализации, следует проводить в специализированных учреждениях - противотуберкулезных больницах, диспансерах, санаториях. Терапия должна быть комплексной и включать в себя противотуберкулезную химиотерапию, средства повышения защитных сил организма (отдых, полноценное питание, витамины), физиотерапию, хирургическое лечение по показаниям.
В основе лечения туберкулеза лежит химиотерапия с использованием не менее 3 препаратов. Химиотерапию подбирают индивидуально с учетом формы заболевания, переносимости препарата, возможного развития лекарственной устойчивости микобактерий туберкулеза. Неправильное лечение туберкулеза приносит больше вреда, чем пользы, поскольку оно переводит легко излечимые формы болезни в трудно излечимый лекарственно-устойчивый туберкулез. К средствам первого (основного) ряда, рекомендованным ВОЗ для включения в стандартные схемы (directly observed therapy - DOT), относят рифампицин (450-600 мг/сут), стрептомицин (0,5-1 г/сут), изониазид (300 мг/сут), пиразинамид (1,5-2 г/сут), этамбутол (15- 30 мг/кг в сутки). Препараты второго ряда (резервные) назначают при устойчивости возбудителя к лекарствам первого ряда. Это аминогликозиды - канамицин (1000 мг/сут), амикацин (10-15 мг/кг в сутки), фторхинолоны - ломефлоксацин (400 мг 2 раза в сутки), офлоксацин (200-400 мг 2 раза в сутки). Возродился интерес к хорошо известным, но вытесненным из клинической практики средствам - парааминосалициловой кислоте (ПАСК) (4000 мг 3 раза в сутки), циклосерину (250 мг 2-3 раза в сутки), этионамиду (500-750 мг/кг в сутки), протионамиду (500-750 мг/кг в сутки). Программа лечения больных генитальным туберкулезом предусматривает длительный (от 6 до 24 мес) прием нескольких (от 3 до 8) противотуберкулезных препаратов.
В комплекс лечения целесообразно включать антиоксиданты (токоферола ацетат, тиосульфат натрия), иммуномодуляторы (ронко-лейкин, метилурацил, левамизол), специфический препарат туберкулин, витамины группы В, аскорбиновую кислоту.
Хирургическое лечение применяется только по строгим показаниям (тубоовариальные воспалительные образования, неэффективность консервативной терапии при активном туберкулезном процессе, образование свищей, нарушения функции тазовых органов, связанные с выраженными рубцовыми изменениями). Операция сама по себе не приводит к излечению, поскольку туберкулезная инфекция сохраняется. После операции следует продолжать химиотерапию.
Клинические формы болезни в некоторых ситуациях требуют симптоматического лечения (антипиретики, анальгетики и др.), коррекции нарушений менструальной функции.
Физиотерапию назначают после стихания острых явлений в виде фонофореза гидрокортизона, синусоидальных токов, амплипульс-терапии. Санаторно-курортное лечение туберкулеза в настоящее время признано малоэффективным и слишком дорогим. От него отказались в большинстве стран мира еще в середине XX века. В России этот вид реабилитационного лечения сохранился как форма социальной помощи больным. Наиболее подходящим считается климат горных, степных и южных морских курортов.
Профилактика Генитального туберкулеза:
Специфическая профилактика туберкулеза начинается уже в первые дни жизни с введения вакцины БЦЖ. Ревакцинацию проводят в 7, 12, 17 лет под контролем реакции Манту. Другой мерой специфической профилактики является изоляция больных активным туберкулезом. Неспецифическая профилактика подразумевает проведение общеоздоровительных мероприятий, повышение резистентности организма, улучшение условий жизни и труда.
К каким докторам следует обращаться если у Вас Генитальный туберкулез:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Генитального туберкулеза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Центральный научно-исследовательский институт туберкулеза, Москва
Центральный научно-исследовательский институт туберкулеза, Москва
Центральный научно-исследовательский институт туберкулеза, Москва
Сочетание рака шейки матки и кавернозного туберкулеза легких
Журнал: Онкология. Журнал им. П.А. Герцена. 2014;3(5): 61‑64
Каюкова С.И., Демихова О.В., Уварова Е.В., Васильева И.А., Амансахедов Р.Б., Багдасарян Т.Р. Сочетание рака шейки матки и кавернозного туберкулеза легких. Онкология. Журнал им. П.А. Герцена. 2014;3(5):61‑64.
Kaiukova SI, Demikhova OV, Uvarova EV, Vasilyeva IA, Amansakhedov RB, Bagdasaryan TR. Concurrence of cancer of the cervix uteri and cavernous pulmonary tuberculosis. P.A. Herzen Journal of Oncology. 2014;3(5):61‑64. (In Russ.).
Центральный научно-исследовательский институт туберкулеза, Москва
Приведен сложный клинический случай сочетания рецидивирующего кавернозного туберкулеза легких и карциномы in situ шейки матки у пациентки молодого возраста. Изложены анамнез заболевания, развитие сопутствующих осложнений, трудности одновременного лечения туберкулезного процесса и онкологической патологии. Анализ течения заболевания позволил выявить роль персистирующей папилломавирусной инфекции в этиологии и патогенезе злокачественного процесса шейки матки у пациентки с тяжелым иммунодефицитом. Своевременная гистологическая верификация карциномы in situ, радиоволновая конизация шейки матки, а также эффективное противотуберкулезное и противовирусное лечение позволили добиться излечения и улучшить прогноз для реализации репродуктивной функции в последующем.
Центральный научно-исследовательский институт туберкулеза, Москва
Центральный научно-исследовательский институт туберкулеза, Москва
Центральный научно-исследовательский институт туберкулеза, Москва
Патологические состояния шейки матки являются самой частой и широко распространенной проблемой современной гинекологии, затрагивают большой контингент женщин молодого возраста и отражаются на их репродуктивном здоровье [2, 4]. В течение двух последних десятилетий у молодых женщин, больных туберкулезом органов дыхания, наметилась тенденция к росту заболеваемости дисплазией и раком шейки матки [1, 6]. Возникновение и прогрессирование дисплазии эпителия шейки матки у женщин, больных туберкулезом, связывают со снижением защитных сил организма, нарушениями системного и местного иммунитета, персистенцией папилломавирусной инфекции [3, 5].
Приводим клиническое наблюдение.
Пациентка Т., 1989 г. р., длительно проживала на одной жилой площади с матерью, которая болела и умерла от туберкулеза легких. В 2006 г. впервые обнаружен инфильтративный туберкулез верхней доли правого легкого в фазе распада и обсеменения. Микобактерии туберкулеза (МБТ) (+). Выявлена множественная лекарственная устойчивость (МЛУ) к противотуберкулезным препаратам: изониазид (H), рифампицин ®, стрептомицин (S). Госпитализирована в противотуберкулезный диспансер (ПТД) по месту жительства, где получала лечение в течение 6 мес. В сентябре 2007 г. произведена сегментарная резекция S I — II правого легкого. Гистологическое исследование подтвердило наличие туберкулезного процесса.
В мае 2008 г. — рецидив процесса, проведена терапия в стационаре в течение 7 мес по IIБ режиму, далее амбулаторное лечение в течение 8 мес, бактериовыделение прекратилось. В июне 2010 г. — повторный рецидив процесса, появление симптомов интоксикации, легочное кровотечение. Госпитализирована в Уральский НИИ фтизиопульмонологии, где проходила лечение в течение 12 мес с диагнозом: инфильтративный туберкулез нижней доли правого легкого. МБТ (+), без эффекта. На фоне длительного пребывания в стационаре у пациентки развилась тяжелая психологическая депрессия, предпринимались суицидальные попытки, после чего выписана в ПТД по месту жительства.
11.11.2011 поступила в ЦНИИ туберкулеза РАМН с диагнозом: фиброзно-кавернозный туберкулез (ФКТ) правого легкого в фазе инфильтрации и обсеменения. МБТ (+). При поступлении жалобы на повышение температуры тела до 38 °C, слабость, кашель с гнойной мокротой, одышку при физической нагрузке. Пациентка астенического телосложения, пониженного питания, с дефицитом массы тела (масса 41 кг, рост 157 см). По данным рентгенотомографического исследования органов дыхания (10.11.2011), в S III , VI , VIII правого легкого выявлены множественные каверны и очаги отсева средней и низкой плотности, в S I — II левого легкого — очаги средней плотности. Заключение: ФКТ правого оперированного легкого в фазе инфильтрации (рис. 1). 12.12.2011 при бронхоскопии определены фиброзная деформация со стенозированием среднедолевого бронха, рубцовый стеноз 6-го бронха справа. Бактериологическое исследование мокроты выявило рост МБТ. Обнаружена широкая лекарственная устойчивость к препаратам: изониазид (H), рифампицин ®, стрептомицин (S), этамбутол (Е), канамицин (K), протионамид (Pt), фторхинолоны (Fq). Проведено лечение: авелокс 0,4 внутривенно капельно, теризидон 0,6, капреомицин 0,75 внутримышечно, пиразинамид 1,5, ПАСК 9,0; линезолид 600,0 внутривенно капельно, амоксиклав 2,0. Коллапсотерапия — еженедельные инсуфляции воздуха в брюшную полость по 700 мл. При рентгенологическом исследовании 20.03.2012 отмечена положительная динамика в виде уменьшения размера каверн справа и уплотнения очагов (рис. 2). 29.10.2012 установлен эндобронхиальный клапан в устье нижнезонального бронха справа.

Рис. 1. На фоне уменьшенного в объеме правого гемоторакса в дорсальной части SIII, VI, VIII сегментов выявляются полигональной формы фиброзные каверны с неравномерно утолщенными стенками. Мультипланарная реформация во фронтальной плоскости.

Рис. 2. В динамическом исследовании наблюдается уменьшение размера каверны в SIII и закрытие каверны в SVI, VIII сегментах правого легкого. Мультипланарная реформация во фронтальной плоскости.
18.10.2012 обратилась за консультацией к гинекологу ЦНИИТ РАМН с жалобами на нарушение менструального цикла (задержки до 14 дней, оскуднение менструального кровотечения), периодически боль внизу живота. Диагностировано нарушение менструального цикла по типу опсоменореи, эрозия шейки матки, кольпит. Молекулярно-генетическое исследование с помощью метода ПЦР выявило кандиды и вирус папилломы человека (ВПЧ) 16-го типа. Проведен курс противовирусной и противогрибковой терапии. 20.12.2012 при расширенной кольпоскопии обнаружена зона трансформации 1-го типа. Проба с 3% уксусной кислотой обнаружила участки плотного ацетобелого эпителия с ровными контурами и подворачивающимися краями: аномальная картина II степени 1-го типа. Предварительный диагноз: CIN II—III? (рис. 3). Произведена прицельная биопсия шейки матки. Гистологическое исследование: эндоцервикоз с плоскоклеточной метаплазией и инвазией плоского эпителия в эрозионные железы, дисплазия II—III степени. 05.03.2013 пациентка консультирована в Российском научном центре рентгенорадиологии. При пересмотре гистологического материала выявлены фрагменты шейки матки из области переходной зоны, покрытые плоским эпителием с признаками тяжелой дисплазии (CINIII), соответствующей плоскоклеточному раку in situ. 04.03.2013 при УЗИ органов малого таза убедительных признаков инвазивного процесса в шейке матки нет. Рекомендовано хирургическое лечение в объеме высокой ножевой ампутации шейки матки, от которой пациентка отказалась.

Рис. 3. Кольпоскопия 20.12.2012. Зона трансформации 1-го типа. Аномальная картина II степени 1-го типа. CIN II—III?
19.03.2013 консультирована в РОНЦ им. Н.Н. Блохина. Проведено исследование генотипов ВПЧ высокого онкогенного риска: результаты теста — 642 отн. ед., в цервикальном образце детектировано присутствие генотипов высокого онкогенного риска ВПЧ 16 и 31 в клинически значимой концентрации. Диагноз: преинвазивный рак in situ шейки матки на фоне персистирующей вирусной инфекции. В июне 2013 г. произведена радиоволновая конизация шейки матки. Гистологическое исследование подтвердило диагноз.
16.09.2013 проведено удаление эндобронхиального клапана. На фоне проведенного лечения отмечена положительная клинико-рентгенологическая динамика (рис. 4). В бактериологических посевах в феврале—декабре 2013 г. и январе 2014 г. МБТ не обнаружено. 28.01.2014 проведен контрольный осмотр шейки матки, кольпоскопия, цитологическое исследование: патологии не выявлено (рис. 5). Рекомендовано наблюдение в динамике. 17.02.2014 выписана домой под наблюдение по месту жительства с диагнозом: кавернозный туберкулез правого легкого в фазе частичного рассасывания. ШЛУ (H, R, S, E, Z, Fq, Cm, K).

Рис. 4. В динамике определяется уменьшение размера каверны в SIII и отграничение, частичное рассасывание крупноочаговых уплотнений в SVI, VIII сегментах правого легкого. Мультипланарная реформация во фронтальной плоскости.

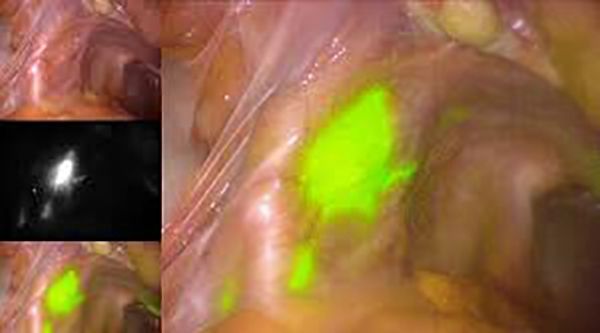
Рис. 5. Кольпоскопия через 1,5 мес после радиоволновой конизации шейки матки. Оригинальный эпителий, без патологии.
Заключение
Данное клиническое наблюдение демонстрирует сочетание рецидивирующего кавернозного туберкулеза легких и карциномы in situ шейки матки. В условиях развившегося иммунодефицита наблюдалась активная персистенция ВПЧ-инфекции (высокоонкогенных типов), что привело к озлокачествлению процесса в короткие сроки у пациентки молодого возраста. Своевременная гистологическая верификация карциномы in situ шейки матки, радиоволновая конизация шейки матки на фоне рациональной противотуберкулезной и противовирусной терапии привели к успешному излечению и улучшили прогноз для реализации репродуктивной функции в последующем.
Читайте также:

