Увеличение вилочковой железы инфекция
Обновлено: 13.05.2024
II кафедра клинической хирургии (заведующий - профессор Тимофей Павлович Макаренко) Центрального института усовершенствования врачей на базе Центральной клинической больницы № 1МПС.
Публикация посвящается памяти Василия Дмитриевича Стоногина (1933-2005)
Заболевания вилочковой железы изучаются врачами различных специальностей: невропатологами, эндокринологами, иммунологами, гемато¬логами, хирургами, патогистологами и др. Проблема миастении является относительно изученной; в последние годы установлено участие вилочковой железы в таком жизненно важном процессе, как выработка (регулировка) иммунитета.
Опухоли и кисты вилочковой железы, миастения и некоторые аутоиммунные заболевания требуют хирургического лечения. Значительный вклад в этот сложный раздел внесли отечественные и зарубежные хирурги (А. Н. Бакулев и Р. С. Колесникова; В. Р. Брайцев; Б. К. Осипов; Б. В. Петровский; М. И. Кузин и соавт.; С. А. Гаджиев и В. Васильев; Viets, и др.).
С 1966 по 1973 год мы наблюдали 105 больных с различными заболеваниями переднего средостения, из них 66 с различными заболеваниями вилочковой железы. Эти больные были разделены на следующие клинические группы: 1-я - 30 больных с гиперплазией вилочковой железы и явлениями миастении; 2-я - 23 больных с опухолями вилочковой железы (тимомами), из них с доброкачественными 15, в том числе с явлениями миастении 9; со злокачественными 8, в том числе с явлениями миастении 5; 3-я - 4 больных с кистами вилочковой железы, все без миастении; 4-я - 3 больных с тератоидными образованиями; 13-я - 2 больных - лимфогранулематоз с изолированным поражением вилочковой железы; 6-я - 4 больных с апластической анемией на фоне аутоиммунной агрессии вилочковой железы.
Из 66 больных 65 были оперированы: 62 произведена радикальная и 3 эксплоративная операция.
С явлениями миастении под нашим наблюдением было 44 больных, из которых 43 (13 мужчин и 30 женщин) оперированы; возраст оперированных был от 14 до 55 лет, причем возраст большинства (25 больных) - от 15 до 30 лет. Среди больных с опухолями вилочковой железы преобладали 30-40-летние (13 больных).
Миастения - сложное нейроэндокринное заболевание, основным проявлением которого является слабость и особенно быстрая, патологическая мышечная утомляемость после физической нагрузки. Наряду с этим, согласно исследованиям ряда авторов (М. И. Кузин и соавт., и др.), при ми¬астении нарушается функция многих органов и систем (сердечно-сосудистой, дыхательной, пищеварительной, обмена веществ и т. д.).
Клиника миастении хорошо известна, однако правильный диагноз больному с миастенией нередко ставят после продолжительного наблюдения. У 32 из 44 наших больных правильный диагноз был поставлен только через 6-8 месяцев после появления первых признаков заболевания. Это объяс¬няется малой выраженностью клинической картины миастении в начальной стадии и плохой осведомленностью практических врачей, к которым впервые обращаются за помощью больные миастенией (невропатологи, окулисты, отоларингологи, терапевты).
При выраженной генерализованной форме миастении диагноз не труден. В начальной стадии и в случаях, когда миастения носит локализован¬ный характер (бульбарная, глазная, скелетно-мышечная, глоточно-лицевая), у наших больных предполагались самые разнообразные диагнозы, вплоть до подозрения на симуляцию. Считаем необходимым подчеркнуть особую важность прозериновой пробы, имеющей дифференциально-диагностическое значение. У больных миастенией внутримышечная инъекция 1-2 мл 0,05% раствора прозерина устраняет мышечную слабость и быструю утомляемость, в то время как при миопатиях и мышечной слабости, вызванных другими причинами, инъекция прозерина не дает эффекта. Имеют значение динамометрия, эргометрия и электромиография.
Общепризнано, что лечение миастении должно проводиться комплексно с участием 3-4 специалистов: невропатолога, терапевта-эндокринолога, анестезиолога-реаниматолога и хирурга. На основании большого клинического материала (сотни оперированных и наблюдаемых в отдаленном периоде) авторы подчеркивают преимущество оперативного лечения миастении перед консервативным (М. И. Кузин; А. С. Гаджиев и соавт., и др.). Результаты оперативного лечения лучше, если операцию производят впервые 2-2,5 года от начала заболевания. В более поздние сроки операция оказывается менее эффективной. Отсюда вытекает особая важность ранней диагностики миастении.
Из 43 оперированных нами больных в первый год заболевания миастенией поступили лишь 12, в сроки от 1 года до 3 лет - 23 и после 3 лет - 8 больных. Следовательно, больные поступали в клинику для оперативного лечения поздно.
Специальным методом исследования вилочковой железы является рентгеноконтрастный - пневмомедиастинография, которая позволяет судить о степени увеличения вилочковой железы, её структуре - отдель¬ный узел с четко ограниченными контурами или опухоль с инфильтрирую¬щим ростом и т. д.
Наличие у больного выраженной клинической картины прогрессирующей миастении является показанием к операции, так как все консервативные методы лечения, включая и рентгенотерапию, дают лишь временное улучшение.
У больных миастенией необходима специальная предоперационная подготовка, цель которой - снижение проявлений миастении путем индивидуального подбора дозы лекарственных препаратов. Дозировки препаратов подбирают строго индивидуально, с таким расчетом, чтобы в течение суток не наблюдалось периодов миастенического истощения, не наступало миастенического криза. Предоперационная подготовка, являясь симптоматической терапией, оказывает некоторое лечебное действие, что имеет положительное значение для предстоящей операции. Однако не у всех больных предоперационная подготовка, несмотря на ее комплексность и интенсивность, оказывается эффективной.
Вопрос о необходимости предоперационной рентгенотерапии нельзя считать окончательно решенным. Только 5 из наших больных перед операцией получали рентгеновское облучение, причем каких-либо улучшений в течении послеоперационного периода мы у них не отметили. У больных, оперированных по поводу злокачественной тимомы с явлениями миастении, предоперационное облучение играет важную роль в ближайшем исходе операции и в какой-то степени влияет на сроки наступления рецидива заболевания (М. И. Кузин и соавт.).
Большинство операций по поводу миастении нами выполнено из переднего доступа путем полной срединной продольной стернотомии. Наиболее ответственным моментом операции является отделение железы от левой плечеголовной вены. Ранение этого сосуда опасно из-за массивного кровотечения и возможной воздушной эмболии. В одном случае произошло ранение этой вены, закончившееся благополучно (был наложен боковой сосудистый шов). При операции следует избегать наложения зажимов на железистую ткань, раздавливания её.
У 3 наших больных было сочетание миастении и загрудинного зоба. Произведены тимэктомия и субтотальная струмэктомия.
У 26 больных во время операции была повреждена медиастинальная плевра, в том числе у 8 больных с обеих сторон. Осложнений, связанных с операционным пневмотораксом, не было. Если во время операции плевра не повреждена, переднее средостение дренируется одной резиновой трубкой, конец которой выводят в нижний угол раны или через отдельный прокол ниже мечевидного отростка и соединяют с отсосом. Вслед за тимэктомией трахеостома (превентивно) была наложена 5 больным.
Если сама операция тимэктомии по сравнению с другими торакальными операциями не представляет особой сложности, то течение послеоперационного периода у ряда больных сопровождается осложнениями, на 1-м месте среди которых стоит миастенический криз. Поэтому операции по поводу миастении возможны только в тех учреждениях, где можно обеспечить круглосуточное наблюдение анестезиолога-реаниматолога, а также многодневную аппаратную вентиляцию лёгких.
Вопрос о назначении антихолинэстеразных препаратов в послеоперационном периоде окончательно не решен. С целью уменьшения гиперсекреции бронхов лучше назначать прозерин с небольшими дозами атропина.
Тяжелый миастенический криз с расстройством дыхания, сердечной деятельности, глотания и т. д. наблюдали в первые дни после операции у 26 больных. Вывести из криза консервативными мероприятиями удалось 7 больных; 19 больным была наложена трахеостома с переводом их на аппаратное дыхание, длительность которого составляла от 3 до 40 суток. Через трахеостому систематически круглосуточно аспирируют слизь из трахеобронхиального дерева. Питание больных, находящихся на аппаратном дыхании, осуществляется через зонд. Помимо медикаментозного лече¬ния, применения кислорода, использования дыхательной гимнастики, в последние годы всем больным миастенией в послеоперационном периоде проводится лечебный массаж всего тела, повторяемый несколько раз в день.
Трахеостомическую трубку удаляют после того, как у больного стойко восстанавливается самостоятельное дыхание.
Из 43 оперированных по поводу миастении в первые дни после операции умерли 3 больных. Это относится к периоду, когда в клинике только осваивались эти операции. Все больные оперированы в тяжелом состоянии. Отдаленные результаты прослежены у 26 больных: выздоровление наступило у 17 и улучшение (больные принимают антихолинэстеразные препараты) - у 8 больных; состояние осталось без изменений у 3 больных. Двое оперированных умерли от рецидива злокачественной тимомы (один - с явлениями миастении через 3 года, другой - с инфарктом миокарда).
Доброкачественные опухоли вилочковой железы (тимомы) представля¬ют собой узлы округленной формы с плотной капсулой. При гистологическом исследовании в этих опухолях наряду с соединительнотканными клетками обнаруживаются фибробласты и концентрически расположенные вытянутые эпителиальные клетки, напоминающие тельца Гассаля. Эти опухоли по строению напоминают склерозирующую ангиому, еще их называют ретикулярной перителиомой (Pope и Osgood). Особое место занимают липотимомы. Одни авторы относят их к доброкачественным опухолям, другие - к злокачественным (Andrus и Foot). Опухоли эти нередко достигают боль¬ших размеров и состоят из жировой дольчатой ткани, содержащей скопления тимоцитов и гассалевых телец. Если в опухоли преобладает жировая ткань, её рекомендуют называть липотимомой, если преобладают элементы вилочковой железы - тимолипомой.
Среди наших больных мы наблюдали 3 (2 мужчин и 1 женщину, все старше 40 лет) с липотимомой. У них опухоль была небольших размеров, с ровными четкими границами; опухоль была расценена нами как доброкачественная. Заболевание сопровождалось умеренно выраженными явлениями миастении. Один из этих больных поступил с жалобами на слабость и быструю утомляемость; при дальнейшем обследовании у него была выявлена тяжелая гипопластическая анемия. Больной оперирован; в ближайшем послеоперационном периоде отмечены благоприятные результаты.
Из 15 наших больных с доброкачественными тимомами у 9 (4 мужчин и 5 женщин) были явления миастении, у остальных опухоль ничем себя не проявляла и была выявлена случайно.
Злокачественные тимомы - плотные, различных размеров бугристые опухоли, нередко прорастающие капсулу. У больных с этими новообразованиями из-за быстрого роста опухоли, прорастания соседних органов или сдавления их рано развивается синдром медиастинальной компрессии. Больные жалуются на боли за грудиной, чувство давления в грудной клетке и др. Нередко злокачественные тимомы протекают с явлениями миастении, отмеченной нами у 5 из 8 больных. Злокачественная тимома может протекать и совершенно бессимптомно. Приводим пример.
Больной М., 19 лет, поступил 17.III.1966 года. Жалоб нет. После окончания средней школы при прохождении медицинского обследования для поступления в учебное заведение у него рентгенологически было выявлено опухолевое образование в переднем средостении. Признаков миастении нет. Пневмомедиастинография: в переднем средостении со всех сторон окутанное газом образование продолговатой формы размером 15*5 см, с участками просветления в центре; заключение: опухоль вилочковой железы, возможно, с участками распада. Произведена тимэктомия. Гистологически: злокачественная тимома ретинулоклеточного типа. Проведена послеоперационная рентгенотерапия. Осмотрен через 4 года после операции:, жалоб нет, состояние хорошее, признаков рецидива нет.
Дифференциальный диагноз доброкачественных и злокачественных тимом нередко бывает трудным. Злокачественная тимома по рентгенологическим признакам напоминает лимфогранулематоз и лимфосаркому. В отличие от этих образований тимома располагается непосредственно за грудиной, обычно бывает овально-сплющенной или конусовидной формы. Всякая тимома, протекает она с явлениями миастении или без них, подлежит удалению, В литературе имеются указания, что каждую тимому следует рассматривать как потенциально злокачественную опухоль (Б. В. Петровский; Seybold и соавт., и др.).
Кисты вилочковой железы встречаются довольно редко. Обычно это тонкостенные образования различных размеров, расположенные в толще железы, выполненные желтоватой или коричневатой жидкостью. Из-за эла¬стичности этих образований признаков сдавления окружающих органов не наблюдается. Клиническая картина кист, если они протекают без миастении, бедна. Как правило их обнаруживают случайно, при профилактическом осмотре. Все наши 4 больных (3 женщины и 1 мужчина) были старше 40 лет (41 год - 48 лет). Ни у одного больного не было признаков миастении, хотя описаны сочетания кисты вилочковой железы и миастении. Все были оперированы (тимэктомия) с благоприятным результатом.
У 3 оперированных нами больных опухоль переднего средостения по гистологическому строению была тератомой. Учитывая тесную связь образования с остатками вилочковой железы и наличие в самом образовании ткани вилочковой железы, мы расценили опухоль как тератому вилочковой железы. У 2 больных на основании признаков (появление в мокроте сальных масс, волос у одной больной, а также обнаружение органоидных включений на рентгенограмме у другой) диагноз был поставлен до операции, у третьей больной - лишь во время операции. Из 3 оперированных больных у 2 при¬шлось удалить не только тератоидное образование, но и долю лёгкого из-за вовлечения последнего в процесс (прорыв нагноившейся тератомы в верхнедолевой бронх). Высокая степень злокачественного превращения тератоидных образований, возможность нагноения и другие осложнения убеждают в необходимости раннего и радикального хирургического удаления этих новообразований.
Вопрос о возможности изолированного поражения вилочковой железы лимфогранулематозом представляется спорным. Мы наблюдали 2 больных, у которых до операции был установлен диагноз “опухоль вилочковой железы”. После операции, при гистологическом исследовании препаратов, диагноз был изменен: изолированное поражение лимфогранулематозом вилочковой железы. Принимая во внимание указания о возможности изолированного поражения вилочковой железы на ранних стадиях заболевания (С. А. Гаджиев и В. В. Васильев), оба эти наблюдения мы отнесли к патологии вилочковой железы. После операции за больными ведётся наблюдение в течение 5 лет. Признаков рецидива и генерализации процесса нет.
Заболевание, заключающееся в сочетании патологии вилочковой желе¬зы и гипопластической анемии, которая возникает вследствие избирательного поражения костного мозга без изменения продукции лейкоцитов и тромбоцитов, впервые описано Кацнельсоном в 1922 году. Позже было предположено, что вилочковая железа влияет на гемопоэтическую функцию костного мозга, регуляцию состава белковых фракций, состояние лимфоидной системы и т. д. (Soutter и соавт.). С тех пор опубликованы данные некоторых авторов об отдельных операциях на вилочковой железе при различных болезнях крови (А. Н. Бакулев, 1958; Chaemers и Boheimer, и др.). К настоящему времени нами произведены 4 операции тимэктомии у больных гипопластической анемией. О результатах этих операций говорить пока рано, так как после них прошел небольшой срок. Ближайшие результаты удовлетворительные у 3 больных.
- В вилочковой железе возникает ряд патологических процессов, которые требуют оперативного лечения.
- Оперативное лечение по поводу миастении оправдано как при наличии рентгенологически и клинически определяемой опухоли, так и лишь при гиперплазии вилочковой железы.
- Операцию рекомендуется производить в ближайшее время после установления диагноза. Лучевое лечение целесообразно проводить после удаления злокачественной опухоли или если произвести радикальную операцию невозможно.
1) Бакулев А. Н., Колесникова Р. С. Хирургическое лечение опухолей и кист средостения. М., 1967.
2) Брайцев В. Р. Врожденные дизонтогенетические образования средостения и легких. М., 1960.
3) Гаджиев С. А., Догель Л. В., Ваневский В. Л. Диагностика и хирургическое лечение миастении. Л., 1971.
4) Гаджиев С. А., Васильев В. Мед газета, 1973, №15.
5) Кузин М. И. Клин мед, 1969, № 11, с. 6.
6) Кузин М. И., Успенский Л. В., Волков Б. П. Вести, хир., 1972, №7, с.48.
7) Осипов Б. К. Хирургические заболевания легких и средостения. М., 1961.
8) Петровский Б. В. Хирургия средостения. М., 1960.
9) Andгus W., Fооt N., J. thorac. Surg., 1937, v. 6. p. 648.
10) Chaemers G., Boheimer K., Brit. med. J., 1954, v.2, p.1514.
11) Pope R., О s g о о d R., Am. J. Path., 1953, v. 20, p. 85.
12) S е у b о 1 d W., D о n a 1 d М. С., J. thorac. Surg. Clagett C. et al., 1950, v. 20, p.195.
13) Soutter G., Sommers Sh. R e 1 m о n Ch. et al. Ann. Surg., 1957, v. 146, p. 426.
14) Viets H., Brit. med. J., 1950, v. 1, p.139.
Данные об авторах:
| 1) Виктор Львович Маневич – профессор, доктор медицинских наук, 2-я кафедра клинической хирургии ЦОЛИУв. |  |
| 2) Василий Дмитриевич Стоногин – доцент 2-й кафедры хирургии ЦОЛИУв, заведующий учебной частью кафедры, кандидат медицинских наук. E-mail: svas70@mail.ru |  |
Восстановление текста, компьютерная графика - Сергей Васильевич Стоногин.
Любое копирование материала запрещено без письменного разрешения авторов и редактора.
Тимомегалия - гиперплазия тимуса и его гипофункция, сопровождающие ряд заболеваний детского возраста. Незначительная тимомегалия протекает бессимптомно; выраженное увеличение тимуса может проявляться синдром сдавления жизненно важных органов, синдромом лимфопролиферации, иммунными и эндокрино-обменными нарушениями. Диагностика тимомегалии требует участия детского иммунолога, проведения УЗИ вилочковой железы, рентгенографии грудной клетки, исследования показателей Т-звена иммунной системы и гормонального статуса. Детям с тимомегалией рекомендуются общеоздоровительные мероприятия, прием поливитаминов, биостимуляторов; по показаниям - глюкокортикостероидов.
Общие сведения
Тимомегалия – превышение массы и объема вилочковой железы у детей предельных возрастных норм с сохранением нормальной гистологической структуры органа. Тимомегалия обнаруживается примерно у 13-34% детей раннего возраста и 3-12% детей старше 3-х лет. После 5-6 лет количество детей с тимомегалией существенно уменьшается. У мальчиков тимомегалия диагностируется в 1,5-2 раза чаще, чем у девочек. Дети, страдающие тимомегалией, составляют в педиатрии группу риска по развитию аллергических, эндокринных, аутоиммунных и онкологических заболеваний, синдрома внезапной детской смерти, потому нуждаются в особом уходе и дополнительном наблюдении со стороны педиатра и детского аллерголога-иммунолога.

Причины тимомегалии
Вилочковая железа или тимус представляет собой центральный орган иммунной системы и железу внутренней секреции. В тимусе происходит трансформация клеток-предшественников (претимоцитов) в Т-лимфоциты, участвующие в регуляции клеточного и гуморального иммунитета. Кроме этого, вилочковая железа секретирует свыше 20 биологически активных веществ, среди которых гормоны и гормоноподобные вещества, регулирующие обмен веществ, гемопоэз, уровень кальция и сахара в крови, фосфора в скелетных мышцах, рост и половое созревание. Максимальную массу тимус имеет к моменту рождения ребенка (4,4% массы тела); его рост продолжается до 15 лет, после чего орган подвергается постепенной возрастной инволюции – замещению железистой ткани жировой и соединительной.
К развитию тимомегалии могут приводить различные эндогенные и экзогенные факторы, а также их сочетание. Доказана генетическая детерминированность тимомегалии и ее связь с HLA-антигенами B15, B18, В27. Определенную роль в формировании тимомегалии у ребенка играет отягощенный акушерский анамнез матери (аборты и выкидыши в анамнезе, токсикозы беременности, резус-конфликт, поздняя беременность и др.); вредное влияние на плод лекарств, алкоголя, рентгеновского облучения; патология периода новорожденности и раннего возраста (асфиксия, недоношенность, родовые травмы, синдром дыхательных расстройств, конъюгационная желтуха, сепсис новорожденных) и др. Тимомегалия является характерным проявлением лимфатико-гипопластического диатеза.
Классификация тимомегалии
Исследователи выделяют врожденную (первичную) и приобретенную (вторичную) тимомегалию. При врожденной тимомегалии вилочковая железа сформирована правильно, однако увеличена в размерах, что сопровождается снижением ее секреторной функции, гиперплазией лимфоидной ткани и дисфункцией нейро-эндокринной системы.
Приобретенная тимомегалия развивается вследствие первичного поражения других эндокринных желез: гипокортицизма, обусловленного аддисоновой болезнью, травмами, воспалительным или опухолевым поражением коры надпочечников; гипоталамического синдрома при окклюзионной гидроцефалии, васкулитах, опухолях головного мозга и пр.
Кроме этого, увеличение вилочковой железы может носить функциональный характер (например, при ОРВИ, пневмонии и др. заболеваниях); в этих случаях после выздоровления размеры тимуса и иммуногормональные показатели приходят в норму. Органическая тимомегалия связана с непосредственным поражением вилочковой железы.
Симптомы тимомегалии
Дети с тимомегалией отличаются характерными фенотипическими чертами: округлыми мягкими формами тела, крупными чертами лица и увеличенными поперечными размерами тела (широким лицом, плечами, грудной клеткой, ладонями и стопами), бледной, слабо пигментированной кожей, светлыми волосами и глазами, слабо развитой мускулатурой, повышенным аппетитом. Чаще чем в популяции у них отмечается нарушение темпов и последовательности прорезывания зубов, позднее начало ходьбы, задержка речевого развития и дислалия.
Из сопутствующих заболеваний при тимомегалии могут встречаться паховые и пупочные грыжи, ВПС (септальные дефекты), перинатальная энцефалопатия, рахит, врожденный вывих бедра, синдактилия, крипторхизм, фимоз, гипоплазия матки и влагалища и др. Дети с тимомегалией склонны к артериальной гипотонии, аритмиям, повышенной потливости, необъяснимому длительному субфебрилитету. Клинически значимая тимомегалии может сопровождаться сдавлением жизненно важных органов (трахеи, сосудистого пучка, ВПВ, блуждающего нерва), развитием синдромов иммунодефицита и лимфопролиферации, эндокрино-обменных нарушений.
При компрессии увеличенным тимусом жизненно важных органов может развиваться синдром верхней полой вены: набухание шейных вен, расширение венозной сети на верхней части туловища, одышка, цианоз. В случае сдавления трахеи возникает кашель, одышка, шумное храпящее дыхание, возбужденное состояние. Раздражение блуждающего нерва сопровождается брадикардией, дисфонией, срыгиваниями или рвотой, коллапсами.
Тимомегалия обычно сочетается с гиперплазией лимфоидной ткани (лимфаденопатией, увеличением аденоидов и миндалин, спленомегалией). В раннем и дошкольном возрасте дети с тимомегалией относятся к группе часто болеющих; у них отмечаются частые эпизоды ОРВИ с сильным коклюшеподобным кашлем и ложным крупом, отиты, пневмонии, выраженные поствакцинальные реакции. Эндокринные сдвиги проявляются ожирением, гипокортицизмом, гипопаратиреозом, сахарным диабетом, дисфункцией щитовидной железы, гиперпигментацией кожных покровов.
Диагностика тимомегалии
Обследование детей с тимомегалией проводится педиатром, детским иммунологом, детским эндокринологом и включает несколько этапов (клинико-анамнестический, инструментальный и лабораторный). При оценке объективного статуса ребенка с тимомегалией обращается внимание на перинатальный анамнез, конституционные данные, перенесенные заболевания.
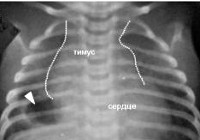
Основная роль в выявлении тимомегалии принадлежит инструментальному обследованию – рентгенографии грудной клетки, УЗИ вилочковой железы, УЗИ органов брюшной полости и надпочечников. Рентгенодиагностика позволяет определить степень тимомегалии на основании исчисления кардио-тимико-торакального индекса (КТТИ) и вазокардиального индекса (ВКИ). В норме на рентгенограммах в прямой проекции тень вилочковой железы располагается за тенью сердца и сосудистого пучка. При тимомегалии I степени тень тимуса занимает 1/2 половину грудной клетки, II степени - 1/2 - 3/4 грудной клетки, III степени - более 3/4 грудной клетки. УЗИ тимуса позволяет оценить объем и массу органа и составить более четкое представление о степени тимомегалии.
Лабораторные показатели при тимомегалии характеризуются снижением субпопуляции Т-лимфоцитов (CD3, CD4, CD8); резким уменьшением количества зрелых В-клеток, низким уровнем IgG и IgА, повышенным - IgM и IgE; снижением концентрации АКТГ, кортизола, повышением уровня СТГ и ТТГ, некоторым увеличением концентрации паратиреоидного гормона.
Лечение тимомегалии
Вопросы ведения детей с тимомегалией и необходимости проведения корригирующей терапии разработаны недостаточно. Общепринято считать, что при незначительном увеличении тимуса специальных лечебных мероприятий не требуется. Рекомендуется грудное вскармливание, рациональное питание, ограничение стрессов и контактов с инфекционными больными.
Объем медикаментозной терапии определяет иммунолог, наблюдающий ребенка с тимомегалией. Часто болеющим детям каждые 3-4 месяца показан прием адаптогенов и биостимуляторов (женьшеня, пантокрина, элеутерококка, лимонника китайского). С целью иммунокоррекции используется экстракт тимуса крупного рогатого скота. Дважды в год до достижения 5-6-летнего возраста ребенку назначаются курсы индукторов синтеза глюкокортикоидов (аммония глицирризината, этимизола).
При тяжелых заболеваниях, стрессах, а также перед оперативными вмешательствами детям с тимомегалией назначаются глюкокортикоиды (преднизолон, гидрокортизон). В случае развития синдрома тимусо-надпочечниковой недостаточности (апатии, сильной слабости, брадикардии, рвоты, диспепсии, артериальной гипотонии, признаков почечной недостаточности) показано введение преднизолона, инфузионных растворов, сердечных гликозидов, препаратов калия.
При тимомегалии I-II степени профилактическая вакцинация не противопоказана, но проводится на фоне гипосенсибилизирующей терапии и гипоаллергенной диеты. Детям с тимомегалией III степени при благоприятной эпидобстановке дается отвод от прививок на 6 месяцев (за исключением вакцинации против полиомиелита).
Прогноз и профилактика тимомегалии
Обычно тимомегалия у детей сохраняется до 3-6 лет, после чего размеры вилочковой железы приходят норму. Тем не менее, дети с тимомегалией более подвержены инфекционно-воспалительным и аллергическим заболеваниям, риску внезапной смерти от гипофункции коры надпочечников, сдавления увеличенным тимусом органов средостения.
Дети с тимомегалией должны состоять на диспансерном учете у педиатра, детского аллерголога-иммунолога, эндокринолога; проходить ежегодное лабораторно-инструментальное обследование. К возможным мерам по предупреждению тимомегалии можно отнести исключение перинатальных вредностей. Детям с увеличенной вилочковой железой следует избегать стрессов, контактов с инфекционными больными, своевременно проходить профилактические курсы лечения.
Тимома – гетерогенная группа новообразований, различных по гистогенезу и степени зрелости, берущих начало из эпителиальной ткани вилочковой железы. Варианты клинического течения тимомы могут быть различны: от бессимптомного до выраженного (компрессионный, болевой, миастенический, интоксикационный синдром). Топографо-анатомический и этиологический диагноз устанавливается с помощью лучевых методов (рентгенография, КТ средостения), трансторакальной пункции, медиастиноскопии, исследования биоптата. Лечение хирургическое: удаление тимомы вместе с вилочковой железой и жировой клетчаткой переднего средостения, дополненное по показаниям химиолучевой терапией.
Общие сведения
Причины формирования опухолей вилочковой железы неизвестны. Предполагается, что тимомы могут иметь эмбриональное происхождение, быть связаны с нарушением синтеза тимопоэтина или иммунного гомеостаза. Факторами, провоцирующими рост и развитие опухоли, могут служить инфекционные заболевания, радиационное воздействие, травмы средостения. Замечено, что тимомы часто сочетаются с различными эндокринными и аутоиммунными синдромами (миастенией, дерматомиозитом, СКВ, диффузным токсическим зобом, синдромом Иценко-Кушинга и др.).

Строение и функции вилочковой железы
Вилочковая железа, или тимус располагается в нижней части шеи и переднем отделе верхнего средостения. Орган образован двумя асимметричными долями – правой и левой. В свою очередь, каждая доля представлена множеством долек, состоящих из коркового и мозгового вещества и заключенных в соединительнотканную строму. В вилочковой железе различают два типа ткани – эпителиальную и лимфоидную. Эпителиальные клетки секретируют тимические гормоны (тимулин, a-, b-тимозины, тимопоэтины и пр.), лимфоидная ткань состоит из Т-лимфоцитов различной степени зрелости и функциональной активности.
Таким образом, вилочковая железа одновременно является железой внутренней секреции и органом иммунитета, обеспечивающим взаимодействие эндокринной и иммунной систем. После 20 лет тимус подвергается возрастной инволюции; после 50 лет паренхима тимуса на 90% замещается жировой и соединительной тканью, сохраняясь в виде отдельных островков, лежащих в клетчатке средостения.
Классификация тимом
В онкологии различают три типа тимом: доброкачественную, злокачественную тимому 1-го типа (с признаками атипии, но относительно доброкачественным течением) и злокачественную тимому 2-го типа (с инвазивным ростом).
- Доброкачественная тимома (50-70% опухолей тимуса) макроскопически имеет вид одиночного инкапсулированного узла, диаметром не более 5 см. С учетом гистогенеза внутри этой группы выделяют медуллярную (тип А), смешанную (тип АВ) и преимущественно кортикальную (тип В1) тимому.
- Тимома типа А (медуллярная) составляет 4–7% доброкачественных опухолей вилочковой железы. В зависимости от строения может быть солидной и веретеноклеточной-крупноклеточной, практически всегда имеет капсулу. Прогноз благоприятный, 15-летняя выживаемость составляет 100%.
- Тимома типа АВ (кортико-медуллярная) встречается у 28–34% пациентов. Сочетает в себе очаги кортикальной и медуллярной дифференцировки. Имеет удовлетворительный прогноз; 15-летняя выживаемость – более 90%.
- Тимома типа В1 (преимущественно кортикальная) встречается в 9–20% случаев. Часто имеет выраженную лимфоцитарную инфильтрацию. Более чем у половины пациентов сопровождается миастеническим синдромом. Прогноз удовлетворительный; 20-летняя выживаемость - более 90%.
- Злокачественная тимома 1-го типа (20-25% случаев) представляет собой одиночный или множественные дольчатые узлы без четкой капсулы. Размер опухоли чаще не превышает 4-5 см, однако иногда встречаются новообразования больших размеров. Отличается инвазивным ростом в пределах железы. В гистологическом отношении представлена кортикальной тимомой (тип В2) и высокодифференцированной карциномой.
- Тимома типа В2 (кортикальная) составляет около 20–36% тимом. Гистологические разновидности вариабельны: темноклеточная, светлоклеточная, водянисто-клеточная и др. В большинстве случаев протекает с миастенией. Прогностически менее благоприятна: 20 лет живут менее 60% больных.
- Тимома типа В3 (эпителиальная) развивается у 10–14% пациентов. Часто обладает гормональной активностью. Прогноз хуже, чем при кортикальной разновидности; 20-летняя выживаемость менее 40%.
- Злокачественная тимома 2-го типа (рак тимуса, тимома типа C) составляет до 5% всех наблюдений. Отличается выраженным инвазивным ростом, высокой метастатической активностью (дает метастазы в плевру, легкие, перикард, печень, кости, надпочечники). Выделяют 6 гистологических типов рака тимуса: плоскоклеточный, веретеноклеточный, светлоклеточный, лимфоэпителиальный, недифференцированный, мукоэпидермоидный.
В зависимости от удельного веса лимфоидного компонента в тимоме дифференцируют лимфоидные (более 2/3 всех клеток опухоли представлено Т-лимфоцитами), лимфоэпителиальные (Т-лимфоциты составляют от 2/3 до 1/3 клеток) и эпителиальные тимомы (Т-лимфоцитами представлено менее 1/3 всех клеток).
Основываясь на степени инвазивного роста, выделяют 4 стадии тимомы:
- I стадия - инкапсулированная тимома без прорастания жировой клетчатки средостения
- II стадия – прорастание элементов опухоли в медиастинальную клетчатку
- III стадия - инвазия плевры, легкого, перикарда, крупных сосудов
- IV стадия – наличие имплантационных, гематогенных или лимфогенных метастазов.
Симптомы тимомы
Клинические проявления и течение тимомы зависит от ее типа, гормональной активности, размеров. Более чем в половине случаев опухоль развивается латентно и обнаруживается во время профилактического рентгенологического исследования.
Инвазивные тимомы вызывают компрессионный медиастинальный синдром, который сопровождается болями за грудиной, сухим кашлем, одышкой. Сдавление трахеи и крупных бронхов проявляется стридором, цианозом, дыхательной недостаточностью. При синдроме компрессии верхней полой вены возникает одутловатость лица, синюшность верхней половины туловища, набухание шейных вен. Давление растущей опухоли на нервные узлы обусловливает развитие синдрома Горнера, осиплость голоса, элевацию купола диафрагмы. Сдавливание пищевода сопровождается расстройством глотания – дисфагией.
По различным данным, от 10 до 40% тимом сочетаются с миастеническим синдромом. Больные отмечают снижение мышечной силы, быструю утомляемость, слабость мимических мышц, двоение в глазах, поперхивание, нарушения голоса. В тяжелых случаях может развиться миастенический криз, требующий перехода к ИВЛ и зондовому питанию.
В поздних стадиях злокачественной тимомы появляются признаки раковой интоксикации: лихорадка, анорексия, снижение массы тела. Нередко тимоме сопутствуют различные гематологические и иммунодефицитные синдромы: апластическая анемия, тромбоцитопеническая пурпура, гипогаммаглобулинемия.
Диагностика
Диагностика тимомы проводится торакальными хирургами с привлечением онкологов, рентгенологов, эндокринологов, неврологов. При клиническом осмотре может выявляться расширение вен грудной клетки, выбухание грудины в проекции опухоли; увеличение шейных, надключичных, подключичных лимфоузлов; признаки компрессионного синдрома и миастении. Физикальное исследование обнаруживает расширение границ средостения, тахикардию, свистящие хрипы.
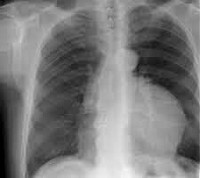
На рентгенограмме грудной клетки тимома имеет вид объемного образования неправильной формы, расположенного в переднем средостении. КТ грудной клетки значительно расширяет объем информации, полученный при первичной рентгендиагностике и в ряде случаев позволяет поставить морфологический диагноз. Уточнение локализации и взаимоотношения новообразования с соседними органами при КТ средостения позволяет в дальнейшем выполнить трансторакальную пункцию опухоли средостения, что чрезвычайно важно для гистологического подтверждения диагноза и верификации гистологического типа тимомы.
Для визуального исследования средостения и выполнения прямой биопсии проводится диагностическая медиастиноскопия, парастернальная торакотомия или торакоскопия. Диагноз миастении уточняется с помощью электромиографии с введением антихолинэстеразных препаратов. Дифференциально-диагностические мероприятия позволяют исключить другие объемные процессы в средостении: загрудинный зоб, дермоидные кисты и тератомы средостения.
Лечение тимом
Лечение опухолей вилочковой железы проводится в отделениях торакальной хирургии и онкологии. Хирургический метод является основным в лечении тимомы, поскольку только тимэктомия обеспечивает удовлетворительные отдаленные результаты. При доброкачественных тимомах оперативное вмешательство заключается в удалении опухоли вместе с вилочковой железой (тимомтимэктомия), жировой клетчаткой и лимфатическими узлами средостения. Такой объем резекции диктуется высоким риском рецидива опухоли и миастении. Операция выполняется из срединного стернотомического доступа.
При злокачественных новообразованиях тимуса операция может дополняться резекцией легкого, перикарда, магистральных сосудов, диафрагмального нерва. Послеоперационная лучевая терапия показана при II и III стадиях тимомы. Кроме этого, облучение является ведущим методом лечения неоперабельных злокачественных тимом IV стадии. В настоящее время большее значение в лечении инвазивных тимом получает трехэтапное лечение, включающее неоадъювантную химиотерапию, резекцию опухоли и лучевую терапию.
В послеоперационном периоде у больных, перенесших тимэктомию, может случиться миастенический криз, который требует проведения интенсивной терапии, трахеостомии, ИВЛ, длительного назначения антихолинэстеразных препаратов.
Отдаленные результаты лечения доброкачественных тимом хорошие. После удаления опухоли исчезают или значительно уменьшаются симптомы миастении. У больных злокачественной тимомой, прооперированных на ранних стадиях, 5-летняя выживаемость достигает 90%, на III стадии – 60-70%. Неоперабельные формы онкологического заболевания имеют плохой прогноз с летальностью 90% в течение ближайших 5 лет.
Туберкулез — инфекционное заболевание, вызываемое различными микобактериями (МБТ) — M.humanus, M.bovis, M.avium. Однако и другие виды микобактерий могут вызывать заболевание, которое принято называть микобактериозами. Микобактериоз может разв
 |
Туберкулез — инфекционное заболевание, вызываемое различными микобактериями (МБТ) — M.humanus, M.bovis, M.avium. Однако и другие виды микобактерий могут вызывать заболевание, которое принято называть микобактериозами. Микобактериоз может развиваться при заражении M.xenopi, M.kasasii, M.ulcerans и др.
Сегодня можно констатировать, что туберкулез поражает все слои общества, все возрастные группы и особенно опасен для детей первых трех лет жизни. По нашему мнению, при инфицировании ребенка на первом году жизни практически в 100% случаев развивается заболевание.
Наряду с ростом заболеваемости значительно возросло число осложненных форм туберкулеза у детей (особенно раннего возраста), что является следствием его поздней выявляемости.
Дети чаще всего заражаются микобактериями человеческого типа от взрослых членов семьи, обычно от близких родственников. В сельской местности, неблагополучной по туберкулезу крупного рогатого скота, происходит заражение младенцев от животных (употребление парного молока) микобактерией бычьего типа.
Преимущественно МБТ проникает в организм человека аэрогенным путем при ингаляции мельчайших капелек мокроты больного, выделяемых при кашле, чихании, разговоре. Гораздо реже отмечается инфицирование через высохшую мокроту. Возможно заражение алиментарным или контактным путями (через поврежденную кожу или слизистые оболочки). Крайне редко наблюдается внутриутробное заражение с развитием так называемого врожденного туберкулеза.
Наряду с перечисленными путями проникновения туберкулезной палочки в организм существует “ятрогенное” заражение в результате вакцинации и ревакцинации БЦЖ. Наши наблюдения за 420 детьми раннего возраста позволяют считать, что дальнейшее течение туберкулезной инфекции у детей раннего возраста и особенно первого года жизни обусловлено рядом факторов:
- социальным фактором;
- анатомо-физиологическими особенностями, характерными для данной возрастной группы;
- трудностями выявления и диагностики заболевания.
Анатомо-физиологические особенности, предполагающие и определяющие развитие и течение туберкулеза, заключаются в незрелости бронхолегочного аппарата, недифференцированности лимфатической системы, незрелости иммунной системы для локализации и уничтожения МБТ и в первую очередь реакции гиперчувствительности замедленного типа, превалировании экссудативно-альтеративного компонента в воспалительных реакциях. Существенную роль в этой возрастной группе играет склонность к частым острым респираторным инфекциям, развитию рахита и дефицита железа, аллергическая настроенность организма. Все это способствует возникновению тотального казеозного поражения внутригрудных лимфатических узлов, ранней лимфогематогенной диссеминации, быстрому прогрессированию процесса с развитием осложнений. Самоизлечение туберкулеза в этой возрастной группе, в отличие от других возрастных групп, наблюдается крайне редко. Известны лишь единичные случаи частичной регрессии процесса и переход его в хронически текущий первичный туберкулез с развитием обширных кальцинированных очагов в легких и лимфоузлах.
Диагностика туберкулеза в этом возрасте весьма затруднена, особенно на первом году жизни. Клинические проявления туберкулеза не имеют специфических черт, могут протекать под масками различных заболеваний — ОРВИ, бронхита, пневмонии и т. д. — или бессимптомно.
Туберкулинодиагностика на первом году жизни в массовом порядке еще не проводится. При проведении туберкулинодиагностики среди вакцинированных детей в первые 6-8 месяцев жизни возникают трудности в дифференциальной диагностике инфекционной и поствакцинальной аллергии. При инфицировании ребенка в первые дни и недели жизни идет параллельное формирование специфической аллергии. Только к концу первого года жизни и старше туберкулинодиагностика позволяет более четко констатировать инфекционный характер аллергии (формирование высокого уровня чувствительности к туберкулину или гиперэргическая реакция).
При генерализации туберкулезного процесса (милиарный туберкулез, туберкулезный менингит) в 30-50% формируется анергия к туберкулину. Незнание этого феномена нередко приводит к диагностическим ошибкам.
При проведении рентгенодиагностики можно столкнуться с рядом трудностей, которые обусловлены особенностями рентгеносимеотики неосложненного и осложненного первичного туберкулеза и с анатомо-физиологическими особенностями рентгенограммы органов грудной клетки ребенка первых лет жизни.
Особенности рентгеносимеотики определяются патофизиологическими механизмами первичного туберкулеза. Высокая реактивность тканей к микробактериям туберкулеза проявляется в виде обширных перифокальных реакций в легочной ткани, сегментарных и лобарных легочных поражений. Склонность к генерализации и лимфотропность приводит к увеличению внутригрудных лимфатических узлов.
Анатомо-физиологические особенности заключаются в том, что в малой по размерам грудной клетке ребенка относительно большое место занимает срединная тень, образуемая сердцем и сосудами, за которыми скрываются корни легких, особенно на первом году жизни. Большая вилочковая железа прикрывает зону верхнего средостения, что также затрудняет визуализацию внутригрудных лимфатических узлов. К тому же во время исследования маленький ребенок ведет себя беспокойно, и заставить его сделать глубокий вздох невозможно. Все это очень затрудняет диагностику поражения внутригрудных лимфатических узлов. В итоге рентгенологически локальный внутригрудной туберкулез подтверждается иногда лишь при динамическом наблюдении и целенаправленном рентгенотомографическом исследовании.
Бактериологические методы лечения в педиатрии, в отличие от терапии для взрослых, менее информативны, так как дети редко выделяют МБТ, да и получение мокроты представляет большие трудности.
Поэтому диагноз устанавливается на основании многих показателей: подробно собранный анамнез — сведения о вакцинации БЦЖ, контактах с больным туберкулезом, факторами риска по развитию туберкулеза; динамическое наблюдение за течением заболевания, рентгенотомографической картины; туберкулинодиагностика.
При развитии первичного туберкулеза у детей раннего возраста в 90-92% случаев диагностируется внутригрудной процесс.
Внутригрудной туберкулез проявляется в виде бронхоаденита — 89,3% и первичного туберкулезного комплекса соответственно — 10,7%. По результатам рентгенотомографического исследования бронхоаденит протекает преимущественно в виде туморозной и инфильтративной форм. Редко встречается “малая” форма (3,2%). При этом нередко поражаются все группы внутригрудных лимфатических узлов.
 |
Первичный туберкулезный комплекс характеризуется развитием воспалительных изменений в легочной ткани, поражением регионарных внутригрудных лимфатических узлов и лимфангитом. Легочный компонент у 96,6% детей локализуется в верхних долях (сегменты 2, 3, 4, 5), реже в зоне 6-го сегмента и крайне редко в сегментах 8, 9, 10, чаще справа, как правило в пределах одного или двух сегментов. В отличие от других возрастных групп у детей раннего возраста поражение лимфоузлов редко бывает регионарным, а характеризуется вовлечением нескольких, а то и всех групп внутригрудных лимфоузлов и зачастую по туморозному типу.
Туберкулезная интоксикация выявляется крайне редко, и при отсутствии локальных туберкулезных поражений требуется поиск других причин интоксикации.
Характерным проявлением туберкулезной инфекции в раннем детском возрасте является высокий удельный вес осложнений — 55,4%, а у детей первого года жизни частота осложнений доходит до 80%. В структуре осложнений наиболее часто встречаются бронхолегочные поражения — 55,6% (ателектатически-инфильтративный процесс в пределах одного или нескольких сегментов, доли или всего легкого), милиарный туберкулез — 19,3%, генерализованные формы — 13,9%, туберкулезный менингит (менингоэнцефалит) — 11,2%.
| Причинами эпидемиологического неблагополучия по туберкулезу являются ухудшение социально-экономических, экологических условий, снижение жизненного уровня населения, рост преступности (среди пребывающих в ИТУ туберкулез диагностируется в 42 раза чаще, чем в среднем по стране); рост числа людей без определенного места жительства и занятий; миграционные процессы (распространенность туберкулеза среди беженцев и вынужденных переселенцев — от 459 до 700 случаев на 100 тыс.) |
Развитие осложнений дает нередко более яркую клиническую картину, в отличие от неосложненных форм первичного туберкулеза, что в 38,4% случаев является поводом для госпитализации ребенка в общесоматический стационар и требует проведения дифференциальной диагностики. При этом необходимо отметить, что среди детей с осложненным течением первичного туберкулеза 70-72% — дети из семей мигрантов. Этот факт имеет важное значение в диагностике туберкулеза для врачей-педиатров соматических и инфекционных больниц.
Клинические проявления туберкулеза не имеют специфических черт. В 81,8% случаев туберкулез начинается постепенно [5]. Первые признаки заболевания проявляются в виде умеренно выраженных симптомов интоксикации: снижении аппетита, изменении поведения ребенка. При осмотре обращает внимание бледность кожных покровов, понижение массы тела, тургора, эластичности тканей, увеличение периферических лимфатических узлов. На ранних этапах можно выявить увеличение печени и селезенки, эпизодические подъемы температуры до субфебрильных цифр. В гемограмме отмечается гипохромная анемия, не поддающаяся лечению препаратами железа и коррекции питанием. В формуле крови при нормальном уровне лейкоцитов — нейтрофильный сдвиг с развитием лимфопении. С присоединением осложнений (милиарный туберкулез, менингит, бронхолегочные поражения) нарастает интоксикация, значительно снижается масса тела, температура становится субфебрильной-фебрильной, нарастает одышка, появляется непродуктивный кашель, а при менингите развивается менингеальная симптоматика.
Учитывая эти факторы, врач-педиатр может своевремено провести обязательный диагностический минимум для подтверждения или исключения специфического процесса.
| Классификация постпрививочных осложнений, предложенная в 1984 году Международным союзом по борьбе с туберкулезом ВОЗ; категории осложнений: |
| I — локальные кожные поражения (холодные абсцессы, язвы) II — персистирующая и диссеминированная БЦЖ-инфекция без летального исхода (волчанка, оститы и др.) III — диссеминированная БЦЖ-инфекция по типу генерализованного поражения с летальным исходом, которое отмечается при врожденном иммунодефиците IV — пост-БЦЖ синдром (проявления заболевания, возникшие вскоре после вакцинации БЦЖ, главным образом аллергического характера, узловатая эритема и т. д.) |
Более чем 37-летние результаты использования для вакцинации и ревакцинации внутрикожного введения БЦЖ, а затем и БЦЖ-М свидетельствуют о ее благоприятном влиянии на течение первичной туберкулезной инфекции у привитых. Противотуберкулезная вакцинация уменьшает развитие таких тяжелых форм заболевания, как милиарный туберкулез, туберкулезный менингит. Отмечено, что первичное инфицирование и первичные формы туберкулеза у вакцинированных при рождении детей по сравнению с невакцинированными протекают более доброкачественно, без осложнений и приводят к сравнительно быстрому благоприятному исходу [5]. Наряду с этим необходимо отметить два важных положения.
Первое — в условиях раннего инфицирования (первые дни и недели жизни ребенка) противотуберкулезная вакцинация, проведенная на четвертый—шестой день жизни, не может предупредить развитие туберкулеза и его осложнений, так как еще не сформировался поствакцинальный иммунитет. Отсюда следует вывод о необходимости обязательного обследования всех членов семьи перед выпиской ребенка из родильного дома, независимо от того, была проведена вакцинация в родильном доме или нет.
Второе — БЦЖ-инфекция. Частота поствакцинальных осложнений на отечественную вакцину БЦЖ — 0,02% после вакцинации и 0,003% — после ревакцинации [3]. После внедрения в практику вакцины БЦЖ-М частота осложнений уменьшилась до 0,004% к числу привитых новорожденных.
Проявления БЦЖ-инфекции также многообразны, как и проявления первичного туберкулеза, но в отличие от последних протекают менее агрессивно.
В большинстве случаев осложнения после вакцинации БЦЖ носят местный характер. Это подкожные холодные абсцессы; язвы величиной 10 мм и более в диаметре на месте внутрикожного введения вакцины; лимфадениты регионарных лимфатических узлов (подмышечные, шейные, над- и подключичные) при увеличении узла до 1,5 см и более в фазе инфильтрации, абсцедирования и кальцинации. Редко, но встречаются БЦЖ-оститы и диссеминированная БЦЖ-инфекция как следствие врожденного иммунодефицита (хроническая гранулематозная болезнь).
В условиях массовой вакцинации БЦЖ высокая частота поствакцинальных осложнений привела к тому, что довольно большое количество детей, в основном первого, реже второго года жизни требует длительного консервативного, а нередко и хирургического лечения.
Таким образом, в настоящее время в окружающей среде накоплен значительный резервуар туберкулезной инфекции. Туберкулез ведет себя агрессивно, поражая все возрастные и социальные группы населения. Наиболее негативно во всех своих проявлениях он действует на детей раннего возраста и особенно первого года жизни, приводя нередко к летальному исходу.
Литература
1. Аксенова В. А., Олянишин В. Н. Сборник резюме. Екатеринбург, 1997. № 186. С. 57.
2. Митинская Л. А. Противотуберкулезная вакцинация БЦЖ. М., 1975.
3. Митинская Л. А., Юхименко Н. В., Камаева В. Ф. Вакцинация БЦЖ и укороченные курсы лечения поствакцинальных осложнений с применением раствора рифампицина с димексидом. Педиатрия, 1986. № 6. С. 94-95.
4. Хоменко А. Г. Сборник резюме. Екатеринбург, 1997. С. 5-7.
5. Чугаев Ю. П. Диагностика и лечение туберкулеза у детей раннего возраста. Автореф. дис. док. мед. наук. М., 1988.
Читайте также:

