Вэб цмв инфекция у детей лечение
Обновлено: 25.04.2024
ЦМВ — представитель группы вирусов ргерпес, содержащий двойную спираль ДНК.
Эпидемиология
Вирус распространен во всем мире, чаще отмечается в перинатальном периоде и в детском возрасте. В США им инфицированы около 1% новорожденных. Инфицирование происходит только в результате повторного длительного тесного контакта. Передача происходит при сексуальных контактах, после переливания препаратов крови с частотой 0,1–10% на единицу перелитой крови. После того, как инфицированный ЦМВ ребенок попадает в семью или небольшой коллектив, передача инфекции чувствительным лицам составляет 50% в течение 6 мес.
Патогенез
После проникновения ЦМВ в организм в ходе бессимптомной или клинически манифестной инфекции, он латентно персистирует в тканях организма неопределенно долго. При нарушении активности Т-клеток организма вирус может реактивироваться, что проявляется разнообразными клиническими синдромами.
Клинические проявления
Врожденная ЦМВ-инфекция. В большинстве случаев у новорожденных ЦМВ-инфекция не имеет проявлений; у 5–25% детей, родившихся без проявлений инфекции, в течение последующих лет развиваются психомоторные, слуховые, зрительные отклонения. Цитомегалия, или инклюзивная болезнь, развивается примерно у 5% плодов, матери которых были первично инфицированы во время беременности. Симптомы: петехии, гепатоспленомегалия и желтуха (у 60–80%). В 30–50% случаев бывает микроцефалия (с кальцификацией вещества головного мозга или без нее), замедление внутриутробного роста и недоношенность. При тяжелых поражениях летальность составляет 20–30%.
Перинатальная инфекция. У большинства новорожденных, инфицированных в родах, признаки заболевания отсутствуют. Инфицирование происходит при прохождении через инфицированные родовые пути, а после рождения — с молоком матери. Реже ЦМВ вызывает затянувшийся интерстициальный пневмонит недоношенных.
ЦМВ-мононуклеоз. Мононуклеоз с отрицательными гетерофильными антителами — наиболее частое проявление ЦМВ-инфекции у соматически здоровых новорожденных. Инкубационный период 20–60 дней, длительность заболевания 2–6 нед. ЦМВ-мононуклеоз характеризуется длительной высокой лихорадкой, иногда с ознобом, быстрой утомляемостью, недомоганием. Миалгия, головная боль и спленомегалия встречаются часто, а экссудативный фарингит и шейная лимфаденопатия редки, что контрастирует с мононуклеозом, вызванным вирусом Эпштейна-Барр, для которого эти поражения характерны. Лабораторные данные — относительный лейкоцитоз с наличием более 10% атипичных лимфоцитов. Умеренное повышение активности сывороточной АлАТ и ЩФ также типичны; желтуха встречается редко.
ЦМВ-инфекция у больных со сниженным иммунитетом. ЦМВ наиболее часто поражает реципиентов трансплантируемых органов. Симптомы инфекции: лихорадка, лейкопения, гепатит, пневмонит, эзофагит, гастрит, колит, ретинит. Период максимального риска приходится на 14-й месяц после трансплантации. Максимальный риск заболевания выше при первичном инфицировании. После пересадки печени возникает ЦМВ-гепатит, после пересадки легких — ЦМВ-пневмонит. Он также развивается у 15–20% больных реципиентов костного мозга и дает летальность 84–88%. ЦМВ часто обнаруживают у больных с ВИЧ-инфекцией. В процесс вовлекается ЖКТ (включая язвы пищевода и колит). ЦМВ-ретинит — главная причина развития слепоты при СПИДе.
Диагностика: необходимо выделить вирус в тканевой культуре, это занимает несколько дней при высоком титре вируса, но может потребоваться и несколько недель. Для ускорения многие лаборатории применяют оболочнопузырьковую методику для работы с тканевой культурой. При этом применяют моноклональные антитела и иммуноцитохимический тест для раннего обнаружения антигена. Выделение вируса из мочи или слюны не подтверждает заболевания, поскольку сохраняется месяцы и годы после перенесенной инфекции; определение ЦМВ-виремии культуральным методом или скоростными антигенными тестами и в лейкоцитах периферической крови — эти методики являются наилучшими. Нужно учесть, что, хотя 4-х кратный подъем в титре антител может подтвердить наличие инфекции в организме, этот подъем может занять около 4 нед, титр остается повышенным на протяжении ряда лет.
Лечение
Ганцикловир был эффективен у 70–90% больных с ВИЧ-инфекцией, леченных по поводу ЦМВ-вирусного ретинита и колита. Начальная доза препарата составила 5 мг/кг 2 раза в сутки внутривенно в течение 14–21 дня, поддерживающая — 5 мг/кг в сутки внутривенно. Нейтропения, главный токсический эффект, может быть уменьшена путем применения колониестимулирующих факторов. У реципиентов костного мозга применение ганцикловира и ЦМВ-иммунного глобулина позволило получить положительный результат у 50–70% больных с ЦМВ-пневмонитом. Для разновидностей ЦМВ, резистентных к ганцикловиру, эффективен фоскарнет (влечении больных с ЦМВ-ретинитом при ВИЧ-инфекции). Первоначальная доза фоскарнета 60 мг/кг через 8 ч в течение 14–21 дня, затем сутки вводят инфузионно 90–120 мг/кг. У 5% больных лечение сопровождалось выраженным токсическим эффектом, включая дисфункцию почек, гипомагнезиемию, гипокалиемию, гипокальциемию, судороги, лихорадку, сыпь.
Инфекции, вызванные вирусом Эпштейна-Барр
ВЭБ содержит ДНК в форме двойной спирали, относится к группе герпесвирусов человека, обладает лимфотропностью к Вклеткам.
Эпидемиология
ВЭБ передается преимущественно со слюной, иногда при переливании крови и не является высоко контагиозным. Первичная инфекция в основном поражает детей раннего возраста, а также малообеспеченные слои населения и популяции в развивающихся странах. Инфекционный мононуклеоз обусловливает большинство случаев данного заболевания среди подростков и молодых взрослых. У взрослых в большинстве случаев обнаруживаются антитела к ВЭБ. Вирус выделяется во внешнюю среду из ротоглотки в течение 18 мес после первичного инфицирования. Затем выделение вируса периодически продолжается у всех серопозитивных реконвалесцентов при отсутствии клинической симптоматики.
Клинические проявления
Инфекционный мононуклеоз. Инкубационный период длится 4–8 нед. Продромальные признаки (слабость, анорексия, озноб) часто на несколько дней опережают начало заболевания в виде фарингита, лихорадки и лимфаденопатии. Выраженный фарингит заставляет больного обращаться за медицинской помощью. Лихорадка отмечена у 90% больных, температура тела может достигать 39–40°С. При физикальном исследовании: распространенный фарингит с экссудацией у 1/3 больных; шейная лимфаденопатия, захватывающая задние и (или) передние группы лимфатических узлов более чем у 90% больных, спленомегалия примерно у половины на 2–3-й неделях болезни и сыпь у 5%. После назначения ампициллина у 90–100% больных инфекционным мононуклеозом возникает зудящая макулопапулезная сыпь. Фарингит длится не более 5–7 дней с постепенным исчезновением в последующие 7–10 дней; лихорадка тянется 7–14 дней, но иногда дольше; лимфаденопатия исчезает за 3 нед, а слабость сохраняется на протяжении месяцев. Осложнения нечасты, но могут быть тяжелыми, включая развитие аутоиммунной гемолитической анемии, тромбоцитопении, гранулоцитопении, разрыв селезенки, патологию черепных нервов, энцефалит, гепатит, перикардит, миокардит, спазм коронарных артерий, обструкцию дыхательных путей. Описаны случаи крайне тяжелой ВЭБ инфекции, которую расценивали как связанный с Х-хромосомой лимфопролиферативный синдром, или синдром Дункана.
Злокачественные новообразования, связанные с вирусом Эпштейна-Барр.
Эта зависимость была впервые описана между ВЭБ и африканской лимфомой Беркитта. Она прослежена у 90% больных лимфомой, тогда как в США — у 15%; то же установлено в отношении анапластической назофарингеальной карциномы, Вклеточной лимфомы, особенно у больных с иммунодефицитом после трансплантации аллотканей; у больных с атаксиейтелеангиоэктазией (синдром ЛуиБар) и ВИЧ-инфекцией.
Диагностика
Лечение
Лечение инфекционного мононуклеоза — симптоматическое. На 6–8 нед следует ограничить интенсивную физическую активность, которая может вызвать разрыв селезенки. Глюкокортикоиды назначают лишь при синдроме обструкции дыхательных путей, выраженной гемолитической анемии и тромбоцитопении. Состояние некоторых больных с затяжным течением болезни можно улучшить проведением короткого курса преднизолона, но стандартная терапия стероидами не показана.
Эпштейна-Барр вирусная инфекция (ЭБВИ) относится к наиболее распространенным инфекционным заболеваниям человека. Антитела (Ат) к вирусу Эпштейна-Барр (ВЭБ) обнаруживают у 60% детей первых двух лет жизни и у 80–100% взрослых [3, 13]. Заболеваемость острой формой ЭБВИ (ОЭБВИ) в различных регионах мира колеблется от 40 до 80 случаев на 100 тыс. населения [2]. Хроническая форма ЭБВИ (ХЭБВИ) развивается у 15–25% лиц после ОЭБВИ [1, 5, 15]. Установлена роль ВЭБ в развитии злокачественных новообразований, аутоиммунных заболеваний и синдрома хронической усталости [3, 5, 14, 15]. Все это свидетельствует об актуальности проблемы ЭБВИ.
ВЭБ, открытый в 1964 г. M. Epstein и Y. Barr, относится к γ-герпес-вирусам [3]. ВЭБ имеет в своем составе 3 антигена: капсидный (VCA), ранний (EA) и ядерный (EBNA). Своеобразие патологического процесса при ЭБВИ определяется способностью ВЭБ к трансформации В-лимфоцитов, пожизненной персистенции в организме человека, индукции вторичного иммунодефицитного состояния (ИДС), аутоиммунных реакций, злокачественных опухолей [1, 3, 5, 12].
Источник заражения ВЭБ — больные манифестными и бессимптомными формами. 70–90% лиц, перенесших ОЭБВИ, выделяют вирус в последующие 1–18 мес. Пути передачи ВЭБ: воздушно-капельный, контактно-бытовой, парентеральный, половой, вертикальный. ОЭБВИ характеризуется эпидемическими подъемами 1 раз в 6–7 лет, чаще регистрируется в возрасте от 1 до 5 лет, в организованных коллективах [4, 7, 9].
Иммунный статус 109 больных ОЭБВИ в возрасте от 5 до 14 лет в нашей работе выявил признаки активации Т-клеточного звена иммунной системы — повышение количества Т-лимфоцитов (CD3), цитотоксических Т-лимфоцитов (CD8), клеток с маркерами поздней активации (HLA-DR); поликлональную активацию В-лимфоцитов — увеличение количества CD20-клеток, иммуноглобулинов (Ig) IgA, IgM, IgG, циркулирующих иммунных комплексов (ЦИК). Обнаружены признаки угнетения иммунной системы: нормальное содержание Т-хелперов (CD4), снижение иммунорегуляторного индекса CD4/CD8, количества естественных киллерных клеток NK (CD16), повышение готовности иммунокомпетентных клеток к апоптозу (CD95). Наблюдалась активация кислородзависимого метаболизма нейтрофилов и редукция его адаптационных возможностей.
У трети обследованных детей (33,9%) ОЭБВИ протекала в форме микст-инфекции с цитомегаловирусами (ЦМВ), вирусами простого герпеса 1 и 2 типов (ВПГ-1, ВПГ-2). При бактериологическом исследовании мазков из ротоглотки у 41,3% пациентов выделены Streptococcus (S.) viridans, у 11,9% — Candida albicans, у 8,2% — Staphilococcus (Staph.) epidermidis, у 6,4% — S. pyogenes, у 2,7% — Klebsiella (Kl.) pneumoniae, у 41,3% — ассоциация бактерий. У 43,1% пациентов — серологические маркеры активной формы хламидийной инфекции, у 30,3% — микоплазмоза.
Возможны следующие исходы ОЭБВИ: латентная инфекция, ХЭБВИ, ИДС, онкологические, аутоиммунные заболевания, синдром хронической усталости [5, 8, 10, 11]. Переход в ХЭБВИ связан с комплексом неблагоприятных факторов в анте-, интра- и постнатальном периодах, нарушением нейроиммунноэндокринной регуляции, генетической предрасположенностью.
Проведенное нами обследование 60 детей в возрасте от 5 до 14 лет с ХЭБВИ показало, что в этой группе у 86,7% матерей имел место отягощенный акушерский анамнез; у 83,3% детей обнаружены перинатальная и постнатальная патология ЦНС, ЛОР-органов и др.
Нарушения иммунного статуса приводили к активации условно-патогенной микрофлоры, вирусных и грибковых инфекций. В микробном спектре слизистой ротоглотки пациентов с ХЭБВИ выделены S. Viridans (30%), Candida albicans (28,3%), Staph. Epidermidis (25%), S. Pyogenes (20%), Kl. Pneumoniae (8,4%), ассоциация бактерий (41,7%); у 28,3% — серологические маркеры активной формы хламидиоза, у 26,7% — микоплазмоза. У 90% пациентов заболевание протекало в форме микст-инфекции с участием герпес-вирусов: ВЭБ + ЦМВ, ВЭБ + ВПГ-1, ВПГ-2.
Классификация. Общепринятая классификация заболевания отсутствует; рекомендуем использовать разработанную нами рабочую классификацию ЭБВИ.
- По периоду возникновения: врожденная, приобретенная.
- По форме: типичная (инфекционный мононуклеоз), атипичная: стертая, бессимптомная, висцеральная.
- По тяжести: легкая, среднетяжелая, тяжелая.
- По течению: острая, затяжная, хроническая.
- По фазе: активная, неактивная.
- Осложнения: гепатит, разрыв селезенки, менингоэнцефалит, полирадикулонейропатия, миокардит, синусит, отит, гемолитическая анемия, тромбоцитопения, нейтропения, панкреатит и др.
- Микст-инфекция.
Примеры оформления диагноза:
- Осн.: Приобретенная ЭБВИ, типичная тяжелая форма (инфекционный мононуклеоз), острое течение, активная фаза. Осл.: Острый гепатит.
- Осн.: Приобретенная ЭБВИ, висцеральная форма (менингоэнцефалит, гепатит, нефрит), тяжелое хроническое течение, активная фаза. Осл.: острая печеночно-почечная недостаточность. Сопp.: Респираторный хламидиоз (ринофарингит, бронхит, пневмония).
Клиническая картина острой ЭБВИ впервые была описана Н. Ф. Филатовым (1885) и Е. Пфейфером (1889). Инкубационный период длится от 4-х дней до 7 нед. Полный симптомокомплекс формируется к 4–10-му дням болезни [4, 7].
Нами обследованы 109 детей с ОЭБВИ. У большинства пациентов заболевание начинается остро, с повышения температуры тела и появления симптомов интоксикации; реже отмечается постепенное начало: несколько дней наблюдается недомогание, слабость, вялость, снижение аппетита. Температура тела субфебрильная или нормальная. Ко 2–4-му дням болезни температура достигает 39–40 °С; лихорадка и симптомы интоксикации могут сохраняться в течение 2–3 и более недель.
Тонзиллит — наиболее частый и ранний симптом ОЭБВИ, сопровождается увеличением миндалин до II-III степени. Лакунарный рисунок подчеркнут за счет инфильтрации ткани миндалин или сглажен из-за лимфостаза. На миндалинах — налеты желтовато-белого или грязно-серого цвета в виде островков, полосок. Они исходят из лакун, имеют шероховатую поверхность (напоминают кружево), легко снимаются без кровоточивости, растираются, не тонут в воде. Характерно несоответствие размера налета и степени увеличения регионарных ЛУ. При фибринозно-некротическом характере налетов в случае их распространения за пределы миндалин необходим дифференциальный диагноз с дифтерией. Налеты на миндалинах исчезают, как правило, через 5–10 дней.
Гепатомегалия может быть обнаружена с первых дней болезни, однако чаще выявляется на второй неделе. Нормализация размеров печени происходит в течение полугода. У 15–20% больных в качестве осложнения развивается гепатит.
Спленомегалия относится к поздним симптомам, встречается у большинства больных. Нормализация размеров селезенки происходит в течение 1–3 нед.
Экзантема при ОЭБВИ появляется на 3–14-й дни болезни, имеет полиморфный характер — пятнистая, папулезная, пятнисто-папулезная, розеолезная, мелкоточечная, геморрагическая. Определенной локализации нет. Сыпь наблюдается в течение 4–10 дней, иногда оставляет пигментацию. У детей, получавших ампициллин или амоксициллин, сыпь появляется чаще (90–100%).
Гематологические изменения включают лейкоцитоз (10–30 х 10 9 /л), нейтропению с палочкоядерным сдвигом влево, увеличение количества лимфоцитов, моноцитов, атипичных мононуклеаров до 50–80%, повышение СОЭ до 20–30 мм/час. Характерный гематологический признак — атипичные мононуклеары в количестве 10–50%: они появляются к концу первой недели заболевания, сохраняются в течение 1–3 нед.
Хроническая ЭБВИ является исходом ОЭБВИ или развивается как первично-хроническая форма [2, 5, 8, 10, 11, 15]. Нами обследовано 60 детей с ХЭБВИ, клиника которой включала хронический мононуклеозоподобный синдром и полиорганную патологию. У всех пациентов обнаружены лимфопролиферативный синдром (генерализованная лимфаденопатия, гипертрофия небных и глоточной миндалин, увеличение печени и селезенки) и признаки хронической интоксикации (длительный субфебрилитет, слабость, снижение аппетита и др.). Вследствие развития ИДС наблюдались острые инфекции респираторного тракта и ЛОР-органов с обострениями до 6–11 раз в год: ринофарингиты (28,3%), фаринготонзиллиты (91,7%), аденоидиты (56,7%), отиты (11,7%), синуситы (20%), ларинготрахеиты (18,3%), бронхиты (38,3%), пневмонии (25%). Обращала внимание высокая частота полиорганной патологии, обусловленная длительной репликацией ВЭБ, вторичным ИДС, аутоиммунными реакциями (патология ЦНС; хронический гастрит, дискинезия желчевыводящих путей; кардиальный синдром, артралгии).
В последние годы описана врожденная ЭБВИ. Установлено, что риск ее при первичной ЭБВИ во время беременности составляет 67%, при реактивации — 22%. Клиника врожденной ЭБВИ сходна с ЦМВИ.
Установлена роль ВЭБ в развитии онкологических заболеваний и паранеопластических процессов — лимфомы Беркетта, назофарингеальной карциномы, лимфогранулематоза, опухолей желудка, кишечника, слюнных желез, матки, лейкоплакии языка и слизистой ротовой полости, а также ряда аутоиммунных заболеваний — системной красной волчанки, ревматоидного артрита, синдрома Шегрена, лимфоидного интерстициального пневмонита, хронического гепатита, увеита и др. [3, 5, 14, 15]. ВЭБ, наряду с вирусами герпеса человека 6 и 7 типов, является этиологическим фактором синдрома хронической усталости и наиболее частой причиной (15%) развития длительной лихорадки неясного генеза.
Диагностика ЭБВИ основана на учете групп риска, ведущих клинических синдромов и данных лабораторного исследования [8–11]. К группам риска у матери относят отягощенный анамнез, маркеры герпес-вирусных инфекций и др., у ребенка — перинатальное поражение ЦНС, аллергический фенотип, ИДС, маркеры герпес-вирусных инфекций и др. Ведущими клиническими синдромами ЭБВИ являются мононуклеозоподобный, общеинфекционный синдромы, экзантема, синдром полиорганной патологии.
В обязательный стандарт диагностики ЭБВИ входят клинический анализ крови, общий анализ мочи, биохимическое исследование крови, бактериологическое исследование слизи ротоглотки и носа, серологические маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм, УЗИ органов брюшной полости, консультация ЛОР-врача, по показаниям — рентгенография придаточных пазух носа, органов грудной клетки, ЭКГ. Дополнительный стандарт диагностики (в специализированном лечебно-профилактическом учреждении): маркеры ВЭБ, других герпес-вирусов, хламидий, микоплазм методом полимеразной цепной реакции (ПЦР), иммунограмма второго уровня, консультация иммунолога, по показаниям — коагулограмма, морфологическая картина стернальной пункции, консультация гематолога, онколога.
Методом иммуноферментного анализа (ИФА) определяют Ат к антигенам ВЭБ, что позволяет осуществить лабораторную диагностику ЭБВИ и определить период инфекционного процесса.
Ат класса IgM к VCA появляются одновременно с клиникой ОЭБВИ, сохраняются в течение 2–3 мес, повторно синтезируются при реактивации ВЭБ. Длительная персистенция высоких титров этих Ат характерна для ХЭБВИ, ВЭБ-индуцированных опухолей, аутоиммунных заболеваний, ИДС.
Ат класса IgG к EA достигают высокого титра на 3–4-й нед ОЭБВИ, исчезают через 2–6 мес. Они появляются при реактивации, отсутствуют при атипичной форме ЭБВИ. Высокие титры Ат данного класса выявляют при ХЭБВИ, ВЭБ-индуцированных онкологических и аутоиммунных заболеваниях, ИДС.
Ат класса IgG к EBNA появляются через 1–6 мес после первичной инфекции. Затем их титр уменьшается и сохраняется в течение всей жизни. При реактивации ЭБВИ происходит повторное увеличение их титра.
Большое значение имеет исследование авидности Ат класса IgG (прочности связывания антигена с Ат). При первичной инфекции сначала синтезируются Ат с низкой авидностью (индекс авидности (ИА) менее 30%). Для поздней стадии первичной инфекции характерны Ат со средней авидностью (ИА — 30–49%). Высокоавидные Ат (ИА — более 50%) образуются через 1–7 мес после инфицирования ВЭБ.
Серологическими маркерами активной фазы ЭБВИ являются Ат IgM к VCA и Ат IgG к EA, низкая и средняя авидность Ат IgG к маркерам неактивной фазы, Ат IgG к EBNA.
Материалом для ПЦР служат кровь, ликвор, слюна, мазки со слизистой ротоглотки, биоптаты органов и др. Чувствительность ПЦР при ЭБВИ (70–75%) ниже, чем при других герпесвирусных инфекциях (95–100%). Это связано с появлением ВЭБ в биологических жидкостях лишь при иммуноопосредованном лизисе инфицированных В-лимфоцитов.
На основании опыта лечения 169 детей с ЭБВИ нами разработан стандарт лечения этого заболевания.
Базисная терапия: охранительный режим; лечебное питание; противовирусные препараты: вироцидные препараты — инозин пранобекс (Изопринозин), аномальные нуклеозиды (Валтрекс, Ацикловир), Арбидол; препараты ИФН — рекомбинантный ИФН α-2β (Виферон), Кипферон, Реаферон-ЕС-Липинт, интерфероны для в/м введения (Реаферон-EC, Реальдирон, Интрон А, Роферон А и др.); индукторы ИФН — Амиксин, сверхмалые дозы антител к γ-ИФН (Анаферон), Циклоферон, Неовир. По показаниям: локальные антибактериальные препараты (Биопарокс, Лизобакт, Стопангин и др.); системные антибактериальные препараты (цефалоспорины, макролиды, карбапенемы); иммуноглобулины для внутривенного введения (Иммуновенин, Габриглобин, Интраглобин, Пентаглобин и др.); витаминно-минеральные комплексы — Мульти-табс, Вибовит, Санасол, Киндер Биовиталь гель и др.
Интенсификация базисной терапии по показаниям:
Симптоматическая терапия.
При лихорадке — жаропонижающие препараты (парацетамол, ибупрофен и др.); при затруднении носового дыхания — назальные препараты (Изофра, Полидекса, Називин, Виброцил, Адрианол и др.); при сухом кашле — противокашлевые препараты (Глаувент, Либексин), при влажном кашле — отхаркивающие и муколитические препараты (АмброГЕКСАЛ, бромгексин, ацетилцистеин и др.).
Эффективность этиотропной терапии ОЭБВИ оценена в двух группах больных. Пациенты 1-й группы (52 человека) получали инозин пранобекс (Изопринозин) в сочетании с рекомбинантным ИФН α-2β (Вифероном), больные 2-й группы (57 детей) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Клинико-серологические показатели до начала лечения и через 3 мес терапии представлены в табл. 1. У пациентов обеих групп в динамике отмечалось достоверное уменьшение таких симптомов, как генерализованная лимфаденопатия, тонзиллит, аденоидит, гепатомегалия и спленомегалия. Вместе с тем на фоне комбинированной терапии, положительная динамика клинических показателей была более значительной; острые респираторные инфекции (ОРИ) лишь у 19,2% больных 1-й группы и у 40,3% больных 2-й группы (p < 0,05). На фоне комбинированной терапии наблюдалось более быстрое исчезновение серологических маркеров репликации.
Эффективность этиотропной терапии исследована у 60 больных ХЭБВИ. Пациенты 1-й группы (30 детей) получали инозина пранобекс (Изопринозин) и рекомбинантный ИФН α-2β (Виферон), 2-я группа (30 человек) — монотерапию рекомбинантным ИФН α-2β (Вифероном). Независимо от схемы лечения через 3 мес после начала терапии отмечалось достоверное уменьшение частоты генерализованной лимфаденопатии, гипертрофии небных и глоточной миндалин, спленомегалии, интоксикационного, инфекционного и вегето-висцерального синдромов (табл. 2). Комбинация инозина пранобекса (Изопринозина) с рекомбинантным ИФН α-2β (Вифероном) способствовало более существенной динамике клинических показателей. Количество эпизодов ОРИ снизилось с 6–11 (7,9 ± 1,1) до 4–6 (5,2 ± 1,2) в год на фоне монотерапии рекомбинантным ИФН α-2β (Вифероном), и до 2–4 (2,5 ± 1,4) в год на фоне комбинированной терапии (p < 0,05). В обеих группах уменьшалась частота репликации ВЭБ, однако при сочетанном применении противовирусных препаратов этот эффект был более выраженным.
Побочных эффектов при использовании инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона) не было.
Результаты проведенного исследования свидетельствуют о потенцировании эффектов при комбинации инозина пранобекса (Изопринозина) с рекомбинантным ИФН a-2b (Вифероном) у больных ЭБВИ.
Потенцирование противовирусных, иммуномодулирующих и цитопротекторных эффектов этих препаратов приводит к более существенной, чем при монотерапии, положительной динамике проявлений клинических симптомов ЭБВИ, к исчезновению серологических маркеров активности инфекционного процесса. Следует отметить высокую эффективность и безопасность комбинированной терапии с использованием инозина пранобекса (Изопринозина) и рекомбинантного ИФН α-2β (Виферона).
Реабилитация. Ребенок наблюдается участковым врачом и инфекционистом, снимается с учета через 6–12 мес после исчезновения клинико-лабораторных показателей активности инфекционного процесса. Кратность осмотров — 1 раз в месяц. По показаниям рекомендуют консультацию ЛОР-врача, иммунолога, гематолога, онколога и др. Лабораторные и инструментальные исследования пациентов включают: клинический анализ крови 1 раз в месяц в течение 3 мес, затем 1 раз в 3 месяца, по показаниям — чаще; серологические маркеры ВЭБ методом ИФА один раз в три месяца, по показаниям — чаще; ПЦР крови, мазков из ротоглотки 1 раз в 3 месяца, по показаниям — чаще; иммунограмма — 1 раз в 3–6 мес; биохимическое и инструментальное исследования — по показаниям.
Реабилитационная терапия включает: охранительный режим, лечебное питание, противовирусные препараты по пролонгированным схемам. Под контролем иммунограммы осуществляют иммунокоррекцию. По показаниям назначают локальные антибактериальные препараты, курсы витаминно-минеральных комплексов, про- и пребиотиков, препаратов метаболической реабилитации, энтеросорбентов, антигистаминные препараты, гепато-, нейро- и ангиопротекторы, кардиотропные препараты, ферменты, гомеопатические средства, немедикаментозные методы лечения.
Таким образом, ЭБВИ характеризуется широким распространением, длительным течением с периодической реактивацией инфекционного процесса у части пациентов, возможностью развития осложнений и неблагоприятных исходов (онкозаболеваний, аутоиммунной патологии). Важную роль при ЭБВИ играет формирование вторичного ИДС. Ведущими клиническими синдромами ЭБВИ являются острый и хронический мононуклеозоподобный синдромы, интоксикационный, инфекционный, церебральный, гастроинтестинальный, кардиальный и артралгический синдромы. Диагностика ЭБВИ основана на анализе групп риска, выделении ведущих клинических синдромов и лабораторном исследовании. Лечение ЭБВИ является комплексным и включает этиотропные средства (виростатические препараты, интерферон и его индукторы), препараты патогенетической, иммуномодулирующей, симптоматической терапии. Сочетанное пролонгированное использование инозина пранобекс (Изопринозина) и рекомбинантного ИФН α-2β (Виферона), потенцирующих свои иммунокорригирующие и цитопротекторные эффекты, существенно повышает эффективность лечения. Больные ЭБВИ нуждаются в длительной реабилитации с обязательным контролем клинико-лабораторных показателей активности инфекционного процесса.
По вопросам литературы обращайтесь в редакцию.
Э. Н. Симованьян, доктор медицинских наук, профессор
В. Б. Денисенко, кандидат медицинских наук
Л. Ф. Бовтало, кандидат медицинских наук
А. В. Григорян
Ростовский ГМУ, Ростов-на-Дону
Вирус Эпштейна-Барр (ВЭБ) и цитомегаловирус — головная боль многих инфекционистов, и моя в частности. И не потому, что они вызывают опасные заболевания (зачастую как раз наоборот), а потому, что в свое время некоторые дяди и тети решили построить свой бизнес на диагностике и лечении этих инфекций. Расскажу-ка я вам, что это за вирусы такие на самом деле и почему нас всех на них разводят, как слепых котят.
Итого имеем первый факт: ЦМВ и ВЭБ — это очень распространенные заболевания, и антитела к ним можно обнаружить как минимум у половины здорового (!) населения планеты Земля, причем остаются они в крови человека на всю жизнь.
Так какие же заболевания вызывают эти вирусы? В подавляющем большинстве случаев проникновение этих возбудителей в организм (что чаще всего бывает в детском возрасте) не сопровождается никакими симптомами вообще, то есть заражение проходит бессимптомно. Вот не было явного заболевания, а мама вдруг решила (или доктор/подружка/интернет посоветовал) сдать анализ крови на антитела, а они положительные, и у мамы шок. Если же знакомство с этими вирусами сопровождается заболеванием, то проявляется оно в основном в виде банального ОРВИ (сопли+кашель+лихорадка) или инфекционного мононуклеоза (сопли+кашель+лихорадка+увеличение глоточной/небных миндалин и лимфатических узлов), или просто лихорадки неясного генеза. Все симптомы обычно проходят в течение недели, но могут тянуться и несколько недель и даже месяцев (до 6 месяцев максимум), а затем обязательно проходят.
А если все-таки заболевание себя проявило? Ну, например, появились признаки инфекционного мононуклеоза. Как это лечить? Нужны ведь противовирусные и укрепляющие препараты? К сожалению, на сегодняшний день не разработано эффективных препаратов, уничтожающих ВЭБ в организме. В пробирке — да, но когда его вводят в организм, то толку практически никакого. Что касается цитомегаловируса, то препараты есть, однако они настолько токсичные (и недешевые, кстати), что их применяют только при тяжелых формах заболевания, которые возникают исключительно при наличии иммунодефицита (СПИД, в основном); на фоне постоянного приема препаратов, подавляющих иммунитет; у людей с пересаженными органами и при врожденной цитомегаловирусной инфекции (и то не всегда).
Вырисовываем факт номер три: эффективного лечения против этих вирусов еще не нашли, и максимум, что вам реально поможет — это симптоматическая терапия.
Теперь отделяем котлеты от мух:
1) антитела к ЦМВ и ВЭБ обнаруживаются у более чем половины населения, а значит, они не настолько опасны, иначе человечество просто не дожило бы до сегодняшнего дня;
2) чаще всего у изначально здоровых детей и взрослых эти вирусы не вызывают никаких симптомов, а если и вызывают, то протекают сравнительно легко и имеют конкретную клиническую картину;
Прошу вас, не ищите проблему там, где ее нет. Ну не вызывают цитомегаловирус и ВЭБ срыгивания, дрожание подбородочка и жидкий зеленый стул у ребенка на ГВ. Но если вы все-таки решили сдать кровь на антитела к этим вирусам, то хоть проверьте, есть ли у вас показания к этому анализу (читайте выше), иначе вы рискуете найти то, что есть у 95 % населения Земли и абсолютно не связано с вашей проблемой или проблемой вашего ребенка.
Цитомегалия – это инфекционное заболевание вирусного генеза, передающееся половым, трансплацентарным, бытовым, гемотрансфузионным путем. Симптоматически протекает в форме упорной простуды. Отмечается слабость, недомогание, головные и суставные боли, насморк, увеличение и воспаление слюнных желез, обильное слюноотделение. Часто протекает бессимптомно. Опасна цитомегалия беременных: она может вызывать самопроизвольный выкидыш, врожденные пороки развития, внутриутробную гибель плода, врожденную цитомегалию. Диагностика осуществляется лабораторными методами (ИФА, ПЦР). Лечение включает противовирусную и симптоматическую терапию.
МКБ-10
Общие сведения
Другие названия цитомегалии, встречающиеся в медицинских источниках, - цитомегаловирусная инфекция (ЦМВ), инклюзионная цитомегалия, вирусная болезнь слюнных желез, болезнь с включениями. Цитомегалия является широко распространенной инфекцией, и многие люди, являясь носителями цитомегаловируса, даже не подозревают об этом. Наличие антител к цитомегаловирусу выявляется у 10—15% населения в подростковом возрасте и у 50% взрослых людей. По некоторым источникам, носительство цитомегаловируса определяется у 80% женщин детородного периода. В первую очередь это относится к бессимптомному и малосимптомному течению цитомегаловирусной инфекции.

Причины
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: при сексуальных контактах через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, иногда - при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Нередко цитомегаловирус находится в организме многие годы и может ни разу не проявить себя и не нанести вреда человеку. Проявление скрытой инфекции происходит, как правило, при ослаблении иммунитета. Угрожающую по своим последствиям опасность цитомегаловирус представляет у лиц со сниженным иммунитетом (ВИЧ-инфицированных, перенесших трансплантацию костного мозга или внутренних органов, принимающих иммунодепрессанты), при врожденной форме цитомегалии, у беременных.
Патогенез
Попадая в кровь, цитомегаловирус вызывает выраженную иммунную реакцию, проявляющуюся в выработке защитных белковых антител – иммуноглобулинов М и G (IgM и IgG) и противовирусной клеточной реакцией - образованием лимфоцитов CD 4 и CD 8. Угнетение клеточного иммунитета при ВИЧ-инфекции приводит к активному развитию цитомегаловируса и вызываемой им инфекции.
Даже при бессимптомном течении инфекции носитель цитомегаловируса является потенциально заразным для неинфицированных лиц. Исключение составляет внутриутробный путь передачи цитомегаловируса от беременной женщины плоду, который происходит в основном при активном течении процесса, и лишь в 5% случаев вызывает врожденную цитомегалию, в остальных же носит бессимптомный характер.
Симптомы цитомегалии
Врожденная цитомегалия
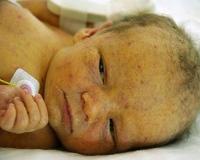
В 95% случаев внутриутробное инфицирование плода цитомегаловирусом не вызывает развития заболевания, а протекает бессимптомно. Врожденная цитомегаловирусная инфекция развивается у новорожденных, матери которых перенесли первичную цитомегалию. Врожденная цитомегалия может проявляться у новорожденных в различных формах:
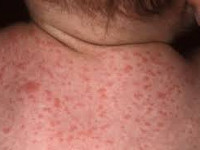
- петехиальная сыпь – мелкие кожные кровоизлияния - встречается у 60-80% новорожденных;
- недоношенность и задержка внутриутробного развития плода - встречается у 30% новорожденных;
- желтуха;
- хориоретинит – острый воспалительный процесс в сетчатке глаза, часто вызывающий снижение и полную потерю зрения.
Летальность при внутриутробном инфицировании цитомегаловирусом достигает 20-30%. Из выживших детей большая часть имеет отставание в умственном развитии или инвалидность по слуху и зрению.
Приобретенная цитомегалия у новорожденных
При инфицировании цитомегаловирусом в процессе родов (при прохождении плода по родовым путям) или в послеродовом периоде (при бытовом контакте с инфицированной матерью или грудном вскармливании) в большинстве случаев развивается бессимптомное течение цитомегаловирусной инфекции. Однако у недоношенных младенцев цитомегаловирус может вызывать затяжную пневмонию, к которой часто присоединяется сопутствующая бактериальная инфекция. Часто при поражении цитомегаловирусом у детей отмечается замедление в физическом развитии, увеличение лимфоузлов, гепатит, сыпь.
Мононуклеозоподобный синдром
У лиц, вышедших из периода новорожденности и имеющих нормальный иммунитет, цитомегаловирус может вызывать развитие мононуклеозоподобного синдрома. Течение мононуклеазоподобного синдрома по клинике не отличается от инфекционного мононуклеоза, вызываемого другой разновидностью герпесвируса – вирусом Эбштейна-Барр. Течение мононуклеозоподобного синдрома напоминает упорную простудную инфекцию. При этом отмечается:
- длительная (до 1 месяца и более) лихорадка с высокой температурой тела и ознобами;
- ломота в суставах и мышцах, головная боль;
- выраженные слабость, недомогание, утомляемость;
- боли в горле;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания, напоминающие сыпь при краснухе (обычно встречается при лечении ампициллином).
В отдельных случаях мононуклеозоподобный синдром сопровождается развитием гепатита – желтухой и повышением в крови печеночных ферментов. Еще реже (до 6% случаев) осложнением мононуклеозоподобного синдрома служит пневмония. Однако у лиц с нормальной иммунной реактивностью она протекает без клинических проявлений, выявляясь лишь при проведении рентгенографии легких.
Длительность течения мононуклеозоподобного синдрома составляет от 9 до 60 дней. Затем обычно наступает полное выздоровление, хотя на протяжении нескольких месяцев могут сохраняться остаточные явления в виде недомогания, слабости, увеличенных лимфоузлов. В редких случаях активизация цитомегаловируса вызывает рецидивы инфекции с лихорадкой, потливостью, приливами и недомоганием.
Цитомегаловирусная инфекция у лиц с ослабленным иммунитетом
Ослабление иммунитета наблюдается у лиц, страдающих синдромом врожденного и приобретенного (СПИД) иммунодефицита, а также у пациентов, перенесших пересадку внутренних органов и тканей: сердца, легкого, почки, печени, костного мозга. После пересадки органов пациенты вынуждены постоянно принимать иммунодепрессанты, ведущие к выраженному подавлению иммунных реакций, что вызывает активность цитомегаловируса в организме.
У пациентов, перенесших трансплантацию органов, цитомегаловирус вызывает поражение донорских тканей и органов (гепатит – при пересадке печени, пневмонию при пересадке легкого и т. д.). После трансплантации костного мозга у 15-20% пациентов цитомегаловирус может привести к развитию пневмонии с высокой летальностью (84-88%). Наибольшую опасность представляет ситуация, когда инфицированный цитомегаловирусом донорский материал пересажен неинфицированному реципиенту.
Цитомегаловирус поражает практически всех ВИЧ-инфицированных. В начале заболевания отмечаются недомогание, суставные и мышечные боли, лихорадка, ночная потливость. В дальнейшем к этим признакам могут присоединяться поражения цитомегаловирусом легких (пневмония), печени (гепатит), мозга (энцефалит), сетчатки глаза (ретинит), язвенные поражения и желудочно-кишечные кровотечения.
У мужчин цитомегаловирусом могут поражаться яички, простата, у женщин – шейка матки, внутренний слой матки, влагалище, яичники. Осложнениями цитомегаловирусной инфекции у ВИЧ-инфицированных могут стать внутренние кровотечения из пораженных органов, потеря зрения. Множественное поражение органов цитомегаловирусом может привести к их дисфункции и гибели пациента.
Диагностика
С целью диагностики цитомегаловирусной инфекции проводится лабораторное обследование. Постановка диагноза цитомегаловирусной инфекции основана на выделении цитомегаловируса в клиническом материале или при четырехкратном повышении титра антител.
- ИФА-диагностика. Включает определение в крови специфических антител к цитомегаловирусу - иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении цитомегаловирусом либо о реактивации хронической ЦМВИ. Определение высоких титров IgМ у беременных может угрожать инфицированию плода. Повышение IgМ выявляется в крови спустя 4-7 недель после заражения цитомегаловирусом и наблюдается на протяжении 16-20 недель. Повышение иммуноглобулинов G развивается в период затухания активности цитомегаловирусной инфекции. Их наличие в крови говорит о присутствии цитомегаловируса в организме, но не отражает активности инфекционного процесса.
- ПЦР-диагностика. Для определения ДНК цитомегаловируса в клетках крови и слизистых (в материалах соскобов из уретры и цервикального канала, в мокроте, слюне и т. д.) используется метод ПЦР-диагностики (полимеразной цепной реакции). Особенно информативно проведение количественной ПЦР, дающей представление об активности цитомегаловируса и вызываемого им инфекционного процесса.
В зависимости от того, какой орган поражен цитомегаловирусной инфекцией, пациент нуждается в консультации гинеколога, андролога, гастроэнтеролога или других специалистов. Дополнительно по показаниям проводится УЗИ органов брюшной полости, кольпоскопия, гастроскопия, МРТ головного мозга и другие обследования.
Лечение цитомегаловирусной инфекции
Неосложненные формы мононуклеазоподобного синдрома не требует специфической терапии. Обычно проводятся мероприятия, идентичные лечению обычного простудного заболевания. Для снятия симптомов интоксикации, вызываемой цитомегаловирусом, рекомендуется пить достаточное количество жидкости.
Лечение цитомегаловирусной инфекции у лиц, входящих в группу риска, проводится противовирусным препаратом ганцикловиром. В случаях тяжелого течения цитомегалии ганцикловир вводится внутривенно, т. к. таблетированные формы препарата обладают лишь профилактическим эффектом в отношении цитомегаловируса. Поскольку ганцикловир обладает выраженными побочными эффектами (вызывает угнетение кроветворения - анемию, нейтропению, тромбоцитопению, кожные реакции, желудочно-кишечные расстройства, повышение температуры и ознобы и др.), его применение ограничено у беременных, детей и у людей, страдающих почечной недостаточностью (только по жизненным показаниям), он не используется у пациентов без нарушения иммунитета.
Для лечения цитомегаловируса у ВИЧ-инфицированных наиболее эффективен препарат фоскарнет, также обладающий рядом побочных эффектов. Фоскарнет может вызывать нарушение электролитного обмена (снижение в плазме крови магния и калия), изъязвление половых органов, нарушение мочеиспускания, тошноту, поражение почек. Данные побочные реакции требуют осторожного применения и своевременной корректировки дозы препарата.
Прогноз
Особую опасность цитомегаловирус представляет при беременности, так как может провоцировать выкидыш, мертворождение или вызывать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с герпесом, токсоплазмозом и краснухой, относится к числу тех инфекций, обследоваться на которые женщины должны профилактически, еще на этапе планирования беременности.
Профилактика
Особенно остро вопрос профилактики цитомегаловирусной инфекции стоит у лиц, входящих в группу риска. Наиболее подвержены инфицированию цитомегаловирусом и развитию заболевания ВИЧ-инфицированные (особенно больные СПИДом), пациенты после трансплантации органов и лица с иммунодефицитом иного генеза.
Неспецифические методы профилактики (например, соблюдение личной гигиены) неэффективны в отношении цитомегаловируса, так как заражение им возможно даже воздушно-капельным путем. Специфическая профилактика цитомегаловирусной инфекции проводится ганцикловиром, ацикловиром, фоскарнетом среди пациентов, входящих в группы риска. Также для исключения возможности инфицирования цитомегаловирусом реципиентов при пересадке органов и тканей необходим тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Цитомегаловирусная инфекция у детей — это инфекционное заболевание, которое вызвано цитомегаловирусом и поражает слюнные железы, внутренние органы, ЦНС. В детстве патология чаще возникает при трансплацентарном или интранатальном заражении. Локализованные формы проявляются сиаладенитом, гепатитом, нефритом и т. д., распространенный вариант инфекции характеризуется поражением головного мозга, легких, почек и органов ЖКТ. Диагностика предполагает идентификацию возбудителя цитологическими, гистологическими, серологическими и молекулярно-биологическими методами. Лечение цитомегаловирусной болезни проводится специфическим иммуноглобулином и противовирусными препаратами.
МКБ-10
Общие сведения
Заражение цитомегаловирусной инфекцией (ЦМВИ) наблюдается у 20%‒60% всего детского населения, но в большинстве случаев оно протекает бессимптомно. Внутриутробное инфицирование вирусом от больной матери происходит в 30-50% случаев, при этом до 18% младенцев после рождения имеют клинические симптомы. Учитывая полиморфизм клинической картины, ранняя диагностика и лечение у детей затруднены. Цитомегаловирусная инфекция представляет серьезную опасность, особенно для плода и новорожденного, у которых заболевание, как правило, вызывает необратимые осложнения.

Причины
Болезнь вызвана герпесвирусом 5 типа — Cytomegalovirus hominis. Он имеет 6 штаммов: Davis, AD 169, Kerr, C-87, Esp, Towne, причем ребенок может быть инфицирован сразу несколькими подтипами возбудителя. Цитомегаловирус (ЦМВ) имеет ДНК-геном, отличается медленной репликацией и сравнительно низкой вирулентностью. Он термолабилен, уничтожается при температуре более 56°С, но длительно сохраняет жизнеспособность в комнатных условиях.
При врожденной ЦВМИ передача вируса к плоду происходит трансплацентарно, при перинатальной инфекции — путем контакта с вагинальными выделениями матери, грудным молоком или препаратами крови. Риск заражения увеличивается, если мать с острой формой болезни не получает специфическое лечение. В постнатальном периоде ребенок чаще всего заражается от ближайших родственников и сверстников воздушно-капельным или контактно-бытовым путем.
Патогенез
Попадая в кровь, вирус реплицируется в лейкоцитах, моноцитах и макрофагах и в дальнейшем он пожизненно сохраняется в лимфоцитарных органах. Зачастую процесс выражается в виде латентной инфекции, при которой у ребенка нет симптомов, и ему не требуется лечение. Активность цитомегаловируса зависит от состояния иммунитета: при физиологической иммунной недостаточности, которая наблюдается у детей раннего возраста, риск манифестной цитомегаловирусной инфекции возрастает в разы.
Классификация
В детской инфектологии различают врожденную (внутриутробную) и приобретенную формы патологии. По течению инфекция бывает острой (до 3 месяцев), подострой (3-6 месяцев), затяжной (6-12 месяцев) и хронической (более 1 года). По клиническим признакам выделяют локализованный (сиаладенит, нефрит, гепатит, энцефалит) и генерализованный вариант. С учетом тяжести течения цитомегаловирусную болезнь делят на 3 степени:
- Легкая. Отличается незначительными патоморфологическими изменениями во внутренних органах, которые не сказываются на их функциональной активности.
- Среднетяжелая. Проявляется выраженными органическими поражениями в сочетании с клиническими симптомами и расстройством функции некоторых внутренних органов.
- Тяжелая. Манифестирует тяжелыми органическими патологиями, резко выраженной интоксикацией и генерализованным характером поражения.
Симптомы
Врожденная ЦМВИ
У пациентов с манифестной врожденной форме цитомегаловирусной болезни признаки наблюдаются с первых дней жизни. Типичный комплекс симптомов у новорожденных детей включает недоношенность и/или низкую массу тела, поражение гепатобилиарной системы (увеличение печени, желтуха, гепатиты и циррозы), лимфаденопатии и геморрагическую сыпь на коже. Если инфицирование произошло на ранних сроках беременности, ребенок рождается с аномалиями — микроцефалией, гипоплазией легких, атрезией пищевода.
Приобретенная ЦМВИ
Приобретенная цитомегаловирусная болезнь обычно протекает в субклинической или латентной форме, когда у ребенка возникают гриппоподобные симптомы, субфебрильная температура без видимой причины. После заражения инфекция может длительное время себя не проявлять и давать обострения при снижении иммунного статуса, действии неблагоприятных эндо- или экзогенных факторов.
Течение манифестной приобретенной формы напоминает инфекционный мононуклеоз. У ребенка внезапно появляется слабость, повышается температура, беспокоят недомогание, головные боли, отсутствует аппетит. Позже присоединяются сильные боли в горле, увеличиваются подчелюстные и шейные лимфоузлы. Если цитомегаловирусная инфекция проявляется сиаладенитом, наблюдается резкое увеличение и болезненность слюнных желез на фоне фебрильной лихорадки.
Генерализованная ЦМВИ
При генерализованном варианте течения инфекции у детей поражается бронхолегочная система (пневмонии, дыхательная недостаточность), ЖКТ (энтероколит, мальабсорбция), печень (желтуха, цитомегаловирусный гепатит, билиарный цирроз). Особенно опасно вовлечение в процесс нервной системы, что проявляется судорожным синдромом, парезами и параличами, задержкой психомоторного развития.
Осложнения
Поражение клеток при цитомегаловирусной болезни создает благоприятные условия для возникновения аутоиммунных поражений — системной красной волчанки, рассеянного склероза, гломерулонефрита. Иногда после малосимптомной врожденной цитомегаловирусной инфекции осложнения наблюдаются в отдаленном периоде (в возрасте ребенка 2-5 лет). В основном они проявляются неврологическими расстройствами и поражением органов чувств.
Диагностика
Цитомегаловирусная инфекция отличается многообразием клинических признаков и часто протекает под маской других патологий, что затрудняет работу детского инфекциониста. На первичном приеме, помимо стандартного физикального осмотра, врач собирает детальный акушерский анамнез, чтобы выявить факторы риска антенатального инфицирования. Диагноз ЦМВИ правомочен только при лабораторном подтверждении, для чего используют следующие методы:
Инструментальные методы подбираются соответственно форме заболевания. Для оценки структурно-функциональных особенностей печени и билиарного тракта назначают УЗИ органов брюшной полости. КТ и МРТ головного мозга информативны для выявления врожденных пороков и кальцификатов. Рентгенография ОГК необходима при симптомах дыхательных расстройств. По показаниям ребенка направляют на консультации к профильным специалистам— кардиологу, неврологу, отоларингологу.
Лечение цитомегаловирусной инфекции у детей
Препаратом выбора у новорожденных и детей первого года жизни является специфический антицитомегаловирусный иммуноглобулин, который имеет повышенную концентрацию IgG. Лечение начинают при манифестных формах заболевания и проводят по схеме: вначале вводится высокая доза препарата, а спустя 9-10 дней дозировку постепенно уменьшают, контролируя степень ответа на терапию и активность процесса.
В старшем возрасте перечень препаратов, применяемых при цитомегаловирусной инфекции, значительно расширяется. Лечение включает противовирусные средства из группы нуклеозидов и нуклеотидов (ганцикловир, валганцикловир), производные ортофосфорной кислоты (фоскарнет). При легкой и среднетяжелой формах назначают интерфероны, иммуностимуляторы.
Для купирования интоксикации показано обильное питье (при легких формах), при среднетяжелых и тяжелых клинических вариантах рекомендована инфузионная терапия. Патогенетическая терапия подбирается в соответствии с характером течения болезни и может включать пищеварительные ферменты, ингибиторы протеиназ, гемостатики. Для предупреждения вторичных бактериальных осложнений используют антибиотики (макролиды, цефалоспорины, гликопептиды).
Прогноз и профилактика
При малосимптомных приобретенных вариантах цитомегаловирусная болезнь протекает без осложнений, зачастую у ребенка выявляется только латентное носительство. Угрозу для жизни и здоровья представляют тяжелые генерализованные инфекции, которые в 50-60% случаев сопровождаются осложнениями, несмотря на проводимое лечение. Особо опасно поражение цитомегаловирусом для детей с иммунодефицитными состояниями.
Основу профилактики врожденной ЦМВИ составляет обязательное лабораторное обследование женщин на носительство цитомегаловируса, которое проводится при планировании зачатия и во время беременности. Если в семье есть пациент с цитомегаловирусной инфекцией, необходимо ограничить его общение с ребенком и обеспечить лечение. Карантинно-изоляционные мероприятия в отношении заболевших и контактных лиц не производятся.
2. Клинические рекомендации (протокол лечения) оказания медицинской помощи детям больным цитомегаловирусной инфекцией. — 2015.
Читайте также:

