Вибрион холеры имеет клеточное строение
Обновлено: 06.05.2024
Холера - инфекция вызванная Vibrio cholerae: диагностика, лечение, профилактика
Вибрионы — мелкие грамотрицательные изогнутые подвижные оксидаза-положительные палочки. Существует более восьми видов вибрионов. Для человека наиболее патогенны Vibrio cholerae и V. parahaemolyticus.
Выделяют серогруппы холерного вибриона (Vibrio cholerae), различающиеся по строению соматического О-антигена. Холеру вызывают только O1 и 0139 серогруппы. Вибрионы выживают в солянокислой среде желудка, проникают через слизь к эпителию тонкой кишки, прикрепляются к нему посредством GM1-ганглиозида и начинают вырабатывать полимерный белковый токсин (холерный токсин), стимулирующий повышенный синтез внутриклеточной аденилатциклазы, в результате чего увеличивается секреция воды и электролитов в просвет кишечника. Эпидемиология инфекции вызванной Vibrio cholerae.
Холерой болеют исключительно люди. Заболевание передаётся через заражённую воду и пищу (особенно морские продукты). Чаще всего инфекцию регистрируют в развивающихся странах, где население в недостаточной мере соблюдает санитарные нормы и отсутствует необходимое количество безопасных источников водоснабжения. Эпидемия часто возникает при изменении условий окружающей среды, при этом деятельность человека (войны, исход беженцев, миграция населения) способствует распространению инфекции. Периодически возникали пандемии холеры, в настоящее время идёт седьмая пандемия.
Возбудитель холеры - Vibrio cholerae
Клинические признаки холеры. Большинство заболеваний, вызываемых V. cholerae, протекает в лёгкой форме или бессимптомно. Клиника холеры характеризуется появлением обильного безболезненного жидкого стула (до 20 л в день), который может сопровождаться рвотой. Со временем развивается тяжёлое обезвоживание организма, осложняющееся электролитными нарушениями.
Диагностика инфекции вызванной Vibrio cholerae. В эндемичных регионах диагностика заболевания основана на данных клинической картины. Методом лабораторной экспресс-диагностики холеры является иммобилизация вибрионов группоспецифической антисывороткой в копрофильтрате. Для культивирования микроорганизма используют селективные среды, содержащие цитрат тиосульфата, соли жёлчи и сахарозу или обогащенный щелочной пептонный бульон.
Для подтверждения диагноза исследуют также биохимические свойства возбудителя и проводят серотипирование.
Лечение холеры. Проводят пероральную регидратацию растворами солей и глюкозы; тяжелобольным пациентам рекомендовано внутривенное введение жидкости. Применяют тетрациклин, ципрофлоксацин (коротким курсом), которые снижают тяжесть клинических проявлений.
Профилактика и контроль инфекции вызванной Vibrio cholerae. Для профилактики эпидемий холеры большое значение имеет санитарное просвещение населения и использование безопасных источников водоснабжения. В настоящее время проходят клинические испытания нескольких вакцин (живых ослабленных; вакцин, состоящих их субъединиц холерного токсина).
Видео эпидемии холеры и их значение
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биохимические свойства холеры. Биовары холеры. Антигены холеры. Антигенная структура холеры. Схемы Хайберга. Серогруппы холеры.
Холерные вибрионы сбраживают с образованием кислоты многие углеводы (глюкозу, сахарозу, мальтозу, маннит, лактозу, гликоген, крахмал и др.). Ферментация маннозы, сахарозы и арабинозы (так называемая триада Хёйберга) имеет диагностическое значение.
По способности разлагать эти три углевода все вибрионы холеры разделяют на 6 групп. Холерные вибрионы разлагают только маннозу и сахарозу и принадлежат к 1-й группе Хейберга.
Бактерии холеры этой группы обладают плазмокоагулирующим (свёртывают плазму кролика) и фибринолитическим (разжижают свёрнутую сыворотку по Леффлеру) свойствами.
Холерные вибрионы свёртывают молоко и разлагают другие белки и их дериваты до аммиака и индола; H2S не образуют, восстанавливают нитраты и образуют индол (эту способность учитывают в нитрозоиндоловой реакции, также известной как холера-рот реакция).
Бактерии серовара Бенгал устойчивы к полимиксину и не проявляют гемолитической активности.
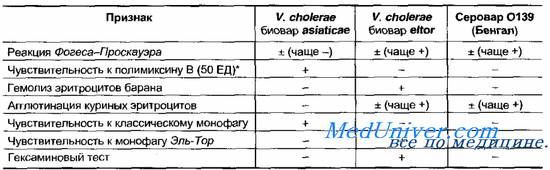
Таблица 18—4. Дифференциальные признаки возбудителей холеры
Антигены холеры. Антигенная структура холеры. Схемы Хайберга. Серогруппы холеры.
У холерных вибрионов выделяют термостабильные О- и термолабильные Н-Аг.
О-антигены. По структуре О-антигены выделяют 139 серогрупп; возбудители холеры относят к 01 группе. Принадлежность к ней отличает их от ходероподобных и парахолерных вибрионов.
Поэтому, несмотря на возможные биохимические различия, при исследовании на холеру обязательно проводят типирование 01-антисывороткой. О-Аг 01 группы холерных вибрионов неоднороден и включает А, В и С компоненты, разные сочетания которых присущи сероварам Огава (АВ). Инаба (АС) и Хикоджима (ABC).
Эти свойства используют в качестве эпидемиологического маркёра для дифференцирования очагов по возбудителям холеры, хотя иногда от одного больного можно выделить бактерии разных сероваров. R-формы, а также слизистые М-формы (с изменённой структурой О-Аг) не агглютинируются О-антисыворотками, для идентификации OR- и R-диссоциатов используют OR-антисыворотки.
Бактерии серовара холеры 0139 не агглютинируются видоспеиифической О1 и типоспецифическими Огава-, Инаба- и RO-сыворотками.
Поскольку холероподобные вибрионы также не агглютинируются 01-антисывороткой, их обозначают как неагглютинирующиесн (НАГ) вибрионы.
Н-антигены — общие антигены для большой группы бактерий, поэтому их разделяют на А и В группы. В группу А входят холерные вибрионы; в группу В — вибрионы, биохимически отличные от холерных. Вибрионы группы В имеют неоднородную структуру О-Аг, их разделяют на 6 серологических подгрупп, состав которых совпадает с разделением на 6 биохимических групп схемы Хайберга.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Холера - инфекция вызванная Vibrio cholerae: диагностика, лечение, профилактика
Вибрионы — мелкие грамотрицательные изогнутые подвижные оксидаза-положительные палочки. Существует более восьми видов вибрионов. Для человека наиболее патогенны Vibrio cholerae и V. parahaemolyticus.
Выделяют серогруппы холерного вибриона (Vibrio cholerae), различающиеся по строению соматического О-антигена. Холеру вызывают только O1 и 0139 серогруппы. Вибрионы выживают в солянокислой среде желудка, проникают через слизь к эпителию тонкой кишки, прикрепляются к нему посредством GM1-ганглиозида и начинают вырабатывать полимерный белковый токсин (холерный токсин), стимулирующий повышенный синтез внутриклеточной аденилатциклазы, в результате чего увеличивается секреция воды и электролитов в просвет кишечника. Эпидемиология инфекции вызванной Vibrio cholerae.
Холерой болеют исключительно люди. Заболевание передаётся через заражённую воду и пищу (особенно морские продукты). Чаще всего инфекцию регистрируют в развивающихся странах, где население в недостаточной мере соблюдает санитарные нормы и отсутствует необходимое количество безопасных источников водоснабжения. Эпидемия часто возникает при изменении условий окружающей среды, при этом деятельность человека (войны, исход беженцев, миграция населения) способствует распространению инфекции. Периодически возникали пандемии холеры, в настоящее время идёт седьмая пандемия.

Возбудитель холеры - Vibrio cholerae
Клинические признаки холеры. Большинство заболеваний, вызываемых V. cholerae, протекает в лёгкой форме или бессимптомно. Клиника холеры характеризуется появлением обильного безболезненного жидкого стула (до 20 л в день), который может сопровождаться рвотой. Со временем развивается тяжёлое обезвоживание организма, осложняющееся электролитными нарушениями.
Диагностика инфекции вызванной Vibrio cholerae. В эндемичных регионах диагностика заболевания основана на данных клинической картины. Методом лабораторной экспресс-диагностики холеры является иммобилизация вибрионов группоспецифической антисывороткой в копрофильтрате. Для культивирования микроорганизма используют селективные среды, содержащие цитрат тиосульфата, соли жёлчи и сахарозу или обогащенный щелочной пептонный бульон.
Для подтверждения диагноза исследуют также биохимические свойства возбудителя и проводят серотипирование.
Лечение холеры. Проводят пероральную регидратацию растворами солей и глюкозы; тяжелобольным пациентам рекомендовано внутривенное введение жидкости. Применяют тетрациклин, ципрофлоксацин (коротким курсом), которые снижают тяжесть клинических проявлений.
Профилактика и контроль инфекции вызванной Vibrio cholerae. Для профилактики эпидемий холеры большое значение имеет санитарное просвещение населения и использование безопасных источников водоснабжения. В настоящее время проходят клинические испытания нескольких вакцин (живых ослабленных; вакцин, состоящих их субъединиц холерного токсина).
Видео эпидемии холеры и их значение
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
РФ, Ростов-на-Дону, 2014
Примечание. * — нуклеотидные последовательности геномов, секвенированные авторами; ** — нуклеотидные последовательности геномов, взятые из NCBI GenBank.
Определение продукции холерного токсина проводили иммуноферментным методом GM1-ELISA [17]. Разведения очищенного CT (Sigma chemicals,США) известной концентрации использовали для построения стандартной кривой и оценки СТ в образцах. Для постановки ELISA применяли кроличьи антитоксические антитела и антикроличий IgG, конъюгированный с пероксидазой хрена (Gibco-BRL). Эксперименты ставили в 3-кратной повторности. Для статистической обработки данных применяли программу Microsoft Excel 2010.
Выделение и очистку геномной ДНК бактерий проводили с использованием коммерческого набора Axy Prep Bacterial Genomic DNA Miniprep Kit в соответствии с протоколом производителя. Клетки предварительно обрабатывали мертиолятом натрия до конечной концентрации 1:10 000 (0,01%) и прогревали при 56 °C в течение 30 мин.
Таблица 2. Последовательности олигонуклеотидных праймеров и зондов, использованных в работе
Нуклеотидная последовательность (5’-3’)
Результаты и обсуждение
Сравнительный анализ структуры генома профага CTXφ и острова патогенности VPI-1 V. cholerae О1 биовара Эль Тор с разной вирулентностью. Ранее нами при экспериментальном моделировании были выявлены структурные изменения генома вирулентных штаммов после их пребывания в водной среде, которые выражались в потере профага CTXφ с генами, кодирующими CT [21]. Такие штаммы утрачивали вирулентность. Для поиска возможных генетических изменений у штаммов 89 и 147 мы провели анализ нуклеотидных последовательностей участков их геномов, обязательных для проявления вирулентности, — профага CTXφ, несущего структурные гены CT (оперон ctxAB), а также острова патогенности VPI-1 со структурными генами tcpA-F, кодирующими TCP, и тремя основными регуляторными генами toxT, tcpP и tcpH, контролирующими через регуляторный каскад экспрессию ctxAB и tcpA-F. Оказалось, что исследуемые штаммы содержали в хромосоме интактные геномы профага CTXφ со всем набором генов основных (CT) и дополнительных (Ace, Zot) токсинов, а также ОП VPI-1 и не отличались по этим свойствам от референсного вирулентного штамма N16961 (рис. 2, а—в). При сравнении нуклеотидных последовательностей геномов этих авирулентных штаммов с таковыми других вирулентных изолятов V. cholerae О1 биовара Эль Тор 28, Р18899 и 76, изолированных от больных холерой в 1994, 2006 и 2011 гг. соответственно, было установлено, что штаммы 89 и 147 относятся к геновариантам возбудителя, возникшим в начальный период их формирования. Геном их профага CTXφ содержал в опероне ctxAB аллель ctxB1 холерных вибрионов классического биовара, что характерно для вирулентных генетически измененных штаммов 28 и Р18899, возникших в начале 90-х годов прошлого столетия (см. рис. 2, б—д). В то же время нуклеотидная последовательность их гена tcpA, кодирующего основную субъединицу ТСР, была идентична таковой типичных штаммов холерных вибрионов Эль Тор (см. рис. 2, а—в). Вместе с тем по этим свойствам авирулентные штаммы 89 и 147 отличались от вирулентного изолята 76, содержащего другие аллельные варианты генов ctxB и tcpA, а именно ctxB7 и tcpA CIRS , появившиеся у возбудителя на более поздних этапах эволюции (см. рис. 2, б, в, е). Анализ нуклеотидной последовательности регуляторных генов toxT, tcpP и tcpH из ОП VPI-1, контролирующих активность ключевых структурных генов вирулентности ctxAB и tcpA-F, показал идентичность их структуры у авирулентных и вирулентных штаммов. Таким образом, предположение о том, что неспособность изучаемых штаммов вызывать развитие холерной инфекции могла быть следствием изменений структуры мобильных элементов, несущих ключевые гены вирулентности, присущих как типичным штаммам, так и геновариантам возбудителя, не подтвердилось.

Рис. 2. Схема структуры генома профага СТХφ, острова патогенности VPI-I и глобального регуляторного гена toxR авирулентных и вирулентных штаммов V. cholerae O1 биовара Эль Тор с генотипом ctxA + tcpA + .
ctxAB и tcpA-F — структурные ключевые гены вирулентности, кодирующие CT и TCP соответственно; ctxB1, ctxB3, ctxB7 — аллели гена ctxB, кодирующего B-субъединицу CT; tcpA ET и tcpA CIRS — аллели гена tcpA, кодирующего основную субъединицу TCP; toxR — глобальный регуляторный ген интактный (белый цвет) или мутантный (черный).
Обнаружение мутации в глобальном регуляторном гене toxR. Поскольку, помимо генов toxT, tcpP и tcpH, одним из основных компонентов генной сети вирулентности, координированно регулирующей экспрессию генов СТ и TCP, является глобальный регуляторный ген toxR, расположенный в коровой части генома, можно было ожидать, что одной из причин авирулентности штаммов 89 и 147 могло быть изменение в его структуре. Это предположение основано на том, что трансмембранный сенсорный ДНК-связывающийся белок ToxR (мол. масса 32,5 кД) на уровне транскрипции осуществляет позитивный контроль экспрессии одного из основных регуляторных генов вирулентности toxT, продукт которого — транскрипционный активатор ToxT непосредственно обеспечивает биосинтез двух критических факторов вирулентности TCP и CT (см. рис. 1, а). Действительно, в результате анализа нуклеотидной последовательности гена toxR у обоих штаммов обнаружили делецию одного нуклеотида — тимина (T) в позиции 357, что привело к замене смыслового кодона TTG, кодирующего лейцин, на стоп-кодон TGA (рис. 3, а). Такая мутация обусловила утрату 176 аминокислот (aa) из цитоплазматического (64 аа), трансмембранного (16 aa) и периплазматического (96 aa) доменов (рис. 3, б), присутствующих в интактном белке ToxR вирулентного референсного штамма V. cholerae О1 биовара Эль Тор N16961, содержащего 294 aa (цитоплазматический домен 182 aa, трансмембранный домен 16 aa, периплазматический домен 96 aa) [22]. В то же время нуклеотидная последовательность гена toxR вирулентных клинических штаммов Р18899 и 76 была идентична таковой референсного штамма возбудителя холеры N16961 (см. рис. 3, а).

Рис. 3. Структура регуляторного гена toxR авирулентных и вирулентных штаммов V. cholerae O1 биовара Эль Тор ctxA + tcpA + .
а — нуклеотидная последовательность гена toxR авирулентных (89 и 147) и вирулентных (Р18899, 76 и N16961) штаммов; у авирулентных штаммов серым цветом обозначена делеция одного нуклеотида в гене toxR, приводящая к образованию стоп-кодона TGA; б — аминокислотная последовательность белка ToxR — продукта интактного (референсный штамм N16961) и мутантного (штаммы 89 и 147) гена toxR.
Образование дефектного белка ToxR, являющееся следствием обнаруженной мутации в нуклеотидной последовательности гена toxR, могло привести к потере его функции. Для проверки этого предположения мы провели сравнительный анализ продукции белков внешней мембраны OmpU и OmpT в мутантных по гену toxR авирулентных штаммах и вирулентных изолятов с интактным геном toxR. Если у авирулентных штаммов, несущих мутацию в гене toxR, действительно изменяется активность кодируемого им белка, то эти штаммы должны отличаться от вирулентных продукцией белка OmpU (38,0 kD), для экспрессии которого требуется интактный белок ToxR, а также белка OmpT (42,0 кД), экспрессия которого негативно регулируется непосредственно ToxR [23, 24] (см. рис. 1, б). В результате было показано, что мутация в гене toxR действительно привела к тому, что в отличие от клинического вирулентного штамма 76 с интактным геном toxR, взятого в качестве контроля, авирулентные штаммы 89 и 147 утратили белок OmpU, но у них появился другой белок — OmpT (рис. 4, дорожки 3—5). Таким образом, обнаруженные изменения продукции двух белков внешней мембраны, гены которых, ompT и ompU, находятся под непосредственным контролем гена toxR, явно связаны с потерей функции белка ToxR у авирулентных штаммов в результате нарушения последовательности гена toxR.

Рис. 4. Электрофореграмма белков внешней мембраны OmpU и OmpT авирулентных и вирулентных штаммов V. cholerae O1 биовара Эль Тор ctxA + tcpA + .
M — маркер молекулярной массы, 1, 3 — вирулентные штаммы Дакка 35 Tox + и 76 соответственно, 2, 4, 5 — авирулентные штаммы Дакка 35 Tox – , 89 и 147 соответственно.
Влияние мутации в глобальном регуляторном гене toxR на уровень транскрипции ключевых структурных и регуляторных генов вирулентности. Потеря функции белка ToxR вследствие однонуклеотидной делеции в гене toxR, обусловившей образование стоп-кодона, могла изменить активность другого центрального регуляторного гена toxT, непосредственным транскрипционным активатором которого является белок ToxR. Методом ОТ ПЦР в реальном времени мы сравнили уровень транскрипции генов toxR и toxT у мутантных по гену toxR штаммов 147 и 89 с таковыми вирулентного штамма 76, взятого в качестве контрольного. В результате было выявлено статистически значимое снижение уровня транскрипции этих генов у мутантных штаммов 147 и 89. Активность их гена toxR снизилась в 1,5—2,0 раза (рис. 5, а). Наиболее выраженным было понижение уровня транскрипции гена toxT — в 5,3 раза у штамма 147 и в 5,6 раза у штамма 89 (см. рис. 5, д). Поскольку белковый продукт гена toxT является прямым позитивным регулятором структурных генов ctxAB и tcpA-F, кодирующих CT и TCP, резкое снижение его транскрипции могло привести к существенному изменению экспрессии генов этих ключевых факторов вирулентности. Для подтверждения этого предположения был определен уровень транскриции генов ctxA, ctxB и tcpA у изученных штаммов. Оказалось, что их транскрипционная активность была значительно снижена в сравнении с таковой вирулентного штамма 76. Наиболее существенно снизился уровень транскрипции генов холерного токсина — гена ctxA в 33,0—50,0 раза и гена ctxB в 33,0—100,0 раза (см. рис. 5, б, в). Что касается гена tcpA, кодирующего основную субъединицу TCP, то его активность была также снижена — в 7,5 раза у штамма 147 и в 10,0 раза у штамма 89 по сравнению с контрольным штаммом 76 (см. рис. 5, г). Таким образом, полученные данные свидетельствуют о том, что транскрипция изученных регуляторных и структурных генов вирулентности действительно была заметно снижена у исследуемых штаммов V. cholerae 147 и 89, содержащих однонуклеотидную делецию в регуляторном гене toxR, которая привела к сдвигу рамки считывания и утрате функции глобального регулятора ToxR.

Рис. 5. Относительный уровень транскрипции ключевых структурных (ctxA, ctxB, tcpA) и регуляторных (toxR, toxT) генов, входящих в состав генной сети вирулентности, авирулентных штаммов V. cholerae O1 биовара Эль Тор 147 и 89 ctxA + tcpA + d в сравнении с вирулентным штаммом 76 ctxA + tcpA + .
По оси абсцисс — гены, входящие в сеть вирулентности V. cholerae 01 биовара Эль Тор. По оси ординат — уровень транскриптов генов в относительных единицах.
Следовало также ожидать, что следствием этого события будет резкое понижение или отсутствие у авирулентных штаммов продукции CT, определяющего развитие специфического холерогенного синдрома у экспериментальных животных. Действительно, по данным иммуноферментного метода GM1 ELISA, продукция токсина у штаммов 89 и 147 составляла 0,01 и 0,02 мкг/мл соответственно, тогда как взятые для сравнения вирулентные клинические штаммы 28, 76 и 153 продуцировали 0,43—0,63 мкг/мл этого белка. Полученные данные позволили заключить, что утрата функции регуляторного белка ToxR из-за мутации в гене toxR, обусловившая каскадное снижение мРНК-структурных и регуляторных генов вирулентности штаммов 147 и 89, привела к резкому снижению продукции CT, что и явилось причиной их авирулентности.
Филогенетическая связь авирулентных и вирулентных штаммов V. cholerae биовара Эль Тор. Обнаружение авирулентных штаммов V. cholerae биовара Эль Тор, содержащих в геноме все известные генетические маркеры эпидемически опасных штаммов, ставит вопрос об их происхождении. Для выяснения филогенетических связей штаммов 147 и 89 с вирулентными штаммами были использованы нуклеотидные последовательности их полных геномов, а также 19 вирулентных штаммов, секвенированных нами (14 штаммов) или взятых из базы данных NCBI GenBank (5). Выбранные вирулентные штаммы относились к типичным, вызвавшим начало 7-й пандемии холеры, или к разным геновариантам, возникшим на различных этапах эволюции генома возбудителя. Филогенетический анализ и построение дендрограммы проводили на основе выявления коровых SNPs в полногеномных нуклеотидных последовательностях этих штаммов. При сравнении с референсным типичным штаммом возбудителя холеры Эль Тор V. cholerae N16961 в геноме взятых штаммов было найдено 392 SNPs, на основе которых проведено построение дендрограммы Maksimum Parsinomy (рис. 6). Согласно представленным данным, штаммы образовали три группы, отражающие этапы эволюционных преобразований генома патогена (см. рис. 6). В первую группу вместе с референсным N16961 вошли типичные штаммы, отличающиеся от него лишь на 48—64 SNPs, что подтверждает их клональное происхождение. Геноварианты возбудителя образовали две отдельные группы — вторую и третью. Вторая группа состояла из вирулентных штаммов генетически измененного возбудителя с аллелем ctxB1, возникших в ранний период их формирования (1991—1995 гг.) и отличалась от типичного референсного штамма из первой группы на 102—121 SNPs. Третья группа была представлена новыми вариантами возбудителя, сформированными в более поздний период (2001—2014 гг.) и несущими, согласно ранее полученным данным, дополнительные мутации в генах вирулентности и пандемичности — новые аллели ключевых и дополнительных генов патогенности ctxB (ctxB7), tcpA (tcpA CIRS ), rtxA (rtxA4) и протяженную делецию в VSP-II (см. рис. 6). Эта группа имела более значимые отличия от референсного штамма, составляющие 117—160 SNPs. Что касается изучаемых штаммов 147 и 89, содержащих в структурных генах холерного токсина аллель ctxB1, то, несмотря на отличия в вирулентности и выделение в более поздний период (2010 г.), эти штаммы оказались филогенетически близкими с геновариантами второй группы, различаясь между собой на три SNPs, что указывает на их клональное происхождение. Тем не менее геномы этих штаммов имели 21—44 SNPs, отличающих их от геномов других штаммов, входящих в состав этой группы, и 14 SNPs, специфичных только для них. Распределенные по геному в разных позициях, эти уникальные SNPs были связаны с изменением аминокислотной последовательности белков, выполняющих в клетке разные функции (транспорт различных веществ, биосинтез полисахаридов, устойчивость к антибиотикам) (табл. 3). Пока неясно, как влияют эти замены на функциональность указанных белков. Тем не менее, вполне возможно, что эти мутации могут быть значимы для функционирования генов вирулентности. Таким образом, установленные филогенетические связи позволяют полагать, что изученные авирулентные штаммы, сформированные, видимо, на эндемичной по холере территории, являются производными вирулентных геновариантов возбудителя, появившихся в начальный период их формирования. Возникновение мутации в глобальном регуляторном гене toxR, обусловившей авирулентность геновариантов, является, возможно, следствием их адаптации к стрессовым воздействиям водной среды.

Рис. 6. Филогенетическое дерево вирулентных и авирулентных штаммов V. cholerae O1 биовара Эль Тор ctxA + tcpA + , построенное методом maximum parsimony tree по данным анализа коровых SNPs в полногеномных последовательностях 21 штамма.
Овалами выделены группы типичных штаммов (1), геновариантов, возникших в ранний период (2), и геновариантов, выделенных в более поздний период эволюции возбудителя (3). В скобках указано количество SNP, отличающее каждую группу от референсного штамма V. cholerae N16961.
Таблица 3. Уникальные несинонимичные однонуклеотидные замены (SNPs) в локусах авирулентных штаммов V. cholerae биовара Эль Тор 147 и 89 ctxA + tcpA +
Биохимические свойства холеры. Биовары холеры. Антигены холеры. Антигенная структура холеры. Схемы Хайберга. Серогруппы холеры.
Холерные вибрионы сбраживают с образованием кислоты многие углеводы (глюкозу, сахарозу, мальтозу, маннит, лактозу, гликоген, крахмал и др.). Ферментация маннозы, сахарозы и арабинозы (так называемая триада Хёйберга) имеет диагностическое значение.
По способности разлагать эти три углевода все вибрионы холеры разделяют на 6 групп. Холерные вибрионы разлагают только маннозу и сахарозу и принадлежат к 1-й группе Хейберга.
Бактерии холеры этой группы обладают плазмокоагулирующим (свёртывают плазму кролика) и фибринолитическим (разжижают свёрнутую сыворотку по Леффлеру) свойствами.
Холерные вибрионы свёртывают молоко и разлагают другие белки и их дериваты до аммиака и индола; H2S не образуют, восстанавливают нитраты и образуют индол (эту способность учитывают в нитрозоиндоловой реакции, также известной как холера-рот реакция).
Бактерии серовара Бенгал устойчивы к полимиксину и не проявляют гемолитической активности.

Таблица 18—4. Дифференциальные признаки возбудителей холеры
Антигены холеры. Антигенная структура холеры. Схемы Хайберга. Серогруппы холеры.
У холерных вибрионов выделяют термостабильные О- и термолабильные Н-Аг.
О-антигены. По структуре О-антигены выделяют 139 серогрупп; возбудители холеры относят к 01 группе. Принадлежность к ней отличает их от ходероподобных и парахолерных вибрионов.
Поэтому, несмотря на возможные биохимические различия, при исследовании на холеру обязательно проводят типирование 01-антисывороткой. О-Аг 01 группы холерных вибрионов неоднороден и включает А, В и С компоненты, разные сочетания которых присущи сероварам Огава (АВ). Инаба (АС) и Хикоджима (ABC).
Эти свойства используют в качестве эпидемиологического маркёра для дифференцирования очагов по возбудителям холеры, хотя иногда от одного больного можно выделить бактерии разных сероваров. R-формы, а также слизистые М-формы (с изменённой структурой О-Аг) не агглютинируются О-антисыворотками, для идентификации OR- и R-диссоциатов используют OR-антисыворотки.
Бактерии серовара холеры 0139 не агглютинируются видоспеиифической О1 и типоспецифическими Огава-, Инаба- и RO-сыворотками.
Поскольку холероподобные вибрионы также не агглютинируются 01-антисывороткой, их обозначают как неагглютинирующиесн (НАГ) вибрионы.
Н-антигены — общие антигены для большой группы бактерий, поэтому их разделяют на А и В группы. В группу А входят холерные вибрионы; в группу В — вибрионы, биохимически отличные от холерных. Вибрионы группы В имеют неоднородную структуру О-Аг, их разделяют на 6 серологических подгрупп, состав которых совпадает с разделением на 6 биохимических групп схемы Хайберга.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

