Вич что это такое научное исследование
Обновлено: 13.05.2024
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
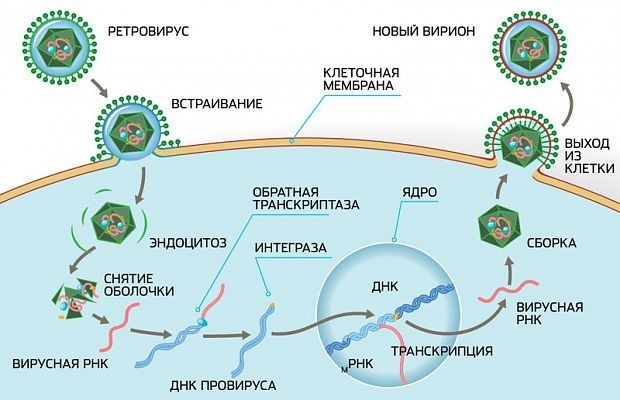
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
ВИЧ-инфекция — это медленно прогрессирующее инфекционное заболевание, вызываемое вирусом иммунодефицита человека (ВИЧ).
Размножаясь, ВИЧ поражает клетки иммунной системы — так называемые CD4+ Т-лимфоциты. В результате чего количество их постепенно уменьшается.
Что это за клетки?
Они отвечают за уничтожение тех вирусов, которые попали в организм человека и смогли преодолеть гуморальный барьер.
Т-лимфоциты действуют не против возбудителей, циркулирующих в крови, а распознают измененную, то есть зараженную вирусом, клетку и разрушают ее. Клетки CD4 регулируют весь этот процесс, выполняя функцию иммунной памяти.
Именно поэтому против ВИЧ иммунная система не может сработать так, как это было бы с любым другим вирусом.
Стоит сразу отметить, что ВИЧ — вирус нестойкий, он погибает вне среды человеческого организма при высыхании содержащих его жидкостей и практически моментально погибает при температуре выше 56ºС.
ВИЧ содержится во всех биологических жидкостях человеческого организма. Однако достаточное для инфицирования количество ВИЧ может содержаться только в крови, сперме, предэякуляте, вагинальном секрете и грудном молоке.
Слюна, пот и моча не содержат достаточного для инфицирования количества вируса.
Пути инфицирования ВИЧ
Вероятность инфицирования при незащищенном контакте такого типа наиболее велика.
Некоторые другие практики, например оральный секс, могут подразумевать меньшую опасность инфицирования.
Несмотря на то, что в справочниках обычно для орального секса отмечается процент вероятности, отличный от нуля, за всю историю эпидемии пока достоверно не зафиксировано ни одного случая инфицирования таким образом — даже в том случае, если принимающий партнер проглатывает сперму после эякуляции.
Таким образом, получить ВИЧ может каждый независимо от пола, возраста, национальности, сексуальной ориентации, материального достатка или принадлежности к какой-либо социальной группе.
Часто люди могут знать, как необходимо поступать, чтобы избежать инфицирования, однако в силу социальных, культурных или экономических условий, в которых им приходится находиться, они могут воздерживаться от правильных действий.
Что такое СПИД?
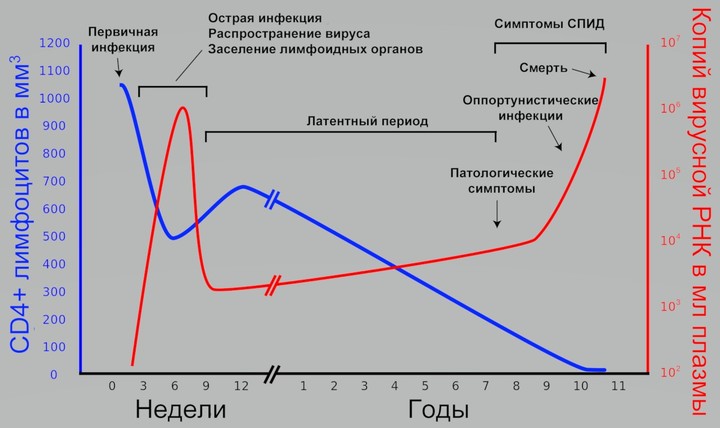
ВИЧ-инфекция течет медленно и почти бессимптомно. В течение многих лет она может никак не тревожить человека.
СПИД — синдром приобретенного иммунодефицита — тяжелое состояние, которое вызывается у человека длительным течением ВИЧ-инфекции.
Считается, что с момента проникновения вируса в организм до достижения стадии СПИДа проходит в среднем 10 лет (от 5 до 15 лет). Но только в том случае, если пациент, получив вирус, не начал лечение.
Антиретровирусная терапия является единственным средством для лечения ВИЧ-инфекции с доказанной эффективностью.
Если антиретровирусная терапия не начата вовремя и количество CD4+ Т-лимфоцитов снизилось ниже критического уровня 200 кл/мкл, у человека появляется вероятность развития СПИДа.
Но СПИДа можно избежать!
Что для этого нужно сделать? Необходимо как можно скорее после обнаружения в организме следов вируса начать так называемую антиретровирусную терапию (сокращенно АРВТ или АРТ).
Антиретровирусная терапия — это комбинация из 3-4 препаратов, которые блокируют размножение ВИЧ на разных этапах. Вследствие ее применения вирус иммунодефицита человека перестает размножаться.
Пока АРТ неспособна элиминировать вирус, то есть полностью вылечить ВИЧ-инфекцию, однако в состоянии не просто продлить жизнь ВИЧ-инфицированного человека, но и повысить ее качество.
Пациенты, которые получают АРТ, не болеют СПИДом!
Предполагаемая продолжительность жизни человека с ВИЧ-инфекцией, получающего АРТ, не отличается от таковой в общей популяции людей. Более того, человек, принимающий препараты АРТ и достигший неопределяемого уровня вирусной нагрузки, безопасен для своего сексуального партнера, даже в том случае, если занимается с ним сексом без презерватива.
Считается, что, если у человека с ВИЧ показатель вирусной нагрузки менее 200 копий, риск передачи отсутствует. Если этот показатель выше — риск безусловно есть. В этом случае ВИЧ-отрицательному партнеру советуется начать доконтактную профилактику (PrEP, ДКП).
Почему важно регулярно проходить тестирование на ВИЧ?
Зная результат обследования, вы избавитесь от неопределенности, связанной с тревожными размышлениями о том, что у вас может быть ВИЧ-инфекция, но вы не знаете об этом.
Плюсы тестирования:
Если результат теста показал, что у вас нет ВИЧ-инфекции, но при этом вы знаете, что ваше поведение связано с риском инфицирования, вы можете узнать, как быть осторожнее, дабы избежать инфицирования в будущем.
Впрочем, о тестировании не стоит забывать даже тем, кто состоит в моногамных отношениях: вы не можете знать наверняка, верен ли ваш партнер. Более того, испытывая чувство вины, он может стыдиться рассказывать вам о тех случайных связях, которые были у него на стороне.
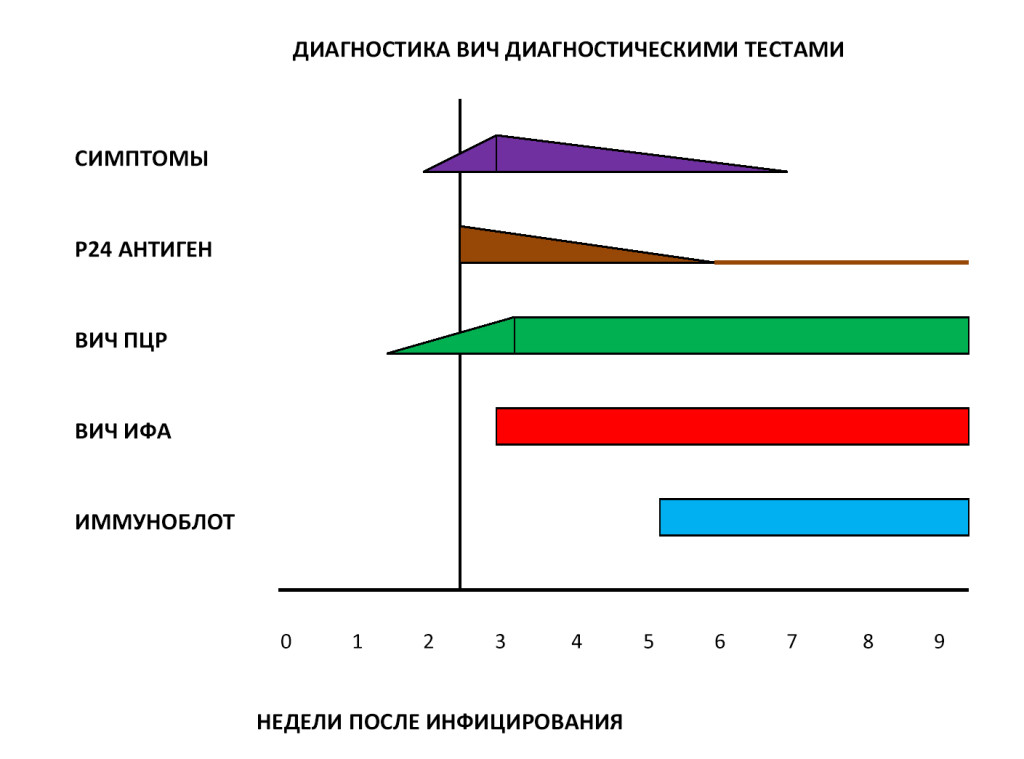
Большинство тестов определяют не сам ВИЧ, а антитела к нему: иммунная система начинает вырабатывать их после того, как вирус попадает в организм. У 97 % людей антитела к ВИЧ выявляют в срок от 3 до 12 недель после инфицирования. В течение этого срока проверку можно проходить как в лабораторных условиях (ИФА-диагностика), так и при помощи домашней тест-системы — по крови или слюне.
Более чувствительные тесты (ИФА четвертого поколения) выявляют антигены, которые являются частью самого вируса и появляются в достаточном для определения количестве, пока антитела еще не появились. Подобные тест-системы показывают результат на сроке в 2—6 недель после инфицирования.
ПЦР-диагностика выявляет не антитела или антигены, а генетический материал вируса. Из-за высокой стоимости и сложности этот метод используется реже других. Он способен показать точный результат в срок от 1 до 4 недель.
Более подробно о том, каким бывает тестирование, вы можете узнать, вернувшись к оглавлению данного раздела.
ВИЧ-положительными называют людей, чей тест на ВИЧ показал положительный результат. То есть вирус в организме этого человека есть.
ВИЧ-отрицательными — людей, чей тест не обнаружил следов вируса в организме.
Знайте: тот факт, что у кого-то из вас обнаружена ВИЧ-инфекция, вовсе не означает, что вы должны отказываться от секса и/или отношений.
Но это значит, что как можно скорее вам нужно начать антиретровирусную терапию. От этого зависит ваше здоровье и здоровье вашего партнера.
Не бойтесь АРВ-терапии: несмотря на то, что в прошлом многие препараты от ВИЧ были весьма токсичны, сегодня они ничуть не опаснее других лекарств. Свои побочные эффекты есть и у них, но всех их можно избежать, если правильно подобрать схему лечения.
Запомните: схема подбирается врачом! Именно он обладает всеми необходимыми знаниями, чтобы определить, какие именно таблетки и по какому графику вам необходимо принимать. Не занимайтесь самолечением!
Если вы столкнулись с побочными эффектами, сообщите об этом вашему лечащему врачу в центре СПИД и попросите его подобрать для вас альтернативную схему терапии.
Как оценивают эффективность АРВТ и от чего она зависит?
Для оценки эффективности и неэффективности лечения используются разные критерии: вирусологические, иммунологические и клинические.
Вирусологическая эффективность — это уменьшение вирусной нагрузки до неопределяемой (менее 20 копий/мкл). Чем быстрее и значительнее упадет вирусная нагрузка, тем дольше терапия будет эффективной. Если через 6 месяцев после начала терапии вирусная нагрузка сохраняется выше порога определения — это вирусологическая неэффективность.
Причинами вирусологической неэффективности лечения могут быть:
низкая приверженность пациента лечению, то есть пропуск приема препаратов; несоблюдение других условий приема лекарств, например, таких как сочетание с пищей, межлекарственные взаимодействия; резистентность вируса к проводимой АРТ.
Иммунологическая эффективность — это увеличение количества CD4+ T- клеток. В разных исследованиях критерием иммунологического ответа служит прирост количества CD4+ T-клеток на 50 в микролитре, на 100 в мкл или на 200 в мкл. Или превышение CD4+ T-клетками порога в 200 кл/мкл или 500 кл/мкл. Под иммунологической неэффективностью подразумевается отсутствие прироста CD4+ T-клеток.
Стадия СПИДа наступает только в том случае, если количество CD4+ ниже 200 кл/мкл.
Клиническая эффективность
Клинический успех лечения оценивается как отсутствие СПИД- индикаторных заболеваний. Уменьшение выраженности общих симптомов.
Клинический успех лечения напрямую связан с вирусологическим и иммунологическим ответом на лечение.
Как рассказать партнеру, с которым я встречаюсь, что у меня ВИЧ?
Многие люди с ВИЧ-инфекцией сталкивались с отказом в отношениях, когда рассказывали о ВИЧ партнерам, с которыми встречались, из-за чего им было тяжело в дальнейшем принимать решение о раскрытии своего статуса.
Рассказать о себе партнеру будет проще, если вы предварительно обсудите это с другими ВИЧ-позитивными людьми или с профессионалом, работающим в этой сфере.
Однако помните, что ваш диагноз касается в первую очередь вас — это ваш личный мир, очень глубокая и интимная часть вас и вашей жизни.
От того, как и при каких обстоятельствах вы это преподнесете, будет зависеть реакция вашего партнера. Лучше всего рассказывать о том, что у вас ВИЧ-инфекция, тогда, когда вы сами приняли свой диагноз, а значит, перестал испытывать чувства вины и стыда, связанные с диагнозом.
Потому что состояние, находясь в котором, мы делимся чем-то сокровенным, отражается на собеседнике.
Теперь меня бросят, и я останусь один?
Нет. Не обязательно. Конечно, такая новость может огорчить и даже напугать вашего любимого человека, но это вовсе не означает, что он обязательно должен вас из-за этого бросить.
В мире много пар, в которых один из партнеров имеет положительный ВИЧ-статус, и эти пары остаются вместе, несмотря на ВИЧ.
Общение и честность являются ключевыми факторами укрепления и успешного развития отношений. Вы оба должны четко говорить о том, как вы чувствуете себя и что вы хотите друг от друга. Вам обоим нужно уметь внимательно слушать и слышать друг друга.
Вместо послесловия
В течение всех последних лет количество людей с ВИЧ в России растет, количество инфицированных от общего их числа равняется примерно одному проценту, то есть с ВИЧ живет практически каждый сотый россиянин. Это очень много.
Значительная часть из них — совсем не представители уязвимых групп, а гетеросексуальные мужчины и женщины, никогда не употреблявшие наркотиков.
Один из ста — совсем немного? Но это закон статистики: тем самым сотым может стать каждый. Вне зависимости от образа жизни, вероисповедания и социального статуса.
Более того, среди российских геев или мужчин, практикующих секс с мужчинами, носителем вируса по разным оценкам является каждый десятый или даже каждый пятый.
Это очень много. Именно поэтому Фонд помощи людям, живущим с ВИЧ, как и многие другие ВИЧ-сервисные организации, регулярно проводит анонимное бесплатное тестирование на ВИЧ.
В любое время пройти абсолютно анонимный тест (для этого не нужны ни прописка, ни паспорт) можно в открытом пространстве фонда СПИД.ЦЕНТР по адресу:
Москва, ул. Нижняя Сыромятническая, д. 11, с.1, офис 313.

На сегодняшний день существует масса теорий и гипотез происхождения вируса ВИЧ-инфекции. Вирус иммунодефицита человека (ВИЧ) относится к роду Lentvirus (буквальный перевод - "медленный вирус"). Такое название рода вполне объяснимо, поскольку от момента инфицирования до появления значительных нарушений иммунитета проходит довольно продолжительное время. Другие вирусы рода Lentivirus поражают овец, кошек, коров и лошадей. Из всех остальных вирусов самый близкий к ВИЧ - SIV (Simian Immunodeficiency Virus), поражающий обезьян. Возраст SIV, по мнению учёных - 32 000 лет.
Откуда произошёл ВИЧ, как появился в мире?
Сегодня доказано происхождение ВИЧ именно от SIV. ВИЧ-1 произошёл от SIVcpz, который поражает шимпанзе, а ВИЧ-2 произошёл от SIVsm, который поражает воротничковых мангабеев.
В 1999-м учёные завершили исследование вопроса, откуда появился ВИЧ, которое продолжалось 10 лет, придя к выводу о почти полной идентичности обнаруженного ими вируса SIVcpz вирусу ВИЧ-1. Спустя 2 года после этого в журнале Nature была напечатана статья, где утверждалось о заражении диких шимпанзе двумя видами SIV, вследствие чего произошла гибридизация вирусов, они обменялись генетической информацией и в результате появилась ВИЧ-инфекция, поражающая людей.
Но остаётся невыясненным вопрос о том, как вирус попал в человеческий организм из организма шимпанзе. Потому до конца ещё не ясно, какова причина его появления у людей.
Вирусы поражают и животных, и людей. Условием поражения организма вирусом является восприимчивость организма к вирусу, т. е. наличие клеток-мишеней. ВИЧ - не исключение. Человеческий организм характеризуется высокой восприимчивостью к нему, поскольку имеет клетки-мишени.
Сегодня известны разные теории происхождения ВИЧ, объясняющие, как SIV превратился в ВИЧ.
Заражение, как следствие охоты на шимпанзе
Эта теория объясняет происхождение ВИЧ-инфекции от SIVcpz, распространившегося в человеческой популяции вследствие охоты на шимпанзе. Кто-то из охотников, разделывая мясо, мог заразиться SIV, к примеру, через порез. Попав в организм, SIVcpz подвергся мутации и стал известным нам вирусом ВИЧ-1. Доныне такой механизм заражения встречается в странах, где люди охотятся на шимпанзе. Так, согласно исследованию, проведённому в Камеруне, в группе из 1099 охотников около 1% из них были инфицированы вирусом SFV, ранее считавшимся распространённым только среди обезьян.
Теория оральной вакцины от полимиелита
В книге "Река" журналиста Эдварда Хупера была изложена гипотеза о том, что происхождение ВИЧ-вируса могло быть следствием ятрогенного (внутрибольничного) инфицирования человека. В 1950-х гг. оральная вакцина от полиомиелита была использована для прививок, сделанных примерно 1 000 000 человек в Руанде, Бурунди и Конго. Эта вакцина была названа Chat. Но культивирование штамма вакцины полиомиелита требует наличия живых тканей, и именно поэтому якобы были использованы почечные клетки шимпанзе, которые были заражены SIVcpz. Но в 2000-м году была доказана несостоятельность этой гипотезы происхождения ВИЧ, поскольку в найденном пузырьке с вышеупомянутой вакциной, который был использован в 1950-х гг., не было обнаружено ни SIV, ни ВИЧ-1. Выяснилось, что для культивирования применяли почечные клетки макак, которых SIVcpz не поражает в принципе.
Использование многоразовых шприцов
Её можно считать продолжением предыдущей гипотезы происхождения ВИЧ-инфекции. Первые одноразовые шприцы возникли в 1950-м году, но некоторые страны ещё долго не могли закупать их, потому многоразовые шприцы продолжали использоваться ещё долго, а такие шприцы после каждого применения необходимо было стерилизовать, что тоже требует денег. Потому вероятно, что не стерилизованные многоразовые шприцы и стали причиной распространения ВИЧ. А после проникновения в организмы хотя бы нескольких людей вирус подвергся мутации и был реплицирован.
Происхождение в колониальных лагерях
Ещё одна теория, объясняющая происхождение СПИДа и ВИЧ, была описана в 2000-м году учёным Джимом Муром, изучавшим приматов. Она гласит, что инфицирование могло иметь место в лагерях рабочих, в массовом порядке вывозившихся колонизаторами с африканской территории в начале 20-го столетия. В этих лагерях царили ужасные условия, отсутствовала элементарная гигиена, рабочие недоедали, что приводило к ухудшению их иммунитета и мотивировало охотиться на шимпанзе (здесь данная теория пересекается с "охотничьей"). Вероятна и передача инфекции путём сексуальных контактов в колониальных лагерях.
Теория искусственного создания ВИЧ
Для этой теории происхождения ВИЧ-инфекции не нашлось никаких подтверждений, она совершенно не учитывает связь HIV с SIV и факт обнаружения HIV в 1959-м году.
Когда именно этот вирус впервые попал в человеческий организм?
Учёные, исследовавшие проблематику, откуда появился ВИЧ в мире, особенно в начале, стремились обнаружить образцы тканей людей, которые были инфицированы им. Сейчас достоверно известно о четырёх ранних случаях заражения ВИЧ, на основании которых можно предположить предварительную дату проникновения вируса в человеческий организм:
- плазма мужчины из ДР Конго (1959)
- лимфатический узел женщины из ДР Конго (1960)
- ткани подростка из США (1969)
- ткани моряка из Норвегии (1976).
Согласно итогам множества научных исследований, появление ВИЧ и СПИД относится к 1940-50-х гг. Компьютерное моделирование с учётом изменчивости вируса привело к другому выводу - что годом возможного заражения первого человека стал 1931-й.
ВИЧ-2 имеет распространение лишь в некоторых восточноафриканских странах, а до стадии СПИДа развивается крайне медленно. При этом способы инфицирования им полностью совпадают с путями заражения ВИЧ-1. Центром его распространения, согласно данным определённых исследований, стала Португалия, в которой ВИЧ-2 преимущественно распространялся посредством переливаний крови, что подтверждается обнаружением ВИЧ-2 у ветеранов войн.
Ранняя диагностика заболеваний – залог успешного лечения. Ставшее крылатым выражение, особенно актуально для ВИЧ-инфекции. Ведь заболевание неизлечимо полностью, и только своевременная диагностика позволяет взять течение болезни под контроль и выбрать тактику лечения, чтобы жить полноценной жизнью.

Ранний срок диагностики ВИЧ – со 2 недели от предположительного заражения.
Важность клинической диагностики ВИЧ
В понимании многих людей ВИЧ-инфицированный человек выглядит болезненно, изнеможенно. Он кашляет, чихает, чешется, стонет, у него все болит… На самом деле это не так! Проблема в том, что после инфицирования ВИЧ и в последующий инкубационный период симптомы полностью отсутствуют. Затем наступает острая фаза, на протяжении которой присутствуют симптомы, напоминающие ОРВИ или грипп. Но и они вскоре проходят, и наступает, так называемый, латентный период – продолжительный промежуток времени, когда ВИЧ-инфекция себя ничем не выдает. С момента инфицирования и до стадии пред-СПИДа может пройти порядка 10 лет, в течение которых, ни сам пациент, ни его окружение, даже и не подозревают о болезни. А когда она уже на полную мощность заявляет о себе, контролировать ее очень трудно. Сложно противостоять осложнениям ВИЧ, поддерживать практически разрушенную иммунную систему человека.
Очень важно понимать, что, хотя и есть группы риска – гомосексуалисты, наркозависимые и девушки легкого поведения – в основной массе, пациенты с ВИЧ-инфекцией – это обычные люди. Они учатся, ходят на работу, посещают общественные места, знакомятся в интернете – в общем, живут как все. К сожалению, но от ВИЧ никто не застрахован. Незащищенный половой контакт в порыве страсти, заветное тату без соблюдения стерильности, маникюр за полцены у начинающего мастера, уличная драка – все эти и множество других житейских ситуаций могут обернуться инфицированием ВИЧ.
Благоприятные сроки для диагностики ВИЧ
Факт возможного инфицирования и плохое самочувствие без видимых причин – два веских основания для обращения к специалистам. Но отрицательный результат тестирования на антитела не всегда означает, что человек не инфицирован, так как существует период “серонегативного окна” (время между заражением и появлением антител), который составляет около трех месяцев. Поэтому лучше повторить их спустя 3 месяца с момента возможного инфицирования. Если же ответ опять будет отрицательным, но ваша тревога не проходит, и вы уверены в заражении ВИЧ, тогда лабораторную диагностику необходимо повторить спустя 6 месяцев после факта заражения.
Что касается плохого самочувствия, то поводом провериться на ВИЧ может быть сочетание следующих симптомов:
- увеличение лимфатических узлов на шее, в паху, в области подмышек;
- лихорадка;
- мышечные или головные боли;
- молочница и грибковые поражения, в том числе кандидоз полости рта;
- воспаление слизистой носа, рта или глотки;
- ночная потливость;
- ломота в суставах;
- длительная диарея;
- тошнота, рвота;
- резкое снижение массы тела;
- высыпания на коже.
Современные методы диагностики ВИЧ
В настоящее время в диагностике ВИЧ используется двухуровневый подход – косвенные и прямые тесты. Косвенные тесты позволяют обнаружить в крови пациента специфические антитела к ВИЧ, а прямые тесты помогают выявить собственно сам ВИЧ и определить степень вирусной нагрузки на организм. В России стандартная диагностика ВИЧ включает следующие методы лабораторных исследований:
- ИФА (иммуноферментный анализ).
- Иммуноблот (иммунный блоттинг).
Также могут быть применены следующие методики:
- Экспресс-тест ИХА (иммунохроматография).
- ПЦР (полимеразная цепная реакция).
Диагностические принципы лабораторных исследований и степень их достоверности приведены в нижеследующей таблице.
Читайте также:

