Внутрибольничные инфекции особенности лабораторной диагностики
Обновлено: 12.05.2024
Причины и факторы риска внутрибольничной инфекции
Внутрибольничными называют инфекции, возникающие и развивающиеся у пациентов лечебных учреждений (примерно у 25%). Наиболее распространёнными среди них считают респираторные, раневые, инфекции кожи и подкожно-жировой клетчатки, заболевания мочевыводящих путей и мягких тканей, а также септицемию (особенно при длительной катетеризации больных и выполнении инъекций).
Факторы риска - причины внутрибольничной инфекции
Вероятность передачи микроорганизмов между пациентами в лечебном учреждении достаточно высока.
Питание как причина внутрибольничной инфекции. Пищу для пациентов стационара обычно готовят централизованно на больничной кухне, поэтому при несоблюдении санитарно-гигиенических норм возникает риск развития пищевых инфекций. Алиментарным путём обычно происходит распространение антибиотикорезистентных штаммов микроорганизмов.
Вентиляция как причина внутрибольничной инфекции
Передача инфекций (например, мультирезистентных штаммов возбудителей туберкулёза, а также различных респираторных вирусов) может осуществляться воздушно-капельным путём при кондиционировании воздуха. Кроме того, плохая вентиляция может стать причиной заболеваний, вызываемых представителями рода Legionella.
Личные вещи пациентов как причина внутрибольничной инфекции. Любые предметы и вещи, используемые пациентами, могут содержать на своей поверхности различных возбудителей и быть источником возникновения инфекционных заболеваний.
Вода как причина внутрибольничной инфекции. Лечебные учреждения обладают сложной системой водоснабжения, к которой подключены уборные, души, центральное отопление и система кондиционирования воздуха. Кроме того, для работы автоклавов необходим горячий пар, подаваемый под высоким давлением. При этом в резервуарах для воды могут присутствовать микроорганизмы рода Legionella, а система охлаждения может стать источником инфекций, распространение которых осуществляется через систему вентиляции. Для уменьшения риска возникновения различных заболеваний необходимо в резервуарах для горячей воды поддерживать температуру выше 45 °С, а в резервуарах с холодной водой — ниже 20 °С.
Повышение восприимчивости пациентов к инфекциям происходит в результате ослабления защитных функций организма, что может быть связано с основным заболеванием или лечением (например, больные лейкемией или пациенты, подвергаемые химиотерапии). Кроме того, факторами, предрасполагающими к развитию инфекционного процесса, выступают пожилой возраст и неподвижное состояние больного, ишемия тканей делает их более подверженными бактериальной инвазии.

Медицинские процедуры как причина внутрибольничной инфекции
Катетеризация вен как причина внутрибольничной инфекции. Катетеризация вен — самая частая причина развития вну-трибольничной бактериемии. При этом риск возникновения инфекции прямо пропорционален длительности нахождения устройства в вене. При нарушении целостности кожного покрова возникает вероятность проникновения внутрь таких микроорганизмов, как Staphylococcus aureus, S. epidermidis и Corynebacterium jeikeium. Первый признак заражения — воспаление в месте инъекции. Инфекции, возникающие при использовании катетеров, могут осложняться септицемией, эндокардитом и метастатическим распространением инфекции (например, остеомиелитом).
Катетеризация мочевого пузыря. При длительном применении мочевых катетеров возникает риск развития инфекционного процесса в мочевом пузыре, для уменьшения которого необходимо соблюдение правил асептики и антисептики при введении катетера.
Хирургические вмешательства как причина внутрибольничной инфекции
У пациентов хирургического отделения в анамнезе часто отмечают терапевтические заболевания (например, бронхиальная астма, сахарный диабет), снижающие устойчивость организма к инфекции. Кроме того, само хирургическое вмешательство весьма травматично и несёт в себе риск развития различных осложнений (ишемии тканей, раневых инфекций и др.). Помимо объёма и продолжительности операции, большую роль играет мастерство хирурга: чем меньше повреждение тканей во время хирургического вмешательства, тем ниже риск возникновения болезни. Предоперационный период должен быть максимально коротким (во избежание заражения антибиотикорезистентными внутрибольничными микроорганизмами). При наличии симптомов острого заболевания (например, лёгочной инфекции) следует отложить плановую операцию.
Для снижения вероятности заражения во время хирургического вмешательства воздух в операционные подают через специальные фильтры. Движения медперсонала должны быть сведены к минимуму, что позволяет не создавать дополнительных воздушных потоков. Для снижения вероятности распространения возбудителей инфекции перед входом в операционную необходимо переодеться в стерильную одежду. Воздухонепроницаемая одежда уменьшает риск контаминации микроорганизмами, присутствующими на коже хирурга, но вызывает неудобства при её ношении.
Для предотвращения послеоперационных инфекций назначают антибиотикопрофилактику. Препараты должны обладать бактерицидным действием и проникать в необходимое место в концентрации, достаточной для уничтожения микроорганизмов, вызывающих инфекционный процесс. Следует отметить, что данных, подтверждающих эффективность антибиотикопрофилактики, начатой позже 48 ч после выполнения оперативного вмешательства, в настоящее время не существует.
Во время интубации трахеи возникает вероятность проникновения возбудителей в нижние отделы дыхательных путей. При этом послеоперационные боли, неподвижность и обезболивание препятствуют откашливанию, что способствует повышению риска развития пневмонии. Кроме того, в условиях стационара часто возникают респираторные заболевания, вызванные устойчивыми грамотрицательными микроорганизмами, присутствующими в окружающей среде.
Мероприятия по улучшению качества медицинской помощи в первую очередь направлены на борьбу с внутрибольничными инфекционными заболеваниями (например, вызванными Clostridium difficile или метициллинрезистентным золотистым стафилококком (МРЗС).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Примерно 90% всех внутрибольничных инфекций имеют бактериальное происхождение. Вирусы, грибы и простейшие, а также эктопаразиты встречаются значительно реже. Попытка суммировать представления о микробной этиологии ВБИ не отражает всего многообразия и сложности их этиологической структуры. Некоторые из микроорганизмов (например, стафилококки, эшерихии, клебсиеллы, синегнойная палочка и др.) вызывают разные клинические формы ВБИ, другие выделяются только при определенных клинических состояниях (анаэробные микроорганизмы, например, встречаются преимущественно как возбудители ВБИ при глубоких инфекциях мягких тканей или при интраабдоминальных хирургических инфекциях). Некоторые возбудители поражают преимущественно определенные группы пациентов (парвовирус В19, вирусы кори, краснухи, ветряной оспы и эпидемического паротита в педиатрической практике; хламидии, микоплазмы, стрептококки группы В у новорожденных и родильниц и т. п.). Различия в экологических свойствах возбудителей ВБИ, среди которых присутствуют все возможные варианты (от облигатных внутриклеточных паразитов до свободноживущих микроорганизмов), также могут быть весьма существенными, определяя, в свою очередь, соответствующие особенности механизма развития эпидемического процесса в ЛПУ.
В таблице представлена группировка возбудителей внутрибольничных инфекций, в основе которой лежат эпидемиологические аспекты. Эта группировка отнюдь не претендует на право классификации возбудителей ВБИ, однако для эпидемиологов является полезной.
Первая группа возбудителей внутрибольничных инфекций — патогенные агенты — возбудители традиционных инфекций, не имеют в госпитальных условиях специфических черт. Они получают, как правило, большее распространение в стационарах в связи с высокой концентрацией и тесным общением в лечебном учреждении госпитализированных больных. Не исключено, что в какой-то степени сказывается и пониженная общая резистентность организма. Вторая подгруппа среди патогенных микроорганизмов также отражает интенсификацию в больницах процессов, которые могут быть и вне лечебного учреждения. Но в данном случае речь идет об интенсификации ятрогенного действия — медицинских вмешательств. В связи с тем, что госпитальный процесс является кратковременным эпизодом в циркуляции этих возбудителей, формирование вирулентных штаммов, опасных для госпитальных больных, не успевает произойти.
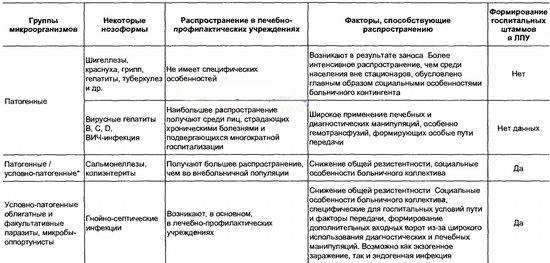
Группировка возбудителей внутрибольничных инфекций с учетом эпидемиологических данных
Вторая группа возбудителей внутрибольничных инфекций — это облигатные паразиты, но их патогенность более всего проявляется в госпитальных условиях. Разбираемая группа микроорганизмов вызывает заболевания, которые, в основном, регистрируются среди больничных контингентов. Связано это в первую очередь с пониженной сопротивляемостью организма госпитализированных больных и в определенной степени — с реализацией путей передачи, которые имеют определенный специфический характер. В таких условиях возможно формирование госпитальных штаммов.
Но наиболее специфична для стационаров третья группа возбудителей внутрибольничных инфекций — условно-патогенные микроорганизмы (УПМ), Возникновение и распространение заболеваний, вызванных УПМ, целиком и полностью определяются причинами, которые действуют лишь в госпитальных условиях.
Уже упоминалось, что условно-патогенные микроорганизмы могут вызвать сходные заболевания и по характеру патологического процесса, и по локализации. Однако это совсем не значит, что у них не проявляются определенные специфические характеристики.
Среди специалистов бытовало мнение, что имеет место смена возбудителей (УПМ) внутрибольничных инфекций. Утверждалось, что на смену золотистому стафилококку пришла синегнойная палочка и т. д. Однако современные данные показывают, что речь идет не о закономерной смене возбудителей ВБИ, а их способности существовать в условиях медицинских отделений, специализирующихся на лечении больных с определенной патологией.
Так, в хирургических стационарах общего профиля доминирует кишечная палочка, в урологических — кишечная палочка, протеи, синегнойная палочка, клебсиеллы, в травматологических — золотистый стафилококк, синегнойная палочка, протеи и т. п. При этом иногда наблюдается более или менее четкая закономерность смены возбудителя в ране: стафилококк — затем синегнойная палочка.
Выявление и характеристика ВБИ невозможна без выявления и характеристики микробных ассоциаций в больницах и контроля за ВБИ. Для этого необходимо получать информацию из самых различных источников.
Диагностика госпитальных инфекций проводится по обычным методикам, которые применяются в бактериологических лабораториях. Специальные методики для внутрибольничных инфекций не разработаны. Однако при микробиологических исследованиях для выделения возбудителей госпитальных инфекций есть некоторые особенности.
Необходимо установить этиологический фактор по многим признакам: род, тип, подтип. - биоценотический принцип.
Необходимо иметь данные по чувствительности выделенных микробов к антибиотикам, антисептикам, дезинфектантам, для организации правильного лечения и профилактики. - Химиотерапевтический принцип.
Всегда следует учитывать степень обсеменения обследуемого материала так как при массивном обсеменении вероятность заболевания увеличивается Количественный принцип.
Надо соблюдать, так называемый, популяционный принцип. Это значит что надо снимать с плотных питательных сред несколько колоний, ибо две колонии одного и того же вида могут отличаться друг от друга.
Больные должны обследоваться в течение пребывания в стационаре несколько раз, т.к. возможна смена возбудителя. - Динамический принцип.
Обязательно изучаются факторы патогенности: выработка токсина, факторов препятствующих фагоцитозу и лизису микроорганизмов, гемолиз выработка лецитиназы у стафилококков и т.д.
Необходимо типирование выделенных микробов (фаготипирование, серотипирование и т.д.) - эпидемиологический приниип.
При изучении специфичности и чувствительности набора тестов, характеризующих внутрибольничный эковар,установлены два высокоспецифичных признака: контаминация штаммом 30% и выше не¬обработанных предметов отделения, в значительной степени представленных медицинскими аппаратами и санитарно-техническим оборудованием, а также контаминация дезинфектанта (Ю.А.Захарова, И.В.Фельдблюм, 2008).
Эпидемиологический стандарт внутрибольничного штамма (эковара) может быть рекомендован к использованию в рамках микробиологического мониторинга в системе эпидемиологического надзора за ВБИ, что позволит улучшить предэпидемическую диагностику ГСИ в ЛПУ с целью принятия своевременных адекватных управленческих решений по снижению заболеваемости ГСИ.
Методы лабораторной диагностики:
1. Микробиологический:
A) Микроскопический:
окраска по Граму: стафилококки, стрептококки, энтеробактерии, менинго-, гонококки и др.
Циль-Нельсена: микобактерии туберкулеза;
Нейсера, метиленовой синькой: дифтерия;
Романовскому-Гимзе: малярия, лейшманиоз, трипоносомоз, возвратный тиф;
По Бури: капсулы — пневмококк
Темное поле: лептоспира;
серебрение по Морозову: тельца Пашена (вирус натуральной оспы)
иммунолюминисцентный: грипп (отпечатки со слизистой носа)
Б) Бактериологический - посев на жидкие (МПБ) и плотные (ЖСА, МПАкр., Эндо, Плоскирева, Левина, Сабуро и др.) питательные среды. Идентификация микроорганизмов, определение ферментативной и биохимической активности возбудителей, постановка пестрых рядов и тестов.
B) Биологический - опыты с лабораторными животными.
2. Серологический. РА, РСК, РГА, РИГА, РТГА, ИФА, РИА, ПЦР, Пауля- Буннеля и др.
В основе всех серологических реакций лежит взаимодействие антигена и антитела.
Взятие крови производят натощак (во избежании мутности (хилезности) сыворотки крови) из локтевой вены или уколом из пальца, у грудных детей - из небольшого разреза пятки. При взятии крови необходимо соблюдать правила асептики. Посуда должна быть чистой и сухой, стерилизация необязательна.
Если удалось взять минимальное количество крови (например, у маленьких детей) ее набирают в количестве 0,1 или 0,2 мл и вносят в пробирку с 0,9 мл или 1,8 мл стерильного физиологического раствора (содержащего 0,25% лимоннокислого натрия), что соответствует разведению сыворотки 1:10. Затем взвесь центрифугируют и оставляют в холодном месте до утра. Из отстоявшейся сыворотки делают последующие 2-х кратные разведения (1:20; 1: 40 и т.д.).
Вторым основным компонентом серологических реакций является антиген. Для обнаружения антител в крови ставят реакцию с заведомо известными антигенами. В качестве антигенов применяют взвеси живых или убитых микробов (РА), экстракты или изолированные химические фракции микробов (РГА, РСК преципитации и др.).
3. Вирусологический: материалом для вирусологических исследований служит: кал, смывы зева, носа, сыворотка крови и др. Хранить необходимо при низких температурах или в замороженном виде (исключение: цельная кровь - гемолиз эритроцитов). Вирус является облигатным паразитом, поэтому его культивирование представляет определенные сложности. Для культивирования вирусов необходимы культуры клеток. Исходя из этого, подтверждение диагноза при вирусных исследованиях чаще основывается на иммунолюминисцентном методе (свечение в люминисцентном микроскопе комплекса антиген-антитело), серологических методах (ПЦР, РФА, метод парных сывороток и др.), к сожалению, большинство этих методов имеют лишь ретроспективное значение.
4. В последнее время достаточно широко стали использоваться более информативные молекулярно-биологические методы — ПЦР (полимеразная цепная реакция).
Микробиологические методы имеют решающее значение в постановке этиологического диагноза оппортунистических инфекций, в выработке рациональной схемы терапии и в предупреждении развития вторичных случаев заболевания.
Микробиологические исследования при заболеваниях, вызванных УПМ, направлены на выделение не одного, а нескольких основных микробов, находящихся в исследуемом материале, а не на индикацию одного специфического патогена, как это принято при заболеваниях, вызванных патогенными микробами.
Основным методом микробиологической диагностики оппортунистических инфекций является кулыпуральный метод, заключающийся в посеве на искусственные питательные среды материала от больного для выделения и идентификации чистых культур возбудителей.
При использовании этого метода следует учитывать:
в материале от больного, как правило, присутствует ассоциация микробов, в которую входят как возбудители заболевания, так и заносные из других органов и внешней среды виды, а также микробы, которые могут попасть в материал при его заборе и доставке;
количественный и видовой состав микрофлоры варьирует у разных больных и меняется в процессе болезни, особенно при использовании антибактериальных препаратов.
Достоверность бактериологического исследования зависит от: правильного забора материала от больного; применения эффективного набора дифференциально-диагностических и селективных питательных сред; использования количественного посева материала; этапности идентификации выделенных чистых культур (семейство, род, вид и, в необходимых случаях, вариант); определения свойств, указывающих на патогенность культур и их принадлежность к госпитальным штаммам.
Обязательным должно быть определение чувствительности культур к антибиотикам и
другим антимикробным химиотерапевтичес-ким препаратам, а также свойств культур, необходимых для эпидемиологического анализа (эпидемиологических меток) — фаговара, се-ровара, резистенсвара и др.
С целью определения смены возбудителей и изменения их свойств исследования материала следует проводить через каждые 5-7 дней.
Микроскопический метод позволяет выявлять в мазках патологического материала бактерии только в случае их массивного содержания (10 5 и более КОЕ/мл) и из-за близости морфологии бактерий дает возможность только ориентировочно судить о возбудителе, относя его к крупным таксонам (палочки, кокки, спирохеты, грамположительные или грамотрицательные и т. п.). Результаты микроскопии могут быть использованы при выборе питательных сред для дальнейшего выделения возбудителя. В редких случаях микроскопически удается определить род или даже вид возбудителя, если он имеет характерную морфологию (клостридии, фузобактерии). В идентификации грибов и простейших возможности микроскопического метода несколько шире. Введение в практику иммунофлюоресцентного метода расширяет возможности микроскопического метода, но и в этом случае он не может заменить бактериологический метод, поскольку не позволяет определить чувствительность возбудителя к химиотерапевтическим препаратам и ряд других, необходимых для практики свойств.
Серологический метод имеет вспомогательное значение. С помощью его не удается установить спектр и уровень активности антимикробных препаратов по отношению к возбудителю болезни и провести внутривидовое типирование. Возможности серологического метода ограничивает выраженная мозаичность антигенной структуры многих УПМ, наличие к ним антител у здоровых людей и слабая выраженность иммунного ответа на антигены УПМ. Тем не менее при затяжных и хронических формах болезни серологический метод иногда позволяет установить этиологию болезни. Серологические реакции ставятся с парными сыворотками крови больного и аутокулыу-рой; результат оценивается по сероконверсии в 4 раза и более. Перспективны серологические методы количественного выявления видовых и
типовых антигенов возбудителя в очаге поражения, а также в биологических жидкостях — крови, слюне, моче. Однако техника постановки таких реакций и критерии этиологического диагноза пока не отработаны. На сегодняшний день слабо разработаны диагностические препараты, основанные на иммунных реакциях (иммуноферментный анализ, иммунофлюо-ресцентные диагностикумы, моноклональные антитела) к микробам-оппортунистам.
Биологический метод обычно не используется из-за неспецифичности клинической картины, вызываемой УПМ у лабораторных животных, и содержания в патологическом материале микробных ассоциаций, которые при заражении животных претерпевают изменения.
Аллергологический метод, в связи с отсутствием сенсибилизации или ее малой специфичностью, не используется.
20.7.1. Правила забора, хранения и транспортировки материала
Результаты микробиологической диагностики зависят от правильного выбора материла и соблюдения условий его забора, доставки, хранения и обработки.
Вид материала определяется клинической картиной заболевания, т. е. он должен соответствовать локализации предполагаемого возбудителя с учетом патогенеза болезни. Например, при бронхолегочных заболеваниях для исследования берут мокроту, при заболеваниях мочевыделительной системы — мочу, в случае отсутствия или неясности локальных очагов — кровь.
Количество материала должно быть достаточным для проведения исследования и его повторения в случае необходимости. Например, при исследовании крови берут 5—10 мл крови.
Материал берут, по возможности, в начальном периоде болезни, так как именно в этот период возбудители выделяются чаще, их больше, они имеют более типичную локализацию. Ранний этиологический диагноз предполагает более раннее и, следовательно, более эффективное лечение и профилактику новых случаев болезни.
Забор материала должен осуществляться до начала антибактериальной терапии или через
определенный промежуток времени после ее назначения, необходимый для выведения препарата из организма (большинство антибиотиков практически через 8— 10 ч после введения уже выводится из организма). Если антибактериальная химиотерапия начата, то ее при необходимости и без ущерба для больного надо прервать на 1—2 дня, а потом производить забор материала. Так же поступают при повторных исследованиях.
Материал необходимо брать непосредственно из очага инфекции или исследовать соответствующее отделяемое (гной из фистулы, мочу, желчь и пр.).
Забор материала проводить во время наибольшего содержания в нем возбудителей болезни: например, кровь для выделения ге-мокультуры в начале озноба, при повышении температуры и т. п.
Необходимо предупредить возможную контаминацию материала нормальной микрофлорой больного и микробами окружающей среды. Для этого забор материала должен проводиться в асептических условиях, в процедурном кабинете, в перевязочной или малой операционной стерильным инструментарием в стерильную посуду. Пути, через которые выделяется или берется материал, должны быть максимально освобождены от нормальной микрофлоры. Для избежания контаминации материала нормофлорой при взятии материала на исследование из полостей тела и полых органов адекватный для забора материала доступ к этим органам осуществляется путем пункции их через кожные покровы.
Следует предупредить возможность попадания в материал антимикробных препаратов (дезинфектантов, асептиков, антибиотиков), исключить контакт с металлами, обладающими олигодинамическим действием, с ватой, содержащей свободные жирные кислоты.
Любой клинический материал должен рассматриваться как потенциально опасный для человека. Поэтому при его заборе, хранении, доставке, обработке во избежание заражения должны соблюдаться такие же меры техники безопасности, как в бактериологической лаборатории.
10. Транспортировку клинического образца в лабораторию следует производить в макси мально короткие сроки.
К клиническому образцу, направляемому в лабораторию, прилагают сопроводительный документ, содержащий основные сведения, необходимые для проведения микробиологического исследования (характер материала, Ф.И.О. больного, название учреждения или отделения, номер истории болезни, предположительный диагноз заболевания, предшествующая антимикробная терапия, дата и время взятия материала, подпись врача, направляющего материал на исследование).
В процессе транспортировки материал следует оберегать от действия света, тепла, холода, механических повреждений. Лучше всего материал доставлять в специальных металлических контейнерах, которые удобно очищать и обеззараживать. Нельзя отправлять материал в лабораторию с больными или случайными людьми.
После исследования остатки материала подлежат уничтожению (автоклавированию или сжиганию), а посуда, контейнеры, инструменты — обеззараживанию.
20.7.2. Обобщенная (типовая) схема выделения возбудителей оппортунистических инфекций 1-й день
Обработка материала с целью его гомогенезации и концентрации (в необходимых случаях).
Приготовление и окраска мазка по Граму. В необходимых случаях, например при подозрении на присутствие в материале простейших, грибов, хлами-дий, микобактерий и т. п., дополнительно применяют специальные методы окраски.
Приготовление разведений патологического материала от 10~1 до 10 6 в теплом растворе хлорида натрия 0,5% с 0,01% желатина (для предупреждения осмотического шока бактерий)
Высев 0,1 мл материала из разведений на чашки Петри с питательной средой газоном (на три чашки из каждого разведения). В стандартный набор питательных сред желательно включить желточно-солевой агар (для стафилококков), среду Эндо или эозинметиловый агар (для энтеробактерий), кровяной агар (для стрептококков и ряда других требовательных к питательным средам видов), среду Сабуро (для грибов), среду для контроля стерильности или другие среды для анаэробов. В случаях, когда имеются указания на вероятный возбудитель (клиническая симптоматика, вид патологического материала, результаты микроскопии), должны быть использованы более селективные среды.
Определение характера роста на питательных средах.
Подсчет количества колоний каждого типа на чашках с посевом разведений патологического материала и расчет бактериальной обсемененности материала по формуле
X КОЕ = N х ПД х СР,
где N — число колоний; ПД — посевная доза; СР — степень разведения. Микроскопия мазков по Граму из всех выросших типов колоний.
Отсев на среду накопления с колоний различных типов. Для повышения достоверности исследования желательно отсевать 2—3 колонии одного типа. Эта мера вызвана гетерогенностью популяции: она удорожает исследование, но зато резко повышает его достоверность.
Ускоренная идентификация (при наличии методов и возможностей).
Идентификация чистых культур. Тесты идентификации зависят от предполагаемого вида или рода выделенной культуры. Она проводится с помощью общепринятых методик или автоматизированных систем.
Определение чувствительности выделенных культур к антибиотикам и, в необходимых случаях, к антисептикам.
1.Учет результатов тестов, использованных для идентификации.
Оформление заключения (семейство, род, вид выделенных культур; обсемененность материала КОЕ/мл или КОЕ/г; антибиотикограмма; этиологическая значимость выделенных культур и состав их популяций).
По клиническим и эпидемиологическим показателям определяют факторы патогенности и эпидемиологические маркеры (фаго-, серо-, резистенс-, бактерио-циновары и др.) у этиологически значимых культур.
20.7.3. Критерии этиологической значимости выделенной чистой культуры
Для установления этиологической роли патогенных микробов достаточно выделения микроба из материала от больного (независимо от количества), обнаружения в сыворотке крови специфических антител в диагностическом титре или сероконверсии в ходе болезни в 4 раза и более, наличия корреляции между выделенным микробом и клинической картиной болезни. Вспомогательное значение имеют результаты биопробы и аллерголо-гического метода диагностики.
Критерии этиологической роли УПМ более сложны и менее надежны. К ним относятся:
Выделение возбудителя из исследуемого материала. Этот критерий имеет решающее значение при выделении микроба из крови и спинномозговой жидкости. При остальных нозологических формах он самостоятельного значения не имеет, если даже выделена монокультура. Отрицательный результат исследования не является основанием для отрицания инфекционной природы болезни, так как он может быть обусловлен методическими причинами. В этом случае инфекционная природа болезни устанавливается на основании клинических данных с повторным микробиологическим исследованием.
инфицирующая доза является производной от степени патогенности микроба и уровня восприимчивости организма. Она может быть и значительно меньше, и значительно больше этой величины, так как численность популяции возбудителя в процессе болезни меняется: при переходе в хроническую форму, в период выздоровления и ремиссии, в процессе химиотерапии, в присутствии конкурента она существенно снижается. В случае выделения из патологического материала нескольких видов или вариантов микробов в оценке этиологической роли важное значение имеет установление количественных соотношений ассоци-антов: за ведущего возбудителя в этом случае принимают доминирующую популяцию.
В сомнительных случаях, например, при подозрении на микробную контаминацию исследуемого материала, внести ясность может повторное, в течение 12—24 ч, исследование этого же материала: выделение того же вида и варианта и в этот раз подтверждает вывод о его этиологической роли.
Принадлежность выделенной культуры к больничному штамму или эковару.
Обнаружение у выделенной культуры факторов патогенности. Ценность этого критерия повышается при выявлении нескольких факторов патогенности и, особенно, в достаточно высокой дозе или активности. К сожалению, методы выявления факторов патогенности и оценки их активности отсутствуют или сложны и долговременны, что снижает возможность использования этого важного критерия. Кроме того, отсутствие специальных факторов патогенности не является основанием для отрицания этиологической роли выделенной культуры, поскольку патогенное действие может быть обусловлено эндотоксином, который содержится у большинства УПМ.
Сероконверсия в сыворотке больного к аутокультуре в 4 раза и более.
Выявление прямой корреляции между чувствительностью культуры к антимикробным химиотерапевтическим препаратам и эффективностью терапии.
Выделение идентичных культур от группы больных в случае вспышки заболевания.
Наличие прямой корреляции между клиническим улучшением и уменьшением мас-
сивности или полной элиминацией микробной популяции.
Основное значение в установлении этиологии заболевания имеют первые два критерия, остальные — только дополнительное; их наличие указывает на этиологическую роль культуры, отсутствие — не позволяет исключить ее роль в возникновении болезни.
Внутрибольничные инфекции – различные инфекционные заболевания, заражение которыми произошло в условиях лечебного учреждения. В зависимости от степени распространения различают генерализованные (бактериемию, септицемию, септикопиемию, бактериальный шок) и локализованные формы внутрибольничных инфекций (с поражением кожи и подкожной клетчатки, дыхательной, сердечно-сосудистой, урогенитальной системы, костей и суставов, ЦНС и т. д.). Выявление возбудителей внутрибольничных инфекций проводится с помощью методов лабораторной диагностики (микроскопических, микробиологических, серологических, молекулярно-биологических). При лечении внутрибольничных инфекций используются антибиотики, антисептики, иммуностимуляторы, физиотерапия, экстракорпоральная гемокоррекция и т. д.

Общие сведения
Внутрибольничные (госпитальные, нозокомиальные) инфекции - инфекционные заболевания различной этиологии, возникшие у пациента или медицинского сотрудника в связи с пребыванием в лечебно-профилактическом учреждении. Инфекция считается внутрибольничной, если она развилась не ранее 48 часов после поступления больного в стационар. Распространенность внутрибольничных инфекций (ВБИ) в медицинских учреждениях различного профиля составляет 5-12%. Наибольший удельный вес внутрибольничных инфекций приходится на акушерские и хирургические стационары (отделения реанимации, абдоминальной хирургии, травматологии, ожоговой травмы, урологии, гинекологии, отоларингологии, стоматологии, онкологии и др.). Внутрибольничные инфекции представляют собой большую медико-социальную проблему, поскольку утяжеляют течение основного заболевания, увеличивают длительность лечения в 1,5 раза, а количество летальных исходов - в 5 раз.

Этиология и эпидемиология внутрибольничных инфекций
Основными возбудителями внутрибольничных инфекций (85% от общего числа) выступают условно-патогенные микроорганизмы: грамположительные кокки (эпидермальный и золотистый стафилококк, бета-гемолитический стрептококк, пневмококк, энтерококк) и грамотрицательные палочковидные бактерии (клебсиеллы, эшерихии, энтеробактер, протей, псевдомонады и др.). Кроме этого, в этиологии внутрибольничных инфекций велика удельная роль вирусных возбудителей простого герпеса, аденовирусной инфекции, гриппа, парагриппа, цитомегалии, вирусных гепатитов, респираторно-синцитиальной инфекции, а также риновирусов, ротавирусов, энтеровирусов и пр. Также внутрибольничные инфекции могут быть вызваны условно-патогенными и патогенными грибами (дрожжеподобными, плесневыми, лучистыми). Особенностью внутригоспитальных штаммов условно-патогенных микроорганизмов служит их высокая изменчивость, лекарственная резистентность и устойчивость к воздействию факторов среды (ультрафиолета, дезинфектантов и пр.).
Источниками внутрибольничных инфекций в большинстве случаев выступают пациенты или медицинский персонал, являющиеся бактерионосителями или больными стертыми и манифестными формами патологии. Как показывают исследования, роль третьих лиц (в частности, посетителей стационаров) в распространении ВБИ невелика. Передача различных форм госпитальной инфекции реализуется с помощью воздушно-капельного, фекально-орального, контактного, трансмиссивного механизма. Кроме этого, возможен парентеральный путь передачи внутрибольничной инфекции при проведении различных инвазивных медицинских манипуляций: забора крови, инъекций, вакцинации, инструментальных манипуляций, операций, ИВЛ, гемодиализа и пр. Таким образом в медучреждении возможно заразиться гепатитами В, С и D, гнойно-воспалительными заболеваниями, сифилисом, ВИЧ-инфекцией. Известны случаи внутрибольничных вспышек легионеллеза при приеме больными лечебного душа и вихревых ванн.
Факторами, участвующими в распространении внутрибольничной инфекции, могут выступать контаминированные предметы ухода и обстановки, медицинский инструментарий и аппаратура, растворы для инфузионной терапии, спецодежда и руки медперсонала, изделия медицинского назначения многоразового использования (зонды, катетеры, эндоскопы), питьевая вода, постельные принадлежности, шовный и перевязочный материал и мн. др.
Значимость тех или иных видов внутрибольничной инфекции во многом зависит от профиля лечебного учреждения. Так, в ожоговых отделениях преобладает синегнойная инфекция, которая в основном передается через предметы ухода и руки персонала, а главным источником внутрибольничной инфекции являются сами пациенты. В учреждениях родовспоможения основную проблему представляет стафилококковая инфекция, распространяемая медицинским персоналом-носителем золотистого стафилококка. В урологических отделениях доминирует инфекция, вызываемая грамотрицательной флорой: кишечной, синегнойной палочкой и др. В педиатрических стационарах особую значимость имеет проблема распространения детских инфекций – ветряной оспы, эпидемического паротита, краснухи, кори. Возникновению и распространению внутрибольничной инфекции способствуют нарушение санитарно-эпидемиологического режима ЛПУ (несоблюдение личной гигиены, асептики и антисептики, режима дезинфекции и стерилизации, несвоевременное выявление и изоляция лиц-источников инфекции и т. д.).
К группе риска, в наибольшей степени подверженной развитию внутрибольничной инфекции, относятся новорожденные (особенно недоношенные) и дети раннего возраста; пожилые и ослабленные пациенты; лица, страдающие хроническими заболеваниями (сахарным диабетом, болезнями крови, почечной недостаточностью), иммунодефицитом, онкопатологией. Восприимчивость человека к внутрибольничным инфекциям увеличивается при наличии у него открытых ран, полостных дренажей, внутрисосудистых и мочевых катетеров, трахеостомы и других инвазивных устройств. На частоту возникновения и тяжесть течения внутрибольничной инфекции влияет долгое нахождение пациента в стационаре, длительная антибиотикотерапия, иммуносупрессивная терапия.
Классификация внутрибольничных инфекций
По длительности течения внутрибольничные инфекции делятся на острые, подострые и хронические; по тяжести клинических проявлений – на легкие, среднетяжелые и тяжелые формы. В зависимости от степени распространенности инфекционного процесса различают генерализованные и локализованные формы внутрибольничной инфекции. Генерализованные инфекции представлены бактериемией, септицемией, бактериальным шоком. В свою очередь, среди локализованных форм выделяют:
- инфекции кожи, слизистых и подкожной клетчатки, в т. ч. послеоперационных, ожоговых, травматических ран. В частности, к их числу относятся омфалит, абсцессы и флегмоны, пиодермия, рожа, мастит, парапроктит, грибковые инфекции кожи и др.
- инфекции полости рта (стоматит) и ЛОР-органов (ангина, фарингит, ларингит, эпиглоттит, ринит, синусит, отит, мастоидит)
- инфекции бронхолегочной системы (бронхит, пневмония, плеврит, абсцесс легкого, гангрена легкого, эмпиема плевры, медиастинит)
- инфекции пищеварительной системы (гастрит, энтерит, колит, вирусные гепатиты)
- глазные инфекции (блефарит, конъюнктивит, кератит)
- инфекции урогенитального тракта (бактериурия, уретрит, цистит, пиелонефрит, эндометрит, аднексит)
- инфекции костно-суставной системы (бурсит, артрит, остеомиелит)
- инфекции сердца и сосудов (перикардит, миокардит, эндокардит, тромбофлебиты).
- инфекции ЦНС (абсцесс мозга, менингит, миелит и др.).
Диагностика внутрибольничных инфекций
Критериями, позволяющими думать о развитии внутрибольничной инфекции, служат: возникновение клинических признаков заболевания не ранее чем через 48 часов после поступления в стационар; связь с проведением инвазивного вмешательства; установление источника инфекции и фактора передачи. Окончательное суждение о характере инфекционного процесса получают после идентификации штамма возбудителя с помощью лабораторных методов диагностики.
Для исключения или подтверждения бактериемии проводится бактериологический посев крови на стерильность, желательно не менее 2-3-х раз. При локализованных формах внутрибольничной инфекции микробиологическое выделение возбудителя может быть произведено из других биологических сред, в связи с чем выполняется посев мочи, кала, мокроты, отделяемого ран, материала из зева, мазка с конъюнктивы, из половых путей на микрофлору. Дополнительно к культуральному методу выявления возбудителей внутрибольничных инфекций используются микроскопия, серологические реакции (РСК, РА, ИФА, РИА), вирусологический, молекулярно-биологический (ПЦР) методы.
Лечение внутрибольничных инфекций
Сложности лечения внутрибольничной инфекции обусловлены ее развитием в ослабленном организме, на фоне основной патологии, а также резистентностью госпитальных штаммов к традиционной фармакотерапии. Больные с диагностированными инфекционными процессами подлежат изоляции; в отделении проводится тщательная текущая и заключительная дезинфекция. Выбор противомикробного препарата основывается на особенностях антибиотикограммы: при внутрибольничной инфекции, вызванной грамположительной флорой наиболее эффективен ванкомицин; грамотрицательными микроорганизмами – карбапенемы, цефалоспорины IV поколения, аминогликозиды. Возможно дополнительное применение специфических бактериофагов, иммуностимуляторов, интерферона, лейкоцитарной массы, витаминотерапии.
При необходимости проводится чрескожное облучение крови (ВЛОК, УФОК), экстракорпоральная гемокоррекция (гемосорбция, лимфосорбция). Симптоматическая терапия осуществляется с учетом клинической формы внутрибольничной инфекции с участием специалистов соответствующего профиля: хирургов, травматологов, пульмонологов, урологов, гинекологов и др.
Профилактика внутрибольничных инфекций
Основные меры профилактики внутрибольничных инфекций сводятся к соблюдению санитарно-гигиенических и противоэпидемических требований. В первую очередь, это касается режима дезинфекции помещений и предметов ухода, применения современных высокоэффективных антисептиков, проведения качественной предстерилизационной обработки и стерилизации инструментария, безукоснительного следования правилам асептики и антисептики.
Медицинский персонал должен соблюдать меры индивидуальной защиты при проведении инвазивных процедур: работать в резиновых перчатках, защитных очках и маске; осторожно обращаться с медицинским инструментарием. Большое значение в профилактике внутрибольничных инфекций имеет вакцинация медработников от гепатита В, краснухи, гриппа, дифтерии, столбняка и других инфекций. Все сотрудники ЛПУ подлежат регулярному плановому диспансерному обследованию, направленному на выявление носительства патогенов. Предупредить возникновение и распространение внутрибольничных инфекций позволит сокращение сроков госпитализации пациентов, рациональная антибиотикотерапия, обоснованность проведения инвазивных диагностических и лечебных процедур, эпидемиологический контроль в ЛПУ.
Читайте также:

