Волосяные фолликулы при вич
Обновлено: 26.04.2024
Одним из частых заболеваний кожных покровов с особенной устойчивостью к терапии является фолликулит. Хроническое течение характерно для фолликулитов, вызванных, в частности, стафилококками. В данной статье представлено исследование препарата, который с ус
One of the most common skin diseases, remarkably resistant to the therapy is folliculitis. The chronic process is typical for folliculitis caused, in particular, by Staphylococcus aureus. This article presents a study of the drug which can be successfully used against antibiotic resistance.
С 1928 года, когда А. Флемингом был открыт первый антибиотик пенициллин, до настоящего времени группа антибактериальных препаратов значительно увеличилась. Антибиотики стали чрезвычайно популярны. Порой их назначение не оправдано, зачастую пациенты самовольно назначают себе антибактериальную терапию, что в конечном итоге привело к тому, что медицинское сообщество столкнулось с такой сложной проблемой, как резистентность к антибиотикотерапии. Основой терапевтического действия антибактериальных препаратов является подавление жизнедеятельности возбудителя инфекционной болезни в результате угнетения более или менее специфичного для микроорганизмов метаболического процесса. Угнетение происходит в результате связывания антибиотика с мишенью, в качестве которой может выступать либо фермент, либо структурная молекула микроорганизма.
Резистентность микроорганизмов к антибиотикам может быть природной и приобретенной.
Истинная природная устойчивость характеризуется отсутствием у микроорганизмов мишени действия антибиотика или недоступностью мишени вследствие первично низкой проницаемости или ферментативной инактивации. При наличии у бактерий природной устойчивости антибиотики клинически неэффективны. Природная резистентность является постоянным видовым признаком микроорганизмов и легко прогнозируется.
Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при воздействии таких концентраций антибиотиков, которые подавляют основную часть микробной популяции. Возможны ситуации, когда большая часть микробной популяции проявляет приобретенную устойчивость. Появление у бактерий приобретенной резистентности не обязательно сопровождается снижением клинической эффективности антибиотика. Формирование резистентности во всех случаях обусловлено генетически: приобретением новой генетической информации или изменением уровня экспрессии собственных генов.
Известны следующие биохимические механизмы приобретенной устойчивости бактерий к антибиотикам:
Механизмы резистентности могут быть различны, например, микроорганизм непроницаем для антибиотика (большинство грамотрицательных бактерий невосприимчивы к пенициллину G, поскольку клеточная стенка защищена дополнительной мембраной). Одной из возможных причин приобретенной резистентности может являться то, что микроорганизм в состоянии переводить антибиотик в неактивную форму (многие виды Staphylococcus spp. содержат фермент β-лактамазу, который разрушает β-лактамное кольцо большинства пенициллинов), или вследствие генных мутаций обмен веществ микроорганизма может измениться таким образом, что блокируемые антибиотиком реакции больше не являются критичными для жизнедеятельности организма [1].
Одним из основных механизмов жизненного цикла микроорганизмов, организации формы их существования в окружающей среде и резистентности к ее агрессивным условиям является способность к образованию биопленок. Согласно современным представлениям, биопленка — это совокупность микроорганизмов, в составе которой бактерии взаимодействуют друг с другом, что способствует повышению их устойчивости к факторам внешней среды. Биопленка состоит из непрерывного мультислоя бактериальных клеток, прикрепленных к поверхности раздела фаз и друг к другу и заключенных в биополимерный матрикс [2, 3]. Способностью к образованию биопленок обладает большое количество микроорганизмов, являющихся этиологическими агентами инфекционных, дерматологических, урогенитальных и других заболеваний. Наиболее изученными видами бактерий, образующих биопленки, являются стафилококки, представители семейства Enterobacteriaceae, Pseudomonas aeruginosa, генитальные микоплазмы [4].
Известно, что матрикс биопленки способен препятствовать скорости диффузии некоторых антибиотиков и других биоцидных препаратов, что зависит от его биохимического состава и метаболической активности популяции. Например, аминогликозиды, как отмечается в ряде работ, достаточно длительно диффундируют через матрикс, фторхинолоны, напротив, легко проникают через этот барьер [5–7]. По данным R. Shafreen, левофлоксацин способен проникать в биопленку, сформированную не только бактериями, но и дрожжеподобными грибами Candida albicans, нарушать их биосинтетическую активность, тем самым разрушая структурную организацию грибкового сообщества [8].
Долгие годы оставался малоизученным вопрос о причинах восстановления популяции микроорганизмов после полноценно проведенного курса антибиотикотерапии. Исследования показали, что в культуре бактерий сохраняется небольшая часть клеток, которые проявляют устойчивость к антибиотику, несмотря на то, что остальная популяция чувствительна к его действию [6, 9, 10]. В процессе изучения данной проблемы биологами и генетиками была выявлена субпопуляция клеток, которые впоследствии были названы персистерами. Персистеры — клетки, составляющие 1–5% всей бактериальной массы биотопа, которые образуются в стационарной фазе роста, не проявляют метаболической активности и обеспечивают выживание материнской популяции в присутствии летальных для других клеток факторов. Они замедляют все физиологические процессы и становятся толерантными к действию разных факторов, в том числе антимикробных препаратов. В данном ракурсе понятие антибиотикотолерантности отличается от антибиотикорезистентности. Антибиотики способны оказывать свое действие, влияя на мишени в делящейся и метаболически активной клетке. Стадия физиологического покоя позволяет сохранить часть популяции микроорганизмов и при благоприятных для нее условиях полностью регенерировать [11–14].
Одним из частых заболеваний кожных покровов с особенной устойчивостью к терапии является фолликулит. Фолликулит (folliculitis) — одна из форм пиодермии, которая возникает в волосяном фолликуле. Причиной воспалительного процесса может быть бактериальный, грибковый или вирусный агент. Если не устранены провоцирующие факторы, фолликулит рецидивирует и может стать хроническим. Хроническое течение характерно для фолликулитов, вызванных стафилококками и грибами-дерматофитами. Факторы, провоцирующие развитие фолликулитов:
В лечении стафилококкового фолликулита традиционно используют антибактериальные мази (например, мупироцин), которые наносят на пораженные участки кожи. Прием антибиотиков показан при хроническом течении фолликулита, распространенном процессе, воспалении регионарных лимфатических узлов, недостаточной эффективности местного лечения. Но и в этом случае зачастую невозможно избежать рецидивирования.
В связи с этим было принято решение о поиске средства, способного снизить резистентность бактерий к антибактериальному лечению. Был проведен анализ современной научной литературы, в которой отражалось действие различных антисептиков на рост и размножение бактерий in vitro. По результатам литературного поиска для проведения исследования эффективности антибиотикотерапии рецидивирующего стафилококкового фолликулита был выбран препарат Мирамистин® (группировочное название — бензилдиметил-миристоиламино-пропиламмоний, химическое название — бензилдиметил[3(миристоиламино)пропил]аммоний хлорид моногидрат).
В основе биологического действия препарата Мирамистин® лежит воздействие на клеточные мембраны бактериальных клеток. В результате воздействия препарата происходит нарушение структуры и функции мембран бактериальных клеток, нарушение их осмотического баланса и быстрый лизис. Мирамистин® не воздействует на оболочки клеток человека, поскольку составляющие их липиды имеют значительно большую длину радикалов, и гидрофобных взаимодействий с молекулами препарата Мирамистин® не происходит. Мирамистин® обладает выраженным антимикробным действием в отношении грамположительных и грамотрицательных, аэробных и анаэробных, спорообразующих и аспорогенных бактерий в виде монокультур и микробных ассоциаций, включая госпитальные штаммы с полирезистентностью к антибиотикам. Под действием препарата Мирамистин® снижается устойчивость бактерий и грибов к антибиотикам [15, 16].
Группой ученых были проведены серии экспериментов in vitro, где изучалось влияние бензилдиметил-миристоиламино-пропиламмония на бактерии S. аureus, находящиеся в состоянии как биопленки, так и в обособленных формах. В ходе исследования были получены данные, что, находясь в биопленке, микроорганизмы проявляли большую устойчивость к действию распространенных в практике растворов антисептиков. Вне зависимости от формы существования микроорганизма бензилдиметил-миристоиламино-пропиламмоний оказывал бактерицидный эффект на S. аureus, в том числе MRSA (метицилинорезистентный Staphylococcus aureus) [17]. Бензилдиметил-миристоиламино-пропиламмоний в концентрации 5 мкг/мл и выше обладал 100% бактерицидной активностью в отношении S. аureus [16, 18].
Целью настоящего исследования было оценить эффективность, переносимость, безопасность и удобство применения раствора для местного применения препарата Мирамистин® (бензилдиметил [3-(миристоиламино)пропил]аммоний хлорид моногидрат) при фолликулитах, устойчивых к базовой терапии топическими антибиотиками.
Материалы и методы исследования
В качестве методов оценки эффективности терапии использовались индекс DIDS (Dermatology Index of Disease Severity, дерматологический индекс тяжести заболевания) и индекс DLQI (Dermatology Life Quality Index, дерматологический индекс качества жизни).
До начала лечения все пациенты проходили инструктаж по применению исследуемого препарата, подписывали форму информированного согласия, по каждому пациенту подробно велась амбулаторная карта. Типовая картина заболевания у пациента с фолликулитом, вызванным S. aureus, представлена на рис. 1. В течение 7 дней пациенты лечились самостоятельно. Терапия была комбинированной: крем, в составе которого метилурацил и хлорамфеникол, и спрей Мирамистин® (0,01%). Схема лечения: аппликация крема 1 раз/сут тонким слоем на весь пораженный участок кожных покровов, а также двукратное орошение в день спреем Мирамистин®. Данные назначения были даны в строгом соответствии с инструкцией препарата. Препарат назначался до полного разрешения симптомов, но не более двух недель (ни у одного из участников исследования симптомы не сохранялись более 9 дней). Первое нанесение препарата осуществлялось пациентами под надзором медицинского персонала. В последующем пациенты лечились самостоятельно, нанося исследуемый препарат 2 раза в день согласно представленным им письменным инструкциям.
.jpg)
В качестве метода оценки эффективности терапии использовался индекс DIDS (Dermatology Index of Disease Severity, дерматологический индекс тяжести заболевания), который был предложен исследователями медицинского центра университета Индианы (США) для оценки степени тяжести воспалительных кожных заболеваний с учетом площади поражения кожи и степени функциональных ограничений. Первый компонент индекса — оценка степени поражения поверхности тела (рис. 2).
Для каждого пациента индивидуально высчитывались проценты по каждому параметру до лечения и по истечении одной недели от начала терапии. После чего высчитывалось среднеарифметическое значение по каждому параметру, которое приобрело не целое, а дробное значение.
Общие принципы подхода к оценке:
- Текущее заболевание, распространенное в определенной области, необходимо мысленно представить в виде одного сливающегося участка поражения. Диссеминированное заболевание может фактически вовлечь только небольшой процент поверхности тела.
- Оценивается только воспалительное заболевание, прогрессирующее в момент обращения пациента.
- Участки поствоспалительной гиперпигментации и рубцы не включаются в оценку.
К моменту начала лечения среднеарифметическое значение степени поражения поверхности тела составило 14,74%, при этом с 5% площадью поражения поверхности тела было 12 человек, с 10% — 6, с 20% — 18, с 40% — 2. К концу первой недели от начала терапии динамика была следующей: с 5% площадью поражения поверхности тела — 1 человек, с 10% — 3, с 20% — 2, с 40% — 0, а среднеарифметическое значение — 1,97%. Пациент с типовой картиной фолликулита спустя 5 дней комбинированной терапии представлен на рис. 3.
.jpg)
Функциональная ограниченность при выполнении повседневных действий в быту и на работе являлась вторым компонентом оценки тяжести заболевания при использовании индекса DIDS (таблица):
- Данное функциональное ограничение должно относиться к прогрессирующему в настоящий момент. Ограничения, имевшие место в прошлом, не учитываются.
- Ограничения, связанные с сопутствующими заболеваниями, такими как артрит, не учитываются.
Исходя из данных табл., к моменту начала лечения среднеарифметическое значение степени тяжести заболевания по индексу DIDS составило 1,74, а к концу первой недели — 0,29.
Важным параметром для каждого человека, считающего себя больным, является так называемый уровень качества жизни, для оценки которого авторы исследования использовали индекс DLQI (Dermatology Life Quality Index, дерматологический индекс качества жизни). Данный индекс рассчитан для применения у пациентов старше 16 лет. Анкета заполнялась больным самостоятельно, на заполнение требовалось не более 1–2 минут. Цель анкеты — измерить, насколько проблемы с кожей повлияли на качество жизни за последнюю неделю до лечения и спустя две недели от начала лечения, за исключением последнего пункта. Оценка влияния лечебных процедур на порядок жизни давалась за последнюю неделю до лечения и за неделю самого лечения. Детальный анализ индекса DLQI проводился по шести разделам: 1) симптомы и ощущения (максимум 6 баллов); 2) повседневная деятельность (максимум 6 баллов); 3) отдых и досуг (максимум 6 баллов); 4) работа и учеба (максимум 3 балла); 5) межличностные отношения (максимум 6 баллов); 6) лечение (максимум 3 балла). По каждому показателю высчитывалось среднеарифметическое значение. Результаты измерения качества жизни представлены на рис. 4.
Результаты и их обсуждение
Заключение
В проведенном исследовании установлено, что раствор для местного применения Мирамистин®, основное действующее вещество которого — бензилдиметил [3-(миристоиламино)пропил]аммоний хлорид моногидрат, является эффективным и легко переносимым, а также косметически приемлемым средством борьбы с устойчивыми к антибиотикотерапии фолликулитами. По результатам исследования можно сделать вывод, что оптимальным режимом применения препарата является орошение спреем Мирамистин® два раза в сутки, при этом в подавляющем большинстве случаев достаточно одной недели терапии. Подобная схема лечения способствует хорошей комплаентности. Исходя из этих данных спрей Мирамистин® может быть рекомендован к широкому использованию для комбинированного лечения устойчивых форм фолликулитов различных локализаций.
Литература
- Практическое руководство по антиинфекционной химиотерапии. Под ред. Страчунского Л. С., Белоусова Ю. Б., Козлова С. Н. 2007.
- Donlan R. M., Costerton J. W. Biofilms: survival mechanisms of clinically relevant microorganisms // Clin Microbiol Rev. 2002; Apr; 15 (2): 167–193.
- Donlan R. M. Biofilms: microbial life on surfaces // Emerg. Infect Dis. 2002, Sep; 8 (9): 881–890.
- Рахматулина М. Р., Нечаева И. А. Биопленки микроорганизмов и их роль в формировании резистентности к антибактериальным препаратам.
- Garcia-Castillo M., Morosini M. I., Galvez M., Baquero F., del Campo R., Maseguer M. A. Differences in biofilm development and antibiotic susceptibility among clinical Ureaplasma urealyticum and Ureaplasma purvum isolates // J. Antimicrob. Chemother. 2008; Nov. 62 (5): 1027–1030.
- Gostev V. V., Sidorenko S. V. Bacterial biofilms and infections // Journ Infectol. 2010; 3: 4–15.
- Xavier J. B. Biofilm-control strategies based on enzymic disruption of the extracellular polymeric substance matrix — a modelling study // Microbiology. 2005; 151: 3817–3832.
- Shafreen R. M., Muthamil S., Pandian S. K. Inhibition of Candida albicans virulence factors by novel levofloxacin derivatives // Appl. Microbial. Biotechnol. 2014; Aug; 98 (15): 6775–6785.
- Pace J. L., Rupp M. E., Finch R. G. Biofilms, Infection, and Antimicrobial Therapy. CRC Press, 2005.
- Feng C., Hung Y., Yu Y., Duan G., Dai Y. Effects on quinolone resistance due to the biofilm formation activity in Ureaplasma urealyticum // Turk. J. Med. Sci. 2015; 45 (1): 55–59.
- Moons P. Bacterial interactions in biofilms // Crit. Rev. Microbiol. 2009; 35 (3): 157–168.
- Karatan E. Signals, regulatory networks, and materials that build and break bacterial biofilms // Microbiol. Mol. Biol. Rev. 2009; 73 (2): 310–347.
- Silva-Dias A. Adhesion, biofilm formation, cell surface hydrophobicy, and antifungal planktonic susceptibility: relationship among Candida spp. // Front Microbal. 2015; 12 (6): 205.
- Stepanyan K., Wenseleers T. Fitness trade-offs explain low levels of persister cells in the opportunistic pathogen Pseudomonas aeruginosa // Mol. Ecol. 2015; Apr.; 24 (7): 1572–1583.
- Павлова Н. В., Кривошеин Ю. С. Исследование возможности снижения формирования лекарственной устойчивости у стафилококков под влиянием мирамистина // Труды Крымского медуниверситета. 2000. Т. 136. С. 134–136.
- Павлова Н. В. Микробиологическое обоснование сочетанного действия мирамистина и антибиотиков при стафилококковой раневой инфекции. Автореф. канд. дисс. Харьков, 2000. С. 16.
- Винник Ю. С., Теплякова О. В., Перьянова О. В., Тяпкин С. И., Соседова Е. В. Адгезивная активность микроорганизмов в выборе дренажного полимера и местных антисептиков при инфицированном панкреонекрозе // Анналы хирургической гепатологии. 2013, т. 18, № 4.
- Кривошеин Ю. С., Рудько А. П., Тышкевич Л. В., Сарачан Т. А. Зависимость между антимикробной активностью и строением в ряду некоторых четвертичных аммониевых соединений. В кн.: Физиологически активные вещества в медицине. Киев, 1984, В. 16, с. 50–52.
Ю. К. Кузнецова* , 1
Ю. Ю. Файрузова**
К. Ю. Кузнецова*, кандидат медицинских наук
Н. С. Сирмайс***, кандидат медицинских наук
Первый МГМУ им. И.М. Сеченова
Инверсные акне: абсцедирующий и подрывающий фолликулит и перифолликулит Гоффмана
Журнал: Клиническая дерматология и венерология. 2018;17(4): 110‑113
Абсцедирующий и подрывающий фолликулит и перифолликулит Гоффмана (АППГ) является одной из патологий, относящихся к инверсным акне. Отсутствие верного диагноза и неадекватная терапия АППГ приводит к эстетическим и психологическим нарушениям у пациентов. В статье представлены современные данные о патогенезе и клинике АППГ. Описана типичная трихологическая и гистологическая картины данной патологии. Зачастую диагноз основывается на результатах этих исследований. Также в работе освещены принятые за рубежом методы лечения от медикаментозной терапии до хирургических процедур. Наиболее эффективным методом лечения в настоящее время можно считать применение системных ретиноидов, в частности изотретиноина. Приведены данные собственных наблюдений, подтверждающих клиническую эффективность применения изотретиноина, созданного по технологии LIDOSE, в терапии АППГ. Значимые результаты достигаются уже через 3—4 мес. Описанная в статье схема терапии подразумевает обязательное достижение курсовой кумулятивной дозы изотретиноина (100 мг/кг для изотретиноина LIDOSE), что возможно только при длительном лечении. Ввиду этого для эффективной терапии АППГ важна не только правильная диагностика заболевания, но также и психологическая подготовка пациента к тому, что выздоровление в данном случае — относительно долгий процесс. Важен также подбор адекватной терапии, увеличивающей приверженность пациентов назначенному лечению.
Первый МГМУ им. И.М. Сеченова
Инверсные акне представляют собой хроническое рецидивирующее воспалительное заболевание апокриновых потовых и сальных желез, сопровождающееся синдромом окклюзии волосяных фолликулов. Данная патология характеризуется длительными и частыми рецидивами и плохо поддается терапии. Инверсные акне включают суппуративный (рецидивирующий) гидраденит, абсцедирующий и подрывающий фолликулит и перифолликулит волосистой части головы Гоффмана (АППГ), декальвирующий фолликулит [1].
АППГ — воспалительное рецидивирующее заболевание кожи волосистой части головы, реже паховой, перианальной и подмышечной областей, характеризующееся образованием абсцессов с последующей рубцовой атрофией. E. Hoffman (1868—1959) дал клиническое описание этого заболевания в 1907 г., но только в 50-х гг. XX века было доказано, что АППГ представляют собой лишь одну из форм акне [2]. АППГ может развиваться самостоятельно или в триаде с гидраденитом и конглобатными акне. Заболевание чаще встречается у молодых мужчин в возрасте 20—40 лет [3].
Отсутствие верного диагноза и неадекватная терапия АППГ приводит к необратимой рубцовой алопеции с масштабными эстетическими поражениями, что негативно сказывается на психологическом состоянии пациента и его окружении.
В настоящее время в патогенезе инверсных акне и в частности абсцедирующего подрывающего фолликулита, большое значение придают микробиоте кожи и иммунным нарушениям. Причина АППГ до конца не известна. Патофизиологические изменения в коже при этом заболевании связывают с фолликулярной окклюзией, расширением и разрывом фолликулярного канала, что инициирует воспалительную реакцию. В дальнейшем происходит выход содержимого фолликула (погибшие корнеоциты, бактерии, жирные кислоты, волосы) в дерму, образование воспалительного перифолликулярного инфильтрата, присоединение вторичной инфекции, формирование абсцесса и фистульных ходов, образование гранулемы, инкапсулирование очага, рубцевание [3, 4].
Диагностика АППГ основана на клинической картине, трихологическом, а при необходимости — гистологическом исследовании.
Гистологически дермоэпидермальный переход представляет собой умеренный воспалительный инфильтрат, преимущественно лимфомоноцитарный, перифолликулярно располагаются многоядерные клетки, гранулемы, макрофаги. Часть волос имеет перифолликулярный фиброз с зонами разрушения волосистого фолликула и заменой его грануляционной тканью [6].
В настоящее время, по данным зарубежных авторов [7, 8], к более эффективным методам лечения относят пероральный прием цинка в низкой дозе, изотретиноина, миноциклина, сульфамидных препаратов, тетрациклина, преднизолона, дапсона; местно — применение клиндамицина, изотретиноина, CО2-лазеров; хирургическое вмешательство. К новым методам относят применение блокаторов фактора некроза опухолей, хинолонов, макролидных антибиотиков, рифампина, алитретиноина, метронидазола и сульфата цинка в высокой дозе (135—220 мг). Изотретиноин, по-видимому, дает наибольшие шансы на ремиссию, но количество отчетов по этому вопросу незначительно, графики дозирования варьируются, а длительность периода наблюдения невелика.
В своей практике мы отдаем предпочтение изотретиноину, произведенному по технологии LIDOSE (Акнекутан * ), в связи с тем, что в данном случае за счет дополнительных компонентов в препарате (гелюцир, спан) увеличивается биодоступность изотретиноина на 20%. Это позволяет сократить суточные и курсовые дозировки изотретиноина при сохранении терапевтической эффективности препарата. Уменьшение дозировки положительно сказывается на переносимости препарата. Для данной формы изотретиноина рекомендуемыми суточными дозами являются 0,4—0,8 мг/кг, тогда как для изотретиноина в обычной форме выпуска — 0,5—1 мг/кг. Использование технологии LIDOSE позволяет также уменьшить зависимость усвоения изотретиноина от пищи. Дополнительные жирорастворимые компоненты обеспечивают усвоение изотретиноина в составе Акнекутана на 70% даже при приеме препарата без пищи, что позволяет быть более уверенным в эффективности терапии даже при условии низкой приверженности пациентов рекомендациям по применению препарата [9].
За период 2014—2017 гг. к нам обратились 8 пациентов в возрасте от 28 лет до 61 года с диагнозом АППГ, подтвержденным гистологически. Изначально пациенты обращались к трихологам в течение нескольких лет. В качестве терапии получали антибиотики длительными курсами, иммуномодулирующую терапию с незначительным улучшением. Для лечения этих пациентов мы применяли системные ретиноиды (Акнекутан) по следующей схеме: 0,4 мг/кг/сут (в зависимости от массы тела пациентов начальная доза составляла в среднем 32 мг/сут) в течение 3—4 мес с последующим снижением суточной дозы до достижения кумулятивной дозы в 100 мг/кг. При наблюдении за пациентами в течение года после окончания терапии рецидива заболевания не отмечено.
Учитывая увеличение частоты данной патологии приводим историю болезни.
Пациент Б., 28 лет, обратился с жалобами на высыпания на коже волосистой части головы в теменной и затылочной области, сопровождающиеся субъективным дискомфортом.
Считает себя больным на протяжении 3 лет, с момента появления высыпаний. Неоднократно получал системную антибиотикотерапию, аутогемотерапию, проводилась хирургическая санация очагов поражения — эффект от лечения был непродолжительным. Процесс приобрел непрерывно рецидивирующий характер с усугубляющейся степенью тяжести клинических проявлений.

Status localis: поражение локализовано на коже волосистой части головы, преимущественно в теменной и затылочной области. Процесс представлен связанными с волосяными фолликулами папулами красного цвета диаметром до 0,6 см, полушаровидной и конической формы, местами пустулами, полушаровидными узлами с округлыми очертаниями диаметром до 1—1,5 см, кожа над ними розовая, гладкая, натянутая. Консистенция узлов мягкая, тестообразная. При сдавливании из некоторых отверстий, расположенных на поверхности узлов и прикрытых желтыми корочками, выделяется гной. Субъективно отмечается незначительное жжение в местах высыпаний, при пальпации узлов — легкая болезненность (рис. 1). Рис. 1. Пациент Б. до лечения.
При гистологическом исследовании в эпидермисе над фолликулом обнаружены признаки акантоза, гиперкератоза и паракератоза, в дерме — участки некроза, периваскулярные лимфогистиоцитарные инфильтраты. Фолликулы многочисленные, некоторые атрофичны, остальные имеют обычное строение. Гистологическая картина соответствует АППГ.
Пациенту был назначен Акнекутан (изотретиноин LIDOSE) в дозе 0,4 мг/кг/сут (первоначальная суточная доза составила 40 мг) с постепенным снижением до достижения кумулятивной дозы в 100 мг/кг, которая была достигнута за 9 мес. За время курса терапии из нежелательных явлений отмечалась сухость кожных покровов только в первые 2 мес приема препарата, которая нивелировалась назначением местных увлажняющих средств.
Через 3 мес терапии отдельные крупные узлы разрешились, уменьшилась интенсивность окраски, было отмечено уплощение остальных элементов, а также снижение (вплоть до исчезновения) субъективных ощущений (жжение, покалывание, зуд) в местах высыпаний (рис. 2). Рис. 2. Пациент Б. через 2 мес терапии. Через 6 мес высыпания полностью регрессировали, оставив рубцовые изменения кожи на месте крупных патологических элементов. В пределах очагов поражения частично возобновился рост волос (рис. 3). Рис. 3. Пациент Б. через 6 мес терапии.
Рост обращаемости с данным заболеванием заставляет обратить внимание на необходимость гистологического подтверждения в случаях папулопустулезных высыпаний на коже волосистой части головы, поскольку назначение несоответствующей терапии приводит к усугублению процесса, рубцовой атрофии и тяжелому психологическому дискомфорту у пациентов.
Применение в терапии АППГ системных ретиноидов, и в частности изотретиноина, соответствует принятым во всем мире методам и демонстрирует высокую эффективность за счет быстрого регресса высыпаний и отсутствия рецидива в длительной перспективе.
Сбор материала — Л.Р. Сакания
Описание клинического случая — Д.Р. Мильдзихова.
Написание и редактирование текста — И.М. Корсунская
Авторы заявляют об отсутствии конфликта интересов.
Collecting and interpreting the data — L.R. Sakaniya
Description of the clinical case — D.R. Mildzihova
Drafting and revising the manuscript — I.M. Korsunskaya
The authors declare no conflict of interest.
Сведения об авторах
Термин фолликулит означает воспаление волосяного фолликула.
Может происходить в любой области кожного, покрытого волосками покрова (за исключением подошв и стоп).
Фолликулит можно классифицировать как менее серьезную гнойную инфекцию кожи.
Этиология развития воспаления разнообразна, причинами могут служить грибковая инфекция, вирусная, паразитарная.
Но обычно инфекция спровоцирована микроорганизмами, принадлежащими к группе стафилококков.

Проявляется заболевание образованием элементов сыпи (pustula), из центра которых прорастает волос.
По мере прогрессирования пустулы вскрываются, образуя небольшие язвенные поражения с последующим рубцеванием.
Больше воспалению волосяных фолликул подвержены жители жарких стран.
Там, где климат способствует благополучному развитию инфекционных заболеваний.
Высокая заболеваемость наблюдается у лиц, проживающих в условиях антисанитарии.
Патология берет начало со стафилококкового импетиго.
Характеризуется поверхностным воспалением устья волосяной луковицы.
Проявляется как эритематозная сыпь, пузыри с волдырями.
В пузырьках содержится экссудат желтоватого оттенка, после их разрыва на месте волдырей образовывается корка.
Если стафилококки инфицируют первичное неинфекционное воспаление кожи, говорят про вторичную импетигинизацию.
По мере распространения процесса и поражения более глубоких слоев дермы, развивается фолликулит.
Согласно международной классификации болезней (МКБ 10), фолликулит находится под кодом L73.8
Фолликулит: причины воспаления
Возбудителями патологии преимущественно являются Staphylococcus.
Относятся к отряду грамположительных бактерий.

Реже встречается фолликулит, для возникновения которого требуются другие инфекционные агенты: синегнойная палочка, трепонема, гонококк.
Причинами бывает:
- грибковое поражение кожного покрова: кандидоз, Malassezia, Microsporum
- вирусные инфекции: герпес, ветряная оспа
- паразитарные возбудители: акариазы, клещи
Риск заражения увеличивается при различных травмах, ожогах, хронических венозных язвах и других нарушениях кожного покрова.
Люди с ослабленным иммунитетом более подвержены заболеванию.
От чего появляется воспаление?
Инфекционный агент проникает в полость волосяной луковицы через микроскопические повреждения, провоцируя воспалительную реакцию.
Вероятность патологического процесса в несколько раз больше у пациентов, имеющих заболевание кожного покрова.
Таких, как экзема, дерматоз, различные типы дерматитов.
Способствуют развитию инфекционного процесса ослабление барьерной функции кожного покрова.
В качестве провоцирующих факторов выделяют наличие у пациента сахарного диабета.
Диабет сопровождается нарушением защитной функции иммунной системы.
Повышенный уровень сахара в крови и присутствие его в моче вызывают частые бактериальные инфекции.
Это связано со способностью некоторых типов патогенных микроорганизмов черпать энергию из глюкозы (попросту, питаться ей).
Вторым провоцирующим фактором, становятся острые иммунодефицитные состояния: ВИЧ, СПИД.
Длительный прием кортикостероидов ослабляет иммунный ответ и вызывает общую иммуносупрессию.
Основной результат нарушения иммунной системы — неспособность организма бороться с инфекциями.
Симптомы болезни
Начало клинической картины сопровождается образованием небольшого красного пятна, локализующегося вокруг волосяной луковицы.

Через время наблюдается образование гнойника, наполненного патологическим секретом.
Позже он самостоятельно вскрывается и при подсыхании образует корочку.
Довольно часто гнойничок трансформируется в фурункул, который является осложнением фолликулита.
Фурункул категорически запрещается вскрывать самостоятельно.
Существует опасность локального распространения бактерий и образования абсцесса, местной флегмоны и даже сепсис.
Например, фурункул на голове или лице может вызвать гнойный менингит.
Иногда несколько фурункулов сливаются в обширный очаг, вызывая образование карбункула.
Воспаление носит многоочаговый характер, сыпь может распространяться на все волосистые части кожного покрова.
У женщин основная локализация приходится на область паха и бедра, у мужчин — на лицо и голову.
При пальпации высыпания болезненны, имеют выраженное покраснение и сопровождаются зудом различной интенсивности.
Общая клиническая картина дополняется:
- жжением в области сыпи
- повышенной сухостью эпидермиса
- образованием рубцов, шрамов
Диагноз ставится при физическом обследовании, поскольку поражения легко узнаваемы даже невооруженным глазом.
Если у врача имеются сомнения, специалист назначает дерматологические анализы.
Глубокий и поверхностный фолликулит
Остиофолликулит или фолликулит поверхностный, представляет собой экссудативный элемент сыпи (пустулы) размером 1-2 мм.
Характеризуется быстрым течением и отсутствием серьезных осложнений.
Спустя несколько дней пустула подсыхает, на ее месте образовывается корочка, которая отпадает самостоятельно, не оставляя рубцов.
Глубокий (гнойный) сопровождается образованием узелка размером 2-3 мм, темно-красного оттенка, в середине которой находится гнойное скопление.
Спустя 3-4 дня образование рассасывается, на его месте появляется язвенное поражение, оставляя рубцы после заживления.
Если речь идет об инфекционном поражении области лица, то диагностируется острый сикоз.
Кроме двух основных выделяют хронический бактериальный процесс.
Заболевание сопровождается заживлением и постоянным появлением новых элементов.
При детальном осмотре можно видеть высыпания и гнойные образования на различных стадиях развития.
Чаще хроническому течению болезни подвержена область лица у мужчин, предпочитающих носить бороду.
Спровоцировать сикоз могут даже незначительные повреждения эпидермиса, например, в ходе бритья.
Риски инфицирования повышаются при наличии предрасполагающих факторов: иммунодефицит, хронические очаги инфекции (ангина, кариес, синусит).
Фолликулит на голове
Фолликулит на волосистой части головы не имеет особых отличий от воспаления на других зонах кожного покрова.
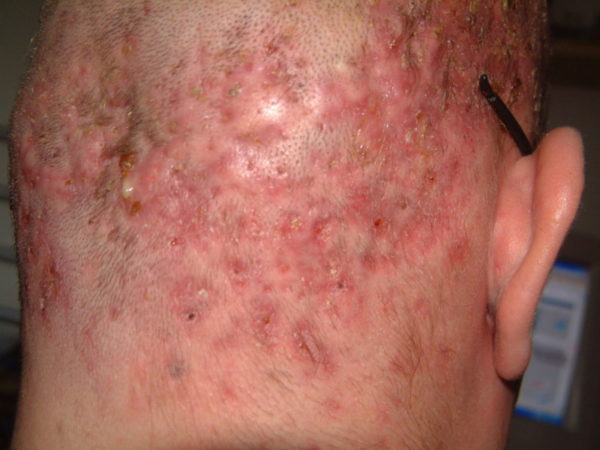
Воспалительная реакция на голове протекает совместно с зудом, покраснением и ощущением болезненности в волосах при пальпации.
В ходе дерматологического осмотра можно выявить небольшие гнойнички.
Со временем они увеличиваются в размерах и желтеют.
Если отсутствует адекватное лечение, на поверхности кожи головы образовывается корка.
Постепенно инфицированию подвергается весь корень волоса.
Как следствие, на коже у пациента наблюдаются эрозивные образования, после которых возникают рубцы.
Классические формы — глубокая и поверхностная.
По этиологии развития: грибковая, бактериальная, вирусная.
Основные возбудители не отличаются от инфекционных агентов, вызывающих заболевание на других участках тела.

О симптомах и лечении
фолликулита полового члена
рассказывает подполковник
медицинской службы, врач
Ленкин Сергей Геннадьевич
Содержание данной статьи проверено и подтверждено на соответствие медицинским
стандартам врачем дерматовенерологом, урологом, к.м.н.
Ленкиным Сергеем Геннадьевичем
Фолликулит Гофмана
Подрывающий фолликулит Гофмана можно встретить под медицинским термином перифолликулит или сокращенно АПФПГ.
Патология указывается как хроническая, и в клинической практике встречается достаточно редко.
Природа возникновения болезни до сих пор неизвестна, преимущественно страдают мужчины от 20 до 45 лет.

Как и все другие виды воспаления, абсцедирующий перифолликулит является инфекционным заболеванием.
Однако начинается с разрушительного процесса волосяных луковиц.
По мере прогрессирования наблюдается скопление кератина в эпидермисе.
В качестве ответной реакции организма происходит образование гранулем (узелков).
Стоит отметить, что многие специалисты в последнее время оспаривают теорию инфекционного происхождения заболевания.
Даже вопреки выявлению элементов микроорганизмов.
Симптоматика заболевания крайне неприятна, особенно при наличии сопутствующего иммунодефицита.
Поверхность кожи красноватая, наблюдаются болезненные узлы с гнойным содержимым.
Иногда гранулемы сопровождаются образованием обширного абсцесса.
Более серьезные случаи включают такие симптомы, как лихорадка, усталость, общее недомогание.
Всегда существует риск распространения бактерий в окружающие ткани или в кровоток, вызывающий септическое состояние.
Болезнь протекает длительно с образованием шрамов.
Виды фолликулита
В клинической дерматологии выделяют множество видов болезни.
Некоторые из них чаще встречаются у мужчин или у женщин, другие возникают при определенных заболеваниях.
Классификация согласно видовой принадлежности выглядит следующим образом:

- Депилирующий – этому виду заболевания подвержены преимущественно жители жарких стран, но фолликулит может развиваться в средних широтах при сильной жаре. Заболеванию подвержены представители сильного пола. Клиническая картина обусловлена симметричными проявлениями на коже. Например, если поражаются фолликулы на одной ноге, симметрия проявляется на второй конечности. После излечения на поверхности дермы остаются фрагменты рубцевания.
- Грамнегативный или грамотрицательный – патологический процесс с вовлечением волосяных фолликулов развивается на фоне пониженного иммунитета или иммунодефицита. Может развиваться на фоне длительного приема антибактериальных средств. Этому виду болезни свойственно внезапное и стремительное развитие, участки тела покрываются угревой сыпью, есть риск формирования абсцессов.
- Фолликулит на фоне поражения дерматофитами – на начальном этапе развития поражается верхний слой эпидермиса. По мере прогрессирования в патологический процесс вовлекается верхняя часть волосяных фолликулов, а затем и основа волосяного корня. Развивается дерматофития, микозное поражение кожи (преимущественно на голове под волосяным слоем), последствием которой становится разрушение кератина.
Фолликулит на ногах
Фолликулит на ногах, как и другие виды этого заболевания, сопровождается инфекционным поражением частей волосяных фолликулов.
Но если в других случаях поражения локализуются на лице, руках, спине, груди или подмышечной области.
В данном случае затрагиваются преимущественного разные участки нижних конечностей.
По частоте проявлений первое место занимает поражение голеней.
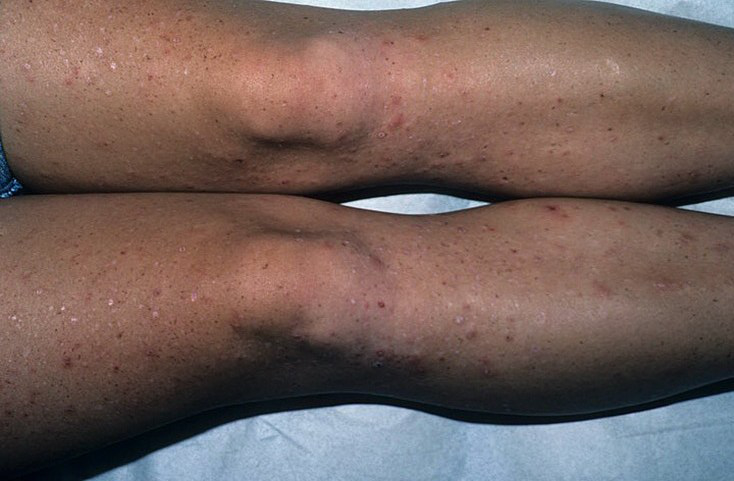
Но к распространенным вариантам также относится инфицирование фолликулов на бедрах (с внутренней и внешней стороны) и лобковой части.
Такая статистика обусловлена обильным ростом волос на этих участках кожи.
Основными причинами фолликулита в области нижних конечностей и лобковой зоны является:
- раздражение верхнего слоя эпидермиса после бритья станком
- травмирование кожных покровов
- инфекционные дерматиты
К числу причин можно отнести и гормональные сбои (в том числе вызванные длительной терапией гормональными препаратами), нарушения микроциркуляции в сосудах.
Воспалительные процессы инфекционного генеза в паху встречаются редко.
Исключительно на участках, где имеется волосяной покров.
Если говорить о проявлениях фолликулита в интимной зоне, подобное течение патологического процесса практически исключается.
То есть случаи, когда клинические признаки заболевания диагностируются у мужчин на члене и на половых губах у женщин единичны.
Лечение
Вне зависимости от характера течения болезни, формы или вида, основным направлением лечения фолликулита выступает этиотропная терапия.
Основная цель лечения —подавление жизнедеятельности возбудителя и устранение первопричины развития заболевания.
Важнейшим требованием является усиленное соблюдение гигиены.
На весь период лечения пациенту показано мыться только с антисептическими средствами.
Нужно регулярно обрабатывать пораженные участки левомицетином, спиртом.

Исключить внешние факторы, провоцирующие болезнь.
Например, в случае псевдомонадного фолликулита часто достаточно не мыться в горячей воде и не перегреваться в течение 7-10 дней.
При условии нормального состояния иммунной системы болезнь отступит без специальной терапии.
Касательно того, как лечить другие формы болезни, обязательно обращайтесь к врачу.
Так как в каждом случае тактика лечения может быть разной.
При стафилококковом виде применяются антибиотики широкого спектра и антисептические средства.
При грибковых поражениях необходимы противогрибковые препараты.
В рамках комплексного подхода к медикаментозной терапии добавляют лечение народными средствами.
При отсутствии осложнений возможно лечение в домашних условиях, при условии регулярных консультаций врача.
Госпитализации требуют осложненные формы болезни, сопровождающиеся сильных ухудшением общего состояния, образованием абсцессов.
Длительность лечения определяется индивидуально, но в большинстве случаев терапия длится не менее 7 дней.
Мазь от фолликулита
Лекарства для наружного применения (мазь, крем) часто выступают основой медикаментозной терапии.
Эти препараты назначаются в соответствии с характером заболевания.
Антибиотики при стафилококковом фолликулите – Бактробан, Кетозорал в форме мази применяется в случаях грибкового вида патологии.
Если диагностирован псевдофолликулит, применяется средство в форме геля под названием Бензамицин.

Подобных примеров масса, все зависит от причин развития болезни и возбудителя, может применятся даже ихтиоловая мазь.
Именно поэтому важно обращаться к врачу и не заниматься самолечением.
Заразен ли фолликулит
Фолликулит заразен и передается контактно-бытовым путем.
Инфицирование возможно при тесном бытовом контакте с больным, использовании общего белья, предметов гигиены.
Любой контакт кожи с возбудителем, в том числе, попавшим на предметы домашнего обихода, может стать причиной заражения.
Чтобы не заболеть, важно всегда соблюдать правила личной гигиены, осторожно проводить любые косметические процедуры, даже бритье.
При обнаружении фолликулита, обращайтесь к грамотным дерматовенерологам.
Среди большого числа проявлений ВИЧ-инфекции поражения кожи занимают особое место. Поражения кожи могут иметь важное диагностическое значение как для острой стадии болезни, так и для определения стадий вторичных заболеваний.
Among a large number of manifestations of HIV infection lesions occupy a special place. Skin lesions may have important diagnostic value for the diagnosis of acute stage of the disease, and to identify the stages of secondary diseases.
Заболеваемость ВИЧ-инфекцией (ВИЧ — вирус иммунодефицита человека) сохраняет тенденцию к неуклонному росту. Существенно увеличилось число больных с поздними стадиями ВИЧ-инфекции и наличием различных оппортунистических заболеваний, в частности поражений кожного покрова. Диагностика этих изменений нередко представляет большие трудности на догоспитальном уровне для врачей общего профиля, а также дерматологов и инфекционистов [1, 2].
Среди множества специфических проявлений ВИЧ-инфекции и оппортунистических заболеваний поражения кожи занимают особое место, т. к. уже с момента манифестации заболевания являются наиболее частым и ранним ее проявлением [1–3]. Вовлечение кожи в патологический процесс обусловлено как иммунодефицитом в целом, так и тем обстоятельством, что ВИЧ поражает не только Т-лимфоциты-хелперы, но и клетки Лангерганса, играющие важную роль в дермальных иммунных реакциях и, возможно, являющиеся местом первичной репликации ВИЧ в коже.
В 2011–2014 гг. в ИКБ № 2, куда госпитализируется более 80% ВИЧ-инфицированных больных в г. Москве, нами наблюдались 586 пациентов с различными кожными проявлениями, что составило 69% от общего числа госпитализированных (в 4-й стадии ВИЧ-инфекции — 88%). Их можно подразделить на 3 группы: кожные проявления при манифестации ВИЧ-инфекции, заболевания в стадии вторичных проявлений (4-я стадия) и поражения кожи, не связанные с ВИЧ-инфекцией. Поражения кожи могут иметь важное диагностическое значение. Часто на ранних стадиях развития болезни (уже через 3–4 недели после заражения) на коже больного может появиться острая экзантема (3-е место после мононуклеозоподобного синдрома и лимфаденопатии), состоящая из отдельных эритематозных пятен и папул [1, 4]. Пятнисто-папулезная сыпь — своеобразное поражение кожи у ВИЧ-инфицированных, которое до сих пор не получило определенного нозологического статуса. Сыпь имеет распространенный характер, обычно сопровождается легким зудом. Она локализуется в основном на верхней половине туловища, шее и лице; дистальные отделы конечностей поражаются редко. Папулезную сыпь рассматривают как проявление морфологической реакции кожи на инфицирование ВИЧ. Изменения на коже сопровождаются лихорадкой, изменениями на слизистых ротоглотки (чаще кандидоз полости рта). После стихания острой фазы (2–2,5 недели) пятна и папулы подвергаются спонтанному регрессу. Экзантема при острой ВИЧ-инфекции не отличается морфологической спецификой, поэтому в стационар больные чаще всего направляются с диагнозами: острая респираторная вирусная инфекция, токсикоаллергическая реакция, корь, краснуха. Надо отметить, что состояние иммунного статуса у этой категории больных не имеет существенных отклонений от нормы, а исследование крови на ВИЧ методом иммуноферментного анализа имеет сомнительные или отрицательные результаты, т. к. специфические антитела еще отсутствуют. В ранние сроки диагноз ВИЧ-инфекции может быть подтвержден только методом полимеразной цепной реакции. Серологические реакции на ВИЧ у этих больных становятся положительными позже, чаще через 6–12 недель от начала острой фазы болезни.
Экзантема, наблюдаемая в периоде сероконверсии, обусловлена самим вирусом иммунодефицита, все другие изменения кожи связаны с оппортунистическими заболеваниями, развивающимися на фоне иммунодефицита при снижении СД4+ менее 300 клеток. Этиологически можно выделить 3 основные группы кожных проявлений у больных ВИЧ/СПИД: неопластические, инфекционные (вирусные, грибковые, бактериальные, паразитарные) и дерматозы неясной этиологии. Первые две группы относятся к ВИЧ-индикаторным заболеваниям, так как все виды опухолей у больных ВИЧ/СПИД имеют вирусную этиологию и их формирование обусловлено тяжелым иммунодефицитом. Дерматозы неясной этиологии, возможно, обусловлены лекарственно-аутоиммунными поражениями, особенно при длительной антиретровирусной терапии (АРВТ) (в частности — Эпивиром) или специфической терапии оппортунистических заболеваний, не исключено и непосредственное воздействие ВИЧ на кожу. Самыми распространенными у больных СПИДом являются грибковые поражения кожи и слизистых. Наиболее часто наблюдаются кандидоз, руброфития, разноцветный лишай (81%) [5, 6]. Другие микозы встречаются значительно реже. Особенностями грибковых заболеваний при ВИЧ-инфекции являются: поражение лиц молодого возраста, особенно мужчин; быстрая генерализация с формированием обширных очагов, расположенных по всему кожному покрову; упорное течение; резистентность к проводимой терапии. Характерно сочетание поражения кожи и слизистых оболочек (полость рта, гениталии). Второе место среди поражений кожи занимает себорейный дерматит (68%). Как правило, у этих больных он протекает остро и тяжело. Вначале процесс локализуется только на лице (брови, усы, область рта), волосистой части головы и на разгибателях верхних конечностей. При развитии процесса на волосистой части головы можно обнаружить довольно сильное шелушение, напоминающее перхоть. Иногда при ВИЧ процесс может распространиться по всему кожному покрову в виде зудящих экзематозных бляшек. Такое распространение дерматита говорит о резко пониженном иммунитете и является плохим прогностическим признаком. Третье место по частоте занимают герпетические инфекции, в частности вирусы простого герпеса 1-го и 2-го типов и varicella zoster (28%) [7, 8]. Герпетические высыпания могут появиться на любом участке кожи и слизистых оболочек, но чаще они возникают на губах, половых органах или в перианальной области. Высыпания часто трансформируются в крупные, болезненные, долго не заживающие язвы. Нередко клинические проявления герпеса напоминают ветряную оспу или импетиго. Помимо поражения кожи и слизистых оболочек, при ВИЧ-инфекции у больных часто развивается герпетический проктит, который проявляется в виде болезненной отечной эритемы в перианальной области. Опоясывающий лишай при условии возникновения его у лиц молодого возраста из группы риска, отсутствии провоцирующих заболеваний и иммуносупрессивной терапии служит индикатором ВИЧ-инфекции. Пузырьковые высыпания сопровождаются сильными болями, оставляют рубцы, рецидивируют, что не наблюдается у лиц без иммунного дефицита. Наиболее характерным дерматологическим неопластическим проявлением ВИЧ-инфекции остается саркома Капоши, вызванная вирусом простого герпеса 6-го типа [9, 10]. Надо отметить, что ее частота снизилась с 40% у мужчин со СПИДом в 1980–90 гг. до 9% начиная с 2000 г. Основными клиническими особенностями саркомы Капоши является то, что у большинства больных заболевание развивается в возрасте до 35 лет; очаги поражения на коже носят распространенный характер; склонность к быстрой генерализации процесса (в первую очередь поражаются легкие, желудочно-кишечный тракт, лимфоузлы и слизистая оболочка полости рта); высокая смертность в течение короткого времени без лечения. Появление на коже различных пятен синюшного или розового цвета, бляшек или папул у лиц молодого возраста обязательно должно насторожить лечащего врача в отношении ВИЧ-инфекции и требует обязательного проведения гистологического исследования биоптата кожи для исключения саркомы Капоши. В поздних стадиях болезни кожные элементы (розеолы, папулы, пятна) становятся многочисленными, инфильтрируются, могут изъязвляться. Обильные кожные проявления практически всегда сопровождаются выраженным лимфостазом, поражением суставов, с развитием контрактур. Примером прямой зависимости поражения кожи от ВИЧ-инфекции может служить папилломавирусная инфекция кожи и слизистых оболочек (10%) [11, 12]. У ВИЧ-инфицированных больных изменения на коже имеют необычный вид, поражают нетипичные места, многочисленные, имеют участки распада в центре папул, сливаются и после хирургического удаления практически всегда рецидивируют. Эти элементы появляются преимущественно на лице, а также в области гениталий и могут быть крупными (гигантский моллюск), напоминать рак кожи, остроконечные кондиломы, обычные вульгарные бородавки и кератоакантомы.
У трети ВИЧ-инфицированных в течение нескольких недель от начала лечения различных оппортунистических инфекций этиотропными препаратами, а также АРВТ появлялась распространенная зудящая сыпь в виде эритематозных пятен и папул, что расценивалось как медикаментозная токсикоаллергическая реакция. Нами наблюдались и более тяжелые медикаментозные реакции, в частности синдром Стивенса–Джонсона и токсический эпидермальный некролиз.
Учитывая все вышеизложенное, больным ВИЧ-инфекцией с поражениями кожи и слизистых оболочек необходимо постоянное наблюдение врача-дерматолога. Для достижения положительного эффекта от проводимого лечения необходимы более продолжительные курсы терапии кожных заболеваний и максимальные дозы используемых препаратов, а после излечения — прием показанных препаратов профилактически. Помимо терапии кожных заболеваний больным ВИЧ-инфекцией показано назначение АРВТ. Диагностика кожных проявлений имеет важное практическое значение, так как способствует более раннему установлению диагноза ВИЧ-инфекции, своевременному назначению АРВТ, улучшению качества и продолжительности жизни пациента.
Литература
М. В. Нагибина* , 1 , кандидат медицинских наук
Н. Н. Мартынова**, кандидат медицинских наук
О. А. Преснякова**
Е. Т. Вдовина**
Б. М. Груздев***, кандидат медицинских наук
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ГБУЗ ИКБ № 2, Москва
*** МГЦ СПИД, Москва
Читайте также:

