Восприимчивость детского организма к инфекциям
Обновлено: 25.04.2024
Острые респираторные заболевания (ОРЗ) – самые частые инфекционные заболевания у детей [1]. Несмотря на новые знания об этиопатогенезе ОРЗ и огромное количество лекарственных препаратов в арсенале врача, заболевания респираторного тракта сохраняют 1-е место в структуре общей заболеваемости как у детей, так и у взрослых.
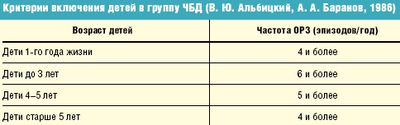
В.Ю.Альбицкий и А.А.Баранов еще в 1986 г. предложили критерии [3], согласно которым ЧБД считаются те, кто переносит от 3 до 7 и более эпизодов ОРЗ в год (табл. 1). При этом авторы рекомендовали определять принадлежность к группе ЧБД в зависимости от возраста и частоты заболеваемости.
Таблица 1. Критерии включения детей в группу ЧБД
| Возраст детей | Частота ОРЗ (эпизодов/год) |
|---|---|
| 1-го года жизни | ≥4 |
| до 3 лет | ≥6 |
| 4–5 лет | ≥5 |
| старше 5 лет | ≥4 |
Термин ЧБД достаточно широко известен как среди врачей-педиатров, так и среди медицинских сестер, работающих с детьми, педагогов, родителей. Но несмотря на серьезные исследования по этой проблеме, проведенные ведущими педиатрами нашей страны [3–6], еще существуют разногласия как в терминологии, так и в вопросах этиологии, патогенеза, лечения, профилактики и диспансерного наблюдения за этой категорией детей.
В то же время некоторые клиницисты высказывают мнение, что если у детей раннего возраста, особенно в период адаптации к детскому коллективу, ОРЗ протекают легко, то допустимая частота заболеваний может достигать до 8 раз в год [6, 9].
Более частым эпизодам ОРЗ у детей раннего возраста по сравнению со взрослыми способствуют анатомо-физиологические особенности дыхательной системы, прежде всего мукоцилиарной и сурфактантной, особенности строения бронхов. Кроме того, воздействие экопатогенных факторов приводит к сенсибилизации детского организма, существенно снижая его резистентность к вирусным и бактериальным инфекциям. Многократные атаки вирусов и бактерий при респираторных инфекциях приводят к напряжению, затем к истощению иммунной системы, а впоследствии к нарушениям компенсаторно-адаптационных механизмов и снижению иммунорезистентности, что способствует хронизации процесса. Развивающаяся при этом иммунологическая недостаточность является патологическим фоном, который приводит к формированию контингента ЧБД.
Среди ЧБД больше половины страдают хроническими заболеваниями носоглотки и гиперплазией элементов лимфоглоточной ткани носоглотки. Полученные в последние годы данные свидетельствуют о том, что иммунная система ЧБД хотя и не имеет грубых первичных и приобретенных дефектов, но характеризуется крайней напряженностью процессов иммунного реагирования, нарушением межклеточной кооперации и недостаточностью резервных возможностей. Безусловно, такое состояние иммунной системы является фактором высокого риска развития осложнений [10].
Учитывая высокую частоту детей с рецидивирующими респираторными инфекциями, необходимо проводить диспансерноенаблюдение за детьми этой группы, а для установления причины высокого уровня респираторной заболеваемости в индивидуальном порядке проводить комплексное обследование. Однако все дети с рецидивирующими инфекциями нуждаются в тщательном осмотре педиатром и обязательном осмотре ЛОР-врачом, включающем оценку состояния миндалин, аденоидов, придаточных полостей носа и барабанных перепонок. Кроме того, эти дети подлежат проведению профилактических мероприятий, направленных на снижение уровня респираторной заболеваемости.
Оздоровление ЧБД требует планомерного и систематического подхода, состоящего из проведения реабилитационных мероприятий между эпизодами ОРЗ, иммунопрофилактики, вакцинации, этиопатогенетического лечения ОРЗ.
Основу профилактики рецидивирующих респираторных заболеваний у ЧБД, безусловно, составляет формирование собственного адекватного иммунного ответа. Способствуют этому оптимизация образа жизни, в том числе установление рационального режима дня, полноценное питание, контроль за окружающей средой.
Коррекция режима дня у детей с рецидивирующими инфекциями направлена на устранение занятий и игр, приводящих к переутомлению, перевозбуждению ребенка, уменьшение стрессовых ситуаций, а также нормализацию сна.
В составе проводимого комплекса профилактических мероприятий детям из группы ЧБД для уменьшения частоты эпизодов ОРЗ необходимо сбалансированное питание. Оно должно быть разнообразным, содержащим адекватное количество витаминов и микроэлементов с учетом суточной потребности ребенка в белках, жирах и углеводах.
В последнее время в программах профилактики рецидивирующих респираторных инфекций уделяется большое внимание контролю за окружающей средой. Профилактика частых ОРЗ состоит в уменьшении возможных контактов с источниками инфекции в семье и детских дошкольных учреждениях, использовании противоэпидемических мероприятий в очаге инфекции, сокращении использования городского транспорта, удлинении времени пребывания на свежем воздухе, контроле над влажностью и температурой помещений. Кроме того, частая респираторная заболеваемость тесно связана с пассивным курением, поэтому прекращение курения в семье – важное условие лечения и профилактики.
Не теряют своей актуальности в профилактике частых ОРЗ полоскание зева антисептическими отварами ромашки, зверобоя и др.; ирригационная терапия: промывание носовых ходов солевыми растворами (физиологический раствор, Салин, Аквамарис, Физиомер и др.), а также разнообразные программы закаливания [4, 5, 11, 12].
Закаливание – это система мероприятий, направленных на повышение устойчивости генетически предопределенных механизмов защиты и приспособление организма ко многим факторам с тем, чтобы суточные и сезонные, периодические и внезапные изменения температуры, атмосферного давления и т.д. не вызывали резких изменений в растущем организме. В основе закаливания лежит тренировка вазомоторных механизмов адекватной реакции на холодовые воздействия. Систематическое контрастное воздушное или водное закаливание сопровождается повышением устойчивости организма к температурным колебаниям окружающей среды и повышением иммунологической реактивности организма. Адаптационные возможности ребенка хорошо поддаются тренировке. Использование любых методов закаливания совершенствует работу аппарата терморегуляции и расширяет возможности приспособления организма к изменившимся температурным условиям. Закаливание не требует очень низких температур, важны контрастность воздействия и систематичность проведения процедур. Хорошо закаливают воздействия на подошвы ног и постепенно – на всю кожу туловища и конечностей. Максимальная длительность закаливающих процедур не должна превышать 10–20 мин, гораздо важнее его регулярность и постепенность. Закаливающие процедуры хорошо сочетать с проведением гимнастики и массажа грудной клетки.
Закаливание после нетяжелого ОРЗ можно возобновить (или начать) через 7–10 дней, при заболевании с длительностью температурной реакции более 4 дней – через 2 нед, а после 10-дневной лихорадки – через 3–4 нед. Эффективность закаливания можно оценить не ранее, чем через 3–4 мес, а максимальный эффект наблюдается через 1 год от начала регулярных процедур.
Одним из самых важных профилактических мероприятий является вакцинация. Частые ОРЗ не могут быть поводом для отвода от прививок. По окончании ОРЗ, как и других острых заболеваний, вакцинацию возможно проводить через 2–3 нед после нормализации температуры. Для специфической профилактики гриппа у детей рекомендуются субъединичные и сплит-вакцины [Гриппол (Россия), Агриппал S1, Бегривак (Германия), Ваксигрип (Франция), Инфлювак (Нидерланды), Флюарикс (Германия), Инфлексал (Швейцария)]. Иммунитет вырабатывается через 14 дней после вакцинации, он кратковременный (6–12 мес) и типоспецифичный, что требует ежегодных прививок. Профилактическая эффективность – 70–90%, но и при заражении другими разновидностями гриппа заболевание протекает в более легкой форме. Прививочные реакции и осложнения у сплит-вакцин, как правило, отсутствуют.
Пневмококк и гемофильная палочка являются наиболее частыми бактериальными причинами возникновения ОРЗ у детей до 5 лет, поэтому целесообразно проводить вакцинацию против пневмококковой инфекции и Haemophilus influenzae у детей с рецидивирующими заболеваниями респираторного тракта, что позволяет снизить частоту менингитов, тяжелых бактериальных пневмоний, ЛОР-патологии.
В последние годы очень важным направлением снижения заболеваемости респираторными инфекциями, кроме комплекса общеукрепляющих мероприятий, является неспецифическая профилактика, включающая назначение иммуномодулирующей терапии. При этом большинство исследователей подчеркивают, что использование иммуномодулирующих препаратов с целью предупреждения респираторных инфекций у ЧБД должно проводиться на фоне обязательного соблюдения общих принципов профилактики и оздоровления.
Иммуномодуляторы представляют собой неоднородную группу препаратов, они могут быть бактериального или растительного происхождения, содержать тимические гормоны, медиаторы иммунной системы или синтетические вещества. Наиболее широкое применение в педиатрической практике получили растительные препараты из эхинацеи пурпурной, бактериальные лизаты и их синтетические аналоги, пидотимод, интерфероны и индукторы выработки интерферонов. Назначение этих лекарственных средств не требует предварительного иммунологического обследования, они характеризуются хорошей переносимостью, имеются убедительные данные об их высоком терапевтическом эффекте.
Критерии включения в исследование: дети в возрасте от 3 до 16 лет, госпитализированные в стационар с клиникой ОРЗ, страдающие рецидивирующими респираторными заболеваниями (рецидивирующий ринит, ларингит, ларинготрахеит, синусит, ангина, бронхит, отит, хронический фарингит, хронический тонзиллит).
Критерии исключения из исследования: наличие гиперчувствительности; аллергические реакции на компоненты препарата; наличие тяжелых сопутствующих заболеваний (сахарный диабет, туберкулез, хронические заболевания печени и почек, онкологические заболевания в любой стадии, ВИЧ); несоблюдение пациентом назначений врача; острые воспалительные заболевания ЖКТ; применение других иммуномодуляторов за 4 нед до начала исследования и в период исследования; отказ родителей от участия в программе.
Среди наблюдаемых детей в основном были дети в возрасте от 3 до 7 лет: в группе наблюдения их было 65%, в контрольной группе – 80%. По гендерному и возрастному признаку группы были сравнимы.
У детей, поступавших в стационар, длительность ОРЗ была от нескольких часов до 10 дней, преимущественно 1–2 сут. В среднем в группе наблюдения срок давности заболевания составил 2,1±0,9, в контрольной группе – 1,9±0,7 дня.
Среди детей, поступавших на стационарное лечение, преобладали заболевания верхних дыхательных путей, такие как острый ринофарингит (27,5% в группе наблюдения и 30% в контрольной) и острый стенозирующий ларинготрахеит (50% в обеих группах).
Все наблюдаемые дети, поступавшие в стационар, имели различные рецидивирующие заболевания респираторного тракта, среди которых преобладали стенозирующий ларинготрахеит, ринит, аденоидит, ангина, хронический тонзиллит и др. (табл. 2).
Таблица 2. Структура рецидивирующих респираторных заболеваний у наблюдаемых детей
| Группа наблюдения | Контрольная группа | |||
|---|---|---|---|---|
| т | % | т | % | |
| ринит | 6 | 15 | – | – |
| стенозирующий ларинготрахеит | 17 | 42,5 | 8 | 40 |
| аденоидит | 1 | 2,5 | 4 | 20 |
| ангина | 8 | 20 | – | – |
| ларингит | 1 | 2,5 | – | – |
| синусит | 1 | 2,5 | – | – |
| отит | 4 | 10 | 4 | 20 |
| бронхит | 1 | 2,5 | 2 | 10 |
| хронический тонзиллит | 6 | 15 | – | – |
Рис. 1. Динамика температурной реакции

Динамика симптомов интоксикации, других проявлений ОРЗ (вялость, осиплость голоса, боль в горле и др.) достоверно не отличалась в наблюдаемых группах. Однако продолжительность кашля была меньше в группе наблюдения (5,2±2,0 дня) по сравнению с детьми контрольной группы (6,0±1,9 дня) (p>0,05).
В составе комплексной терапии антибактериальную получали 37,5% больных из группы наблюдения, 50% детей контрольной группы (цефалоспорины I и III поколения, защищенные пенициллины).
Для цитирования: Зайцева О.В. Профилактика и лечение рецидивирующих инфекционных заболеваний дыхательных путей у детей. РМЖ. 2014;21:1497.
Наиболее высокий уровень заболеваемости респираторными инфекциями отмечается у детей дошкольного и младшего школьного возраста, которые посещают организованные коллективы. Высокая частота инфекций дыхательной системы у детей обусловлена физиологическими особенностями созревания иммунной системы ребенка, неблагоприятными анте- и перинатальными факторами; курением родителей, особенно матерей; типом конституции; высокой контагиозностью вирусных инфекций, нестойким иммунитетом к ряду возбудителей, разнообразием серо- и биотипов пневмотропных бактерий (пневмококков, стафилококков, гемофильной палочки) и многими другими факторами.
Частые повторные эпизоды инфекций респираторного тракта у детей являются значимой социально-экономической проблемой российского здравоохранения, т. к. не только приводят к ухудшению здоровья и качества жизни пациентов, но и наносят существенный экономический ущерб семье и обществу. Значительное число ОРЗ протекает легко и не требует проведения серьезных лечебных мероприятий. Известно, что контакт и взаимодействие с респираторными инфекциями – необходимые условия становления иммунной системы ребенка, приобретения им иммунологического опыта, необходимого для адекватного реагирования на микробную агрессию. Однако частые респираторные заболевания, следующие одно за другим, безусловно, оказывают на ребенка негативное воздействие. Дети с частыми повторными (рекуррентными) заболеваниями органов дыхания требуют особого внимания врача и должны наблюдаться во II диспансерной группе здоровья с соблюдением соответствующих профилактических и терапевтических стандартов. Повторные респираторные инфекции способствуют формированию хронических заболеваний и могут определить на долгие годы неудовлетворительное качество здоровья ребенка [2, 7, 10].
Профилактика респираторных инфекций ЧБД предусматривает ограничение контактов ребенка с больными гриппом и ОРВИ, проведение санитарно-гигиенических мероприятий, сокращение использования городского транспорта и удлинение времени пребывания ребенка на воздухе. Частая респираторная заболеваемость тесно связана с пассивным курением, поэтому его прекращение – важное условие лечения и профилактики [2, 5]. Все дети, склонные к частым респираторным инфекциям, должны быть осмотрены и, при необходимости, пролечены ЛОР-врачом.
Одним из основных методов повышения сопротивляемости ребенка инфекционным агентам служит закаливание. Систематическое контрастное воздушное или водное закаливание сопровождается повышением устойчивости организма к температурным колебаниям окружающей среды и увеличением иммунологической реактивности организма. Использование любых методов закаливания совершенствует работу аппарата терморегуляции и расширяет возможности приспособления организма к изменившимся температурным условиям. Закаливание не требует очень низких температур, важны контрастность воздействия и систематичность проведения процедур. Хорошо закаливает воздействие на подошвы ног и, постепенно, – на всю кожу туловища и конечностей. Максимальная длительность закаливающих процедур не должна превышать 10–20 мин, гораздо важнее их регулярность и постепенность. Было показано, что у ЧБД сочетание местных закаливающих процедур стоп и носоглотки через 3–4 мес. восстанавливало цитологические показатели носового секрета. Закаливание после нетяжелого ОРЗ можно возобновить (или начать) через 7–10 дней, при заболевании с длительностью температурной реакции более 4 дней – через 2 нед., а после 10-дневной лихорадки – через 3–4 нед. [7]. Эффективность закаливания можно оценить не ранее чем через 3–4 мес., а максимальный эффект наблюдается через 1 год от начала регулярных процедур.
Вакцинация ЧБД – одно из самых важных профилактических мероприятий. Поскольку частые ОРВИ у этой группы детей не свидетельствуют о наличии иммунодефицита, они не могут быть поводом для отвода от прививок, противопоказанием к их проведению. По окончании ОРВИ, как и других острых заболеваний, прививки можно проводить через 2–3 нед. после нормализации температуры тела [10].
С учетом ведущей роли дисфункций иммунитета в развитии повышенной восприимчивости детского организма к респираторным инфекциям кроме комплекса общеукрепляющих мероприятий с целью профилактики используется целый ряд иммуномодулирующих лекарственных средств. При этом большинство авторов подчеркивают, что такие препараты с целью предупреждения респираторных инфекций у ЧБД должны применяться с обязательным соблюдением общих принципов профилактики и оздоровления.
Из средств неспецифической профилактики респираторных инфекций в педиатрии часто применяются препараты, полученные из эхинацеи. В современной медицине чаще применяют препараты из эхинацеи пурпурной (Echinacea purpurea). Известно, что эхинацея богата полисахаридами и фитостеринами, оказывающими стимулирующее действие на иммунную систему, содержит макро- и микроэлементы: железо, цинк, селен, калий, кальций, молибден, серебро, кобальт, никель, барий, бериллий, ванадий, марганец. Эхинацея пурпурная содержит активные вещества, укрепляющие естественные защитные силы организма и действующие в качестве неспецифических стимуляторов. При назначении эхинацеи наблюдаются повышение фагоцитоза, иммунорегуляторного индекса, функциональной активности В-лимфоцитов, индукция синтеза интерферона. В эксперименте показано, что перитонеальные макрофаги мышей под влиянием эхинацеи продуцировали фактор некроза опухоли, интерлейкины (ИЛ): ИЛ-1, ИЛ-6, ИЛ-10.
Как в нашей стране, так и за рубежом хорошо известен и наиболее часто применяется препарат из высушенного сока эхинацеи Иммунал®. Повышая количество лейкоцитов (гранулоцитов) и стимулируя фагоцитоз, активные вещества препарата подавляют рост и размножение микроорганизмов в организме человека и способствуют уничтожению болезнетворных бактерий. Многочисленными исследованиями установлено противовирусное действие препаратов из эхинацеи пурпурной в отношении респираторных вирусов, а также возбудителей гриппа и герпеса.
Показания к применению препарата Иммунал® плюс С: профилактика простудных заболеваний и гриппа; комплексное лечение инфекционно-воспалительных заболеваний респираторного тракта для ускорения процесса выздоровления, в т. ч. при антибиотикотерапии хронических инфекционных заболеваний, сопровождающихся снижением иммунитета, а также в качестве источника витамина С, необходимого при ОРЗ. Но следует отметить, что начинать лечение препаратом Иммунал® плюс С необходимо как можно раньше – при первых клинических признаках заболевания.
Применять Иммунал® плюс С рекомендуется внутрь независимо от приема пищи детям старше 12 лет и взрослым по 2–3 мл 3 р./сут, детям в возрасте от 4 до 12 лет – по 1–2 мл 3 р./сут, детям в возрасте от 1 до 4 лет – по 1 мл 3 р./сут. Для достижения терапевтического эффекта препарат следует принимать в течение 7–10 дней. Повторные курсы возможны после 14-дневного перерыва.
Таким образом, целенаправленные комплексные профилактические мероприятия могут существенно снизить вероятность развития респираторных заболеваний. Однако при возникновении инфекционного процесса дети из группы часто болеющих требуют применения особых методов терапии. Существует ошибочное мнение, что ОРЗ можно не лечить – заболевание пройдет самостоятельно. Однако респираторные инфекции без адекватного лечения часто принимают затяжное или осложненное течение, легкий насморк может закончиться тяжелой пневмонией или синуситом. У ЧБД особое значение приобретает повышение эффективности терапии респираторного заболевания. Безусловно, лечение, как и профилактика ОРЗ, должны быть комплексными и проводиться индивидуально в каждом конкретном случае.
В заключение необходимо еще раз подчеркнуть, что часто болеющие дети – группа диспансерного наблюдения, достаточно многочисленная среди детей дошкольного возраста, проживающих в экологически неблагоприятных регионах и посещающих детские дошкольные учреждения. Эти дети нуждаются в проведении регулярных комплексных профилактических мероприятий, а при развитии острой респираторной инфекции – в своевременной и адекватной терапии.


Отечественные педиатры до настоящего времени в группу ЧБД относят детей на основании критериев, предложенных А. А. Барановым и В. Ю. Альбицким (табл.).
В то же время некоторые клиницисты высказывают мнение, что если у детей раннего возраста, особенно в период адаптации к детскому коллективу, острые респираторные вирусные инфекции (ОРВИ) протекают легко, то допустимая частота заболеваний может достигать до 8 раз в год.
Хорошо известно, что острые респираторные инфекции являются самыми частыми заболеваниями как у детей, так и у взрослых. Но наиболее высокий уровень заболеваемости респираторными инфекциями отмечается у детей дошкольного возраста, посещающих организованные коллективы. Частые ОРЗ у детей в настоящее время представляют не только медицинскую, но и социально-экономическую проблему.
С другой стороны, контакт и взаимодействие с респираторными инфекциями — необходимые условия становления иммунной системы ребенка, приобретение им иммунологического опыта, необходимого для адекватного реагирования на микробную агрессию. Однако частые респираторные заболевания, следующие одно за другим, безусловно, оказывают на ребенка негативное воздействие.
Таким образом, выделение диспансерной группы ЧБД является своевременным и актуальным, однако в каждом конкретном случае необходимо проводить комплексное обследование ребенка для уточнения причин у него высокого уровня респираторной заболеваемости. Диспансерное наблюдение за детьми, у которых повторные эпизоды респираторных инфекций обусловлены стойкими изменениями иммунитета, врожденными или наследственными заболеваниями, должно проводиться в строгом соответствии с основным заболеванием.
Основными возбудителями ОРЗ являются различные вирусы, тропные к эпителию дыхательных путей и способствующие их вторичной колонизации бактериями. Вирусные инфекции повреждают эпителий дыхательных путей и вызывают воспаление слизистой оболочки. Для воспаления респираторного тракта характерно повышение продукции вязкой слизи, что проявляется насморком и кашлем. Вязкий секрет способствует прилипанию (адгезии) возбудителей респираторных инфекций на слизистых оболочках респираторного тракта, что создает благоприятные условия для развития бактериальной суперинфекции. В свою очередь микроорганизмы и их токсины ухудшают движение ресничек эпителия, нарушают дренажные функции бронхиального дерева, снижают бактерицидные свойства бронхиального секрета и местную иммунологическую защиту дыхательных путей с высоким риском развития затяжного и хронического течения воспалительного процесса. Поврежденный эпителий бронхов имеет повышенную чувствительность рецепторов к внешним воздействиям, что значительно повышает вероятность развития бронхоспазма и бактериальной суперинфекции.
Основными бактериальными возбудителями ОРЗ являются пневмотропные микроорганизмы, в т.ч. пневмококк и другие грамположительные кокки, палочка гемофилюс инфлюенца, моракселла катаралис, атипичные возбудители (микоплазма, хламидофила пневмонии) и пр. Считают, что первичная вирусная инфекция часто приводит к активации эндогенной условно-патогенной флоры. Причина более легкой трансформации этой микрофлоры в патогенную у ряда детей связана с индивидуальными особенностями иммунного ответа, нарушением барьерной функции респираторного тракта, снижением местного иммунитета, а также с суперинфицированием бактериальными агентами. Присоединение бактериальной инфекции приводит к нарастанию тяжести заболевания и может быть основной причиной неблагоприятного исхода болезни. Характер клинической картины ОРЗ во многом обусловлен патогенными свойствами возбудителя. Однако известно, что чем моложе ребенок, тем меньше специфических признаков имеет заболевание.
Таким образом, инфекционное воспаление является основным патогенетическим звеном клинических проявлений острых респираторных инфекций. Развитие воспаления слизистой оболочки верхних и нижних дыхательных путей способствует гиперсекреции вязкой слизи, формированию отека слизистой оболочки респираторного тракта, нарушению мукоцилиарного транспорта и бронхиальной обструкции. Это приводит к заложенности носа, выделениям носового секрета, гиперемии зева, боли в горле, отеку миндалин, осиплости голоса, появлению кашля и других симптомов острого респираторного заболевания, в том числе ларинготрахеита и острого бронхита. У части больных развивается обструктивный бронхит.
Лечение
Известно, что до настоящего времени не существует универсальных и безопасных химиопрепаратов, эффективных в отношении большинства респираторных вирусов. Противовирусные химиопрепараты (рибавирин и др.) у детей применяют только при тяжелом течении ОРВИ установленной этиологии. Использование противовирусных мазей типа Оксолиновой может рассматриваться только как профилактическое средство, а назначение таких препаратов, как Ремантадин, детям первых лет жизни противопоказано вследствие его высокой токсичности и недостаточной эффективности.
Достаточно широкое применение при вирусных респираторных инфекциях нашли препараты интерферона, которые как факторы защиты и средства поддержания иммунитета обладают самым широким спектром профилактического и лечебного действия. Интерфероны — естественные факторы защиты, то есть вырабатываются самим организмом при его контакте с инфекциями различного происхождения (вирусами, бактериями, грибами и др.). Следовательно, применение препаратов интерферона абсолютно естественно для человека. Кроме того, в силу своих биологических особенностей воздействия на возбудителей инфекций, интерфероны являются универсальными защитниками, они эффективны в отношении всех респираторных вирусов. Помимо противовирусного и противомикробного воздействия препараты интерферона повышают собственные защитные силы и предотвращают вредное воздействие радиации на организм человека.
Очевидно, что в практическом здравоохранении препараты интерферона широко применяются. Сначала это были препараты лейкоцитарного интерферона, получаемого из донорской крови. Впоследствии развитие биотехнологии позволило создать рекомбинантные (генно-инженерные) препараты человеческих интерферонов, во многом превосходящие препараты первого поколения. В настоящее время существует довольно много препаратов рекомбинантных интерферонов как отечественного, так и зарубежного производства: Виферон, Реаферон, Гриппферон, Реальдирон, Интрон А, Роферон-А и др.
Иммунокоррегирующие и иммуномодулирующие препараты при ОРЗ оказывают как профилактический, так и лечебный эффект. Имеются убедительные данные о высоком терапевтическом эффекте при лечении детей с гриппом и ОРВИ индукторов эндогенного интерферона (Амиксин, Арбидол, Циклоферон). При этом Арбидол может быть использован у детей начиная с 2-летнего возраста, Циклоферон разрешен для применения у детей старше 4 лет, а Амиксин — только у детей старше 7 лет. Безусловно, синтетические иммуностимуляторы, препараты тимического происхождения и некоторые другие обладают выраженными эффектами на иммунную систему, однако решение о необходимости их применения, особенно у детей, должно приниматься только после клинико-иммунологического обследования, уточнения типа дисфункции иммунной системы и при наличии четких клинико-иммунологических показаний. При этом сама терапия должна проводиться при обязательном клиническом мониторинге и иммунологическом контроле.
Очень эффективным иммуномодулятором является повышение температуры тела, когда усиливается синтез естественной иммунной защиты — интерферонов. Многие микроорганизмы не могут размножаться при температуре 38°С. Поэтому снижать температуру до 39°С у взрослых и 38,5°С у детей не рекомендуется (речь идет о здоровых в остальном людях), если подъем температуры не сопровождается сильной головной болью, ломотой в мышцах и суставах. В качестве жаропонижающих препаратов у детей можно использовать только препараты парацетамола или ибупрофена. Комплексные противопростудные препараты, вопреки создающемуся из-за рекламы впечатлению, не лечат респираторную инфекцию, а только облегчают ее симптомы.
Антибактериальная терапия системными антибиотиками при ОРЗ малоэффективна и показана крайне редко, не более чем в 10% всех случаев заболевания. Назначив системный антибиотик без должных оснований, врач повышает риск побочных явлений, нарушает микробиоценоз, способствует снижению иммунитета и распространению лекарственной резистентности. Местная антибактериальная терапия обеспечивает непосредственное воздействие на очаг инфекции, создает оптимальную концентрацию препарата и не имеет системных побочных эффектов. Одним из лучших местных антибактериальных препаратов для лечения ОРЗ у детей и взрослых является фюзафюнжин (Биопарокс), который уникален благодаря своему двойному действию: антибактериальному и противовоспалительному.
Для воспалительных заболеваний респираторного тракта характерно изменение вязкости мокроты и снижение мукоцилиарного клиренса. Если перистальтические движения мелких бронхов и деятельность реснитчатого эпителия не обеспечивают необходимого дренажа, развивается кашель. Следовательно, кашель — это защитный рефлекс, направленный на восстановление проходимости дыхательных путей. Очевидно, что необходимость в подавлении кашля у детей с использованием истинных противокашлевых препаратов с патофизиологических позиций не оправдана. Целью рациональной терапии является разжижение мокроты, снижение ее адгезивности (вязкости) и увеличение тем самым эффективности кашля. Для этого используют лекарственные средства, стимулирующие отхаркивание (фитопрепараты, щелочные растворы) и муколитики (бромгексин, амброксол, ацетилцистеин и др.). Эти препараты улучшают мукоцилиарный клиренс и тем самым способствуют уменьшению воспаления слизистых оболочек респираторного тракта.
Острые респираторные инфекции у часто болеющих детей иногда могут протекать очень тяжело, с выраженным токсикозом, гипертермией, синдромом ацетонемической рвоты, бронхообструктивным синдромом. Лечение в этом случае должно строиться с учетом необходимой посиндромной терапии. При тяжелом и/или осложненном течении ребенок нуждается в госпитализации и проведении лечения в условиях стационара.
Таким образом, лечение острых респираторных заболеваний у часто болеющих детей является актуальной, но непростой задачей. Комплексная терапия должна строиться с учетом основных этиологических и патогенетических факторов заболевания, а использование современных фармакологических препаратов обеспечивает эффективность проводимого лечения. В то же время своевременное проведение профилактических мероприятий может существенно уменьшить частоту респираторных инфекций у детей.
Профилактика
Наилучшей системой профилактики острых респираторных заболеваний у часто болеющих детей, безусловно, является формирование собственного адекватного иммунного ответа. Способствуют этому здоровый образ жизни, рациональный режим дня, полноценное питание, разнообразные программы закаливания.
Профилактика респираторных инфекций часто болеющих детей предусматривает ограничение контактов ребенка с больными гриппом и ОРВИ, проведение санитарно-гигиенических мероприятий, сокращение использования городского транспорта и удлинение времени пребывания ребенка на воздухе. Частая респираторная заболеваемость тесно связана с пассивным курением, поэтому прекращение его — важное условие лечения и профилактики. Все дети, склонные к частым респираторным инфекциям, должны быть осмотрены и, при необходимости, пролечены ЛОР-врачем.
Основными методами повышения сопротивляемости ребенка инфекционным агентам служит закаливание. Систематическое контрастное воздушное или водное закаливание сопровождается повышением устойчивости организма к температурным колебаниям окружающей среды и повышением иммунологической реактивности организма. Адаптационные возможности ребенка хорошо поддаются тренировке. Использование любых методов закаливания совершенствует работу аппарата терморегуляции и расширяет возможности приспособления организма к изменившимся температурным условиям. Закаливание не требует очень низких температур, важна контрастность воздействия и систематичность проведения процедур. Хорошо закаливают воздействия на подошвы ног и, постепенно — на всю кожу туловища и конечностей. Максимальная длительность закаливающих процедур не должна превышать 10–20 минут, гораздо важнее его регулярность и постепенность. Было показано, что у часто болеющих детей сочетание местных закаливающих процедур стоп и носоглотки через 3–4 месяца восстанавливало цитологические показатели носового секрета. Закаливающие процедуры хорошо сочетать с проведением гимнастики и массажа грудной клетки. Закаливание после нетяжелого ОРЗ можно возобновить (или начать) через 7–10 дней, при заболевании с длительностью температурной реакции более 4 дней — через 2 недели, а после 10-дневной лихорадки — через 3–4 недели. Эффективность закаливания можно оценить не ранее чем через 3–4 месяца, а максимальный эффект наблюдается через год от начала регулярных процедур.
Учитывая ведущую роль дисфункций иммунитета в развитии повышенной восприимчивости детского организма к респираторным инфекциям, кроме комплекса общеукрепляющих мероприятий с целью профилактики используется целый ряд иммуномодулирующих лекарственных средств. При этом большинство авторов подчеркивают, что использование иммуномодулирующих препаратов с целью предупреждения респираторных инфекций у часто болеющих детей должно проводиться на фоне обязательного соблюдения общих принципов профилактики и оздоровления.
Так, существуют рекомендации по сезонному курсовому (1–2 раза в год) применению препаратов рекомбинатного интерферона (Виферона, Гриппферона) с целью повысить неспецифическую резистентность часто болеющих детей к острым респираторным заболеваниям.
Через активацию врожденного и адаптивного иммунитета происходит поддержание целостности слизистых и развитие полноценной защиты респираторного тракта. Из средств неспецифической профилактики хорошо известны растительные адаптогены: китайский лимонник, элеутерококк, женьшень, эхинацея, левзея. Наиболее часто применяются препараты, полученные из эхинацеи (Иммунал, Иммунорм, Эхинацин ликвидум). Хорошо зарекомендовал себя Биоарон С (сочетание алоэ и черноплодной рябины).
В настоящее время возрос интерес к иммуномодулирующим лекарственным средствам бактериального происхождения, обладающим также и вакцинальным эффектом, которые не только повышают активность неспецифических факторов иммунной защиты, но и способствуют формированию специфического иммунного ответа к наиболее значимым пневмотропным бактериальным возбудителям. Среди современных иммуномодуляторов бактериального происхождения выделяют высокоочищенные бактериолизаты, мембранные фракции и рибосомальный иммуномодулятор Рибомунил, в состав которого входят не лизаты бактерий, а их рибосомы и фрагменты клеточной стенки (протеогликаны), что и определяет высокую клинико-иммунологическую эффективность и минимальную реактогенность этого препарата, сочетающего свойства вакцины и неспецифического иммуномодулятора.
Часто возникает вопрос о возможности одновременного проведения календарной вакцинации или гриппозной прививки детям, получающим лечение бактериальными вакцинами. Специальными исследованиями было показано, что такое сочетание не только возможно, но и желательно, поскольку оно может сопровождаться усилением иммунного ответа. Вполне оправдано и совмещение профилактической вакцинации с началом лечения бактериальными вакцинами.
Вообще вакцинация часто болеющих детей является одним из самых важных профилактических мероприятий. Частые ОРВИ не фигурируют в списке противопоказаний к проведению прививок. Поскольку частые ОРВИ у этой группы детей не свидетельствуют о наличии иммунодефицита, они не могут быть поводом для отвода от прививок. По окончании ОРВИ, как и других острых заболеваний, прививки возможно проводить через 2–3 недели после нормализации температуры.
По вопросам литературы обращайтесь в редакцию.

Инфекционный процесс у ребенка имеет свои особенности. Реакция организмов детей разных возрастов на воздействие инфекционного агента сильно различается. У малышей иммунная система определенное время остается незрелой и не может нормально функционировать, поэтому многие заболевания в детском возрасте протекают тяжелее, чем у взрослых.
Почему дети более восприимчивы к инфекциям, чем взрослые?
- Дети больше подвержены инфекционным болезням не только из-за слабой работы иммунной системы, но также из-за тонкости, сухости и рыхлости поверхностного слоя кожи, который должен выполнять функцию защитного барьера.
- Следующим препятствием на пути инфекции становятся лимфатические узлы, которые у малышей развиты довольно слабо, имеют рыхлую капсулу, но много сосудов. В связи с этим лимфоузлы не задерживают болезнетворные микроорганизмы должным образом, и инфекция гораздо легче распространяется по организму.
- Еще одной особенностью является то, что иммунная система ребенка слабо вырабатывает интерфероны – белки, обладающие противовирусными свойствами. Поэтому острые респираторные вирусные и ротавирусные инфекции являются одними из самых распространенных детских заболеваний. Особенно часто они наблюдаются у детей в возрасте от 6 месяцев до 2 лет, потому что пассивный иммунитет, полученный от матери, ребенок утрачивает, а вырабатывать собственные антитела его организм пока не может.
По причине незрелости иммунной, нервной, кровеносной и других систем организма, инфекционные заболевания у малышей часто протекают нетипично, поэтому сами родители не могут их распознать без помощи врачей.
Чем лучше переболеть в детстве?
Некоторые инфекции, наоборот, протекают у детей легче, чем у взрослых, например ветряная оспа или краснуха. Поэтому малышей, которые контактировали с заболевшим ребенком, в таких случаях сначала не изолируют. За ними просто требуется тщательное наблюдение, а изоляция становится необходимой, когда появляются симптомы заболевания. После выздоровления у детей формируется стойкий пожизненный иммунитет.
Осложнения этих болезней наблюдаются редко, но они бывают очень тяжелыми, поэтому периодически консультироваться с врачом необходимо до полного выздоровления вашего ребенка, чтобы исключить возможность развития осложнений.
Как вы можете уберечь ребёнка от инфекций?
Крайне внимательными следует быть беременным женщинам и тем, кто только планирует материнство, потому что некоторые возбудители инфекции могут проникать к плоду через плаценту, вызывать у него врожденные заболевания и различные пороки развития.
Следует учитывать, что инфекционные болезни в детских коллективах передаются очень быстро, ведь дети постоянно контактируют друг с другом, иногда пренебрегают правилами гигиены. Поэтому, если вы обнаружили у своего ребенка признаки инфекционной болезни, его необходимо изолировать, то есть временно прекратить посещение детского сада или школы. Это нужно, во-первых, для соблюдения постельного режима, ведь высокая физическая активность во время заболевания может привести к распространению инфекции по организму. Во-вторых, таким образом вы защитите других детей от заражения.
Не забывайте, что некоторые инфекционные заболевания передаются детям и от родителей. Например, гастрит и язвенная болезнь желудка тоже может становятся результатом инфекции – наличия в пищеварительной системе Helicobacter pylori (сделать тест на Хеликобактер), которая может передаваться со слюной. Поэтому крайне нежелательно пользоваться с ребенком одной ложкой или вилкой.
Чтобы не допускать появления кишечных инфекций, следует стерилизовать детскую посуду, подвергать продукты питания термической обработке, а в будущем обучать своего малыша мыть руки после посещения туалета, перед едой.
Прививки и укрепление детского иммунитета
Огромную роль в профилактике инфекционных болезней играет вакцинация, которая проводится в нашей клинике опытным персоналом. В организм ребенка вводят ослабленных возбудителей инфекции или их компоненты. В ответ детская иммунная система начинает вырабатывать антитела, и перед настоящим инфекционным заболеванием ваш ребенок уже будет полностью защищен.
Нежелательные последствия от введения вакцин все же наблюдаются, поэтому наш врач обязательно должен осмотреть малыша перед прививкой. Ослабленным и больным детям некоторые вакцины не вводят – требуется ждать выздоровления. Большинство врачей считают, что небольшое повышение температуры тела и легкое недомогание являются нормальной реакцией организма на прививку. Вакцинируя своего ребенка в нашей клинике, вы защищаете его от множества тяжелых инфекционных заболеваний.
С целью экстренной профилактики используются уже готовые защитные антитела. Однако через некоторое время они погибают, и ребенок теряет пассивный иммунитет.
Если ваш малыш переносит инфекционные заболевания чаще 8 – 10 раз в год, есть повод обратиться также к врачу-иммунологу, для оценки работы иммунной системы.
Диагностика и лечение у наших педиатров
Чтобы диагностировать заболевание, наши врачи иногда прибегают к дополнительным методам исследования:
- общему анализу крови
- взятию биологических жидкостей с целью посева на питательные среды
- полимеразной цепной реакции (ПЦР), реакции связывания комплемента (РСК), иммуноферментному анализу (ИФА)
- рентгенографии .
Лечение многих (но не всех) инфекционных заболеваний у детей предусматривает антибактериальную терапию. Сегодня многим родителям уже известно, что антибиотики бесполезны при вирусных инфекциях, но врачи все же иногда их назначают, например, при ОРЗ. Все дело в том, что при очень тяжелом течении вирусной инфекции в ослабленный детский организм гораздо легче проникнуть бактериям. Чтобы не допустить присоединения вторичной микрофлоры, доктор прописывает курс антибактериальной терапии, однако родителям не следует самостоятельно принимать подобных решений. Даже если вы уверены, что заболевание у ребенка вызвано бактериями, не спешите бежать в аптеку за антибиотиками. Часто возбудители бактериальной инфекции чувствительны лишь к некоторым из них, но совершенно невосприимчивы к средствам другой группы, и об этом вам может сказать только опытный врач.
Из-за того, что детский организм зачастую очень бурно реагирует на проникновение инфекционного агента, малышам требуется неспецифическая симптоматическая терапия. Так, при кишечных инфекциях дети теряют много жидкости и электролитов, а восполнить эти потери может иногда только инфузионная терапия. Это еще раз доказывает необходимость обращения за медицинской помощью при наличии инфекционного заболевания у ребенка.
Врач педиатр нашей клиники не только помогут точно выявить и полностью вывести инфекцию из организма вашего ребёнка, но и сделают это максимально щадящими и безболезненными способами, которые не вызовут у вашего малыша ни аллергических реакций, ни страха.
Ключевые слова: предрасположенность к заболеваниям, иммунная система, дети, пренатальное развитие, бронхиальная астма
Keywords: predisposition to disease, the immune system, children, prenatal development, bronchial asthma
Иммунотоксичность на ранних фазах развития и риск для здоровья у взрослого человека
Иммунотоксичность на ранних фазах развития (ИТРР) представляет собой серьезный предмет для опасений в отношении развития у детей предрасположенности к различным заболеваниям. В частности, в последние десятилетия возросла распространенность таких болезней, как детская астма, аллергические заболевания, аутоиммунные болезни, рецидивирующие инфекции (3). Повышенная чувствительность развивающейся иммунной системы к воздействию факторов окружающей среды связана с особенностями созревания иммунной системы, ярко проявляющимися в раннем возрасте в виде критических моментов формирования иммунного ответа (например, негативная селекция в отношении аутореактивных Т-клеток в развивающейся вилочковой железе).
Факторы окружающей среды и их воздействие на пренатальное развитие, а также на иммунный ответ организма
Иммунный ответ организма в неонатальный период
Кесарево сечение может негативно повлиять на иммунный ответ организма новорожденного, а также повысить риск развития атопии. С помощью мультивариантного анализа была выявлена достоверная связь между рождением с помощью кесарева сечения и повышенной частотой аллергического ринита (увеличение степени риска 1.8; 95% ДИ, 1,0-3,1), но не астмы (5). Данное исследование продемонстрировало, что кесарево сечение может быть ассоциировано с аллергическим ринитом и атопией, особенно у детей, родители которых также страдают аллергией. Это может быть объяснено с помощью недостаточного контакта с вагинальной/фекальной микрофлорой матери вследствие кесарева сечения.
Результаты новейших исследований показали, что именно микрофлоре, нарушениям ее нормального развития в неонатальной фазе принадлежит определяющая роль в формировании воспалительного заболевания слизистых оболочек и, впоследствии, манифестации патологии в виде микозов, аутоиммунных состояний и аллергий. Токсическая нагрузка в ранний период развития, представленная в виде ксенобиотических инфекционных агентов или стресса, играет решающую роль в формировании дальнейшей неустойчивости организма по отношению к детским инфекционным заболеваниям, неврологическим расстройствам, синдрому хронической усталости, аутоиммунным заболеваниям, аллергиям (включая астму), пищевым аллергиям и даже раку (детской лейкемии, 6).

Рисунок 1
Дисрегуляция иммунной системы в детском возрасте: преобладание Т-хелперных клеток (Th-2) связано с опасностью развития атопии
Аллергические заболевания у детей
Стремительное увеличение количества случаев заболевания астмой в промышленно развитых странах, отмечаемое в последние десятилетия, привело к значительному росту расходов на здравоохранение. В 2002 году распространенность этого диагноза у подростков достигла 16 миллионов случаев (4). В качестве факторов риска развития аллергической астмы и, среди прочего, аллергического ринита рассматриваются сегодня различные токсины, инфекционные патогены, загрязняющие агенты в воздушной среде, курение в период беременности (2). Обсуждается также и гипотеза о том, что аномальная экспрессия гена, отвечающего за синтез Th-2-клеток, в пренатальный период может сохраняться и у новорожденного, что приводит к повышению риска заболевания астмой.
В ходе проспективного исследования, проводившегося в течение восьми лет с участием 308 детей в возрасте до 7 лет с рецидивирующей астмой, было выявлено, что в качестве прогностических факторов риска выступают аллергические заболевания, наличие астмы у родителей, атопия и позднее проявление симптомов самой астмы. Происхождение заболевания можно было проследить вплоть до самого раннего периода развития (в частности, за многие годы до контакта с инициировавшим астму аллергеном, 7).
В рамках данного исследования было выдвинуто предположение, что корректирующее воздействие на иммунную систему на внутриутробной и неонатальной стадиях развития способно снизить вероятность формирования фетального иммунного фенотипа, а также ускорить и повысить эффективность созревания Th-1-клеток, что позволит снизить риск развития астмы у детей (4, рис. 1). Далее было отмечено, что у детей, матери которых принимали антибиотики в течение беременности, впоследствии чаще развивались аллергические заболевания (2).
Неврологические заболевания у детей
Следующим примером может служить синдром хронической усталости (СХУ) у детей, причиной которого, несомненно, являются события, произошедшие в период раннего развития (8). Иммунная дисфункция признается составляющей СХУ-фенотипа, но привлекает меньше внимания со стороны врачей, по сравнению с эндокринными и неврологическими нарушениями. Однако результаты современных исследований подтверждают, что недостаточность или нарушение функции иммунной системы в ранний период развития, включая ИТРР, вызванную ксенобиотиками, может рассматриваться как важная причина СХУ. Детская фибромиалгия представляется вариантом СХУ с преобладающей гипоталамо-гипофизарно-адреналовой (ГГА, 9) дисфункцией (рис. 2). Чаще всего фибромиалгия встречается у людей среднего возраста, однако может наблюдаться и у детей. Типичным проявлением служит хронический, широко распространенный по всем регионам тела болевой синдром (10), ассоциированный с целым спектром различных симптомов, таких как слабость, не приносящий отдыха сон, а также воспалительные заболевания кишечника. Основным патофизиологическим аспектом фибромиалгии является повышенная чувствительность центральной нервной системы; развитию синдрома также могут способствовать различные внешние стимулы, такие как травма или стресс.

Рисунок 2
Терапия дисфункции гипоталамо-гипофизарно-адреналовой (ГГА) оси у пациентов в состоянии стресса и с синдромом хронической боли препаратами Тонзилла композитум, Таламус композитум и Спаскупрель
Онкопатологии
Дисфункция иммунного ответа может стать причиной заболевания раком, в частности, детская лейкемия считается связанной с ИТРР (2, 6). Основным фактором риска детских инфекционных заболеваний также, по всей видимости, является раннее отклонение от нормы в ходе иммунной реакции организма.
Пренатальный импринтинг (программирование) метаболического синдрома. пренатальный стероидный стресс
Мощным медиатором процессов развития на ранних стадиях формирования организма человека являются кортикостероиды. То, что они обладают выраженным влиянием на тканевое развитие (ускоренное созревание органов, особенно легких), подтверждается их широким терапевтическим использованием в акушерской практике и в практике неонатологов, в частности, при уходе за недоношенными детьми. Напротив, кортикостероиды редко используются в рамках антенатальной терапии плода, подверженного риску врожденной адреналовой гиперплазии (1, 12-13). Однако применение стероидов во время беременности снижает вес ребенка при рождении. Обсуждается гипотеза, согласно которой пренатальный стресс, связанный с ИТРР (см. выше) или избыток кортикостероидов являются частью механизма, связывающего пренатальное развитие и формирование патологического состояния у взрослых (14). Согласно данным эпидемиологических исследований, недостаточный вес ребенка при рождении является фактором риска развития сердечно-сосудистых, метаболических и нейроэндокринных заболеваний в дальнейшем.
У человека мутации гена 11бета-Н8Б2 вызывают снижение веса новорожденного. Более того, дети с недостаточным весом при рождении имеют повышенный уровень кортизола в плазме. Как известно, кортизол является потенциальным гормоном стресса для взрослого человека (1, 12).
В период беременности у человека тяжелый стресс, переживаемый организмом матери, отрицательно воздействует на ось ГГА, а также ассоциируется с нейро-психиатрическими нарушениями; более того, терапия кортикостероидами в период внутриутробного развития может нарушить функции мозга у ребенка (12).
Недостаточный вес у ребенка и метаболические осложнения
Результаты многочисленных исследований свидетельствуют о существовании зависимости между недостаточным весом ребенка при рождении и последующим развитием распространенных сердечно-сосудистых и метаболических нарушений у взрослых (гипертония, резистентность к инсулину, диабет типа 2, смерть в результате сердечно-сосудистого заболевания) (1). Описанные выше нарушения в период раннего развития, негативно влияющие на вес при рождении, являются серьезными факторами, детерминирующими смертность взрослых.
Исследование (15) данных в отношении 22000 мужчин (США), вес которых при рождении был менее 2,2 кг, выявило уровень относительного риска гипертонии - 1,26, диабета типа 2 - 1,75 по сравнению с показателями для нормального среднего веса при рождении. Аналогичные исследования были проведены и среди женщин (16).
Пренатальное происхождение ожирения, сердечно-сосудистых заболеваний и резистентности к инсулину
Пренатальное происхождение ожирения, сердечно-сосудистых заболеваний, а также резистентности к инсулину изучалось в ходе целого спектра исследований (эпидемиологические исследования, эксперименты на животных), которые позволили выявить адаптационную реакцию плода на пищевые факторы, направленную на сохранение энергетического гомеостаза и обеспечение выживания (17). Одним из следствий такой эволюционной гибкости может являться долговременная перестройка гомеостаза клеточной энергии, вероятно, с помощью эпигенетической модификации генов, участвующих во множестве ключевых регуляторных циклов (18). Например, сниженное питание в течение I и до II триместра беременности приводит к развитию жировой ткани у плода на фоне повышения концентрации клеток, предшественников адипоцитов (19). Но гораздо более важно то, что клинически значимая адаптация к пищевым изменениям, происходящая в период внутриутробного развития, способна проявиться в качестве первичного компонента метаболического синдрома только в том случае, если она сопровождается периодом ускоренного роста в ранний постнатальный период и/ или если у ребенка развивается ожирение. Следовательно, ожирение у взрослого - это не тривиальный результат неправильного образа жизни, а заболевание, детерминированное на ранних стадиях развития и не имеющее генетического характера. Поэтому для применения диетических и медикаментозных мероприятий в постнатальный период необходимо понимание механизмов, которые опосредуют эпигенетические изменения.
Недостаточное питание и гипоксия плода ассоциированы с повышенной вероятностью развития разнообразных метаболических нарушений у взрослого. Наряду с ожирением следует упомянуть заболевания сердечно-сосудистой системы, а также резистентность к инсулину. Представляется небезынтересным тот факт, что у детей, родившихся раньше срока, также отмечается повышенный в будущем, через десятилетия риск развития сердечнососудистых заболеваний (16). Наблюдения показывают, что различные режимы питания, в частности, у недоношенных детей, оказывают отдаленный по времени эффект в аспекте развития тех или иных хронических метаболических нарушений (17).
Метаболический синдром у детей. механизм развития метаболического синдрома в ранний период жизни ребенка
В силу вышеописанных причин риск развития ожирения или резистентности к инсулину может быть заложен еще в период внутриутробного развития.
Было показано, что развитие метаболического синдрома является следствием комплексного взаимодействия специфических генов и факторов окружающей среды (20). Первичным механизмом, ответственным за перинатальную адаптацию, является эпигенетическая модификация, опосредованная метилированием ДНК, с перманентным эффектом на экспрессию генов, выражающимся затем в форме эндокринных и поведенческих изменений, которые сохраняются и у взрослых. Далее, генетический полиморфизм на уровне регуляторных циклов может сочетаться с воздействием факторов окружающей среды, проявившимся в период внутриутробного развития, что создает основу для развития многих болезней человека. Полиморфизм на уровне инсулин-промоторных генов в сочетании с наследственной предрасположенностью к метаболическому синдрому создают условия для появления избыточного веса у новорожденного и формирования резистентности к инсулину (рис. 3).

Рисунок 3
Терапия метаболического синдрома и дисрегуляции гипоталамо-гипофизарно-адреналовой (ГГА) оси у детей препаратами Плацента композитум, Лимфомиозот, Гепар композитум и Коэнзим композитум
В дополнение к этому отмечается, что повышенный выброс провоспалительных цитокинов (фактор некроза опухоли-альфа, интерлейкинов-1 и -6) напрямую связан с повышением вероятности ожирения у подростков. Подобное повышение уровня цитокинов снижает активность восприятия сигнала инсулиновыми рецепторами и, таким образом, способствует формированию состояния резистентности к инсулину.
Масса тела ребенка возрастает; ожирение, как было показано выше, ведет к общему увеличению риска смерти у взрослых, в том числе от сердечно-сосудистых заболеваний. Согласно современным данным о частоте встречаемости метаболического синдрома у детей и подростков с избыточным весом в возрасте от 2 до 19 лет, отмечается рост коэффициента корреляции до 60%.
Неалкогольное ожирение печени у детей
Следующим осложнением при ожирении является неалкогольная жировая инфильтрация печени, распространенность которой у детей стала в настоящее время поводом для тревоги.
Возрастающая наряду с учащением случаев ожирения неалкогольная жировая болезнь печени может привести к жировому гепатозу, фиброзу и даже циррозу (22). Происхождение данного заболевания связывают с повышением выброса свободных жирных кислот висцеральными адипоцитами в систему кровообращения портальной вены. В результате возрастает уровень триглицеридов, и образуется избыток липидов в самой печени. Степень распространения заболевания среди детей оценивается в 9,6% (в США). Заболеваемость значительно различается в зависимости от расы и этнической принадлежности (азиаты 10,2%; афроамериканцы 1,5%, латиноамериканцы 11,8%; белое население 8,6%). Наибольшей распространенностью заболевание характеризуется у детей с ожирением (38%).
Неалкогольное ожирение печени у детей поддается терапии с помощью изменения образа жизни (нормализации массы тела, физической активности), а также использования факторов повышения чувствительности к инсулину. Поэтому выбор эффективной стратегии лечения и профилактики этого коморбидного по отношению к ожирению заболевания взрослых и детей является важным и в таком критическом для жизни аспекте, как предупреждение дальнейших сердечно-сосудистых заболеваний и улучшение здоровья пациентов.
Метаболические факторы риска и половое развитие девочек-подростков
Фактором риска для полового развития девочек-подростков, связанным с заболеванием диабетом типа 2 и сердечно-сосудистыми заболеваниями, является поликистозный синдром (поликистоз яичников). Данный синдром связан с такими симптомами, как гиперандрогения, ановуляторный менструальный цикл или олигоменорея, гирсутизм, а также обнаружение при ультразвуковом исследовании поликистоза яичников (23). Резистентность к инсулину и повышенный уровень лютеинизирующего гормона в сыворотке крови также являются характерными признаками поликистоза яичников. Поликистозный синдром связан с повышенным риском диабета типа 2 и сердечно-сосудистых заболеваний. Устойчивость к инсулину в сочетании с нарушением регуляции оси ГГА поддерживает гиперандрогенный статус на уровне яичников и надпочечников (20). Подростки, страдающие ожирением в сочетании с ПКС, подвержены гораздо более существенному риску нетолерантности к глюкозе, резистентности к инсулину и атерогенному уровню липидов по сравнению со сверстницами без избыточной массы тела, также страдающими ПКС.
Раннее созревание
Следующим важным социальным и медицинским фактором является раннее половое созревание у девочек. Исследования показывают, что раннее созревание у девочек становится все более частым явлением (24).
Проявление раннего созревания встречается у одного из пяти тысяч детей, причем в десять раз чаще оно отмечается у девочек. В США статистически подтвержденным явлением считают более раннее, чем отмечалось 30 лет тому назад, созревание девочек, а также рост случаев появления вторичных половых признаков в возрасте до 8 лет и наступление менархе в возрасте до 9 лет. Раннее наступление менархе связывают с повышенным риском рака грудных желез у взрослых женщин. Из этих соображений: раннее созревание повышает подобный риск.
Факторы, которыми обусловлено данное явление, весьма многообразны. К их числу относятся генетический и этнический фон, детское ожирение, экологические факторы нарушения эндокринных функций (химические вещества, токсины, растворители, методы вскармливания грудных детей, косметика для волос и кожи, технологии искусственного оплодотворения), психосоциальный стресс, раннее приобщение к сексуально ориентированному обществу (24). В этой связи часто упоминается и ожирение. За последние 20 лет вдвое возросло количество детей с ожирением в возрасте от 6 до 11 лет (с 7,0% в 1980 году до 18,8% в 2004), и более чем втрое - среди подростков в возрасте от 12 до 19 лет (с 5,0% в 1980 году до 17,1% в 2004).
Выводы
Все большее количество данных доказывает, что генетические и эпигенетические факторы (факторы воздействия внешней и внутренней среды на ранние фазы развития организма человека) оказывают выраженный эффект на пренатальное развитие. Они вызывают структурные и функциональные изменения, которые можно считать причиной дальнейших заболеваний, проявляющихся в детском и взрослом организме. Данная концепция программирования (или импринтинга) последующих физиологических реакций на этапе раннего развития (27) изучалась в аспекте пренатального и пост-натального воздействия со стороны эндогенных факторов (например, половых гормонов) и экзогенных агентов (включая токсины, наркотики и сильнодействующие медикаменты). Выявлен определенный порог или фаза уязвимости, в которой различные ткани, регуляторные циклы, в том числе и циклы регуляции оси ГГА, а также иммунная система проявляют повышенную чувствительность к воздействию этих факторов. Многие хронические заболевания, распространенность которых сегодня увеличилась (детская астма, аллергии, неврологические синдромы, метаболический синдром) запускаются посредством факторов окружающей среды на этапах раннего развития организма человека и в результате дисфункций иммунной системы. Поэтому идентификация и своевременная защита от воздействия факторов риска, угрожающих иммунной системе в аспекте нарушений ее функций и манифестации тканевых патологий представляется важнейшим направлением и возможностью профилактики большого числа распространенных хронических заболеваний у взрослых и детей.
Читайте также:

