Возбудитель холеры продуцирует экзотоксин
Обновлено: 08.05.2024
Эшерихиозы — группа бактериальных антропонозных инфекционных болезней, вызываемых патогенными (диареегенными) штаммами кишечной палочки, протекающих с симптомами общей интоксикации и поражением ЖКТ.
Классификация
Этиология и патогенез
Эшерихии — подвижные грамотрицательные палочки, аэробы, относящиеся к виду Escherichia coli, роду Escherichia, семейству Enterobacteriaceae. Растут на обычных питательных средах, выделяют бактерицидные вещества-колицины. Морфологически серотипы не отличаются друг от друга. Эшерихии содержат соматические (О-Аг — 173 серотипа), капсульные (К-Аг — 80 серотипов) и жгутиковые (Н-Аг — 56 серотипов) антигены. Диареегенные кишечные палочки подразделяются на пять типов:
Факторы патогенности ЭТКП (пили, или фимбриальные факторы) определяют склонность к адгезии и колонизации нижних отделов тонкой кишки, а также к токсинообразованию. Термолабильный и термостабильный энтеротоксины ответственны за повышенную экскрецию жидкости в просвет кишки. Патогенность ЭПКП обусловлена способностью к адгезии. ЭИКП способны, имея плазмиды, проникать в клетки кишечного эпителия и размножаться в них. ЭГКП выделяют цитотоксин, шигоподобные токсины 1-го и 2-го типов, содержат плазмиды, которые облегчают адгезию к энтероцитам. Факторы патогенности энтероадгезивных кишечных палочек изучены недостаточно.
Эшерихии устойчивы в окружающей среде, могут месяцами сохраняться в воде, почве, испражнениях. Сохраняют жизнеспособность в молоке до 34 дней, в детских питательных смесях — до 92 дней, на игрушках — до 3-5 мес. Хорошо переносят высушивание. Обладают способностью размножаться в пищевых продуктах, особенно в молоке. Быстро погибают при воздействии дезинфицирующих средств и при кипячении. У многих штаммов Е. coli отмечают полирезистентность к антибиотикам.
Эшерихии проникают через рот, минуя желудочный барьер, и в зависимости от типовой принадлежности оказывают патогенное действие.
Энтеротоксигенные штаммы способны вырабатывать энтеротоксины и фактор колонизации, посредством которого осуществляются прикрепление к энтероцитам и колонизация тонкой кишки.
Энтеротоксины — термолабильные или термостабильные белки, которые воздействуют на биохимические функции эпителия крипт, не вызывая видимых морфологических изменений. Энтеротоксины усиливают активность аденилатциклазы и гуанилатциклазы. При их участии и в результате стимулирующего действия простагландинов увеличивается образование цАМФ, вследствие чего в просвет кишки секретируется большое количество воды и электролитов, которые не успевают реабсорбироваться в толстой кишке, — развивается водянистая диарея с последующими нарушениями водно-электролитного баланса. Инфицирующая доза ЭТКП — 10х10 10 микробных клеток.
ЭИКП обладают свойством внедряться в клетки эпителия толстой кишки. Проникая в слизистую оболочку, они вызывают развитие воспалительной реакции и образование эрозий кишечной стенки. Из-за повреждения эпителия усиливается всасывание в кровь эндотоксинов. У больных в испражнениях появляются слизь, кровь и полиморфно-ядерные лейкоциты. Инфицирующая доза ЭИКП — 5х10 5 микробных клеток.
Механизм патогенности ЭПКП изучен недостаточно. У штаммов (055,086,0111 и др.) выявлен фактор адгезии к клеткам Нер-2, за счёт которого происходит колонизация тонкого кишечника. У других штаммов (018, 044, 0112 и др.) этот фактор не обнаружен. Инфицирующая доза ЭПКП — 10х10 10 микробных клеток.
ЭГКП выделяют цитотоксин (SLT — shiga-like toxin), который разрушает клетки эндотелия, выстилающего мелкие кровеносные сосуды кишечной стенки проксимальных отделов толстой кишки. Сгустки крови и фибрин препятствуют кровоснабжению кишки — в кале появляется кровь. Развивается ишемия кишечной стенки, вплоть до некроза. У некоторых больных наблюдают осложнения с развитием синдрома диссеминированного внутрисосудистого свёртывания (ДВС), ИТШ и ОПН.
ЭАКП способны к колонизации эпителия тонкой кишки. Вызванные ими заболевания взрослых и детей протекают длительно, но легко. Это связано с тем, что бактерии прочно закрепляются на поверхности эпителиальных клеток.
Эпидемиология
Основной источник эшерихиозов — больные со стёртыми формами заболевания, меньшую роль играют реконвалесценты и носители. Значимость последних возрастает, если они работают на предприятиях по приготовлению и реализации пищевых продуктов. По некоторым данным, источник возбудителя при энтерогеморрагических эшерихиозах (0157) — крупный рогатый скот. Инфицирование людей происходит при употреблении продуктов, которые были недостаточно термически обработаны. Механизм передачи — фекально-оральный, который осуществляется пищевым, реже — водным и бытовым путём. По данным ВОЗ, для энтеротоксигенных и энтероинвазивных эшерихии характерен пищевой, а для энтеропатогенных — бытовой путь.
Из пищевых продуктов чаще фактором передачи служат молочные изделия, готовые мясные продукты, напитки (квас, компот и др.).
В детских коллективах инфекция может распространяться через игрушки, загрязнённые предметы обихода, руки больных матерей и персонала. Реже регистрируют водный путь передачи эшерихиозов. Наиболее опасно загрязнение открытых водоёмов, которое происходит в результате сброса необезвреженных хозяйственно-бытовых сточных вод, особенно из детских учреждений и инфекционных больниц.
Основу профилактики эшерихиозов составляют меры по пресечению путей передачи возбудителя. Особенно важно соблюдать санитарно-гигиенические требования на объектах общественного питания, водоснабжения; предупреждать контактно-бытовой путь заражения в детских учреждениях, родильных домах, стационарах (использование индивидуальных стерильных пелёнок, обработка рук дезинфицирующими растворами после работы с каждым ребёнком, дезинфекция посуды, пастеризация, кипячение молока, молочных смесей). Продукты, готовые к употреблению, и сырые, нужно разделывать на разных досках отдельными ножами. Посуду, в которой транспортируют пищу, необходимо обрабатывать кипятком.
При подозрении на эшерихиоз необходимо обследовать беременных до родов, рожениц, родильниц и новорождённых.
Контактных в очаге заболевания наблюдают 7 дней. Детей, контактных с больным эшерихиозом по месту жительства, допускают в детские учреждения после разобщения с больным и трёхкратных отрицательных результатов бактериологического исследования кала.
При выявлении больных эшерихиозом в детских учреждениях и родильных домах прекращают приём поступающих детей и рожениц. Персонал, матери, дети, бывшие в контакте с больным, а также дети, выписанные домой незадолго до заболевания, обследуются трёхкратно (проводят бактериологическое исследование кала). При выявлении лиц с положительными результатами обследования их изолируют. Больных, перенёсших эшерихиоз, наблюдают в течение 3 мес с ежемесячным клиническим и бактериологическим обследованием в КИЗ. Перед снятием с учёта — двукратное бактериологическое исследование кала с интервалом в 1 день.
Клиническая картина
Cимптомы, течение
Клинические проявления эшерихиозов зависят от типа возбудителя, возраста больного, иммунного статуса.
Заболевание начинается остро, больных беспокоят слабость, головокружение. Температура тела нормальная или субфебрильная. Появляются тошнота, повторная рвота, разлитые схваткообразные боли в животе. Стул частый (до 10-15 раз в сутки), жидкий, обильный, водянистый, нередко напоминающий рисовый отвар. Живот вздут, при пальпации определяют урчание, небольшую разлитую болезненность. Тяжесть течения определяется степенью дегидратации. Возможна молниеносная форма заболевания с быстрым развитием эксикоза. Длительность болезни 5-10 дней.
Особенности эшерихиоза, вызванного энтероадгезивными штаммами, изучены мало. Заболевание регистрируют у пациентов с ослабленной иммунной системой. Чаще выявляют внекишечные формы — поражение мочевыводящих (пиелонефрит, цистит) и желчевыводящих (холецистит, холангит) путей. Возможны септические формы (коли-сепсис, менингит).
Диагностика
Клиническая картина эшерихиозов сходна с клинической картиной других диарейных инфекций. Поэтому диагноз подтверждают на основании бактериологического метода исследования. Материал (испражнения, рвотные массы, промывные воды желудка, кровь, моча, ликвор, жёлчь) следует брать в первые дни болезни до назначения больным этиотропной терапии. Посевы производят на среды Эндо, Левина, Плоскирева, а также на среду обогащения Мюллера.
Используют иммунологические методы исследования РА, РИГА в парных сыворотках, но они не убедительны, так как возможны ложноположительные результаты из-за антигенного сходства с другими энтеробактериями. Эти методы используют для ретроспективной диагностики, особенно во время вспышки.
Перспективным методом диагностики служит ПЦР. Инструментальные методы исследования (ректороманоскопия, колоноскопия) при эшерихиозах малоинформативны.
Дифференциальный диагноз
Дифференциальную диагностику эшерихиозов проводят с другими острыми диарейными инфекциями: холерой, шигеллёзом, сальмонеллёзом, кампилобактериозом, ПТИ стафилококковой этиологии и вирусными диареями: ротавирусной, энтеровирусной, Норволк-вирусной инфекцией и др.
В отличие от эшерихиозов, холера характеризуется отсутствием интоксикации, лихорадки, болевого синдрома, наличием многократной рвоты, быстрым развитием дегидратации III-IV степени. Помогает в постановке диагноза эпидемиологический анамнез — пребывание в эндемичных для холеры регионах.
Сальмонеллёз, в отличие от эшерихиозов, характеризуется более выраженной интоксикацией, разлитыми болями в животе, болезненностью при пальпации в эпигастральной и околопупочной областях, урчанием. Характерен зловонный стул зеленоватого цвета.
Для ПТИ стафилококковой этиологии, в отличие от эшерихиозов, характерны острое, бурное начало заболевания, короткий инкубационный период (30-60 мин), более выражены симптомы интоксикации, рвота неукротимая. Боли в животе режущего характера, с локализацией в эпигастральной и околопупочной областях. Характерны групповой характер заболевания, связь заболевания с пищевым фактором, быстрый регресс болезни.
Осложнения
Чаще эшерихиозы протекают доброкачественно, но возможны осложнения: ИТШ, гиповолемический шок с дегидратацией III-IV степени, ОПН, сепсис, пневмония, пиелоцистит, пиелонефрит, холецистит, холангит, менингит, менингоэнцефалит. Летальный исход в результате ОПН (синдром Гассера) регистрируют у детей до 5 лет в 3-7% случаев. В Москве за последние 10 лет летальных исходов не было.
Лечение
В остром периоде болезни больным рекомендуют щадящую терапию (стол № 4, при нормализации стула — № 2, в период реконвалесценции — № 13).
В лёгких случаях заболевания достаточно назначения оральной регидратационной терапии (регидрон и другие растворы, количество которых должно в 1,5 раза превышать потери воды с испражнениями).
Показаны ферменты (панзинорм-форте, мезим-форте), энтеросорбенты (полисорб, энтеросгель, энтеродез в течение 1-3 дней). При лёгком течении болезни целесообразно использование кишечных антисептиков (интетрикс по две капсулы три раза в день, неоинтестопан после каждого акта дефекации по две таблетки, до 14 в сутки, энтерол по две капсулы два раза в день) в течение 5-7 дней. Лёгкие и стёртые формы эшерихиозов не требуют назначения этиотропных препаратов.
При лечении больных в условиях стационара показан постельный режим в первые 2-3 дня. Назначают этиотропную терапию. С этой целью при среднетяжёлых формах используют один из следующих препаратов: ко-тримоксазол по две таблетки два раза в день или препараты фторхинолонового ряда (ципрофлоксацин по 500 мг два раза в сутки перорально, пефлоксацин по 400 мг два раза в сутки, офлоксацин по 200 мг два раза в сутки), длительность терапии 5-7 дней.
В тяжёлых случаях фторхинолоны применяют вместе с цефалоспоринами 2-го (цефуроксим по 750 мг четыре раза в сутки внутривенно или внутримышечно; цефаклор по 750 мг три раза в сутки внутримышечно; цефтриаксон 1,0 г один раз в сутки внутривенно) и 3-го поколения (цефоперазон по 1,0 г два раза в сутки внутривенно или внутримышечно; цефтазидим по 2,0 г два раза в сутки внутривенно или внутримышечно).
При дегидратации II-III степени назначают регидратационную терапию внутривенно кристаллоидными растворами (хлосоль, ацесоль и пр.), которую проводят по общим правилам.
При выраженных симптомах интоксикации используют коллоидные растворы (декстран и др.) в объёме 400-800 мл/сут.
После приёма антибактериальных препаратов при продолжающейся диарее используют эубиотики для коррекции дисбактериозов (бифидумбактерин-форте, хилак-форте и др.) в течение 7-10 дней. Больных выписывают после полного клинического выздоровления, нормализации стула и температуры тела, а также однократного бактериологического исследования кала, которое проводят не ранее чем через 2 дня после окончания лечения.
При лёгкой форме заболевания 5-7 дней, при среднетяжёлой 12-14 дней, при тяжёлой — 3-4 нед. Диспансеризация не регламентирована.
Госпитализация
Госпитализацию больных с эшерихиозами проводят по клиническим и эпидемиологическим показаниям. Больных при среднетяжёлом и тяжёлом течении заболевания госпитализируют в инфекционные больницы. В лёгких случаях больные могут лечиться амбулаторно при наличии благоприятных бытовых, санитарно-гигиенических условий.
По эпидемиологическим показаниям госпитализации подлежат лица из декретированных групп, больные из организованных коллективов, а также пациенты, проживающие в коммунальных квартирах, общежитиях.
Патогенез холеры. Патогенез поражений холеры. Токсины холеры. Экзотоксин холеры. Эндотоксин холеры.
Попав в организм человека, значительная часть вибрионов погибает под действием кислой среды желудка, и лишь их небольшая часть достигает тонкой кишки.
Способность холерного вибриона быстро колонизировать эпителий кишечника обусловливают жгутики, муциназа (разжижает слизь и облегчает проникновение к поверхности эпителия) и нейраминидаза (обеспечивает взаимодействие с. микроворсинками).
В ответ на проникновение бактерий холеры эпителиальные клетки выделяют щелочной секрет, служащий идеальной средой для размножения возбудителя. Основной фактор патогенности — способность к токсинооб-разованию. Холерные вибрионы образуют эндо-и экзотоксины.

Эндотоксин холеры — термостабильный ЛПС, сходный по структуре и активности с эндотоксинами прочих грамотрицательных бактерий. Он проявляет иммуногенные свойства, индуцируя синтез вибриоцидных AT.
Однако этот токсин холеры не играет существенной роли в развитии характерных проявлений.
Экзотоксин холеры (холероген) — термолабильный белок; его образование кодируют как хромосомные, так и плазмидные гены. Молекула токсина включает 2 компонента — А и Б. Компонент Б взаимодействует с рецепторами эпителия тонкой кишки, облегчая проникновение в клетку компонента А. Компонент А составляют субъединица A1(активный центр) и субъединица А2, связывающая компоненты А и Б. Субъединица А1 активирует адснилатциклазу, приводя к увеличению внутриклеточного содержания цАМФ и выходу жидкости и электролитов из клеток либеркюновых желёз в просвет кишечника. Токсин не способен реализовать своё действие на каких-либо других клетках. Бактерии серовара 0139 также синтезируют экзотоксин с аналогичными свойствами, но в меньшем количестве.
Холерные вибрионы также секретируют экзотоксины, аналогичные токсинам токсигенных эшерихий, шигелл и сальмонелл.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Патогенность холерных вибрионов. Эпидемиология холеры
Патогенные свойства холерных вибрионов обусловлены наличием у них ряда токсинов: связанного с бактериальной клеточной мембраной термостабильного липополисахарида (ЛПС), обладающего свойствами эндотоксина и индуцирующего синтез вибриоцидных антител, термолабильного экзотоксина (холерного энтеротоксина, или холерогена), обусловливающего ведущий клинический синдром дегидратации, и группы ферментов, способствующих реализации эффекта холерогена — нейраминидазы (инвазии), липазы, протеазы и др. Различают антигенные варианты холерного энтеротоксина (ХЭТ) — ХЭТ-1, синтезируемый V. cholerae var. cholerae и V. cholerae var. El-Tor, и ХЭТ-2, продуцируемый V cholerae var. El-Tor и V 0139 Bengal.
ХЭТ, синтез которого кодируется cfct-геном, состоит из двух компонентов: В (продукт ctx-B гена) — представленного 5 молекулами массой по 11 500, обеспечивающими взаимодействие токсина с рецепторами энтероцитов (GM1 ганглиозидами), и А (продукт ctx-A гена) — эффекторного протеина, включающего активный фрагмент-А1 молекулярной массой 23 500 и фрагмент-А2 массой 5 500, связывающий А1 и В компоненты.
Будучи морскими организмами, вибрионы быстро погибают при высушивании и в кислой среде (при рН 4,5 и ниже), при УФ-облучении и воздействии хлорсодержащих дезинфектантов, мгновенно — при кипячении и через 30 мин при нагревании до 56 °С. Вместе с тем, вибрионы могут длительно сохраняться в открытых водоемах (несколько месяцев в морской воде), в организме гидробионтов (устрицы, лягушки, ракообразные и др.) и в условиях низких температур. На пищевых продуктах при комнатной температуре они выживают в течение 2-5 дней, на затененных от солнца овощах и фруктах — до 8 ч. Устойчивость вибрионов El-Tor выше, чем классических холерных вибрионов.
Возбудители высокочувствительны к тетрациклиновым производным, левомицетину, ко-тримоксазолу, ампициллину, фторхинолонам.
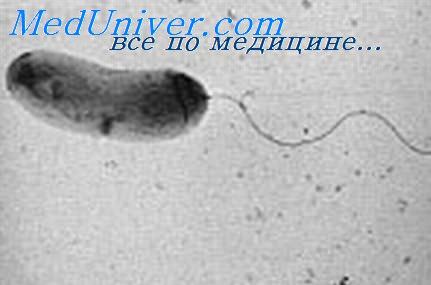
Холера — кишечный антропоноз, склонный к пандемическому распространению
В практических условиях эпидемическая заболеваемость холерой возникает вследствие реализации различных путей заражения
В эпидемических очагах заболевания чаще возникают у мужчин трудоспособного возраста, в разгар эпидемии половые различия заболеваемости не выражены
В связи со склонностью холеры к эпидемическому и пандемическому распространению каждый случай болезни в течение 24 ч подлежит регистрации в ВОЗ (International Health Regulations —IHR) Под эгидой ВОЗ/ЮНИСЕФ разработана и реализуется Программа по борьбе с диарейными заболеваниями (Programme for Control of Diarrheal Diseases — CDD).
В настоящее время заболевания холерой наблюдаются более чем в 30 странах, преимущественно в Африке (более 70% мировой заболеваемости) и Азии, где регистрируется около 200 000 случаев болезни, в странах Америки и Европы выявлены завозные случаи холеры.
Холера xe "Холера" — антропонозное, особо опасное острое карантинное инфекционное заболевание, протекающее с тяжёлой диареей, рвотой, приводящими к обезвоживанию организма.
Этиология. Возбудитель — подвижная грамотрицательная бактерия Vibrio cholerae (холерный вибрион, или запятая Коха). Выделяют 3 типа возбудителей — V. cholerae asiaticae (возбудитель классической холеры), V. cholerae eltor (возбудитель холеры Эль-Тор) и серовар О139 (Бенгал) (возбудитель холеры в Юго-Восточной Азии). Подвижность бактерий весьма выражена, и её определение (методом висячей или раздавленной капли) — важный диагностический признак. Деление клеток происходит очень быстро и на щелочной пептонной воде возбудитель даёт видимый невооружённым глазом рост уже через 6 ч. Быстро погибает при кипячении в кислой среде.
Эпидемиология. Холера — типичная кишечная инфекция. Единственный природный резервуар — больные и бактерионосители, основные пути передачи — водный и пищевой, реже контактно-бытовой. Факторы передачи: пищевые продукты, вода, объекты окружающей среды. Определённую роль играют мухи, способные переносить возбудитель с испражнений на пищевые продукты. Несмотря на то, что выделение возбудителя в окружающую среду происходит в течение короткого времени, большое число скрытых форм поддерживает циркуляцию возбудителя. Единственный исторический эндемичный очаг холеры — дельта Ганга и Брахмапутры. Выделяют 2 типа эпидемий холеры: эпидемии-вспышки с едиными источником инфекции и путями распространения, характеризующихся одномоментным появлением большого числа больных, и вялотекущие эпидемии с небольшой постоянной заболеваемостью и трудно выявляемыми путями передачи возбудителя. В большинстве случаев подъём заболеваемости наблюдают в тёплое время года.
Патогенез. В организме человека большая часть вибрионов погибает под действием кислой среды желудка, и лишь их небольшая часть достигает тонкой кишки. В ответ на проникновение бактерий кишечный эпителий выделяет щелочной секрет, насыщенный жёлчью (жёлчь — идеальная среда для размножения возбудителя). Клинические проявления холеры обусловлены образованием экзотоксинов • Экзотоксин (холероген) — термолабильный белок, молекула токсина включает 2 компонента: компонент В взаимодействует с моносиаловым ганглиозидным рецептором, что обусловливает проникновение в клетку компонента А. Компонент А составляют субъединица А1 (активный центр) и субъединица А2, связывающая оба компонента. Субъединица А1 катализирует рибозилирование гуанилзависимого компонента аденилат циклазы, приводит к повышению внутриклеточного содержания циклического 3,5-аденозинмонофосфата и выходу жидкости и электролитов из клеток либеркюновых желёз в просвет кишечника. Токсин не способен реализовать своё действие на любых других клетках. Бактерии серовара О139 также продуцируют экзотоксин с аналогичными свойствами, но в меньших количествах; токсинообразование кодируют как хромосомные, так и плазмидные гены • Определённую роль в поражениях, вызываемых биотипом Эль-Тор, играют гемолизины.
Клиническая картина
• Инкубационный период продолжается от нескольких часов до 5 дней (чаще 2–3 дня).
• У большинства инфицированных лиц заболевание протекает бессимптомно, либо возможна лёгкая диарея. Соотношение тяжёлых поражений к количеству стёртых проявлений для классической холеры — 1:5–1:10, для холеры Эль-Тор — 1:25–1:100.
• Клинически выраженные случаи характеризуются общим недомоганием, рвотой и развитием выраженного диарейного синдрома, отсутствием интоксикации (температура тела не повышается). Для последнего характерно выделение значительного количества (до 10 л/сут) водянистых, бесцветных испражнений. Другая характерная черта — сладковатый, рыбный (но не фекальный) запах испражнений.
• Тяжёлые случаи болезни обусловлены развитием обезвоживания: у больных резко снижается диурез с развитием ОПН. Характерна охриплость голоса или афония. Ведущий патогенетический фактор — гиповолемия и дефицит электролитов. Как следствие развиваются артериальная гипотензия, коронарная недостаточность, нарушение сознания и гипотермия. Подобное состояние определяют как холерный алгид (Алгид — симптомокомплекс, обусловленный обезвоживанием организма (потеря натрия хлорида, калия, бикарбонатов): гипотермия, гемодинамические расстройства, анурия, тонические судороги, выраженная одышка). Отмечают характерное проявление — facies hippocratic a (запавшие глаза, заострённые черты лица с резко выступающими скулами). Продолжительность проявлений зависит от своевременно начатого, адекватно проводимого лечения и варьирует от нескольких часов до нескольких дней. При отсутствии лечения летальность больных в алгидной стадии может достигать 60%.
• Выздоровление сопровождается выработкой непродолжительного иммунитета, нередко отмечают случаи повторного заражения.
Методы исследования • Выделение и идентификация возбудителя; цели исследований — выявление больных и бактерионосителей, установление окончательного диагноза при исследовании погибших, контроль за эффективностью лечения больных и санации носителей, контроль над объектами внешней среды и эффективностью дезинфекционных мероприятий. Материалы для исследования — испражнения, рвотные массы, жёлчь, секционный материал (фрагменты тонкой кишки и жёлчный пузырь), постельное и нательное бельё, вода, ил, сточные воды, гидробионты, смывы с объектов окружающей среды, пищевые продукты, мухи и др. Наиболее объективные результаты даёт исследование проб, взятых до начала антибактериальной терапии • Анализ крови — признаки дегидратации (ацидоз, гипокалиемия, гипонатриемия, гипохлоремия, гипогликемия, полицитемия, незначительный нейтрофильный лейкоцитоз).
Дифференциальную диагностику проводят с различными тяжёлыми диареями (например, вызванными видами S almonella , E. coli или энтеропатогенными вирусами), отравлением грибами, мышьяком.
Лечение • Этиотропная терапия •• Взрослым и детям старше 8 лет — доксициклин по 300 мг 1 р/сут, либо по 100 мг 2 р/сут или тетрациклин по 50 мг/кг/сут в течение 3 дней. В качестве альтернативного препарата возможно использование ципрофлоксацина в среднетерапевтической дозировке •• Детям до 8 лет — ко-тримоксазол (по 4 мг/кг триметоприма и 20 мг/кг сульфаметоксазола каждые 12 ч) или фуразолидон 5–10 мг/кг/сут в 4 приёма через 6 ч в течение 3 дней •• Беременным — фуразолидон по 100 мг 4 р/сут в течение 7–10 дней • Возмещение потери жидкости и электролитов в соответствии со степенью обезвоживания больного •• При лёгкой и среднетяжёлой формах — пероральная регидратация (р-р регидратационной соли [натрия хлорида 3,5 г, калия хлорида 1,5 г, глюкозы 20 г, тринатрия цитрата 2,9 г в 1 л воды], глюкосолана или цитраглюкосолана) •• При тяжёлой форме — введение солевых р-ров в/в (натрия ацетат+натрия хлорид+калия хлорид).
Синонимы • Азиатская холера • Эпидемическая холера • Диарея рисовым отваром
МКБ-10 • A00 Холера
Код вставки на сайт
Холера xe "Холера" — антропонозное, особо опасное острое карантинное инфекционное заболевание, протекающее с тяжёлой диареей, рвотой, приводящими к обезвоживанию организма.
Этиология. Возбудитель — подвижная грамотрицательная бактерия Vibrio cholerae (холерный вибрион, или запятая Коха). Выделяют 3 типа возбудителей — V. cholerae asiaticae (возбудитель классической холеры), V. cholerae eltor (возбудитель холеры Эль-Тор) и серовар О139 (Бенгал) (возбудитель холеры в Юго-Восточной Азии). Подвижность бактерий весьма выражена, и её определение (методом висячей или раздавленной капли) — важный диагностический признак. Деление клеток происходит очень быстро и на щелочной пептонной воде возбудитель даёт видимый невооружённым глазом рост уже через 6 ч. Быстро погибает при кипячении в кислой среде.
Эпидемиология. Холера — типичная кишечная инфекция. Единственный природный резервуар — больные и бактерионосители, основные пути передачи — водный и пищевой, реже контактно-бытовой. Факторы передачи: пищевые продукты, вода, объекты окружающей среды. Определённую роль играют мухи, способные переносить возбудитель с испражнений на пищевые продукты. Несмотря на то, что выделение возбудителя в окружающую среду происходит в течение короткого времени, большое число скрытых форм поддерживает циркуляцию возбудителя. Единственный исторический эндемичный очаг холеры — дельта Ганга и Брахмапутры. Выделяют 2 типа эпидемий холеры: эпидемии-вспышки с едиными источником инфекции и путями распространения, характеризующихся одномоментным появлением большого числа больных, и вялотекущие эпидемии с небольшой постоянной заболеваемостью и трудно выявляемыми путями передачи возбудителя. В большинстве случаев подъём заболеваемости наблюдают в тёплое время года.
Патогенез. В организме человека большая часть вибрионов погибает под действием кислой среды желудка, и лишь их небольшая часть достигает тонкой кишки. В ответ на проникновение бактерий кишечный эпителий выделяет щелочной секрет, насыщенный жёлчью (жёлчь — идеальная среда для размножения возбудителя). Клинические проявления холеры обусловлены образованием экзотоксинов • Экзотоксин (холероген) — термолабильный белок, молекула токсина включает 2 компонента: компонент В взаимодействует с моносиаловым ганглиозидным рецептором, что обусловливает проникновение в клетку компонента А. Компонент А составляют субъединица А1 (активный центр) и субъединица А2, связывающая оба компонента. Субъединица А1 катализирует рибозилирование гуанилзависимого компонента аденилат циклазы, приводит к повышению внутриклеточного содержания циклического 3,5-аденозинмонофосфата и выходу жидкости и электролитов из клеток либеркюновых желёз в просвет кишечника. Токсин не способен реализовать своё действие на любых других клетках. Бактерии серовара О139 также продуцируют экзотоксин с аналогичными свойствами, но в меньших количествах; токсинообразование кодируют как хромосомные, так и плазмидные гены • Определённую роль в поражениях, вызываемых биотипом Эль-Тор, играют гемолизины.
Клиническая картина
• Инкубационный период продолжается от нескольких часов до 5 дней (чаще 2–3 дня).
• У большинства инфицированных лиц заболевание протекает бессимптомно, либо возможна лёгкая диарея. Соотношение тяжёлых поражений к количеству стёртых проявлений для классической холеры — 1:5–1:10, для холеры Эль-Тор — 1:25–1:100.
• Клинически выраженные случаи характеризуются общим недомоганием, рвотой и развитием выраженного диарейного синдрома, отсутствием интоксикации (температура тела не повышается). Для последнего характерно выделение значительного количества (до 10 л/сут) водянистых, бесцветных испражнений. Другая характерная черта — сладковатый, рыбный (но не фекальный) запах испражнений.
• Тяжёлые случаи болезни обусловлены развитием обезвоживания: у больных резко снижается диурез с развитием ОПН. Характерна охриплость голоса или афония. Ведущий патогенетический фактор — гиповолемия и дефицит электролитов. Как следствие развиваются артериальная гипотензия, коронарная недостаточность, нарушение сознания и гипотермия. Подобное состояние определяют как холерный алгид (Алгид — симптомокомплекс, обусловленный обезвоживанием организма (потеря натрия хлорида, калия, бикарбонатов): гипотермия, гемодинамические расстройства, анурия, тонические судороги, выраженная одышка). Отмечают характерное проявление — facies hippocratic a (запавшие глаза, заострённые черты лица с резко выступающими скулами). Продолжительность проявлений зависит от своевременно начатого, адекватно проводимого лечения и варьирует от нескольких часов до нескольких дней. При отсутствии лечения летальность больных в алгидной стадии может достигать 60%.
• Выздоровление сопровождается выработкой непродолжительного иммунитета, нередко отмечают случаи повторного заражения.
Методы исследования • Выделение и идентификация возбудителя; цели исследований — выявление больных и бактерионосителей, установление окончательного диагноза при исследовании погибших, контроль за эффективностью лечения больных и санации носителей, контроль над объектами внешней среды и эффективностью дезинфекционных мероприятий. Материалы для исследования — испражнения, рвотные массы, жёлчь, секционный материал (фрагменты тонкой кишки и жёлчный пузырь), постельное и нательное бельё, вода, ил, сточные воды, гидробионты, смывы с объектов окружающей среды, пищевые продукты, мухи и др. Наиболее объективные результаты даёт исследование проб, взятых до начала антибактериальной терапии • Анализ крови — признаки дегидратации (ацидоз, гипокалиемия, гипонатриемия, гипохлоремия, гипогликемия, полицитемия, незначительный нейтрофильный лейкоцитоз).
Дифференциальную диагностику проводят с различными тяжёлыми диареями (например, вызванными видами S almonella , E. coli или энтеропатогенными вирусами), отравлением грибами, мышьяком.
Лечение • Этиотропная терапия •• Взрослым и детям старше 8 лет — доксициклин по 300 мг 1 р/сут, либо по 100 мг 2 р/сут или тетрациклин по 50 мг/кг/сут в течение 3 дней. В качестве альтернативного препарата возможно использование ципрофлоксацина в среднетерапевтической дозировке •• Детям до 8 лет — ко-тримоксазол (по 4 мг/кг триметоприма и 20 мг/кг сульфаметоксазола каждые 12 ч) или фуразолидон 5–10 мг/кг/сут в 4 приёма через 6 ч в течение 3 дней •• Беременным — фуразолидон по 100 мг 4 р/сут в течение 7–10 дней • Возмещение потери жидкости и электролитов в соответствии со степенью обезвоживания больного •• При лёгкой и среднетяжёлой формах — пероральная регидратация (р-р регидратационной соли [натрия хлорида 3,5 г, калия хлорида 1,5 г, глюкозы 20 г, тринатрия цитрата 2,9 г в 1 л воды], глюкосолана или цитраглюкосолана) •• При тяжёлой форме — введение солевых р-ров в/в (натрия ацетат+натрия хлорид+калия хлорид).
Синонимы • Азиатская холера • Эпидемическая холера • Диарея рисовым отваром
Пищевые токсикоинфекции — острые инфекционные заболевания, вызываемые услквно-патогенными бактериями, выделяющими экзотоксины. При попадании микроорганизмов в пищевые продукты токсины накапливаются в них и могут вызывать отравление человека.
Этиология • Пищевые токсикоинфекции (ПТИ) вызывает большая группа бактерий; основные возбудители — Staphylococcus aureus, Proteus vulgaris, Bacillus cereus, Clostridium perfringens, Clostridium difficile, представители родов Кlebsiella, Enterobacter, Citrobacter, Serratia, Enterococcus и др. • Возбудители широко распространены в природе, обладают выраженной устойчивостью и способны размножаться в объектах внешней среды. Все они — постоянные представители нормальной микрофлоры кишечника человека и животных • Нередко у заболевших не удаётся выделить возбудитель, т.к. клинику ПТИ в основном определяет действие микробных токсических субстанций • Под действием различных факторов внешней среды условно-патогенные микроорганизмы изменяют такие свои биологические свойства, как вирулентность и устойчивость к антибактериальным препаратам.
Эпидемиология.
• Источник инфекции — различные животные и люди •• Наиболее часто это лица, страдающие гнойными заболеваниями (панарициями, ангинами, фурункулёзом и др.); среди животных — коровы и овцы, болеющие маститами. Все они выделяют возбудителей, попадающих в пищевые продукты в процессе их обработки, где и происходит размножение и накопление возбудителей •• Эпидемиологическую опасность представляют как больные, так и носители возбудителей •• Период контагиозности больных небольшой, относительно сроков бактерионосительства данные противоречивы •• Возбудители других токсикоинфекций (C. p erfringens , B. cereus и др) люди и животные выделяют во внешнюю среду с испражнениями •• Резервуаром ряда возбудителей может быть почва, вода и другие объекты внешней среды, загрязнённые испражнениями животных и человека.
• Механизм передачи — фекально-оральный; основной путь передачи — пищевой • Для возникновения ПТИ, вызываемых условно-патогенными бактериями, необходима массивная доза возбудителей либо определённое время для его размножения в пищевых продуктах •• Чаще всего ПТИ связаны с контаминацией молока, молочных продуктов, рыбных консервов в масле, мясных, рыбных и овощных блюд, а также кондитерских изделий, содержащих крем (тортов, пирожных) •• Основные продукты, участвующие в передаче клостридий, — мясо (говядина, свинина, куры и др.) •• Приготовление некоторых мясных блюд и изделий (медленное охлаждение, многократное подогревание и др.), условия их реализации способствует прорастанию спор и размножению вегетативных форм • В эстафетной передаче возбудителя участвуют различные объекты внешней среды: вода, почва, растения, предметы быта и ухода за больными • Продукты, содержащие стафилококковый и другие энтеротоксины, по внешнему виду, запаху и вкусу не отличаются от доброкачественных • Заболевания протекают в виде спорадических случаев и вспышек. Их чаще регистрируют в тёплое время года, когда создаются благоприятные условия для размножения возбудителей и накопления их токсинов.
• Естественная восприимчивость людей — высокая. Обычно заболевает большая часть лиц, употреблявших контаминированную пищу • Помимо свойств возбудителя (достаточная доза, высокая вирулентность), для развития заболевания необходимы факторы, способствующие возникновению ПТИ, как со стороны микроорганизма, так и со стороны макроорганизма (сниженная сопротивляемость, наличие сопутствующих заболеваний и др.) •• Более восприимчивы люди из групп риска: новорождённые, ослабленные лица, пациенты после хирургических вмешательств либо длительно получавшие антибиотики и др.
Патогенез. Общее свойство всех возбудителей ПТИ — способность синтезировать различные типы экзотоксинов (энтеротоксинов) и эндотоксинов (липополисахаридных комплексов). Именно вследствие особенностей действия этих токсинов отмечают определённое своеобразие в клинических проявлениях ПТИ, обусловленных различными возбудителями. На исключительно важную роль бактериальных токсинов в развитии ПТИ указывает и относительно короткий инкубационный период заболевания.
• В зависимости от типов токсинов, они могут вызывать гиперсекрецию жидкости в просвет кишечника, клинические проявления гастроэнтерита и системные проявления заболевания в виде синдрома интоксикации.
• Токсины бактерий реализуют своё действие через синтез эндогенных медиаторов (цАМФ, Пг, ИЛ, гистамина и др.), непосредственно регулирующих структурно-функциональные изменения органов и систем, выявляемые у больных с ПТИ.
• Сходство патогенетических механизмов ПТИ различной этиологии обусловливает общность основных принципов в подходах к лечебным мероприятиям при этих заболеваниях, а также при сальмонеллёзе и кампилобактериозе.
Клиническая картина • Инкубационный период обычно составляет несколько часов, однако в отдельных случаях он может укорачиваться до 30 мин или, удлиняться до 24 ч и более • Несмотря на полиэтиологичность ПТИ, основные клинические проявления синдрома интоксикации и водно-электролитных расстройств при этих заболеваниях сходны между собой и мало отличимы от таковых при сальмонеллёзе • Для заболеваний характерно острое начало с тошноты, повторной рвоты, жидкого стула энтеритного характера от нескольких раз до 10 и более дефекаций в сутки • Боли в животе и температурная реакция могут быть незначительными, однако в части случаев выявляют сильные схваткообразные боли в животе, кратковременное (до суток) повышение температуры тела до 38–39 °С, озноб, общую слабость, недомогание, головную боль • Степень выраженности клинических проявлений дегидратации и деминерализации зависит от объёма жидкости, теряемой больным при рвоте и диарее • Течение заболевания короткое и в большинстве случаев составляет 1–3 дня.
Дифференциальная диагностика. ПТИ следует отличать от сальмонеллёза и других острых кишечных инфекций — вирусных гастроэнтеритов, шигеллёзов, кампилобактериоза, холеры и других, а также от хронических заболеваний ЖКТ, хирургической и гинекологической патологий, ИМ.
Лабораторная диагностика • Основу составляет выделение возбудителя из рвотных масс, промывных вод желудка и испражнений • Однако возбудитель выделяют достаточно редко, а обнаружение конкретного микроорганизма у больного ещё не позволяет считать его причиной заболевания. Для этого необходимо доказать этиологическую роль возбудителя либо с помощью серологических реакций с аутоштаммом, либо установлением идентичности возбудителей, выделенных из заражённого продукта и из выделений больного.
Осложнения регистрируют крайне редко; возможны гиповолемический шок острая сердечно-сосудистая недостаточность, сепсис и др.
Лечение такое же, как при сальмонеллёзе • Показаны промывание желудка, сифонные клизмы, раннее назначение энтеросорбентов (активированного угля и др.), витаминов • При необходимости проводят регидратационную терапию (см. Сальмонеллёз) • Этиотропное лечение при неосложнённом течении ПТИ не показано.
Сокращения. ПТИ — пищевая токсикоинфекция.
МКБ-10 • A05 Другие бактериальные пищевые отравления
Код вставки на сайт
Пищевые токсикоинфекции — острые инфекционные заболевания, вызываемые услквно-патогенными бактериями, выделяющими экзотоксины. При попадании микроорганизмов в пищевые продукты токсины накапливаются в них и могут вызывать отравление человека.
Этиология • Пищевые токсикоинфекции (ПТИ) вызывает большая группа бактерий; основные возбудители — Staphylococcus aureus, Proteus vulgaris, Bacillus cereus, Clostridium perfringens, Clostridium difficile, представители родов Кlebsiella, Enterobacter, Citrobacter, Serratia, Enterococcus и др. • Возбудители широко распространены в природе, обладают выраженной устойчивостью и способны размножаться в объектах внешней среды. Все они — постоянные представители нормальной микрофлоры кишечника человека и животных • Нередко у заболевших не удаётся выделить возбудитель, т.к. клинику ПТИ в основном определяет действие микробных токсических субстанций • Под действием различных факторов внешней среды условно-патогенные микроорганизмы изменяют такие свои биологические свойства, как вирулентность и устойчивость к антибактериальным препаратам.
Эпидемиология.
• Источник инфекции — различные животные и люди •• Наиболее часто это лица, страдающие гнойными заболеваниями (панарициями, ангинами, фурункулёзом и др.); среди животных — коровы и овцы, болеющие маститами. Все они выделяют возбудителей, попадающих в пищевые продукты в процессе их обработки, где и происходит размножение и накопление возбудителей •• Эпидемиологическую опасность представляют как больные, так и носители возбудителей •• Период контагиозности больных небольшой, относительно сроков бактерионосительства данные противоречивы •• Возбудители других токсикоинфекций (C. p erfringens , B. cereus и др) люди и животные выделяют во внешнюю среду с испражнениями •• Резервуаром ряда возбудителей может быть почва, вода и другие объекты внешней среды, загрязнённые испражнениями животных и человека.
• Механизм передачи — фекально-оральный; основной путь передачи — пищевой • Для возникновения ПТИ, вызываемых условно-патогенными бактериями, необходима массивная доза возбудителей либо определённое время для его размножения в пищевых продуктах •• Чаще всего ПТИ связаны с контаминацией молока, молочных продуктов, рыбных консервов в масле, мясных, рыбных и овощных блюд, а также кондитерских изделий, содержащих крем (тортов, пирожных) •• Основные продукты, участвующие в передаче клостридий, — мясо (говядина, свинина, куры и др.) •• Приготовление некоторых мясных блюд и изделий (медленное охлаждение, многократное подогревание и др.), условия их реализации способствует прорастанию спор и размножению вегетативных форм • В эстафетной передаче возбудителя участвуют различные объекты внешней среды: вода, почва, растения, предметы быта и ухода за больными • Продукты, содержащие стафилококковый и другие энтеротоксины, по внешнему виду, запаху и вкусу не отличаются от доброкачественных • Заболевания протекают в виде спорадических случаев и вспышек. Их чаще регистрируют в тёплое время года, когда создаются благоприятные условия для размножения возбудителей и накопления их токсинов.
• Естественная восприимчивость людей — высокая. Обычно заболевает большая часть лиц, употреблявших контаминированную пищу • Помимо свойств возбудителя (достаточная доза, высокая вирулентность), для развития заболевания необходимы факторы, способствующие возникновению ПТИ, как со стороны микроорганизма, так и со стороны макроорганизма (сниженная сопротивляемость, наличие сопутствующих заболеваний и др.) •• Более восприимчивы люди из групп риска: новорождённые, ослабленные лица, пациенты после хирургических вмешательств либо длительно получавшие антибиотики и др.
Патогенез. Общее свойство всех возбудителей ПТИ — способность синтезировать различные типы экзотоксинов (энтеротоксинов) и эндотоксинов (липополисахаридных комплексов). Именно вследствие особенностей действия этих токсинов отмечают определённое своеобразие в клинических проявлениях ПТИ, обусловленных различными возбудителями. На исключительно важную роль бактериальных токсинов в развитии ПТИ указывает и относительно короткий инкубационный период заболевания.
• В зависимости от типов токсинов, они могут вызывать гиперсекрецию жидкости в просвет кишечника, клинические проявления гастроэнтерита и системные проявления заболевания в виде синдрома интоксикации.
• Токсины бактерий реализуют своё действие через синтез эндогенных медиаторов (цАМФ, Пг, ИЛ, гистамина и др.), непосредственно регулирующих структурно-функциональные изменения органов и систем, выявляемые у больных с ПТИ.
• Сходство патогенетических механизмов ПТИ различной этиологии обусловливает общность основных принципов в подходах к лечебным мероприятиям при этих заболеваниях, а также при сальмонеллёзе и кампилобактериозе.
Клиническая картина • Инкубационный период обычно составляет несколько часов, однако в отдельных случаях он может укорачиваться до 30 мин или, удлиняться до 24 ч и более • Несмотря на полиэтиологичность ПТИ, основные клинические проявления синдрома интоксикации и водно-электролитных расстройств при этих заболеваниях сходны между собой и мало отличимы от таковых при сальмонеллёзе • Для заболеваний характерно острое начало с тошноты, повторной рвоты, жидкого стула энтеритного характера от нескольких раз до 10 и более дефекаций в сутки • Боли в животе и температурная реакция могут быть незначительными, однако в части случаев выявляют сильные схваткообразные боли в животе, кратковременное (до суток) повышение температуры тела до 38–39 °С, озноб, общую слабость, недомогание, головную боль • Степень выраженности клинических проявлений дегидратации и деминерализации зависит от объёма жидкости, теряемой больным при рвоте и диарее • Течение заболевания короткое и в большинстве случаев составляет 1–3 дня.
Дифференциальная диагностика. ПТИ следует отличать от сальмонеллёза и других острых кишечных инфекций — вирусных гастроэнтеритов, шигеллёзов, кампилобактериоза, холеры и других, а также от хронических заболеваний ЖКТ, хирургической и гинекологической патологий, ИМ.
Лабораторная диагностика • Основу составляет выделение возбудителя из рвотных масс, промывных вод желудка и испражнений • Однако возбудитель выделяют достаточно редко, а обнаружение конкретного микроорганизма у больного ещё не позволяет считать его причиной заболевания. Для этого необходимо доказать этиологическую роль возбудителя либо с помощью серологических реакций с аутоштаммом, либо установлением идентичности возбудителей, выделенных из заражённого продукта и из выделений больного.
Осложнения регистрируют крайне редко; возможны гиповолемический шок острая сердечно-сосудистая недостаточность, сепсис и др.
Лечение такое же, как при сальмонеллёзе • Показаны промывание желудка, сифонные клизмы, раннее назначение энтеросорбентов (активированного угля и др.), витаминов • При необходимости проводят регидратационную терапию (см. Сальмонеллёз) • Этиотропное лечение при неосложнённом течении ПТИ не показано.
Сокращения. ПТИ — пищевая токсикоинфекция.
МКБ-10 • A05 Другие бактериальные пищевые отравления
Читайте также:

