Возбудители дифтерии туберкулеза и лепры
Обновлено: 25.04.2024
Диагностика туберкулеза. Принципы микробиологической диагностики туберкулеза. Выделение возбудителя туберкулеза.
Для диагностики туберкулёза применяют бактериоскопические, бактериологические, биологические, серологические и аллергологические методы, входящие в обязательный диагностический минимум. Материалом для исследований служат мокрота, отделяемое свищей, моча, СМЖ, испражнения.
Микроскопия возбудителя туберкулеза в патологическом материале. В мазках, окрашенных по Цилю-Нильсену, обнаруживают кислотоустойчивые палочки возбудителя туберкулеза.
Нередко материал содержит мало бактерий туберкулеза и для повышения вероятности их обнаружения используют методы обогащения: центрифугирование и флотацию. В первом случае исследуемый материал обрабатывают смесью растворов NaCl и NaOH, центрифугируют и микроскопируют осадок. Второй метод включает обработку материала смесью NaOH, дистиллированной воды и ксилола (или бензола). Образец энергично встряхивают; образующаяся пена всплывает и захватывает микобактерии. Пену отсасывают и готовят мазки.
Наиболее результативна люминесцентная микросколия возбудителя туберкулеза. Материал обрабатывают аурамин-родамином и бактерии окрашиваются в бело-жёлтый цвет. Для выявления L-форм применяют AT, меченные флюорохромами.
Выделение возбудителя туберкулеза
Достоинство метода — возможность получения чистой культуры туберкулеза, позволяющая её идентифицировать, оценить вирулентные свойства и определить чувствительность к ЛС. Материал засевают, тщательно втирая, на твёрдые питательные среды.
Для повышения эффективности выделения возбудителя туберкулеза и уничтожения контаминирующей микрофлоры применяют методы обогащения или обрабатывают материал 6-12% серной кислотой. Основной недостаток бактериологического метода — длительность получения результата (от 2 до 12 нед). В связи с этим разработаны ускоренные микрометоды выделения возбудителя туберкулеза.
Один из распространённых методов выделения возбудителя туберкулеза, метод Прайса, заключается в следующем. Материал помещают на предметное стекло, обрабатывают серной кислотой, отмывают физиологическим раствором и вносят в питательную среду, дополненную цитратной лизированной кровью.
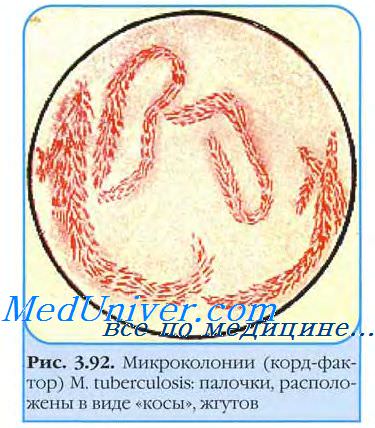
Стекло вынимают через 3-4 сут и окрашивают но Цилю-Нильсену. При микроскопии обнаруживают микроколонии микобактерии возбудителя туберкулеза. Вирулентные бактерии образуют змеевидные (рис. 22-2), а невирулентные — аморфные микроколонии. Культуры L-форм выделяют посевом в столбик полужидкой среды и инкубируют при 37 °С 1-2 мес.
Рост проявляется в виде облачка помутнения с мелкими вкраплениями. Вирулентность выделенной культуры возбудителя туберкулеза определяют заражением лабораторных животных и по наличию корд-фактора. Последний легко идентифицируют по способности микобактерии связывать нейтральный красный и нильский голубой и удерживать их после добавления щелочи. Вирулентные штаммы возбудителя туберкулеза удерживают красители, авирулентные — нет.
Возбудитель туберкулеза, его основные свойства, патогенез, лечение и профилактика туберкулеза. Методы микробиологической диагностики туберкулеза.
Возбудители дифтерии, их свойства, отличия от дифтероидов и ложнодифтерийных бактерий. Патогенез, лечение, профилактика и микробиологическая диагностика дифтерии.
Возбудители коклюша, их свойства. Патогенез, лечение, профилактика и микробиологическая диагностика коклюша.
Теоретический материал для самоподготовки
Вопрос 1. Микобактерии туберкулеза
Туберкулез – первично хроническое заболевание человека и животных, сопровождающееся поражением различных органов и систем (органов дыхания, лимфатических узлов, кишечника, костей, суставов, глаз, кожи, почек и мочевыводящих путей, половых органов, ЦНС).
Возбудители туберкулеза относятся к семейству Mycobacteriaceae, роду – Mycobacterium. Заболевание вызывается 3 видами:
M. tuberculosis – человеческий вид (в 92% случаев),
M. вovis – бычий вид (в 5% случаев),
M. аfricanum – промежуточный вид (в 3% случаев).
Морфологические и культуральные свойства.
- прямые или изогнутые палочки,
- грамположительны (но из-за большого содержания липидов в клеточной стенке плохо воспринимают красители),
- чаще применяют окраску по Цилю–Нильсену, при этом микобактерии обнаруживаются в препаратах в виде ярко-красных кислотоустойчивых палочек, расположенных поодиночке или небольшими скоплениями.
- спор не образуют,
- в состав клеточной стенки входят миколовая, фтионовая, туберкулостеариновая и другие жирные кислоты.
Родовой признак микобактерий – кислото-, спирто- и щелочеустойчивость.

Рис.Туберкулезные палочки в чистой культуре (рисунок)


Рис. Мазок из чистой культуры M. вovis Рис. M.tuberculosis в мазке
(окраска по Цилю-Нильсену) из мокроты (окраска по Цилю-Нельсену)
Растут на сложных питательных средах, содержащих яйца, глицерин, картофель, аспарагин, витамины, соли. Для подавления токсического действия образуемых в процессе метаболизма жирных кислот к средам добавляют активированный уголь или сыворотки животных, для подавления роста сопутствующей микрофлоры – красители (малахитовый зеленый) и антибиотики, не действующие на микобактерии. Элективной средой является среда Левенштейна–Йенсена.


Рис. Корд-фактор M.tuberculosis: палочки, Рис. Незавершенный фагоцитоз микобактерий
расположены в виде "косы", жгутов (окраска по Цилю-Нильсену)
Биохимические признаки.
В отличие от условно-патогенных микобактерий, M. tuberculosis и M. bovis в большом количестве образуют никотиновую кислоту (ниацин), которая накапливается в жидкой питательной среде.
В отличие от M. bovis, M. tuberculosis обладают способностью редуцировать нитраты в нитриты.
Факторы патогенности.
К факторам патогенности микобактерий относятся компоненты клеточной стенки бактерий: туберкулопротеины, липиды и их комплексы.
- Туберкулопротеины являются основными носителями антигенных свойств микобактерий, они – высокотоксичны и вызывают развитие гиперчувствительности 4-го типа.
- Липиды (миколовая и фтионовая кислоты, корд-фактор) вызывают развитие гранулем, подавляют активность фагоцитарных клеток.
- Корд-фактор – это гликолипид, состоящий из трегалозы и димиколата. Он разрушает митохондрии клеток инфицированного организма, чем нарушает функцию дыхания.
Экзотоксины микобактерии не образуют.
Устойчивость в окружающей среде.
В естественных условиях при отсутствии солнечного света жизнеспособность микобактерий сохраняется в течение нескольких месяцев, при рассеянном свете – погибают через 1-1,5 мес.
В уличной грязи они сохраняются до 4 мес., в речной воде – до 7 мес., в сточной воде – до 15 мес., в навозе – до 2-х лет.
При кипячении они погибают через 5 мин, при пастеризации – в течение 30 мин, под воздействием ультрафиолетовых лучей – через 2-3 мин.
Возбудители туберкулеза устойчивы к действию дезинфицирующих веществ. Для дезинфекции используются активированные растворы хлорамина и хлорной извести, вызывающие гибель бактерий в течение 3-5 ч.
Источники инфекции:
1.Основной - больной туберкулезом органов дыхания человек, выделяющий микробы в окружающую среду с мокротой.
2. Второстепенную роль играют больные сельскохозяйственные животные (крупный рогатый скот, верблюды, свиньи, козы, овцы) и люди, страдающие внелегочными формами туберкулеза (пищеварительного тракта или урогенитальной системы) и выделяющие микробактерии с мочой и калом.
Пути передачи:
Реже заражение туберкулезом может происходить пищевым путем при употреблении термически не обработанных мясных или молочных продуктов, что особенно характерно для заболеваний, вызванных M. bovis, чаще поражающих детей.
Возможен контактный путь передачи инфекции от больных туберкулезом через поврежденные кожные покровы и слизистые оболочки при использовании инфицированной одежды больных, игрушек, книг, посуды. Известны случаи заражения людей при уходе за больными животными. Описаны редкие случаи заражения хирургов, паталогоанатомов, мясников.
Возможен и трансплацентарный путь передачи, но он, как правило, не реализуется вследствие тромбоза кровеносных сосудов плаценты в местах поражения. Внутриутробное заражение плода может происходить не только через пупочную вену и плаценту, но и при заглатывании амниотической жидкости, содержащей микобактерии.
Организм человека обладает высокой устойчивостью к действию патогенных микобактерий, поэтому большое значение для возникновения заболевания имеют длительность контакта с источником инфекции, массивность инфицирования, вирулентность микобактерий и снижение резистентности макроорганизма.
Инкубационный период длится от 3-8 недель до 1 года и более (40 лет). Возбудитель в течение длительного времени сохраняется в фагоцитирующих клетках региональных лимфатических узлов.
В развитии заболевания выделяют первичный туберкулез, диссеминированный и вторичный.
Первичный туберкулез возникает у ранее неинфицированных людей и характеризуется выраженными токсикоаллергическими осложнениями и некротическими изменениями в тканях, возникающими на фоне высокой чувствительности макроорганизма к возбудителям туберкулеза. Для него характерна гематогенная диссеминация.
В зоне проникновения и размножения бактерий возникает специфический воспалительный очаг – инфекционная гранулема. Затем развивается специфический воспалительный процесс в региональных лимфатических узлах и наблюдается сенсибилизация организма - формируется первичный туберкулезный комплекс. Обычно первичный очаг имеет доброкачественное течение, он рассасывается, пораженный участок кальцинируется и рубцуется. Но бактерии полностью не уничтожаются. В первичном очаге и лимфатических узлах они могут сохраняться долгие годы и при неблагоприятных условиях может произойти активация возбудителя и генерализация процесса.
Из первичного туберкулезного комплекса микобактерии разносятся:
в результате чего образуются очаги в других органах и тканях и возникает диссеминированный легочный или внелегочный туберкулез.
Вторичный туберкулез возникает у ранее инфицированных людей, процесс, чаще всего, локализуется в каком-либо органе. Возникновение вторичного туберкулеза – результат активации старых эндогенных очагов или нового экзогенного заражения возбудителями туберкулеза (суперинфекция) вследствие тесного контакта с бактериовыделителем.
Различают 3 клинические формы заболевания: первичная туберкулезная интоксикация у детей и подростков, туберкулез органов дыхания, туберкулез других органов и систем.
Чаще всего возникает туберкулез органов дыхания (легких и внутригрудных лимфатических узлов). Он проявляется субфебрильной температурой тела, кашлем с мокротой, кровохарканьем, одышкой. Симптомов, характерных только для туберкулеза, нет.
В отличие от M. tuberculosis, M. bovis чаще поражает детей и вызывает такие внелегочные формы заболевания, как туберкулез периферических лимфатических узлов и мочеполовых органов, туберкулез костей и суставов, сопровождающиеся лекарственной устойчивостью к изониазиду.
Противотуберкулезный иммунитет.
Иммунитет нестерильный, что обусловлено длительной персистенцией L-форм бактерий в макроорганизме. Он появляется через 4-8 недель после попадания микробов в макроорганизм.
Микробиологическая диагностика.
Материалом для исследования служит мокрота.
Обязательными методами микробиологической диагностики туберкулеза являются бактериоскопическое и бактериологические исследования, биопроба и туберкулинодиагностика. Обнаружение в патологическом материале возбудителей является прямым доказательством активности инфекционного процесса.
Бактериоскопическое исследование. Из материала готовят мазки, окрашивают по Цилю–Нильсену и микроскопируют. В препаратах обнаруживают единичные или слипшиеся по 2-3 красные палочки, если в 1 мл мокроты их содержится не менее 10 4 -10 5 бактериальных клеток (предел метода). При получении отрицательных результатов прибегают к методам обогащения материала: гомогенизации и флотации.
Метод гомогенизации: к суточной порции мокроты добавляют равный объем 1% раствора едкого натра, флакон закрывают пробкой и встряхивают 10-15 мин, центрифугируют, нейтрализуют кислотой и из осадка готовят мазок.
Чаще применяют метод флотации: мокроту гомогенизируют и прогревают при 55 0 С 30 мин на водяной бане. Затем добавляют 1-2 мл ксилола, дистиллированную воду и повторно встряхивают в течение 10 мин. Оставляют стоять 25-30 мин при комнатной температуре. На поверхности образуется пена, состоящая из всплывших капелек ксилола с адсорбированными бактериями. Мазок готовят из пенообразного слоя, несколько раз наслаивая материал на стекло. Метод флотации на 10% повышает обнаружение микобактерий в патологическом материале.
Широкое распространение получил высокочувствительный метод люминесцентной микроскопии, основанный на способности липидов микобактерий воспринимать люминесцентные красители и светиться при облучении ультрафиолетовыми лучами.
Бактериологическое исследование является основным методом диагностики туберкулеза Исследуемый материал перед посевом в течение нескольких минут подвергают действию 10% серной кислоты или 4-6% едкого натра для освобождения от сопутствующей микрофлоры, затем тщательно встряхивают и центрифугируют. Осадок нейтрализуют и засевают в несколько пробирок со средой Левенштейна–Йенсена. Посевы инкубируют при 37 0 С 4-6 нед и более, просматривая посевы 1 раз в неделю. Выделенную культуру микобактерий туберкулеза дифференцируют от условно-патогенных микобактерий по морфологическим, тинкториальным, биохимическим свойствам и др.
Из биохимических свойств чаще всего определяют способность исследуемой культуры синтезировать никотиновую кислоту (ниациновая проба). Для определения ниацина к культуре микобактерий в жидкой питательной среде добавляют 1 мл КСN и 1 мл 5% раствора хлорамина. При наличии ниацина через несколько минут появляется ярко-желтая окраска. После учета результатов для нейтрализации КСN в пробирки добавляют 3-5 мл 10% гидрокарбоната натрия.
2.А. Для ускорения диагностики используют метод микрокультур Прайса. На нескольких предметных стеклах делают толстые мазки из исследуемого материала, высушивают, обрабатывают несколько минут 2-6% серной кислотой и нейтрализуют. Затем стекла опускают во флаконы с гемолизированной цитратной кровью в разведении 1/4-1/8 и ставят в термостат. Через 4-14 дней извлекают стекла, фиксируют препарат, окрашивают по Цилю–Нильсену и микроскопируют. Вирулентные штаммы образуют микрокультуры, имеющие вид кос или жгутов.
2.Б. Определение лекарственной устойчивости микобактерий проводят перед началом лечения, спустя 3 мес. и далее при продолжающемся выделении бактерий туберкулеза через каждые 6 мес. методом серийных разведений.
С этой целью по 0,1 мл взвеси микобактерий засевают в пробирки со средой Левенштейна–Йенсена, содержащей различные концентрации антибактериальных препаратов: 5, 10, 50 мкг/мл стрептомицина, 1, 5, 10, 25 мкг/мл тубазида и т.п. Результаты исследования учитывают по истечении определенного срока выращивания, достаточного для получения обильного роста в контрольных пробирках.
Устойчивость штамма выражается максимальной концентрацией антибактериального препарата (количество микрограммов в 1 мл питательной среды), при которой еще наблюдается рост, приближающийся к росту в контроле.
Биологический метод является наиболее надежным при выявлении микобактерий туберкулеза, он позволяет обнаружить от 1 до 5 микробных клеток в исследуемом материале. Исследуемый материал обрабатывают серной кислотой для освобождения от посторонней микрофлоры, нейтрализуют и вводят подкожно по 2-3 мл морской свинке и кролику с отрицательными туберкулиновыми реакциями. Через 4 мес., если животное не погибнет, его забивают и проводят микроскопическое исследование его органов. M. tuberculosis – высокопатогенны для морских свинок и малопатогенны для кроликов, M. bovis –высокопатогенны для кроликов.
5. Для экспресс-диагностики применяют реакцию иммунофлюоресценции (РИФ) с использованием видоспецифических моноклональных антител, иммуноферментный анализ (ИФА) и полимеразно-цепную реакцию (ПЦР). Эти методы направлены на обнаружение как антигенов возбудителей туберкулеза, так и антител к ним.
Препараты для лечения.
Международный союз борьбы с туберкулезом в связи с распространением в настоящее время множественно-резистентных штаммов предложил все противотуберкулезные препараты по степени их эффективности разделить на 3 группы:
группа А – наиболее эффективные – изониазид, рифампицин и их производные;
группа В – препараты средней эффективности – стрептомицин, канамицин, этионамид (пропионамид), этамбутол, пиразинамид, флоримицин, циклосерин, производные фторхинолонов; группа С – препараты малой эффективности – ПАСК, тибон (тиоацетозон).
В России препараты группы С в последнее время не применяются, а также получены препараты, превосходящие рифампицин по лечебным свойствам: рифапентин, рифабутин и комбинированные препараты: рифатер, рифанг.
Период лечения состоит из 2 этапов. Цель первого - подавить репликацию активно размножающейся бактериальной популяции, располагающейся в основном внеклеточно, добиться снижения ее численности. Цель второго этапа – долечивание в результате воздействия на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий.
Большинство больных перестают быть источником инфекции в течение 2 недель с начала соответстующей противотуберкулезной терапии.
Препараты для специфической профилактики.
Для специфической профилактики используют живую вакцину БЦЖ – BCG, полученную путем длительного культивирования M. bovis на картофельно-глицериновом агаре с добавлением бычьей желчи. Вакцинацию проводят новорожденным на 2-5 день в роддоме внутрикожно с последующей ревакцинацией согласно календарю прививок. Ревакцинацию проводят лицам с отрицательной туберкулиновой пробой с интервалом 5-7 лет до 30-летнего возраста.
Морфологические и культуральные особенности патогенных микобактерий, коринебактерий и актиноми- цетов.
Микробиологическая диагностика туберкулеза, лепры, дифтерии, нокардиоза и актиномикоза.
Значение серологических исследований и кожных проб при диагностике этих заболеваний.
Диагностические, профилактические и лечебные препараты.
Возбудители туберкулеза и лепры относятся к семейству Mycobacteriaceae, роду Mycobacterium, который включает патогенные и непатогенные виды.
Это слегка изогнутые или прямые палочки размером 0,2—0,6X1— 10 мкм, иногда ветвящиеся; возможен нитевидный или мицелиеобразный рост, но при легком механическом воздействии происходит фрагментация на палочки или кок- ковидные элементы. На определенной стадии размножения они становятся кислото- или спиртоустойчивы за счет значительного содержания липидов, особенно миколовых кислот и восков в клеточной оболочке. По Граму окрашиваются с трудом, но обычно рассматриваются как грамположительные.
Возбудители туберкулеза — Mycobacterium tuberculosis и Mycobacterium bovis— растут медленно. Их выращивают 4—6 нед при 37°С на специальных средах (глицериновый агар, глицериновый картофель, яичные и синтетические среды). Колонии микобактерий шероховатые, плотные, морщинистые с неровным краем, желтоватого цвета.
Туберкулез поражает человека и многие виды животных. Туберкулезный процесс может локализоваться в любых органах и тканях, однако чаще всего — в легких и лимфатических узлах.
В лабораторной диагностике используют обычно бак- териоскопический и бактериологический методы, иногда заражение животных, кожные пробы и серологические реакции. Наиболее доступным методом является бактериоскопия. Для исследования у больного берут мокроту,
Рис. 25. Микобактерии тубер-кулеза в жидкой питательной среде (микрокультура).
ют воду и 1—2 мл ксилола
гной, плевральную или цереброспинальную жидкость, мочу и окрашивают по методу Циля — Нильсена или ис-пользуют люминесцентную микроскопию.
Для накопления микобактерий в клиническом материале используют методы обогащения, которые при исследовании мокроты состоят в ее гомогенизации при воздействии щелочи, растворяющей слизь, с последующим центрифугированием или флотацией. При флотации к гомогенизированному материалу добавля- (бензола, бензина или петролейного эфира), интенсивно взбалтывают и дают отстояться. Микробные клетки переходят в верхний слой углеводорода, из которого затем готовят мазки. Одним из ускоренных методов выделения микобактерий из мокроты является метод выращивания микрокультуры на предметных стеклах, помещенных в жидкую питательную среду (рис. 25).
Для выявления инфицированности организма используют кожные пробы с туберкулином (пробы Пирке и Манту), хотя они имеют ограниченное диагностическое значение.
Возбудитель лепры — М. leprae — при лабораторной диагностике основным методом является микроскопическое исследование. В клиническом материале при окраске по Цилю — Нильсену обнаруживаются кислотоустойчивые палочки, расположенные в виде пачки сигар или наподобие шаров. На питательных средах возбудитель лепры не культивируется.
Дифтерия —заболевание преимущественно детского возраста, передается воздушно-капельным или контактно-бытовым путем. Источником инфекции является больной или носитель возбудителя инфекции.
На слизи-стой оболочке зева и носа образуется характерная пленка. Заболевание сопровождается тяжелыми явлениями интоксикации дифтерийным экзотоксином. Для лабораторной диагностики берут слизь из зева и носа стерильными ватными тампонами и делают посев на элективную среду, содержащую свернутую сыворотку (среды Ру и Леффлера) и теллуритовую среду Клауберга (МПА с теллуритом натрия, глицерином и дефибринированной кровью). На свернутой сыворотке образуются мелкие круглые колонии с уплотнением в центре. На теллурито- вой среде можно различать два биологических варианта С. diphtheriae—gravis и mitis: первые образуют серовато-черные колонии с радиальной исчерченностью, вторые — круглые выпуклые колонии черного цвета.
Для определения способности культуры продуцировать токсин используют метод преципитации в агаре. Для этого на чашку Петри с питательной средой помещают полоску фильтровальной бумаги, пропитанной антитоксической противодифтерийной сывороткой; перпендикулярно полоске штрихами подсевают исследуемые культуры. Если культура токсигенна, то через 24—48 ч инкубации при 37°С в агаре образуются линии преципитации (рис. 27).
Рис. 27. Определение токсиген ности дифтерийной палочки методом иммунопреципитации в агаре.
Невосприимчивость к дифтерии, обусловленную наличием у человека антитоксического иммунитета, можно определить при постановке кожной пробы Шика. Для этого токсин в дозе У4о DLM для морской свинки вводят внутрикожно в область внутренней стороны предплечья. При отсутствии у испытуемого антитоксического иммунитета на месте введения через 48 ч разовьется краснота и припухлость.
Возбудители актиноми- коза и нокардиоза. Актино- мицеты представляют собой своеобразную группу прока- риотических микроорганизмов, некоторые из них по морфологии имеют сходство с грибами, так как образуют мицелий и размно-жаются с помощью спор, формирующихся на споро-
носцах. Они широко распространены в природе, постоянно обнаруживаются в почве, входят в состав нормальной микрофлоры организма, обитают в полости рта.
Актиномикоз — хроническое гнойное заболевание, при котором образуются гранулемы, подвергающиеся некротическому распаду и формированию свищей, наиболее часто вызывают Actinomyces israeli и A. bovis. Очаги нередко имеют шейно-лицевую локадизацию, могут быть поражены и другие органы и ткани.
При лабораторной диагностике исследуют гной из очагов поражения, фистул; мокроту и материал, полученный путем биопсии или аутопсии. В исследуемом материале при микроскопии обнаруживают друзы — особые образования, представляющие собой скопление мицелия в центре и характерные булавовидные структуры по периферии. Выделить культуру путем посева на специальные среды (сывороточная, кровяная, глицериновая, тио- гликолевая) удается в 5—50% случаев. Рост выявляется через 1—2 нед культивирования при 37°С. При микроскопии препаратов, окрашенных по Граму или Цилю — Нильсену, видны тонкие (0,5—1,2 мкм) нити, цепочки из удлиненных элементов, округлые споры на концах мицелия. Из серологических методов наиболее четкие результаты дает РСК. В качестве антигенов для серологических реакций используют актинолизат (фильтрат лизирую- щихся культур актиномицетов), лучше из штаммов, выделенных от больных.
Кожные пробы при актиномикозе диагностического значення не имеют в виду малой специфичности.
Для лечения используют актинолизаты, актииомицет- ную вакцину, антибиотики, сульфамидные препараты, препараты йода.
Нокардиоз — хроническое гранулематозное заболевание легких, кожи, лимфатических узлов, мозга и его оболочек, почек. Возбудителями нокардиоза являются No- cardia asteroides, N. brasiliensis и некоторые другие виды нокардий. Нокардии вызывают мицетому (мадурская болезнь). Заражение происходит воздушно-пылевым путем или через поврежденные кожные покровы. Для лабораторной диагностики у больного берут гной, мокроту, це-реброспинальную жидкость, мочу, экссудат. В мазках наблюдают грамположительные кокковидные, палочковидные структуры или скопления ветвящихся палочек. Используют также метод иммунофлюоресцентной микроскопии. Культура может быть получена на среде Сабуро, кровяном агаре и других средах. Колонии морщинистые, зернистые, желтого или оранжевого цвета, восковидные. Рост появляется через 2—3 нед инкубации при 37°С. Можно использовать заражение лабораторных животных с последующим выделением и идентификацией культуры.
Для лечения применяют сульфаниламидные препараты в комбинации с ампициллином и триметопримом.
Что такое дизентерия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Шигеллёзы, или дизентерия — это группа острых/хронических заболеваний, вызываемых бактериями рода Шигелла, которые поражают желудочно-кишечный тракт (преимущественно дистальный отдел толстой кишки). Манифестные формы (клиническая картина) дизентерии: синдром общей инфекционной интоксикации, синдром поражения желудочно-кишечного тракта (дистальный колит), синдром обезвоживания. При отсутствии адекватного лечения приводит к серьёзным осложнениям и хронизации.
Возбудитель дизентерии
семейство — кишечные бактерии (Enterobacteriaceae)
род — Шигелла (Shigella)
виды — 4 основных:
- Dysenteriae (серовары — шигелла Григорьева-Шига, Штутцера-Шмитца, Ларджа-Сакса);
- Flexneri (Флекснера);
- Boydii (Боудии);
- Sonnei (Зонне).
Являются факультативно-анаэробными (способны существовать как при наличии, так и при отсутствии кислорода), граммотрицательными, неподвижными палочками. Хорошо растут на обычных питательных средах.
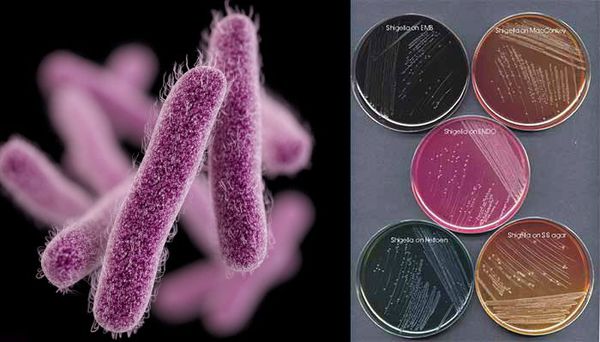
Имеют О-антиген (серологическая специфичность) и К-антиген (оболочечная структура). Клеточная стенка частично состоит из эндотоксина (липополисахарида), высвобождающегося при гибели микроорганизма. Бактерии вида Shigella Dysenteriae серовара Григорьева-Шига продуцируют высокоактивный цитотоксин, который нарушает синтез белка рибосомами клеток кишечного эпителия. Цитотоксин в совокупности с энтеротоксином (усиливающим секрецию жидкости и солей в просвет кишки) и нейротоксином (оказывающим нейротоксическое действие на сплетения Ауэрбаха) образует экзотоксином — токсин, выделяемый в процессе жизнедеятельности шигелл (Цитотоксин + энтеротоксин + нейротоксин = экзотоксин). Также у данной группы микроорганизмов происходит выделение гемолизинов — веществ, разрушающих эндотелий капилляров и вызывающий ишемию в тканях кишечника).
Факторы патогенности шигелл (механизм приспособления бактерий):
- адгезия (прикрепление к слизистой оболочке кишечника);
- инвазия (проникновение в эпителиальные клетки слизистой оболочки толстого кишечника);
- токсинообразование;
- внутриклеточное размножение.
Тинкториальные свойства (особенности микроорганизмов при окрашивании): быстро изменяют чувствительность к антибактериальным препаратам. Характерна высокая выживаемость во внешней среде (в воде, почве и пище при комнатной температуре сохраняются до 14 дней, в канализационных стоках — до 30 дней, при благоприятных условиях могут быть жизнеспособны до 4 месяцев). Способны к размножению в пищевых продуктах. При воздействии УФО (ультрафиолетового облучения) погибают за 10 минут, в 1% феноле — за 30 минут, при кипячении — мгновенно.
Интересная особенность: чем выше ферментативная активность возбудителя дизентерии, тем ниже вирулентность (минимальная доза возбудителя, способная заразить человека) и наоборот. [3] [6]
Эпидемиология
Антропоноз (повсеместное распространение).
Источник инфекции — человек (больной, носитель и лица с субклинической формой заболевания).
Минимальная инфицирующая доза для бактерии Григорьева-Шига — 10 микробных тел в 1 грамме вещества, для Флекснера — 10 2 бактерий, для Зонне — от 10 7 .
Длительное время в РФ превалировали случаи заражения, вызванные шигеллой Флекснера 2а, однако в настоящее время ввиду широкого развития туризма длительного преобладания какой-либо формы нет.
Механизм передачи — фекально-оральный (пищевой, водный, контактно-бытовой), из них преимущественно:
- Григорьева-Шига (контактно-бытовой путь);
- Зонне (с молоком и молочными продуктами);
- Флекснера (водный путь);
- Дизентериа (пищевой путь).
Наибольшую опасность представляют работники питания и водоснабжения. Больные заразны с начала болезни (конца инкубационного периода) и до трёх недель болезни.
Иммунитет непродолжителен и моноспецифичен (вырабатывается только к одному серотипу, который вызвал заболевание). [1] [4] [5]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дизентерии
Инкубационный период — от 1 до 7 дней.
Начало заболевания острое (развитие основных синдромов наблюдается в первые сутки заболевания), характерна лихорадка постоянного типа.
Читайте также:

