Врожденная краснуха токсоплазмоз сифилис
Обновлено: 05.05.2024
Клиника внутриутробной инфекции. Перинатальные поражения нервной системы у новорожденных
Клинические проявления внутриутробных инфекций полиморфны и зависят не столько от этиологии/сколько от локализации и тяжести процесса. Наиболее типичны задержка внутриутробного развития, гепатомегалия, спленомегалия, желтуха, сыпь, синдром дыхательных расстройств, сердечнососудистая недостаточность и неврологические нарушения. Тяжесть клинических проявлений в большей мере зависит от того, на каких сроках гестации произошло инфицирование.
При развитии инфекции во второй половине беременности заболевание у новорожденного клинически манифестирует как генерализованная инфекция или как поражение отдельных органов. У всех наблюдавшихся больных, госпитализированных в Центр детской гепатогии с перинатальной патологией гепато-билиарной системы, были выражены и поражения центральной нервной системы, по поводу которых они получали специальное обследование и лечение невропатолога.
Последствия перинатальных инфекционных заболеваний ЦНС в плане этиологии и патогенетической основы рассматриваются как:
1) поражения вследствие перенесенного (врожденного) энцефалита, менингита, менингоэнцефалита (TORCH-синдром — цитомегаловирусная инфекция, герпетическая инфекция, токсоплазмоз, врожденная краснуха, ECHO — вирусы и другие, сифилис);
2) поражения ЦНС вследствие перенесенного неонатального сепсиса (менингит, менингоэнцефалит, вентрикулит, энцефалит).
Варианты клинических форм в первой группе — перинатальное постинфекционное (врожденное) органическое поражение мозга с различными клиническими синдромами, исходы которых могут варьировать от легких до тяжелых форм умственной отсталости, ДЦП, симптоматических резистентных эпилепсии. Варианты клинических форм во второй группе — постинфекционная
3) энцефалопатия или постинфекционное поражение ЦНС, проявляющиеся клиническими синдромами гидроцефалии, гиперактивного поведения, нарушений (задержки) моторного развития, очаговых нарушений (парезы и параличи), тяжелых нарушений моторного развития (формирующиеся и сформированные ДЦП) и другими. Исходы поражений ЦНС зависят от ранней диагностики и определяются своевременностью адекватной терапии, могут варьировать от легких функциональных до тяжелых психоневрологигеских нарушений.
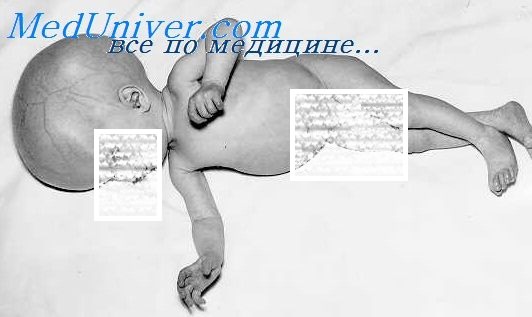
Новорожденный с врожденным токсоплазмозом
Целью исследований К. Е. Скляр с соавторами было выявление клинико-патогенетических закономерностей формирования врожденных пороков развития при внутриутробной инфекции у новорожденных. Проведено обследование 86 новорожденных с врожденными пороками развития различной локализации (у 50 % — врожденные пороки сердца) и клиническими признаками внутриутробной инфекции. Положительные результаты ПЦР получены у 43 (53 %) детей, в том числе РНК краснухи — у 36, ДНК токсоплазмоза — у 2, ДНК хламидий и вируса простого герпеса — в двух случаях, смешанная инфекция — у трех.
Анализ анамнестических данных и клинического течения заболевания не позволил авторам выделить каких-либо симптомов, соответствующих этиологии инфекции. У 30 (34,9%) оперативное лечение проведено в периоде новорожденности, из них — у 8 (9,3 %) в первые сутки после рождения. При морфологическом исследовании интраоперационно полученных биоптатов выявлены нарушения гистоархитектоники, склеротические и дистрофические явления, признаки нарушения локального кровообращения. Развитие указанных процессов в органах, по всей видимости, отражает исход инфекционного процесса.
По мнению авторов, именно склеротические процессы в аномальных тканях могут оказывать влияние на дальнейшее развитие детей и проявляться в различных формах хронических состояний, в том числе хронического гепатита и атрезии желчевыводящих путей при поражении пегени.
Желтуха и поражение печени наряду с поражением центральной нервной системы — ведущие клинические признаки большинства перинатальных инфекций.
В подтверждении диагноза и выяснении этиологии поражения пегени у новорожденных велика ответственность спектра, кагества проведения и клинического толкования результатов лабораторных исследований. Характеристика диагностических методов внутриутробной инфекции, применяемых в повседневной практике, предполагает определение титра специфических антител IgG в динамике (если он не снижается в возрасте от 6 до 12 недель, диагностируется врожденная инфекция). В 6 месяцев титр пассивно приобретенных от матери антител должен быть не выше 1:8.
Однако диагностика иммунохимическими методами у беременных и новорожденных может быть затруднена из-за недостаточной выработки специфических маркеров острой инфекции — антител класса IgM, трансплацентарной передачи антител класса IgG, низкого уровня продукции антигенов. В связи с этим клиническую значимость приобретает метод полимеразной цепной реакции.
Диагностика предполагает использование методов этиологической расшифровки с помощью генодиагностики. В то же время выявление ДНК вируса и тем более микоплазм и хламидий не может служить основанием для верификации этиологии инфекции и назначения лечения. Е. М. Малковой с соавторами из 117 новорожденных с признаками ВУИ у 112 обнаружены ДНК 26 возбудителей. Отмечено значительное количество вирусно-вирусных, микоплазменно-вирусных, вирусно-вирусно-микоплазменных, вирусно-хламидийных и прочих ассоциаций, составивших 22,1% среди положительных результатов исследований.
Клиническая картина не имела специфических признаков, была выраженной дыхательная недостаточность с развитием пневмонии, раннее и затяжное тегение желтухи, неврологические нарушения. Развитие фетального гепатита преобладало при сочетанных инфекциях. Наиболее тяжелое состояние отмечалось у детей при положительных результатах ПЦР сразу в нескольких биоматериалах. Необходимость терапии латентных форм заболеваний у новорожденных при детекции ДНК возбудителей определяется способностью многих из них длительно сохраняться в условиях иммунокомпетентного организма (персистировать с сохранением патогенных свойств).
При изменении иммунного статуса происходит быстрое восстановление вирулентности, которое становится основой рецидивирующего характера хронических инфекций и возможной инвалидизации ребенка. Однако, по данным авторов, результаты ПЦР-иследований у беременных женщин и их детей совпали только в 33,3 % слугаев, поэтому их трактовка, с нашей тогки зрения, должна быть осторожной.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
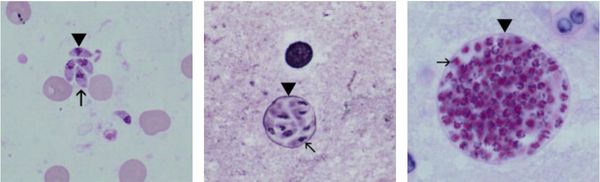
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
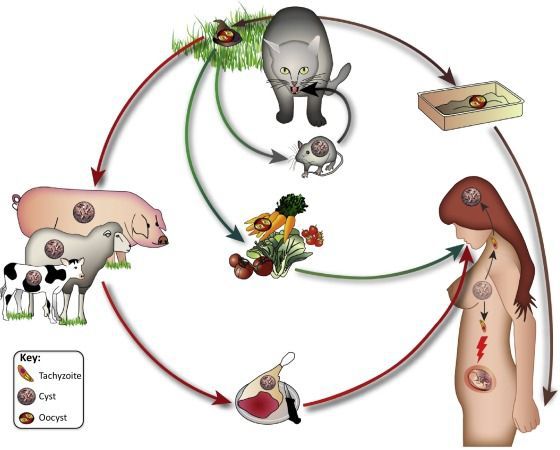
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
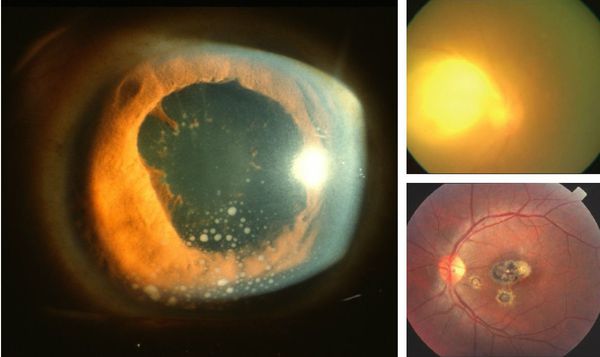
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
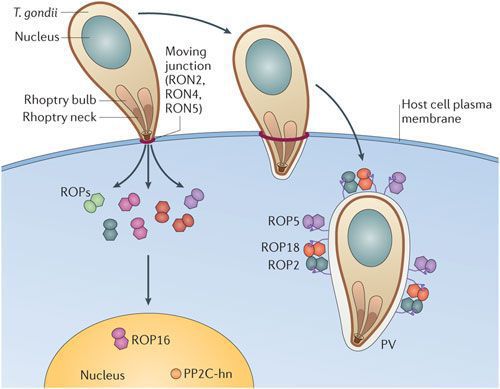
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
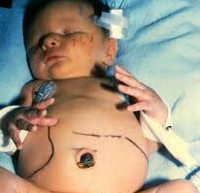
Врожденный токсоплазмоз – это паразитарная патология, которая возникает при трансплацентарном инфицировании ребенка Toxoplasma gondii. У большинства детей протекает бессимптомно. Возможные проявления заболевания: интоксикационный синдром, пятнисто-папулезная сыпь, лимфаденопатия, желтуха, гепатоспленомегалия, отеки нижних конечностей. Часто провоцирует развитие патологий органа зрения, слуха, ЦНС; реже – миокарда, легких и печени. Антенатальная диагностика базируется на проведении биопсии, постнатальная – на совокупности анамнестических и клинико-лабораторных данных (ИФА, ПЦР). Этиотропное лечение врожденного токсоплазмоза проводится при помощи схем на основе препаратов пириметамина и сульфадимезина или спирамицина.
МКБ-10
Общие сведения
Врожденный токсоплазмоз – заболевание в педиатрии и неонатологии, возникающее в результате трансплацентарного заражения плода на фоне острой формы токсоплазменной инфекции у матери. Впервые Toxoplasma gondii была описана французами К. Николь и Л. Монсо в 1908 году. В 1939 г. американцы Э. Вольф, Д. Кауэн и Б. Пэйдж подтвердили трансплацентарный механизм передачи возбудителя. Промежуточными хозяевами могут выступать более 400 видов животных. Согласно статистическим данным ВОЗ, число инфицированных токсоплазмой людей в мире составляет порядка 1,5 млрд. человек, в России – около 30% всего населения. Частота врожденной формы 1,5:1000 новорожденных. Даже на фоне лечения средний показатель смертности у детей до 5 лет составляет 12%, осложнения возникают почти у 90%.

Причины врожденного токсоплазмоза
Врожденный токсоплазмоз развивается только при инфицировании матери Toxoplasma gondii во время вынашивания ребенка. Механизм заражения беременной женщины – фекально-оральный. Наиболее распространенные причины: контакт с животными из семейства кошачьих и употребление термически необработанной пищи. Инвазивная форма возбудителя – ооциста – формируется в кишечнике животных и выделяется с калом, после чего может на протяжении 12 и больше месяцев сохранять контагиозность в условиях внешней среды. В крайне редких случаях этиологическим фактором может стать трансплантация контаминированных органов или переливание крови. Заражение плода T. gondii происходит трансплацентарным путем. После рождения ребенка развивается интенсивный гемолиз, возникают геморрагии на слизистых оболочках, расширение камер сердца, пневмония или интерстициальный отек легких, некроз печени и селезенки, увеличение лимфоузлов, воспаление и отек тканей головного мозга, некробиоз сетчатки. При гистологическом исследовании непосредственно пораженных тканей определяется некроз, гранулематозная или диффузная пролиферация ретикулоцитов, инфильтрация плазмоцитами и лимфоцитами, перифокально – множество токсоплазм. Впоследствии на месте некротизированных участков формируется фиброз, переходящий в кальциноз.
Классификация врожденного токсоплазмоза
В зависимости от периода инфицирования плода врожденный токсоплазмоз может протекать в трех формах:
- Хроническая форма. Заражение происходит в I-II триместрах беременности. Риск передачи возбудителя – 13-18%. При такой форме могут развиваться атрофия головного мозга, гидроцефалия, деформация желудочков мозга, анофтальмия, колобома, атрофия сетчатки, врожденные пороки сердца и других органов и систем.
- Подострая форма. Инфицирование – III триместр. Риск заражения ребенка – 75-85%. Проявления могут включать в себя энцефалит, менингоэнцефалит, очаговый некроз сетчатки, увеит.
- Острая форма. Токсоплазма попадает в организм ребенка непосредственно перед родами. Возможные симптомы: гипертермия, пятнисто-папулезная сыпь, интенсивная желтуха, гепатоспленомегалия, анемия, миокардит, пневмония.
Симптомы врожденного токсоплазмоза
Врожденный токсоплазмоз может проявляться в различные периоды жизни ребенка – от первых дней до нескольких месяцев. Специфических симптомов данное заболевание не имеет. Зачастую присутствующая клиника нечеткая и имитирует другие врожденные патологии. Наиболее вероятные проявления врожденного токсоплазмоза: ухудшение общего состояния, пятнисто-папулезная сыпь различной локализации, генерализованная лимфаденопатия, увеличение печени и селезенки, желтуха, отеки нижних конечностей, субфебрильное повышение температуры тела. Тяжесть симптомов зависит от степени инфицирования токсоплазмами, триместра беременности, в котором произошло инфицирование, и иммунных сил матери. Примерно 70-90% детей не имеют каких-либо проявлений в ранние периоды жизни, но почти у всех спустя некоторое время возникают осложнения. Классический врожденный токсоплазмоз проявляется триадой Сэбина – обструктивная гидроцефалия, хориоретинит и массивное внутричерепное обызвествление. Наблюдается данный комплекс не более чем у 3% детей. Помимо триады, часто возникают миокардит, миозит, гепатит и пневмония. Клинические проявления напрямую зависят от присутствующих патологических изменений. Вероятность развития поздних осложнений на фоне латентного врожденного токсоплазмоза составляет порядка 90%. Период возникновения может быть разным – от нескольких месяцев до нескольких лет. Наиболее часто наблюдается поражение глаз, органа слуха и ЦНС. Самое распространенное осложнение – ретинит (примерно 85% случаев). К другим последствиям перенесенного врожденного токсоплазмоза относят олигофрению, гидроцефалию, повышение внутричерепного давления, острый и хронический энцефалит, эпилепсию, полную глухоту и/или слепоту, микрофтальм, увеит, хроническую гипертермию, редко – шизофрению.
Диагностика врожденного токсоплазмоза
Диагностика врожденного токсоплазмоза может проводиться в антенатальном и постнатальном периоде. Антенатальное исследование подразумевает использование инвазивных методов с дальнейшими лабораторными анализами. Абсолютное показание к их проведению – острый токсоплазмоз матери в сумме с нарушениями развития плода по результатам акушерского УЗИ. Выбор методики исследования зависит от срока беременности. При гестации от 10 недель проводится биопсия хориона, от 16 недель – амниоцентез, от 18 – кордоцентез. Для верификации инфекции полученный материал исследуют при помощи ПЦР. Постнатальная диагностика включает в себя сбор анамнестических данных и проведение клинического и лабораторного исследования. Данная мера является обязательной для всех детей, входящих в группу риска внутриутробного инфицирования. Неспецифическая диагностика и ее результаты зависят от присутствующих симптомов и синдромов. Список исследований может включать в себя ОАК (анемия, тромбоцитопения, лейкоцитоз); рентгенографию ОГК (признаки инфильтрации легких); нейросонографию и КТ головного мозга; биохимическое исследование крови с измерением АЛТ и АСТ, определением СРБ, уровня билирубина и его фракций (все показатели выше нормы); офтальмоскопию (некроз сетчатки); спинномозговую пункцию (признаки воспаления). Специфические методы подразумевают серодиагностику биологических жидкостей методом ИФА, при котором наблюдается возрастание титра антител IgG в 4 и больше раз и высокий уровень IgM на протяжении 10-14 суток. При необходимости проводится ПЦР с целью идентификации ДНК токсоплазмы.
Лечение врожденного токсоплазмоза
Лечение новорожденного с выраженной клинической картиной врожденного токсоплазмоза проводится только в условиях стационара, в отделении патологии новорожденных. Соблюдение специфического режима и рациона не требуется, их коррекция проводится в соответствии с состоянием ребенка. При наличии отягощенного анамнеза матери этиотропную терапию начинают с момента постановки предварительного диагноза. В других случаях перед началом лечения требуется проведения лабораторных методов исследования. Используемые схемы: пириметамин и сульфадимезин на 1-1,5 месяца; спирамицин или другие макролиды на 4-6 недель. В некоторых случаях применяют системные глюкокортикостероиды – преднизолон. Симптоматическое лечение зависит от присутствующих симптомов и синдромов, выявленных педиатром или неонатологом. При стойком повышении внутричерепного давления или развитии гидроцефалии показано хирургическое лечение. При необходимости дальнейшее лечение может проводиться амбулаторно под контролем педиатра, инфекциониста и других специалистов. В таких же условиях проводится терапия субклинической и латентной формы врожденного токсоплазмоза. Решение об отказе от приема препаратов принимается на основе клинико-лабораторных показателей, находящихся в пределах возрастной нормы, и заключения всех лечащих врачей.
Прогноз и профилактика врожденного токсоплазмоза
Прогноз при врожденном токсоплазмозе зависит от триместра, в котором произошло инфицирование плода и тяжести клинических проявлений. При развитии патологии в I триместре может наблюдаться самопроизвольное прерывание беременности и выкидыш или дальнейшее развитие тяжелых форм заболевания, однако аномалии органов при этом не возникают. При адекватной и своевременной терапии прогноз для жизни благоприятный, для выздоровления – сомнительный. Неспецифическая профилактика врожденного токсоплазмоза включает в себя ограничение контакта домашних животных с беременной женщиной, соблюдение гигиенических норм, прием в пищу только термически обработанных продуктов, тщательное мытье овощей и фруктов. При наличии факторов, указывающих на возможное инфицирование матери, проводится специфическая диагностика, направленная на идентификацию T. gondii. При подтверждении диагноза показано немедленное проведение этиотропной терапии. Специфической профилактики врожденного токсоплазмоза не разработано.
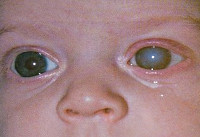
Врожденная краснуха – вирусное заболевание, передающееся от инфицированной матери ребенку во внутриутробном периоде. Заражение женщины происходит во время беременности либо до нее. Болезнь проявляется множественными внутренними пороками и дефектами развития плода, преимущественно поражением органов зрения и слуха, а также сердечно-сосудистой и нервной системы. В большинстве случаев проявляется с первых дней жизни, но возможно и более позднее обнаружение симптомов. Диагностируется с момента рождения специальными лабораторными тестами и клинически (по вышеуказанной симптоматике). Специфическое лечение отсутствует, применяется интерферон и симптоматическая терапия.
Общие сведения
Врожденная краснуха – контагиозное заболевание. Это означает, что ребенок, которому педиатр поставил такой диагноз, может передавать вирус окружающим. Болезнь получила свое название в 1740 году по одному из распространенных симптомов – тромбоцитопенической пурпуре. Первым врачом, описавшим заболевание, был Ф. Хофман. Однако прошло более двухсот лет, прежде чем врожденная краснуха стала вызывать серьезные опасения, поскольку именно во второй половине ХХ века был выявлен возбудитель инфекции. Вместе с этим была обнаружена связь между заболеванием женщины во время беременности и патологиями новорожденного.
Из других особенностей следует отметить высокое распространение инфекции в странах с умеренным климатом и сезонность. Пик заболеваемости приходится на весну и осень. Крупные эпидемии случаются раз в 6-9 лет, причем среди непривитого населения частота заболеваемости выше. По этой причине педиатрия – первая и самая важная клиническая дисциплина в вопросах профилактики врожденной краснухи. Именно в первые годы жизни дети получают вакцину против краснухи, что и позволяет избежать заражения во взрослом возрасте, в частности, во время беременности у женщин.
Статистика показывает, что врожденная краснуха составляет до 10% среди всех врожденных патологий. При заражении женщины и плода в первые недели беременности самопроизвольный аборт случается в 40% случаев. В 75% случаев отмечаются множественные поражения органов (два и более дефекта). Последние статистические данные свидетельствуют о том, что заболеваемость неуклонно возрастает.

Причины врожденной краснухи
Единственной причиной инфекции является вирус краснухи, выделенный американскими учеными в 1961 году. Это РНК-вирус, относится к семейству тогавирусов. Заражение происходит во внутриутробном периоде, когда возбудитель от инфицированной матери проходит через сосуды плаценты, попадая в кровь плода. Риск заражения зависит от того, когда именно заболела будущая мать. Если женщина переносит инфекцию в первом триместре беременности, то в 60-90% случаев у ребенка будет диагностирована врожденная краснуха. Во втором триместре риск уменьшается до 10-20% случаев. К концу беременности риск заражения плода снова повышается из-за ослабления плацентарного барьера. Большей опасности подвержены женщины, не вакцинированные ранее.
Проходя через сосуды плаценты, возбудитель врожденной краснухи попадает в кровь плода, где оказывает тератогенное действие. Он воздействует непосредственно на генетический аппарат клетки (хромосомы), замедляя рост и развитие органов, с чем и связаны множественные пороки развития. Попутно вирус разрушает мелкие сосуды плаценты, что приводит к ухудшению плацентарного кровотока. Отсутствие должного питания и хроническая гипоксия плода также способствуют замедлению развития ребенка. В хрусталике глаза и улитке внутреннего уха вирус оказывает непосредственное цитодекструктивное действие, то есть разрушает клетки. Чем раньше произошло заражение, тем более серьезными будут симптомы врожденной краснухи, поскольку именно на первых неделях беременности происходит закладка основных систем: сначала органов зрения, затем – органов слуха, сердечно-сосудистой и нервной системы и т. д.
Симптомы врожденной краснухи
Еще в 1942 году Н. Грегг выделил три основных признака врожденной краснухи: поражение органов зрения (чаще всего врожденная катаракта), глухота и пороки сердца. Симптоматика обычно наблюдается сразу после рождения ребенка, реже врожденная краснуха проявляет себя через несколько лет. Речь идет об отставании в умственном развитии. Выраженность клинических проявлений зависит от срока беременности, на котором произошло заражение. Поэтому на практике не всегда имеет место классическая триада симптомов Н. Грегга, а если они и представлены в совокупности, то нарушения могут быть не настолько грубыми.
Среди врожденных пороков сердца часто встречается поражение клапана аорты, стеноз аорты, дефекты межпредсердной и межжелудочковой перегородки. Это вызывает серьезную недостаточность кровообращения, из-за чего все внутренние органы оказываются недоразвиты в той или иной степени. Поражение нервной системы может проявляться микроцефалией, гидроцефалией, встречаются случаи менингоэнцефалита, параличей и судорог, нарушений сознания. Катаракта, глаукома, микроофтальмия наиболее вероятны, когда заражение происходит на первых неделях беременности. Также часто выявляются пороки развития скелета, такие как остеопороз, дисплазия тазобедренных суставов, синдактилия. Реже встречаются пороки развития мочеполовой и пищеварительной систем.
К основным симптомам врожденной краснухи относится также тромбоцитопеническая пурпура, причина которой – сосудистые нарушения и изменения в крови больного ребенка. Визуально пурпура выглядит, как ярко-красная сыпь по всему телу малыша. Как правило, сыпь проходит без лечения через пару недель после рождения. Неспецифическим симптомом является длительная желтуха новорожденного, связанная с недостаточным развитием внутренних органов и неспособностью утилизировать избыточный билирубин в крови, как это происходит в норме. Внешне новорожденный обычно выглядит слегка заторможенным. В первую очередь это обусловлено поражением зрительного и слухового аппарата, но здесь играют роль и неврологические нарушения.
Исход заболевания напрямую зависит от его тяжести. В тяжелых случаях продолжительность жизни больных детей составляет несколько лет. К смертельному исходу приводят, как правило, пороки сердца и сосудов (стеноз аорты и легочной артерии, открытый артериальный проток), микроцефалия, гидроцефалия, менингоэнфефалиты, гепатит, заболевания костей, тяжелая тромбоцитопения, присоединение различных инфекций вследствие низкого иммунитета и др. Врожденная краснуха считается полностью излеченной, когда вирус перестает обнаруживаться в крови. После заболевания формируется стойкий иммунитет.
Диагностика врожденной краснухи
Первый этап – ранняя пренатальная диагностика, то есть выявление заболевания у беременной женщины. Этим занимаются инфекционист и акушер-гинеколог, наблюдающий женщину на протяжении беременности. Когда диагноз подтвержден, можно оценить вероятность развития врожденной краснухи у ребенка. Будущая мать имеет возможность принять осознанное решение о вынашивании ребенка либо искусственном прерывании беременности с учетом всех медицинских показаний. Риск развития болезни у ребенка зависит от срока беременности и достигает 60-90% в первом триместре.
После родов врожденная краснуха предварительно диагностируется клинически, то есть по основным симптомам. Врачи обращают внимание на одновременное поражение органов зрения и слуха. Во-первых, в процессе физикального осмотра неонатолог обнаружит, что ребенок не реагирует на яркий свет в родовом зале и не поворачивает голову в сторону источника звука. Также сразу можно заподозрить и пороки сердца. Иногда внешне отмечаются неврологические признаки: нарушения мышечного тонуса, микроцефалия, гидроцефалия, симптомы менингизма и др. Ярко-красная сыпь заметна с первых дней жизни.
Врожденная краснуха подтверждается лабораторными тестами. Диагноз считается достоверным после обнаружения специфических IgM-антител в жидкостях организма: моче, крови, спинномозговой жидкости. Чаще всего проводят анализ мочи и мазка из носоглотки. Выявить антитела позволяет ИФА-диагностика. Лабораторные исследования помогают отличить врожденную краснуху от многих заболеваний с похожей симптоматикой, таких как цитомегаловирусная инфекция, токсоплазмоз, вирус Эпштейна-Барр и некоторых других.
Для диагностики пороков сердца проводят ЭКГ и ЭхоКГ, нарушения слуха и зрения уточняют и подтверждают узкие специалисты – офтальмолог и оториноларинолог. Обязательно наблюдение у детского невролога с самого рождения. Даже если с первых дней жизни не обнаружено неврологических нарушений, они очень часто проявляются позже, даже через несколько лет. Тогда же к терапии может подключиться психиатр, поскольку отставание в умственном развитии неизбежно - от легких когнитивных расстройств до олигофрении разной степени тяжести.
Лечение врожденной краснухи
Терапия проводится исключительно в условиях стационара. Поскольку врожденная краснуха имеет вирусную природу, в лечении задействованы препараты, повышающие противовирусный иммунитет, а именно – интерферон. Все остальное – борьба с симптомами заболевания.
Реабилитационные меры направлены на компенсацию или устранение сопутствующих заболеваний внутренних органов. Пороки сердца чаще всего операбельны и корректируются. Нарушения слуха и зрения устраняются настолько, насколько это возможно. Внутриутробное поражение головного мозга не поддается лечению, врач может лишь корректировать внутричерепное давление, судороги, если они имеются, но полное излечение невозможно. Перечисленные меры могут значительно повысить качество жизни больного ребенка. Одновременно проводится и социальная адаптация, поскольку перенесенная врожденная краснуха делает ребенка инвалидом, а также влияет на его умственное развитие.
Прогноз и профилактика врожденной краснухи
Прогноз полностью зависит от степени тяжести заболевания, которая определяется сроком инфицирования плода и имеющейся симптоматикой. В тяжелых случаях продолжительность жизни составляет несколько лет. Если органы зрения и слуха мало пострадали, в дальнейшем врожденная краснуха будет проявляться только отставанием в развитии и неврологическими нарушениями.
Профилактика тесно связана с ранней диагностикой краснухи у беременной женщины. В первом триместре рекомендуется прервать беременность в связи с высоким риском инфицирования плода и наиболее тяжелыми клиническими проявлениями в случае заражения. Смертность среди таких детей остается высокой. Еще одним эффективным способом профилактики врожденной краснухи является вакцинация. У детей она проводится в первые годы жизни. Вакцинация против краснухи является обязательной в Национальном календаре прививок. Взрослым, особенно женщинам репродуктивного возраста, повторная иммунизация рекомендована каждые 10 лет.
Читайте также:

