Врожденные инфекционные заболевания у детей
Обновлено: 26.04.2024
В настоящее время ВИЧ-инфекция у детей является одной из актуальнейших проблем во всем мире.
В настоящее время ВИЧ-инфекция у детей является одной из актуальнейших проблем во всем мире. Первоначально в нашей стране она была обусловлена внутрибольничной заболеваемостью, а в последние годы — рождением детей ВИЧ-инфицированными женщинами. Более 90% детской ВИЧ-инфекции является результатом именно перинатальной трансмиссии вируса.
По данным МГЦ СПИД за последние 10 лет произошло уменьшение числа детей с врожденной ВИЧ-инфекцией. Так, если в 2001 году, когда химиопрофилактика вертикальной трансмиссии ВИЧ-инфекции только начинала проводиться, число ВИЧ-инфицированных детей составляло 8%, то в 2006 году — всего 1,5%. Таких результатов удалось добиться благодаря введению в практику схемы профилактики согласно протоколу от 1996 г. PACTG 076 (Pediatric AIDS Clinical Trial Group), который основан на назначении беременной женщине Азидотимидина — антиретровирусного препарата из группы нуклеозидных ингибиторов обратной транскриптазы.
Однако даже своевременное проведение химиопрофилактики не исключает полностью возможность перинатальной передачи ВИЧ-инфекции от матери плоду.
К факторам, повышающим риск передачи ВИЧ от матери к ребенку, относятся:
родоразрешение через естественные родовые пути (при вирусной нагрузке более 1000 копий/мл перед родами);
При отсутствии профилактики перинатальной передачи ВИЧ, риск заражения составляет 30–40% [3].
Причинами отсутствия химиопрофилактики во время беременности и родов могут быть: диагностика ВИЧ-инфекции только во время родов, употребление наркотических веществ во время беременности, добровольный отказ от профилактики, в т. ч. по религиозным убеждениям, беременность до внедрения в практику профилактики вертикальной передачи ВИЧ и домашние роды.
Особенности клинических проявлений ВИЧ-инфекции у детей определяются стадией онтогенеза, на которой произошло инфицирование плода ВИЧ в организм (внутриутробно или интранатально) и от возраста ребенка в случае постнатального заражения.
При заражении плода в позднем перинатальном периоде или ребенка после рождения течение ВИЧ-инфекции почти не отличается от взрослых.
Целью данной работы является оценка эффективности общей и высокоактивной антиретровирусной терапии (ВААРТ) у детей с врожденной ВИЧ-инфекцией.
Задачи
Нами проанализированы 60 случаев врожденной ВИЧ-инфекции у детей в возрасте от 1 месяца до 7 лет, в т. ч.: 30 амбулаторных карт детей, состоящих на диспансерном учете в московском городском центре СПИД (МГЦ СПИД); 30 историй болезни детей, находящихся на стационарном лечении в МГЦ СПИД.
По результатам анализа амбулаторных карт и историй болезни нами были выявлены следующие наиболее часто встречающиеся клинические проявления врожденной ВИЧ-инфекции у детей: поражение ЦНС, лимфаденопатия, гепатолиенальный синдром, интерстициальные изменения в легких, анемия, гипотрофия, недоношенность.
Поражение ЦНС в нашем исследовании наблюдалось у 75% детей. Установлено, что ВИЧ является не только иммунотропным, но и нейротропным вирусом и проникает через гематоэнцефалический барьер на ранних этапах инфекционного процесса в организме, поражая олигодендроциты и астроциты, нейроциты, микроглию, макрофаги, клетки эндотелия кровеносных сосудов, фибробластоподобные клетки мозга. Указанные клетки имеют рецептор CD4 и считаются прямыми клетками-мишенями для ВИЧ. Патоморфологические изменения головного мозга при ВИЧ-инфекции могут быть охарактеризованы как альтернативно-дистрофические, с периваскулярным отеком, дистрофией нейронов, очаговой демиелинизацией и циркуляторными нарушениями.
У обследованных нами ВИЧ-инфицированных детей наблюдался полиморфизм клинических неврологических проявлений.
В начале заболевания отмечались астеноневротический и цереброастенический синдромы. Для этой стадии СПИДа характерной была ВИЧ-энцефалопатия. Также было установлено, что тяжесть поражения нервной системы более выражена у детей первого года жизни.
ВИЧ-энцефалопатия — тяжелое заболевание, затрагивающее все функции ЦНС. При подострой прогрессирующей энцефалопатии утрачиваются ранее приобретенные умения и навыки. Вялотекущая прогрессирующая энцефалопатия замедляет или прекращает формирование новых навыков, не затрагивая при этом старых. Обе формы прогрессирующей энцефалопатии резко замедляют психомоторное развитие. Дети с непрогрессирующей энцефалопатией продолжают приобретать новые навыки, но медленнее, чем здоровые сверстники.
Одновременно поражение ЦНС проявлялось грубой задержкой психомоторного развития, синдромом гипервозбудимости и гидроцефальным синдромом.
Клиническая манифестация ВИЧ-инфекции у детей разнообразна и зачастую неспецифична. Нами установлено, что лимфаденопатия, ассоциированная с гепатоспленомегалией, является одним из наиболее ранних признаков врожденной ВИЧ-инфекции. Так, персистирующая генерализованная лимфаденопатия выявлена в 64% случаев, а гепатолиенальный синдром — в 38% случаев. Сочетание обоих синдромов наблюдалось у 36% детей.
Интерстициальные изменения в легких были у 25% детей, они развивались в результате многократно перенесенных ранее пневмоний различной этиологии.
Гипотрофия (от I до III степени) была выявлена у 18% больных, недоношенность отмечалась в 14% случаев.
Из сопутствующих заболеваний чаще встречались хронический вирусный гепатит С и туберкулез, а из оппортунистических заболеваний — грибковые поражения кожи и слизистых, пневмоцистная пневмония, герпетическая инфекция, цитомегаловирусная инфекция.
Грибковые поражения кожи и слизистых отмечались у 38% детей.
Наиболее частая этиология — грибы рода Candida.
Чаще всего наблюдался оральный кандидоз, которому сопутствовал ангулярный хейлит, когда в углах рта возникали мацерации, эрозии, трещины. По краям трещин иногда отмечался гиперкератоз. Для детей, больных ВИЧ/СПИДом, характерно рецидивирующее течение орофарингеального кандидоза. В зависимости от степени иммунодефицита (определяется по количеству CD4-лимфоциов), было отмечено возникновение рецидивов через несколько месяцев, недель, а иногда и дней после отмены антимикотической терапии. Продолжительность периодов ремиссии была индивидуальна у каждого больного.
Наиболее опасная оппортунистическая инфекция, пневмоцистная пневмония, наблюдалась у 26% детей. Пневмоцистная пневмония может развиться в любом возрасте, но у наблюдавшихся нами больных почти в половине случаев приходилась на первые 6 месяцев жизни.
Обычно она развивалась остро, проявляясь одышкой и кашлем. Однако в некоторых случаях сначала появлялся кашель, и в течение нескольких дней к нему присоединялось постепенно нарастающее тахипноэ. Вначале появлялось навязчивое покашливание, затем кашель становился коклюшеподобным, особенно в ночное время. У ребенка отмечалась прогрессирующая слабость, снижение аппетита, бледность кожного покрова, цианоз носогубного треугольника. Температура тела в начале заболевания была нормальной или субфебрильной [1, 5].
При физикальном исследовании выявлялись тахипноэ, одышка, влажные и сухие хрипы. При прогрессировании пневмонии, возможно, возникала легочно-сердечная недостаточность.
Диагноз пневмоцистной пневмонии был основан на обнаружении возбудителя в мокроте, в материале, полученном при бронхоальвеолярном лаваже или биопсии легкого. У большинства детей пневмоцистная пневмония сочеталась с другими оппортунистическими заболеваниями.
У ВИЧ-инфицированных детей могут наблюдаться различные поражения кожи.
В 8% случаев была выявлена инфекция кожного покрова, обусловленная вирусом Varicella-Zoster. На фоне иммунодефицита наблюдалось тяжелое генерализованное течение инфекции с полиорганными поражениями.
Цитомегаловирусная инфекция отмечалась у 7% детей. Клинически манифестация заболевания сопровождалась разнообразной симптоматикой — от сиалоаденита и лимфаденита до тяжелых диссеминированных форм.
Хронический вирусный гепатит С был выявлен у 16% детей и обусловлен вертикальной трансмиссией вируса от матери плоду.
Туберкулез отмечался в 5% случаев. Случаи заболевания были обусловлены трансплацентарным путем инфицирования.
Диагностика врожденной ВИЧ-инфекции
Диагноз ВИЧ-инфекции у ребенка может быть установлен при получении двух положительных результатов ПЦР в двух образцах крови, взятых в разные дни. ПЦР-диагностика проводится: в первые 48 часов жизни, в 14 дней жизни, в 1–2 месяца, в 3–6 месяцев [5].
ВИЧ-инфекцию можно исключить: при 2 и более отрицательных результатах ПЦР на ВИЧ (один в возрасте до 1 месяца, один — старше 4 месяцев); при 2 и более отрицательных серологических тестах на антитела к ВИЧ в возрасте старше 6 месяцев при отсутствии грудного вскармливания.
На основании приказа Минздрава РФ № 606 от 19.12.2003 г., ребенок может быть снят с диспансерного учета по ВИЧ-инфекции в возрасте 18 месяцев при отрицательном результате исследования на антитела к ВИЧ методом ИФА, отсутствии гипогаммаглобулинемии, отсутствии клинических проявлений ВИЧ-инфекции.
Лечение
Основным компонентом лечения больных ВИЧ-инфекцией является антиретровирусная терапия, с помощью которой можно добиться контролируемого течения заболевания, то есть состояния, при котором удается остановить прогрессирование болезни. Антиретровирусная терапия должна проводиться пожизненно, непрерывно. В процессе лечения проводятся обследования, цель которых — контроль его эффективности и безопасности. В плановом порядке эти обследования проводятся через 4 и 12 недель после начала лечения, впоследствии — каждые 12 недель.
Лекарственная терапия ВИЧ-инфекции включает в себя базисную терапию (которая определяется стадией заболевания и уровнем CD4-лимфоцитов), а также терапию вторичных и сопутствующих заболеваний [2].
В настоящее время придерживаются рекомендаций, разработанных Рабочей группой по антиретровирусной терапии и лечению ВИЧ-инфекции у детей (создана Национальным центром ресурсов Центра Франсуа-Ксавье Банью, Медицинским и стоматологическим университетом Нью-Джерси (UMDNJ), Управлением ресурсов и служб здравоохранения (HRSA) и Национальным институтом здравоохранения (NIH) США), согласно которым всех ВИЧ-инфицированных детей разделяют на 3 возрастных группы (до 12 месяцев, от 1 года до 5 лет и 5 лет и старше) [5].
Детям до 12 месяцев рекомендуется начинать антиретровирусную терапию, независимо от клинических проявлений, количества CD4-лимфоцитов и уровня вирусной нагрузки.
Детям от 1 года до 5 лет и старше 5 лет проведение антиретровирусной терапии рекомендуется:
при наличии СПИДа или наличии симптомов, соответствующих стадии С и большей части симптомов стадии B (по классификации CDC, 1994 г.), независимо от количества CD4-лимфоцитов и уровня вирусной нагрузки;
детям в возрасте 1 год и старше, которые находятся на стадиях N, A или имеют следующие симптомы стадии В: единственный эпизод тяжелой бактериальной инфекции или лимфоидную интерстициальную пневмонию при уровне CD4-лимфоцитов ≥ 25% у детей от 1 года до 5 лет или уровне CD4-лимфоцитов ≥ 350 клеток/мм3 у детей > 5 лет и уровне вирусной нагрузки ≥ 100 000 копий/мл.
Антиретровирусную терапию можно временно не назначать детям, у которых нет клинических проявлений ВИЧ-инфекции или они слабо выражены, при уровне CD4-лимфоцитов ≥ 25% у детей от 1 года до 5 лет или уровне CD4-лимфоцитов ≥ 350 клеток/мм3 у детей > 5 лет и уровне вирусной нагрузки < 100 000 копий/мл.
ВААРТ назначается ребенку пожизненно.
Терапия проводится не менее чем тремя препаратами с режимом приема 2–3 раза в день.
Применяются следующие группы антиретровирусных препаратов:
Препараты, блокирующие процесс обратной транскрипции (синтез вирусной ДНК на матрице вирусной РНК), — ингибиторы обратной транскриптазы. Среди них выделяют две группы препаратов:
нуклеозидные ингибиторы обратной транскриптазы (НИОТ) (измененные молекулы нуклеозидов), встраивающиеся в синтезируемую цепочку ДНК и прекращающие ее дальнейшую сборку: зидовудин (Азидотимидин)**, фосфазид*, ставудин*, диданозин**, зальцитабин*, ламивудин**, абакавир*, Комбивир (ламивудин + зидовудин);
ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), блокирующие необходимый для осуществления обратной транскрипции вирусный фермент — обратную транскриптазу: эфавиренз*, невирапин**.
Препараты, блокирующие процесс формирования полноценных протеинов ВИЧ и, в конечном итоге, сборку новых вирусов — ингибиторы протеазы (ИП) ВИЧ: саквинавир, индинавир, нелфинавир**, ритонавир*, лопинавир/ритонавир**.
Препараты, воздействующие на рецепторы, используемые вирусом для проникновения ВИЧ в клетку хозяина, — ингибиторы слияния.
При выборе оптимальной схемы терапии для конкретного больного принимается во внимание: эффективность и токсичность препаратов, возможность их сочетания между собой, переносимость препаратов пациентом, удобство приема препаратов — кратность приема, сочетание антиретровирусных препаратов с препаратами, которые применяются (или, возможно, будут применяться) для лечения имеющихся у пациента вторичных и сопутствующих заболеваний.
Комбинация из двух препаратов НИОТ является основой различных схем антиретровирусной терапии.
Для детей рекомендуются схемы терапии, включающие 2 НИОТ и 1 ИП или 2 НИОТ и 1 ННИОТ.
В дальнейшем, при эффективной ВААРТ, уровень вирусной нагрузки должен быть ниже уровня определения, но возможны подъемы, не превышающие 1000 копий/мл (рис. 1).
В результате проведенного анализа амбулаторных карт и историй болезни детей с врожденной ВИЧ-инфекцией, получающих антиретровирусную терапию, было установлено, что в среднем уже через 3 месяца от начала лечения наблюдалось снижение уровня вирусной нагрузки ниже уровня определения (ниже 400 копий в мл), а количество CD4-лимфоцитов повышалось (рис. 2).
Эффективность специфической терапии определялась:
Если ВААРТ является неэффективной и это не связано с нарушением режима приема препарата, приемом лекарств антагонистов и т. п., рекомендуется проведение теста на резистентность вируса к лекарственным препаратам и назначение новой схемы терапии с учетом результатов этого теста.
На 2007 г. из 169 детей, состоящих на учете в МГЦ СПИД, 100 детей получают ВААРТ. Отсутствие приверженности, т. е. неготовность семьи к проведению ВААРТ, несоблюдение режима приема препаратов было в 1-м случае, что привело к летальному исходу.
Положительный тест на резистентность к ВААРТ был у 5 детей (13%). Схема лечения была пересмотрена.
Клинический пример. М. А., 2 года 11 месяцев. Дата рождения: 18.03.05 г. Находилась в детском отделении с 31.03.05 г. по 3.03.06 г. с диагнозом: ВИЧ-инфекция, стадия вторичных заболеваний IIIВ: генерализованная цитомегаловирусная инфекция, рецидивирующая пневмония, распространенная грибковая инфекция, анемия, энцефалопатия смешанного генеза, грубая задержка психомоторного и физического развития, истощение IV ст., гидроцефальный синдром, глубокая недоношенность, лимфаденопатия, гепатолиенальный синдром.
Ребенок от ВИЧ-инфицированной матери 25 лет, 7 беременностей (5 медицинских абортов), 2 преждевременных родов в домашних условиях, в женской консультации не наблюдалась. Профилактику во время беременности не получала. Вес при рождении 1280 г, рост 42 см. Состояние при поступлении тяжелое за счет острой дыхательной недостаточности, обусловленной пневмонией с ателектазами.
За время нахождения в стационаре многократно болела ОРЗ и пневмониями с обструктивным синдромом. С сентября 2005 г. полисегметарная пневмония рецидивирующего течения, плевропневмония, в ноябре 2005 г. деструктивная правосторонняя пневмония. С января 2006 г. интерстициальные изменения в легких, плевральные спайки.
Иммунный статус на 18.06.05 г.: CD4 – 920 (19%), вирусная нагрузка 6 000 000 копий/мл. С мая 2005 г. проводилась специфическая терапия: Вирасепт + Эпивир ТриТиСи + Калетра. Иммунный статус на 3.03.06 г.: CD4 – 1480 (20%), вирусная нагрузка 7300 копий/мл. На фоне лечения состояние стабилизировалось, ребенок выписан в удовлетворительном состоянии под амбулаторное наблюдение.
Выводы:
Чаще всего врожденная ВИЧ-инфекция проявляется симптомами поражения ЦНС, лимфаденопатией, гепатоспленомегалией.
Из оппортунистических инфекций ведущими являются грибковые поражения кожи и слизистых, пневмоцистная пневмония, а из сопутствующих заболеваний — хронический вирусный гепатит С.
На фоне приема ВААРТ отмечалась положительная клиническая динамика и улучшение специфических лабораторных показателей: на 12–24 неделе лечения количество CD4-лимфоцитов повысилось в среднем на 5% от исходного уровня, в то время как уровень вирусной нагрузки снизился до неопределяемого (< 400 копий/мл).
Отмечался постепенный регресс вторичных заболеваний в результате проводимой специфической терапии в сочетании с ВААРТ.
— отсутствие приверженности;
— развитие резистентности к проводимой терапии (отмечалось в 13% случаев).
Литература
Покровский В. В., Ермак Т. Н., Беляева В. В., Юрин О. Г. ВИЧ-инфекция: клиника, диагностика и лечение. 2000.
Покровский В. В., Ладная Н. Н., Соколова Е. В., Буравцова Е. В., Кравченко А. В. ВИЧ-инфекция. Информационный бюллетень № 30. 2007.
Peter Havens, Russell Van Dyke, Geoffrey Weinberg. Guidelines for the Use of Antiretroviral Agents inPediatric HIV Infection. 2008.
Н. О. Голохвастова, студентка 6 курса МГМСУ, Москва
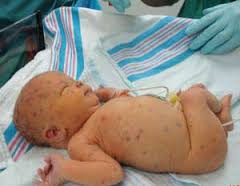
Врожденный герпес – герпетическая инфекция, встречающаяся у новорожденных при антенатальном или интранатальном заражении от инфицированной матери. Характеризуется специфическими кожными проявлениями в виде везикулярной сыпи, которая может также располагаться на слизистых оболочках глаз, рта, внутренних органов. Часто развивается герпетический энцефалит с очаговой симптоматикой и судорогами. Патологические изменения отмечаются в печени, селезенке, легких, почках и других органах. Врожденный герпес диагностируется на основании результатов серологических, гистологических исследований, а также выявления частиц вируса. Лечение – противовирусные препараты, иммуномодуляторы, иммуноглобулины, витаминотерапия.
Общие сведения
Врожденный герпес является одним из множества вариантов герпетической инфекции, к которой также относятся цитомегалия, ветряная оспа, внезапная экзантема детей и другие нозологии. Частота встречаемости заболевания – 1 случай на 2,5-60 тыс. новорожденных. Предположительно, такой разброс статистических данных связан с низкой выявляемостью в развивающихся странах. Врожденный герпес имеет высокую значимость в педиатрии в связи с ростом заболеваемости, а также увеличением случаев рецидивирующего течения. Это обусловлено тем, что вирусом простого герпеса инфицировано практически все население планеты, а сам вирус постоянно претерпевает значительные мутации. Кроме того, низкая специфичность симптомов часто является причиной запоздалой диагностики, что, в свою очередь, представляет опасность для жизни ребенка.

Причины и классификация врожденного герпеса
Возбудитель заболевания – вирус простого герпеса человека. Известно множество типов данного вируса, однако врожденный герпес в 80% случаев вызывается вирусом 2 типа, который также известен как генитальный герпес. Оставшиеся 20% в структуре заболеваемости приходятся на долю вируса простого герпеса 1 типа. Заражение чаще всего происходит интранатально, при прохождении плода по инфицированным родовым путям. Реже врожденный герпес развивается еще в утробе, попадая в организм малыша через плаценту. В этом случае речь идет о наиболее тяжелом течении заболевания, результатом чего обычно является выкидыш или рождение ребенка с разной степенью недоношенности и тяжелыми пороками развития.
Заболевание может протекать в нескольких формах, которые отражают доминирующие клинические проявления. Выделяют 3 формы врожденного герпеса: локализованную, церебральную и генерализованную. Первая из них представлена характерными кожными высыпаниями, и именно этот симптом является ведущим. Церебральная форма, как правило, проявляется менингитом и энцефалитом герпетической природы. Генерализованный врожденный герпес у новорожденных достаточно часто развивается вследствие несовершенства иммунного ответа и сопровождается симптомами со стороны внутренних органов. Мозговые нарушения и кожные элементы также присутствуют.
Симптомы врожденного герпеса
Как уже было сказано выше, симптоматика различается в зависимости от формы заболевания. Чаще всего врожденный герпес дебютирует на 7-14 день жизни. Время появления первых клинических признаков зависит от многих факторов: сроки гестации, срока инфицирования, сопутствующей патологии и т. д. Примерно в половине случаев врожденный герпес проявляется специфической для данной нозологии везикулярной сыпью. Мелкие пузырьки с серозным содержимым могут локализоваться на любой части тела, при этом элементы располагаются группами, образуя скопления и иногда сливаясь. Везикулы окружены кольцом гиперемии и отека, за счет чего они слегка приподнимаются над кожей. Характерно поражение слизистой оболочки глаз в виде кератитов и конъюнктивитов.
Часто содержимое кожных элементов в короткие сроки становится геморрагическим или гнойным. После вскрытия на месте пузырьков остаются эрозии, заживающие путем образования корочки. Общее состояние малыша может ухудшаться незначительно, температура повышается до субфебрильных значений. Исключение составляют случаи так называемого первичного врожденного герпеса, представляющего собой локализованную форму заболевания и проявляющегося обильной сыпью, элементы которой часто сливаются, оставляя после вскрытия обширные эрозии. Температура высокая, высыпания присутствуют не только на коже, но и на слизистых. В отсутствие своевременной терапии генерализация происходит в 50% случаев.
Церебральная форма врожденного герпеса проявляется менингеальной симптоматикой при отсутствии поражения кожи. Иногда везикулярная сыпь возникает позже, спустя примерно неделю после дебюта мозговых нарушений, но элементов сыпи в этом случае всегда немного. На первый план выходят симптомы менингита и энцефалита: нарушения сознания, эпилептиформные, тонические и тонико-клонические судороги. Симптомы неспецифичны, поэтому герпетический энцефалит легко спутать с энцефалитом любой другой природы. Значительная интоксикация ухудшает состояние, однако у новорожденных лихорадка может быть не выражена. Также присутствуют признаки отека мозга, что проявляется стволовыми нарушениями: дисфагией, расстройствами дыхания и пр.
Генерализованная форма врожденного герпеса является самой опасной. Она включает в себя и элементы сыпи, и церебральную симптоматику, описанную выше. Помимо этого, заболевание проявляется поражением внутренних органов: гепатоспленомегалией, пневмонией, специфическими изменениями в почках и надпочечниках. Явления токсикоза выражены в значительной степени. Смертность при генерализованной форме врожденного герпеса составляет более 50%, а по некоторым данным достигает 80-90% случаев, при этом половина выживших детей остаются глубокими инвалидами. Медленный регресс общемозговых и очаговых расстройств и их частая необратимость являются особенностью герпетической инфекции.
Диагностика врожденного герпеса
Выявление заболевания сопряжено для педиатра со значительными трудностями. Во-первых, если отсутствуют кожные проявления, то врожденный герпес можно заподозрить с той же вероятностью, что и многие другие патологии неонатального периода, в частности, внутриутробные инфекции, гипоксическую травму и т. д. Кроме того, часто выявление возбудителя не является доказательством герпетической инфекции, поскольку основная масса населения в мире имела контакт с данным вирусом. Тем не менее, основой диагностики является обнаружение самого вируса или его антигенов в разных средах, например, в содержимом везикул, крови, мазках из носо- и ротоглотки, цереброспинальной жидкости и др.
Метод высокоспецифичен, но занимает много времени. По этой причине проводятся серологические исследования с целью определения специфических антител класса IgM, что является подтверждением острой фазы врожденного герпеса. Подтверждение диагноза возможно также на основании обнаружения антител класса IgG, при этом решающую роль играет не сам факт их наличия, а нарастание титра в динамике не менее чем в 4 раза (при отсутствии нарастания антитела являются материнскими). В диагностике герпетического энцефалита врачи опираются именно на данные серологического исследования. Врожденный герпес также подтверждается, исходя из анамнеза матери и результатов гистологического обследования последа.
Лечение и прогноз врожденного герпеса
Проводится этиотропная терапия заболевания, от сроков ее начала во многом зависит прогноз для жизни и здоровья ребенка. Применяются противовирусные препараты, высокотропные именно к вирусу простого герпеса. Используется парентеральный путь введения. Также назначаются средства наружного действия для лечения везикулярной сыпи. Кроме того, к терапии врожденного герпеса всегда подключаются иммуноглобулины и иммуномодуляторы, проводится курс витаминотерапии. По показаниям осуществляется кислородная поддержка и ИВЛ, вводятся противосудорожные препараты, проводится дегидратация.
Прогноз неблагоприятный. Врожденный герпес часто протекает в генерализованной форме, последствия герпетического энцефалита необратимы. Выжившие дети очень редко не отстают в развитии от сверстников. Большинство из них остаются инвалидами или погибают в период разгара клинических проявлений. Даже если терапия начата своевременно, заболевание может неоднократно рецидивировать с той же симптоматикой. Для профилактики рецидивов возможно использование герпетической вакцины. В настоящее время существует несколько ее видов, но вследствие частых мутаций вируса эффективность вакцинации остается под вопросом.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.
Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Что такое ветряная оспа (ветрянка)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
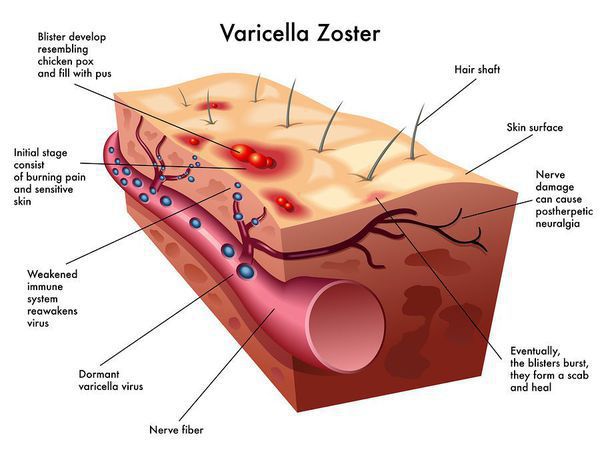
Ветряная оспа (Chickenpox) — острое инфекционное заболевание, вызываемое вирусом ветряной оспы, поражающим кожные покровы и нервную систему.
Симптомы ветрянки: умеренно выраженная общая интоксикация и везикулёзная экзантема. При длительной персистенцией вируса в виде латентной инфекции, при активизации которой (чаще после 60 лет) протекает в форме опоясывающего лишая. Течение доброкачественное при отсутствии осложнений.
Этиология
Возбудитель принадлежит к семейству Herpesviridae (от греч. herpes — ползучая), роду Varicellavirus. Вирус герпеса 3 типа — Varicella zoster. ДНК-содержащий, покрыт липидной оболочкой. Антигенная структура вируса устойчива, и не было выявлено измененных вариантов возбудителя. Крайне неустойчив во внешней среде, солнечная радиация, свежий воздух при проветривании, дезинфицирующие средства убивают вирус почти мгновенно. [1] [3] [5]
Эпидемиология
Антропоноз. Источник инфекции — больной человек (ветряной оспой и опоясывающим лишаём) независимо от степени тяжести и клинических проявлений. Больной заражает неболевших восприимчивых людей (восприимчивость 100%) с последних 48 часов инкубационного периода и до 5 суток с момента появления последнего свежего элемента сыпи.
Пути заражения
Механизм передачи воздушно-капельный (пути — аэрозольный, контактно-бытовой). Заболевание очень контагиозно, но для реализации заражения необходим тесный контакт больного и восприимчивого организма.
До 50% заболеваний приходится на возраст 5-9 лет, к 15 годам остается неиммунной прослойка не более 10% населения. Заболеваемость повышается в холодное время года.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы ветряной оспы
Сколько длится ветряная оспа (ветрянка)
Инкубационный период длится от 10 до 21 дня. В типичных случаях (у детей и подростков) заболевание начинается остро. В среднем ветряной оспой болеют 7-10 дней.
Симптомы ветряной оспы у взрослых и детей
Ветрянка у взрослых из-за утраты лабильности иммунной системы проявляется подострым и постепенным началом (т. е. основной синдром появляется на 2-3 и более поздние дни от начала заболевания). Дети, как правило, заболевание переносят легче.
Симптомы ветрянки у детей и взрослых:
- общая инфекционная интоксикация (СОИИ);
- везикулёзная экзантема;
- везикулёзная энантема (афты);
- лимфаденопатия (ЛАП);
- лихорадка постоянного типа.
В типичных случаях разгару заболевания предшествует продромальный период длительностью до одних суток, маловыраженный, сопровождающийся небольшой слабостью, субфебриллитетом, редко мелкопятнистой rash-сыпью.
Очень характерна динамика высыпаний: вначале появляется округлое красноватое пятно размерами 5-10 мм, далее в центре образуется папула, далее — везикула (пузырёк) с прозрачным содержимым до 10 мм (однокамерная и спадающаяся при проколе). Далее при присоединении вторичной флоры возможно её нагноение, после — подсыхание и образование корочек, отпадение которых происходит через 6-8 дней, обычно без последующих дефектов. В редких случаях (выраженное нагноение, расчесывание) могут образовываться рубчики.
Одновременно с высыпаниями на кожных покровах на слизистой оболочке рта образуются нежные везикулы, которые, быстро вскрываясь, образуют афты (эрозии) и могут вызывать чувство дискомфорта, жжения во рту.
Ветряная оспа у новорождённых
Грудные дети ветряной оспой болеют редко, так как большинство из них защищены материнскими антителами. Если ребёнку от матери передались антитела против вируса, то болезнь может протекать стёрто в лёгкой форме. Если защитных материнских антител нет, то ветрянка протекает бурно: выражены симптомы интоксикации, возможны судороги, нарушается сознание, возникают осложнения со стороны внутренних органов и нервной системы.
Ветряная оспа у беременных
Виду широкого распространения заболевания преимущественно в детском и подростковом возрасте к моменту наступления беременности женщины оказываются в большинстве случаев иммунны к вирусу ветряной оспы (т. е. если ветрянка была перенесена до беременности, риска повторного заболевания и угрозы для ребёнка нет, соответственно, нет рисков при контакте беременной с больным ветряной оспой или опоясывающим лишаём). В редких случаях, когда беременная не имеет титра протективных антител и вступает в контакт с больным человеком, возможны различные исходы, зависящие от срока беременности. Значительную опасность представляет острое заболевание ветряной оспой для самой беременной (о чём зачастую забывает как сама женщина, так и врач, диагностировавший заболевание).
Патогенез ветряной оспы
Классификация и стадии развития ветряной оспы
1. По клинической форме:
- рудиментарная (отсутствует синдром общей инфекционной интоксикации, из сыпи — розеолы);
- пустулёзная (присоединение вторичной — бактериальной флоры, нагноение и выраженное усиление интоксикации, частое образование рубчиков);
- буллёзная (выраженные проявления интоксикации, образование пузырей с жидкостью до 3 см);
- геморрагическая (геморрагическое пропитывание содержимого пузырьков, нейротоксикоз);
- гангренозная (образование язв, нейротоксикоз, развитие сепсиса);
- генерализованная (врожденная у детей, прогноз неблагоприятен);
- абортивная (быстрое обратное развитие сыпи).
2. По степени тяжести:
- легкая (умеренный СОИИ, повышение температуры тела до 38°С, необильные высыпания);
- средняя (выраженный СОИИ, повышение температуры тела до 39°С, обильные высыпания);
- тяжелая (резко выраженный СОИИ, повышение температуры тела свыше 39°С, гиперинтенсивные высыпания, сопровождающиеся образованием язв, геморрагиями). [1][2][3]
Стадии заболевания
Осложнения ветряной оспы
Осложнения ветрянки у детей и взрослых
Ветряная оспа у детей и взрослых протекает схоже, но у взрослых осложнения развиваются чаще.
Специфические осложнения:
- стенозирующий ларинготрахеит;
- неврологические осложнения — менингит, энцефалит, миелит;
- кератит;
- геморрагический нефрит.
Неспецифические осложнения:
- абсцессы;
- флегмоны;
- отит;
- пневмония;
- сепсис.
Осложнения ветрянки у беременных
По разным данным, развитие пневмонии у беременных при ветрянке достигает в среднем 22% от общего числа заболевших, а из них 42% случаев заканчивается летально. Вирус проникает через плацентарный барьер и может поражать ребёнка, выраженность проявлений зависит от сроков беременности. Так, при заражении в 1 триместре абортов не отмечается, но риск развития пороков развития достигает 5%, смертность от которых у новорожденных доходит до 34%. Во 2-3 триместрах тяжесть поражения возрастает, однако частота заражения ребёнка резко падает. Наибольший риск для ребёнка представляет заболевание матери за 5 дней до родов и 5 дней после них (риск врожденной инфекции до 20% и смертность до 30%), поэтому при развитии заболевания в предродовом периоде вариантом спасения может быть задержка родов на 5-7 дней (при возможности) и введение специфического иммуноглобулина. [1] [4] [5]
Что такое ветряночная пневмония
Ветряночная пневмония — это опасное осложнение, которое в основном возникает у беременных. Для заболевания характерно двустороннее воспаление лёгких, в тяжёлых случаях приводящее к их отёку и дыхательной недостаточности.
Диагностика ветряной оспы
При каких симптомах нужно обратиться к врачу
В каких случаях проводят анализ крови на ветряную оспу
В общей практике лабораторная диагностика ветряной оспы проводится редко. При необходимости в сомнительных или сложных случаях могут использоваться:
- клинический анализ крови с лейкоцитарной формулой (лейкопения и нормоцитоз, лимфо- и моноцитоз, при наслоении бактериальных осложнений — нейрофильный лейкоцитоз со сдвигом влево, т. е. изменения, свойственные большинству вирусных инфекций);
- общий анализ мочи (изменения редки, указывают на степень интоксикации);
- биохимические анализы крови (иногда повышение АЛТ как проявление герпетического гепатита, креатинина при поражениях почек);
- серологические реакции (возможна ретроспективная диагностика методами РСК, РА, ИФА классов IgM и G наиболее широко применяемый метод, позволяет провести дифференциальную диагностику между острой инфекцией и более старым инфекционным процессом, что наиболее важно при беременности. Достаточно информативен метод ПЦР).
Специальная подготовка для сдачи анализов не требуется. Расшифровкой анализов занимается врач.
При риске или произошедшем развитии осложнений производятся соответствующие лабораторные и инструментальные исследования (люмбальная пункция, рентген придаточных пазух носа, органов грудной клетки, КТ, МРТ и др.). [2] [4]
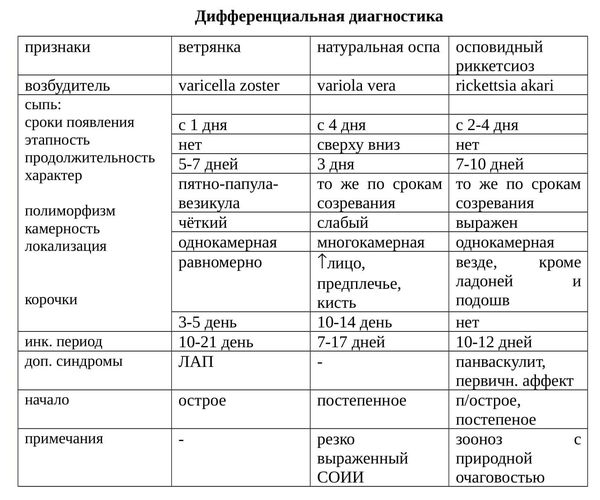
Как отличить ветрянку от других заболеваний
Лечение ветряной оспы
Ввиду всеобщей заболеваемости и в большей степени наличия форм лёгкой и средней тяжести заболевания больные ветряной оспой проходят лечение дома, в случае тяжелого заболевания (с риском развития и развившимися осложнениями), лица, проживающие в организованных коллективах, беременные должны проходить терапию в условия инфекционного стационара (до нормализации процесса и появлении тенденций к выздоровлению).
Самолечение ветряной оспы недопустимо. При появлении первых признаков нужно обратиться к терапевту или педиатру. Далеьнейшим ведением пациента занимается инфекционист.
Больной должен быть изолирован от окружающих (неболевших) людей до 5 дня со времени появления последнего свежего элемента сыпи.
Режим дня
Желателен постельный режим, строгое соблюдение санитарных норм (чистое бельё, коротко остриженные ногти, интимная гигиена).
Питание
Пища должна быть разнообразная, механически и химически щадящая, богатая витаминами, показаны мясные нежирные бульоны, обильное питьё до 3 л/сут. (теплая кипяченая вода, чай, морсы).
Медикаментозная терапия
Лечение ветрянки включает в себя этиотропную (т. е. воздействующую на возбудителя заболевания), патогенетическую (дезинтоксикация) и симптоматическую (облегчающую состояние больного путем уменьшения беспокоящих симптомов) терапию.
Этиотропная терапия назначается лишь при заболеваниях тяжелой степени тяжести и риске развития осложнений. Отдельно стоит указать на желательность данного вида лечения ветрянки и у взрослых больных, т. к. именно у них есть повышенный риск развития осложнений.
В качестве патогенетической и симптоматической терапии могут быть использованы препараты следующих групп:
Особенности ухода и лечения детей с ветрянкой
Ветряную оспу у детей и взрослых лечат схоже. Жаропонижающие детям следует давать при температуре свыше 38,5℃ (взрослым от 39,5℃). При уходе за ребёнком с ветрянкой важно не допускать расчёсывания кожи и срывания корочек.
Признаки выздоровления
К критериям выписки пациента, переболевшего ветрянкой, относятся:
- с момента появления последнего свежего элемента сыпи прошло не менее пяти дней;
- нормализация температуры тела;
- отсутствие изменений лабораторных показателей (при тяжёлом течении);
- отсутствие осложнений.
Ввиду нестойкости вируса в окружающей среде заключительную дезинфекцию в очаге заболевания не проводят (достаточно проветривания). [1] [2] [4]
Прогноз. Профилактика
- ведущую роль в профилактике распространения ветряной оспы играет изоляционное разобщение больных и здоровых (детей до 7 лет, не болевших, разобщают с 9 по 21 день с момента контакта с больным);
- мытьё рук и лица с мылом после общения с больными;
- прогулки на свежем воздухе;
- здоровое питание, поливитамины;
- частое проветривание помещения.
Вакцинация. Стоит ли делать прививку от ветрянки взрослым
Вакцинация в раннем возрасте предотвращает в 99 % развитие заболевания у детей, при контакте в подавляющем большинстве случаев — в первые 72 часа, предотвращает развитие тяжёлых форм и патологий плода у беременных. Однако есть ряд ограничений, существенно препятствующих распространению вакцинации в нашей стране — высокая стоимость вакцины, отсутствие массового вакцинирования (по данным ВОЗ, для реализации коллективного иммунитета необходимо привить не менее 90% детского населения, иначе возрастает риск заболевания неболевших и непривитых лиц взрослого состава). [1] [5]
- небеременным женщинам детородного возраста;
- медицинским работникам;
- людям с ослабленным иммунитетом и родственникам, проживающим с ними;
- учителям и воспитателям;
- персоналу домов престарелых и людям, проживающих в них;
- международным путешественникам [6] .
Можно ли второй раз заболеть ветрянкой
Иммунитет после болезни стойкий, повторные заболевания возможны у лиц с иммунодефицитом, врожденным дефицитом иммуноглобулина А. [1] [2] [5]
К заражению устойчивы:
- люди, переболевшие ветряной оспой;
- новорождённые с защитными антителами, которые передались им от матери;
- вакцинированные пациенты.
Постконтактная профилактика
Предотвратить развитие инфекции или ослабить её течение поможет внутримышечное введение иммуноглобулина к вирусу ветряной оспы (VariZIG).
Профилактика после контакта с заболевшим показана:
- пациентам с лейкемией, иммунодефицитом или другими тяжёлыми заболеваниями;
- беременным женщинам, не имеющим антител к вирусу;
- новорождённым, чьи матери были инфицированы ветряной оспой за пять дней до родов или через два дня после них;
- новорождённые младше 28 недель, контактировавшие с возбудителем не через мать, даже если у неё есть специфический иммунитет [7] .
Профилактика рубцов и шрамов
Как правило, изменения кожи при ветряной оспе полностью исчезают после выздоровления. Важно лишь не расчёсывать кожу, не срывать корочки и ограничить применение косметических средств.
Читайте также:

