Анализ крови при циррозе печени и гепатите с
Обновлено: 26.04.2024
Цирроз печени – хроническое заболевание, характеризующееся необратимым замещением паренхимы печени рубцовой соединительной тканью с постепенной утратой органом своей функции, его уплотнением и сморщиванием.
Патология может быть вызвана вирусной инфекцией, интоксикацией организма, наследственными и аутоиммунными нарушениями, поражением других структур гепатобилиарной системы. Без помощи врачей болезнь прогрессирует и через несколько лет приводит к смерти пациента от развившихся осложнений.
Терапия цирроза печени включает прием лекарственных препаратов для облегчения симптомов и коррекции сопутствующих нарушений. Единственным радикальным методом лечения является хирургическая трансплантация органа, однако проводится операция в крайних случаях.
Причины цирроза печени
Одной из самых распространенных причин цирроза печени, особенно у мужчин, считается злоупотребление алкоголем. Часто фиброз органа развивается в исходе других заболеваний гепатобилиарной системы – вирусных и токсических гепатитов, обструкции или воспаления желчевыводящих путей, желчнокаменной болезни.
- паразитарная инвазия;
- венозный застой в сосудах печени;
- портальная гипертензия;
- аутоиммунные заболевания;
- тяжелая правожелудочковая сердечная недостаточность;
- вторичный или третичный сифилис, бруцеллез;
- наследуемые нарушения обмена веществ;
- продолжительный прием лекарственных препаратов, например, Ипразид, анаболические стероиды, Изониазид, андрогены, Метилдофа, Индерал, Метотрексат;
- отравление грибами, попадание в организм промышленных ядов, солей тяжелых металлов и других токсинов.
Классификация
- билиарный, вызванный поражением желчевыводящих путей;
- токсический и токсико-аллергический;
- инфекционный;
- циркуляторный, при венозном застое;
- обменно-алиментарный;
- криптогенный, когда этиология осталась неуточненной.
Симптомы и стадии цирроза печени
- Начальная. Умеренный фиброз протекает практически бессимптомно. Заболевание становится случайной находкой во время периодических медицинских осмотров, диспансеризации, при обследовании пациента со смежной патологией.
- Клиническая. Выраженный фиброз сопровождается нарушением функции органа. Первыми симптомами цирроза печени становятся привкус горечи и чувство сухости во рту, быстрая утомляемость, раздражительность, потеря веса, вздутие кишечника, периодическое нарушение стула, боль в правом подреберье после физической нагрузки или погрешности в диете. Позже снижается аппетит, присоединяются тошнота, рвота, отрыжка, желтушность кожи и слизистых оболочек, субфебрильная температура тела. Печень и селезенка увеличиваются в размерах, на животе появляются расширенные вены и сосудистые звездочки.
- Терминальная. Орган уменьшается в размере. Возникают желтуха, асцит, отеки конечностей, кровотечение из варикозно-расширенных вен пищевода, желудка и кишечника.
Диагностика
Диагностикой и лечением цирроза печени занимается врач-гастроэнтеролог. В ходе беседы с пациентом он выявляет предрасполагающие факторы к развитию патологии, такие как прием алкоголя или лекарственных препаратов, неправильное питание, вредные условия труда, наследственная предрасположенность, другие хронические болезни.
Наружный осмотр и пальпация правого подреберья позволяют обнаружить объективные признаки цирроза печени – желтушность кожи, слизистых оболочек, увеличение печени, бугристость ее края и уплотнение.
-
. Оценивают признаки анемии, количество тромбоцитов.
- Общий анализ мочи. Отклонения указывают на гепаторенальный синдром.
- Биохимический анализ крови. Обращают внимание на такие показатели как АСТ, АЛТ, ГГТП, щелочная фосфотаза, общий билирубин и его фракции, альбумин, сывороточное железо, общий холестерин, креатинин, глюкоза, натрий,калий, ферритин, церулоплазмин.
- Анализ крови на свертываемость – коагулограмма.
- Уровень антинуклеарных антител и альфа-фетопротеина в сыворотки крови.
- Обнаружение маркеров вирусных гепатитов – HBsAg, анти-HCV, анти-HDV, а также ВИЧ.
- Электрокардиография.
- Ультразвуковое исследование органов брюшной полости.
- Эндоскопическое исследование желудка и двенадцатиперстной кишки, а также осмотр сосудов прямой кишки с помощью ректороманоскопии на предмет расширения вен.
- Определение когнитивных нарушений с помощью теста связывания чисел и других методик.
- определение среднего объема эритроцитов с целью выявления алкогольного поражения печени; ; ;
- определение гамма-глобулина;
- биохимический анализ крови на общий белок, уровень аммиака, мочевины; ;
- антитела к двуспиральной ДНК, гладкой мускулатуре, печеночно-почечным микросомам анти-LKM1;
- гормоны щитовидной железы – Т4 свободный, ТТГ, антитела к тиреопероксидазе;
- исследование уровня общего эстрадиола у женщин, андрогенов у мужчин;
- содержание криоглобулинов;
- КТ или МРТ органов брюшной полости с контрастированием;
- УЗИ органов малого таза при подозрении на поражение почек;
- ЭхоКГ;
- непрямую эластографию печени.
Лечение цирроза печени
Всем пациентам с поражением печени рекомендованы отказ от алкоголя, ограничение физической нагрузки и диета с исключением жирной, тяжелой, содержащей большое количество белка, пищи. Также необходимо пересмотреть медикаментозную терапию хронических заболеваний, если она проводилась. Важно установить причину патологических изменений в органах гепатобилиарной системы и устранить ее.
Консервативное лечение цирроза печени включает применение гепатопротекторов, бета-адреноблокаторов, препаратов натрия и урсодезоксихолевой кислоты. Дополнительно производятся профилактика остеопороза и тромбозов препаратами кальция и цинка, витамином Д, бифосфонатами, симптоматическое лечение зуда, контроль и терапия анемии.
При декомпенсированном циррозе печени больного госпитализируют в стационар под круглосуточное наблюдение врачей, так как высок риск летального исхода.
- использование мочегонных средств и хирургическое удаление лишней жидкости при асците;
- ноотропы и сорбенты для улучшения функции головного мозга;
- бета-блокаторы с последующей перевязкой или склеротерапией расширенных вен, созданием дополнительных анастомозов между ними при портальной гипертензии;
- хирургическое удаление пораженных сегментов органа или его трансплантация при злокачественном перерождении ткани печени в гепатоцеллюлярную карциному;
- прием андрогенов мужчинами с выраженными проявлениями гипогонадизма;
- коррекцию гормонального фона у женщин с циррозом печени для профилактики дисфункциональных маточных кровотечений.
Прогноз при циррозе печени зависит от причины заболевания, стадии, на которой он был обнаружен, и осложнений, которые успели появиться на момент начала лечения.
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
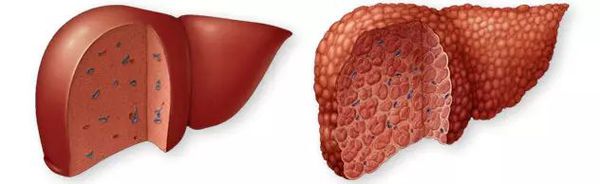
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
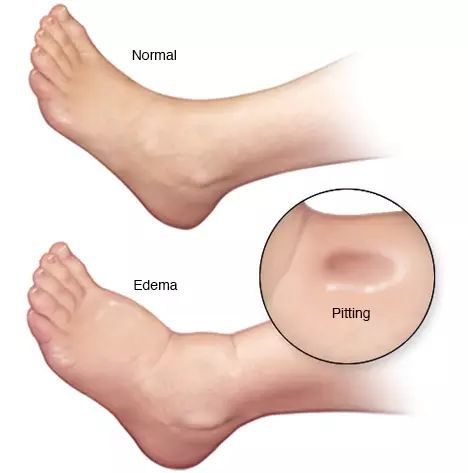
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
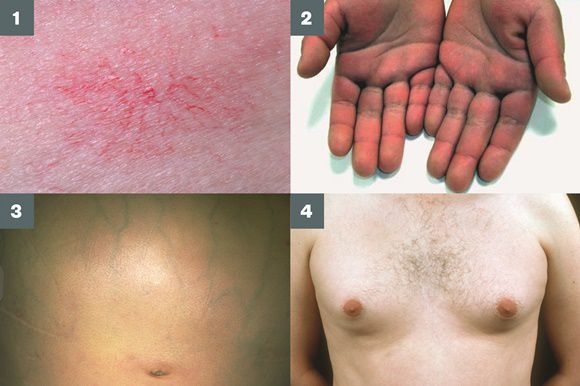
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
М. Г. Ипатова 1, 2 к.м.н., Ю. Г. Мухина 1 д.м.н. профессор, П. В. Шумилов 1 д.м.н., профессор
1 Российский национальный исследовательский медицинский университет им. Н. И. Пирогова
МЗ РФ, Москва
2 Детская Городская Клиническая Больница № 13 им. Н. Ф. Филатова, Москва
Ключевые слова: печень, синдром цитолиза, аланинаминотрансфераза, аспартатамино-трансфераза, гепатопротективные препараты
В статье изложены биохимические лабораторные показатели и их клиническое значение при заболеваниях печени, протекающих с синдромом цитолиза. Отдельное внимание уделено механизмам действия гепатопротективных препаратов, применяемых при цитолитическом синдроме.

Рис. 1. Роль печени в обмене веществ.
Сокращения: ЛПВП - липопротеиды высокой плотности; ЛПОНП - липопротеиды очень низкой плотности; РЭС ретикуло-эндотелиальная система; НАД - никотинамидадениндинуклеотид; ФАД - флавинадениндинуклеотид.
Печень представляет собой центральный орган химического гомеостаза организма, где создается единый обменный и энергетический пул для метаболизма почти всех классов веществ [1]. К основным функциям печени относятся: метаболическая, депонирующая, барьерная, экскреторная, гомеостатическая и детоксицирующая [2]. Печень может обезвреживать как чужеродные экзогенные вещества, обладающие токсическими свойствами, так и синтезированные эндогенно.
Таблица 2. Причины повышения уровня аминотрансфераз
Печеночные причины
Внепеченочные причины
•Вирусные гепатиты (В, С, ЦМВ и др.)
•Хронические инфекции и паразитарные
заболевания (эхинококкоз, токсоплазмоз и др.)
•Неалкогольный стеатогепатит
•Аутоиммунные заболевания печени
•Злоупотребление алкоголем
•Прием лекарственных препаратов
(статины, некоторые антибиотики, противогрибковые препараты, нестероидные
противовоспалительные препараты,
глюкокортикостероиды, другие)
•Метаболические заболевания печени
(галактоземия, фруктоземия, гликогенозы,
дефицит альфа1-антитрипсина,
аминоацидопатии, нарушение цикла мочевины, нарушение окисления жирных кислот, митохондриальная гепатопатия, некоторые лизосомные заболевания (болезнь
Гоше, болезнь Ниманна-Пика, дефицит кислой липазы и др.), муковисцидоз, синдром Швахмана-Даймонда, гемохроматоз, болезнь Вильсона и др.)
•врожденные и приобретенные дефекты
сосудов системы воротной вены (болезнь
Бадда-Киари и др.)
•Цирроз печени
•Опухоли печени
•Патология сердца (острый инфаркт
миокарда, миокардит)
•Повышенная физическая нагрузка
•Наследственные нарушения мышечного
метаболизма
•Приобретенные мышечные заболевания
•Травма и некроз мышц
•Целиакия
•Гипертиреоз
•Тяжелые ожоги
•Гемолиз эритроцитов
•Нарушение кислотно-щелочного равновесия
•Сепсис
Находясь между портальным и большим кругами кровообращения, печень выполняет функцию большого биофильтра. Через воротную вену в нее поступает более 70% крови, остальная кровь попадает через печеночную артерию. Большая часть веществ, всасывающихся в пищеварительном тракте (кроме липидов, транспорт которых в основном осуществляется через лимфатическую систему), поступает по воротной вене в печень [2]. Таким образом, печень функционирует как первичный регулятор содержания в крови веществ, поступающих в организм с пищей (рис 1).
Большое разнообразие функций гепатоцитов приводит к тому, что при патологических состояниях печени нарушаются биохимические константы, отражающие изменения многих видов обмена. Поэтому стандартный биохимический анализ крови включает определение различных параметров, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов.
Концентрация ферментов в клетках значительно выше, чем в плазме крови; в норме только очень незначительная часть определяется в крови. Наиболее частыми причинами повышения уровня ферментов в сыворотке крови являются: прямое поражение клеточных мембран, в частности вирусами и химическими соединениями, гипоксия и ишемия тканей. Иногда активность ферментов увеличивается в результате их повышенного синтеза в тканях. Определение активности тех или других ферментов в сыворотке крови позволяет судить о характере и глубине поражения различных компонентов гепатоцитов [3, 4].
Ферменты в зависимости от их локализации можно разделить на несколько групп:
1) универсально распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах – амино-трансферазы, фруктозо-1-6-дифосфатальдолаза;
2) печеночноспецифические (органоспе-цифические) ферменты; их активность исключительно или наиболее высоко выявляется в печени. К ним относятся холинэстераза, орнитин-карбамилтрансфераза, сорбитдегидрогеназа и др.;
3) клеточноспецифические ферменты печени относят преимущественно к гепатоцитам,
купферовским клеткам или желчным канальцам (5-нуклеотидаза, аденозинтрифосфатаза);
4) органеллоспецифические ферменты, являются маркерами определенных органелл
гепатоцита: митохондриальные (глутаматде-гидрогеназа, сукцинатдегидрогеназа, цитохромоксидаза), лизосомальные (кислая фос фатаза, дезоксирибонуклеаза, рибонуклеаза), микросомальные (глюкозо-6-фосфатаза).
Специфичность ферментов и их диагностическое значение представлено в таблице 1 [5].
Отдельное место занимает макроэнзиме-мия – редкое и крайне сложное для дифференциальной диагностики состояние, при котором происходит комплексирование молекул того или иного энзима с иммуноглобулинами или небелковыми веществами. Описаны клинические наблюдения макро-КФК-емии, макро-ЛДГ-емии, макро-АСТ-емии, макро-ГГТ-емии, макроамилаземии. Макро-энзимемии сложны для диагностики и дифференциальной диагностики и ведут к проведению инвазивных методов обследования и необоснованному лечению.
В основе выявления макроэнзимемии лежит выявление отличий молекулы макрофермента от молекулы обычного энзима. Некоторые из этих методов являются прямыми, т. е. такими, которые позволяют непосредственно определить присутствие в крови ферментного комплекса, имеющего гораздо более высокий молекулярный вес, чем молекула нормального фермента. В основу прямого метода положено разделение белков сыворотки по молекулярному весу. Другие же методы являются непрямыми, так как выявление макроэнзима в крови проводится не путем выявления самого ферментного комплекса, а основываются на выявлении какого-либо из свойств макроэнзима. Прямые тесты имеют большее диагностическое значение и влекут за собой меньше технических и диагностических ошибок.
В некоторых ситуациях повышение ферментов является физиологическим: уровень щелочной фосфатазы повышен у подростков в период вытяжения (период ускорения роста), у здоровых женщин во время третьего триместра беременности (за счет плаценты). Однако очень высокую активность щелочной фосфатазы наблюдают у женщин с преэк-лампсией, что связно с нарушением кровообращения плаценты [7].
Большое значение в диагностике заболеваний печени имеют анамнестические данные и клиническая картина заболевания. Из анамнеза следует попытаться узнать о факторах риска заболеваний печени, обращая особое внимание на семейный анамнез, прием лекарств, витаминов, растительных добавок, наркотиков, алкоголя, трансфузии препаратов крови, патологические результаты печеночных проб в прошлом и симптоматику заболеваний печени. Клиническое обследование позволяет диагностировать до 50–60% патологических состояний. Более детальная дифференциальная диагностика основана на иммунохимических методах. Они позволяют детализировать характер вирусной, а также паразитарной инфекции, определить локализацию неопластического процесса, определить этиологию аутоиммунного заболевания, уточнить вид нарушения наследственных заболеваний обмена веществ.
При патологии печени в биохимическом анализе крови выделяют 4 синдрома:
• Синдром печеночно-клеточной недостаточности
• Мезенхиально-воспалительный синдром.
В данной статье мы подробно разберем по
казатели, характерные для синдрома цитолиза.
Синдром цитолиза – это синдром, обусловленный нарушением проницаемости клеточных мембран, распадом мембранных структур или некрозом гепатоцитов с выходом в плазму ферментов (АЛТ, АСТ, ЛДГ, альдолазы и др.).
АМИНОТРАНСФЕРАЗЫ: аспартатаминотрансфераза и аланинаминотрансфераза
Референтные значения: у новорожденных детей до 1 мес. – менее 80 Ед/л; от 2 мес. до 12 мес. – менее 70 Ед/л., с 1 года до 14 лет – менее 45 Ед/л, у женщин – менее 35 Ед/л, у мужчин – менее 50 Ед/л.
В клинической практике широко применяется одновременное определение уровня двух трансаминаз – аспартатаминотрансферазы (AСT) и аланинаминотрансферазы (АЛТ) в сыворотке крови.
Ферменты АЛТ и АСТ содержатся практически во всех клетках человеческого организма. Однако самый высокий уровень фермента АЛТ содержится в печени, поэтому уровень данного энзима служит специфическим маркером поражения печени. В свою очередь, АСТ помимо печени (в порядке снижения концентрации) содержится в сердечной и скелетных мышцах, почках, поджелудочной железе, легких, лейкоцитах и эритроцитах [6, 7, 8].
В печени АЛТ присутствует только в цитоплазме гепатоцитов, а АСТ – в цитоплазме и в митохондриях. Более 80% печеночной АСТ представлено именно митохондриальной фракцией [6, 7, 8].
В норме постоянство концентрации транс-аминаз в плазме крови отражает равновесие между их высвобождением вследствие физиологического апоптоза состарившихся гепатоци-тов и элиминацией. Соотношение синтеза АСТ/ АЛТ в печени равно 2,5/1. Однако при нормальном обновлении гепатоцитов уровни АСТ и АЛТ в плазме крови практически одинаковы (30–40 Ед/л) из-за более короткого периода полувыведения АСТ (18 ч против 36 ч у АЛТ).
При заболеваниях печени в первую очередь и наиболее значительно повышается активность АЛТ по сравнению с АСТ. Например, при остром гепатите, независимо от его этиологии, активность аминотрансфераз повышается у всех больных, однако преобладает уровень АЛТ, содержащейся в цитоплазме, вследствие ее быстрого выхода из клетки и поступления в кровяное русло. Таким образом, по уровню АЛТ судят о биохимической активности заболевания печени. Повышение показателя в 1,5–5 раз от верхней границы нормы свидетельствует о низкой активности процесса, в 6–10 раз – об умеренной и более 10 раз – о высокой биохимической активности. Повышение активности трансаминаз более 6 месяцев является биохимическим признаком хронического гепатита [6, 7].
Некоторые лекарственные препараты (например, вальпроевая кислота) метаболизируются в митохондриях гепатоцитов [9], поэтому ранним лабораторным маркером гепатотоксичности может быть лишь изолированное повышение АСТ.
Помимо патологии печени АСТ служит одним из ранних маркеров повреждения сердечной мышцы (повышается у 93–98% больных инфарктом миокарда до 2–20 норм); специфичность его не высока. Уровень ACT в сыворотке крови возрастает через 6–8 часов после начала болевого приступа, пик приходится на 18–24 часа, активность снижается до нормальных значений на 4–5 день. Нарастание активности фермента в динамике может свидетельствовать о расширении очага некроза, вовлечении в патологический процесс других органов и тканей, например, печени [7].
Интенсивные мышечные упражнения с чрезмерной нагрузкой также могут вызвать преходящее увеличение уровня ACT в сыворотке крови. Миопатии, дерматомиозиты и другие заболевания мышечной ткани вызывают повышение трансаминаз, преимущественно за счет АСТ.
Умеренное увеличение активности АСТ (в 2–5 раз от верхней границы нормы) отмечается при острых панкреатитах и гемолитических анемиях.
При латентных формах цирроза печени повышения активности ферментов, как правило, не наблюдают. При активных формах цирроза стойкий незначительный подъем аминотрансфераз выявляют в 74–77% случаев, и, как правило, преобладает активность АСТ над АЛТ в два и более раз.
Снижение активности АЛТ и АСТ имеет место при недостаточности пиридоксина (витамина В6), при почечной недостаточности, беременности.
Ниже приведены печеночные и внепеченочные причины повышения активности аминотрансфераз в сыворотке крови (табл. 2).
Помимо оценки уровня трансаминаз в клинической практике широко применяется коэффициент де Ритиса – отношение АСТ к АЛТ (АСТ/АЛТ). В норме значение этого кэффициента составляет 0,8–1,33. Следует отметить, что расчет коэффициента де Ритиса целесообразен только при выходе АСТ и/или АЛТ за пределы референтных значений.
У новорожденных детей соотношение АСТ/АЛТ обычно превышает 3,0, однако к пятому дню жизни снижается до 2,0 и ниже.
При поражениях печени с разрушением гепатоцитов преимущественно повышается АЛТ, коэффициент де Ритиса снижается до 0,2–0,5. При патологии сердца преобладает уровень АСТ, и коэффициент де Ритиса повышается. Однако для точной дифференциальной диагностики этот коэффициент непригоден, так как нередко при алкогольном поражении печени, неалкогольном стеатогепатите, циррозе печени также преобладает повышение АСТ и коэффициент де Ритиса составляет 2,0–4,0 и более. Значение данного коэффициента выше нормы часто наблюдается при обтурационных желтухах, холециститах, когда абсолютные значения АЛТ и АСТ невелики.
1. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АЛТ выше, чем АСТ (коэффициент де Ритиса меньше 1,0). Тяжелое поражение паренхимы печени может изменить это соотношение.
2. При алкогольном гепатите и циррозе нередко активность АСТ оказывается выше, чем АЛТ (коэффициент де Ритиса больше 1,0).
3. При остром ИМ активность АСТ выше, чем АЛТ (коэффициент де Ритиса больше 1,5).
ЛАКТАТДЕГИДРОГЕНАЗА
Референтные значения ЛДГ для новорожденных – до 600 Ед/л, у детей с 1 года до 12 лет активность ЛДГ – 115 – 300 Ед/л, для детей старше 12 лет и у взрослых норма ЛДГ – до 230 Ед/л.
Лактатдегидрогеназа (ЛДГ) – гликолитический цинксодержащий фермент, обратимо катализирующий окисление L-лактата в пируват, широко распространен в организме человека. Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце, скелетной мускулатуре и печени. ЛДГ содержится не только в сыворотке, но и в значительном количестве в эритроцитах, поэтому сыворотка для исследования должна быть без следов гемолиза [7].
При электрофорезе или хроматографии удается обнаружить 5 изоферментов ЛДГ, отличающихся по своим физико-химическим свойствам. Наибольшее значение имеют два изофермента – ЛДГ1 и ЛДГ5. Фракция ЛДГ1 более активно катализирует обратную реакцию превращения лактата в пируват. Она в большей степени локализуется в сердечной мышце и некоторых других тканях, в норме функционирующих в аэробных условиях. В связи с этим миокардиальные клетки, обладающие богатой митохондриальной системой, окисляют в цикле трикарбоновых кислот не только пируват, образующийся в результате протекающего в них самих процесса гликолиза, но и лактат, образующийся в других тканях. Фракция ЛДГ5 более эффективно катализирует прямую реакцию восстановления пирувата в лактат. Она локализуется преимущественно в печени, в скелетных мышцах. Последние нередко вынуждены функционировать в анаэробных условиях (при значительной физической нагрузке и быстро наступающем утомлении). Образующийся при этом лактат с кровотоком попадает в печень, в которой он используется для процесса глюконеогенеза (ресинтеза глюкозы), а также в сердце и другие ткани, где происходит его преобразование в пируват и вовлечение в цикл трикарбоновых кислот (цикл Кребса). Любое повреждение клеток тканей, содержащих большое количество ЛДГ (сердце, скелетные мышцы, печень, эритроциты), приводит к повышению активности ЛДГ и ее изо-ферментов в сыворотке крови. Наиболее частыми причинами повышения активности ЛДГ являются:
1. Поражение сердца (острый инфаркт миокарда, миокардит, застойная сердечная недостаточность); в этих случаях обычно преобладает повышение активности ЛДГ1 и/или ЛДГ2.
2. Поражение печени (острые и хронические гепатиты, цирроз печени, опухоли и метастазы печени), когда преимущественно увеличивается изофермент ЛДГ5, ЛДГ2, ЛДГ4.
3. Повреждение скелетных мышц, воспалительные и дегенеративные заболевания
скелетных мышц (преимущественно увеличение изофермента ЛДГ1, ЛДГ2, ЛДГ3).
4. Заболевания крови, сопровождающиеся распадом клеток крови: острый лейкоз, гемолитическая анемия, В12-дефицитная анемия, серповидноклеточная анемия, а также заболевания и патологические состояния, сопровождающиеся разрушением тромбоцитов (массивная гемотрансфузия, эмболия легочной артерии, шок и др.). В этих случаях может преобладать повышение активности ЛДГ2, ЛДГ3.
5. Острый панкреатит.
6. Заболевания легких (пневмония и др.)
7. Инфаркт почки.
8. Опухоли (повышенный уровень ЛДГ наблюдается в 27% случаев опухолей в I стадии и в 55% – метастатических семином).
Следует помнить, что многие заболевания сердца, скелетных мышц, печени и крови могут сопровождаться повышением активности в сыворотке крови общей ЛДГ без отчетливого преобладания какого-либо из ее изоферментов.
Таблица 3. Эффективность гепатопротекторов при синдроме цитолиза (по С. В. Морозову с соавт., 2011 г. и Н. Б. Губергриц, 2012 г.) [10]

Нарушения гематологических показателей часто встречаются при циррозе печени. Множество причиныспособствуют возникновению гематологических нарушений. Недавние исследования показывают, что наличие гематологических цитопений связано с плохим прогнозом при циррозе. Представляет интерес патогенез, заболеваемость, распространенность, клиническое значение и лечение аномальных гематологических показателей при циррозе печени. Патогенез аномальных гематологических показателей (His) при циррозе является многофакторным и включает в себя наличие портальной гипертензии , вызванной секвестрации, изменений в костном мозге , стимулирующих факторов, viral- и токсин-индуцированного подавления костного мозга и др. Нарушения в HI связаны с повышенным риском осложнений, включая кровотечение и инфекцию ( Qamar A.,Grace N., et.al., 2009).
Ниже перечислены причины тромбоцитопении при циррозе :
Портальная гипертензия, вызванная секвестрацией селезенки
Изменения в тромбопоэтине
Подавление костного мозга опосредованое токсинами (например, алкоголь, гепатит В и С)
Коагулопатия (например, низкокачественная диссеминированная внутрисосудистая коагуляция, приобретенная внутрисосудистая коагуляция и фибринолиз)
Увеличеные кровопотери (например, кровоизлияние)
Связь между гемопоэтическими стимулирующими факторами и тромбоцитопенией, анемией и лейкопенией при циррозе:
Гематопоэтический стимулирующий фактор
Ассоциация с циррозом
Значительная связь с наличием тромбоцитопении
Возможна ассоциация, данные ограничены
Гранулоцитарный колониестимулирующий фактор
Секвестрация селезенки и разрушение тромбоцитов, лейкоцитов и эритроцитов в увеличенной селезенке, вызванной портальной гипертензией, определяется как гиперспленизм. У пациентов с циррозом печени происходит перераспределение тромбоцитов, при этом до 90% циркулирующей массы тромбоцитов находится в увеличенной селезенке. Аналогичным образом, секвестрация эритроцитов в селезенке способствует развитию анемии при заболеваниях печени. Используя 51 Cr-меченные эритроциты, Subiyah и Al-Hindawi продемонстрировали корреляцию между снижением выживаемости эритроцитов и спленомегалией, связанной с портальной гипертензией. Они также показали, что спленэктомия привела к улучшению выживаемости эритроцитов. Другие авторы исследовали частоту исчезновения аутологичных гранулоцитов в крови 20 пациентов с алкогольным циррозом печени. Гранулоциты метили 32 P-меченным диизопропилфторфосфатом ( 32 DFP), и получали кривые исчезновения и коррелировали с давлением и размером селезеночной пульпы. Портальные давления оценивались по давлению селезеночной пульпы. Была получена двухфазная кривая, в которой 59% из 32 DFP-меченые гранулоциты извлекали в начальной быстрой фазе. Эта начальная фаза коррелировала с давлением в пульпозной пульпе, но не с размером селезенки. На втором этапе оставшиеся гранулоциты исчезали с меньшей скоростью. В целом, не было никакой связи между извлечением гранулоцитов и размером селезенки или давлением в селезеночной пульпе, что позволяет предположить, что секвестрация происходит вне селезенки, возможно, в селезеночной циркуляции.
У пациентов с компенсированным циррозом исследователи показали значительную корреляцию между градиентом венозного давления в печени (HVPG [маркер портальной гипертензии]) и HI. Однако корреляция между количеством тромбоцитов, количеством лейкоцитов и гемоглобином была лишь незначительной или умеренной. Это говорит о том, что другие факторы, помимо секвестрации селезенки, способствуют возникновению аномальных HI при циррозе. Как для лейкопении, так и для анемии портальная гипертензия, по-видимому, имеет ограниченное значение.
Тромбопоэтин
Тромбопоэтин вырабатывается печенью, почками, мышцами и костным мозгом, и его синтез в основном зависит от функции печени. Тромбопоэтин стимулирует выработку и дифференцировку мегакариоцитов в зрелые тромбоциты. Исследования показали, что он эффективен в увеличении количества тромбоцитов в нецирротических условиях. Многочисленные исследования оценивали тромбопоэтин при циррозе печени. Одни авторы оценивали периферические уровни тромбопоэтина у 28 пациентов с циррозом печени, ни у одного из которых не было обнаружимого тромбопоэтина. Тем не менее, семерым из этих пациентов была проведена трансплантация печени с повышением уровня тромбопоэтина через два дня после операции. С другой стороны, у пяти из этих пациентов, перенесших декомпрессию по поводу портальной гипертензии, не было отмечено повышение уровня тромбопоэтина. В аналогичном исследовании Martin et.al. не смогли обнаружить тромбопоэтин в плазме у 39 из 44 пациентов с циррозом. Они также отметили, что среди 16 из 17 пациентов, перенесших трансплантацию печени, тромбопоэтин стал выявляться. Последующие исследования подтвердили эти выводы.
Поскольку печень является одним из основных органов, вырабатывающих тромбопоэтин, изменения в перфузии печени могут изменить либо синтез, либо выброс гормона. Исследователи использовали тест на моноэтилглицинексилидид, который частично зависит от перфузии печени, для оценки уровня тромбопоэтина. Они продемонстрировали умеренную корреляцию между временем испытания моноэтилглицинексилидида и уровнем тромбопоэтина у пациентов с циррозом печени. Это говорит о том, что перфузия печени может играть роль в регуляции уровня тромбопоэтина. Другие авторы обнаружили, что уровни тромбопоэтина коррелировали с размером селезенки, но не с количеством тромбоцитов. После частичной эмболизации селезенки у этих пациентов была восстановлена физиологическая взаимосвязь между уровнем тромбопоэтина и количеством тромбоцитов. В докладе сделан вывод о том, что усиление деградации тромбопоэтина в перегруженной портальной гипертонией селезенке может способствовать тромбоцитопении цирроза печени.
Sezai et.al. показали, что у 19 пациентов с циррозом печени гепатофугальное кровообращение, которое обычно связано с более низким давлением в портальной вене и менее тяжелой портальной гипертензией, имело более низкое соотношение тромбопоэтина в печеночной вене и портальной вене. Это говорит о том, что для высвобождения тромбопоэтина может потребоваться определенное перфузионное давление. Однако для подтверждения этих результатов требуется более масштабное исследование. Кроме того, авторы использовали портовенозное давление для оценки портальной гипертензии, которая не учитывает внутрипеченочную синусоидальную гипертензию. Более точным фактором, определяющим портальную гипертензию, является HVPG; этот вывод следует использовать в будущих исследованиях.
Анемия
Эритропоэтин вырабатывается преимущественно почками, а также печенью. Он защищает эритроциты от апоптоза и способствует развитию предшественников эритроцитов. Yang et.al. исследовали значение эритропоэтина у 67 пациентов с различной степенью тяжести цирроза печени и сообщили, что уровни эритропоэтина в плазме были значительно выше у пациентов с циррозом, чем в контрольной группе. Они также обнаружили, что уровни выше у пациентов с анемией. Интересно, что они продемонстрировали положительную корреляцию между HVPG и эритропоэтином и отрицательную корреляцию между печеночным кровотоком и эритропоэтином. Другие авторы обнаружили увеличение эритропоэтина у больных циррозом с анемией, только когда уровень гемоглобина был ниже 120 г / л. Авторы считают, что ответ на эритропоэтин был притупленным по сравнению с другими причинами анемии, такими как дефицит железа.
Факторы, стимулирующие лейкоциты
Очень мало известно о роли гранулоцитарного колониестимулирующего фактора (G-CSF) или гранулоцитарного макрофагального колониестимулирующего фактора (GM-CSF) в лейкопении, связанной с циррозом печени. Эти факторы вырабатываются иммунными клетками для стимуляции костного мозга, чтобы производить и выпускать гранулоциты и стволовые клетки в кровообращение. Они также играют роль в дифференциации и функции зрелых нейтрофилов. Gurakar et.al. показали, что лечение GM-CSF в течение семи дней у пациентов с циррозом и лейкопенией приводило к увеличению количества лейкоцитов. Более того, они не показали увеличения доли захваченных лейкоцитов в селезенке.
Подавление костного мозга
Вирусный гепатит B или C, чрезмерное употребление алкоголя и лекарств обычно связаны с циррозом печени и повышенным риском панцитопении из-за подавления костного мозга в результате гипоплазии костного мозга. Интерферон, азатиоприн и микофенолят мофетил являются примерами лекарств, которые могут вызывать панцитопению у пациентов с циррозом печени.
Другие факторы
Многие другие факторы способствуют развитию патологических HIs при циррозе. Пациенты с портальной гипертензией могут иметь острое или хроническое кровотечение из портальной гипертонической гастропатии и / или энтеропатии, что приводит к анемии и тромбоцитопении. Пациенты с продолжающимся употреблением алкоголя могут иметь гемолиз, который усугубляет анемию. Низкая степень диссеминированного внутрисосудистого свертывания может способствовать возникновению тромбоцитопении у пациентов с декомпенсированным циррозом печени.
Гетерогенные исследования пациентов с различными стадиями цирроза показали распространенность аномальных HI в диапазоне от 6% до 77%. Многие из этих исследований, однако, состоят из пациентов с различной степенью тяжести цирроза печени с декомпенсацией или без нее. В недавнем анализе гомогенных пациентов с компенсированным циррозом А / В класса Чайлд-Пью было обнаружено, что 84% имеют аномалии в HI, определяемые как количество тромбоцитов, меньшее или равное 150 × 10 9 / л, количество лейкоцитов в крови меньше или равно 400 × 10 9 / л или уровень гемоглобина меньше или равен 135 г / л для мужчин и 115 г / л для женщин. 32% этих пациентов имели комбинацию цитопений . Тромбоцитопения была наиболее распространенной единственной аномалией, а тромбоцитопения и лейкопения были наиболее распространенной сочетанной аномалией.
Оценка истинного возникновения аномальных HI при циррозе ограничена дизайном поперечных сечений большинства исследований, сообщающих эти результаты. Недавно когорта из 34 пациентов с компенсированным циррозом А / В класса Чайлд-Пью с нормальным исходным HI прослеживалась продольно в течение приблизительно пяти лет, чтобы определить последовательность аномальных HI при циррозе Тромбоцитопения была самой распространенной и самой ранней аномалией развития HI, за которой последовательно следовали анемия и тромбоцитопения.
Клиническое значение
Возникновение тромбоцитопении, лейкопении или анемии у пациентов с циррозом может иметь значительные клинические последствия. Они могут быть ограничивающим фактором при рассмотрении инвазивных процедур, таких как биопсия печени, парацентез или стоматологические, эндоскопические или хирургические процедуры. Лейкопения может также увеличить риск заражения. Хроническая анемия может способствовать ухудшению исхода после любого геморрагического эпизода.
Исследование , оценивающее риск смерти или трансплантации среди 213 пациентов с компенсированным циррозом А / В по шкале Чайлд-Пью, показало, что как тромбоцитопения, так и лейкопения были в значительной степени связаны с повышенным риском заболеваемости и смертности, даже при учете таких факторов, как Балл по шкале Чайлда-Пью, портальная гипертензия, определяемая HVPG или употреблением алкоголя.
Наибольший риск имел место у пациентов с тромбоцитопенией и лейкопенией. Распространенность аномальных HI различалась у пациентов с клинически значимой портальной гипертензией (HVPG 10 мм рт. ст. И выше) по сравнению с клинически незначимой портальной гипертензией (HVPG менее 10 мм рт. ст.)
Предполагается, что тромбоцитопения является неинвазивным маркером наличия варикозного расширения вен пищевода. Во многих исследованиях сообщается о широком диапазоне пороговых значений количества тромбоцитов, которые побуждают обследовать пациентов с использованием верхней эндоскопии для выявления варикозно расширенных вен пищевода. Интерпретация этих исследований была ограничена их поперечным характером и различной степенью тяжести цирроза среди включенных субъектов. Недавно одна группа исследователей решила эту проблему, проанализировав пациентов, включенных в проспективное рандомизированное контролируемое исследование в которых пациенты наблюдались в среднем 54,9 месяцев. Поперечная оценка не обнаружила порога количества тромбоцитов, который был бы клинически полезен для указания наличия варикозно-расширенных вен желудка и пищевода. Удивительно, но у 14% пациентов с большим варикозом или варикозным кровоизлиянием было нормальное количество тромбоцитов . Продольная оценка количества тромбоцитов не дала лучшего результата и оказалась недостаточной для прогнозирования возникновения гастроэзофагеальных варикозов при компенсированном циррозе. Таким образом, можно сделать вывод, что использование количества тромбоцитов недостаточно для выявления наличия или возникновения варикозно-расширенных вен желудка при циррозе.
Лечение
Лечение аномальных HI при циррозе печени предполагает многогранный подход. Профилактика кровотечений с желудочно-кишечной профилактикой с использованием ингибиторов протонной помпы и переливание тромбоцитов перед процедурами может снизить риск обострения основных нарушений HI. Консультирование пациентов по снижению потребления алкоголя может предотвратить дальнейшее обострение аномалий HI. Однако в настоящее время снижение портального давления и использование гематопоэтических факторов роста являются наиболее часто используемыми методами лечения.
Бета – блокаторы
Если аномалии в HI, по крайней мере, частично связаны с портальной гипертензией, то можно ожидать, что снижение портального давления, связанное с лечением неселективными бета-блокаторами, покажет улучшение аномального HI. Preneta et.al (1998) сообщили, что у пациентов с циррозом и варикозным расширением вен пищевода, получавших пропранолол, наблюдалось увеличение количества тромбоцитов на 37% по сравнению с контролем на 3,8%. Это было связано с большим снижением HVPG после терапии пропранололом (пропранолол 10,7% против плацебо 6,7%). Однако у пациентов, достигших значительного снижения HVPG (то есть более 20%), наблюдалось парадоксальное снижение, а не ожидаемое увеличение количества тромбоцитов. Другие авторы лечили 19 пациентов пропранололом или плацебо в течение одной недели. Используя ультразвуковую допплерографию для измерения гемодинамики селезеночной артерии, они обнаружили, что пропранолол улучшает пульсирующую селезеночную артерию и увеличивает количество тромбоцитов на 16 × 10 9 / л по сравнению с отсутствием эффекта при использовании плацебо.
Эти данные предполагают, что эффект бета-блокаторов в улучшении количества тромбоцитов является переменным и может быть связан с факторами, отличными от декомпрессии портальной гипертензии.
Тромбопоэтин
Недавно было опубликовано важное исследование с использованием агониста рецептора тромбопоэтина Eltrombopag . У 74 пациентов с циррозом печени, у которых количество тромбоцитов составляло от 20 × 10 9 / л до 70 × 10 9 / л, лечение элтромбопагом или плацебо проводилось в течение четырех недель. Количество тромбоцитов было увеличено до более чем 100 × 10 9/ Л у 75% до 95% пациентов, получавших элтромбопаг, по сравнению с отсутствием увеличения у пациентов, получавших плацебо. Определенные проблемы, однако, остаются. Во-первых, влияние eltrombopag на свертываемость крови или риск злокачественности остается неизвестным. Во-вторых, поскольку портальная гипертензия, по-видимому, влияет на тромбопоэтин, она также может влиять на влияние элтромбопага на количество тромбоцитов. Наконец, гемостатический эффект от увеличения числа тромбоцитов в результате лечения элтромбопагом при циррозе также неизвестен.
Эритропоэтин
Пациенты с циррозом вируса гепатита С, которые получают противовирусную терапию интерфероном и рибавирином, имеют более высокий риск развития анемии. Эти пациенты успешно прошли лечение препаратами эритропоэтина с заметным улучшением уровня гемоглобина. Преимущество лечения пациентов с циррозом печени в условиях, отличных от противовирусной терапии, неизвестно. Исследования, изучающие эффект предотвращения анемии при циррозе, отсутствуют.
Колоний- стимулирующие факторы
GM-CSF безопасно использовался у пациентов с циррозом и лейкопенией, с улучшением показателей WBC. Однако неизвестно, связано ли это увеличение количества лейкоцитов со сниженным риском заражения или нет.
Причины лейкопении при циррозе:
Портальная гипертензия, вызванная селезеночной и селезеночной секвестрацией
Изменения в гранулоцитарколониестимулирующем факторе и гранулоцитарном макрофаге-колониестимулирующем факторе
Подавление костного мозга опосредовано токсинами (например, алкоголь, гепатит В и С)
Причины аномальных гематологических показателей при циррозе
Портальная гипертензия, вызванная секвестрацией селезенки
Изменения в эритропоэтине
Подавление костного мозга опосредовано токсинами (например, алкоголь, гепатит В и С)
Основная функция печени состоит в фильтрации и очищении крови от шлаков, токсинов, а также побочных продуктов метаболизма. По данным ВОЗ, этот орган поражен почти у трети населения Земли. Его заболевания могут протекать остро или в хронической форме, различаться по степени тяжести.
Раннее выявление болезней печени повышает шансы на выздоровление, поэтому крайне важно вовремя их диагностировать.
Гепатит
Этим термином обозначается воспалительный процесс в печени. Его вызывают:
- вирусы;
- токсическое воздействие алкоголя, лекарств;
- специфические причины — паразиты, бактерии туберкулеза;
- аутоиммунная реакция — организм воспринимает собственные клетки как чужеродные и атакует их.
Проявления гепатита зависят от формы заболевания. К основным симптомам относят тяжесть, боли в правом подреберье, тошноту, рвоту, пожелтение кожных покровов, обесцвечивание кала, потемнение мочи, кожный зуд.
Вид гепатита, тяжесть течения и степень поражения печени диагностируются с помощью лабораторных и инструментальных исследований:
- анализа крови на определение вирусных частиц и антител к ним;
- УЗИ печени;
- КТ, МРТ печени;
- общего анализа мочи;
- биохимического анализа крови;
- общего анализа крови.
Лечение патологии зависит от ее причины:
- вирусные заболевания предполагают курс противовирусной терапии;
- паразиты — прием соответствующих средств, в первую очередь антигельминтных;
- интоксикация — очищение крови, внутривенное введение растворов поддерживающих, питающих препаратов.
Значимую роль в лечении заболеваний печени играет диета. Принципы питания при гепатите:
- Исключить крепкие чай, кофе. В рационе не должно быть шоколада, сладкой выпечки, грибов, бобовых, колбас, жирного мяса, жареных яиц. Не рекомендуется есть очень кислые и соленые продукты.
- Полезны хорошо проваренные каши, супы (особенно пюре), травяные чаи, ягодные компоты, маложирная молочная продукция, паровые омлеты, нежирные рыба и мясо, отрубной хлеб, сухофрукты, печеные яблоки.
- Порции должны соответствовать потребностям организма — переедание недопустимо. Оптимальным считается 4–5-разовый прием пищи в день, но малыми объемами.
В нашей клинике можно сдать анализы для выявления разных видов гепатита, получить подробную консультацию по расшифровке результатов и дальнейшие рекомендации по медикаментозному лечению и питанию.
Цирроз печени
Необратимые изменения в печени называют циррозом. Орган утрачивает возможность функционировать, процесс сопровождается нарушениями в пищеварительной системе, отеками, интоксикацией. Чаще всего цирроз наблюдается как исход хронического гепатита С и злоупотребления алкоголем.
Заболевание диагностируется с помощью биохимического и общего анализа крови, общего анализа мочи, УЗИ, КТ или МРТ органа. Цирроз опасен перерождением в рак, поэтому в сомнительных случаях проводится биопсия — забор и исследование частей ткани печени. К осложнениям заболевания относятся кровотечения, перитонит, кома, тромбоз.
Лечение основывается на диете, уменьшении нагрузок. Медикаментозная терапия направлена на поддержание работы органа, снижение интоксикации.
Как питаться при циррозе — рекомендации гепатологов:
- Старайтесь отдавать предпочтение растительным источникам белка (брокколи, фасоль, крупы, нут, авокадо, курага, чечевица, некоторые овощи). Также полезны нежирные кисломолочные продукты и красное мясо в небольшом количестве.
- Выбирайте цельнозерновой хлеб. Он уменьшает вероятность развития рака печени, улучшает пищеварение.
- Алкоголь следует исключить. Также вредны колбасы и сосиски (они содержат трансжиры, соль, пищевые добавки, негативно влияющие на работу печени). Не стоит употреблять консервы, фастфуд, маргарин, копчености.
- Оптимальный режим питания — от 6 до 8 раз в день маленькими порциями. Пищу лучше варить или тушить; овощи и фрукты по возможности есть в свежем виде.
Для выявления цирроза, составления подробного меню, получения рекомендаций по обследованию и лечению рекомендуем вам обратиться в нашу клинику.
Читайте также:

