Асцит при циррозе печени и вирусном гепатите
Обновлено: 25.04.2024
В настоящее время выделен вирус гепатита G, который подобно вирусу С дает хронизацию процесса в печени, а исходом хронического вирусного гепатита G может быть цирроз печени. В редких случаях постгепатитный цирроз развивается непосредственно после острого вирусного гепатита, минуя стадию хронического гепатита. Цирроз печени диагностируют в интервале от 3 до 28 лет после перенесенного острого вирусного гепатита, часто через 10-20 лет. При сохранении гистоморфологических признаков активного хронического гепатита на фоне цирротической перестройки ткани печени устанавливают диагноз активного цирроза печени. У 2/3 больных развивается макронодулярный цирроз печени. Для вирусной этиологии цирроза печени характерно длительное, на протяжении ряда лет, латентное течение. Патологический процесс персистирует без выраженной активности, часто обострения самостоятельно купируются. Спленомегалия и диспротеинемия (гипергаммаглобулинемия) выражены в большей степени, а гипераминотрансфераземия - умеренно по сравнению с активным хроническим гепатитом. Исключения составляют случаи фульминантного обострения цирроза печени в начальных стадиях, когда заболевание манифестирует тяжелой печеночно-клеточной желтухой, часто с холестазом, резко выраженным повышением активности аминотрансфераз и часто резистентно к глюкокортикоидам.
Неблагоприятным, но сравнительно редким вариантом течения является циррозом печени с высокой мезенхимально-воспалительной активностью в терминальном периоде на стадии паренхиматозной и/или сосудистой декомпенсации.
У большинства больных начало заболевания постепенное, появляются неспецифические жалобы на общую слабость, снижение работоспособности, боли в правом подреберье, тошноту, метеоризм, потерю в массе тела. Эти нарушения нарастают в периоды обострения одновременно с увеличением активности аминотрансфераз крови и развитием умеренной желтухи. При обострении возможны усиление геморрагического синдрома в виде кровоточивости, артралгии, увеличение количества кожных телеангиэктазий. На неблагоприятное течение заболевания указывает резистентная желтуха, значительная диспротеинемия с гипоальбуминемией и гипергаммаглобулинемией, выраженная аминотрансфераземия. Стечением времени у большинства больных отмечается постепенное снижение биохимических показателей, отражающих воспалительную активность с тенденцией к нормализации аминотрансфераземии. При этом появляются признаки гепатоцеллюлярной недостаточности и развивается декомпенсация портальной гипертензии. Варикозное расширение вен пищевода и кардии развивается у больных вирусным циррозом печени чаще и раньше, а асцит позже и реже, чем у больных алкогольным циррозом. Средняя продолжительность жизни с момента установления диагноза - около 10-15 лет, однако нередко больные живут значительно дольше.
О вирусной В-этиологии цирроза печени свидетельствуют положительная реакция крови на HBsAg, HBeAg (у 20% больных) и анти-НВс IgM, анти-НВе и анти- НВс, выявление в биопсированной ткани печени методом иммунофлюоресценции очаговых скоплений гепатоцитов, содержащих HBcAg в ядрах и HBsAg в цитоплазме, наличие ступенчатых и мостовидных некрозов с воспалительной инфильтрацией в периферических отделах псевдодолек и отсутствие выраженной жировой дистрофии гепатоцитов, свойственной алкогольным циррозам. Отсутствие серологических и тканевых маркеров вируса В отнюдь не исключает вирусной природы цирроза печени. Цирроз печени вследствие острого вирусного гепатита С (серонегативный) по аналогии с острым вирусным гепатитом С и активном хроническим гепатитом С можно заподозрить при исключении других этиологических факторов, особенно у больных с медленной эволюцией и умеренной активностью патологического процесса, переходящего на протяжении нескольких лет в неактивную стадию. В отличие от цирроза типа В при этой форме нет преобладания мужчин, число лиц мужского и женского пола примерно одинаково. При этом в крови серологически определяется специфическая HCV - РНК и антитела к ней.
При вирусном циррозе повышение активности АлАТ, гипергаммаглобулинемия и подъем показателя тимоловой пробы выражены в большей степени, а активность ГГТП повышена значительно реже и меньше, чем при алкогольном, осадочные пробы положительны у 80% больных, в сыворотке крови умеренно повышена концентрация IgG, а при алкогольном циррозе повышается преимущественно IgA.
Традиционные современные принципы лечения цирроза печени вирусной этиологии включают:
интерферонизацию (альфа 2 -интерферон, предпочтительно интрон или лаферон в сочетании с ламивудином (зеффикс) при В и рибавирином (ребетол) при С-вирусной инфекции, и иммуномодуляцию (тималин, Т-активин, тимоген, вилозен, нуклеинат натрия по схеме: 1 раз в день 3 дня подряд, затем 1 раз в нед. 2 раза, всего 5 инъекций на курс);
лактулозу (дюфалак) из расчета 1-1,5 г на 1 кг массы тела больного в течение 15-30 дней с переходом на поддерживающие дозы, уменьшенные в 2-3 раза;
силимаринсодержащие (симепар - силимарин в сочетании с витаминами группы В), легалон, карсил, силибор в увеличенной в 3 раза терапевтической дозе, гепабене (силимарин и фумария) по 2 капе. 3 раза вдень, 1-2 мес;
мочегонные: антагонисты альдостерона - спиронолактоны в сочетании с тиазидными производными (по индивидуальной схеме);
препараты, влияющие надетоксическую функцию печени: цитраргинин, орницетил (доза индивидуальная и зависит от тяжести течения заболевания).
Существует мнение, что при циррозе печени редко имеет место репликация вируса, потому малые дозы а 2 -интерферона (по 1 млн ME 15-30 дней) назначают не с целью подавления репликации, а для восстановления иммунного статуса пациента
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
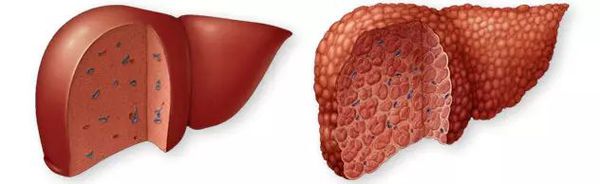
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
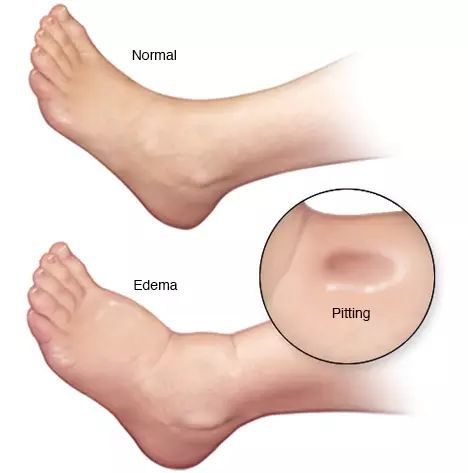
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
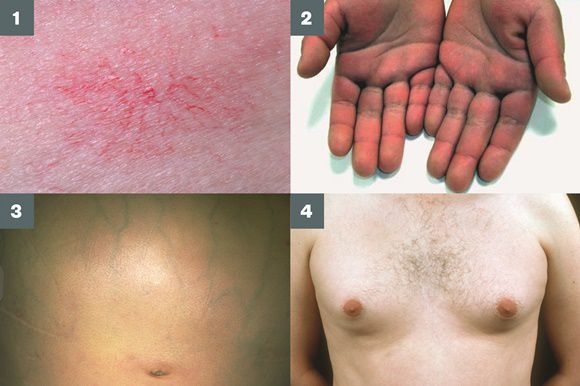
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Асцит - накопление жидкости в брюшной полости. Наиболее часто синдром встречается при циррозе печени. Слово "асцит" образовалось от греческого ascos,что означает "мешок" или "сумка". Асцит известен врачам со времен Гиппократа. Единственным способом терапии асцита вплоть до XX в. был парацентез.
Что провоцирует / Причины Отечно-асцитического синдрома:
Асцит может возникнуть неожиданно или развиваться медленно, в течение нескольких недель или месяцев. Внезапное возникновение асцита характерно для проявления печеночно-клеточной недостаточности на фоне геморрагического синдрома, шока, интоксикации и др. Постепенное развитие асцита обусловлено наличием длительно текущего, далеко зашедшего патологического процесса, часто При отсутствии определенного причинного фактора. При асците наблюдается увеличение в объеме живота, появление метеоризма, одышки. При большом количестве асцитической жидкости (15-20 л) появляются дополнительные симптомы: пупочные и паховые грыжи, геморроидальных вен, смещение диафрагмы вверх, верхушечного толчка - вверх и влево, повышение давления в яремной вене, набухание шейных вен. У таких больных могут определяться диафрагмальная грыжа, желудочно-пищеводный рефлюкс.
В 6-7 % случаев у больных циррозом печени развивается правосторонний гидроторакс.
Патогенез (что происходит?) во время Отечно-асцитического синдрома:
Патогенез асцита у больных циррозом печени является многофакторным. Портальная гипертензия и связанный с ней застой в системе воротной вены являются пусковыми факторами развития асцита. Кроме того, развитию асцита способствует каскад нейрогормональных, гемодинамических и вводно-электролитных сдвигов. В настоящее время патогенез асцита рассматривается как индивидуальное сочетание многочисленных патогенетических факторов прогрессирования основного патологического процесса, которые условно разделены на местные (регионарные) и общие (системные).
К местным регионарным факторам относятся повышение печеночного сосудистого сопротивления вследствие взаимодействия комплекса органических и функциональных нарушений. По преимущественной локализации поражения при ХЗП можно выделить преси-нусоидальный, синусоидальный и постсинусоидальный уровни блока. В зависимости от обратимости изменений выделяют необратимые, или органические, поражения и потенциально обратимые, или функциональные, изменения.
Внутрипеченочный блок оттока приводит к усиленному лимфообразованию. При этом лимфа может просачиваться через лимфатические сосуды глиссоновой капсулы прямо в брюшную полость или поступать в области ворот печени в грудной лимфатический проток. В результате развивающегося лимфатического застоя происходит пропотевание жидкости в брюшную полость.
Одним из важных моментов патогенеза асцита является накопление у больных в циркулирующей крови нерасщепленных эндогенных вазодилататоров (глюкагон и др.), способствующих расширению мелких периферических артерий, а также открытию артериовенозных шунтов в органах и тканях, что помогает снижению кровенаполнения артерий, увеличению сердечного выброса, гиперволемии, повышению скорости портального кровотока и портальной гипертензии. Кроме того, следует помнить, что накопление асцитической жидкости сопровождается снижением эффективного кровотока в результате депонирования значительной части объема плазмы в сосудах брюшной полости. Эффект вазодилататоров повышается на фоне недостатка синтеза оксида азота, что способствует усилению вазоконстрикции в синусоидах и мелких разветвлениях воротной вены. Аналогичным образом действует значительная гиперпродукция эндотелинов набухшими эндотелиоцитами.
Установлено, что асцит в первую очередь формируется внутрипеченочно, внутри печеночных синусоидов. Стенки эндотелиальной выстилки синусоидов имеют относительно большие поры-финестры, необходимые для обеспечения легкого доступа плазмы к гепатоцитам в пространстве Диссе. В перипортальной области имеются выстланные эндотелием, слепо начинающиеся лимфатические капилляры, благодаря чему жидкость из пространства Диссе может попасть в лимфатические капилляры, проходя эндотелиальную стенку. При формировании блока оттока из печени возникает синусоидальная гипертензия. В соответствии с законом Старлинга, повышение синусоидального давления является фактором, усиливающим проникновение элементов плазмы через стенку синусоида в перисинусоидальное пространство Диссе, а затем в лимфатические сосуды, которые компенсируют синусоидальную гипертензию за счет возрастания оттока лимфы из печени.
К системным факторам, способствующим формированию ПГ, можно отнести гипоальбуминемию, активизацию симпатической нервной системы, повышение секреции компонентов ренин-ангиотензиналь-достероновой системы, антидиуретического гормона, предсердного натрийуретического пептида, снижение продукции простагландинов.
Наряду с вышеуказанными изменениями важную роль в формировании асцита играет гиперальдостеронизм, природа которого довольно сложна и включает в себя следующие механизмы:
- активизация РААС, приводящая к увеличению уровня альдостерона;
- развитие вторичного гиперальдостеронизма;
- повышение чувствительности канальцев почек к действию альдостерона.
Известно, что концентрация альбумина в сыворотке крови является ведущим фактором, определяющим онкотическое давление. По мере прогрессирования патологического процесса, проявляющегося на морфологическом уровне дистрофически-некротическими процессами в паренхиме и синусоидах, нарушается синтез альбуминов и, как следствие, изменяется проницаемость синусоидального эндотелия. При этом значение гипоальбуминемии и сопутствующих ей изменений онкотических градиентов возрастает.
У большинства больных хроническими гепатитами на цирротической стадии выявлены признаки активации симпатической нервной системы. Повышение уровня катехоламинов в сыворотке крови обнаружено у 60 % пациентов Считается, что снижение эффективного внутрисосудистого объема и гипоальбуминемия способствуют повышению секреции катехоламинов в целях поддержания важнейших го меостатических показателей.
Секреция ренина в почках является одной из важнейших компенсаторных реакций в условиях гиповолемии. Выброс ренина происходит вследствие как гиповолемии, так и гипонатриемии. Ренин вызывает увеличение синтеза ангиотензина, являющегося мощным вазоконстриктором, и стимулирует секрецию альдостерона. Увеличение уровня альдостерона приводит к повышению реабсорбции натрия и воды в почках
Снижение внутрисосудистого объема - сигнал к синтезу антидиуретического гормона опосредованно через волюморецепторы, предположительно расположенные в предсердиях. Физиологическим эффектом антидиуретического гормона является повышение объема циркулирующей плазмы.
Большинство авторов сообщает о повышении уровня предсердного натрийуретического пептида при циррозе печени с асцитом. По-видимому, повышение концентрации натрийуретического пептида и увеличение задержки натрия при циррозе могут объясняться снижением чувствительности почек к данному гормону
Одним из возможных участников патогенеза асцита рассматривается простагландин Ег, синтезирующийся, в частности, в почках и обладающий вазодилататорным действием. Считается, что степень задержки натрия может быть вызвана снижением продукции этого вазодилататора. При этом простагландины оказываются патогенетически связующим звеном между изменениями гемодинамики на локальном уровне и системными гуморальными реакциями.
Следовательно, в развитии асцита при заболеваниях печени важную роль играют гемодинамические и метаболические факторы, проявляющиеся на фоне морфологической перестройки печени Появление асцита обусловлено выраженной задержкой натрия. Суточная экскреция натрия с мочой при асците не превышает 5 ммоль.
Согласно теории "недостаточного наполнения сосудистого русла", задержка натрия и воды почками вторична и обусловлена расширением сосудистого русла внутренних органов. Причиной указанных явлений считается активизация ренин-ангиотензин-альдостероновой системы, симпатической нервной системы, простагландина Ег, способствующая изменению функции почек. При этом натрийуретическому фактору отводится второстепенная роль.
Теория "избыточного наполнения сосудистого русла" предусматривает первичную задержку натрия с дальнейшим увеличением объема циркулирующей плазмы и переходом жидкости в межклеточное пространство.
Важная роль отводится активному переносу жидкости через мембрану капилляров брюшины. Кроме того, формированию асцита способствуют повышение давления внутри синусоидов, что наблюдается ПРИ циррозе, усиленное образование лимфы при обструкции синусоидов, печеночных вен.
Диагностика Отечно-асцитического синдрома:
Большое скопление жидкости в брюшной полости можно обнаружить обычными клиническими методами. При перкуссии выявляется притупление звука в боковых отделах живота. Перемещение больных на левый или правый бок вызывает смещение тупости к соответствующему фланку. При наличии осумкованной жидкости в брюшной полости, при слипчивом перитоните туберкулезной этиологии, кисте яичника перемена положения пациента тимпанит не изменяет. Асцитическую жидкость объемом менее 1,5 л определить клиническими методами не удаегся. В подобных случаях асцит можно определить с помощью УЗИ. Минимальное количество асцитической жидкости, определяемое указанным методом, составляет 200 мл. УЗИ в ряде случаев позволяет выявить заболевание, явившееся причиной развития асцита (цирроз печени, новообразование органов брюшной полости, панкреатит и др.). После клинического обнаружения асцига в неясных случаях показано проведение диагностического парацентеза с биохимическим и цитологическим исследованиями полученной жидкости. При парацентезе с помощью тонкой иглы получают 50-250 мл асцитической жидкости.
Показаниями для проведения диагностического парацентеза являются;
- впервые выявленный асцит,
- подозрение на злокачественную опухоль,
- исключение спонтанного бактериального перитонита.
В асцитической жидкости определяют уровень общего белка, альбумина, глюкозы, холестерина, триглицеридов, билирубина, активности амилазы, производят подсчет количества лейкоцитов, эритроцитов, атипических клеток, окраску бактерий по Граму, посев жидкости на микрофлору с определением чувствительности к антибиотикам В. A Runyon предлагает определять в асцитической жидкости сывороточно-асцитический альбуминовый градиент (СААГ).
СААГ = (альбумин сыворотки) - (альбумин асцитической жидкости), СААГ 1,1 может свидетельствовать о том, что причиной асцита является портальная гипертензия, обусловленная циррозом печени.
Лечение Отечно-асцитического синдрома:
Лечение отечно-асцитического синдрома при циррозе печени. При лечении асцита необходимо установить этиологию цирроза печени, выявить факторы, лежащие в основе его декомпенсации Выделяют базисную и диуретическую терапию.
Мероприятия, проводимые в рамках базисной терапии, включают постельный режим, уменьшение потребления поваренной соли, ограничение приема жидкости, соблюдение диеты. Для поддержания натриевого баланса целесообразно ограничить поступление хлористого натрия до 500 мг в сутки Проведение диуретической терапии предусматривает ежедневный контроль ряда параметров.
Все блюда готовят без добавления соли Целесообразно дополнить рацион белковой пищей с низким содержанием натрия. Энергетическая ценность диеты, содержащей 70 г белка (22 ммоль натрия в сутки - 500 мг NaCl), составляет 1500-2000 ккал/сут. Больным необходимо ограничивать прием жидкости до 750-1000 мг в сутки. Назначение постельного режима основано на том, что горизонтальное положение влияет на выработку ренина, ангиотензина и тонус симпатической нервной системы Вертикальное положение ведет к стимуляции симпатической нервной системы, уменьшению гломерулярной фильтрации, увеличению абсорбции натрия в канальцах. Начальный клинический эффект общих мероприятий оценивается после 4-го дня лечения.
Терапия диуретиками проводится по ступенчатому принципу. Прием диуретиков можно осуществлять при отсутствии тяжелых электролитных сдвигов и нарушений функции почек. Диуретики подавляют факторы, вызывающие задержку натрия, и повышают экскрецию натрия и воды. В лечении больных асцитом чаще используют две группы диуретиков. В первую группу входят петлевые диуретики* фуросемид, буметанид, этакриновая кислота. Ко второй группе относятся спиронолактон, триамтерен, амилорид
Больной с асцитом и отеками на фоне эффективной терапии должен терять не более 1 кг массы тела, при наличии асцита без отеков - не более 500 г в сутки. Монотерапия фуросемидом больных циррозом печени и асцитом нецелесообразна ввиду выраженных электролитных изменений Переход к следующей, более высокой ступени показан при потере массы тела больного на фоне лечения менее 1,5 кг за 4 дня терапии.
Тактика при длительном лечении больных циррозом печени с асцитом.После ликвидации асцита возникает вопрос о длительном лечении указанной категории лиц. Больные должны придерживаться рекомендованной бессолевой диеты, проводить регулярный контроль за количеством выпитой жидкости и выделенной мочи, измерять массу тела. Доза диуретического препарата зависит от тяжести и стадии заболевания. При этом чаще используются 100-200 мг/сут спиронолактона и через день 40-80 мг/сут фуросемида в сочетании с препаратами калия. Один раз в месяц нужно исследовать содержание электролитов, азота, мочевины, проводить функциональные пробы печени, определять содержание белка в крови.
Рефрактерный (ригидный) асцит. Термин "рефрактерный к лечению асцит" используется в том случае, когда при терапии, проводимой по всем правилам, масса тела не снижается. Если диуретическая терапия, проводимая, как минимум, в течение 4 нед, оказывается неэффективной и исключаются все причины, способные вызывать мнимую рефрактерность к лечению, можно думать о рефрактерном асците.
Причинами данного синдрома чаще являютсядалеко зашедший патологический процесс в печени, большие поступления натрия в организм (с пищей, лекарственными препаратами), отсутствие ограничения приема жидкости, нарушение функции почек, не связанное с заболеванием печени, происхождение асцита (злокачественные новообразования, воспаление асцитической жидкости) и др.
Эффективным методом лечения рефрактерного асцита является парацентез, при проведении которого удаляется 5-10 л жидкости на фоне введения бессолевого альбумина: по 6 г на 1 л удаляемой жидкости. В качестве симптоматической терапии таким больным показаны методы экстракорпоральной гемокоррекции: ультрафильтрация и реинфузия асцитической жидкости, перитонеовенозное шунтирование, имплантация TIPS, трансплантация печени.
К каким докторам следует обращаться если у Вас Отечно-асцитический синдром:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Отечно-асцитического синдрома, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .

Цирроз печени — это тяжёлое заболевание печени, при котором паренхиматозная ткань необратимо замещается фиброзной соединительной тканью. Размеры печени, пораженной циррозом, увеличиваются или уменьшаются, она становится необычно плотной, бугристой, шероховатой.
Из-за того, что под воздействием разных разрушающих факторов гибнут клетки печени, ее нормальная ткань начинает замещаться фиброзной, при этом формируются узлы и перестраивается вся структура печени. Если же нарушается структура печени, то от этого нарушаются все ее функции, и у больного развивается печёночная недостаточность.
Наиболее часто цирроз возникает после долгой интоксикации спиртным и на основе вирусных гепатитов. Цирроз может также развиваться из-за заболеваний желчевыводящих путей. Он иногда наблюдается у людей, страдающих сердечной недостаточностью. Цирроз также может быть последствием различных химических и лекарственных интоксикаций. Им заболевают люди с нарушениями метаболизма.
Существует несколько видов этого заболевания:
- Алкогольный цирроз наблюдается у человека, который страдает алкогольной зависимостью, то есть уже долгое время регулярно употребляет спиртное в недопустимом количестве. В большинстве случаев вследствие алкоголизма у человека развивается алкогольный гепатит, нарушающий функции печени, а это служит благоприятной основой для развития цирроза. Если человек перестанет употреблять алкоголь, то состояние его организма немного улучшится.
- Другая форма этой болезни первичный билиарный цирроз печени, который является хроническим заболеванием. При таком заболевании разрушаются внутрипеченочные желчные протоки из-за того, что в них возникает воспалительный процесс. По причине таких патологических изменений начинает застаиваться желчь и значительно нарушается деятельность печени, то есть развивается печёночная недостаточность.
- Нередко встречается аутоиммунный цирроз. Им чаще всего заболевают женщины в начале или в конце детородного возраста. Судя по названию, печень перестает нормально функционировать из-за того, что не правильно работает иммунная система. При такой форме цирроза иммунная система пораженного пациента начинает бороться с собственными клетками печени. Происходит это потому, что иммунная система воспринимает эти клетки как инородные тела.
Диагностировать цирроз на начальном этапе возникновения крайне трудно. Болезнь имеет очень медленное и тихое течение. Яркие симптомы, свидетельствующие о заболевании начинают проявляться лишь на последнем этапе болезни. Симптомы характеризуются постоянной усталостью и сонливостью. Они сопровождают больного все время, если даже он недавно проснулся. Человек также теряет аппетит, он начинает плохо есть, вследствие чего теряет вес. У него начинает краснеть кожа на ладонях. Происходит это потому, что в данной области приливает большое количество крови.
При циррозе печени на коже человека появляются сосудистые звездочки. Они бледнеют, если несильно надавить на них пальцем. Но как только пальцы убираются, они опять краснеют от притока крови.
Исходы цирроза печени

Трудно сказать, что ожидает человека, которому был поставлен такой диагноз. Во многом исход болезни зависит от того, почему она возникла. Имеет также значение в каком возрасте больной, на каком этапе находится болезнь.
Цирроз – это пожизненная болезнь. Чтобы избавиться от нее нужно пересадить печень. А сделать такую операцию сможет далеко не каждый. Болезнь сама не излечима, но можно замедлить процесс ее развития. Для этого больной должен выполнять все предписания, указанные врачом, тем самым поддерживая функционирование печени.
Чтобы поставить конечный диагноз, а значит, и исход болезни лечащий врач пользуется специальной таблицей, в которой он принимает во внимание есть ли осложнения заболевания и на каком уровне развития они находятся. Отсюда следует, что исход болезни зависит от того, на какой стадии у больного ее обнаружили. И понятно, чем раньше была диагностирована болезнь, тем легче будет бороться с ней. Лечение помогает болезни оставаться на своем начальном этапе. Это позволит человеку вести свою обычную жизнь, которая была у него до страшного диагноза.
Как можно продлить жизнь больного циррозом
Если человеку поставили диагноз – цирроз печени, то единственным спасением для него будет изменение своих привычек. Более того он обязан изменить весь образ жизни. Во-первых, он должен прекратить употреблять алкогольные напитки. Если раньше человек курил сигареты, то теперь он должен перестать это делать. Для увеличения продолжительности жизни, он должен придерживаться строгой диеты и соблюдать определенный распорядок дня. Он не должен употреблять в пищу какую бы то ни было выпечку, даже обыкновенный хлеб. Он должен сторониться всяких копченостей, солений, консервированных продуктов, и конечно же всю еду он должен употреблять без добавления соли и не есть ничего жареного. Молоко можно пить не больше 200 мл в день. А вот фрукты и овощи можно употреблять и свежими, и приготовленными на пару.

Человек должен внимательно наблюдать не появились ли у него сосудистые звездочки на кожном покрове и не покраснели ли у него ладони. Если он увидит какой-то из признаков, то это должно послужить тревожным сигналом. В таком случае нужно не откладывая обратиться к врачу. Ведь проблемы с кожей могут говорить о том, что состояние ухудшается, что может даже закончиться смертельным исходом, если в нужное время не принять соответствующих мер.
Если больной будет придерживаться всех этих действий, то его организм очистит клетки печени от вредных веществ, а это поможет запустить обновление поврежденных тканей этого важного органа.
При такой болезни очень помогает повышение активности иммунной системы при помощи цинка. Это поможет очищению организма от болезнетворных микробов. После очищения, как правило, назначается обязательное общее восстанавливающее лечение.
Асцит, как осложнение цирроза
Очень часто циррозу сопутствуют такие заболевания, которые представляют собой не меньшую опасность для жизни. Одним из таких заболевания является асцит или брюшная водянка. При такой болезни наблюдается переизбыток жидкости в брюшной полости. Она начинает сильно давить на органы, и по этой причине оттесняется диафрагма, а это приводит к нарушению нормальной сердечной деятельности. Брюшная водянка опасна тем, что нельзя абсолютно предсказать, когда она появится. Часто болезнь диагностируется только тогда, когда жидкость в организме накапливается в таком количестве, что живот выпячивается и это становится видно невооруженным глазом.
Асцит появляется и при заболеваниях органов пищеварения, но если причиной стал цирроз, то болезнь может активироваться буквально за миг, и уже через некоторое время брюшная полость будет наполнена жидкостью. Если человек болен асцитом, то на жизнь ему отпускается три года. Если же больной будет следить за собой, и будет лечиться, то это продлит ему жизнь еще на пять лет. До сих пор ученым не понятно, как начинает развиваться болезнь на определенном этапе цирроза.
Геморрагия при циррозе

Когда у больного циррозом заболевание начинает прогрессировать, то часто у него возникает кровотечение. Кровоточат в основном венозные сосуды и желудочно-кишечная система. Причиной этому может служить то, нарушается процесс свертываемости крови и давление в воротной вене скачкообразно меняется.
При алкогольном или вирусном циррозе таких кровотечений, как правило, не наблюдаются. Но именно это кровотечение становится причиной резкого ухудшения состояния и приводит к смертельному исходу. Встречаются иногда люди, которые живут еще до двух лет, после того как они впервые начали кровоточить, и тогда причиной смерти у них становится что-то другое.
В последнее время стали часто наблюдаться случаи возникновения рака печени по причине цирроза. Цирроз печени сопровождается длительными клиническими ремиссиями, но состояние стабилизируется у редких людей. Если болезнь находится в активной форме, то она не поддается лечению. Болезнь приводит к формированию печёночной недостаточности, а в дальнейшем может привести к смертельному исходу.
Чтобы провести профилактику болезни, люди, которые входят в группу риска, должны избегать всех тех причин, которые могут привести к заболеванию. Помимо этого они должны постараться обнаружить болезнь вовремя. Нужно скорее обратиться к специалисту, который поставит диагноз и назначит соответствующую терапию. Самое опасное заключается в том, что человек начинает медлить с лечением и болезнь, начиная прогрессировать, приводит к серьёзнейшим осложнениям. Если человек находится на начальном этапе болезни, то его трудоспособность оказывается ограниченной. С развитием болезни, когда цирроз становится достаточно сформированным, он её полностью утрачивает.
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов.

Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов. Медленное нарастание фиброза при ХГ С наблюдается у женщин молодого возраста в отсутствие таких факторов, как стеатоз печени, синдром перегрузки железом, злоупотребление алкоголем. Ряд причин обусловливает быстрое формирование ЦП: пожилой возраст при инфицировании, мужской пол, систематическое употребление алкоголя более 50 г/сут, наличие коинфекции вирусов гепатита В и/или ВИЧ, избыточная масса тела (> 28 кг/мІ), гетерогенность по гену гемохроматоза, полиморфизм генов ряда цитокинов, играющих ключевую роль в фиброгенезе. Среднее время развития ЦП у лиц, инфицированных в возрасте после 40 лет и злоупотребляющих алкоголем, составляет 13 лет, а у молодых женщин в отсутствие приема алкоголя ЦП формируется через 42 года. У 32% больных ХГ С протекает стабильно и не сопровождается прогрессированием болезни.
Важным фактором фиброгенеза является сохраняющаяся активность ХГ С по лабораторным данным и морфологическим признакам. У больных со стойко нормальным уровнем трансаминаз сыворотки риск развития ЦП С составляет 5%, в то время как наличие 3–5-кратного повышения АЛТ сыворотки ассоциируется с быстрым формированием ЦП С у 50% больных. Показано также, что факторами риска прогрессирования фиброза являются: наличие фиброза в ткани печени при первой биопсии, стеатоз печени и возраст больных. Быстрота прогрессирования фиброза определяется предшествующим фиброзом, стеатозом и лобулярным гепатитом [1]. При ХГ С низкой степени активности (ИГА по Knodell 4–8 баллов) риску развития ЦП С подвержены 7–10% больных, при ХГ С высокой степени активности (ИГА — более 13 баллов) у 71% больных цирроз может развиться уже через 7 лет. Проспективное изучение 404 больных компенсированным ЦП С показало, что за 85,7±36 мес наблюдения у 28% больных развивается хотя бы одно осложнение ЦП С, в том числе гепатоцеллюлярная карцинома (ГЦК) — у 19%, асцит — у 17%, кровотечение из варикозно расширенных вен пищевода (ВРВП) — у 5%, декомпенсация ЦП С (Чайлд В/С) — у 17%, энцефалопатия — у 2% [2].
Высокая частота развития ЦП С при хронической HCV-инфекции и риск серьезных осложнений в этой группе больных определяют задачи противовирусной терапии (ПВТ). Основная задача лечения — эрадикация вируса гепатита С и достижение стойкой ремиссии ХГ С, однако возможности достижения устойчивого вирусологического ответа (УВО) у больных ЦП С значительно ниже, чем при ХГ С. Исследования последних лет показали, что ПВТ способствует уменьшению выраженности фиброза, поэтому у больных ЦП С без вирусологического ответа целью противовирусного лечения является замедление прогрессирования болезни, снижение риска декомпенсации ЦП и развития его осложнений, в том числе ГЦК, В-клеточной лимфомы, криоглобулинемии, внепеченочных проявлений, портальной гипертензии и печеночно-клеточной недостаточности.
Представляют интерес исследования M. Curry и соавторов (2005), изучивших влияние длительной терапии пегинтерфероном α-2b в малых дозах на динамику портальной гипертензии у больных ХГ С со стадией фиброза F3 и ЦП С (F4). В исследование COPILOT были включены 267 больных, получавших колхицин 0,6 мг 2 раза в день, и 270 больных, которым проводится лечение пегинтроном 0,5 мкг/кг 1 раз в неделю в течение 4 лет. Обе группы были представлены больными, не ответившими на комбинированную терапию интерфероном и рибавирином. 83% больных в каждой группе имели ЦП С, у 40% из них имелись признаки портальной гипертензии, выявленные при эндоскопии (ВРВП или портальная гастропатия). ЭГДС проводилась с интервалом в 2 года. Опубликованы предварительные результаты исследования.
У 5 больных ЦП С, не получавших β-блокаторы с целью коррекции портальной гипертензии, до лечения пегинтроном провели измерение портального давления. Спустя 2 года лечения при повторной ЭГДС новые ВРВП появились у 11 из 66 больных, получавших колхицин, и сохранялись у 5 из 66 больных, получавших монотерапию пегинтроном. У всех 5 больных первоначальное портальное давление составляло 15 мм рт. ст., через 24 нед лечения составило в среднем 6 мм рт. ст. Кровотечение из ВРВП через 2 года отмечено у 11 (9%) больных, получавших колхицин, и у одного (1%) больного, получавшего пегинтрон. Асцит и печеночно-клеточная недостаточность также чаще выявлялись при лечении колхицином (20 больных), чем пегинтроном (13 больных). Таким образом, длительное лечение малыми дозами пегинтрона больных ЦП С может замедлить формирование ВРВП, снизить портальное давление, предотвратить кровотечение из ВРВП и другие осложнения портальной гипертензии у больных ЦП С, не достигших УВО на предшествующую комбинированную терапию интерфероном и рибавирином [3].
В последние годы ПВТ претерпела существенные изменения: с 2000 г. комбинированная терапия пегилированными интерферонами α-2a и 2b и рибавирином заняла ведущие позиции в лечении ХГ С и компенсированного ЦП С. Изучены прогностические факторы ответа на лечение, появились возможности коррекции ряда побочных эффектов ПВТ, что позволило достичь УВО у 56–63% больных ХГ С, включенных в лечение. Приверженность больных к лечению, адекватные дозы препаратов и длительность ПВТ позволяют повысить УВО до 72–75% [4, 5]. Наибольший эффект комбинированной терапии ХГ С отмечается у больных с генотипами 2 или 3 HCV: непродолжительный курс лечения (24 нед) при высокой приверженности к лечению пегилированными ИФН α и рибавирином позволяет достичь успеха в 84–94% случаев.
Несмотря на достижения последних лет, остаются категории трудных для лечения больных ХГ С, к которым относятся пациенты с генотипом 1 HCV и высокой вирусной нагрузкой и больные ЦП С.
Генотип 1 HCV и высокая вирусная нагрузка оказались независимыми прогностическими факторами слабого ответа на лечение. Причины этого до конца не ясны. Изучается значение мутаций в E2 и NS5A генах HCV (неструктурный регион NS5A определяет чувствительность к интерферону). Элиминация гепатоцитов, инфицированных генотипом 1 HCV, в процессе ПВТ происходит медленнее, чем при других генотипах. В первые 1–2 нед терапии вирусная нагрузка снижается на 1,6 log копий/мл при генотипе 1 HCV и на 2,9 log копий/мл при генотипе 2. Скорость гибели инфицированных гепатоцитов составляет 0,1 в день у больных с генотипом 1 и 0,26 в день при генотипе 2, что объясняется различиями в иммунном ответе у больных и дает основание для обсуждения необходимости более агрессивной и, возможно, более длительной ПВТ при генотипе 1 HCV [5].
Стратегия лечения больных ЦП и ХГ С, инфицированных генотипом 1 HCV и имеющих высокую вирусную нагрузку, тесно связана. УВО при лечении ИФН α в стандартном режиме больных ХГ С с генотипом 1 HCV не превышает 10% независимо от сроков лечения — 24 или 48 нед. При использовании комбинированной терапии (ИФН α/рибавирин) в течение 48 нед УВО у таких больных возрастает до 28–36%, оставаясь значительно ниже УВО при генотипах 2 и 3 HCV (64–79%). Лечение ХГ С с генотипом 1 HCV в течение 48 нед дает более высокие результаты (46–52%), чем 24 нед (29–42%). Таким образом, генотип вируса HCV определяет стратегию ПВТ ХГ С и ЦП С.
Уровень вирусной нагрузки, как и генотип вируса, не влияет на вариант и тяжесть течения ХГ C. Высокая вирусная нагрузка (более 2х10 6 копий/мл или более 800 000 МЕ/мл) может быть выявлена при хроническом гепатите низкой, умеренной, высокой степени активности, при минимальных изменениях в печени или при ЦП С. Однако уровень виремии отчетливо влияет на частоту достижения УВО: пегилированный ИФН α-2b 1,5 мкг/кг 1 раз в неделю в комбинации с рибавирином в дозе 800 мг/сут при высокой вирусной нагрузке обеспечивает УВО в 42% случаев, а при низкой — в 78%.
В последние годы разработан метод оценки успеха терапии на основании изучения вирусной кинетики на ранней стадии ПВТ. Ранний вирусологический ответ позволяет прогнозировать УВО. Высокая приверженность больных ХГ C к лечению и оценка прогноза ПВТ на основании данных раннего вирусологического ответа на 4-й или 12-й неделе позволили повысить результативность терапии в группе всех леченных больных ХГ С до 90%. Отказ от стандартных схем лечения ИФН α (3 млн МЕ 3 раза в нед) с переходом на комбинированную ПВТ также способствует повышению количества больных с ранним вирусологическим ответом.
Изучение раннего вирусологического ответа на основании количественного анализа HCV-РНК с помощью высокочувствительной ПЦР позволяет идентифицировать больных, которые не ответят на ПВТ. Если после 12-недельной ПВТ пегилированными ИФН α и рибавирином уровень HCV-РНК снизился на два и более десятичных логарифмов, но РНК вируса по-прежнему выявляется в крови, то целесообразно продолжить ПВТ еще в течение 12 нед, а затем провести повторное исследование HCV-РНК. При его отрицательном результате УВО колеблется от 42 до 78% в зависимости от вирусной нагрузки. Представляется целесообразным 72-недельный курс ПВТ, т. е. продление лечения до 1,5 лет, что позволяет значительно улучшить результаты лечения. При сохраняющейся виремии с падением ее уровня на 12-й неделе менее чем на два десятичных логарифма УВО составляет от 0 до 5%, что позволяет уже на ранних этапах либо отказаться от бесперспективной терапии при генотипе 1 HCV, либо модифицировать ее, либо перейти на поддерживающую терапию пегилированным ИФН α-2а (90 мкг) или ИФН α-2b (0,5 мкг/кг) с целью замедления прогрессирования ЦП С и профилактики развития ГЦК и лимфомы.
Тройная схема комбинированной ПВТ с включением помимо пегилированного ИФН α и рибавирина 200 мг амантадина не имеет преимуществ перед обычной схемой в лечении ХГ C генотипа 1b с высокой вирусной нагрузкой.
Обоснованием для лечения ХГ C с продвинутой стадией фиброза или сформировавшимся ЦП С стали данные о снижении риска декомпенсации ЦП и развития ГЦК, а также регрессе фиброза у 60% больных, получающих ПВТ. Наличие портального фиброза или ЦП С считается независимым фактором низкой частоты УВО у HCV-инфицированных больных. Пациенты с ЦП C обычно плохо отвечают на стандартную монотерапию ИФН α: УВО составляет от 5 до 20%. Эффективность комбинированной терапии ИФН α и рибавирином составила в этой группе 5–29%. Применение пегилированных ИФН α в составе комбинированной терапии компенсированного ЦП C или ХГ С с мостовидным фиброзом позволило повысить УВО до 44–50%.
Следует отметить, что даже при монотерапии пегилированным ИФН α можно достигнуть гистологического улучшения у 54% больных компенсированным ЦП С. В сравнительном исследовании эффективности пегилированных ИФН α-2a и 2b у больных ЦП C наличие мостовидного фиброза являлось отрицательным прогностическим фактором достижения раннего вирусологического ответа. В конце 24-недельной ПВТ вирусологический ответ в 1-й группе больных ЦП C составил 83%, во 2-й — 60%. Таким образом, пегилированный ИФН α-2a может быть препаратом выбора в комбинированной терапии ЦП C [8]. Даже при отсутствии вирусологического ответа на комбинированную ПВТ при ЦП C отмечается улучшение гистологической картины в печени (снижение ИГА и ГИС).
Наиболее значимое улучшение морфологических данных имеет место при достижении УВО, что сопровождается улучшением качества жизни больных ЦП С, несмотря на наличие продвинутой стадии болезни. Интерес представляют данные Poynard и соавторов (2000), наблюдавших 3010 больных ХГ С с повторной биопсией печени (до начала ПВТ и спустя 6–12 мес после ее окончания) при использовании различных режимов лечения: монотерапии ИФН α-2b, комбинированной ПВТ ИФН α или пегилированным ИФН α-2b и рибавирином в течение 48 нед. Более чем у трети больных, у которых был достигнут УВО, улучшилась гистологическая картина (ГИС и ИГА) в печени, морфологическая динамика отмечена также у трети больных без вирусологического ответа [9]. Анализ биопсий печени у больных ХГ С, участвовавших в четырех многоцентровых исследованиях, показал, что у 75 (49%) из 153 пациентов ЦП С после окончания терапии ГИС (уровень фиброза) снизился на 1–3 балла, что позволяет говорить о возможности регресса фиброза при ЦП С под влиянием настойчивой целенаправленной ПВТ [10].
В последние годы предпринимаются попытки противовирусного лечения декомпенсированного ЦП С (Чайлд В и С). Известно, что 40% всех ортотопических трансплантаций печени проводится в связи с ЦП С. Больные с сохраняющейся виремией имеют высокий риск реакций отторжения трансплантата и инфицирования донорской печени вирусом гепатита С с быстрым развитием (в течение 5–7 лет) ЦП С и/или ГЦК в пересаженной печени. В 2003–2004 гг. появились первые публикации использования ПВТ малыми дозами интерферона и рибавирина при декомпенсированном ЦП С у кандидатов на трансплантацию печени. Предлагается начинать лечение ИФН α 3 млн МЕ ежедневно и рибавирином 800 мг/сут за 4 мес до предполагаемой операции. Режим ежедневного введения интерферона позволяет уменьшить частоту гриппоподобного синдрома, лечение в течение 4 мес позволяет добиться максимального снижения виремии (до операции). У 9 (30%) из 30 больных декомпенсированным ЦП С (Чайлд В или С) удалось достичь вирусологического ответа на 12-й неделе, у 6 из них (20%) авиремия сохранялась после трансплантации печени [11]. Аналогичные данные о возможности развития УВО в 18–20% случаев декомпенсированного ЦП С опубликованы рядом авторов, длительность наблюдения за такими больными продолжается более 3,9 лет.
Известно, что употребление алкоголя значительно повышает смертность при вирусных ЦП: пятилетняя выживаемость больных достигает лишь 43%, значительно отличаясь в группах ЦП Чайлд А (66%), Чайлд В (50%) и Чайлд С (25%). При продолжающемся приеме алкоголя риск смерти у больных ЦП С повышается в случае наличия таких факторов, как пожилой возраст, печеночно-клеточная дисфункция (Чайлд В или С), желудочно-кишечное кровотечение, коинфекция (HBV, HCV), курение и отсутствие признаков острого алкогольного гепатита при биопсии печени. Среди механизмов влияния алкоголя на прогрессирование HCV-инфекции отмечают активацию репликации, повышение разнообразия квазивидов и мутаций вируса, усиление апоптоза гепатоцитов, подавление иммунного ответа хозяина, нарастание стеатоза и уровня железа в печени. Все это ведет к быстрому развитию болезни, высокой частоте формирования ЦП С и ГЦК и низкой эффективности интерферонотерапии. Эффективность ПВТ при ХГ С у лиц, употребляющих алкоголь, в 3 раза ниже стандартных показателей УВО: при монотерапии ИФН УВО снижается до 7–8% по сравнению с 25% у больных, не употребляющих алкоголь; при комбинированной терапии — до 12–4% по сравнению с 41%. Не существует безопасных доз алкоголя для больных ХГ С. Рекомендуется полный отказ от его приема за 6 мес до предполагаемой ПВТ, что улучшает результаты противовирусного лечения, однако УВО не достигает показателей, свойственных больным, не употреблявшим алкоголь в прошлом. Возврат к приему алкоголя после окончания ПВТ повышает риск обострения ХГ С и возврата виремии.
У больных ХГ С на стадии цирроза или при наличии мостовидного фиброза (F3) риск развития побочных эффектов интерферонотерапии выше, чем при менее продвинутых стадиях фиброза. Показано, однако, что частота их выявления и необходимость прекращения ПВТ существенно не отличаются в группах больных, леченных пегилированным ИФН α или ИФН α в стандартном режиме. Пегилированный ИФН α-2а обладает более выраженным миелосупрессивным действием, чем ИФН α-2b. Гематологическая токсичность при применении пегилированных ИФН α проявляется в первые 4 нед лечения, затем достигается устойчивый уровень лейкоцитов и тромбоцитов. Особенно быстро их число снижается после первой дозы препаратов. ПВТ назначают больным компенсированным ЦП С с уровнем лейкоцитов 3000/ммЁ и тромбоцитов 50 000/ммЁ. При снижении уровня нейтрофилов до 600/ммЁ, а уровня тромбоцитов до 20 000/ммЁ ИФН α отменяют.
Модификация дозы пегилированного ИФН α или рибавирина (снижение дозы или отмена препарата) в связи с побочными эффектами отмечена у 50% больных ЦП С. В зависимости от достижения раннего вирусологического ответа на 12-й неделе лечения предложены различные варианты лечения ЦП С: продолжение комбинированной терапии в максимально эффективных дозах в течение 36 нед при достижении раннего вирусологического ответа; лечение небольшими дозами пегилированного ИФН α-2b (0,5 мкг/кг) в течение 5 лет при отсутствии такого ответа на 4-й нед (EPIC3) или малыми дозами пегилированного ИФН α-2а (90 мкг) в течение 4 лет (HALT-С).
Определены показания к повторным курсам ПВТ: наличие генотипов 2 или 3 НСV; частичный ответ при предшествующем курсе ПВТ, F3- и F4-стадии фиброза. Противопоказаниями к повторным курсам лечения являются: пожилой возраст, генотип 1, ЦП С с гипербилирубинемией, высокая вирусная нагрузка, высокий индекс массы тела, минимальные изменения в печени при биопсии (ИГА менее 4 баллов) и продолжающееся употребление алкоголя или наркотиков.
Таким образом, ПВТ компенсированного и декомпенсированного ЦП при ХГ С решает ряд следующих задач: замедление декомпенсации цирроза, снижение смертности от его осложнений (кровотечение из варикозно расширенных вен, печеночно-клеточная недостаточность и т. д.), предотвращение развития ГЦК и профилактику реактивации инфекции после трансплантации печени, а также улучшение качества жизни больных и обеспечение их социальной реабилитации. Несомненно, что на ранних стадиях HCV-инфекции ПВТ дает лучшие результаты: частота УВО при лечении острого гепатита С достигает 90%, ХГ С — 60–70%, что превышает эффективность лечения ЦП С пегилированными ИФН α и рибавирином (30–50%). Наш опыт ПВТ ХГ С низкой степени активности позволяет говорить о высокой эффективности лечения данной категории больных. Используя пегилированный ИФН α-2b (1,5 мкг/кг) и рибаверин (более 10,6 мг/кг) при лечении первичных больных с небольшим сроком заболевания (5,9±5,7 лет), преимущественно низкой степени активности и слабым фиброзом (F1), а также низкой вирусной нагрузкой, мы получили устойчивый вирусологический ответ в 86 % случаев, в том числе у 77% пациентов с генотипом 1 HCV, включая 5 больных на стадии ЦП С [12].
Литература
Т. Н. Лопаткина, кандидат медицинских наук, доцент
Читайте также:

