Белки рнк гепатита с
Обновлено: 05.05.2024
Антитела к вирусу гепатита С в сыворотке в норме отсутствуют
Суммарные антитела к вирусу гепатита С представляют собой антитела классов IgM и IgG, направленные к комплексу структурных и неструктурных белков вируса гепатита С.
Это исследование является скрининговым для выявления пациентов с ВСГ. Суммарные антитела к вирусу гепатита С можно выявить в первые 2 недели заболевания, и их присутствие свидетельствует о возможной инфицированности вирусом или перенесенной инфекции.
Однозначный ответ на основании результатов данного теста получить невозможно, так как тест определяет суммарные антитела IgM и IgG. Если это ранний период острого вирусного гепатита С, то об этом свидетельствуют антитела IgM, а если это период реконвалесценции или состояние после перенесенного ВГС, то на это указывают антитела IgG.
Оценка результатов исследования
Результат исследования выражается качественно – положительный или отрицательный. Отрицательный результат исследования указывает на отсутствие суммарных антител (JgM и JgG) к ВГС в сыворотке крови. Положительный результат – выявление суммарных антител (JgM и JgG) к ВГС свидетельствует о начальной стадии острого вирусного гепатита С, остром периоде инфекции, ранней стадии реконвалесценции, перенесенном вирусном гепатите С или хроническом вирусном гепатите С.
Однако обнаружение суммарных антител к ВГС недостаточно для постановки диагноза ВГС и требует подтверждения для исключения ложноположительного результата исследования. Поэтому при получении положительного результата скринингового исследования на суммарные антитела к ВГС в лаборатории проводится подтверждающий тест. Окончательный результат определения суммарных антител к ВГС выдается совместно с результатом подтверждающего теста.
Антитела к вирусу гепатита С JgM
Антитела к вирусу гепатита С JgM в сыворотке в норме отсутствуют. Наличие антител класса JgM к ВГС в крови пациента позволяет верифицировать активную инфекцию. Антитела класса JgM могут выявляться не только при остром ВГС, но и при хроническом гепатите С.
Антитела класса JgM к ВГС появляются в крови пациента спустя 2 недели после развития клинической картины острого вирусного гепатита С или обострения хронического гепатита и обычно исчезают спустя 4-6 месяцев. Снижение их уровня может свидетельствовать об эффективности лекарственной терапии.
Оценка результатов исследования
Результат исследования выражается качественно – положительный или отрицательный. Отрицательный результат исследования указывает на отсутствие антител JgM к ВГС в сыворотке крови. Положительный результат – выявление антител JgM к ВГС свидетельствует о начальной стадии острого вирусного гепатита С, остром периоде инфекции, ранней стадии реконвалесценции или активном хроническом вирусном гепатите С.
Обнаружение вируса гепатита С методом ПЦР (качественно)
Вирус гепатита С в крови в норме отсутствует.
В отличие от серологических методов диагностики ВГС, где обнаруживают антитела к ВГС, ПЦР позволяет выявить наличие непосредственно РНК ВГС в крови как качественно, так и количественно. Определяемым фрагментом в обоих служит консервативный участок генома гепатита С.
Обнаружение только антител к ВГС подтверждает лишь факт инфицирования пациента, но не позволяет судить об активности инфекционного процесса (о репликации вируса), о прогнозе заболевания. Кроме того, антитела к вирусу ГС обнаруживают как в крови больных острым и хроническим гепатитом,так и у тех пациентов, кто болел и выздоровел, а нередко антитела в крови появляются только спустя несколько месяцев после появления клинической картины заболевания, что затрудняет диагностику. Обнаружение вируса в крови методом ПЦР – более информативный метод диагностики.
Качественное выявление ВГС методом ПЦР в крови свидетельствует о виремии, позволяет судить о размножении вируса в организме и является одним из критериев эффективности противовирусной терапии.
Аналитическая чувствительность метода ПЦР составляет не менее 50-100 вирусных частиц в 5 мкл, прошедшей выделение ДНК-пробы, специфичность – 98%. Обнаружение РНК вируса гепатита С с помощью ПЦР на ранних этапах развития вирусной инфекции (возможно уже через 1-2 недели после заражения) на фоне полного отсутствия каких-либо серологических маркеров может служить самым ранним свидетельством инфицирования.
Однако изолированное выявление РНК вируса гепатита С на фоне полного отсутствия каких-либо других серологических маркеров не может полностью исключить ложноположительный результат ПЦР. В таких случаях требуется всесторонняя оценка клинических, биохимических и морфологических исследований и повторное неоднократное подтверждение наличия инфекции ПЦР.
Согласно рекомендациям ВОЗ для подтверждения диагноза вирусного гепатита С необходимо троекратное выявление РНК вируса гепатита С в крови пациента.
Обнаружение РНК вируса гепатита С методом ПЦР используется в целях:
Обнаружение вируса гепатита С методом ПЦР (количественно)
Количественный метод определения содержания РНК вируса гепатита С в крови дает важную информацию об интенсивности развития заболевания, об эффективности лечения и о развитии резистентности к антивирусным препаратам. Аналитическая чувствительность метода составляет от 5.102 копий/мл вирусных частиц в сыворотке крови, специфичность – 98%.
Уровень виремии оценивают следующим образом: при содержании РНК ВГС от 10^2 до 10^4 копий/мл – низкий; от 10^5 до 10^7 копий/мл – средний и выше 10^8 копий /мл – высокий.
Количественное определение содержания РНК ВГС в сыворотке крови методом ПЦР имеет важное значение для прогноза эффективности лечения интерфероном-альфа. Показано, что наиболее благоприятный прогноз заболевания и наибольшую вероятность положительного ответа на противовирусную терапию имеют лица с низким уровнем виремии. При эффективном лечении уровень виремии снижается.
Генотипирование вируса гепатита С - определение генотипа
Метод ПЦР позволяет не только выявить РНК ВГС в крови, но и установить его генотип. Наиболее важное значение для клинической практики имеют 5 субтипов ВГС – 1а, 1b, 2а, 2b и 3а. В нашей стране наиболее часто встречается субтип 1b, далее идут 3а, 1а, 2а.
Определение генотипа (субтипа) вируса имеет важное значение для прогноза течения ВГС и подбора пациентов с хроническим ВГС к проведению лечения интерфероном-альфа и рибавирином.
При инфицировании пациента субтипом 1b хронический ВГС развивается примерно в 90% случаев, при наличии субтипов 2а и 3а – в 33-50%. У пациентов с субтипом 1b заболевание протекает в более тяжелой форме и часто заканчивается развитием цирроза печени и гепатоцеллюлярной карциномы. При инфицировании субтипом 3а у больных более выражен стеатоз, поражение желчевыводящих путей, активность АЛТ и менее выражены фиброзные изменения в печени, чем у пациентов с субтипом 1b.
Показаниями к лечению хронического ВГС интерфероном–альфа являются:
При лечении интерфероном-альфа больных вирусным гепатитом С с субтипом 1b эффективность терапии отмечается в среднем в 18% случаев, у инфицированных другими субтипами – в 55%. Использование комбинированной схемы лечения (интерферон-альфа + рибавирин) повышает эффективность терапии. Стойкий ответ наблюдается у 28% больных с субтипом 1b и у 66% - с другими субтипами ВГС.
Белки и антигены вируса гепатита С. Диагностика ВГС
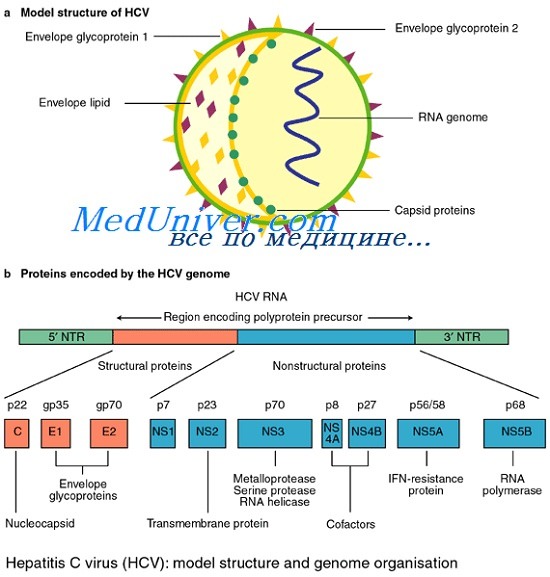
Сегодня известно минимум 10 структурных и неструктурных белков, кодируемых геномом HCV. К структурным белкам относят core, envelop 1 и envelop 2. Белок core является белком нуклеокапсида, тогда как envelop 1 и envelop 2 — гликопротеины внешней оболочки вируса. В структурной зоне кодируется также белок р7, функция которого не ясна, однако аналогия с другими представителями семейства Flaviviridae позволяет предположить, что его функция связана с высвобождением вириона из инфицированной клетки.
Этот белок отщепляется клеточной пептидазой от envelop 2, но не во всех случаях, что обусловливает существование envelop 2 в виде двух форм более и менее протяженной.
Неструктурная область генома HCV кодирует 6 белков — NS2, NS3, NS4A, NS4B, NS5A и NS5B. Белок NS2 является вирусной металлозависимой протеиназой. Белок NS4A действует как эффектор или кофактор для NSЗ-протеолитической активности в NS4A/NS4B, NS4B/NS5A, NS5A/NS5B сайтах нарезания полипротеина вируса.
В настоящее время фрагменты структурных и неструктурных белков, полученных генноинженерным путем (рекомбинантные белки) или с помощью химического синтеза, используют в качестве антигенов при конструировании иммуноферментных тест-систем. Первое поколение иммуноферментных тест-систем появилось на рынке в 1989 году и было основано на прямом ИФА. В качестве иммуносорбента были использованы фрагменты двух белков, NS3 и NS4, обозначаемых как 5-1-1 и С100-3.
Одновременно были разработаны и подтверждающие тесты на основе иммуноблота с рекомбинантными белками (RIBA). Чувствительность этих тест-систем первого поколения составляла только 64% для ИФА и 55% для иммуноблота. Тест-системы второго поколения появились на рынке в 1991 году. В качестве антигенов, сорбированных на твердой фазе, в этих тест-системах использовали капсидные белки (фрагмент с22-3) и антигены неструктурных регионов NS3 (фрагменты с200 и сЗЗс) и NS4, что позволило повысить чувствительность и специфичность исследований. Поскольку гуморальный иммунный ответ на капсидные антигены (структурные белки) нагинается быстрее, гем на неструктурные белки, период от инфицирования до выявляемой сероконверсии удалось уменьшить до двух месяцев.
Подтверждающие тест-системы на основе иммуноблота позволяли идентифицировать участвующие в реакции антигены. Результаты, полученные при помощи этих тест-систем, интерпретировали как положительные лишь при реакции антител, находящихся в исследуемом субстрате, по крайней мере, с двумя антигенами, тогда как при наличии реакции лишь с одним из антигенов результат считали неопределенным. Было установлено, что специфичность второго поколения тест-систем зависела от источника антигенов. В 1993 году на рынке появилось третье поколение тест-систем. В дополнение к вышеупомянутым антигенам в этих тест-системах используются также антигены, аминокислотная последовательность которых соответствует иммунодоминантным участкам NS5 белков.
В тест-системах первого, второго и третьего поколений в качестве антигенов использовались или рекомбинантные, или синтетические пептиды. В настоящее время можно выделить также тест-системы четвертого поколения, в которых в качестве иммуносорбента используют сочетания рекомбинантных и синтетических пептидов.
Опыт применения тест-систем различных поколений в мире очень большой. Было установлено, что если с помощью тест-систем первого или второго поколения у больных с острым вирусным гепатитом С антитела выявляли на 10-16, а в ряде случаев и 25-30 неделе от начала заболевания, то диагностикумы третьего поколения позволяли сократить этот срок до 2-3 недель. Согласно обобщенным данным чувствительность тест-систем первого, второго и третьего поколений составляет соответственно 70-80%, 92-95% и 97%.
В то же время, по данным С. Colin, 2001, чувствительность тест-систем третьего поколения составила 98,9% у пациентов с хроническими заболеваниями печени и 97,2% на специальных контрольных панелях сывороток. Достижение высокой чувствительности иммуноферментных тест-систем 3 и 4 поколения сопряжено с некоторыми проблемами в обеспечении специфичности исследований, что в ряде случаев может приводить к появлению ложноположительных результатов. В литературе имеются данные о возможных погрешностях в специфичности ELISA 3 тест-систем. Они являются общими для всех ELISA тест-систем, включая тест-системы для диагностики СПИДа.
Ложнопозитивные результаты могут быть следствием повышенного содержания в образцах гамма-глобулинов (сыворотки пациентов африканской расы, миеломная болезнь, ревматоидные факторы), заболеваний печени (цирроз, рак), аутоиммунных заболеваний (коллагенозы, аутоиммунные гепатиты), других вирусных инфекций (ВИЧ, гепатит В) и длительного хранения сывороток в меняющихся температурных условиях. Проведение какой-либо иммунизации также может сопровождаться повышением частоты ложнопозитивных реакций. Рекомендуемые в настоящее время меры по устранению этой проблемы следующие: а) повторная постановка образца в этой же ИФТС; б) повторная детекция anti-HCV в другой ИФТС; в) использование подтверждающих тестов на основе ИФА и иммуноблота.
Однако использование предлагаемых способов подтверждения результатов зачастую приводят к расхождениям в их итоговой трактовке, что показано исследованиями российских и зарубежных исследователей.
В настоящее время производители ИФТС для детекции anti-HCV достигают высокой чувствительности или за счет более полного выявления антител к NS3 или антител к антигенам core. Сравнительные исследования, выполненные на различных группах риска и специальных контрольных панелях показали, что тест-системы, лучше выявлявшие антитела к NS3, оказались несколько более чувствительными, чем тест-системы, лучше выявлявшие антитела к антигенам core. Их чувствительность составляла, соответственно 99,9% и 98,6%.
Вирус гепатита С и его геном
Вирус гепатита С (HCV) идентифицирован в 1989 году американскими исследователями под руководством М. Houghton, когда была выделена нуклеиновая кислота при экспериментальном заражении шимпанзе и в дальнейшем получена ДНК-копия, которую использовали для создания библиотеки клонов. Скрининг образцов из этой библиотеки позволил выявить клон, экспрессирующий антиген, который реагировал с антителами из сывороток людей, больных посттрансфузионным гепатитом ни А ни В.
Далее был получен рекомбинантный белок, который содержал последовательность из 363 аминокислотных остатков вирусного белка. Эту последовательность обозначили как С-100-3 и использовали в качестве антигена при создании иммуноферментной тест-системы.
Геном вируса гепатита С представлен однонитевой позитивной линейной молекулой РНК, состоящей из 9379 оснований и кодирующей полипротеин из ЗОН аминокислот, который под действием вирусных и клеточных протеаз нарезается на отдельные вирусные белки. Таксономический анализ выявил принадлежность вируса гепатита С к семейству Flaviviridae самостоятельному роду Hepacivirus.
Проведенный анализ нуклеотидных последовательностей изолятов вируса гепатита С различных частей его генома сделал возможным классификацию этого вируса. Наиболее удобной в настоящее время является номенклатура P. Simmonds et al, 1993, основанная на анализе последовательностей области NS5. Эта классификация, а также разработанная примерно в это же время система Н. Okamoto et al., 1992 стала общепринятой. К наиболее распространенным в мире генотипам вируса гепатита С относят: la, lb, 2а, 2b и 3а. Эти генотипы распространены в странах Западной Европы и в Америке, причем преобладающим является генотип lb.
Совсем другое распределение генотипов HCV в странах центрального Востока и Северной и Центральной Африки. Генотип 4, главным образом 4а, доминирует в Египте, Йемене, Кувейте, Ираке, Саудовской Аравии, Заире, Бурунди, Габоне. На юге Африке наиболее часто встречается генотип 5а, который в других частях мира находили исключительно редко. Генотип 3 выявлен в странах Западной Европы, в Сингапуре, Таиланде, Мьянме и Восточной Индии. Всего выделено 9 подтипов третьего генотипа HCV.
В России также проведены исследования по определению структуры генотипов ВГС, циркулирующих в различных ее регионах. Наиболее часто — 60-70 % случаев определен генотип HCV lb. Далее следуют генотипы За, 1а, и 2а. Так, в 1998 году Е. В. Лисицина во Владимирской области выявила следующую структуру генотипов HCV: lb — 72,9 %, 2а — 2,9 %, 2Ь — 2,9 % и За — 15,7 %. В 5,7 % случаев с имеющимся набором праймеров генотип определить не удалось.
При этом было отмечено, что у лиц различного возраста структура генотипов различается. У лиц в возрасте 7-14 лет генотип It и За выявлен с одинаковой частотой —42,9%. Среди лиц старше 50 лет генотип lb выявлен в 90% случаев, тогда как За не определен вовсе.
Вирусный гепатит С является одной из главных причин хронических заболеваний печени. Первичная диагностика гепатита С осуществляется путем определения антител к белкам вируса гепатита С (ВГС) в сыворотках с использованием широко представленных на рынке тест-систем для иммуноферментного анализа (ИФА). Положительные результаты, полученные при скрининге сывороток, несут информацию о самом факте инфицирования, однако серологические методы не позволяют разграничить разрешившуюся острую инфекцию от хронического заболевания, а также оценить эффективность антивирусной терапии. В связи с этим для установления диагноза и характеристики активности хронического гепатита наряду с комплексным клиническим обследованием пациентов проводятся вирусологические исследования, направленные на определение прямых маркеров ВГС - РНК и вирусспецифических белков.
Патогенез гепатита С остается во многом неясным. До сих пор не существует однозначного ответа на вопрос, как присутствие вируса в организме влияет на развитие заболевания. Во многом это обусловлено тем, что исследователи этой проблемы получают противоречивые результаты. В этом обзоре мы постарались коротко изложить существующие в настоящее время опубликованные данные и результаты собственных исследований, касающиеся связи между присутствием РНК и белков ВГС в организме больных и активностью хронического гепатита С.
Для изучения распределения РНК вируса гепатита С в различных органах и тканях инфицированного организма применяют методы полимеразной цепной реакции с этапом обратной транскрипции (ОТ-ПЦР), гибридизации in situ, ПЦР in situ. Вирусные белки выявляют либо с помощью поликлональных сывороток, либо с помощью моноклональных антител.
Для оценки влияния вирусной нагрузки на активность хронического гепатита С, которая может варьировать от минимальных гистологических изменений в печени до случаев цирроза и гепатокарциномы, используют различные варианты количественного и полуколичественного методов ОТПЦР. Активность патологического процесса в печени оценивают по уровню активности фермента аланинаминотрансферазы (АЛТ), индексу гистологической активности (ИГА). Стадию заболевания характеризуют, используя гистологический индекс склероза (ГИС). Гистологический диагноз (ИГА и ГИС) ставится на основании морфологического изучения биопсийного материала печени и выражается в баллах в соответствии с международной классификацией (DesmetV.J. et al., 1994).
По данным ряда исследователей, репликация вируса возрастает по мере прогрессирования болезни (Cho S.W. et al., 1996), и более высокий уровень виремии коррелирует с более серьезным повреждением печени (Gretch D. et al., 1994). При исследовании парафиновых срезов печени Dries V. с соавт. (1999) отмечали более частое выявление РНК В ГС в печени пациентов с высоким уровнем воспалительной активности по сравнению со случаями, при которых повреждения печени были минимальны. По мнению авторов, это связано с тем, что вирусная нагрузка клеток печени может определять воспалительно-некротическую реакцию (Dries V. et al., 1999). По данным Jamal M.M. с соавт. (1999), у пациентов с постоянно нормальным уровнем АЛТ наблюдается значительно более низкий уровень РНК ВГС в печени, чем у больных с повышенным уровнем АЛТ. Adinolfi L.E. с соавт. (1998) указывают, что у пациентов с циррозом печени уровень РНК в печени превышает таковой у пациентов с низким уровнем ИГА (1-4). Наиболее высокий уровень РНК ВГС в печени наблюдается у больных с ИГА>8 (Adinolfi L.E.etal., 1998).
В противоположность этому большинство исследователей сходятся на том, что прямая связь между количеством РНК ВГС в организме (как в печени, так и в периферической крови) и степенью активности патологического процесса отсутствует (BallardiniG.etal., 1997, McGuinnesP.H. et al., 1996, Negro F. et al., 1998, 1999, Rodriguez-Inigo E.et al., 1999, Sugano M. et al., 1995). Поданным этих авторов, присутствие вируса в организме и уровень вирусной РНК не коррелируют со значениями ИГА, ГИС или АЛТ. Есть данные об уменьшении уровня вирусной РНК в печени при прогрессировании хронического гепатита С (Di MartinoetaL, 1997).
Результаты, полученные в нашей лаборатории, согласуются с последней концепцией: при исследовании материалов (ткани печени, сыворотки и лимфоцитов периферической крови) от 75 пациентов с хроническим гепатитом С не было обнаружено достоверных отличий между частотой выявления РНК ВГС у больных с различной активностью заболевания (Лакина Е.И. и др., 2000). При проведении нами количественного анализа уровня РНК ВГС в сыворотке крови больных ХГС (Amplicor Monitor Test, v.2.0., "Roche Diagnostics") также не выявлено значимой корреляции между показателями ИГА, ГИС, АЛТ и уровнем виремии.
В настоящее время в литературе активно обсуждается вопрос о роли лимфоцитов в развитии ВГС-инфекции. Результаты выявления РНК ВГС в мононуклеарах периферической крови больных гепатитом С, полученные разными исследователями, варьируют в широких пределах. Так, по данным одних авторов, РНК ВГС в мононуклеарах периферической крови встречается у 24% больных (Young K.S. et al., 1993), по данным других - у всех (100%) обследованных (MellorG. et al., 1998, OkumuraA. et al., 1998). Согласно нашим данным, РНК ВГС в лимфоцитах периферической крови выявляется в 64% случаев. Связи между наличием ВГС в лимфоцитах и активностью гепатита С не обнаружено.
Zignego A.L. с соавт. (1995) показали, что РНК вируса чаще встречается в клетках крови пациентов с более серьезными повреждениями печени. Для объяснения существования этой связи авторы предположили, что активная инфекция различных субпопуляций клеток, вовлеченных в иммунный ответ хозяина, может нарушать их функцию, приводя к персистенции ВГС и развитию хронических повреждений печени. Частое обнаружение РНК ВГС в периферических мононуклеарах больных с хроническими повреждениями печени может объясняться тем, что при длительной ВГС-инфекции клеток печени происходит увеличение пула инфицированных лимфоидных клеток путем передачи от клетки к клетке (Zignego et al., 1995). Показано, что инфицированные лимфоидные клетки могут быть причиной заражения здоровой печени, пересаженной в организм ВГС-инфицированного пациента (Feray С. et al., 1992). Внепеченочный резервуар инфекции может также служить источником реактивации болезни после прекращения интерферонотерапии (Gil В. et al., 1993).
При изучении вопроса о том, насколько уровень вируса в сыворотке отражает его количество в печени, данные исследователей расходятся. Тогда как одни авторы выявляют корреляцию между присутствием геномной РНК в печени и уровнем виремии (De Moliner L. et al., 1998, Mc Guinnes P.H. et al., 1996, Negro F. et al., 1999), другие (Ballardini G. et al., 1997) подобную связь отрицают. Martin с соавт. (1998) указывают на существование корреляции между количеством РНК ВГС в печени и в сыворотке крови, но не в периферических мононуклеарах. В работе Sugano M. с соавт. (1995) сообщается о положительной корреляции между уровнем РНК ВГС в печени и сыворотке крови до лечения интерфероном. После интерферонотерапии корреляция между количеством РНК в печени и в сыворотке не была обнаружена. Подсчет инфицированных клеток в печени после проведения гибридизации in situ показал, что число клеток, содержащих РНК ВГС, может колебаться от 4,8% до 87,6% у разных больных, и уровень виремии прямо зависит от числа инфицированных клеток в печени (Gosalvez J. et al., 1998, Lau G.K.K. et al., 1994, Rodriguez-Inigo E. et al., 1999). При сопоставлении частоты выявления РНК ВГС в печени и в сыворотке крови нами были получены результаты, согласно которым примерно в трети случаев возникает ситуация, когда при наличии вируса в печени РНК ВГС в сыворотке не выявляется: частота выявления РНК ВГС в печени составляет 86%, в сыворотке крови -51%. Эти результаты согласуются с данными других авторов (Haydon G.H. et al.„ 1998, Seidi S. et al., 1999). Например, в работе Haydon G.H. с соавт. (1998) геномная РНК ВГС выявлена в клетках печени 10 из 12 пациентов, негативных по этому показателю в сыворотке.
Жизненный цикл ВГС включает образование репликативных (минус-) цепей РНК, которые служат матрицей для образования геномных молекул. Частота выявления репликативной формы РНК ВГС по данным одних исследователей составляет 35% случаев (Gastaldi M. et al., 1995), тогда как по данным других до 100% (Okabe M. et al., 1997, Sansonno D. et al., 1997, Chang M. et al., 2000). Существенное расхождение данных может объясняться трудностями, возникающими при определении минус-РНК, так как количество негативных цепей РНК на один (lanford R.E. et al., 1995) - три (Mellor J. et al., 1998) порядка ниже, чем +РНК. Это объясняется тем, что одна молекула -РНК может служить матрицей для синтеза нескольких геномных молекул.
Среди исследователей нет единого мнения о том, насколько репликация вируса связана с процессами повреждения печени и выходом вирусных частиц в периферическую кровь (De Moliner L. et al., 1998. Negro F. et al., 1999). По данным Negro F. с соавт. (1998, 1999), использовавших полуколичественный метод PCR, нет строгой связи между вирусной репликацией и уровнем виремии. Согласно полученным нами данным, репликация вируса в печени сопровождается большей частотой выявления РНК ВГС в сыворотке крови, однако достоверной корреляции между этими параметрами не обнаружено. Несоответствие между количеством выявленных геномной и репликативной форм РНК ВГС в печени и уровнем виремии может быть следствием ряда причин: 1 - элиминации вируса из сыворотки с помощью специфических антител; 2 - поступления ВГС в периферическую кровь не только из печени, но и из других органов и тканей; 3 - нарушения процесса высвобождения вируса из клеток печени под действием лекарственных средств или других факторов (Negro F. et al., 1998). Опыты, проведенные в нашей лаборатории, не выявили достоверной корреляции между частотой встречаемости минус-РНК ВГС в печени и степенью поражения печеночной ткани (Лакина Е.И. и др., 2000). Это согласуется с предположением, что вирус может реплицироваться, не вызывая серьезных повреждений в ткани печени (Negro F. et al., 1998). Однако есть данные о возможном участии вирусной репликации в развитии цитопатического эффекта (Chang M. et al., 2000, Tsutsumi M. et al., 1994). С помощью метода гибридизации in situ показано, что клетки, содержащие репликативную форму РНК вируса, локализованы преимущественно в очагах поражения печени (Tsutsumi M. et al., 1994). Обнаружена достоверная корреляция между количеством гепатоцитов, содержащих репликативную форму РНК ВГС, и степенью воспаления печени. Следует отметить, что для геномной РНК ВГС авторы такой связи не выявили (Chang M. et al., 2000).
Согласно мнению большинства исследователей, хотя печень и является главным органом, где происходит вирусная репликация, ВГС может реплицироваться в периферических мононуклеарах, лимфатических узлах, поджелудочной железе, в меньшей степени - в костном мозге, селезенке, щитовидной железе и надпочечниках (Lerat Н. et al., 1996, Okumura A. et al., 1998, Gowans E.J., 2000, Grovatto M. et al., 2000, Radkoowski M. et al., 2000).
Наряду с определением РНК, перспективным методом изучения активности вирусной репродукции является выявление вирусных белков непосредственно в тканях с помощью иммуногистохимических методов (ИГХ). В качестве иммунных реагентов для детекции антигенов ВГС используются как моноклональные антитела (Ballardini G. et al., 1995, Gonzalez-Peralta R.P. et al., 1994, Noun-Aria K.T et al., 1995, Sansonno D. et al., 1995, Nayak N.C., SatharS.A., 1999), так и поликлональные антисыворотки, полученные от экспериментально иммунизированных животных (Gonzalez-Peralta R.P. et al., 1994, Tsutsumi M. et al., 1994) или больных хроническим гепатитом С людей (Ballardini G. et al., 1995, Nouri-Aria K.T. et al., 1995).
Большой интерес представляет вопрос о связи экспрессии вирусных белков с активностью патологических процессов в печени. Согласно большинству исследований, число гепатоцитов, содержащих вирусные антигены, не коррелирует ни со степенью гистологических изменений в печени, ни с показателями биохимической активности (Gonzalez-Peralta R.P. et al., 1994, Nayak N.C., Sathar S.A., 1999, Gowans E.J., 2000). С другой стороны, Hiramatsu N. с соавт. (1992) показали, что экспрессия антигенов ВГС в печени возрастала с увеличением степени поражения органа. Sansonno D., Damacco F. (1993), изучая печень больных острым гепатитом С, обнаружили топографическую связь между очагами воспаления и некроза с одной стороны и гепатоцитами, экспрессирующими антигены ВГС, - с другой. Однако при переходе болезни в хроническое состояние эта связь не обнаруживалась.
Мы изучали распределение антигенов нуклеокапсида, неструктурных белков NS3, NS4A и NS4B с помощью полученных нами МКА в клетках печени больных хроническим гепатитом С на криостатных срезах печени. Были использованы биопсийные материалы от больных с различной активностью гепатита С и на разных стадиях заболевания. Параллельно ткань печени анализировали методом RT-PCR на наличие геномной и репликативной цепей РНК ВГС. В целом, антигены ВГС обнаружены в печени 33 из 34 (97%) пациентов, имеющих геномную РНК в ткани печени. Уровень детекции белка нуклеокапсида составлял 53%, NS3 - 76%, NS4 - 81%. Репликативная форма РНК ВГС значительно чаще ассоциировалась с выявлением соrе-белка. При этом доля антиген-позитивных гепатоцитов варьировала в широких пределах от 1 до 90% у разных пациентов, составляя в среднем около 32%. У больных с ХГС обнаружены качественные и количественные различия в соотношении структурных и неструктурных белков ВГС в клетках печени. В целом, все исследованные белки накапливались в печени пациентов с более тяжелыми формами ХГС (Абдулмеджидова АГ. и др., 2000). Между антиген-содержащими клетками и очагами воспаления и некроза ткани печени топографической связи выявлено не было, что подтверждает ранее полученные данные (Sansonno D., Damacco F., 1993). Эти результаты свидетельствуют в пользу гипотезы об отсутствии прямого цитопатического действия ВГС.
Анализ внутриклеточной локализации вирусных белков методом ИГХ показал, что специфическое окрашивание наблюдается только в цитоплазме гепатоцитов, что согласуется с большинством опубликованных работ (Ballardini G. et al., 1997, Blight К. et al., 1994, Brody R.I. et al., 1998, Gonzalez-Peralta et al., 1994, 1995, Nouri-Aria K.T. et al., 1995, Sansonno D. et al., 1995 (a,b), 1997).
Большой интерес представляет использование моноклональных антител для выявления белка нуклеокапсида ВГС в сыворотках крови больных гепатитом С и доноров (Onto E. et al., 1996, Jolivet-Reynaud С. et al., 1998, Masalova O.V. et al., 1998). Подобные исследования наталкиваются на две основные трудности: низкая концентрация вируса и блокирование антигенов ВГС антителами в составе иммунных комплексов (Onto E. et al., 1996, Shiratori Y. et al., 1997). В нашей лаборатории разработан метод для количественного определения соге-белка, входящего в состав циркулирующих в плазме "свободных" вирионов и иммунных комплексов. При исследовании плазм от 80 антиВГС-позитивных доноров оказалось, что вирусная РНК выявляется только в половине образцов. В 94,4% РНК-позитивных плазм выявлен и белок нуклеокапсида ВГС. Концентрация белка core в разных образцах варьировала в широких пределах и составляла 5-850 пг/мл (Масалова О.В. и др., 2000). В сыворотках пациентов с ХГС (n=71) белок нуклеокапсида был обнаружен у 74% больных. Концентрация соге-белка не коррелировала с тяжестью заболевания Показано, что циркуляция ВГС в виде иммунных комплексов ассоциирована с более продвинутой стадией ХГС (согласно значениям ГИС) (Masalova O.V. et al., 2000). Тест-системы для ИФА на основе моноклональных антител, позволяющие определять белок нуклеокапсида не только на качественном, но и на количественном уровне, являются более простым и дешевым, чем ПЦР, методом выявления ВГС. Их внедрение в практику здравоохранения может существенно обогатить возможности современной диагностики и контроля за течением гепатита С.
Таким образом, несмотря на десятилетнее изучение вопроса о связи между присутствием вируса гепатита С в организме и прогрессированием хронического гепатита, многое по-прежнему остается неясным. Данные о роли вирусного генома и вирусных белков в патогенезе инфекции противоречивы. Необходимы дальнейшие исследования по комплексному анализу обоих компонентов иммунного распознавания: вируса (РНК, структурных и неструктурных белков) и иммунной системы хозяина (антител к ВГС, Т-клеток, цитокинов и иммунных комплексов). Эти знания необходимы для разработки эффективных средств профилактики и специфических препаратов для лечения гепатита С, что позволит контролировать это широко распространенное тяжелое заболевание человека.
* Работа поддержана РФФИ, проект № 01-04-48890
Вирус гепатита С (HCV) представляет собой небольшой вирус, покрытый липидной оболочкой, содержащей одноцепочечную РНК. HCV относится к флавивирусам, роду семейства тогавирусов. Между 5' и 3' терминальными участками генома вируса располагаются структурные и неструктурные гены (рис. 1). 6 Структурные гены (С - core, Е1, Е2) кодируют ядерный и оболочечные гликопротеиды, в то время как неструктурные гены (NS2, NS3, NS4, NS5) - ферменты, участвующие в репликации вируса. Внутри генома имеются вариабельные и гипервариабельные участки, 6, 7 и в зависимости от их строения выделяют по крайней мере 6 различных генотипов HCV (возможно, их 12 или больше). 5, 8, 9 Генотипы вируса, по-видимому, различаются по иммуногенности, географическому распределению и, вероятно, влияют на течение HCV-инфекции и результаты лечения (см. также "Зависимость тяжести течения от генотипа HCV", "Ответ на лечение ИФН альфа-2b, влияние генотипа HCV"). 5, 7, 8 Вариабельность генома также может снижать чувствительность имеющихся диагностикумов для тестирования донорской крови и осложнять разработку вакцин против вируса. 10 (В настоящее время все усилия направлены на разработку вакцин на основе core региона, являющегося относительно стабильным участком у всех генотипов). 11, 12
Разные генотипы могут выявляться на протяжении инфекции у одного и того же больного. 13, 14 Исходя из этого было предположено, что наличие более вариабельных участков генома может отражать стратегию ускользания вируса от механизмов защиты хозяина. 5, 13, 15 По мнению других исследователей, данный феномен не имеет значения для репликации вируса. 13
Рис. 1 Организация генома HCV (По Van der Poel и соавт., 6 воспроизведено с разрешения)
ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ ПРИ HCV-ИНФЕКЦИИ
Anti-HCV и HCV РНК
По мере расширения представлений о структуре HCV методы выявления вируса становятся все более чувствительными. В настоящее время нет тест-систем для прямого определения антигенов HCV и больные тестируются на антитела к вирусу (anti-HCV). Скрининговым тестом обычно является иммуноферментный анализ (ELISA) (описан ниже). Положительные результаты контролируются более чувствительными методами рекомбинантного иммуноблоттинга (RIBA). По возможности необходимо исследование HCV РНК (с помощью полимеразной цепной реакции или метода амплификации разветвленной ДНК) для подтверждения наличия или отсутствия вируса в сыворотке.
Скрининговые тесты. Первые тест-системы для выявления anti-HCV основывались на обнаружении антител к вирусному антигену c 100 (anti-c100) с помощью ELISA первого поколения (табл. 1). 16 Однако anti-c100 могут появляться через много лет после инфицирования HCV; при этом наблюдается высокая частота ложноположительных результатов в популяциях низкого риска (таких как доноры), 14, 17-20 при исследовании длительно хранившихся образцов крови и у больных с гипергаммаглобулинемией. 21-23
Второе поколение тест-систем ELISA является более чувствительным, позволяя обнаруживать антитела к другим вирусным белкам, включая с22 и с33 (табл. 1). 24-26 Антитела к данным антигенам обнаруживаются чаще, чем anti-c100, и появляются в более ранние сроки. Они могут использоваться в диагностике как острой, так и хронической HCV-инфекции. 26-28
Третье поколение тест-систем ELISA сейчас широко используется для скрининга донорской крови, является более чувствительным и специфичным по сравнению с тест-системами ELISA предыдущих поколений 29-30 и дает почти 100% гарантию предотвращения заражения реципиентов донорской крови. Однако антитела могут быть не обнаружены у больных, инфицированных менее 6 месяцев назад, и у больных с иммуносупрессией. Возможны ложноположительные результаты (часто среди доноров). В связи с этим положительные результаты ELISA должны подтверждаться дополнительными тестами.
Табл. 1 Методы выявления антител к вирусу гепатита С (anti-HCV)
| Метод | Выявляемые антитела (кодирующий ген) |
| Скрининговые тесты | |
| I поколения ELISA | anti-c100 (NS4) |
| II поколения ELISA | anti-c22(C), anti-c33+anti-c100[anti-c200] (NS3/NS4) |
| II поколения ELISA | (С, NS3, NS4, NS5) |
| Дополнительные тесты | |
| I поколения RIBA | anti-c100 (NS4), anti-5-1-1 (белки NS3/NS4 регионов) |
| II поколения RIBA | anti-c22(C) ,anti-c33 (NS3), anti-c100 (NS4), anti-5-1-1 (NS3/NS4) |
| II поколения RIBA | (С, NS3, NS4, NS5) |
*Полимеразная цепная реакция (ПЦР), позволяющая выявить, клонировать и определить последовательность генома вируса, имеет наибольшую чувствительность из принятых тестов, позволяя определять РНК вируса даже при низком уровне виремии. ПЦР пока не доступна для широкого применения, имеет ограничения, связанные с возможностью загрязнения и количественным определением; в то же время амплификация вирусного генома дает большое преимущество в выявлении низких концентраций вируса и различий в нуклеотидной последовательности между разными генотипами. Количественное определение HCV РНК стало возможным благодаря адаптированию ПЦР с использованием метода серийных разведений или коамплификации РНК. 5 Новейший метод количественного определения основан на амплификации разветвленной ДНК (bDNA, Chiron). 36-39 Данный метод, выявляющий линейную корреляцию между тест-сигналом и титром вируса (более 3-4 log), более прост в исполнении, 40 но менее чувствителен, 5, 37 чем ПЦР. Результаты исследования могут различаться в зависимости от генотипа вируса. 38 Указанные тесты имеют важное значение при установлении связи титра HCV РНК с инфекциозностью, уровнем аминотрансфераз, тяжестью заболевания и ответом на противовирусную терапию.
HCV РНК. Тест-системы для прямого определения антигенов HCV в сыворотке еще не разработаны, и в настоящее время HCV РНК является лучшим маркером виремии, инфекциозности и активности болезни (см. "Хронический гепатит С. Биохимические показатели, сывороточные маркеры HCV"). Тестирование на HCV РНК проводится в основном в специализированных центрах, однако недавно появились коммерческие наборы для ПЦР. 32 Выявление HCV РНК с помощью ПЦР может подтвердить наличие виремии при отрицательных результатах исследования anti-HCV методами ELISA и RIBA. HCV РНК появляется в крови гораздо раньше других маркеров, обнаруживаясь спустя несколько дней после инфицирования. 33, 34 Следует, однако, отметить, что при циркуляции вируса в низких, подпороговых концентрациях HCV РНК может периодически не определяться. Поэтому суждение об отсутствии виремии на основании единичного отрицательного результата ПЦР не является окончательным.
Читайте также:

