Что изучает генетика вирусов
Обновлено: 25.04.2024
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ГЕНОМА ВИРУСА
Вирусы являются одним из излюбленных объектов молекулярной генетики благодаря простому строению и малой молекулярной массе их геномов, которая в 10 6 раз меньше массы генома эукариотической клетки. Организация генетического аппарата у ряда вирусов, например у SV40, настолько сходна с таковой генов эукариотической клетки, что получила название минихромосомы. Минихромосома широко используется для изучения организации и репликации ДНК.
Число генов у вирусов значительно варьирует: от 3—4 генов у просто устроенных вирусов (парвовирусы) до 150 генов и больше у сложно устроенных (вирус оспы). Геном вирусов животных является гаплоидным, за исключением ретровирусов, которые имеют диплоидный геном, представленный двумя идентичными молекулами РНК. У вирусов с фрагментарным геномом (вирусы гриппа, реовирусы) каждый фрагмент обычно представляет собой один ген.
В составе генов ДНК-содержащих вирусов есть регуляторные участки, в том числе промотор, контролирующие функцию структурных генов. Сильными промоторами являются концы многих вирусных ДНК, представляющие собой длинные концевые повторы, сильный промотор имеют гены тимидинкиназы вирусов оспы и герпеса. Эти промоторы используются в генной инженерии для усиления транскрипции изучаемого гена.
СПОСОБЫ УВЕЛИЧЕНИЯ ИНФОРМАЦИОННОЙ ЕМКОСТИ ВИРУСНОГО ГЕНОМА
У многих вирусов молекулярная масса синтезирующихся белков превышает теоретически рассчитанную. Этот феномен объясняется наличием у вирусов механизмов, позволяющих получить развернутую генетическую информацию при максимальной экономии генетического материала; подобные механизмы выработаны в процессе эволюции вирусов как генетических паразитов.
Способами увеличения генетической информации являются: 1) двукратное считывание одной и той же иРНК, но с другого инициирующего кодона; 2) сдвиг рамки трансляции; 3) сплайсинг; 4) транскрипция с перекрывающихся областей ДНК и др.

Трансляция может происходить без сдвига рамки и со сдвигом рамки. Генетический код является триплетным, это означает, что три нуклеотида, составляющих триплет, или кодон, кодируют одну аминокислоту. В том случае, если триплеты сохранены и генетический код не изменился, то при трансляции с двух разных инициирующих кодонов будут синтезироваться полипептиды, представляющие собой укороченную копию первого полипептида (трансляция без сдвига рамки).
В том случае, если произошел сдвиг на один или два нуклеотида, образуются новые триплеты (кодоны) и появляется новый генетический код. В этом случае одна молекула иРНК может транслироваться с образованием двух уникальных белков, т. е. таких белков, у которых нет идентичных аминокислотных последовательностей.
Одним из способов экономии генетического материала является нарезание полипептида-предшественника на участки разной длины, в результате чего образуются разные полипептиды с перекрывающимися аминокислотными последовательностями. Подобный механизм нарезания имеет место у аденоассоциированных вирусов и у SV40.
Таким образом, число реальных генов превосходит молекулярную массу генома. Основанный на длине генома расчет числа генов неизменно приведет к ошибочным результатам. Более точные представления о числе генов можно получить путем биохимического и генетического анализов.
ОСНОВНЫЕ ПРОЦЕССЫ, КОНТРОЛИРУЮЩИЕ НАСЛЕДСТВЕННОСТЬ И ИЗМЕНЧИВОСТЬ ВИРУСОВ
Модификации. Модификациями называются не наследуемые (фенотипические) изменения у вирусов, обусловленные клеткой-хозяином. Эти изменения лежат в основе адаптации вируса к новому хозяину и преодоления зависимого от хозяина ограничения. Модификации нуклеиновых кислот вирусов осуществляют клеточные ферменты, ответственные за ограничение (рестрикцию) репродукции вируса.
Мутации. В основе изменчивости вирусов лежат мутации, т. е. изменения состава и последовательностей нуклеотидов вирусного генома. Мутации происходят у всех вирусов, независимо от того, является ли их генетическим аппаратом ДНК или РНК. В результате мутаций отдельные вирионы могут приобретать новые свойства. Дальнейшая судьба таких вирусов зависит от естественного отбора, сохраняющего популяцию, наиболее приспособленную к условиям существования.
Мутации могут иметь разные последствия. В одних случаях они ведут к изменению фенотипических проявлений в нормальных условиях. Например, увеличивается или уменьшается размер бляшек под агаровым покрытием; увеличивается или ослабляется нейровирулентность для определенного вида животных; вирус становится более чувствительным к действию химиотерапевтического агента и т. п.
В других случаях мутация является летальной, так как вследствие ее нарушается синтез или функция жизненно важного вирусспецифического белка, например вирусной полимеразы.
В некоторых случаях мутации являются условно летальными, так как вирусспецифический белок сохраняет свои функции в определенных, оптимальных для него, условиях и теряет эту способность в неразрешающих (непермиссивных) условиях. Типичным примером таких мутаций являются температурно-чувствительные (temperature sensitive) — ts-мутации, при которых вирус теряет способность размножения при повышенных температурах (39—42° С), сохраняя эту способность при обычных температурах выращивания (36—37° С).
По своему механизму мутации могут быть тоже разными. В одних случаях происходит делеция, т. е. выпадение одного или нескольких нуклеотидов, в других случаях происходит встраивание одного или нескольких нуклеотидов, а в некоторых случаях — замена одного нуклеотида другим.
Мутации могут быть прямыми и обратными. Прямые мутации меняют фенотип, а обратные мутации — реверсии — его восстанавливают. Возможны истинные реверсии, когда обратная мутация происходит в месте первичного повреждения, и псевдореверсии, если мутация происходит в другом участке дефектного гена (интрагенная супрессия) или в другом гене (экстрагенная супрессия). Реверсия не является редким событием, так как ревертанты обычно более приспособлены к данной клеточной системе. Поэтому при получении мутантов с заданными свойствами, например вакцинных штаммов, приходится считаться с возможной их реверсией к дикому типу.
Мутации носят случайный характер и объясняются статистическими законами.
В качестве физических мутагенов наиболее часто применяется ультрафиолетовое облучение, так как его энергия сопоставима с энергией химических связей. Реже применяются более жесткие виды облучения — рентгеновское и γ-облучение, а также обработка вирусных суспензий нейтронами, протонами, электронами и ядрами гелия, так как они вызывают сильные разрушения вирусных геномов и их инактивацию.
В качестве химических мутагенов применяют аналоги оснований (бромурацил, бромдезоксиуридин, 2-аминопурин, нитрозогуанидин и пр.), алкилирующие и флуоресцирующие соединения (профлавин), интеркалирующие агенты (актиномицин, этидий бромид), азотистую кислоту, гидроксиламин и многие другие.
ГЕНЕТИЧЕСКИЕ И НЕГЕНЕТИЧЕСКИЕ ВЗАИМОДЕЙСТВИЯ МЕЖДУ ВИРУСАМИ
Как в естественных, так и в экспериментальных условиях одна клетка может быть заражена не одним, а несколькими вирусами. В процессе такой смешанной инфекции могут иметь место различные формы взаимодействия как между вирусными геномами, так и между продуктами генов. При взаимодействии геномов могут наблюдаться такие формы генетических взаимодействий, как множественная реактивация, рекомбинация, пересортировка генов, кросс-реактивация, гетерозиготность. При взаимодействии на уровне продуктов генов могут иметь место негенетические взаимодействия: комплементация, интерференция, фенотипическое смешивание и др.
Множественная реактивация. Вирусная инфекция может возникнуть при заражении клетки несколькими ви-рионами с поврежденными геномами вследствие того, что функцию поврежденного гена может выполнять вирус, у которого этот ген не поврежден. Этот феномен был вначале обнаружен на бактериофагах и получил название множественной реактивации. В основе множественной реактивации лежит кооперативный процесс, при котором вирионы с поражением разных генов дополняют друг друга путем генетической рекомбинации, в результате чего репродуцируется исходный неповрежденный вирус. Эффективность множественности реактивации зависит от многих причин: степени повреждения генома вирионов, числа проникших в клетку вирионов, концентраций их в определенных участках клетки, аутоинтерференции поврежденных вирионов. Для множественной реактивации важное значение имеет расстояние между вирионами с поврежденными геномами внутри клетки. Обработка вирионов двухвалентными ионами металлов, ведущая к их агрегации, усиливает множественную реактивацию.
Рекомбинация. Генетической рекомбинацией называют обмен генетическим материалом, происходящий между родительскими вирусами. Возможен обмен полными генами (межгенная рекомбинация), так и участками одного и того же гена (внутригенная рекомбинация). Образующийся вирус-рекомбинант обладает свойствами, унаследованными от разных родителей.
Обычно рекомбинируемые штаммы обладают характерными признаками, которые обозначаются как маркеры. Например, были получены рекомбинанты между вирусами полиомиелита, обладающие повышенной устойчивостью и повышенной чувствительностью к гуанидину, разной нейровирулентностью, разной устойчивостью к повышенной температуре, разной чувствительностью к ингибиторам сывороток лошадей и коров и т. п. Для получения рекомбинантов используют штаммы, содержащие два или большее число маркеров.
Тест рекомбинации применяют для генетических исследований вирусов. С его помощью возможно построение генетических карт вирусов, в которых определяется, в каких участках генома произошли мутации, а также в условных единицах измеряется расстояние между разными мутациями.
Пересортировка генов. Вариантом рекомбинации является феномен, получивший название пересортировки генов. Она наблюдается при генетических взаимодействиях между вирусами, имеющими сегментированный геном. Образующиеся при этом гибридные формы вирусов называют реассортантами. Реассортанты вирусов гриппа получают при совместном культивировании вирусов с разными генами гемагглютинина и нейраминидазы. В этом случае из общего потомства путем нейтрализации соответствующих антигенов можно выделить интересующие исследователя варианты.
Существуют определенные группировки (констелляции или созвездия) генов, которые в данной системе клеток более стойки и делают вирус более жизнеспособным.
Сходные процессы пересортировки генов имеют место у вирусов гриппа типов А, В и С и у других вирусов с фрагментарным геном — у буньявирусов, аренавирусов (однонитчатые РНК) и реовирусов (ротавирусов) (двунитчатая РНК). Однако эти процессы не столь интенсивны и доступны изучению, как у вирусов гриппа.
Гетерозиготность. При совместном культивировании двух штаммов вируса может происходить формирование вирионов, содержащих в своем составе два разных генома или по крайней мере один полный геном и часть второго генома. Это явление названо гетерозиготностью.
Комплементация. Комплементация (дополнение) является таким видом негенетического взаимодействия при смешанной инфекции двумя вирусами, которое стимулирует репродукцию обоих партнеров или одного из них, но не изменяет генотипы вирусов. Принцип комплементации заключается в том, что вирус снабжает партнера недостающими компонентами, обычно белками, структурными или неструктурными.
Комплементация широко распространена среди вирусов и встречается как между родственными, так и неродственными вирусами. Феномен тесно связан с проблемой дефектности вирусов.
Поскольку в вирусной популяции помимо стандартных обычно присутствуют дефектные неинфекционные вирусные особи, в частности дефектные частицы, утратившие часть генетического материала, комплементация имеет место в инфекционном цикле многих вирусов и заключается в том, что члены популяции снабжают друг друга продуктами генов, которые дефектны у партнеров. Отличие комплементации от генетической рекомбинации заключается в отсутствии обмена генетическим материалом.
Комплементация встречается и у неродственных вирусов, принадлежащих к разным семействам. Одним из семейств, вирусы которого наиболее часто участвуют в комплементации, является семейство аденовирусов. В одних системах аденовирусы могут действовать как дефектные вирусы, в других — как помощники. Например, в культуре клеток почек макак резусов аденовирусы могут репродуцироваться только в присутствии SV40, который является в данном случае вирусом-помощником. В других системах сами аденовирусы действуют как вирусы-помощники, а вирусом-сателлитом является аденоассоци-ированный вирус, относящийся к семейству парвовирусов. Репродукция этого вируса полностью зависит от комплементирующего действия аденовирусов. Вирус гепатита В является помощником для дельта-агента, который покрывается его наружным белком — HBs-антигеном. Сочетание обоих вирусов обнаружено при наиболее тяжелых формах гепатита.
Возможна не только межцистронная, но и внутрицистронная комплементация в том случае, когда один ген кодирует несколько белков.
Фенотипическое смешивание. При совместном культивировании двух вирусов может наблюдаться феномен фенотипического смешивания, когда геном одного вируса бывает заключен в капсид, состоящий частично или полностью из белков другого вируса.
Фенотипическое смешивание наблюдается при смешанной инфекции,многими вирусами, причем эти вирусы могут быть как близкими друг другу (например, вирусы гриппа А и В или разные серологические подтипы вируса гриппа А), так и весьма далекими (онковирусы и рабдовирусы).
РЕСТРИКТАЗЫ И ФИЗИЧЕСКИЕ КАРТЫ ВИРУСОВ
Подлинную революцию в физическом картировании геномов вирусов произвело применение рестриктаз и секвенирование вирусных геномов. Рестриктазы имеют исключительное значение в молекулярной генетике вообще и генетической инженерии в частности. Их открытие (1968—1970 гг.) впервые дало возможность специфически расщеплять ДНК на строго определенные фрагменты, доступные для препаративного выделения и анализа.
Рестриктазы или эндодезоксирибонуклеазы — это просто организованные белки, являющиеся ферментами, широко распространенными среди прокариотов и участвующими в генетических процессах. В отличие от экзонук-леаз, отщепляющих концевые нуклеотиды или свободные остатки фосфорной кислоты, эндонуклеазы расщепляют молекулу ДНК изнутри, обычно — в местах, где преобладают пиримидиновые основания. Рестриктазы характеризуются высоковыраженной специфичностью, распознавая строго определенные последовательности нуклеотидов в двунитчатой ДНК.
Число новых рестриктаз стремительно нарастает и со временем, по-видимому, будут обнаружены рестриктазы, узнающие любую последовательность нуклеотидов.
Использование разных рестриктаз позволяет получать фрагменты разной величины, которые затем разделяются и анализируются путем электрофореза в агарозных или полиакриламидных гелях. Сочетание рестрикционного анализа с другими методами позволяет составить физические карты геномов вирусов. Физические карты вирусных геномов обозначают взаимное расположение генов, их границы, локализацию начала репликации, промоторов, лидеров, экзонов и интронов, сигнальных последовательностей и других генетических элементов.
Генетический код для синтеза белков вируса SV-40 записан не на одной, а на обеих нитях ДНК, а транскрипция разных генов идет в разных направлениях.
В настоящее время полностью расшифрованы нуклеотидные последовательности отдельных генов и целых геномов методом секвенирования (от англ. sequence — последовательность). Если речь идет о РНК-содержащих вирусах, то предварительным условием для дальнейшего их анализа является переписка РНК на ДНК с помощью РНК-зависимой ДНК-полимеразы (обратной транскриптазы), после чего генетический материал может быть подвергнут рестрикционному анализу.
Проектное задание к модулю
В качестве проектного задания студентам предлагается написание рефератов по следующим темам:
1. Природа дефектных вирусных геномов. Вирусы-сателлиты.
2. Вирусная интерференция
3. Необычные свойства ретровирусов
4. Трансформация клетки опухолеродными ДНК-вирусами
5. Классификация и основные свойства вирусов гриппа
6. Индукция специфического иммунного ответа на вирусы
7. Особенности репродукции пикорнавирусов
8. Семейство тогавирусов. Особенность репродукции и инфекционного процесса.
9. Вирус клещевого энцефалита.
10. Вирус бешенства
11. Вирусная персистенция
12. Основные свойства парамиксовирусов
13. Вирус кори. Биология возбудителя. Особенности патогенеза
14. Аденовирусы, их репликация и связь с другими вирусами
16. Пути распространения вирусных болезней растений.
17. Прионы. Возбудители или провокаторы или….
18. Вироиды как вирусоподобные инфекционные агенты.
19. Вирусы, вызывающие респираторные инфекции. Сравнительная характеристика
20. Место вирусов в биосфере.
21. Бактериофаги. Их морфологическое многообразие и взаимодействие с бактериями.
22. Атипичная пневмония и возможность происхождения новых вирусов
23. Роль вирусов в возникновении злокачественных опухолей
24. Особенности транскрипции РНК- содержащих вирусов.
25. Морфогенез вирусов или морфологические превращения в процессе репродукции.
Тест рубежного контроля

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Вирусология (вирус[ы] + греч. logos учение) — учение о вирусах; самостоятельная область биологии, развивающая знания о субмикроскопических внутриклеточных паразитах, поражающих людей, животных, растения и микроорганизмы. К этой же области биологии относится учение о вирусах бактерий.
Вирусология занимает значительное место в биологии и медицине, т. к. вирусы вызывают многие заболевания людей, животных, растений, поражают плесневые грибы, простейшие организмы и бактерии, а также в связи с тем, что на модели вирусов изучаются основные проблемы генетики и молекулярной биологии.
История
Основоположник Вирусологии — русский ученый Д. И. Ивановский. Изучая мозаичную болезнь табака и использовав при этом метод фильтрации, он установил в 1892 г., что фильтрат из растертой взвеси листьев, пораженных этой болезнью, не содержал видимых в микроскоп микроорганизмов, однако вызывал типичные признаки мозаичной болезни у здоровых растений. На основании этих опытов Ивановский сделал вывод, что мозаичная болезнь табака вызывается мельчайшими микроорганизмами, проходящими через керамические фильтры, задерживающие все известные в то время бактерии, что они не способны расти на искусственных питательных средах, применяемых в бактериологии, и передаются в серии последовательных пассажей (прививок). В 1902 г. Ивановский обнаружил кристаллические включения в клетках табачных растений, пораженных мозаичной болезнью, в дальнейшем другими учеными было подтверждено, что это скопление вирусных частиц.
Использование метода фильтрации позволило в дальнейшем установить прохождение через керамические фильтры возбудителей других известных заболеваний человека и животных: ящура [Ф. Леффлер и Фрош (P. Frosch), 1898], желтой лихорадки [Рид (W. Reed, 1901) с сотр.]. В 1911 г. Ф. Раус доказал вирусную этиологию саркомы кур, т. е. впервые экспериментально установил, что вирусы могут вызывать неопластические процессы.
Для изучения вирусов, поражающих животных и растения, использовались в качестве модели соответствующие виды животных и растений. Для изучения и выделения вирусов, вызывающих заболевания человека, применялись восприимчивые к этому вирусу лабораторные животные (мыши, крысы, морские свинки, кролики, хорьки и т. д.). Широко использовались приемы введения различного инфекционного материала в роговицу глаза, кожу, мозг, дыхательные пути, а также принцип повторных пассажей на различных видах животных. Так, используя экспериментальных животных, выделили и изучили вирусы бешенства, оспы, герпеса, ящура, гриппа, энцефалитов, полиомиелита, хориоменингита и др. Однако к концу 30-х годов возможности этого метода были исчерпаны, т. к. не удавалось выделить многие вирусы, к к-рым экспериментальные животные были невосприимчивы, или нельзя было получить большого количества вирусов, очищенных от тканевых элементов, и в высоких концентрациях.
В 1931 г. был предложен метод культивирования вирусов на 8—13-дневном курином эмбрионе Вудраффом (М. F. Woodruff) и Э. Гудпасчером. В 40-х годах метод получил широкое распространение в вирусологии, т. к. имел ряд преимуществ: простота применения, большая чувствительность, возможность накопления большого количества вируса, относительная герметичность, предохраняющая от контаминации, относительная простота очистки от примесей, возможность быстрого определения наличия вируса в жидкостях эмбриона по данным реакции гемагглютинации.
Методом культивирования в курином эмбрионе (в клетках амниотической оболочки, в отдельных органах зародыша и клетках желточного мешка) были изучены вирусы гриппа человека и животных, чумы птиц, коровьей оспы, герпеса человека, энцефаломиелита лошадей и др. Эндерс, Роббинс, Уэллер (J. F. Enders, F. С. Robbins, Т. H. Weller, 1948—1952) применили для выделения и изучения вирусов метод культур клеток и тканей. Этот метод стал широко использоваться в различных вирусологических исследованиях и за несколько лет обогатил науку не только открытием сотен неизвестных ранее вирусов, но расширил возможности производства более качественных вирусных вакцин и диагностических препаратов; метод тканевых культур открыл новые возможности изучения различных аспектов и этапов процесса взаимодействия вируса и клетки (см. Культивирование вирусов, Культуры клеток и тканей).
Дальнейший прогресс В., и в частности изучение структуры, физиологии, биохимии и генетики вирусов, зависел от получения их в концентрированном и очищенном виде и был связан с внедрением новых физ.-хим. методов исследования: дифференциального и градиентного центрифугирования, молекулярно-адсорбционной и ионообменной хроматографии, электрофореза на бумаге и в полиакриламидном геле, радиоактивных изотопов и ряда других.
Быстрый прогресс В. был обусловлен применением электронных микроскопов с высокой разрешающей способностью (до 1,0—0,5 нм, в сочетании с методами оттенения и двойного оттенения, ультратонких срезов, позитивного и негативного контрастирования, а также авторадиографии, цитохимических и иммунохимических методов исследования. Использование комплекса перечисленных методов позволило изучить структурную организацию вирионов различных вирусов, предложить новую классификацию вирусов, основанную на их строении и биохимическом составе, изучить закономерности репродукции вирусов и определить детали их онтогенеза, охарактеризовать основные параметры субвирусных компонентов (нуклеиновых кислот, белков и др.), начать углубленные исследования по генетике вирусов и приступить к разработке рациональных подходов к химиотерапии вирусных инфекций.
Развитие Вирусологии способствовало изучению и решению общебиологических проблем: доказательству генетической функции нуклеиновых кислот, расшифровке генетического кода, пониманию важнейших механизмов регуляции синтеза клеточных макромолекул, установлению передачи информации от клетки к клетке и др.
Практическое здравоохранение получило ряд надежных вакцин для специфической профилактики не только оспы, что было известно еще задолго до рождения В. как науки, но и желтой лихорадки, полиомиелита, кори; появились новые средства для неспецифического воздействия на вирусные инфекции, напр, интерферон (см.).
Основные направления современной вирусологии
Основные направления современной общей и мед. вирусологии: дальнейшее изучение тонкой структуры вирусов, их биохимии и генетики, репликации вирусных нуклеиновых кислот, взаимодействия вируса с клеткой, углубленное изучение противовирусного иммунитета, совершенствование методов выделения вирусов и диагностики вирусных заболеваний, разработка основ химиотерапии и химиопрофилактики вирусных инфекций; изучение экологии вирусов, разработка более совершенных методов профилактики, поиски и испытание препаратов для лечения вирусных заболеваний.
Особое внимание будет сосредоточено на изучении вирусов, вызывающих неопластические процессы, а также латентных вирусных инфекций и скрытого вирусного носительства, поисках возбудителей инфекционного и сывороточного гепатита, разработке профилактики гриппа.
В 30-х годах в СССР были созданы первые вирусологические лаборатории: по изучению вирусов растений— при Украинском институте защиты растений (1930), по изучению вирусов животных — в Ин-те экспериментальной ветеринарии в Москве в 1930 г. (Н. Ф. Гамалея), Центральная вирусологическая лаборатория НКЗ РСФСР в Москве (Л. А. Зильбер) и отдел вирусологии в Ин-те эпидемиологии и микробиологии им. Л. Пастера в Ленинграде (А. А. Смородинцев) в 1935 г. В послевоенные годы в СССР созданы и функционируют профильные научно-исследовательские, научно-производственные и практические учреждения. По данным на 1-е января 1973 г., в СССР исследования по общей и мед. В. проводились в 60 научных, научно-производственных учреждениях и учебных заведениях. Наиболее значительные: Ин-т вирусологии им. Д. И. Ивановского АМН СССР, Ин-т полиомиелита и вирусных энцефалитов АМН СССР, Ин-т эпидемиологии и микробиологии им. Н. Ф. Гамалеи АМН СССР, Ин-т экспериментальной и клинической онкологии АМН СССР, Ин-т молекулярной биологии АН СССР, Ин-т микробиологии АН СССР, Всесоюзный ин-т гриппа М3 СССР, Московский научно-исследовательский ин-т вирусных препаратов М3 СССР, Свердловский научно-исследовательский ин-т вирусных инфекций М3 РСФСР, Ин-т вирусологии и микробиологии АН Украинской ССР, Одесский научно-исследовательский ин-т вирусологии и эпидемиологии им. И. И. Мечникова М3 Украинской ССР, Институт инфекционных болезней М3 Украинской ССР, Ин-т микробиологии им. А. Кирхенштейна АН Латвийской ССР; во всех научно-исследовательских ин-тах микробиологии и эпидемиологии союзных республик созданы вирусологические лаборатории и отделы.
Наиболее крупные зарубежные учреждения, проводящие научные исследования по общей и мед. В.: National Institute for Medical Research (Лондон), National Communicable Disease Centre (Атланта, США), National Institute of Health (Токио), National Institute of Health (Бетесда, США), Institute of Epidemiology and Microbiology (Прага), Institute of Virology (Братислава), Institute Pasteur (Париж), Institute Inframicrobiology (Бухарест), Institute of Virology (Глазго, Англия), State Institute of Hygiene (Будапешт), Virus Research Centre (Пуна, Индия), Queensland Institute of Medical Research (Брисбейн, Австралия).
Результаты научных исследований по общей и мед. В. публикуются в следующих научных журналах: Доклады АН СССР (Москва), Бюллетень экспериментальной биологии и медицины (Москва), Вопросы вирусологии (Москва), Журнал микробиологии, эпидемиологии и иммунологии (Москва), Вестник АМН СССР (Москва), Archiv fur die gesamte Virusforschung (Вена), Acta Virologica (Прага), Virology (Нью-Йорк), Ann. Institute Pasteur (Париж), Revue Romanine de Virologie (Бухарест), Inter. Journal of Cancer (Хельсинки), Journal of Virology (Вашингтон), Advances Virus Research (Питтсбург, США), Journal of the National Cancer Institute (Бетесда, США), Intervirology (Берн).
Первые монографии по вирусологии: Rivers Т., Filterable Viruses, Baltimore, 1928; Hauduroy P., Les Ultra Virus, Paris, 1929; Гамалея H. Ф. Фильтрующиеся вирусы, М., 1930.
Результаты научных исследований по В. обсуждаются на конференциях, сессиях, проводимых профильными ин-тами, а также на международных конгрессах.
В СССР первая научная конференция по вирусным болезням растений состоялась в марте 1935 г. в Харькове, первая научная конференция по ультрамикробам, фильтрующимся вирусам и бактериофагам — в декабре 1935 г. в Москве. В 1966 г. на 9-м Международном конгрессе по микробиологии впервые был избран Международный комитет по номенклатуре вирусов.
1-й Международный конгресс по В. состоялся в 1968 г. в Хельсинки, 2-й — в 1971 г. в Будапеште (был принят устав секции вирусологов, учрежденной в рамках Международной ассоциации микробиологов), 3-й в 1975 г. в Мадриде.
Развитие В. привело к открытию новых вирусов, количество которых быстро возрастало, в связи с чем создавались коллекции вирусов — музеи, где хранились вирусы, выделенные как в данной стране, так и полученные из других стран. Наиболее крупные коллекции вирусов: в СССР (Москва, Ин-т вирусологии АМН СССР) — Государственная коллекция вирусов, основана в 1956 г. как филиал Всесоюзного музея живых культур и условнопатогенных микроорганизмов; в США (Вашингтон) — коллекция вирусов и риккетсий, основана в 1959 г. на базе коллекции типовых культур (American type culture collection, Washington 7, Rockville, Maryland, USA); в ЧССР (Прага, Ин-т эпидемиологии и микробиологии) — Чехословацкая национальная коллекция типовых культур, основана в 1969 г. (Czechoslovak National collection of type cultures of the Institute Epidemiology and Microbiology, Prague); в Японии (Токио) — Японская коллекция культур микроорганизмов, основана в 1962 г. (The Japanes Federation of Culture collection of Microorganisms, Tokyo, Japan); в Англии (Лондон) — каталог национальной коллекции типовых культур, основан в 1936 г. (Medical Research Council, Catalog of the National collection of Type cultures, London, England); в Швейцарии (Лозанна, Международный центр живых культур) имеется международный каталог вирусов.
Преподавание Вирусологии в медицинских вузах СССР проводится кафедрами микробиологии на II и III курсах, а по вирусным инфекциям лекции и клинические занятия проводят кафедры инфекционных болезней на V курсе.
На биол, ф-тах Московского и Киевского ун-тов созданы в течение последних 10 лет кафедры В., где готовят специалистов-вирусологов и ведется преподавание В. в течение одного семестра студентам других ф-тов.
Прогресс мед. В. в СССР сопровождался ростом числа специалистов высокой квалификации: с 1946 по 1960 г. подготовлено 16 докт, наук, с 1961 по 1972 г.— 140, кандидатов наук соответственно 217 и 836 (из них 54% путем обучения в аспирантуре). Важное значение в подготовке кадров вирусологов (специализация и усовершенствование) сыграла созданная в 1955 г. кафедра В. при ЦИУ, к-рая подготовила с октября 1955 г. по 1964 г.— 688 специалистов, а с 1965 г. по январь 1974 г.— 933, гл. обр. для обеспечения вирусологической работы в сан.-эпид, станциях.
Библиография: Авакян А. А. и Быковский А. Ф. Атлас анатомии и онтогенеза вирусов человека и животных, М., 1970, библиогр.; Бешенство, под ред. В. Д. Соловьева, М., 1954, библиогр.; Гаврилов В. И., Семенов Б. Ф. и Жданов В. М. Хронические вирусные инфекции и их моделирование, М., 1974, библиогр.; Гамалея Н. Ф. Фильтрующиеся вирусы, М.—Л., 1930; Гендон Ю. 3. Генетика вирусов человека и животных, М., 1967, библиогр .; Жданов В. М. и Гайдамович С. Я. Вирусология, М., 1966; Жданов В.М.,Соловьев В. Д. и Эпштейн Ф. Г. Учение о гриппе, М., 1958; Зильбер Л. А. Учение о вирусах (общая вирусология), М., 1956; Ивановский Д. И. О двух болезнях табака, Сельское хоз. и лесоводство, т. 169, № 2, с. 104, 1892; Косяков П. Н. и Ровнова 3. И. Противовирусный иммунитет, М., 1972; Морозов М. А. и Соловьев В. Д. Оспа, М., 1948; Першин Г. Н. и Богданова Н. С. Химиотерапия вирусных инфекций, М., 1973, библиогр.; С о-ловьев В. Д. Весенне-летний клещевой энцефалит, М., 1944, библиогр.; Соловьев В. Д. и Баландин PI. Г. Биохимические основы взаимодействия вируса и клетки, М., 1969, библиогр.; они же, Клетка и вирус, М., 1973, библиогр.; Соловьев В. Д. и Бектемиров Т. А. Интерферон в теории и практике медицины, М., 1970, библиогр.; Тихоненко Т. И. Биохимия вирусов, М., 1965, библиогр.; Шубладзе А. К. и Гайдамович С. Я. Краткий курс практической вирусологии, 2-е изд., М., 1954; Шубладзе А. К., Бычкова E. Н. и Баринский И. Ф. Вирусемия при острых и хронических инфекциях, М., 1974; Comprehen sive virology, ed. by H. Fraenkel-Conrat a. R. R. Wagner, v. 1 — 4, N. Y., 1974, bibliogr.; Starke G. u. HlinakP. Grundriss der allgemeinen Virologie, Jena, 1974, Bibliogr.
Периодические издания — Вопросы вирусологии, М., с 1956; Медицинский реферативный журнал, Раздел III — Медицинская микробиология, Вирусология, Медицинская паразитология, Эпидемиология, Инфекционные болезни, М., с 1960; Acta virologica, Praha, с 1957; Archiv fiir die gesamte Virusforschung, Wein, с 1939; Excerpta medica, Section IV — Microbiology, Bacteriology, Virology, Mycology and Parasitology, Amsterdam, с 1968; Journal of General Virology, L., с 1967; Journal of Virology, Baltimore , с 1969; Virology, N. Y., с 1955.
L Плазмиды несут необязательные для клетки-хозяина гены и придают бактериям дополнительные свойства, которые могут им обеспечить преимущества по сравнению с бактериями, не имеющими плазмид.
ПЛАЗМИДЫ
L Это внехромосомная генетическая структура бактерий, представляющая замкнутое кольцо двунитевой ДНК, находящейся в цитоплазме в автономном состоянии и ориентирующаяся на передачу хромосомы, будучи с нею в интегрированном состоянии.
Конъюгативная плазмида
l Плазмиды – это очень удобная модель для генной инженерии.
Вирусы являются одним из излюбленных объектов молекулярной генетики благодаря простому строению и малой молекулярной массе их геномов, которая в 106 раз меньше массы генома эукариотической клетки. Организация генетического аппарата у ряда вирусов, например у sv40, настолько сходна с таковой генов эукариотической клетки, что пблучила название минихромосомы. Минихромосома широко используется для изучения организации и репликации ДНК.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ГЕНОМА КЛЕТКИ
В составе генома имеются структурные гены, кодирующие определенные* биополимеры (белки или РНК), и регуляторные гены, которые контролируют функцию структурных генов. Регуляция происходит с помощью белковых продуктов регуляторных генов — репрессоров, подавляющих активность структурных генов. Регуляторными участками генов, контролирующих транскрипцию, являются усилитель транскрипции (enhancer) и промотор — область, предшествующая структурным генам и определяющая место специфического связывания РНК-полимеразы.
Характерной особенностью генов эукариотической клетки является их мозаичная структура, т. е. прерывистость гена. В составе гена, кодирующего один белок, кодирующие участки прерываются вставочными последовательностями, которые не несут никакой кодирующей информации и не транслируются. Кодирующие участки гена называются экзонами, а вставки — нитронами (рис. 25).
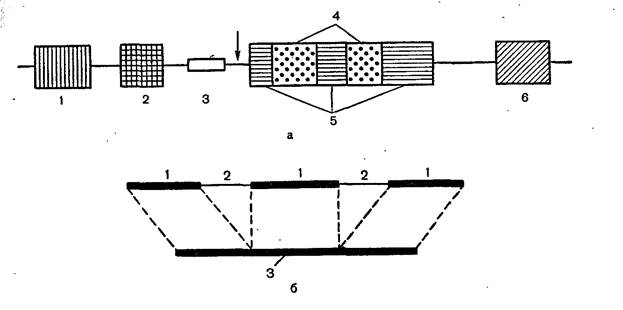
Строение эукариотического гена и его транскрипция.
а_ строение эукариотического гена 8У40: 1—усилитель транскрипции; 2—
промотор; 3— инициация репликации ДНК вируса (origin); 4— интроны; 5— экзоны (кодирующие области гена); 6— терминирующая последовательность ААТААА; стрелка обозначает участок начала транскрипции, б — схема сплайсинга при созревании иРНК: 1—экзоны, 2—интроны, 3—зрелая иРНК.

Основной особенностью вирусного генома является то, что наследственная информация у вирусов может быть записана как на ДНК, так и на РНК. Геном ДНК-содержащих вирусов двухнитевой (исключение составляют парвовирусы, имеющие однонитевую ДНК), несегментированный и проявляет инфекционные свойства. У вирусов, принадлежащих к родам Poxvirus и Hepadnavirus геном представлен двумя цепочками ДНК разной длины. Геном большинства РНК-содержащих вирусов однонитевой (исключение составляют реовирусы и ретровирусы, обладающие двунитевыми геномами) и может быть сегментированным (представители родов Retrovirus , Orthomyxovirus , Arenavirus и Reovirus ) или несегментированным.
Вирусные РНК в зависимости от выполняемых функций подразделяются на две группы. К первой группе относятся РНК, способные непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е выполнять функции иРНК и мРНК. Их называют плюс-нити РНК и обозначают как +РНК (позитивный геном). Они имеют характерные окончания (`шапочки') для специфического распознавания рибосом.
У другой группы вирусов РНК не способна транслировать генетическую информацию непосредственно на рибосомы и функционировать как иРНК. Такие РНК служат матрицей для образования иРНК, т.е. при репликации первоначально синтезируется матрица (+РНК) для синтеза -РНК. Такой тип РНК определяют как минус-нить и обозначают -РНК (негативный геном). У вирусов этой группы репликация РНК отличается от транскрипции по длине образующихся молекул: при репликации длина РНК соответствует материнской нити, а при транскрипции образуются укороченные молекулы иРНК. Молекулы +РНК проявляют инфекционность, а -РНК не проявляют инфекционные свойства и для воспроизведения должны транскрибироваться в +РНК.
Исключение составляют ретровирусы, которые содержат однонитевую +РНК, служащую матрицей для вирусной РНК-зависимой ДНК-полимеразы (обратной транскриптазы). При помощи этого фермента информация переписывается с РНК на ДНК, в результате чего образуется ДНК-провирус, интегрирующийся в клеточный геном.
ИНФОРМАЦИОННОЙ ЕМКОСТИ ВИРУСНОГО ГЕНОМА
У многих вирусов молекулярная масса синтезирующихся белков превышает теоретически рассчитанную. Этот феномен объясняется наличием у вирусов механизмов, позволяющих получить развернутую генетическую информацию при максимальной экономии генетического материала; подобные механизмы выработаны в процессе эволюции вирусов как генетических паразитов.
Способами увеличения генетической информации являются: 1) двукратное считывание одной и той же иРНК, но с другого инициирующего кодона; 2) сдвиг рамки трансляции; 3) сплайсинг; 4) транскрипция с перекрывающихся областей ДНК и др.
2) Трансляция может происходить без сдвига рамки и со сдвигом рамки. Генетический код является триплетным, это означает, что три нуклеотида, составляющих триплет, или кодон, кодируют одну аминокислоту. В том-случае, если триплеты сохранены и генетический код не изменился, то при трансляции с двух разных инициирующих кодонов будут синтезироваться полипептиды, представляющие собой укороченную копию первого полипептида (трансляция без сдвига рамки).
В том случае, если произошел сдвиг на один или два нуклеотида, образуются новые триплеты (кодоны) и появляется новый генетический код. В этом случае одна молекула иРНК может транслироваться с образованием двух уникальных белков, т. е. таких белков, у которых нет идентичных аминокислотных последовательностей.
3) Сплайсинг со сдвигом рамки широко используется у ряда вирусов (вирусы гриппа, парамиксовирусы, буньяви-русы, аденовирусы, паповавирусы, парвовирусы и др.). Один и тот же ген парамиксовирусов (вирус Сендай) кодирует два уникальных белка: структурный белок Р и неструктурный белок С.
Одним из способов экономии генетического материала является нарезание полипептида-предшественника на участки разной длины, в результате чего образуются разные полипептиды с перекрывающимися аминокислотными последовательностями. Таким образом, число реальных генов превосходит молекулярную массу генома. Основанный на длине генома расчет числа генов неизменно приведет к ошибочным результатам. Более точные представления о числе генов можно получить путем биохимического и генетического анализов.
Конечная цель генетического изучения вирусов животных — понимание деталей структуры и функции вирусного генома и каждого из генных продуктов вируса.
Методы исследования генетики вирусов.
На раннем этапе генетические исследования вирусов животных сдерживались из-за отсутствия подходящих методов исследования индивидуального потомства при смешанном заражении. Решение этой проблемы было найдено Дульбекко [32, 33], который разработал метод бляшек для цитоцидных вирусов. Использование метода бляшек позволило точно определять количество потомства, получать чистые клональные штаммы вируса и очищать вирусы от других примесных вирусов и дефектных интерферирующих частиц того же типа вируса. С помощью этого метода была получена система, пригодная для анализа условно-летальных мутаций. Таким образом, в значительной степени генетика вирусов животных началась с введения в практику метода бляшек. В настоящее время применимость метода бляшек рассматривают как необходимое условие для начала исследований генетики новой группы вирусов подобно тому, как разработка метода фокусов трансформации для нецитолитических, трансформирующих вирусов [151] послужила ключом к развитию генетических исследований этих вирусов.
При изучении регуляции синтеза вирусных нуклеиновых кислот и белков во многих системах, например у герпесвирусов, с успехом использовали ингибиторы белкового синтеза, такие как пуромицин или циклогексимид, а также ингибиторы синтеза РНК, например актиномицин Е) Разработка электрофоретических систем с высоким разрешением для анализа белков и нуклеиновых кислот позволила провести генетические исследования вирусов с сегментированным РНК-геномом, используя в качестве маркеров полиморфизм электрофоретической подвижности РНК-сегментов и белков Применение рестрикционных эндонуклеаз сыграло аналогичную роль для ДНК-содержащих вирусов с использованием в качестве генетических маркеров полиморфизма подвижности фрагментов ДНК и белков.
Методы исследования транскрипции и трансляции in vitro вирусов доказали свою эффективность при построении физических карт, особенно в системах, где отсутствует генетическая рекомбинация. В последнее время генетические приемы используют для изучения вирусного патогенеза и иммунного ответа хозяина на вирусную инфекцию, если хотят сопоставить специфические свойства вируса с индивидуальными вирусными генами и генными продуктами. Иными словами, современный генетик, изучающий вирусы животных, охотно заимствует методы у биохимика и применяет их в генетическом анализе. Наряду с этим генетики и другие специалисты используют генетический анализ для ответа на вопросы, которым традиционно не уделялось должного внимания. Такое слияние дисциплин очень помогло генетикам и в значительной мере определило быстрый прогресс этой науки в последние несколько лет.
Читайте также:

