Что такое вирус зика в сша
Обновлено: 25.04.2024

Обзор
Реконструкция оболочки вируса Зика. Карта поверхности вириона (разрешение — 3,8 Å), полученная с помощью программной обработки криоэлектронных микрофотографий, позволяет предположить, как именно вирус поражает те или иные клетки, и вычислить потенциальные мишени для терапии или компоненты для вакцины. Симметрически неэквивалентные мономеры вирусного гликопротеина Е окрашены разными цветами.
Автор
Редакторы
В эпоху глобализации из-за свободного перемещения людей по миру проникновение ZIKV в новые регионы становится неизбежным. Там он может длительно сохраняться, передаваясь от животных к животным и изредка вызывая мелкие вспышки болезни у людей, либо циркулировать в человеческой популяции. Угроза, исходящая от любого нового заболевания, зависит от его эпидемиологии, клинических особенностей и способности медицинского сообщества эффективно его контролировать (рис. 1). И сейчас огромные усилия брошены на изучение особенностей вируса Зика и механизмов его воздействия на человеческое здоровье, в особенности — на здоровье беременных [1].

Рисунок 1. Сотрудник муниципальной службы города Ресифи (Бразилия) во время операции по уничтожению комаров Aedes aegypti, переносящих вирус Зика.
Хронология событий в Зика-эпопее

Рисунок 2. Микрофотография вируса Зика, полученная с помощью трансмиссионного электронного микроскопа (ТЭМ). Вирусные частицы размером 40 нм окрашены синим цветом.
В Энтеббе расположен Угандийский исследовательский институт вирусологии (Uganda Virus Research Institute, UVRI), чьи сотрудники в 1947 году при изучении желтой лихорадки в лесу Зика выделили из крови макаки до тех пор неизвестный флавивирус. Ученые описали его как вирус Зика (рис. 2). А на следующий год обнаружили вирус в комарах Aedes africanus [3].
В 1952 году вирус выявили уже у людей — в Уганде и Танзании, а в 1954 году — в Нигерии. ZIKV четко ассоциировался с лихорадкой и кожной сыпью, в связи с чем его окончательно объявили патогенным для человека. Тогда же, в 50-е, экспериментальным путем с участием добровольцев установили основного переносчика вируса — комара Aedes aegypti, обычного переносчика желтой лихорадки, лихорадки денге и чикунгуньи. Позже компанию ему составили и другие виды, в том числе Aedes albopictus [1].
В 60–80-е годы легкие формы инфекции выявляли в странах Африки, Азии и в Индии. Длительное присутствие ZIKV в этих регионах подтверждалось обнаружением вируса в комарах и нечеловекообразных обезьянах. У людей до 2007 года фиксировали не так много клинических случаев, и потому система здравоохранения не спешила бить тревогу [4].
Первую крупную вспышку лихорадки Зика зарегистрировали в 2007 году на острове Яп в тихоокеанских Федеративных штатах Микронезии, где инфицированными оказались 73% населения, однако симптомы у подавляющего большинства были умеренными и недолгими. Следующая вспышка охватила в 2013–2014 годах Французскую Полинезию, где заразились 66% жителей. Одновременная волна заболеваемости синдромом Гийена-Барре подняла вопрос о его ассоциации с вирусом Зика: тогда зафиксировали 42 случая — а это на порядок больше, чем в 2012 году, когда синдром диагностировали у троих [1].
К 27 июля ZIKV циркулировал уже в 67 странах и территориях (рис. 3). Крупная вспышка заболевания произошла в Колумбии — там заразились 65 000 человек. У многих из них выявлялись неврологические синдромы, отмечались и случаи микроцефалии [1].
В июле 2016 зафиксировали две смерти, связанные с заражением ZIKV: в США и Пуэрто-Рико. Предполагают, что смерти вызвал не сам вирус, а обострившиеся во время лихорадки симптомы хронических заболеваний.
В середине августа 2016 года в Пуэрто-Рико ввели режим чрезвычайной ситуации, поскольку распространение вируса набирало обороты слишком быстро: за полгода (с декабря 2015 по 12 августа 2016) число заразившихся возросло с одного до 10 000 человек.
К 1 сентября в американской Флориде зарегистрировали 47 случаев заболевания, а в Майами-Бич впервые в США обнаружили трех комаров — переносчиков вируса Зика.

Рисунок 3. История распространения вируса Зика по миру.
В Россию впервые вирус завезли в феврале 2016 года из Доминиканской республики. За прошедшие месяцы отмечены еще 7 случаев. Все — у туристов, вернувшихся из стран, где распространяется ZIKV: большинство — из Доминиканской республики, один — с Карибских островов. Все пациенты благополучно перенесли лихорадку.
Патогенез лихорадки Зика
Передача вируса и развитие болезни
Какие-то симптомы появляются у меньшинства инфицированных: на острове Яп лишь 19% заразившихся сообщили о симптомах, а во Французской Полинезии — 26%. Если признаки лихорадки развиваются, то в 95% случаев это происходит через 6–11 суток после заражения (рис. 4). Симптомы сходны с проявлениями других подобных инфекций [1], [4]:
- повышенная температура тела;
- кожная сыпь;
- боль в суставах и мышцах;
- головная боль;
- конъюнктивит;
- отеки;
- иногда рвота;
- общее недомогание.

Рисунок 4. Схема протекания инфекции у человека и комара. В среднем признаки развиваются на шестой день после инфицирования. Примерно на девятый день начинается выработка иммуноглобулинов (антител): первым обнаруживают IgM, количество которого позже снижается одновременно с ростом концентрации IgG. Последний сохраняется в крови неопределенное время. Виремия, вероятно, возникает до появления симптомов, и ее продолжительность сказывается на риске инфицирования восприимчивых комаров, кусающих зараженного человека. После определенного инкубационного периода комар приобретает способность передавать возбудителя другим людям. Tg — интервал между эпизодами инфицирования первого и второго человека.
Виремия, или вирусемия — медицинское состояние, когда вирусы попадают в кровоток и могут распространяться по всему телу, — аналогично бактериемии, при которой в кровь попадают бактерии [9]. — Ред.
В клетку вирус Зика проникает, взаимодействуя с определенными рецепторами на ее поверхности. Основной из них — AXL. А посредником выступает рецептор TIM-1, который связывает вирусные частицы и транспортирует их к AXL, способствующему проникновению вируса в клетку. Однако TIM-1 не необходимое звено, он лишь повышает концентрацию вирионов на поверхности клетки и ускоряет их взаимодействие с AXL [10].
Когда вирус оказывается внутри клетки, она отвечает повышенной продукцией интерферонов IFN-α и IFN-β, а также хемокинов CXCL10 и CXCL11, которые играют важную роль во врожденном и адаптивном иммунитете. Эти хемокины привлекают Т-клетки и другие лейкоциты к месту воспаления и даже оказывают прямое антимикробное действие, когда их концентрация в кожных фибробластах сильно повышается [10].
Антитела к вирусу обнаруживают в крови уже на девятый день после заражения. Продолжительность иммунитета против ZIKV пока не известна, но, судя по другим флавивирусам, можно предположить, что он пожизненный [1].
Вирус Зика и беременность
Однако установить связь между ZIKV и микроцефалией оказалось достаточно сложно из-за нескольких обстоятельств:
- остается неясным, сколько беременностей затронул вирус — инфекция ведь часто бессимптомна;
- до сих пор нет четкого определения микроцефалии;
- существуют другие инфекционные агенты, вызывающие микроцефалию: цитомегаловирус и Rubella virus (вирус краснухи).
Симптомы инфекции у беременных женщин такие же, как и у остальных, но пока не известно, влияет ли на частоту их проявления иммунодефицит, характерный для этого периода. Результаты исследований, касающихся неблагоприятных последствий заболевания для эмбриона, очень разнородны: где-то у 29% беременных с симптомами болезни развивался эмбрион с микроцефалией, а где-то и у 74%. Возможно, такие расхождения возникли потому, что в исследованиях участвовало недостаточное количество пациентов — меньше 50 человек. С определенной уверенностью можно утверждать лишь то, что ZIKV-ассоциированная микроцефалия разовьется у плода одной из ста инфицированных в первый триместр женщин независимо от наличия симптомов, и этот риск становится незначительным во второй и третий триместры [1].
Помимо микроцефалии с вирусом Зика сейчас связывают и другие эмбриональные патологии [1]:
- внутричерепной кальциноз; ;
- дефекты органа зрения;
- гипоплазию ствола мозга; ; .
Устройство вируса Зика
Организация генома
К концу августа 2016 года в GenBank хранилось 67 полных последовательностей генома ZIKV. Вирус Зика содержит кодирующую молекулу РНК длиной 10,8 т.н. с одной ORF (открытой рамкой считывания), фланкированной нетранслируемыми участками (UTR) — 5′-UTR длиной 106 н. и 3′-UTR длиной 428 н. (рис. 5). ORF кодирует полипротеиновый предшественник, который впоследствии разделяется на три структурных белка (капсидный [С], премембранный [prM] и оболочечный [E]) и семь неструктурных (NS1, NS2A, NS2B, NS3, NS4A, NS4B и NS5). Вирусный полипротеин во время трансляции и/или после нее расщепляется вирусной протеазой, сигнальной пептидазой и неизвестной протеазой клетки-хозяина. Фрагмент pr затем, при производстве зрелых вирионов, обычно отсекается в аппарате Гольджи фурином [17].

Рисунок 5. Геном вируса (представлен в виде последовательности кодируемых РНК белковых продуктов). Структурные белки окрашены серым цветом, неструктурные синим. Цифрами обозначены длины белков (число аминокислотных остатков). Стрелки указывают на места расщепления полипротеина.
Основные белки
Белок E — главный поверхностный гликопротеин флавивирусов, а неструктурные белки NS3 и NS5 — основные ферменты вирусной репродукции [17]. Структура этих белков показана на рисунке 6.

Рисунок 6. Структура главных белков ZIKV.
Белок Е разделен на два структурных региона — стволовой и трансмембранный (на рис. 6 — stem и ТМ) — и три функциональных домена: домен I участвует в организации оболочки (рис. 7), домен II отвечает за взаимодействие мономеров, а домен III связывает клеточный рецептор.
NS3 состоит из протеазного и хеликазо-НТФазного доменов, которые осуществляют процессинг вирусного полипротеина и раскручивание структурированных участков во время синтеза вирусной РНК.
NS5 содержит метилтрансферазный домен, который метилирует 5’-CAP-участок геномной РНК, и домен РНК-зависимой-РНК-полимеразы (RNA dependent RNA polymerase, RdRp).

Рисунок 7. Трехмерная модель вируса Зика в атомном разрешении, созданная в студии биомедицинской визуализации Visual Science. Модель построена по данным научных публикаций об организации вируса Зика и родственных вирусов и считается наиболее достоверной на текущий момент.
Известно, что гликозилирование играет важную роль в инфекционности, созревании и вирулентности флавивирусов [18], [19]. Для вируса Зика предсказаны потенциальные участки для N- и O-гликозилирования в белках prM, E, NS1 и NS4B, которые гликозилируются и в других флавивирусах. Исследования, посвященные роли этих сайтов в жизненном цикле вируса Зика, еще только планируются [17]. Правда, уже обнаружено одно структурное отличие белка Е ZIKV от подобных белков других флавивирусов — выставленная на поверхность вирусной частицы аминокислотная петля, с которой в позиции Asn154 связывается гликан (см. видео). Предполагают, что именно эта петля вместе с прикрепленным сахаром может отвечать за тропизм вируса (взаимодействие с рецепторами определенной группы клеток) и патогенез болезни [20].
Отличие в структуре белка Е ZIKV от гомологичных белков других флавивирусов.
исследовательская группа Университета Пердью, США
Борьба с вирусом Зика
Диагностика
Основные проблемы диагностики ZIKV-инфекции — это значительное количество бессимптомных случаев и неспецифичность симптомов: лихорадка денге и чикунгунья, которые тоже переносятся комарами рода Aedes, проявляются подобным образом. Предположить заражение вирусом Зика можно, если симптомы появляются у человека, который недавно побывал или длительно проживал в районе циркуляции ZIKV [1], [4].
Лучшим решением был бы высокоспецифичный тест на антитела, который можно использовать не только для подтверждения инфицированности, но и для проверки иммунитета против вируса Зика в самом начале беременности, что позволило бы женщинам понять степень риска. Однако такое тестирование осложняется кросс-реактивностью с другими флавивирусами. Определенные надежды дает тест ELISA. Например, IgG-ELISA, применяемый во Французской Полинезии, где циркулирует вирус денге, еще до основной вспышки лихорадки Зика выявлял ZIKV-позитивных доноров крови (тогда их было <1%) [1].
Профилактика
Основной способ — это защита от укусов комаров, в том числе и с помощью контроля их распространения.
В регионах циркуляции вируса Зика и потенциально опасных зонах людям рекомендуют носить светлую одежду, закрывающую как можно больше поверхности тела, устанавливать на окна и двери домов противомоскитные сетки, использовать сетку во время сна, а также применять репелленты с ДЭТА, IR3535 или икаридином [4].
Самки комаров Aedes после насыщения кровью откладывают яйца, которые в безводной среде могут сохраняться до года. Даже в минимальном количестве воды из яиц выходят личинки и дальше развиваются во взрослых особей. Потому для контроля численности и распространения комаров необходимо постоянно отслеживать и ликвидировать места их размножения: ведра, бочки, горшки с водой, сточные канавы, использованные автомобильные покрышки. В особых случаях прибегают к распылению инсектицидов [4].
Пример эффективного контроля численности переносчика вирусов — действия Уильяма Горгаса по ликвидации эпидемии желтой лихорадки в Гаване и регионе Панамского канала в начале XX века. Этот американский военврач и его команда устроили жестокую борьбу с антисанитарией и обработали все здания и улицы инсектицидами (от которых, к слову, пострадало и немало жителей). В результате желтая лихорадка была полностью побеждена [21].
В 50-х и 60-х годах в государствах Америки применяли интенсивные меры по контролю переноса возбудителя желтой лихорадки, включая повсеместное распыление ДДТ. Это привело к устранению Aedes aegypti из 18 стран и значительно сократило область распространения заболевания. Позже подобные программы успешно осуществили Сингапур и Куба. Конечно, через некоторое время лихорадка вернулась, но даже краткосрочный период без инфекции имел большое значение для населения [1].
Чтобы сократить риск передачи ZIKV половым путем (особенно во время беременности), мужчинам, проживающим в зонах циркуляции вируса или недавно побывавшим там, ВОЗ рекомендует пользоваться презервативами или воздерживаться от половой активности на всём протяжении беременности партнерши [4].
Лечение
Обычно заболевание протекает в легкой форме и не требует специального лечения. Во время лихорадки необходим отдых и обильное питье, иногда — прием препаратов для устранения боли и других неприятных симптомов [4].
Тем не менее существуют вещества, которые оказывают воздействие и на сам вирус Зика. Например, эффективно подавляет репродукцию вируса in vitro 2′-C-метиладенозин, а 7-деаза-2′-C-метиладенозин (МК-608) ингибирует репликацию ZIKV in vitro и затормаживает развитие болезни в экспериментах на мышах. Препараты 2′-C-метилцитидин, рибавирин, фавипиравир и T-1105 ослабляют цитопатическое действие вируса и снижают его урожай [22], [23].
Разумеется, вакцина решила бы проблему кардинально, но она до сих пор не разработана. Сейчас исследованиями занимаются 18 коммерческих компаний и исследовательских институтов [24–26]. Однако первая фаза клинических испытаний стартует не раньше конца 2016 года, а значит, готовая вакцина появится еще не скоро, и распространение инфекции по миру продолжится [1].
Заключение
Хотя всевозможные случайности в эволюции вирусов делают точный прогноз пандемий практически невозможным, научный мир пытается повышать скорость реакции на новые угрозы. В ближайшее время усилия биологов и медиков сосредоточатся на разработке единой стратегии, которую в любой момент можно было бы применить к той или иной вспышке заболевания. Такая стратегия позволит быстро разобраться в путях передачи, патогенезе и способах контроля инфекции, чтобы предотвратить ее глобальное распространение.

Обзор
Фотография жизнерадостного молотоголового крылана, потенциального переносчика вируса Эбола.
Автор
Редакторы

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Рисунок 1. Информационный плакат о вирусе Эбола.
Геморрагическая лихорадка Эбола — острая вирусная болезнь с высокой заразностью, которая характеризуется развитием тромбогеморрагического синдрома. Он выражается в снижении числа лейкоцитов (белых кровяных тел, частично отвечающих за иммунитет) у больного и, как следствие, — в уменьшении сопротивляемости организма инфекции; а затем и в снижении количества тромбоцитов, что приводит к нарушению свертываемости крови и, нередко, нарушению целостности сосудистой стенки и кровоизлияниям.
Вирус Эболы (рис. 1, 2) вызывает тяжелое заболевание с острым течением, которое обладает близкой к абсолютной летальностью в отсутствие лечения и средней — порядка 60% от всех заболевших — для пациентов, получающих симптоматическое лечение [1]. Распространяясь через физиологические жидкости больных или умерших людей и животных, а также через загрязненные биологическим материалом предметы, болезнь быстро поражает членов одной семьи или деревни после проявления симптомов инфекции. Низкая плотность населения в Африке — один из немногих естественных барьеров для передачи болезни, но представьте только потенциальную активность этого потрясающего патогена в городских условиях развитых стран! Вирус также разносится естественными носителями, обитателями влажных тропических лесов — крыланами (рис. 3), очаровательными летучими мышами, употребляемыми местными жителями в пищу.
Рисунок 2. Схема структуры вируса Эбола с изображением вирусной РНК и относительным расположением участков, кодирующих его элементы.
Рисунок 3. Крылан молотоголовый, естественный носитель вируса Эболы.
На первом этапе, наступающем через 6–10 дней после контакта с зараженным материалом [2], заболевшие (рис. 4) испытывают симптомы, схожие с другими распространенными в тропических странах заболеваниями, такими как малярия, тифоидная лихорадка (брюшной тиф) и менингит. А именно, у больного наблюдаются повышенная утомляемость, слабость, лихорадка с повышением температуры свыше 38 о С и боли в теле. Спустя еще некоторое время проявляются симптомы обыкновенных кишечных инфекций — тошнота, боли в животе, рвота и диарея.
Рисунок 4. Две медсестры около кровати с больным лихорадкой Эбола. Позднее пациент скончался.
Настоящий ад для заболевших начинается примерно через неделю после проявления первых характерных симптомов. До этого момента, без возможности сделать ПЦР-тест, геморрагическую лихорадку Эбола невозможно обнаружить.
Q-ПЦР (или количественная полимеразная цепная реакция ) — метод молекулярной биологии, позволяющий создать копии определенного фрагмента ДНК из исходного образца, повысив его содержание в пробе на несколько порядков. Он применяется с целью увеличения количества РНК вирусных частиц в пробе и их последующего детектирования посредством взаимодействия с флуоресцентным красителем и регистрации излучения оптическими системами.
Через неделю после проявления первых симптомов лихорадки у больных начинается стадия обильных кровотечений. Вирус Эбола вызывает некоторое снижение свертываемости крови, что в условиях жизни африканских народов в естественном ареале распространения инфекции может провоцировать сильные кровотечения в желудочно-кишечном тракте из-за особенностей слизистых оболочек тонкого и толстого кишечника в десяти процентах случаев, а обильное кровотечение из прочих слизистых — практически в каждом втором. Это приводит к наличию крови в рвоте, кашле и стуле, что многократно повышает заразность заболевания [4].
Как же трактовать частоту появления кровоизлияний? С точки зрения чистой статистики, одна десятая численности — небольшое количество, однако это потенциальные три сотни человек при многотысячной вспышке, подобной той, что была последней в ДРК на текущий момент, которые могут истекать кровью на улице, загрязнять предметы зараженной кровью и разносить инфекцию по округе. Слоняясь в умирающих деревнях, они могут неумышленно распространить вирус на людей, остановившихся с целью помочь и облегчить страдания кажущегося раненным измученного африканца. Инкубационный период болезни вполне может позволить таким туристам покинуть очаг эпидемии.
Именно этот обзор привлек внимание и вызвал оправданное беспокойство нескольких групп эпидемиологов, в том числе американских, к опасности заболевания, возбудитель которого был быстро отнесен к первой группе патогенности.
Рисунок 5. Карта распространения вируса Эбола во время вспышки в 2013–2016 годах.
Текущая обстановка в регионах распространения заболевания остается напряженной: вспышка 2018–2019 годов окончилась при поддержке экспериментальных вакцин как на основе модифицированной ДНК, содержащей гены нуклеопротеинов и гликопротеинов вируса Эболы, так и посредством наиболее свежих на тот момент разработок — векторных вакцин на основе рекомбинантных вирусов .
Параллельно с этим больным оказывалась симптоматическая медицинская помощь в полевых госпиталях и предоставление гуманитарной помощи для находящихся на карантине пострадавших стран. К несчастью, испытания и лечение больных сопровождались вооруженными нападениями на госпитали из-за продолжающейся гражданской войны в ДРК, что неоднократно подрывало миссию медиков и поиск эффективного лечения заболевания и тестирования противовирусных препаратов [8].
Что же такое Инмазеб?
Данный трехкомпонентный препарат состоит из натуральных человеческих специфических антител, которые взаимодействует с гликопротеинами вируса Эбола и блокируют его внедрение в клетки человека, что способствует снижению скорости репликации вирусных частиц и уменьшает тяжесть течения заболевания [10]. В сочетании с имеющимися протоколами лечения болезни, вызываемой вирусом Эбола, это значительно увеличивает эффективность терапии.
Антитела — это крупные глобулярные белки плазмы крови, выделяемые плазматическими клетками иммунной системы и предназначенные для нейтрализации клеток патогенов (бактерий, грибов, многоклеточных паразитов) и вирусов, а также белковых ядов и некоторых других чужеродных веществ. Каждое антитело распознает уникальный элемент патогена, отсутствующий в самом организме, — антиген, а в пределах данного антигена — определенный его участок. Связываясь с антигенами на поверхности патогенов, антитела могут либо непосредственно нейтрализовать их, либо привлекать другие компоненты иммунной системы, чтобы уничтожить чужеродные клетки или вирусные частицы.
Для нейтрализации перечисленных выше патогенов организмом вырабатывается смесь антител, направленных на специфическое связывание с инородными веществами, однако в ряде случаев, а именно — при создании медицинских препаратов узкого спектра действия требуется выделить один компонент из настоящего сонма различных белков, продуцируемых клетками иммунной системы с весьма ограниченным сроком жизни.
Рисунок 6. Строение и типы антител с указанием структурно значимых участков.
О потенциально успешном применении моноклональных антител сообщалось во время ранних клинических препарата ZMapp для лечения лихорадки Эбола [16], и хотя его эффективность не была полностью подтверждена, именно усилия создателей данного лекарственного средства и несколько спасенных жизней показали один из возможных путей борьбы с данной инфекцией. Так начались поиски эффективного типа антител для подавления или ослабления вируса с целью облегчения течения болезни и ее лечения.
Впервые препарат REGN-EB3 был применен в качестве экспериментального лечения во время вспышки заирского эболавируса в 2018 году как на взрослых пациентах, так и на детях параллельно с проведением третьей части клинических испытаний препарата [17]. Согласно данным предварительных исследований, рекомендуемая дозировка для каждого компонента препарата составила 50 мг/кг, однако по завершении вспышки и сбора данных рекомендуемая дозировка была поднята до 100 мг/кг. Препарат разводят перед применением и однократно вводят пациенту внутривенно [18].
Научная сторона исследований
Препарат REGN-EB3, состоящий из антител атолтивимаб (REGN3470), мафтивимаб (REGN3479) и одесивимаб (REGN3471), показал высокое сродство к гликопротеинам вируса Эболы как in silico — при моделировании его активности путем молекулярного докинга, — так и in vivo — при испытании на животных и на людях. Данные электронной микроскопии показали, что при одновременном применении трех типов антител, их связывание с гликопротеином происходит на различных участках, что полностью изменяет свойства белка [18].
Антитела группы атолтивимабов и мафтивимабов успешно нейтрализовали псевдовирусные частицы (клетки, снабженные гликопротеинами вируса Эболы) при сравнительно небольших концентрациях в крови, однако применение одного одесивимаба имело несколько меньший эффект, несмотря на его наибольшее сродство к белковой структуре антигена. Одновременное применение препарата, содержащего все три группы антител, показало полную защиту подопытных животных от летального исхода на пятый, восьмой и одиннадцатый день течения болезни в сравнении с контрольной группой, которой препарат не вводили [18], [19]. Последовательное изучение влияния дозировок препарата на эффективность лечения показало, что минимальная эффективная доза в 100 мг/кг является наименьшей для лучшего контроля за симптомами инфекции [19].
В ходе клинических испытаний препарата, проведенных во время вспышки 2018–2019 годов в ДРК, было обнаружено снижение средней летальности с 50 до 27% и уменьшение общей вирулентности патогена в ходе мутаций в естественной среде обитания, что, несомненно, показывает эффективность препарата в лечении заболевания, однако все еще предполагает комбинированную терапию для достижения наилучшего результата с минимальным количеством летальных исходов.
Обнаруженные во время клинических испытаний побочные эффекты от применения препарата REGN-EB3 включали в себя лихорадку, озноб, тахикардию, учащенное дыхание и другие симптомы (рис. 6), характерные для геморрагической лихорадки Эбола средней тяжести. Полное описание свойств и особенностей представлено на странице 177 опубликованного отчета [9].
Дальнейшие планы
Согласно данным Национальной библиотеки медицины США, протокол клинических испытаний NCT03576690 был одобрен к проведению 14 октября 2020 года, и по настоящее время проводится проверка препарата для лечения болезни, вызываемой заирским эболавирусом, в рамках расширенных клинических испытаний. К исследованиям допускаются люди всех возрастов и полов, которые имеют положительный результат ПЦР-теста и не обладают противопоказаниями к применению представленного протокола лечения геморрагической лихорадки Эбола. Также стоит отметить разрешение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США на включение в перечень допущенных до тестирования субъектов беременных женщин, инфицированных вирусом Эбола.
Несмотря на наличие вакцины от болезни, вызываемой вирусом Эбола у многих стран мира, считается, что ей необходимы дополнительные клинические испытания на людях. Параллельно с этим проводятся расширенные клинические исследования препарата моноклональных антител для терапии больных людей. Всё вместе это отражает стремление ученых к созданию не только средств для предотвращения поражения людей этим смертельно опасным вирусом, но и способов лечения для лиц в зоне риска, а именно — жителей Западной Африки, находящихся далеко от пунктов медицинской помощи. Создание единого комплекса мер по противодействию лихорадке Эбола может стать одним из ключей, необходимых жителям африканских республик для дальнейшего развития в неблагоприятных условиях жизни.

Откуда взялся
Впервые с вирусом Зика исследователи столкнулись в 1947 году: у макаки-резус, которую ученые держали в клетке в лесу Зика в Уганде ради изучения желтой лихорадки, обнаружили неведомую болезнь. К слову, сам лес находится на территории Угандийского института по изучению вирусов (UVRI), основанного в 1936 году фондом Рокфеллера.
Первая работа, посвященная описанию вируса и тому, как его идентифицировать, была опубликована теми же исследователями в 1952 году. Спустя два года первый случай заболевания вирусом Зика у человека был зафиксирован в Нигере. Уже тогда ученые поняли, что переносчиками недуга являются комары рода Aedes: они распространены по всей Земле в тропических и субтропических зонах. Свои выводы исследователи подтвердили в лаборатории, используя для опытов обезьян и мышей.
Активное изучение заболевания продолжалось вплоть до 1958 года, преимущественно в полевых условиях в Африке. С 1951-го по 1981 годы вирус Зика обнаруживали в Уганде, Танзании, Египте, Центральной Африканской Республике, Сьерра-Леоне, Габоне, Кот д’Ивуаре и Сенегале. Однако заболевание не смогло остаться в рамках одного континента: вскоре случаи заболевания вирусом Зика зафиксировали в Индии, Малайзии, Филиппинах, Таиланде, Вьетнаме и Индонезии. Последняя крупная работа, посвященная методике диагностирования вируса, была опубликована в 1988 году.

Комары Aedes aegypti переносят вирус Зика
Фото: Andre Penner / AP
Прошло много лет, прежде чем недуг проявил себя снова: в 2007 году вспышку вируса зафиксировали в Микронезии и Полинезии. В результате этого никто не умер, однако распространение вируса Зика среди жителей острова Яп площадью 56,15 квадратных километра указало специалистам на потенциальную опасность вируса.
Впоследствии подхвативших вирус Зика людей обнаруживали на островах Пасхи, Кука и в Новой Каледонии. Уже тогда у врачей возникали сложности с диагностикой: первоначально они принимали вирус Зика за лихорадку денге, вирус Чикунгунья и лихорадку Росс-Ривер.
В Южную Америку вирус Зика попал из Африки или Азии в 2015 году. И оказалось, что на континенте идеальные условия для масштабного распространения вируса. Так, в Бразилии пик заболеваемости пришелся на осень 2015 года. С тех пор он успел распространиться по всей Южной Америке (вне зоны риска осталась лишь одна страна — Чили). Первый случай заболевания уже зафиксирован в Соединенных Штатах: в зоне риска вся Северная Америка за исключением Канады. Кроме того, нельзя исключать эпидемию в Индии и Юго-Восточной Азии.
Несмертельная опасность
Вирус Зика относится к числу несмертельных, а вызываемая им лихорадка довольно легко переносится. У недуга имеются характерные для многих других заболеваний симптомы: легкая головная боль, макулопапулезная (кореподобная) сыпь, лихорадка, недомогание, конъюнктивит и боли в различных частях тела. Тем не менее ни лекарств, ни вакцины против вируса Зика пока не существует. Две крупные фармацевтические компании (Glaxosmithkline и Sanofi SA) только рассматривают возможность создания вакцины.
Несмотря на то что вирус Зика еще не убил ни одного человека, существует целый ряд причин его опасаться, особенно беременным женщинам. Главной из них является микроцефалия у плода — врожденное уменьшение размеров мозга и черепа, которое приводит к умственной отсталости. Хотя причинно-следственная связь между перенесенной во время беременности лихорадкой Зика и микроцефалией пока не установлена, косвенные данные заставляют ученых такую связь увидеть. Так, в 2015 году в Бразилии было отмечено 4 тысячи случаев микроцефалии у новорожденных — это в 30 раз больше, чем в 2014-м и 2013 годах.
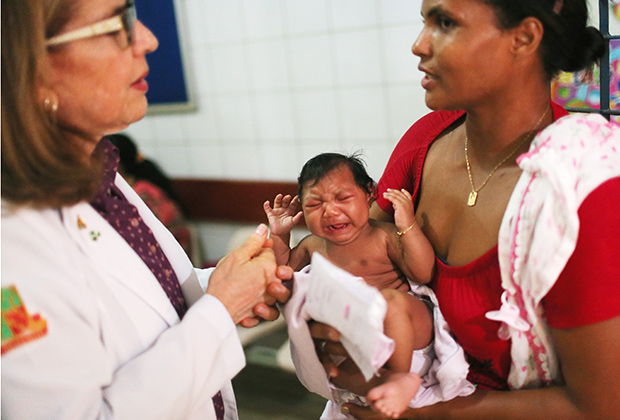
Вирус Зика может быть опасен для беременных женщин и будущих детей
Фото: Mario Tama / Getty
Кроме того, существует предположение, что вирус Зика может передаваться половым путем. Подтверждений этой версии пока нет, однако специалисты ряда стран (Эквадора и Бразилии) призвали женщин не заводить детей в ближайшие три года после болезни. Кроме того, большинство стран Европы, а также Соединенные Штаты, рекомендуют беременным женщинам не ездить в Латинскую Америку.
Второй опасностью вируса Зика является синдром Гийена–Барре, то есть остро развивающееся демиелинизирующее заболевание периферической нервной системы, проявляющееся в виде парестезии конечностей, слабости мышц и вялых параличей. Несмотря на то что в большинстве случаев происходит полное выздоровление, некоторые люди после этого приобретают паралич на всю жизнь. Кроме того, есть вероятность проявления дыхательной недостаточности вплоть до летального исхода.
Летом 2016 года в Бразилии состоятся летние Олимпийские игры. Власти страны обещают побороть пандемию лихорадки до их начала, однако как они будут это делать, пока не ясно.
Биологи из Иммунологического института Ла-Хойи (Калифорния, США) обнаружили новые опасные мутации вируса Зика. Выводы исследования описаны на сайте института.
В ходе работы ученые вводили зараженные вирусом клетки насекомых в организм подопытных мышей. Затем специалисты извлекали из организма животных вирионы, вводили их в клетки комаров и повторяли этот цикл. В результате оказалось, что в геноме вируса Зика достаточно быстро образовывались мутации. Через десять таких циклов биологи получили два новых штамма: ZN-p10 и ZDI-p10. Более подробное изучение этих вариантов выявило повышенную контагиозность (заразность) для людей и животных. Также анализ выявил, что эти штаммы способны вызывать сильную лихорадку, смерть, а также гибель плода в утробе беременных самок.

За возникновения мутаций, как выяснилось, ответственны изменения в гене NS2B, который отвечает за производство вирусных белков, которые являются основой новых вирусных частиц, а также подавляют врожденный иммунитет.
Полученные результаты, считают ученые, говорят об острой необходимости вести постоянный контроль научного мирового сообщества за развитием новых мутаций вируса.
Вирус Зика впервые был обнаружен в 40-х годах XX века в организме комара Aedes aegypti в Уганде. Последняя крупная вспышка заболеваемости произошла в 2015-2016 годах в Латинской Америке. Тогда специалисты обнаружили, что у заболевших вирусом Зика в утробе матери детей проявляется микроцефалия.
Читайте также:

