Генно инженерные противовирусные вакцины
Обновлено: 26.04.2024
По данным ВОЗ около 11 млн. (19%) из 57 млн. людей, умерших в 2002 г., погибли от инфекционных заболеваний [WHO, 2004]. Такие впечатляющие масштабы воздействия патогенов на человеческую популяцию объясняются как минимум двумя причинами. Перенаселенность территорий и развитость транспортных коммуникаций создают благоприятные условия для быстрого распространения особо опасных инфекций не только в пределах одного или нескольких соседствующих государств, но и на географически отдаленных территориях.
Мировое сообщество постоянно находится в ожидании возникновения новых эпидемий или даже пандемий (примером может служить мощный общественный резонанс, связанный со вспышками таких инфекций, как SARS, птичий грипп, сибирская язва, эбола и др.), в связи с чем разработка современных средств защиты от патогенов является одной из важнейших его задач.
Одним из наиболее надежных способов защиты населения от патогенов является вакцинация. На сегодняшний день созданы вакцины против 34 социально значимых инфекций. Применение этих вакцин в медицинской практике привело к снижению уровня заболеваемости дифтерией, корью, столбняком, туляремией, полиомиелитом и явилось причиной исчезновения такой опасной инфекции, как оспа. Однако, несмотря на очевидные успехи вакцинопрофилактики, созданы только 34 вакцины, тогда как для остальных более чем 400 известных патогенов человека эффективных превентивных средств пока не создано.
Как известно, эффективность вакцинации связана с индукцией протективного гуморального и/или клеточного иммунного ответа, который в свою очередь определяется особенностями структуры антигенов патогенов, против которого происходит вакцинация, а также характером взаимодействия микроорганизма с системой врожденного иммунитета. В настоящее время успешно используются вакцины против патогенов, вызывающих остро текущие инфекции. Для латентных или хронических заболеваний, вызываемых такими возбудителями, как ВИЧ, герпес-вирус человека, вирус гепатита С, микобактериями туберкулеза и др., а также для болезней, вызываемых микроорганизмами, характеризующимися внутривидовой изменчивостью (серологические варианты, антигенный дрейф или сдвиг, смена вариантов специфических антигенов), эффективных профилактических вакцин не создано. Очевидно, что для получения превентивных препаратов против этих инфекций необходимо детальное понимание биологии и патогенеза каждого конкретного возбудителя и разработка индивидуальных подходов создания профилактических и терапевтических препаратов.
Успехи в таких областях знаний, как молекулярная биология, иммунология и микробиология, способствовали разработке новых и перспективных направлений защиты от патогенов. Особого внимания заслуживают следующие три направления: 1) генно-инженерные профилактические вакцины и терапевтические средства защиты от патогенов, 2) иммуномодуляторы, способные активировать систему иммунитета через активацию Толл-подобных рецепторов, 3) средства пассивной иммунизации (гуманизированные моноклональные антитела).
Генно-инженерные вакцины подразделяются на 2 типа: субъединичные (протективные антигены различных возбудителей, экспрессированные в дрожжах или E.coli) и генетические. "Генетические" вакцины в свою очередь делятся на ДНК-вакцины и вакцины, базирующиеся на вирусных и бактериальных векторах (реже в качестве системы экспрессии используются растительные клетки). В отличие от большинства традиционных инактивированных вакцин, "генетические" вакцины способны индуцировать клеточный и гуморальный иммунный ответ, а также могут использоваться не только в превентивных, но и в терапевтических целях для лечения некоторых аутоиммунных заболеваний, аллергических состояний, злокачественных новообразований.
Опыт работы исследователей различных стран с кандидатными генно-инженерными вакцинами показывает, что наибольший протективный эффект наблюдается при комбинированном способе иммунизации (прайм-буст иммунизация). Первый этап - праймирование иммунного ответа (индукция клеточного иммунитета), второй этап - бустирование иммунного ответа (индукция гуморального иммунного ответа). При этом возможны различные комбинации прайм-буст агентов (ДНК-вакцина - рекомбинантный белок, ДНК-вакцина - рекомбинантный аденовирус, рекомбинантный аденовирус - рекомбинантный белок и др). Активация сильного иммунного ответа при использовании системы прайм-буст иммунизации кандидатными генно-инженерными вакцинами была показана по отношению к патогенам, вызывающим туберкулез, герпес, малярию, СПИД и др.
В настоящее время в США и странах Европы десятки генно-инженерных вакцин находятся в различных фазах клинических исследований. Из них две находится на 3-й фазе клинических испытаний (вакцины против ВИЧ и папилломы). Три генно-инженерные вакцины (против вируса гепатита В, боррелиоза и вируса бешенства) используются в медпрактике для вакцинации. Такое небольшое количество утвержденных и лицензированных генно-инженерных вакцин объяснить достаточно просто. История создания генно-инженерных вакцин насчитывает около 20 лет. С учетом того, что предклинические и клинические испытания новых вакцин занимают более 10 лет, очевидно, что в настоящий момент многие генно-инженерные вакцины находятся на стадии испытаний или утверждения. В связи с этим, в ближайшие 5-10 лет ожидается внедрение в медпрактику целого ряда лицензированных генно-инженерных профилактических вакцин. В качестве свежего примера можно привести недавнее утверждение комитетом FDA (Food and Drugs Administration) новой генно-инженерной вакцины против герпес-вируса типа 2.
Несмотря на то, что многие генно-инженерные вакцины, проходящие испытания, несомненно, являются перспективными кандидатными средствами профилактики заболеваний, в настоящее время появляются дополнительные подходы к их усовершенствованию. Данные подходы базируются на основании результатов фундаментальных исследований, раскрывающих механизмы активации врожденного иммунитета и его влияния на развитие адаптивного иммунного ответа. Установлено, что ключевую роль в активации врожденного иммунитета играют Толл-подобные рецепторы, локализующиеся на различных иммунокомпетентных клетках и распознающих эволюционно консервативные патоген-ассоциированные молекулярные структуры (ПАМС). После связывания с ПАМС Толл-подобные рецепторы передают внутриклеточный сигнал на активацию синтеза цитокинов и ко-стимулирующих факторов. Различные Толл-подобные рецепторы активируют специфические сочетания цитокинов и ко-стимулирующих факторов, что в конечном итоге определяет тип и эффективность развивающегося приобретенного иммунного ответа. Понимание механизмов функционирования врожденной системы иммунитета позволяет осуществлять "рациональный дизайн" вакцин, основанный на комбинировании сигналов активации врожденного (ПАМС) и приобретенного иммунитета (антиген). Возможность активации системы врожденного иммунитета различными сочетаниями ПАМС дополнительно открывает путь для создания средств быстрой неспецифической защиты против неизвестных патогенов, в т.ч. и в случае актов биотерроризма. В ближайшем будущем в исследовательских программах западных компаний планируется внедрение ПАМС в структуру (конъюгация с вакциной или композиция с ней) генно-инженерных вакцин.
Понятно, что вакцинация, в том случае, когда она возможна, является наиболее эффективным способом защиты от патогенов. Однако в медпрактике часто встречаются ситуации, связанные с неожиданно возникающими вспышками инфекций, при которых требуются препараты немедленного блокирования распространения патогенов и их токсинов в организме. Аналогичные препараты могут потребоваться в случаях возможных актов биотерроризма. Свойствами, необходимыми для экстренной защиты от патогенов, обладают патогенспецифические антитела. Их использование в качестве терапевтического средства защиты от патогенов (пассивная иммунизация) известно давно, но в настоящее время применяется только по жизненным показаниям, ввиду того, что в организм человека вводится специфическая сыворотка крови (обычно лошадей), которая может приводить к развитию сывороточной болезни. Принципиальное решение проблемы создания эффективных и безопасных протективных антител стало возможным после разработки технологии получения рекомбинантных гуманизированных моноклональных антител. Эта технология базируется на методах генной инженерии и нанобиотехнологии. При использовании данных методов в настоящее время создан целый ряд бактериальных продуцентов одноцепочечных гуманизированных моноклональных антител. Показано, что такие гуманизированные наноантитела являются эффективными при лечении различных типов опухолей и при блокировании распространения патогенов в организме человека. В ближайшем будущем ожидается появления большого количества новых гуманизированных антител для терапии опухолевых и инфекционных заболеваний. Дополнительно разрабатываются гуманизированные антитела - средства экстренной защиты от биотерроризма. В частности, в мире получен целый спектр гуманизированных антител против возбудителей особо опасных инфекций. Недавно были получены гуманизированные антитела, эффективно блокирующие развитие инфекции, вызванной сибиреязвенной палочкой. Данные антитела взяты на "вооружение" армией ФРГ.
В заключение следует отметить, что разрабатываемые для защиты от патогенов подходы (генно-инженерные вакцины и гуманизированные антитела) не являются абсолютно универсальными. Было бы ошибочным считать, что внедрение этих технологий в медицинскую практику позволит решить все проблемы, связанные с бактериальными и вирусными патогенами. В то же время нельзя оставаться на позициях и подходах традиционной вакцинопрофилактики. Уже сегодня понятно, что использование прогрессивных технологий позволяет решать конкретные и важные проблемы, связанные с разработкой профилактичеких средств против особо опасных (сибиреязвенная палочка, вирус бешенства) и плохо культивируемых патогенов (вирус гапатита В, герпес-вирус 2 типа). По данным проходящих клинических исследований предполагается, что в течение 3-5 лет ожидается начало производства первых препаратов для генетической иммунизации человека против вируса бешенства, вируса папилломы, через 6-8 лет - вакцин от малярии и туберкулеза (рекомбинантная БЦЖ). В ближайшие 1-2 года будут созданы препараты гуманизированных антител против таких особо опасных патогенов человека, как туляремия, чума и бруцеллез.
Различные стратегии получения генно-инженерных вакцин базируются на использовании приемов клонирования генов, ответственных за синтез различных белков патогена, в плазмидные векторы, которые обеспечивают реализацию необходимой генетической информации в микроорганизме-продуценте (целевой белок, выделенный из продуцента в дальнейшем используется для вакцинации) или в вакцинируемом организме (реже в качестве системы экспрессии используются растительные клетки).
Вакцины. Виды антигенов вакцин. Классификация вакцин. Виды вакцин. Живые вакцины. Ослабленные ( аттенуированные ) вакцины. Дивергентные вакцины.
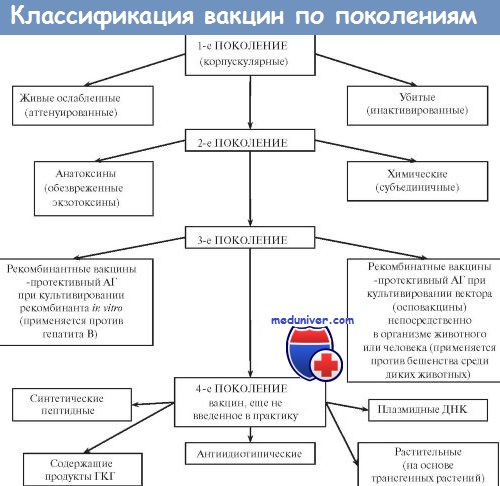
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Высокая эффективность, простота, возможность широкого охвата вакцинируемых лиц с целью массового предупреждения заболевания вывели активную иммунопрофилактику в большинстве стран мира в разряд государственных приоритетов. Комплекс мероприятий по вакцинации включает отбор лиц, подлежащих вакцинации, выбор вакцинного препарата и определение схемы его использования, а также (при необходимости) контроль эффективности, купирование возможных патологических реакций и осложнений. В качестве Аг в вакцинных препаратах выступают:
• цельные микробные тела (живые или убитые);
• отдельные Аг микроорганизмов (наиболее часто протективные Аг);
• токсины микроорганизмов;
• искусственно созданные Аг микроорганизмов;
• Аг, полученные методами генной инженерии.
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
Живые вакцины
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Ослабленные ( аттенуированные ) вакцины
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Современная технология рекомбинантной ДНК. Виды рекомбинантных субъединичных вакцин.
Современная технология рекомбинантной ДНК пришла на смену устаревшей рутинной технологии изготовления вакцины против одного из наиболее опасных и широко распространенных заболеваний людей. Ранние вакцины против гепатита В были необычными и представляли собой очищенный поверхностный антиген вируса (HBsAg), полученный из плазмы крови человека, хронического носителя вируса. Это была уникальная в своем роде вакцина.
Рекомбинантные дрожжевые клетки продуцируют поверхностный антиген вируса гепатита В, агрегированный в многомерные сферические частицы диаметром 22 нм, идентичные натуральному поверхностному HBsAg антигену, обнаруживаемому в плазме крови хронически инфицированных людей.
HBsAg синтезировался в дрожжах в количестве, достаточном для промышленного изготовления вакцины. Антиген, выделенный из разрушенных дрожжей, очищают скоростным центрифугированием в сочетании с иммунной хроматографией.
Сравнительный анализ физико-химических, морфологических и иммуногенных свойств HBsAg, полученного генно-инженерным способом и выделенного из плазмы крови носителей вируса, продемонстрировал близость их характеристик. Однако поверхностный антиген вируса гепатита В, продуцируемый дрожжами, оказался негликозилированным. С целью усиления иммуногенности в рекомбинантные вакцины были включены, помимо HBsAg, белки, кодируемые зонами пpe-S ДНК вируса гепатита В.
Рекомбинантные культуры дрожжей, в отличие от плазмы носителей антигена вируса, практически представляют неограниченный источник вирусного антигена для изготовления вакцинного препарата. Протективная активность рекомбинантной вакцины не отличается от активности вакцины, полученной из плазмы крови доноров. В дрожжах экспрессирован G-белок вируса бешенства в нативном виде.
Основной протективный белок VP2 вируса бурсальной болезни кур образовывался в высокоиммуногенной форме в рекомбинантных дрожжах. Рекомбинантный белок VP2 после однократного внутримышечного введения (50 мкг) в составе эмульгированной вакцины вызывал у кур вируснейтрализующие антитела в таком же титре, как после введения живого вируса. Трансовариальная передача антител обеспечивала выраженный иммунитет у потомства и вселяла надежду на практическое применение такой вакцины.
Аналогичные результаты получены с рекомбинантной субъединичной вакциной, содержащей белок VP2, экспрессированный в бакуловирусной системе.
Создание эффективной вакцины против гепатита С связано с многими проблемами, и в первую очередь, с отсутствием возможности размножения вируса в культуре клеток, а так же генетическим разнообразием и высоким уровнем мутабильности вируса. Вакцины, основанные на гликопротеинах Е1 и Е2, вызывали кратковременное образование антител у обезьян к этим антигенам и требовали частой бустеризации. Привитые животные были защищены против внутривенного заражения малыми дозами вирулентного вируса гомологичной антигенности, но не против заражения большой дозой вируса или заражения гетерологичным штаммом вируса.
Возможно, что для усиления протективного эффекта требуется индукция специфических цитотоксических лимфоцитов к консервативным эпитопам неструктурных белков.
Возрастающий интерес к изготовлению компонентных вакцин на основе технологии рекомбинантной ДНК привлек внимание к использованию клеток животных в качестве систем, экспрессирующих рекомбинантные вирусные белки. В качестве таких систем часто использовали трансформированные линии клеток, в том числе яичника китайского хомяка (линия СНО), а также клетки обезьян, трансформированные вирусом SV-40 (линия COS). Такую систему использовали для наработки антигенов, вируса гепатита В и др. Продуцируемые в рекомбинантных клетках СНО вирусоподобные частицы, содержащие поверхностный антиген вируса гепатита В, имели диаметр 22 нм, плотность в хлориде цезия 1,21 г/см3 и не отличались от частиц, обнаруживаемых в плазме крови инфицированных носителей. Культуральные свойства клеток СНО позволяли рассчитывать на их промышленное использование в качестве продуцентов иммуногенного материала.
Клетки гепатобластомы человека (линия HepG2), трансфицированные полноразмерной ДНК вируса гепатита В, в большом количестве секретировали антигены Е, С и S. Мембранный гликопротеин (340/220) вируса Эпштейн-Барр длительное время экспрессировался в фибрабластоподобных клетках мышей, трансформированных вирусом папилломы крупного рогатого скота.
Белок Е1 вируса краснухи был экспрессирован в клетках COS после трансфекции клеток кДНК в составе вектора обезьяньего вируса SV-40. Этот белок антигенно подобен белку, экспрессируемому в клетках, зараженных вирусом краснухи.
Генно-инженерным методом получена клеточная линия, продуцирующая пустые капсиды парвовируса В-19 человека. Продукция полых капсидов была равной или превышала формирование вирионов в инфицированных клетках костного мозга (1000-2000 капсидов на клетку). Трансфекция не влияла на скорость роста клеток-продуцентов. Капсиды парвовируса В-19, экспрессированные в бакуловирусной системе, по антигенным и иммуногенным свойствам были подобны нативным вирионам. Испытание рекомбинантной вакцины на серонегативных добровольцах дало положительные результаты Получен рекомбинантный вирус бешенства, стабильно экспрессирующий гликопротеин оболочки др 160 вируса иммунодефицита человека 1. Этот вирус вызывал у мышей образование ВН-антител в высоком титре (1:800) и мог служить прообразом рекомбинантной вакцины против ВИЧ-1.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Используя один и тот же плазмидный или вирусный вектор, можно создавать вакцины против различных инфекционных заболеваний, меняя только последовательность, кодирующую необходимые белки-антигены. При этом отпадает необходимость работать с опасными вирусами и бактериями, становится ненужной сложная и дорогостоящая процедура очистки белков. Препараты ДНК-вакцин не требуют специальных условий хранения и доставки, они стабильны длительное время при комнатной температуре.
Уже разработаны и испытываются ДНК-вакцины против инфекций, вызываемых вирусами гепатитов B и C, гриппа, лимфоцитарного хориоменингита, бешенства, иммунодефицита человека (ВИЧ), японского энцефалита, а также возбудителями сальмонеллеза, туберкулеза и некоторых паразитарных заболеваний (лейшманиоз, малярия). Эти инфекции крайне опасны для человечества, а попытки создать против них надежные вакцинные препараты классическими методами оказались безуспешными.
ДНК-вакцинация — одно из самых перспективных направлений в борьбе с раком. В опухоль можно вводить разные гены: те, что кодируют раковые антигены, гены цитокинов и иммуномодуляторов.
Проведя компьютерный (in silico) анализ генома, исследователь получает не только список кодируемых белков, но и некоторые их характеристики, например, принадлежность к определенным группам, возможная локализация внутри бактериальной клетки, связь с мембраной, антигенные свойства.
Третий подход основан на протеомной технологии. Ее методы дают возможность детализировать количественную и качественную характеристики белков в компонентах клетки. Существуют компьютерные программы, которые по аминокислотной последовательности могут предсказать не только трехмерную структуру изучаемого белка, но и его свойства и функции.
Используя эти три метода, можно отобрать набор белков и соответствующие им гены, которые представляют интерес для создания вакцины. Как правило, в эту группу входит около 20-30% всех генов бактериального генома. Для дальнейшей проверки нужно синтезировать и очистить отобранный антиген в количествах, необходимых для иммунизации животных. Очистку белка проводят с помощью полностью автоматизированных приборов. Используя современные технологии, лаборатория, состоящая из трех исследователей, может в течение месяца выделить и очистить более 100 белков.
Важно не только создать вакцину, но и найти наилучший способ ее доставки в организм. Сейчас появились так называемые мукозальные вакцины, которые вводятся через слизистые оболочки рта или носа либо через кожу. Преимущество таких препаратов в том, что вакцина поступает через входные ворота инфекции и тем самым стимулирует местный иммунитет в тех органах, которые первыми подвергаются атаке микроорганизмов.
Терапевтические вакцины
Существующие терапевтические вакцины для лечения хронических воспалительных заболеваний, вызванных бактериями или вирусами, получают классическими методами. Такие вакцины способствуют развитию иммунитета к входящим в их состав микроорганизмам и активизируют врожденный иммунитет.

Одна из важнейших целей разработчиков терапевтических вакцин — ВИЧ-инфекция. Уже проведена серия доклинических и клинических испытаний нескольких препаратов. Их способность вызывать развитие клеточного иммунитета у здоровых людей не вызывает сомнений. Однако убедительных данных о том, что вакцины подавляют размножение вируса у больных, пока нет.
Схема изготовления дендритной вакцины такова: из крови больного выделяют клетки, которые дают начало дендритным клеткам, и размножают их в лабораторных условиях. Одновременно из опухоли пациента выделяют белки-антигены. Дендритные клетки некоторое время выдерживают вместе с опухолевыми антигенами, чтобы они запомнили образ врага, а затем вводят больному. Такая стимуляция иммунной системы заставляет организм активно бороться с опухолью.
У мышей дендритные вакцины помогают предупредить повторное развитие карциномы после удаления опухоли. Это позволяет надеяться, что они будут эффективны для продления безрецидивного периода онкологических больных после хирургического вмешательства.
Читайте также:

