Гепатит в и мерцательная аритмия
Обновлено: 25.04.2024
Журнал: Проблемы эндокринологии. 2017;63(1): 46‑50
Заболевания печени у больных гипертиреозом могут выступать в трех ипостасях: лекарственные гепатиты, развивающиеся в ответ на прием тиреостатиков, сопутствующие аутоиммунные заболевания печени и, наконец, гепатопатии как непосредственное проявление тиреотоксикоза [4—6]. Гепатотоксичность тиреостатиков проявляется менее чем в 0,5% случаев [4] и чаще бывает связана с применением пропилтиоурацила, чем метимазола, в основном метаболизирующегося почками. Отмечены случаи токсического гепатита и на фоне лечения радиоактивным йодом [7]. Универсальная аутоиммунная природа патологического процесса объясняет случаи сочетания болезни Грейвса с аутоиммунным гепатитом [4, 5, 8] и первичным билиарным циррозом [6].
Из трех вариантов поражения печени при тиреотоксикозе лишь последний, очевидно, может рассматриваться в контексте патогенного влияния тиреоидных гормонов. В уже упомянутой статье D. Mazo и соавт. [4] из 8 описанных случаев 2 было представлено аутоиммунным гепатитом, еще 3 — лекарственным гепатитом, индуцированным пропилтиоурацилом, и лишь оставшиеся 3 случая — собственно отражением тиреотоксикоза. Механизм развития тиреотоксического гепатита объясняется диспропорцией между кровоснабжением и метаболическими затратами печени, развивающейся в условиях повышенного сердечного выброса [6, 9]. Правожелудочковая сердечная недостаточность, вызванная тиреогенной миокардиодистрофией, может усугубить повреждение печени [4, 9]. Концепция прямого токсического действия избытка гормонов щитовидной железы на печень убедительного подтверждения не нашла [9], хотя и продолжает обсуждаться [5].
Описание клинического случая
Больной М., 56 лет, поступил в городскую клиническую больницу с жалобами на желтуху, потемнение мочи, слабость, одышку при незначительной физической нагрузке, отеки ног, увеличение живота, похудание. Из анамнеза выяснилось, что последние 5 лет у больного наблюдается постоянная форма мерцательной аритмии (попытки восстановления синусового ритма не предпринимались), а 6 мес назад был установлен диагноз цирроза печени. Самочувствие больного ухудшилось в течение последних 2 мес, когда появились и усилились вышеуказанные жалобы.
При поступлении состояние расценено как тяжелое. Больной истощен (после устранения отеков: рост 176 см, масса тела 52 кг, индекс массы тела 16,8 кг/м 2 ), кожа и склеры интенсивно желтушны. Границы сердца расширены влево, тоны аритмичные 98 в минуту, на верхушке сердца и у основания мечевидного отростка систолический шум. Живот равномерно увеличен за счет асцита. Печень плотная, с гладкой поверхностью, чувствительная при пальпации, выступает из-под края реберной дуги на 5 см.
Общий анализ крови документировал легкую анемию (гемоглобин 108 г/л, эритроциты 3,5´10 12 /л), которая сопровождалась сниженным уровнем железа (8,6 мкмоль/л) и достаточно высоким уровнем ферритина (230 мкг/л). Отмечены гипербилирубинемия (общий билирубин 279,2 мкмоль/л, прямой билирубин 224,6 мкмоль/л, непрямой билирубин 54,6 мкмоль/л), повышение уровня трансаминаз (АСТ 101,4 Ед/л, АЛТ 58 Ед/л), низкие значения фибриногена (1,02 г/л) и общего холестерина (1,87 г/л), диспротеинемия (альбумины 40,7%, γ-глобулины 33,1%), уробилинурия. Маркеры вирусных гепатитов В и С оказались отрицательными.
УЗИ установило повышенную эхогенность печени и умеренную гепатомегалию — косовертикальный размер 167 мм (норма до 150 мм). Зафиксировано увеличение диаметра воротной вены — 13,5 мм (норма до 12 мм) и нижней полой вены — 21 мм (норма до 15—16 мм). Диаметры желчных протоков, размер селезенки в пределах нормы. Подтверждено значительное количество жидкости в брюшной полости.
Эзофагогастродуоденоскопия существенных изменений не выявила.
ЭКГ подтвердила наличие фибрилляции предсердий с частотой активации желудочков 78—136 в минуту, признаки гипертрофии левого желудочка.
Таким образом, заболевание было представлено желтухой, гепатомегалией, нарушением ритма по типу фибрилляции предсердий, сердечной недостаточностью, отечно-асцитическим синдромом. Отклонения лабораторных показателей укладывались в цитолитический, мезенхимально-воспалительный и гепатодепрессивный (гипоальбуминемия, гипофибриногенемия, гипохолестеринемия) синдромы. С учетом выявленного диффузного поражения печени и неизмененных желчных протоков наиболее вероятным признано предположение о печеночном характере желтухи. Стандартное лечение сердечной недостаточности (ингибиторы ангиотензин-превращающего фермента, диуретики, β-адреноблокаторы, сердечные гликозиды) в сочетании с препаратом урсодезоксихолевой кислоты привели к быстрому устранению отеков и асцита, значительному уменьшению одышки; желтуха тем не менее сохранялась.
Выполненная для уточнения диагноза магнитно-резонансная томография констатировала отсутствие изменений формы, размеров, структуры и плотности печени и селезенки, просвета внутрипеченочных протоков, лимфоузлов брюшной полости и забрюшинного пространства; диаметры воротной и нижней полой вен на фоне проведенного лечения приобрели нормальные значения, свободной жидкости в брюшной полости не отмечалось.
Отрицательные маркеры вирусных гепатитов, отсутствие холедохоэктазии и структурных изменений печеночной ткани не давали оснований говорить о первичном поражении печени и желчевыводящей системы. Мерцательная аритмия, тотальная сердечная недостаточность, кардиомегалия в сочетании с систолическим шумом свидетельствовали о возможном пороке сердца. В подобных обстоятельствах желтуха и гепатомегалия могли рассматриваться как проявление кардиального фиброза печени, однако в эту версию не укладывался высокий и стойкий уровень билирубина и выраженные лабораторные признаки гепатодепрессии.
Проведенная эхокардиография выявила признаки легочной гипертензии и легочного сердца: дилатацию полостей предсердий (левое 4,3 см, правое 6,9×5,0 см) и правого желудочка (3,0 см), увеличение диаметра легочной артерии 2,8 см, трикуспидальную регургитацию II степени. Клапанные створки оказались интактны, нарушений локальной сократимости миокарда не отмечено, фракция выброса составила 65%.
В круг болезней с одновременным вовлечением сердца с развитием фибрилляции предсердий и печени входят поражения щитовидной железы, протекающие с явлениями гипертиреоза. При целенаправленном осмотре больного были выявлены положительные глазные симптомы Дельримпля и Штельвага, выраженный блеск глаз, тремор тела и конечностей, экзофтальм. Ультразвуковое исследование установило пониженную эхогенность и увеличение объема щитовидной железы до 26,2 см 3 . Признаки манифестного тиреотоксикоза были документированы уровнем гормонов: Т4 свободный 45,0 пмоль/л (норма 10,0—23,2 пмоль/л), Т4 общий 37,0 нмоль/л (норма 52—155 нмоль/л), Т3 0,4 нг/мл (норма 0,8—2,8 нг/мл), ТТГ 0 мкМЕ/мл (норма 0,23—3,4 мкМЕ/мл).
Лабораторные и клинические признаки тиреотоксикоза дали основание к назначению тиамазола, что привело к уменьшению желтухи и быстрой положительной динамике лабораторных показателей. При контрольном лабораторном исследовании отмечено значительное снижение гипербилирубинемии и нормализация уровня трансаминаз: общий билирубин 55,6 мкмоль/л, прямой билирубин 50,9 мкмоль/л, АСТ 35,4 Ед/л, АЛТ 35,1 Ед/л. Уровень тиреоидных гормонов составил: Т4 свободный 19,6 пмоль/л; Т4 общий 58,0 нмоль/л, Т3 0,99 нг/мл, ТТГ 0,1 мкМЕ/мл.
Окончательный диагноз: диффузный токсический зоб I степени (по ВОЗ), тиреотоксикоз тяжелой степени. Тиреогенная миокардиодистрофия, кардиомегалия, постоянная форма фибрилляции предсердий, СН IIБ стадии. Тиреотоксический гепатит тяжелого течения, гипербилирубинемический криз, отечно-асцитический синдром. Анемия хронических заболеваний легкой степени. Недостаточность питания II степени.
Заключение
Интенсивная желтуха при тяжелом течении тиреотоксикоза описывалась в публикациях, относящихся еще к 20—40-м годам прошлого века. Однако ошибочно считать, что в настоящее время при современном уровне диагностики и лечения проблема поражений печени при заболеваниях щитовидной железы перестала быть актуальной.
Комментируя приведенный случай, хотелось бы обратить внимание на изолированное повышение концентрации свободного Т4 при исходно пониженных уровнях общего Т4 и Т3. Очевидно, выраженное снижение белково-синтетической функции (факт гепатодепрессии подтвержден лабораторно) привело к снижению синтеза белков-переносчиков тиреоидных гормонов, и только уровень свободного (не связанного с белками) Т4 оказался информативным. Показательно, что на фоне лечения концентрации общего Т4 и Т3 возросли, что косвенно свидетельствовало о нормализации функции печени.
В завершение сошлемся на приведенный в работе D. Mazo и соавт. [4] алгоритм ведения пациента с поражением печени, связанным с гипертиреозом (см. рисунок).

Алгоритм ведения пациентов с поражением печени на фоне гипертиреоза [4].
Информация о финансировании и конфликте интересов
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Проведенная поисково-аналитическая работа по подготовке рукописи проведена на личные средства членов авторского коллектива.
Медицинские сведения о пациенте публикуются с его письменного согласия.
Участие авторов: концепция и дизайн исследования — Д.В. Пикулев, А.В. Клеменов; сбор и обработка материалов — Д.В. Пикулев, А.В. Клеменов; анализ полученных данных, написание текста — А.В. Клеменов, Д.В. Пикулев; редактирование текста — А.В. Клеменов.

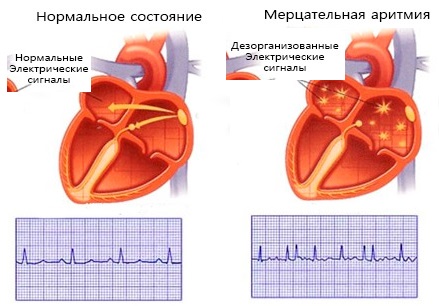
Мерцательная аритмия проявляется разрозненным, хаотичным сокращением мышечной ткани (миокарда) предсердий, со скоростью 350-600 импульсных волн в минуту. В результате предсердия сокращаются не полноценно, ослабевает пребывание крови в желудочки. Часть крови задерживается в предсердиях, что повышает риск формирования тромбов.
Наличие вспышки мерцательной аритмии больше 48 часов приводит к высокому риску развития ишемического инсульта, инфаркта миокарда, тромбоэмболии различных органов и периферических сосудов, выраженной сердечно-сосудистой недостаточности.
Что это такое?
Данное нарушение ритма сердца является довольно распространенным и может наблюдаться в любом возрасте — у детей, пожилых людей, мужчин и женщин среднего и молодого возраста. До 30% случаев потребности в неотложной помощи и госпитализации при нарушениях ритма связано именно с последствиями мерцательной аритмии. С возрастом частота заболевания возрастает: если до 60 лет она наблюдается у 1% пациентов, то позже болезнь регистрируется уже у 6-10 % людей.
При мерцательной аритмии сокращение предсердий происходит в виде их подергивания, предсердия как бы трепещут, по ним идет мерцающая рябь, при этом отдельные группы волокон работают нескоординировано по отношению друг к другу. Заболевание приводит к закономерному нарушению деятельности правого и левого желудочка, которые не могут выбросить достаточное количество крови в аорту. Поэтому при мерцательной аритмии у больного часто обнаруживается дефицит пульса в крупных сосудах и нерегулярность ЧСС. Окончательный диагноз можно поставить по ЭКГ, которая отражает патологическую электрическую активность предсердий, а также выявляет случайный, неадекватный характер сердечных циклов.
Причины возникновения
Спровоцировать нарушение ритма сердца по типу мерцательной аритмии могут различные острые и хронические состояния.
Острыми причинами являются:
- воздействие температурных факторов – гипер- или гипотермия;
- операции;
- инфаркт миокарда;
- чрезмерное употребление кофеина, алкоголя, никотина;
- воспалительные заболевания сердца – перикардиты, миокардиты;
- прием препаратов с аритмогенным эффектом;
- механические воздействия на организм – травмы, вибрация;
- некоторые другие виды аритмий (WPW-синдром).
Воздействие факторов, указанных выше, на здоровое сердце, скорее всего, фибрилляцию предсердий не спровоцирует – ее возникновению способствуют структурные и метаболические изменения миокарда, а также некоторые виды несердечной патологии:
- кардиомиопатии;
- опухоли сердца;
- констриктивный перикардит;
- эндокринная патология, в частности;
- ишемическая болезнь сердца;
- приобретенные и некоторые врожденные пороки сердца;
- артериальная гипертензия;
- тиреотоксикоз;
- заболевания желудочно-кишечного тракта (калькулезный холецистит, диафрагмальная грыжа);
- патология центральной нервной системы;
- интоксикации.

Симптомы мерцательной аритмии
Следует помнить, что в 20-30% случаев мерцательная аритмия протекает без симптомов, не вызывая никаких ощущений. Обнаружение такой формы происходит обычно случайно.
К основным жалобам больных с фибрилляцией предсердий относятся:
- главная жалоба — внезапные приступы учащенного неритмичного сердцебиения или ощущение постоянного неритмичного сердцебиения, пульсацию вен на шее;
- сжимающая боль в области сердца по типу стенокардии;
- общая слабость, повышенная утомляемость;
- затруднение дыхания (одышка), особенно при физической нагрузке;
- головокружения, шаткость походки;
- полуобморочные состояния, обмороки;
- повышенная потливость;
- редко увеличение мочи (полиурия) при выделении натрийуретического гормона.
При развитии постоянной формы заболевания пациенты перестают ощущать дискомфорт или перебои в работе сердца и приспосабливаются жить с этой болезнью.
Осложнения
Наиболее опасные осложнения при МА:
- Развитие тромбоэмболии из-за тромбообразования в камерах сердца.
- Сердечная недостаточность.
- Наступление внезапного летального исхода из-за остановки сердца, вызванной закупоркой его внутренних отверстий.
- Развитие кардиоэмболического инсульта, который возникает из-за застоя крови в предсердиях.
- Кардиогенный шок, провоцирующий значительное понижение артериального давления, в результате которого органы и ткани человеческого организма перестают получать необходимое питание, и в них начинаются необратимые процессы.
- Образование тромбов, которые с током крови могут попасть в любой орган, в том числе и в головной мозг, спровоцировав отмирание мозговых тканей (инсульт).
Мерцательная аритмия лишь на первый взгляд кажется простым заболеванием. Пациентам с таким диагнозом стоит помнить о том, что мерцающая аритмия — это патология, опасность которой связана с осложнениями, возникающими в результате отсутствия своевременного адекватного лечения или же перехода болезни в хроническую форму.
Диагностика
Выставляют диагноз фибрилляции предсердий на основании:
- сбора и анализа анамнеза;
- обнаружения характерных жалоб самого пациента;
- обнаружения определенных специфических изменений записей стандартной электрокардиограммы.
Электрокардиографические признаки рассматриваемой патологии заключаются в следующем:
- обнаруживаются множественные волны f, подтверждающие фибрилляцию (мерцание) предсердий. Такого типа волны могут отличаться амплитудой, формой и иными характеристиками;
- на записях полностью отсутствуют зубцы Р, которые обязательно обнаруживаются при нормальном синусовом ритме сердечных сокращений;
- при сохранении комплексов QRS, наблюдается хаотическое нарушение интервалов RR.
Кроме того, при проведении стандартной электрокардиографии медики получают возможность определить у пациента ассоциированную сердечную патологию, провоцирующую расстройства ритма. Также для установления точного диагноза и обнаружения всех сопутствующих патологий врачи могут использовать такие диагностические методики как: холтеровский мониторинг, эхо-кардиографию, УЗИ сердца и пр.

Пример пароксизмальной мерцательной аритмии на ЭКГ
Лечение мерцательной аритмии
На сегодняшний день при мерцательной аритмии используется несколько способов лечения, направленных на восстановление адекватного ритма сердца и предотвращение новых приступов. Применяются лекарственные препараты, электрическая кардиоверсия. При слабой эффективности этих методов используют оперативные методы лечения – катетерная абляция или вживление кардиостимулятора. Комплексный подход к терапии позволяет предотвратить новые приступы.
Используются следующие препараты при мерцательной аритмии:
- Препятствуют возникновению тромбов разжижающие кровь средства – дезагреганты.
- Бета-блокаторы (бетаксолол, карведилол, небивалол, метопролол, пиндолол, пропраолол, целипролол, эсмолол) и кальциевые блокаторы (верапамил, дилтиазем) – они замедляют ЧСС. Эти лекарства при мерцательной аритмии сердца препятствуют чрезмерно быстрому сокращению желудочков, но не регулируют сердечный ритм.
- Для антитромбоцитарной терапии назначаются антикоагулянты, не исключающие образование тромбов, но снижающие риск этого, а, следовательно, и возникновения инсультов (гепарин, фондапаринукс, эноксапарин).
- Также при диагнозе мерцательная аритмия используются лекарства, которые препятствуют образованию тромбов и возникновению инсультов (варфарин, прадакса).
- Антиаритмичные препараты (амиодарон, дронедарон, ибутилид, новокаинамид, пропафенон, соталол, флекаинид).
Для контроля над воздействием медикаментов требуются регулярные анализы крови. Лишь врач сможет правильно подобрать таблетки при мерцательной аритмии, поскольку у многих из них есть серьёзные противопоказания, а также проаритмическая активность, когда сам приём препарата может неожиданно спровоцировать мерцательную аритмию.
Перед тем как лечить мерцательную аритмию сердца, следует учесть сопутствующие заболевания, имеющиеся у пациента. Иногда приём лекарств начинается в больнице, где врачам проще контролировать реакцию организма и сердечный ритм. При данной терапии в 30-60% случаев состояние пациента улучшается, но со временем эффективность препаратов может снижаться. В связи с этим врачи часто назначают сразу несколько антиаритмических средств.
Лечение постоянной формы мерцательной аритмии
При данной форме пациенту назначаются таблетированные препараты, урежающие ритм сердца. Основными здесь являются группа бета-блокаторов и сердечные гликозиды, например конкор 5 мг х 1 раз в день, коронал 5 мг х 1 раз в день, эгилок 25 мг х 2 раза в день, беталок ЗОК 25-50 мг х 1 раз в день и др. Из сердечных гликозидов применяется дигоксин 0.025 мг по 1/2 таблетки х 2 раза в день — 5 дней, перерыв — 2 дня (сб, вс).
Обязательно назначение антикоагулянтов и антиагрегантов, например кардиомагнила 100 мг в обед, или клопидогрела 75 мг в обед, или варфарина 2.5-5 мг х 1 раз в день (обязательно под контролем МНО — параметра свертывающей системы крови, обычно рекомендуется 2.0-2.5). Данные препараты препятствуют повышенному тромбообразованию и снижают риск развития инфарктов и инсультов.
Хроническую сердечную недостаточность следует лечить мочегонными препаратами (индапамид 1.5 мг утром, верошпирон 25 мг утром) и иАПФ (престариум 5 мг утром, эналаприл 5 мг х 2 раза в день, лизиноприл 5 мг утром), оказывающими органопротективное действие на сосуды и сердце.
![]()
Хирургическое лечение заболевания
Ввиду активного развития науки и медицины, хирургический способ лечения аритмий весьма перспективен. Существует несколько разных подходов:
- Имплантация мини дефибриллятора-кардиовертера. Этот вариант лечения больше подходит людям, у которых пароксизмы мерцательной аритмии нечастые. Такое устройство автоматически распознает нарушение ритма и выдает электрический импульс, способный восстановить нормальную сердечную деятельность.
- Физическое разрушение элемента атриовентрикулярного узла или патологического пучка проведения нервного импульса к желудочкам от предсердия. К такому варианту прибегают при отсутствии эффекта от медикаментозного лечения. В результате операции снижении ЧСС достигается путем нормализации количества проводимых сигналов к желудочкам. При этом довольно часто атриовентрикулярное соединение полностью блокируется, а для нормального сокращения желудочков в них имплантируется кардиостимулятор (ИВР – искусственный водитель ритма).
Образ жизни при мерцательной аритмии
Все болезни сердца предполагают ведение образа жизни, который традиционно характеризуется как здоровый. Фибрилляция предсердий не исключение.
Стандартные рекомендации включают легкие физические нагрузки при мерцательной аритмии сердца: утреннюю зарядку, ежедневные прогулки на свежем воздухе. Человеку следует сохранять естественную подвижность, не следует постоянно лежать (за исключение периодов аритмического приступа).
Отдельным вопросом является совмещение диагноза мерцательная аритмия и алкоголя. Люди с больным сердцем не должны злоупотреблять спиртным.
В то же время известно, что в небольших количествах алкоголь может оказывать положительное влияние, в частности: на нервную систему (успокаивающий эффект), на пищеварительную систему (стимулирует пищеварение), на сосуды (расширяет сосуды). В исключительных случаях человек, страдающий фибрилляцией предсердий, может выпивать в сутки не более 50 г напитка с 40% долей спирта и не более 150 г напитка с 12% долей спирта.

Диета
В основе питания таких больных должна быть растительная нежирная пища, а также каши из цельных круп, супы на воде. Показаны овощные рагу и запеканки, свежие салаты, заправленные небольшим количеством любого рафинированного масла, отварная или приготоленная на пару морская рыба.
Есть нужно малыми порциями: переедание вызывает раздражение блуждающего нерва, который воздействует угнетающе на функцию синусового угла, где потом возникают патологические импульсы.
Отдельно хочется сказать о любом алкоголе: он должен быть совсем исключен из системы питания. Даже у относительно здоровых людей выпитое спиртное может спровоцировать приступ аритмии, купировать который бывает очень сложно из-за быстро наступающих дегенеративных изменений в сердце.
Какой прогноз?
Прогноз для жизни при мерцательной аритмии определяется в первую очередь, причинами заболевания. Так, например, у выживших при остром инфаркте миокарда и при значительном кардиосклерозе краткосрочный прогноз для жизни может быть благоприятным, а для здоровья и в среднесрочной перспективе неблагоприятным, так как в незначительный промежуток времени у пациента развивается хроническая сердечная недостаточность, ухудшающая качество жизни и сокращающая ее продолжительность.
Мерцательная аритмия (МА) – самое распространённое нарушение ритма. Регистрируется повсеместно и встречается практически во всех возрастных группах, но частота ее возникновения увеличивается с каждым десятилетием жизни.
При своевременном обращении к врачу, правильно подобранном лечении и выполнении пациентом всех назначений доктора прогноз при данном заболевании достаточно благоприятный и качество жизни больного значительно не страдает.
Это касается пациентов всех возрастных групп, в том числе и пожилых.
Эти аритмические очаги могут быть достаточно мелкими и множественными и тогда эту форму МА называют фибрилляцией предсердий (от латинского fibrillatio-мелкие сокращения, дрожь).
При более крупных и организованных очагах аритмии говорят о трепетании предсердий (напоминает трепет крыла птицы или бабочки). Фибрилляция предсердий - всегда хаотичные и абсолютно аритмичные сокращения сердца.
Трепетание же предсердий может быть как правильной, так и неправильной формы. В первом случае ритм правильный, а во втором – такой же хаотичный, как при фибрилляции предсердий.
Различить эти формы МА можно лишь по ЭКГ. Однако методы диагностики и лечения, а также профилактики этих форм заболевания едины. Хотя при трепетании предсердий отмечается больший эффект от хирургических методов лечения.
Как и любое заболевание, МА имеет свои особенности течения. Начинается она, как правило, с внезапно развившегося эпизода (пароксизма), который может завершиться так же внезапно, как и начался.
При этом восстановление нормального (синусового) ритма может происходить как спонтанно (самостоятельно), так и с помощью специальных лекарств - антиаритмических средств.


В любом случае, жить с этой аритмией можно, нужно лишь освоить основные принципы управления ею. Однако, следует понимать, что вылечить это заболевание раз и навсегда практически невозможно, как и многие другие болезни (бронхиальная астма, сахарный диабет, гипертоническая болезнь, ишемическая болезнь сердца и т.д.) - можно лишь сосуществовать с МА, контролировать ее симптомы и проводить профилактику развития осложнений. Особую когорту составляют пациенты с частыми рецидивами МА. В этом случае речь идет либо о неправильном лечении (пациент не принимает препараты, либо принимает их в недостаточной дозе, и проблема может быть решена с помощью врача – аритмолога). Однако, в ряде случаев учащение пароксизмов ФП – это естественное течение заболевания, свидетельствующее о том, что скоро пароксизмальная форма МА перейдет в постоянную. Это процесс может быть прерван с помощью хирургических методов лечения.
Мерцательную аритмию принято подразделять на следующие формы:
1.По механизмам развития;
A. фибриляция предсердий
Б. трепетание предсердий:
- правильная форма
- неправильная форма
- тахисистолическая (ЧСС 90-100 в минуту и выше)
- брадисистолическая (ЧСС 60 в минуту и ниже)
- нормосистолическая (ЧСС 60-80 в минуту)
- пароксизмальная (возникающая периодически, каждый такой пароксизм (эпизод аритмии) длится не более 7 дней и нередко проходит самостоятельно, иногда требует приема специальных лекарств для восстановления ритма)
- персистирующая (длится более 7 дней и требует активного восстановления ритма)
- перманентная (длится более года и может быть предпринята попытка восстановления ритма)
- постоянная (длится более года, восстановление ритма не показано в силу его неэффективности)
Естественно, все эти формы сочетаются между собой. Например, в диагнозе может быть указана пароксизмальная тахисистолическая форма фибрилляции предсердий, учащение пароксизмов.
Основными причинами развития МА являются:
- гипертоническая болезнь
- пороки сердца
- перенесённые инфаркты
- перенесенные миокардиты (воспалительные заболевания сердца)
- токсическая (алкогольная) кардиомиопатия
- бронхиальная астма
- хроническая обструктивная болезнь лёгких
- пневмония
- язвенная болезнь
- эрозивный гастродуоденит
- НР-инфекция (хеликобактерный гастродуоденит)
- желчнокаменная болезнь
- хронический панкреатит
- воспалительные заболевания кишечника
- заболевания щитовидной железы (тиреотоксикоз)
- сахарный диабет
5.инфекции (ОРВИ, грипп, сепсис)
6.вредные привычки:
- злоупотребление алкоголем
- применения наркотиков
- интенсивное курение
7.нарушение режима труда и отдыха (работа без выходных и отпусков, частые командировки)
8.обострение любой сопутствующей патологии
9.онкологические заболевания, особенно после курсов лучевой и химиотерапии
10.сочетание факторов
В случае обнаружения МА пациент должен незамедлительно обратиться к аритмологу, либо кардиологу. Ему будет предложено амбулаторное обследование или, при необходимости, госпитализация.
Оптимальным считается срок обращения за медицинской помощью в течение 48 часов с момента развития МА, так как в этом случае можно максимально быстро, эффективно и безопасно восстановить ритм.
В последнем случае искусственное восстановление синусового ритма с помощью лекарств называют медикаментозной кардиоверсией. В случае, когда ритм сердца восстанавливают с помощью электрического тока (дефибриллятором), говорят об электрической кардиоверсии
Так или иначе, любая форма этого заболевания нуждается в лечении. Мировым кардиологическим сообществом давно разработана стратегия ведения таких пациентов и обозначены основные цели лечения больных с мерцательной аритмией.
К ним относятся:
1. Контроль ритма /контроль частоты пульса
Если же нарушение ритма беспокоит более чем один-два раза в год, необходим постоянный прием антиаритмичеких средств.
В качестве антиаритмических средств на сегодняшний день используются:
- бета-блокаторы (метопролол, бисопролол, карведилол)
- пропафенон
- амиодарон
- сотагексал
- аллапинин
- дигоксин
- комбинация лекарственных средств
2.Профилактика осложнений:
профилактика инсульта и тромбоэмболий
При МА нет единого, скоординированного выброса крови сердцем, часть крови застаивается в его камерах и, в виде тромбов, может поступать в сосуды. Чаще всего страдают сосуды головного мозга и развивается инсульт.
С целью его профилактики назначаются препараты, влияющие на свертывание крови -варфарин, ривароксабан, дабигатран, апиксабан, которые надежно (более чем на 90%) защищают от инсульта.
Во время приема этих препаратов пациент должен следить за наличием кровотечений и раз в квартал контролировать общий анализ крови и креатинин. (при приеме ривароксабана, дабигатрана и апиксабана)., либо не реже раза в месяц исследовать МНО (международное нормализованное отношение) при приеме варфарина. Это необходимо для того, чтобы правильно рассчитать дозу препарата и следить за его безопасностью.
Ацетилсалициловая кислота (аспирин, кардиомагнил, тромбоасс) для профилактики тромбоэмболий рутинно не используется, так как степень защиты от венозного тромбоза при ее применении составляет всего 25%.
профилактика развития сердечной недостаточности
Сердечная недостаточность (СН) – осложнение многих заболеваний сердца, в том числе и МА. Это состояние обусловлено отсутствием полноценной насосной функции сердца, вследствие чего жидкая часть крови застаивается в тканях и органах, что проявляется одышкой и отёками.
С целью профилактики и лечения СН применяются ингибиторы АПФ (эналаприл, лизиноприл, периндоприл и др.), верошпирон(эплеренон), мочегонные (торасемид, фуросемид, гипотиазид).
3.Хирургическое лечение применяется в случае отсутствия эффекта от медикаментозных средств и проводится в специализированных кардиохирургических клиниках.
Виды хирургического лечения МА:
- имплантация электрокардиостимулятора при брадиформе МА
- радиочастотная аблация устьев лёгочных вен и других аритмогенных зон
- при пароксизмальной тахиформе фибрилляции и трепетания предсердий
После хирургического лечения с целью профилактики рецидивов аритмии пациентам назначается плановая антиаритмическая терапия.
Пациенту с МА следует беречься простудных заболеваний, вести здоровый образ жизни, избавиться от вредных привычек и избегать факторов, приводящих к ее развитию, а также неукоснительно соблюдать все рекомендации своего лечащего врача. Доктор поможет подобрать индивидуальную схему лечения и порекомендует, что делать при развитии рецидива аритмии, а также своевременно направит к кардиохирургу - аритмологу при наличии показаний.
Важно понимать, что подбор антиаритмической терапии занимает определенное время, требует повторных осмотров врача и ряда исследований в динамике ( общеклинические анализы, исследование уровня гормонов щитовидной железы, УЗИ сердца и холтеровское мониторирование ЭКГ, регистрацию электрокардиограммы) и к этом следует отнестись с пониманием. В ряде случаев требуется замена одного лекарственного препарата на другой.
Жизнь с мерцательной аритмией – процесс непростой и очень важно, чтобы пациент чувствовал поддержку и помощь доктора. Мы рады помочь Вам в этом и готовы предложить программы диспансерного наблюдения кардиолога, аритмолога и кардиохирурга в нашей клинике.
По меткому выражению профессора Архипова М.В., тот врач, который вылечит эту аритмию раз и навсегда, получит Нобелевскую премию. Пока этот приз остался не разыгранным.


Мерцательная аритмия включает фибрилляцию и трепетание предсердий. Для обеих форм нарушений ритма характерны неправильные, асинхронные сокращения сердца вследствие появления в нем аритмических очагов. Но при трепетании предсердий они несколько более крупные и иногда легче поддаются коррекции хирургическими методами, в отличие от фибрилляции предсердий. Принципы диагностики, лечения и профилактики этих форм заболевания едины.
Если эти аритмические очаги достаточно мелкие и множественные, то тогда эту форму МА называют фибрилляцией предсердий (от латинского fibrillatio-мелкие сокращения, дрожь). При более крупных и организованных очагах аритмии говорят о трепетании предсердий (напоминает трепетание крыла птицы или бабочки). Фибрилляция предсердий – это хаотичные и абсолютно аритмичные сокращения сердца. Трепетание же предсердий может быть как правильной, так и неправильной формы. В первом случае ритм правильный, а во втором –хаотичный как при фибрилляции предсердий. Различить эти формы МА можно по ЭКГ. Однако методы диагностики и лечения, а также профилактики этих форм заболевания едины. Хотя при трепетании предсердий отмечается больший эффект от хирургических методов лечения.
Как у любого заболевания, у МА свои особенности течения. Начинается она, как правило, с внезапно развившегося эпизода (пароксизма), который может завершиться так же внезапно, как и начался.
При этом восстановление нормального (синусового) ритма может происходить как спонтанно, самостоятельно, так и с помощью лекарств - антиаритмических средств.
Жить с этой аритмией можно! Нужно лишь освоить основные принципы управления ею. Вылечить это заболевание раз и навсегда практически невозможно, как и многие другие болезни: бронхиальную астму, сахарный диабет, гипертоническую болезнь, ишемическую болезнь сердца и т.д. Но можно сосуществовать с МА, контролировать ее симптомы и проводить профилактику развития осложнений.
Отдельную когорту составляют пациенты с частыми рецидивами МА. Причина может быть в неправильном лечении (пациент не принимает препараты, либо принимает их в недостаточной дозе, и проблема может быть решена с помощью врача – аритмолога). Однако, учащение пароксизмов ФП – это, как правило, естественное течение заболевания, свидетельствующее о том, что скоро пароксизмальная форма МА перейдет в постоянную. Этот процесс может быть прерван хирургическим методом лечения.
МА принято подразделять на следующие формы:
- правильная форма
- неправильная форма
- тахисистолическая (ЧСС 90-100 в минуту и выше)
- брадисистолическая (ЧСС 60 в минуту и ниже)
- нормосистолическая (ЧСС 60-80 в минуту)
- пароксизмальная (возникающая периодически, каждый такой пароксизм (эпизод аритмии) длится не более 7 дней и нередко проходит самостоятельно, иногда требует приема специальных лекарств для восстановления ритма)
- персистирующая (длится более 7 дней и требует активного восстановления ритма)
- перманентная (длится более года и может быть предпринята попытка восстановления ритма)
- постоянная (длится более года, восстановление ритма не показано в силу его неэффективности)
Естественно, все эти формы сочетаются между собой. Например, в диагнозе может быть указана пароксизмальная тахисистолическая форма фибрилляции предсердий, учащение пароксизмов.
Основными причинами развития МА являются следующие:
- гипертоническая болезнь
- пороки сердца
- перенесённые инфаркты
- перенесенные миокардиты (воспалительные заболевания сердца)
- токсическая (алкогольная) кардиомиопатия
- бронхиальная астма
- хроническая обструктивная болезнь лёгких
- пневмония
- язвенная болезнь
- эрозивный гастродуоденит
- НР-инфекция (хеликобактерный гастродуоденит)
- желчнокаменная болезнь
- хронический панкреатит
- воспалительные заболевания кишечника
- заболевания щитовидной железы (тиреотоксикоз)
- сахарный диабет
5.инфекции (ОРВИ, грипп, сепсис)
6.вредные привычки:
- злоупотребление алкоголем
- применения наркотиков
- интенсивное курение
7.нарушение режима труда и отдыха (работа без выходных и отпусков, частые командировки)
8.обострение любой сопутствующей патологии
9.онкологические заболевания, особенно после курсов лучевой и химиотерапии
В случае обнаружения МА пациент должен немедленно обратиться к аритмологу, либо кардиологу. Ему будет предложено амбулаторное обследование или госпитализация.
Оптимальный срок обращения за медицинской помощью - в течение 48 часов с момента развития МА, так как можно быстро и безопасно восстановить ритм. Дело в том, что в течение 2х суток с момента развития МА в сердце не успевают образоваться тромбы. И можно проводить кардиоверсию, то есть активное восстановление ритма. Если же пациент поступает спустя 48 часов с момента появления МА, то требуется длительная подготовка к активному восстановлению ритма.
Искусственное восстановление синусового ритма лекарствами – это медикаментозная кардиоверсия (КВ). В случае, когда ритм сердца восстанавливают электрическим током (дефибриллятором), говорят об электрической кардиоверсии. Оба способа используются как по неотложным показаниям, так и планово.
Медикаментозная кардиоверсия может проводиться как самим пациентом дома, так и в стационаре. Она не требует подготовки. Пациент знает дозы и способы приема антиаритмического препарата, назначенного врачом. Препараты для амбулаторной терапии принимаются в виде таблеток. Если медикаментозная КВ проходит в стационаре, препараты могут вводить внутривенно.
Электрическая кардиоверсия проводится только в стационаре. Перед ее реализацией пациент проходит углублённое обследование. Это ультразвуковое исследование (УЗИ) сердца, чреспищеводное УЗИ сердца (ЧПУЗИ), исследование уровня гормонов щитовидной железы, фиброгастроскопию (ФГС)и т.д.
Если при ЧПУЗИ тромбов в полостях сердца не находят, то можно проводить КВ. Если же будут обнаружены тромбы, то пациент проходит специальное лечение. Затем ЧПУЗИ повторяют и, если тромбы не визуализируются, проведение КВ возможно. Если же и после курса лечения тромбы в полостях сердца сохранятся, то вопрос с восстановлением ритма закрыт навсегда.
Электрическая кардиоверсия проводится следующим образом: пациента погружают в медикаментозный сон. Затем на грудную клетку накладываются электроды дефибриллятора и дается разряд тока. В случае успешной кардиоверсии восстанавливается нормальный (синусовый) ритм, который затем надо удерживать антиаритмическими препаратами. Однако, у ряда пациентов кардиоверсия может быть неуспешной и ритм остается неправильным. Тогда дальнейшие попытки по его восстановлению прекращают.
Зачем вообще восстанавливать синусовый ритм? Дело в том, что в норме в сердце человека есть один главный источник питания, подающий сигналы на миокард и заставляющий сокращаться все сердце. Это синусовый узел (СУ) и поэтому нормальный ритм сердца называют синусовым. При МА функцию СУ берут на себя аритмические очаги.
Но если при синусовом ритме сердце сокращается синхронно и правильно, как единый механизм, то при МА сердце работает хаотично и неполноценно. Это истощает, изнашивает его, приводит к необратимым изменениям, а со временем и к осложнениям –инсульту, сердечной недостаточности. Поэтому важно попытаться восстановить и удержать нормальный ритм сердца насколько это возможно. И только существование МА более года, когда аритмия становится постоянной, делает этот процесс бессмысленным. Любая форма этого заболевания нуждается в лечении. Мировым кардиологическим сообществом давно разработана стратегия ведения таких пациентов и обозначены основные цели лечения больных с мерцательной аритмией:
1. Контроль ритма /контроль частоты пульса
Если же нарушение ритма беспокоит более чем один-два раза в год, необходим постоянный прием антиаритмичеких средств.
В качестве антиаритмических средств на сегодняшний день используются:
- бета-блокаторы (метопролол, бисопролол, карведилол)
- пропафенон
- амиодарон
- сотагексал
- аллапинин
- дигоксин
- комбинация лекарственных средств
2.Профилактика осложнений:
A. профилактика инсульта и тромбоэмболий
При МА нет единого, скоординированного выброса крови сердцем, часть крови застаивается в его камерах и в виде тромбов может поступать в сосуды. Чаще всего страдают сосуды головного мозга и развивается инсульт.
С целью его профилактики назначаются препараты, влияющие на свертывание крови -варфарин, ривароксабан, дабигатран, апиксабан, которые надежно (более чем на 90%) защищают от инсульта.
Во время приема этих препаратов пациент должен следить за наличием кровотечений и раз в квартал контролировать общий анализ крови и креатинин. (при приеме ривароксабана, дабигатрана и апиксабана)., либо не реже раза в месяц исследовать МНО (международное нормализованное отношение) при приеме варфарина. Это необходимо для того, чтобы правильно рассчитать дозу препарата и следить за его безопасностью.
Ацетилсалициловая кислота (аспирин, кардиомагнил, тромбоасс) для профилактики тромбоэмболий рутинно не используется, так как степень защиты от венозного тромбоза при ее применении составляет всего 25%.
Б. профилактика развития сердечной недостаточности
Сердечная недостаточность (СН) – осложнение многих заболеваний сердца, в том числе и МА. Это состояние обусловлено отсутствием полноценной насосной функции сердца, вследствие чего жидкая часть крови застаивается в тканях и органах, что проявляется одышкой и отёками.
С целью профилактики и лечения СН применяются ингибиторы АПФ (эналаприл, лизиноприл, периндоприл и др.), верошпирон(эплеренон), мочегонные (торасемид, фуросемид, гипотиазид).
3.Хирургическое лечение применяется в случае отсутствия эффекта от медикаментозных средств и проводится в специализированных кардиохирургических клиниках.
Виды хирургического лечения МА:
- имплантация электрокардиостимулятора при брадиформе МА
- радиочастотная аблация устьев лёгочных вен и других аритмогенных зон
- при пароксизмальной тахиформе фибрилляции и трепетания предсердий
Если причина аритмии остается невыясненной, МА называют идиопатической.
В ряде случаев пациенту может быть рекомендована электрическая кардиоверсия, то есть восстановление ритма с помощью дефибриллятора. Эта процедура требует специальной подготовки и проводится только в условиях кардиологического стационара. После ее проведения также требуется регулярный прием антиаритмических препаратов.
Подбор антиаритмической терапии занимает время, требует повторных осмотров врача и ряда исследований в динамике. Это общеклинические анализы, исследование уровня гормонов щитовидной железы, УЗИ сердца и холтеровское мониторирование ЭКГ, регистрация электрокардиограммы. Часто требуется замена одного лекарственного препарата на другой. К этому надо быть готовым.
Жизнь с мерцательной аритмией – процесс непростой. Очень важно, чтобы пациент чувствовал поддержку, помощь доктора. Мы рады помочь Вам в этом и готовы предложить программы диспансерного наблюдения кардиолога, аритмолога, кардиохирурга в нашей клинике.
ПВТ — противовирусная терапия
СН — сердечная недостаточность
ХГС — хронический гепатит С
HCV — вирус гепатита С
NT-pro-BNP — N-концевой предшественник мозгового натрийуретического пептида
Хронический гепатит С (ХГС) — актуальная междисциплинарная проблема. Хорошо изучены различные внепеченочные проявления ХГС, такие как смешанная криоглобулинемия, гломерулонефрит, поздняя кожная порфирия, красный плоский лишай, синдром Шегрена и др. Однако существует целый ряд системных проявлений, которые нуждаются в более тщательном изучении, в частности поражение сердца. При ХГС описаны миокардит, гипертрофическая (ГКМП) и дилатационная (ДКМП) кардиомиопатии, коронарит вследствие криоглобулинемического васкулита мелких сосудов сердца, аритмогенная дисплазия правого желудочка, аневризма левого желудочка, раннее развитие атеросклероза и ишемической болезни сердца [1—6]. Возможно развитие цирротической кардиомиопатии (КМП), которая наблюдается при циррозах печени различной этиологии, в том числе вирусной. Развивается диастолическая дисфункция миокарда и синдром удлиненного интервала Q—T, выраженность которого увеличивается по мере нарастания декомпенсации функции печени [7—11]. Наконец, широко используемая противовирусная терапия (ПВТ) ХГС может сопровождаться кардиотоксичностью интерферона (ИФН), имеющей клинические особенности и нередко проявляющейся развитием декомпенсации деятельности сердца.
Миокардит является одним из мало изученных внепеченочных проявлений ХГС [3, 4]. В клинике им. Е.М. Тареева описана серия наблюдений из 22 больных хроническим гепатитом вирусной этиологии с миокардитом, у 13 из которых диагностирован цирроз печени. Поражение сердца у 4 больных стало причиной летального исхода. В 3 наблюдениях на аутопсии выявлена картина хронического активного миокардита: обширные очаги лизиса кардиомиоцитов (КМЦ) с очаговой лимфогистиоцитарной инфильтрацией; многочисленные продуктивные и продуктивно-деструктивные эндофлебиты; диффузный фиброз стромы; лимфогистиоцитарная инфильтрация стромы. В одном случае диагностированы диффузный кардиосклероз, миокардиофиброз, диффузный склероз эндокарда. Особенностью двух других наблюдений явились выраженные изменения в проводящей системе сердца: волокна проводящей системы замурованы в грубоволокнистую фиброзную ткань, отмечены резко выраженная дистрофия и некробиоз КМЦ. У этих больных наблюдались различные нарушения проводимости [4].
Первичные КМП представляют собой гетерогенную группу заболеваний миокарда различной этиологии. Наибольший интерес к проблеме миокардитов и КМП, ассоциированных с HCV-инфекцией, отмечен у исследователей из Японии. Выявлена высокая распространенность HCV-инфекции у больных ГКМП, ДКМП и миокардитом [17—20]. При многоцентровом исследовании по программе Комитета по изучению идиопатических КМП в Японии, антитела HCV в сыворотке выявлены у 74 (10,6%) из 697 больных ГКМП и у 42 (6,3%) из 633 больных ДКМП, значительно превышая частоту обнаружения антител HCV у сопоставимых по возрасту доноров крови (2,4%) [20].
По данным A. Matsumori [1], у 113 больных ГКМП, HCV-инфекция диагностирована у 16 (14,1%), причем ни у одного из них не было семейного анамнеза по ГКМП. В 4 наблюдениях имелись указания на гемотрансфузии в анамнезе, у 10 больных определялся повышенный уровень трансаминаз в сыворотке, у 7 выявлен гепатоцеллюлярный рак. При морфологическом исследовании отмечены умеренная или выраженная гипертрофия правого и левого желудочков, фиброз различной степени и умеренная клеточная инфильтрация миокарда. РНК HCV генотипа 1b выявлена в сыворотке у 7 больных, РНК HCV в ткани миокарда — у 6, минус-цепи РНК HCV обнаружены в биоптатах сердца у 2 больных. Другая группа исследователей выявила антитела HCV у 18 (22,5%) из 80 больных ГКМП [21].
Многоцентровое исследование, проводимое научным комитетом по изучению КМП Всемирной федерации заболеваний сердца, ставило задачу выявления вирусных геномов энтеровирусов, аденовируса, цитомегаловируса и HCV в формалиновых срезах ткани сердца. Геном HCV выявлен в 2 (18%) из 11 биоптатов больных ДКМП и миокардитом в Италии и у 4 (36%) из 11 больных в США, у 2 из них выявлен миокардит и у 2 — аритмогенная дисплазия правого желудочка. Несмотря на то что метод выявления генома HCV в парафиновых (фиксированных в формалине) срезах менее чувствительный, чем в замороженных образцах, предполагается, что HCV-инфекция может быть более частой причиной ряда заболеваний миокарда, в первую очередь миокардита [22]. Показано также, что частота развития КМП, обусловленных HCV, варьирует в различных регионах мира и различных популяциях. Среди больных КМП в Канаде (Ванкувер) РНК HCV не обнаружена ни в одном из 24 образцов ткани сердца. Ряд европейских исследователей также высказываются против связи HCV-инфекции и заболеваний сердца [23].
В последние годы также изучается вопрос о взаимосвязи ХГС и уровня натрийуретических пептидов. Так, в крупном ретроспективном исследовании антитела к HCV выявлены у 59 (4,4%) из 1355 больных с СН неясной этиологии, что значительно превышало частоту НCV-инфекции в общей популяции (1,8%). Уровень N-концевого предшественника мозгового натрийуретического пептида (NT-pro-BNP) в сыворотке у больных с СН и ХГС достоверно выше, чем у больных с СН без маркеров HCV (р<0,0001) [24]. Интересным представляется исследование А. Antonelli и соавт. [25], которые выявили повышенный уровень NT-pro-BNP у 34% больных ХГС, в то время как в группе неинфицированных, сопоставимых по полу и возрасту, повышение данного лабораторного показателя отмечалось лишь в 6% наблюдений. Это может свидетельствовать в пользу субклинического поражения сердца у некоторых больных ХГС.
Генетические факторы и патогенетические звенья поражения сердца при HCV. Несмотря на то что в последнее время в литературе описываются клинические наблюдения ДКМП и ГКМП, ассоциированных c HCV [1, 6, 18, 21]; механизм, посредством которого HCV приводит к их развитию, полностью не изучен. У ряда пациентов с ассоциированной с HCV КМП идентифицированы HLA- и не-HLA-гаплотипы, которые дают основание полагать, что фактором развития данного вида поражения сердца является генетическая предрасположенность. Так, в развитии ДКМП участвует α-фактор некроза опухоли (α-ФНО) — один из ключевых цитокинов, усиление синтеза которого наблюдается при HCV-инфекции [26].
Причиной миокардита, приводящего к ДКМП и СН, могут быть некоторые вирусы, обладающие тропизмом к миокарду [27, 28]. Считается, что в основе развития вирусного миокардита и прогрессирования его в КМП лежат механизмы смерти клетки в результате апоптоза, а также индуцированные вирусами иммунные реакции [29]. Предполагаемым иммунным механизмом является постоянное обновление иммунокомпетентных клеток и продуцируемых ими цитокинов [30, 31]. Среди всех цитокинов, участвующих в развитии и прогрессировании миокардита, наиболее важную роль играет α-ФНО [32—34]. Отдельные исследования показали, что имеется связь как между сниженной функцией миокарда и повышенной экспрессией α-ФНО, так и между концентрацией α-ФНО в плазме и миокарде у больных миокардитом [35] и ДКМП [36]. С помощью иммуногистохимического анализа установлено, что α-ФНО продуцируется КМЦ при вирусных миокардитах, ассоциированных с аденовирусом, цитомегаловирусом, вирусом Эпштейна—Барр, вирусами гриппа, А и B, а также HCV [35, 37]. Отрицательный инотропный эффект α-ФНО обусловлен связыванием α-ФНО со специфическими рецепторами TNFR1 и TNFR2, которые экспрессируются на мембране КМЦ [38]. Также вероятно, что α-ФНО ингибирует кальциевые каналы L-типа, что приводит к снижению систолической функции миокарда [39]. Другим механизмом, посредством которого α-ФНО влияет на миокард, является стимулирование продукции оксида азота (NO), который оказывает отрицательное инотропное действие на миокард, действуя как эндогенный ингибитор и фактически уменьшая положительный инотропный ответ на β-адренергическую стимуляцию [40].
Некоторые гены, например гены системы HLA, причастны к клиренсу и персистенции HCV-инфекции [41]. В нескольких исследованиях сообщалось, что ДКМП и ГКМП ассоциируются с некоторыми аллелями системы HLA. Так, у инфицированных HCV пациентов, у которых развивается ДКМП, более часто выявляются гаплотипы HLA-DPB1*0901 и HLA-DRB1*1201, а у инфицированных HCV пациентов с ГКМП — гаплотипы HLA DRB1*0901 и DQB1*0303 [1, 42]. По данным других авторов, развитие ДКМП, ассоциированной с HCV, наиболее отчетливо коррелирует с аллелями не-HLA-генов, чем с генами системы HLA [43]. Таким образом, пилотные исследования демонстрируют, что имеется генетическая предрасположенность к развитию поражения миокарда у пациентов с ХГС (рис. 1).

Рис. 1. Генетическая предрасположенность к поражению миокарда при HCV-инфекции.
По данным N. O’Garra и соавт. [44], в печени развивается выраженный CD4+ Th1 клеточный ответ, наиболее вероятно индуцируемый интерлейкином (ИЛ) 12, ИФН-α и ИФН-β, которые продуцируются моноцитами, нейтрофилами и макрофагами после стимуляции Toll-like-рецепторов HCV производными продуктами. Если определенные гаплотипы кодируют молекулы главного комплекса гистосовместимости (ГКГ) II класса с более высоким сродством к производным пептидам HCV, то их функция как молекул, презентирующих антигены клеткам Th1 CD4+, повышается. После активации клетки Th1 CD4+ продуцируют ИФН-γ, который активирует макрофаги к продукции провоспалительных цитокинов [44]. Главными цитокинами, продуцируемыми макрофагами, являются ИЛ-1 и α-ФНО [45], которые могут приводить к обновлению иммунных клеток и высокой концентрации α-ФНО в миокарде.
Другим механизмом, посредством которого гаплотипы HLA могут влиять на развитие ДКМП, ассоциированной с HCV, в контексте α-ФНО является так называемая неклассическая функция клеток ГКГ II класса, т. е. их роль в качестве сигнальных трансдукционных молекул, активируемых суперантигенами в клетках некоторых типов [46, 47]. Суперантигены являются протеинами бактериального или вирусного происхождения, которые активируют до 20% Т-клеточной популяции путем одновременного связывания Т-клеточных рецепторов и молекул ГКГ II класса, что приводит к массивному высвобождению цитокинов, которые секретируются как Т-клетками, так и антигенпрезентирующими клетками [48—50]. В контексте полиморфизма HLA предполагалось, что они принимают непосредственное участие в исходе, к которому приводит продукция цитокинов, стимулируемая суперантигенами [51, 52]. Можно предположить, что определенные гаплотипы HLA кодируют эпитопы молекул ГКГ II класса с высоким сродством к производным HCV суперантигенам или антителам, а это ведет к чрезмерной продукции цитокинов, в частности α-ФНО. Более активное обновление иммунных клеток может привести у генетически предрасположенных инфицированных HCV пациентов к развитию миокардита и впоследствии к ДКМП. Следует отметить, что часто при ассоциированном с HCV хроническом активном миокардите у пациентов отмечался нормальный уровень активности печеночных трансаминаз в сыворотке крови вплоть до формирования терминальной стадии СН [53].
Развитие и прогрессирование вирусного миокардита, в том числе у больных ХГС, осуществляется через различные патогенетические звенья (рис. 2): 1) прямое действие вируса на миокард; 2) непрямое (иммунологическое) действие; 3) смерть клеток в результате апоптоза.

Рис. 2. Механизмы поражения миокарда при HCV-инфекции. АФК — активные формы кислорода.
Воздействие HCV на миокард. Ряд исследователей указывают на возможность прямого воздействия HCV на миокард. Показано, что HCV реплицируется в миокарде, о чем свидетельствует выявление там негативных цепей РНК [53—55]. Механизм, посредством которого протеин HCVcorе вызывает повреждение миокарда, остается неясным; однако он может быть сходным с механизмом поражения печени. Показано, что изменения в структуре рецепторов TNFR1, вызываемых протеином HCVcorе, повышают чувствительность клеток к цитолизу, опосредованному α-ФНО [56]. Кроме того, протеин HCVcorе вызывает дисфункцию митохондрий, что приводит к развитию окислительного стресса клеток печени [57, 58]. Фактически, протеин HCVcore ограничивает свое действие в митохондриях, в частности он взаимодействует с наружной мембраной митохондрий, повышает поглощение кальция митохондриями и вызывает окисление глутатиона, что приводит к дальнейшему повышению продукции АФК [59, 60]. Повышение образования АФК инициирует продукцию α-ФНО [61], который, как отмечено ранее, оказывает отрицательное инотропное действие на миокард. В некоторых ранее проводимых исследованиях продемонстрировано, что у пациентов с острой и хронической СН, развившихся в исходе КМП, в миокарде определяется повышение выработки АФК [62, 63].
К тому же ряд исследований на животных подтверждают роль протеина HCVcore в развитии КМП. В частности, развитие КМП наблюдалось у трансгенных мышей, носителей гена HCVcore, в возрасте 12 мес. Гистологический анализ миокарда этих мышей выявил гипертрофию КМЦ, кардиальный фиброз, дезорганизацию, дефицит и лизис миофибрилл, вакуолизацию и деформацию ядер, повышенное количество митохондрий неправильной формы [55], что убедительно подтверждает определяющие действие протеина HCVcore на развитие КМП, ассоциированной с HCV.
Непрямой иммунологический механизм поражения миокарда включает вовлечение в патологический процесс В-клеток, Т-клеток и макрофагов. Участие В-клеток в КМП, ассоциированной с HCV, предположено в результате обследования 3 пациентов с ассоциированным с HCV миокардитом, ответивших на иммуносупрессивную терапию. В сыворотке крови этих больных выявлены антитела к миокарду, что дало основание предполагать иммунологический механизм повреждения клеток. В дальнейшем подтверждение иммуноопосредованного механизма КМП, ассоциированной с HCV, было основано на эффективности иммуносупрессивных препаратов (преднизолон и азатиоприн), терапия которыми привела к нормализации размеров камер сердца и регрессу признаков СН, несмотря на продолжающуюся персистенцию HCV [54].
Прямой и непрямой механизмы развития ДКМП, ассоциированной с HCV, связаны со смертью клеток через апоптоз. Благодаря способности повышать продукцию АФК, протеин HCVcore может инициировать митохондриальный путь апоптоза. АФК могут вызывать диссоциацию цитохрома С на внутренней мембране митохондрий, что приводит к активации каспаз, результатом чего является фрагментация геномной ДНК и смерть клетки [64]. В результате связывания лигандов с внеклеточными рецепторами суперсемейства рецепторов α-ФНО происходит активация рецепторзависимого сигнального пути апоптоза [65]. Наиболее важными лигандами этих рецепторов являются α-ФНО и Fas-лиганд (FasL). Высокий уровень α-ФНО в миокарде у пациентов с ассоциированным с HCV миокардитом может активировать данный механизм смерти клеток путем взаимодействия с рецепторами ФНО [66].
Заключение
Имеются убедительные доказательства того, что поражение сердца служит одним из внепеченочных проявлений HCV-инфекции. Механизм, посредством которого HCV может приводить к поражению миокарда у генетически предрасположенных пациентов, является многофакторным и включает прямое повреждающее действие вируса, аутоиммунный механизм и апоптоз.
Поражение миокарда при ХГС может прогрессировать в хронический персистирующий миокардит через прямой (вирусный) и непрямой (иммунный) механизмы повреждения, которые приводят к активации зависимой от рецепторов смерти КМЦ, результатом чего является развитие фиброза миокарда с возможной трансформацией в ДКМП. Кроме того, описаны случаи взаимосвязи HCV и ГКМП.
До настоящего момента HCV-инфицированным больным с вовлечением сердца ПВТ, как правило, не проводилась из-за побочных эффектов ИФН. Однако за последние несколько лет в ПВТ вирусного гепатита С произошли кардинальные изменения. Длительное изучение механизмов репликации HCV привело к созданию ингибиторов протеаз HCV (NS¾A, NS5A, NS5B), которые позволяют достичь элиминации вируса у 90—99% пациентов за существенно более короткий срок (как правило, 12 нед) без применения препаратов ИФН (так называемая безинтерфероновая терапия). Это делает данную терапию гораздо более безопасной и хорошо переносимой, в том числе в отношении миокарда [67—69].
Нуждается в отдельном изучении вопрос эффективности и безопасности ПВТ у пациентов с ХГС и ассоциированного с ним поражения сердца, включая сравнение только ПВТ и сочетания ПВТ с сердечно-сосудистыми препаратами и/или иммуносупрессорами. Выявление антител к миокарду и определение уровня α-ФНО в сыворотке крови во время терапии может быть использовано для оценки влияния терапии на данные маркеры.
Читайте также:


