Иммунный статус и вирусы
Обновлено: 11.05.2024

Обзор
Авторы
Редакторы

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Чтобы защитить нас от опасных заблуждений, давайте разберемся:
- как устроен вирус ;
- зачем вирусу попадать в организм человека;
- как иммунитет реагирует на вирусы;
- как медицина может помочь иммунитету, если сам он не справляется.
В статье речь идет в основном о новом коронавирусе. — Ред.
Видео. Вирусы и иммунитет: кто кого?
Как устроен вирус
Человек состоит из клеток, в которых очень важную роль играют белки. В ядре клетки хранится ДНК: все вы, наверное, видели картинки с этими переплетенными нитями из разноцветных кусочков.

Кусочки эти одинаковые у всех: и у людей, и у животных, и у растений, и у вирусов. Именно последовательность кусочков ДНК определяет особенности белков в нашем организме, а значит, влияет на наш внешний вид, работу органов и состояние здоровья.
Чтобы разобраться, как клетки производят белки, давайте представим следующее.
Допустим, вы производите посуду. Суперценный образец хранится в сейфе, и вы не готовы вынимать свой эталон из сейфа, даже чтобы сделать новый экземпляр. Поэтому специальный человек прямо в сейфе делает слепок кружки и приносит этот слепок рабочим, которые изготовят новую кружку по форме, получая от курьеров необходимые кусочки материала.

В ядре клетки, как в сейфе, хранится ДНК. С помощью белков-ферментов с ДНК снимается копия — информационная РНК. РНК попадает в рибосому, где начинается сборка белка. А транспортная РНК подносит фрагменты, из которых и собираются белки .

Так работает производство белка не только у человека, но и у многих других живых существ.
Все они адаптируются к среде, как могут, чтобы выжить и дать потомство. Человек тоже приспособился, и в этом ему сильно помог головной мозг. Он позволил ему придумывать приспособления для выживания и передавать информацию другим людям. Благодаря обмену знаниями и их накоплению человек может жить очень долго, потому что поселился в прочных зданиях, изобрел множество приспособлений и научился справляться с болезнями [1].
Раньше людям с рождения угрожали хищники, погодные катаклизмы, огромное количество вирусов и бактерий. Оспа, чума, грипп, малярия, бешенство, энцефалит, столбняк — люди умирали сотнями и тысячами и от эпидемий, и от банальных царапин. Но благодаря достижениям медицины мы научились лечить и предотвращать многие из них [2], [3].
Сейчас может показаться, что этих угроз вообще никогда не существовало. А если окажется, что они существуют до сих пор, очень хочется обвинить кого-нибудь в их создании, как будто они сами не могли появиться из природы. Но вообще-то могли.
Зачем вирусу попадать в организм человека
Вирус отличается от других живых организмов, потому что не питается, не выдает отходы жизнедеятельности, не стареет (вокруг вирусов до сих пор идет дискуссия, стоит ли их вообще считать формой жизни). Но, как и мы, вирус размножается и может умереть. Вирус похож на флешку: снаружи оболочка с шипиками-разъемами для подключения, а внутри информация (ДНК или РНК).

С помощью шипиков вирус пытается попасть внутрь клетки организма, как флешка пытается подключиться к компьютеру. Если все получилось, вирус забирается внутрь, раздевается и начинает диверсию [4].
Если у вируса внутри ДНК, он контрабандой доставляет ее в ядро, запускает копирование этой ДНК, создание РНК и далее по порядку. Если это РНК, он просто подменяет родную РНК клетки на свою [5].
В обоих случаях клетка делает белки не для себя, а для новеньких вирусов.

Когда клетка изжила весь свой ресурс, она лопается. Оттуда прут детки-вирусы, которые с помощью своих шипиков проникают в другие клетки, и процесс повторяется [6], [7].
Как иммунитет реагирует на вирусы
Итак, в организм ворвался чужак, использует наши клетки. Организм должен как-то отреагировать.
Иммунная система как раз отвечает за способность человека противостоять внешним угрозам. Как происходит иммунная реакция именно на вирусы?
Ключевые иммунные клетки — это фагоциты, B-лимфоциты , T-хелперы и T-киллеры.
Латинская буква B происходит от латинского названия bursa fabricii — иммунного органа птиц, в котором их впервые обнаружили.

Когда вирус попадает в клетку, та выставляет на поверхности сигнал о том, что она болеет. На этот сигнал тревоги приходят T-киллеры и фагоциты и пытаются уничтожить зараженные клетки и вирусы.

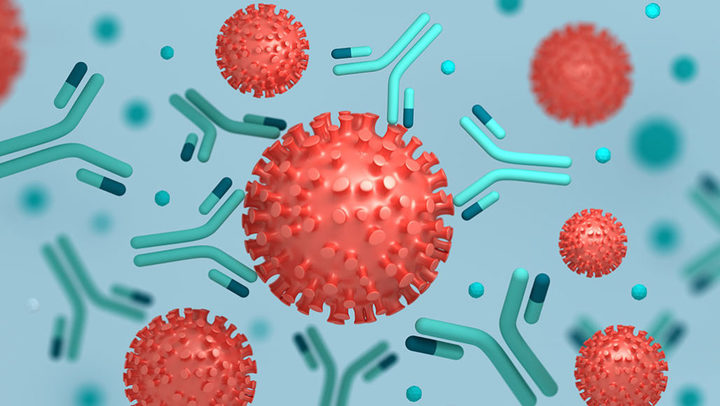
По пути фагоциты хватают сигнальную метку и передают ее T-хелперам. Это клетки-курьеры, которые отправляют полученный материал на изучение B-лимфоцитам. Они разрабатывают специальное оружие против вирусов и зараженных клеток — антитела. Антитела, как черная метка, цепляются за пораженную клетку, и T-киллеры могут быстрее ее обнаружить.

Если метка зацепилась за вирус, на сигнал приходит еще одно оружие — система комплемента, похожая на гранату, которая срабатывает, если два кусочка гранаты соединить вместе.

То есть антитела — это ускоритель иммунной реакции, который обращает внимание T-киллеров на зараженные клетки и подключает систему комплемента. Таким образом организм справляется гораздо быстрее и теряет меньше здоровых клеток.
Часть B-лимфоцитов, изучив вирус, вместо того чтобы создавать антитела прямо сейчас, остается с новыми знаниями про запас, на случай повторного заражения, и превращаются в клетки памяти. Если организм столкнется с вирусом еще раз, то просто активирует клетки памяти. И мы получим моментальные точные выстрелы снайперов и гранатометчиков [8], [9].

Пока вся эта канитель происходит, человеку может стать так плохо, что потребуется госпитализация или даже реанимация. Но накопленный опыт, технологии и медицина как-то должны помогать таким пациентам.
Как медицина может помочь иммунитету, если сам он не справляется
На каком этапе иммунной реакции человек может вмешаться?
Начнем с этапа, когда вирус пытается взломать клетку. У коронавируса есть ключики от слизистых: можно потрогать зараженный объект руками и перенести заразу себе, прикоснувшись к лицу. Носители могут чихнуть или кашлянуть на вас. Капельки слюны распыляются, когда вы разговариваете или смеетесь [10].
С руками все просто: можно смыть верхний слой кожного жира, на котором остаются вирусные частицы. А вот клетки слизистых надо как-то отгородить, например, маской . Но она не защищает глаза. Вирусы, попадая на маску, никуда не исчезают — они там копятся. Важно не занести их, когда вы будете поправлять или снимать маску. А самодельные тканевые маски могут быть бесполезны, если у них широкие поры.
Кардинальный метод защиты (и пока лучший) — уйти на карантин. Но в таком случае плохо становится не здоровью людей, а экономике.
Поможет ли молитва? Нет, клетки устроены одинаково и у церковнослужителя, и у бабули, и у знаменитости.
Поможет ли водка от вируса? Нет. Когда вы пьете алкоголь, вы не дезинфицируете организм, а ослабляете его. Так иммунным клеткам придется даже сложнее [12].
Чеснок, имбирь и другие чудеса народной медицины не работают антисептиком [11]. Чтобы разрушить вирусную частицу, нужен раствор с содержанием спирта не менее 60%, например, специальный антисептик для рук. Им логично протирать руки, поручни, дверные ручки и мобильные телефоны.
Допустим, попадание вируса в организм предотвратить не удалось. Начинается месиво: фагоциты и T-киллеры не справляются, B-лимфоциты стараются делать антитела и клетки памяти, пока вирус вовсю использует наши клетки. За это время человеку может стать очень плохо.
Можно ли помочь B-лимфоцитам? Да, можно еще до заражения ввести мертвый вирус, кусок вируса или подобие вируса, чтобы B-лимфоциты потренировались и заранее сделали антитела. Такой метод называется прививкой [13–16].


Создание лекарств занимает годы. Нужно найти действующее вещество, способ доставлять его в клетки, сделать из него препарат, который не испортится при хранении и не убьет побочными эффектами .
Сайт-агрегатор отчетов по клиническим исследованиям — ClinicalTrials.gov.
Если человеку стало очень плохо, нужно поддержать его организм, чтобы он выжил, пока побеждает вирус. Для этого людям нужны койки в больницах, аппараты ИВЛ и врачи. Но если инфекция быстро распространяется, много людей одновременно нуждаются в помощи.
Напомним, что ивазивная ИВЛ травматична и сама по себе опасна: например, тем, что может повлечь за собой заражение пациента дополнительной внутрибольничной инфекцией. — Ред.

Чтобы люди не умирали без помощи медиков, нужно искусственно замедлить скорость распространения вируса — сидеть дома. Чем больше людей игнорируют карантин, тем больше тех, кому не хватит медицинской помощи, а значит, будет больше смертей [18].
Если организм справился с инфекцией, у него появляются клетки памяти, поэтому он не будет носителем и не заразит других людей. Если клетки памяти будут у большинства, появится коллективный иммунитет. В таких условиях человек из группы риска вряд ли встретит носителя. Когда все носители переболеют, вирус среди людей не будет встречаться.

Некоторые страны уже снимают карантин. Но еще не понятно, есть ли коллективный иммунитет и не вызовет ли это новую волну заражений. В случае с коронавирусом пока неизвестно, сколько живут клетки памяти [19].
В России все еще каждый день заболевает по 8–10 тысяч человек. Возможно, в вашем регионе пандемия только набирает обороты . А значит, любой человек на улице может оказаться носителем.
В наших силах если не остановить, то хотя бы замедлить темпы, чтобы люди не умирали без помощи медиков.
Что же делать людям в борьбе с вирусом?
Защищаться мытьем рук и антисептиками? Искать вакцину или лекарство? Ждать, когда появится коллективный иммунитет? Или замедлять социальную активность, чтобы одновременно не заболело много людей? Сейчас мы делаем всё сразу.
Большинство стран мира следуют рекомендациям ВОЗ. Сайт этой организации переведен на русский язык. Там можно найти комментарии к мифам о коронавирусе и официальные рекомендации как для медиков, так и для населения. Если кто-то предлагает вам чудесное лекарство от болезни, проверьте, написали ли о нем эксперты ВОЗ.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Чтобы разобраться с этим, сначала нужно понять, как иммунная система устроена и какие бывают виды иммунитета.
по теме

Мнение
Кто отвечает за работу различных видов иммунитета?
- Костный мозг. Это центральный орган иммуногенеза. В костном мозге образуются все клетки, участвующие в иммунных реакциях.
- Тимус (вилочковая железа). В тимусе происходит дозревание некоторых иммунных клеток (Т-лимфоцитов) после того, как они образовались в костном мозге.
- Селезенка. В селезенке также дозревают иммунные клетки (B-лимфоциты), кроме того, в ней активно происходит процесс фагоцитоза — когда специальные клетки иммунной системы ловят и переваривают проникших в организм микробов, фрагменты собственных погибших клеток и так далее.
- Лимфатические узлы. По своему строению они напоминают губку, через которую постоянно фильтруется лимфа. В порах этой губки есть очень много иммунных клеток, которые также ловят и переваривают микробов, проникших в организм. Кроме того, в лимфатических узлах находятся клетки памяти — это специальные клетки иммунной системы, которые хранят информацию о микробах, уже проникавших в организм ранее.
Таким образом, органы иммунной системы обеспечивают образование, созревание и место для жизни иммунных клеток. В нашем организме есть много их видов, вот основные из них.

по теме
Эпидемия
Учёные выяснили, как вирусы обманывают иммунитет
Как наша иммунная система понимает устройство антигена и подбирает подходящее для него антитело?
После этого успешно справившийся с задачей B-лимфоцит превращается в плазматическую клетку и начинает в большом количестве синтезировать антитела. Они поступают в кровь, разносятся по всему организму и связываются со всеми проникшими бактериями, вызывая их гибель. Кроме того, бактерии с прилипшими антителами гораздо быстрее поглощаются макрофагами, что также способствует уничтожению инфекции.
Есть ли еще какие-то механизмы?
Специфический иммунитет не был бы столь эффективен, если бы каждый раз при встрече с инфекцией организм в течение двух недель синтезировал необходимое антитело. Но здесь нас выручает другой механизм: часть активированных Т-хелпером В-лимфоцитов превращается в так называемые клетки памяти. Эти клетки не синтезируют антитела, но несут в себе информацию о структуре проникшей в организм бактерии. Клетки памяти мигрируют в лимфатические узлы и могут сохраняться там десятилетиями. При повторной встрече с этим же видом бактерий благодаря клеткам памяти организм намного быстрее начинает синтезировать нужные антитела и иммунный ответ запускается раньше.
Таким образом, наша иммунная система имеет целый арсенал различных клеток, органов и механизмов, чтобы отличать клетки собственного организма от генетически чужеродных объектов, уничтожая последние и выполняя свою главную функцию — поддержание генетического гомеостаза.
Как организм понимает, какие антитела вырабатывать?
Как антитела вырабатываются при вакцинации?
Продолжительность вакцинного иммунитета тоже зависит от иммунологической памяти и может отличаться от естественного иммунитета, возникшего после болезни. Когда иммунитет угасает, нужно вакцинироваться снова. Для вакцин от разных инфекций есть свои графики повторной вакцинации, их частота зависит от времени хранения иммунологической памяти.
Вакцины, полученные по различной технологии, могут отличаться по времени действия вакцинного иммунитета. Обычно эти различия не слишком велики, так как продолжительность иммунитета в гораздо большей степени зависит от вида самого возбудителя, чем от конкретной вакцины.
На формирование защитного иммунитета также влияет состояние самого организма. Например, при тяжелых заболеваниях иммунной системы (наследственные иммунодефициты, злокачественные новообразования) иммунный ответ на вакцину может быть снижен или не формироваться вообще. Как показывает многолетний опыт использования разных вакцин, в случае ВИЧ-инфекции иммунный ответ на вакцины, как правило, ничем не отличается от иммунного ответа у ВИЧ-негативных людей. Поэтому графики вакцинации и дозы вакцины для ВИЧ-позитивных пациентов не будут иметь никаких особенностей.
по теме
Лечение
Безумно дорогое лекарство, которое спасет мир от пандемии
Некоторые лекарства, например глюкокортикоиды и иммунодепрессанты, могут подавлять формирование вакцинного иммунитета. В таких случаях тактику вакцинации нужно обсудить с врачом.
Для вакцин от новой коронавирусной инфекции время действия вакцинного иммунитета остается одним из главных вопросов. Предсказать продолжительность защиты той или иной вакцины очень трудно. Обычно это выясняют на практике, регистрируя частоту инфекций у привитых во время массовой вакцинации людей спустя разное количество времени, а также измеряя титр защитных антител.
Титр? Какой еще титр?
Так как антитела — это сложные белки, определять их химическими методами крайне трудно. Поэтому для определения антител используют иммунологические реакции. Конкретных методов очень много, но в самом общем виде суть этих реакций очень простая. Мы берем раствор нужного антигена (например, того самого шиповидного белка коронавируса) и смешиваем его с сывороткой, в которой ищем антитела. Если антитела в сыворотке есть, то они связываются с антигеном и их соединение выпадает в виде осадка или раствор мутнеет. На практике проведение такой реакции выглядит сложнее, часто используют специальные гелевые среды и разные способы детектирования, но суть от этого не меняется.
Проблема в том, что такой подход отвечает нам только на вопрос, есть антитела в сыворотке или их нет, но ничего не говорит о количестве самих антител. Как в таком случае сравнить между собой две разные сыворотки? По количеству выпавшего осадка — не вариант, слишком большая погрешность. Но есть другой способ — можно разводить исследуемую сыворотку до тех пор, пока реакция (осадок) все еще будет обнаруживаться. И вот последнее, самое сильное разведение, при котором мы еще можем наблюдать реакцию сыворотки с раствором антигена, и называют титром этой сыворотки. То есть титр 1:50 говорит нам о том, что эту сыворотку можно развести в 50 раз и она еще будет давать реакцию с антигеном. Соответственно, чем больше вторая цифра в обозначении титра, тем выше концентрация антител в сыворотке.
Недостаток титра в том, что он указывает на относительное содержание антител. Если у нас есть две сыворотки с титрами 1:50 и 1:100, мы можем с уверенностью сказать, что во второй сыворотке антител в 2 раза больше, чем в первой. Но какая именно концентрация антител в каждой из этих сывороток, мы не знаем. На практике это часто бывает и не нужно: нам достаточно знать, с каким титром антител человек еще защищен от инфекции, а с каким — уже нет. Это легко выяснить, измеряя титр антител у вакцинированных людей, которые все же заразились.
В результатах лабораторных анализов обычно указывают концентрацию антител в международных единицах (МЕ) или относительных единицах (ОЕ). Результаты, полученные в МЕ, можно сравнивать между собой — значение не будет зависеть от лаборатории, тест-системы и условий анализа (для коронавируса таких пока нет). Результаты, выраженные в ОЕ, можно сравнивать между собой только для тестов одной марки, при этом сама лаборатория и время анализа роли не играют, то есть можно отслеживать динамику изменения уровня антител у одного человека.
Чтобы понять, нужна ли вакцина и подействовала ли она, достаточно измерить уровень антител? Какой нужен для ковида?
К сожалению, все немного сложнее. Антитела отвечают за гуморальный иммунитет — и это только лишь часть нашей иммунной системы. Помимо гуморального, есть еще клеточный иммунитет, работа которого не зависит от уровня антител. При защите от разных инфекций разные звенья иммунитета играют неодинаковые роли. В каких-то случаях ведущую роль имеет гуморальный иммунитет и антитела (например, в случае гепатита В, гриппа, столбняка и многих других инфекций). В других случаях — ведущая роль у клеточного иммунитета, например, при туберкулезе. По новой коронавирусной инфекции пока слишком мало данных, чтобы делать выводы о важности каждого из звеньев иммунитета и необходимом уровне антител. То есть даже если вы сделаете тест на антитела, эта информация практически ничего не даст по ряду причин.
Если вы еще не вакцинировались и тест на антитела будет положительным, что говорит о перенесенной инфекции в бессимптомной форме, это все равно не является противопоказанием к вакцинации. Мы не знаем, какова продолжительность естественного иммунитета, так что вакцина может продлить или усилить защиту.
Если вы делаете тест на антитела после вакцинации, сейчас нет надежных данных, с которыми можно было бы соотнести полученные результаты и сделать вывод о том, подействовала ли вакцина. Другими словами, пока никто не знает, сколько должно быть антител после вакцинации, чтобы гарантировать надежный уровень защиты. Плюс уровень антител ничего не говорит о состоянии клеточного иммунитета, а он тоже может быть очень важен для защиты.
Если вы наблюдаете за динамикой концентрации антител после вакцинации и видите ее снижение, это еще не говорит о снижении уровня защиты. Как мы выяснили выше, падение концентрации антител в крови с течением времени — это нормальное явление, а долговременную защиту обеспечивает иммунологическая память, которая с концентрацией антител не связана.
Не все антитела одинаково полезны
Для характеристики антител важно понимать их класс, тип и с каким антигеном они связываются.
Антитела бывают разных классов (A, M, G, E и др.). Основной класс защитных антител — G, в лабораторных исследованиях и тестах их обычно обозначают IgG. Наличие этих антител в крови говорит о наличие иммунитета после вакцинации или перенесенного заболевания. IgM — тоже защитные антитела, которые начинают вырабатываться первыми, раньше, чем IgG. Обычно IgM менее эффективны, чем IgG, и почти полностью исчезают к концу заболевания. Наличие этих антител обычно указывает на еще протекающее, или совсем недавно перенесенное заболевание, или на хроническую инфекцию. То есть, если нас интересует устойчивый иммунитет, в тестах ищем IgG.
И, наконец, антиген. Как мы разбирали выше, антитела обладают очень высокой специфичностью и связываются только с определенными белками. Когда иммунная система, столкнувшись с инфекцией, подбирает нужное антитело, она чаще всего начинает синтезировать сразу несколько разных видов, нацеленных на разные белки возбудителя. Ведь клетки, синтезирующие антитела, получают для анализа разные кусочки полупереваренного микроба — и поверхностные, и внутренние белки — и для каждого из них ищут антитело. Для эффективной защиты важны именно те антитела, которые связываются с белками на поверхности вируса или бактерии. Ведь антитела — это крупные молекулы, которые не могут поникать внутрь вирусных частиц или бактерий, для них доступны только поверхностные белки. Именно поэтому защитный иммунитет в первую очередь обеспечивают антитела к поверхностным антигенам. Например, в случае коронавирусной инфекции вырабатывается как минимум 2 вида антител — к S-белку (который на поверхности вирусной частицы) и к N-белку (он же нуклеокапсидный белок, который находится внутри вирусной частицы). Так как до N-белка антитела добраться не могут, защиту будут обеспечивать именно антитела к S-белку. То есть, если вы все же хотите определить уровень защитных антител после прививки от ковида, нужно искать тест на нейтрализующие IgG к S-белку.
Читайте также:

