Изобрели вакцину от всех видов гриппа
Обновлено: 26.04.2024
История тысячелетней войны
Столетиями люди страдали от разных болезней. Распространенные и редкие, экзотические и местные — заболеваний было больше чем достаточно во все времена существования человечества. Люди не знали главного: что вызывает эпидемии. Например, ещё Гиппократ подробно описал свинку, в том числе отметил и ее заразность для маленьких детей. Вот только почему происходили заражения, было непонятно. И только с развитием биологии и медицины люди стали понимать, в чем причина вспышек заболеваний.
Когда Луи Пастер в XIX веке доказал, что заразные болезни вызывают микроскопические живые организмы — микробы (сегодня мы называем их бактериями), люди стали думать, что наконец нашли причину всех инфекций. Но оказалось, что это не так. Ни один из экспериментальных способов обнаружения бактерий не находил их присутствия в тканях, зараженных оспой, корью или свинкой. Научный мир даже не предполагал возможности существования возбудителя, полностью отличного по своей природе от микробов.
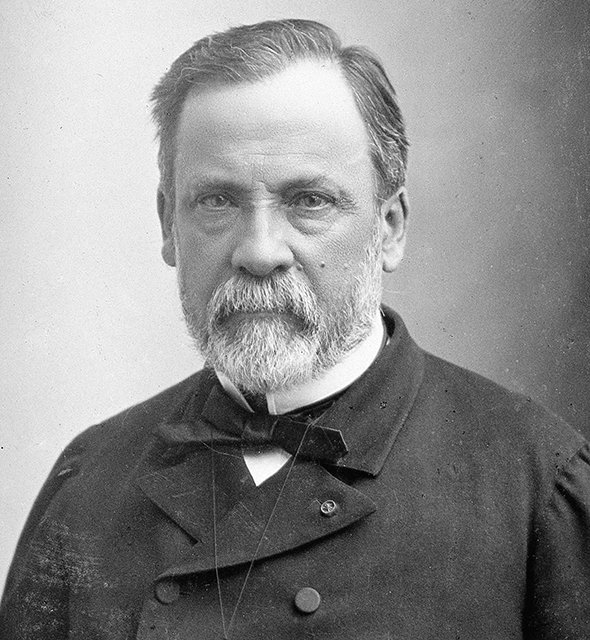
В 1886 году немецкий агроном Адольф Майер занялся изучением мозаичной болезни табака. Он заметил, что сок больных растений вызывает у здоровых такое же заболевание. Мейер несколько лет искал бактерию — причину болезни, и отступил: ее просто не было. В 1892 году физиолог Дмитрий Ивановский из Петербургского университета также занялся мозаичной болезнью, свирепствовавшей на плантации табака в Крыму.

Догадки Майера были верны: сок больных растений был заразен, но после кипячения переставал быть таковым. Ивановский верил, что причиной болезни должны быть бактерии, но под микроскопом ничего не находилось. Он пропускал сок зараженных растений через фильтры из мелкопористой глины, которая задерживает любые микроорганизмы, но сок оставался заразным.
С 1892 года, когда Ивановским был описан небактериальный инфекционный возбудитель табачной мозаики, открытия посыпались одно за другим: в 1901-м обнаружили вирус желтой лихорадки; в 1902-м — оспы животных; 1903-м — бешенства; в 1909-м — полиомиелита; в 1916-м — кори; в 1917-м — вирус герпеса. К 1978 году было известно более 500 вирусных болезней.
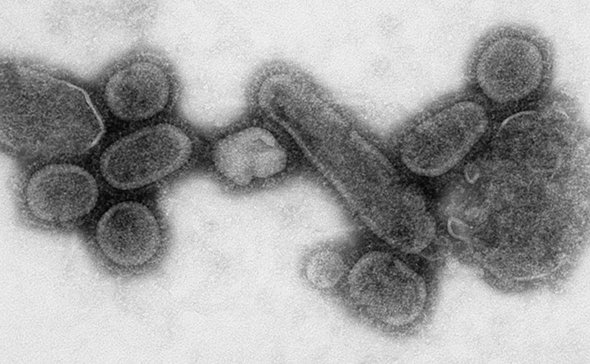
Оказалось, что большинство инфекций вызывают вирусы, а не бактерии. Ими занялись научно-исследовательские институты всех стран мира. Было выяснено, что бактерии способны в течение длительного времени сохраняться в земле, в воде, на поверхности любых предметов. А вот вирусы вне живых клеток могут оставаться лишь непродолжительное время, они легче переносят холод, и хуже — тепло. На солнечном свету вирусы погибают быстро, при комнатной температуре проживают несколько часов, на морозе способны сохраняться годами.
Вне живого организма вирусы не размножаются. Болезнь, вызванная вирусами, — это всегда передача от одного человека к другому, от одного животного к другому.
На сцену выходит грипп, все хлопают, многие убегают
Вы, без сомнения, знакомы с самой распространенной вирусной инфекцией среди людей — это грипп. Его эпидемии не раз охватывали Землю целиком и были известны еще с XII века. С XVI века грипп периодически появлялся в Европе, и эпидемии повторялись каждые 10–20 лет. Раз в два-три года вспышки меньшего размера прокатывались по странам, не затрагивая континент целиком.

Испанка: история самой смертоносной эпидемии XX века
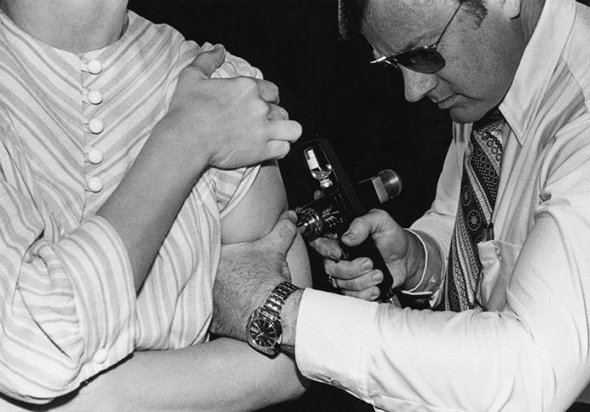
В начале века причиной заболевания считали гемофильную палочку — бактерию, найденную в 1892 году немецким бактериологом Рихардом Пфайффером и ошибочно принятую за возбудитель гриппа. Только в 1933 году одновременно в Англии (Патрик Лейдлоу, Уилсон Смит и Кристофер Эндрюс) и в СССР (Анатолий Смородинцев) обнаружили вирус гриппа человека. В это время как раз пошла новая волна заболеваний гриппом, и материала для изучения было много: в мазках из горла больных не находили бактерий и микробов, а профильтрованная жидкость все равно оставалась заразной. Это был вирус.
В 1936 году в Национальном институте медицинских исследований в Англии началась разработка первых экспериментальных вакцин от гриппа, и уже в 1939 году начался их выпуск. В СССР вакцины появились даже раньше. В начале 1930-х отделом бактериологии в Ленинградском институте эпидемиологии и бактериологии имени Луи Пастера руководил Анатолий Смородинцев. В 1936–1938 годах он разработал первую одновалентную — на основе одного штамма (разновидности) гриппа — вакцину. Для вакцинации команда Смородинцева применяла жизнеспособные ослабленные вирусы, а не их фрагменты. И хотя живые вакцины, как считают сегодня, обладают многими побочными эффектами и осложнениями, не подходят для всех групп населения, они стали большим шагом вперед в борьбе с гриппом. Именно ими стали прививать жителей СССР. Живые вакцины (сделанные по методу Смородинцева) используются и по сей день.

Массовая вакцина в США появилась только в 1943–1945 годах, ею прививали во время Второй мировой войны солдат армии США. В 1946 году началась массовая вакцинация населения. Изготавливалась американская вакцина из мертвых вирусов (инактивированная вакцина).
Для профилактики гриппа используются вакцины трёх основных типов:
- Живые вакцины имитируют естественную инфекцию, но их эффективность варьируется: они вводятся через нос, иммунный ответ зависит от количества прижившегося вируса. Проблема в том, что можно заболеть всерьез, поэтому ими не рекомендуют прививать детей и пожилых людей. Зато живые вакцины дают длительный иммунитет — до трех лет.
- Инактивированные вакцины вводятся подкожно. Осложнений меньше, но они тоже есть, иммунитет действует около полугода.
- Субъединичные вакцины рекомендованы детям до 2 лет и пожилым людям, у них меньше побочных эффектов. Иммунитет — на полгода.
Кто этот скромный микробиолог?
Анатолий Смородинцев родился 19 апреля 1901 года в Башкирии — в Бирске, в семье земского доктора Александра Смородинцева. В 1923 году Анатолий окончил медицинский факультет Томского университета и начал работать в Бактериологическом институте. В 1924 году ушел на Гражданскую войну, попал на Туркестанский фронт.
В 1925 году Анатолий Смородинцев переехал в Ленинград, чтобы стать микробиологом в Институте экспериментальной медицины под руководством создателя ленинградской школы микробиологов Оскара Гартоха. Он работал в бактериологической лаборатории Института акушерства и гинекологии, в отделе бактериологии Ленинградского института эпидемиологии им. Л. Пастера.

В 30-е годы в Институте экспериментальной медицины занимались вирусным энцефалитом, корью, полиомиелитом. И, конечно, гриппом. Смородинцев первым занялся исследованием противовирусного (противогриппозного) иммунитета. Он изучал иммунный ответ вирусам гриппа и роль вируснейтрализующих антител в его формировании. Работа Анатолия Смородинцева, посвященная вакцинопрофилактике гриппа, была в 1937 году опубликована в самом авторитетном медицинском издании — британском журнале The Lancet. В 1939 году им были созданы первые образцы противогриппозных вакцин.

Анатолия Смородинцева называют создателем советской вирусологии. В конце 30-х годов в Сибири, в экспедициях, в которых от клещевого энцефалита гибли микробиологи, он смог создать и испытал на себе первую в мире вакцину против клещевого энцефалита. Она спасла жизни многих людей в Сибири. Смородинцев стал автором знаменитой живой вакцины от полиомиелита, которую из СССР экспортировали в 60 стран мира. В 1967 году он настоял на открытии Всесоюзного института гриппа в Ленинграде. Также он разработал вакцины против кори, эпидемического паротита, краснухи, описал геморрагический нефрозонефрит и двухволновый менингоэнцефалит.
Вирусы атакуют снова
Но появление вакцины от гриппа не стало победой над болезнью: тогда ученые еще не знали, что вирус быстро мутирует, уворачиваясь от атак иммунитета.
В 1940 году в США микробиолог Томас Фрэнсис выделил из материалов больного вирус с похожими на грипп проявлениями, но новый вирус не реагировал на антитела к вирусу гриппа человека, открытому британскими учеными в 1933 году. Это оказался новый штамм болезни. Стало понятно, что одновременно по Земле ходит несколько видов гриппа и вакцина от одного штамма не защищает от другого.
Открытые в 1933-м вирусы гриппа назвали группой А, а в 1940-м — группой В. В 1949 году вирус А исчез, а вместо него появился вирус гриппа с новыми свойствами, который назвали А1. Однако он распространялся среди людей всего восемь лет — и только ученые начали испытания вакцин, как его не стало.

Что такое американский грипп В, кому не страшен вирус и когда вызывать скорую. Педиатр — об эпидемии в этом году
В середине 60-х годов академик Анатолий Смородинцев и одновременно с ним Томас Фрэнсис, первооткрыватель штамма типа В, на основе изучения особенностей вируса гриппа предположили, что он изменяется в пределах конечного числа вариантов. Они высказали гипотезу, что вирусы, которые вызывают современные эпидемии, уже появлялись в прошлом столетии.
Вакцины от гриппа сегодня
Сегодня эксперты Всемирной организации здравоохранения каждый год рекомендуют комбинации белков для вакцин. Ими, по прогнозам, должны обладать те штаммы вируса гриппа, которые будут основными в следующем сезоне. За гриппом сегодня следит глобальная сеть из 112 научных институтов в 83 странах. Полной защиты любая прививка не дает, однако предотвращает около 40% случаев заболеваний и, главное, способна остановить пандемию.
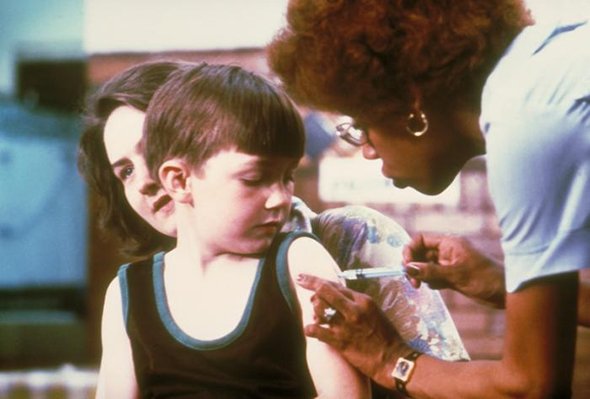
Ученые наблюдают, изучают и ведут учет всех существующих штаммов гриппа и их геномов. В 2012 году впервые появилась квадривалентная инактивированная вакцина — она дает иммунитет от сразу четырех опасных штаммов.
Основной проблемой остается необходимость производить новые вакцины ежегодно, ведь эволюция вируса гриппа на месте не стоит. Идеальным решением стала бы универсальная вакцина, которую не нужно было бы изобретать заново каждый год, но изменчивость вируса делает эту задачу невероятно трудной.
ВОЗ публикует рекомендации по составу вакцин против гриппа дважды в год: для Северного и для Южного полушарий. FluNet — это глобальный веб-инструмент для вирусологического надзора за гриппом, который работает с 1997 года. Данные FluNet используют для отслеживания движения вирусов по всему миру. Данные по странам публикуются еженедельно.
В России от гриппа массово начали прививать с 1996 года. Эта прививка включена в национальный календарь и проводится в государственных медицинских организациях. Вакцинации против гриппа подлежат дети с 6 месяцев, школьники, студенты, работники медицины, транспорта, торговли, коммунальной сферы, призывники, беременные женщины, люди старше 60 лет и страдающие хроническими заболеваниями. Будьте здоровы!
Первые упоминания об эпидемиях гриппа появились еще в XV–XVI веках, но самая трагичная и всем известная эпидемия была в 1918 году. По разным оценкам во время этой эпидемии погибло от 50 до 100 миллионов людей. Так что, несмотря на то, что мы уже на протяжении многих веков регулярно встречаемся с вирусом гриппа, однажды для нас это может оказаться серьезной проблемой. Возможно ли это как-то предотвратить?
На нашем счету есть уже одна победа. Много веков вспышки эпидемии натуральной оспы ежегодно уносили сотни тысяч жизней. Но это длилось до тех пор, пока английский врач Эдвард Дженнер не изобрел вакцину против натуральной оспы. И после проведения крупномасштабных кампаний по вакцинации всех жителей Земли, в 1979 году Всемирная организация здравоохранения наконец-то объявила о полном искоренении этого заболевания.
Позднее на конференции в Далеме был сформулирован ряд условий:
• вирус должен заражать только человека;
• существует быстрая и точная диагностика;
• у заболевания нет скрытой формы и возможно ограничить распространение патогена;
• инфекция не должна быть летальной или существует эффективная вакцина.
Для оспы эти условия выполнимы: вирус натуральной оспы заражает только человека, заболевание имеет характерную клиническую картину, пока не проявились первые признаки заболевания, человек практически не заразен, и у нас есть хорошая вакцина.
Применимо ли это к гриппу? Все наверняка слышали про свиной, птичий грипп. Да, грипп заражает не только людей. У гриппа такие же симптомы, как и еще у 200 различных вирусных заболеваний, а его точная диагностика обойдется в 2,5 тысячи рублей. Вы начнете заражать окружающих еще до того, как появятся первые симптомы. И последнее: у нас нет высокоэффективной вакцины против гриппа.
К сожалению, в ближайшее время грипп не будет искоренен. Изменить природу вируса гриппа уж слишком амбициозная задача. А вот создать новую эффективную вакцину вполне реально.
Какой она должна быть? Во-первых, эффективной, то есть после вакцинации у большинства людей будет формироваться хорошая иммунная защита, и они не заболеют. Во-вторых, универсальной, то есть эта защита будет действовать против большого разнообразия штаммов вируса гриппа. Штамм — это конкретный вирус, который был выделен в определенное время в определенном месте.
Как производят вакцину сейчас
Каждый год вакцину против гриппа собирают с нуля, но по уже отработанной технологии, которая максимально сжата по срокам и занимает восемь-девять месяцев. Сначала собирают информацию о том, какие штаммы циркулируют в природе. В феврале это все обсуждают и выбирают три или четыре наиболее подходящих для вакцины штамма. Затем запускается многостадийное производство, самая длительная стадия которого — выращивание вируса в куриных эмбрионах. Затем надо пройти тестирование на эффективность и безопасность и получить лицензию, только после этого вакцину можно продавать.
В чем здесь проблема? Пока восемь месяцев мы готовим вакцину, грипп тоже не спит, он активно меняется. Выбор штаммов — это попытка предсказания и не всегда удачная. И, чтобы себя обезопасить, нам надо найти в вирусе гриппа что-то такое, что не будет постоянно меняться.
Вирус гриппа, как и большинство других вирусов, может размножаться только в живых клетках другого организма, он устроен намного проще, чем наши клетки или даже бактерии. Существует три вида вируса гриппа: A, B и C. Вакцина включает штаммы только двух первых видов, потому что для нас они представляют наибольшую опасность. Но при этом все три вида имеют схожую структуру, которую условно можно разделить на три части: внешняя мембрана, такая же, как у наших клеток, из белков и липидов, белковая оболочка и геном в виде молекул РНК, покрытых белком. В каждой части есть белки, и наша иммунная система узнает их фрагменты, которые могут быть разными у разных вирусов, то есть вариабельными, а могут быть очень похожими, или консервативными. Вариабельность или консервативность определяются скоростью накопления мутаций. Консервативные фрагменты меняются медленнее, поэтому именно они нас интересуют.
Как иммунитет реагирует на появление вируса в организме?
Есть два пути. Первый — гуморальный. Это синтез антител, которые связывают поверхностные белки вируса, блокируют их и сообщают всем вокруг, что здесь находится что-то чужое. Второй — клеточный. Т-киллеры (разновидность Т-клеток) находят зараженные клетки по фрагментам внутренних белков вируса и убивают эти клетки, чтобы остановить распространение патогена. Но что самое главное: наш иммунитет умеет запоминать те фрагменты белков, с которыми он встретился, и при повторном заражении будет реагировать на них быстрее. Вакцинация — это обучение иммунитета: мы показываем ему патогены и формируем иммунологическую память.
Какие консервативные фрагменты исследователи выбрали для обучения иммунитета?
Начнем с внутренних белков, которые узнают Т-киллеры. Есть два белка, представленные в большом количестве внутри вируса гриппа: нуклеопротеин (NP), который связан с РНК и нанизан на нее, почти как бусинки на ниточку, и матриксный белок 1 (M1), который, как одинаковые кирпичики, выстраивает белковую оболочку. Оба белка, помимо того, что защищают геном вируса, выполняют еще и другие важные функции в жизненном цикле вируса. Так как изменение в аминокислотной последовательности белка может привести к тому, что белок потеряет свою функцию, нуклеопротеину и матриксному белку приходится быть достаточно консервативными.
Но T-киллеры узнают зараженную клетку, когда она показывает им фрагмент вирусного белка, который находится внутри нее. А это значит, при вакцинации вирусные белки как-то должны оказаться внутри. Как же их туда перенести?
Для этого решили использовать вирус осповакцины. Он безопасен, может заражать наши клетки и размножаться в них, но иммунная система очень быстро с ним справляется, и поэтому мы не заболеваем. Несколько генов в этом вирусе заменили на гены нуклеопротеина и матриксного белка, чтобы клетка их синтезировала, а потом показывала Т-киллерам. Такая вакцина уже прошла первую и вторую стадии клинических испытаний, которые показали ее эффективность и безопасность.
Теперь рассмотрим белки и их фрагменты, с которыми могут связываться антитела. Во внешней оболочке вируса гриппа есть ионный канал, состоящий из четырех белков М2, который, как насос, перекачивает ионы внутрь вируса. У каждого белка М2 снаружи есть небольшой кусочек, пептид, который оказался очень консервативным. Но мы не можем иммунизировать маленьким пептидом: антитела его даже не заметят. Поэтому при помощи генно-инженерных методов решили пришить его к другому, большому, белку, мимо которого иммунная система уж точно не пройдет, а заодно и на наш пептид отреагирует. Для это выбрали один из белков вируса гепатита В, и такая вакцина уже завершила первую стадию клинических испытаний.
Объектом самого последнего достижения, о котором сейчас все говорят, стал гемагглютинин (HA). Это поверхностный белок, который находится в оболочке вируса гриппа. Он в чем-то похож на липучку от кроссовок: когда вирус встречает клетку, он цепляется за нее при помощи гемагглютининов, чтобы дальше заразить. У разных вирусов гемагглютинины очень разные, но у некоторых из них ближе к основанию есть похожая область. И все было бы хорошо, но только эта часть белка очень нестабильна, мы не можем ею иммунизировать. Однако эту проблему удалось решить. В прошлом году практически одновременно в двух самых популярных научных журналах (Science и Nature) были опубликованы статьи о создании наночастиц, которые на поверхности несут кусочки гемагглютинина. Такие структуры оказались стабильными и эффективно вызывали иммунный ответ у мышей и хорьков. Начало клинических испытаний планируют начать уже в следующем году.
Для вакцины есть много хороших перспективных идей, но каждая из них должна успешно пройти все стадии тестирования, поэтому до реального применения пройдут еще годы. Но, кроме универсальной вакцины, универсальным может быть и лекарство. Для лекарства так же, как и для вакцинации, выбирают конкретную мишень. Но в отличие от вакцины лекарство действует непосредственно на сам вирус и до тех пор, пока вы им лечитесь.
Противогриппозные препараты начали разрабатывать еще в 1960-х годах, и первыми были созданы блокаторы ионного канала. Ионный канал перекачивает через оболочку протоны, чтобы закислить внутреннюю среду вируса гриппа. Это нужно для того, чтобы после проникновения вируса в клетку РНК смогла отделиться от белковой оболочки.
Однажды узнали, что производные адамантана могут блокировать этот канал, что мешает вирусу гриппа заразить клетку. Были выпущены два препарата: Амантадин и Римантадин, которые действуют только на вирус гриппа А. Но чем чаще их использовали, тем быстрее увеличивалось количество устойчивых к ним штаммов вируса гриппа. К 2005 году в некоторых странах доля устойчивых вирусов достигла 90%, поэтому теперь официальные организации не рекомендуют использовать эти препараты для лечения гриппа.
Позднее появились блокаторы нейраминидазы. Нейраминидаза — это тоже поверхностный белок вируса гриппа. Она помогает потомству вируса гриппа заражать другие клетки и работает как кусачки. Когда новый вирус выходит из клетки, он тут же к ней прилипает. Чтобы он не заражал ту же самую клетку второй раз, нейраминидаза откусывает все молекулы, к которым он прикрепился. Соответственно, блокирование нейраминидазы будет замедлять распространение вируса по нашему организму. Сейчас есть три препарата такого типа (Реленза, Тамифлю и Рапиваб), и все три действуют как на вирус гриппа А, так и на вирус гриппа В. Ко всем трем вирус гриппа пока чувствителен, тем не менее время от времени регистрируют случаи устойчивости. Для Тамифлю даже известна конкретная мутация с заменой одной аминокислоты в нейраминидазе, из-за которой препарат перестает действовать.
И последней вопрос, на который надо ответить, — что лучше: универсальная вакцина или универсальное лекарство? На данный момент иммунная система имеет неоспоримое преимущество над нашим интеллектом. Она умеет охотиться за патогенами и узнавать их даже в случае небольшого количества изменений. Все, что нам надо, — это заранее подготовить ее к тому врагу, с которым ей предстоит встретиться.
Эпидемии гриппа уносили жизни людей миллионами, веками ученые не могли выяснить причину и научиться побеждать эту болезнь. Казалось бы, в современном мире не должно остаться вопросов, но ежегодно происходит 3-5 миллионов случаев болезни с тяжелым течением и 390-650 тысяч смертей! А тема вакцинации продолжает обрастать мифами. Почему вакцина не защищает на 100%, зачем нужно каждый год разрабатывать новую и почему в условиях COVID-19 особенно важно привиться от гриппа? Ответы в нашем обзорном материале.
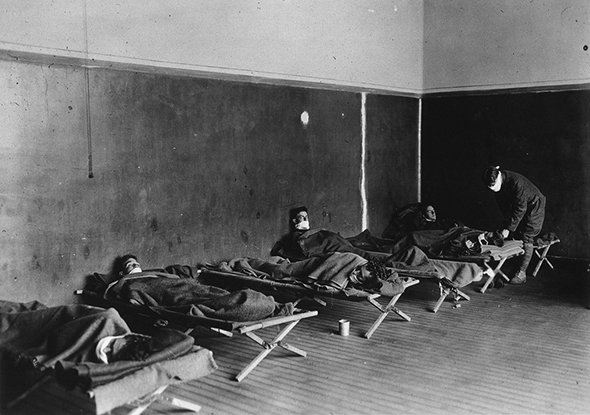
Начало XX века: испанка
Самая известная пандемия гриппа, которая на слуху у всех – испанка. Откуда началась пандемия, доподлинно неизвестно. Есть мнение, что в числе первых стран был Китай. Чуть позже – Америка и Франция, и только спустя несколько месяцев – Испания, Италия, Швейцария и далее весь мир.
Отличительной чертой болезни было быстрое развитие тяжелой пневмонии. Испанка уносила жизни молодого поколения, почти не затрагивая людей 50-60 лет. Позднее медицина объяснит эту загадку тем, что у старшего поколения уже был сформирован иммунитет за счет ранее перенесенного гриппа с похожими штаммами.
В те времена врачи были почти бессильны. Они искали различные способы лечения, но единственное, что хоть как-то помогало, было переливание крови от уже переболевших и выздоровевших.
1-я половина ХХ века: открытие причины болезни
Как ни странно, такие бедствия влекут за собой еще и важные открытия в развитии науки. В 1933 году исследования британских ученых: Патрика Лэйдло, Уилсона Смита и Кристофера Эндрюса – привели к открытию вируса. Они провели эксперименты на лабораторных хорьках (а позднее – мышах) и доказали, что виновник заболевания не бактерия, а вирус.
В разработке первой вакцины принял участие шеффилдский профессор, Чарльз Стюарт-Харрис (автор классических учебников по вирусологии).
Еще одной сложностью стало то, что вирус быстро мутирует, но тогда ученые еще об этом не знали и грипп возвращался снова и снова.
Середина ХХ века: раскрыт секрет вируса
К этому времени ученые уже выделили 3 типа вируса гриппа. Их обозначили А, В и С.
1957 год. Американский вирусолог, Морис Хиллеман с коллегами при открытии очередной разновидности вируса гриппа обнаружили, что люди, пережившие пандемию 1889-1890 годов, имели устойчивость к новому вирусу. Ученые выявили, какие именно белки отвечают за формирование иммунитета и разработали подходящую вакцину.
Оказалось, что вирус гриппа состоит из поверхностных и внутренних антигенов. Поверхностные антигены изменчивы, а внутренние – постоянны.
Поверхностные антигены – это:
гемагглютинин (в наименовании штамма обозначается Н) – обеспечивает способность вируса присоединяться к клетке;
нейраминидаза (обозначается N) – отвечает за способность вирусной частицы проникать в клетку-хозяина и за способность вирусных частиц выходить из клетки после размножения.
Комбинации разных поверхностных антигенов определяют разные штаммы одного вируса A (H1N5, H1N1 и др.). Один из последних выявленных штаммов H18N11 обнаружен в 2013 году у летучих мышей в Центральной Америке.
Внутренние антигены составляют сердцевину (геном) вируса в виде рибонуклеопротеинового комплекса (нуклеопротеин в комплексе с вирусной РНК) и определяют тип вируса (А, В или С).
Однако страны, не имеющие вакцину, продолжали страдать от возвращения вируса, вспышки зафиксированы в конце 1969, в 1970 и 1972 годах. Однако, таких разрушительных последствий уже не было, ведь к этому времени существовали антибиотики, спасавшие от вторичных инфекций; была вакцинация в ряде государств; а также у многих переболевших сформировался иммунитет.
Необычное решение
Если для защиты от большинства вакциноуправляемых инфекций (корь, дифтерия, полиомиелит и т.д.) десятки лет применяется один и тот же состав вакцины, и при этом бывает достаточно 1 курса, а иногда и одной инъекции препарата для выработки у человека иммунитета на всю жизнь, то в ситуации с постоянно мутирующим гриппом ученым нужно было искать иной способ изготовления эффективной вакцины.
Найденное решение поражает своей трудоемкостью и масштабностью. Каждый год к сезону подъема заболеваемости гриппом нужно производить вакцины с новым составом! А для уменьшения риска ошибок предложено включать в вакцину не один штамм, а набор (обычно из трех) наиболее вероятных штаммов. Потребовалась система мониторинга и прогноза циркуляции вируса гриппа во всех странах на всех континентах.
В 1952 году в структуре ВОЗ была создана Глобальная система эпиднадзора за гриппом и принятия ответных мер (Global Influenza Surveillance and Response System (GISRS). Её работа заключается в сборе информации о вирусах со всех уголков мира. Полученные данные вносят в единую базу, и специальная комиссия принимает решение о прогнозе, какие штаммы гриппа будут активно циркулировать и могут вызвать эпидемию в предстоящем сезоне. Учитывается масса факторов, включая и агрессивность вновь выявленных вирусов, и схожесть с ранее циркулирующими штаммами, и наличие иммунитета в популяции.
Именно с участием этой системы появилась возможность эффективной вакцинопрофилактики гриппа.
Как это происходит
Каждый год в феврале происходит заседание ВОЗ, на котором по данным GISRS выдаются рекомендации производителям о штаммах вируса гриппа, которые следует включать в вакцину. В конце февраля-начале марта начинается выращивание штаммов. Почти все изготовители вакцин используют для этого старую проверенную технологию: вирус гриппа размножается в куриных эмбрионах. Если рекомендованный штамм хорошо культивируется – его и берут в производство. Иногда из-за плохого роста какого-либо типа вируса срочно подбирается хорошо растущий аналог со сходной антигенной структурой.
После этого процесс изготовления вакцины включается на полную мощность. Как правило, около 4 месяцев уходит на производство трех (или четырех) штаммов, обезвреживание (разными способами для разных типов вакцин), очистку, контроль качества, смешивание компонентов и расфасовку. Процесс производства вакцины рекомендуем посмотреть в ролике наших партнеров Sanofi Pasteur:
Конец ХХ – начало XXI вв.: врасплох
В таких редких случаях, когда происходят непредвиденные мутации гриппа, вакцины создают в экстренном порядке, чтобы не дать инфекции распространиться масштабно, и применяют отдельно, или включают новый штамм в сезонную вакцину.
В целом за почти 70 лет существования GISRS, система великолепно оправдала себя и показала правильность принятой стратегии по профилактике гриппа путем адаптации производства вакцины под мутации вируса.
На графике наглядно видно снижение заболеваемости в прямой зависимости от количества получивших прививку:
Почему вакцина не защищает на 100%?
Ранее мы уже разбирали случаи, когда привитые тоже могут болеть. Повторяясь, отметим, что любые вакцины не дают гарантии 100%. В инструкции к препаратам вы увидите показатели эффективности всегда выше 80%, близкие к 95-99%.
На эффективность влияют исходные характеристики вакцины и иммунный статус конкретного человека. В случае с гриппом, мы описали дополнительные риски и сложности, связанные с ежегодным прогнозированием и обновлением штаммов.
Ученые имеют богатый опыт борьбы с этим неуловимым врагом, в мире известно более 2000 серотипов вирусов гриппа. Однако риск появления совершенно новой мутации существует всегда, и пока ученые не могут этим управлять. Также как и не могут создать такую вакцину, которая бы защитила от гриппа пожизненно и на 100%.
Стоит ли прививаться, когда вы не уверены в прогнозах Глобальной системы эпиднадзора за гриппом – решать вам. Возможно, сделать сложный выбор помогут цифры: в России среди заболевших гриппом А – непривитые составили 91,8%, а среди умерших – 100%.
Сегодня: современные вакцины
Производство вакцин от гриппа — это вообще постоянная эволюция. Первые вакцины были живые. При производстве использовались ослабленные вирусы. Применялись в виде спрея в нос. Имели очень много побочных эффектов.
Представитель: Ультравак (Россия).
Затем – стали применять инактивированные вакцины. Первые из них содержали хоть и очищенные, но цельные вирусы (цельновирионные вакцины). Их реактогенность (способность оказывать побочные эффекты) была очень высока.
Представитель: Грипповак (Россия).
Позднее стали производить вакцины с разрушенным вирусом (расщепленные или сплит-вакцины). Они имеют меньше побочных реакций и достаточно высокую иммуногенность. В состав таких вакцин входят все вирионные белки вируса (и поверхностные, и внутренние антигены), но вследствие высокой очистки в них отсутствуют вирусные липиды и белки куриного эмбриона.
Представители: Ультрикс (Россия), ФЛЮ-М (Россия), Ваксигрип (Франция), Флюарикс (Германия), Флюваксин (Китай).
Следующий класс вакцин — субъединичные. Они содержат только очищенные поверхностные антигены вируса гриппа. Удалены не только белки вириона и куриного эмбриона, но и внутренние антигены. За счет этого достигнуто значительное снижение реактогенности. Для увеличения длительности и напряженности иммунитета производители субъединичных вакцин нередко в состав добавляют адъювант – вещество, которое усиливает иммунный ответ.
Представители: Инфлювак (Нидерланды),Гриппол плюс (Россия), Совигрипп (Россия).
Помимо обновления технологии инактивации, сборки, очистки гриппозных вакцин, ведутся и иные научные работы по поиску путей повышения качества, переносимости и эффективности противогриппозных вакцин.
Одним из способов повышения эффективности стала рекомендация ВОЗ переориентировать производства с 3-валентных на 4-валентные вакцины. Квадривалентные вакцины содержат белки сразу четырех опасных штаммов.
Примеры: Ультрикс Квадри (Россия), Гриппол квадривалент (Россия).
Кому нельзя?
У всех вакцин против гриппа имеются абсолютные и временные противопоказания, которые указываются в инструкциях к препаратам.
Вакцинация не проводится:
- Если у вас гиперчувствительность к куриному белку, и есть тяжёлая аллергическая реакция на вакцину. Ключевое здесь — тяжёлая.
- При острой болезни, простуде, которая протекает с температурой выше 38°С.
- Если у врача есть основания, что не будет сформирован иммунный ответ организма. Например, если пациент принимает терапию, которая подавляет иммунный ответ.
- Живая вакцина не применяется у детей до 3 лет, беременных женщин и у людей с нарушениями иммунитета.
Помните: Вводимая вакцина не вызывает заболевание и не способствует более тяжелому течению гриппа и других ОРВИ.
Почему особенно важно привиться в условиях COVID-19?
Какую вакцину от гриппа выбрать?
Грипп – смертельно опасная болезнь, важно в принципе сделать прививку ЛЮБОЙ ДОСТУПНОЙ ВАМ вакциной. Все вакцины сезона 2020-2021 будут содержать актуальные штаммы вирусов: (A/Guangdong-Maonan/SWL1536/2019(H1N1)pdm09; A/HongKong/2671/2019 (H3N2); B/Washington/02/2019 (B/Victorialineage). Для четырехвалентных вакцин ВОЗ рекомендовал дополнительно штамм подобный B/Phuket/3073/2013 (B/Yamagatalineage), который присутствовал в аналогичной вакцине в эпидемическом сезоне 2019-2020 годов.
С чего все начинается
Вакцины не разрабатываются просто так, по чьему-либо желанию. Процесс инициируется, когда инфекция приобретает угрожающий характер (эпидемии или пандемии), особенно всемирного масштаба. Огромное количество накопленных статистических данных служит толчком к поиску нового препарата.
Изучение свойств патогена происходит как в условиях лаборатории (с привлечением животных или in vitro), так и путем непосредственного наблюдения за инфицированными людьми.
В процессе принимают участие одновременно несколько групп ученых, каждая из которых имеет свои задачи и методы. Таким образом, инфекционного возбудителя исследуют с максимального числа сторон.
Здесь же формируются гипотезы, каким может быть будущий препарат, – живой, инактивированный, синтетический. Важными моментами являются, например:
как будет происходить оценка иммунного ответа;
какие антигены возбудителя нужно взять;
какая питательная среда потребуется для выращивания микроорганизма;
сколько антигена надо, чтобы стимулировать формирование иммунитета у людей разных возрастов;
сколько дозировок нужно и с какой периодичностью введения, и так далее.
НА ЗАМЕТКУ! Антиген – часть инфекционного возбудителя, к которому иммунная система вырабатывает защитные антитела. Для разных антигенов (даже одного микроба) нужны разные антитела.
То есть, на этапе разработки вакцин ученые сталкиваются с огромным количеством вопросов, выдвигают и проверяют десятки и сотни гипотез, при необходимости меняют концепцию. Понятно, что в экстренных случаях такая работа ведется непрерывно, круглосуточно, и в ней задействовано в несколько раз больше исследований, чем в штатном режиме.
Доклинический этап
Когда базовые исследования закончены, и прототип препарата готов, начинается доклинический этап. Испытания проводятся на животных, параллельно отрабатывается технология производства вакцины.
Среди важных моментов доклинических испытаний можно отметить следующие:
- происходит оценка возможности вакцины формировать иммунитет;
- выявляется токсичность препарата для живого организма;
- определяется минимальная, оптимальная и максимально допустимая дозировка;
- исследуется воздействие на плод (вероятность развития аномалий и прочее);
- оценивается способность препарата влиять на образование и/или рост опухолей;
- оцениваются аллергизирующие свойства и так далее.
В процессе тестирования животным вводят вакцину в различных концентрациях и в разных состояниях организма, наблюдая и фиксируя при этом малейшие изменения. Нужно отметить, что большая часть вакцин не проходит доклинические испытания, так как не приводит к цели – иммунный ответ на введение отсутствует.
НА ЗАМЕТКУ! Для проведения доклинических исследований, как правило, берут два вида животных. Чаще всего, это – мыши и приматы. Идеальный вариант – когда в тестировании принимают участие от трех и более видов. Это дает возможность подобрать оптимально подходящую дозировку и обеспечить полную безопасность препарата.
Если доклинические испытания прошли успешно, для дальнейших испытаний нужно получить разрешение в специализированных органах. Авторы подают заявку, в которой подробно описываются проведенные исследования и тесты, обосновывается необходимость применения препарата и другие моменты. В ответ получают либо отказ, либо разрешение. При положительном решении разработка вакцины переходит в клинический этап.
Клинический этап разработки
Этот этап предполагает непосредственное участие в испытаниях людей-добровольцев. Неважно, для какого возраста разрабатывается вакцина, ее действие изучают только на здоровых взрослых людях. Клинические исследования проводятся в три фазы. Процесс разделен на стадии, что позволяет контролировать тестирование препарата, постепенно увеличивая количество людей. Это значительно снижает риски: всё что будет тестироваться массово, уже прошло испытания в узких кругах. И, конечно, такой подход позволяет прекратить тестирование на любом этапе в случае обнаружения нежелательных явлений. Именно поэтому каждая фаза имеет огромную значимость и свои цели.
Первая фаза
Проводится на совсем небольшом количестве людей (десятки людей). Её цель – подтверждение первичной безопасности для людей в принципе. Происходит исследование вакцины в действии. Ученые обращают внимание на следующие моменты:
- переносимость и побочные явления;
- особенность иммунного ответа (скорость, выраженность и другие);
- взаимодействие с другими препаратами;
- безопасность диапазона доз.
В процессе тестирования может изменяться не только дозировка, но и состав препарата. Вакцину вводят не сразу всем участникам, а поочередно, чтобы избежать массовых негативных проявлений в случае, если что-то пойдет не так.
Вторая фаза
Цель этой стадии – оценка эффективности (иммуногенности) вакцины. Во второй фазе испытаний принимает участие несколько сотен добровольцев. На данном этапе происходит еще большая отработка свойств и дозировки препарата. Тщательно фиксируются и анализируются реакции организма, определяется периодичность и сроки вакцинации, особенности транспортировки и прочие моменты.
Третья фаза
Её цель – доказать безопасность и эффективность вакцины при массовом применении в динамике, а также удостовериться, что польза вакцины компенсирует те нежелательные реакции, которые неминуемо будут выявлены (хотим уточнить, что допускаются лишь легкие реакции). Именно на третьей фазе ученые делают выводы, которые невозможны при небольшой численности испытуемых: действие вакцины изучается на тысячах человек. Анализируется частота побочных эффектов (в том числе отдаленных), продолжается определение безопасности.
После того, как все фазы клинического этапа исследований успешно пройдены, данные о них поступают в специализированные структуры. Положительное решение означает, что вакцина может быть запущена в производство; препарат регистрируют, а фирме-изготовителю выдается соответствующая лицензия.
Нужно отметить, что лицензируется не только сама вакцина, но и ее производство. Если в процесс изготовления вносятся какие-либо изменения или он не может в полной мере обеспечить качество, препарат заново проходит испытания. Вакцины выпускаются сотнями тысяч дозировок, и важно, чтобы каждая из них соответствовала ранее заявленным протоколам.
Выдача лицензии и массовый выпуск вакцины не означает, что исследования закончились. Существует еще четвертая фаза клинических исследований. Она проводится уже после того, как препарат становится доступным для людей через розничную сеть медицинский организаций. Это постмаркетинговые испытания или так называемый постклинический мониторинг. Он имеет масштабный характер, позволяют получить еще более подробную информацию о безопасности и эффективности препарата. Также на четвертой фазе оцениваются комбинации с другими препаратами и уточняются вновь открывшиеся данные и гипотезы.
Может быть и такое: вакцину зарегистрировали и начали применять, но внезапно сняли с производства. Дело в том, что даже несколько тысяч человек в некоторых случаях не могут являться абсолютным показателем безопасности. Только внедрение в массы способно в полной степени проявить те или иные качества препарата. Однако такие случаи – редкость.
Примечательно, что даже после того, как все фазы испытаний пройдены, наблюдения за действием препарата продолжают вестись постоянно в течение многих лет: ученые отслеживают влияние на организм в долгосрочном отношении, анализируют данные о динамике заболевания с момента внедрения препарата.
Как же получают сами препараты?
Непосредственное производство вакцины зависит от ее вида. В общих чертах его можно описать следующим образом.
1. Живая вакцина (ослабленная)
- Выбирают штамм возбудителя.
- Ослабляют микроорганизм.
- Размножают (культивируют) в питательной среде.
- Очищают от примесей.
- Стандартизируют (приводят к нужной концентрации, фасуют).
2. Инактивированная вакцина (убитые возбудители).
3. Рекомбинантная вакцина. Используются методы генной инженерии.
- У патогенного возбудителя берут часть генетического материала.
- Встраивают его в геном клеток, которые будут его производить (чаще всего, это – дрожжи).
- Культивируют клетки в питательной среде.
- Выделяют и очищают антиген.
- Готовят вакцину.
НА ЗАМЕТКУ! Одни из последних разработок ученых – создание вакцин на основе растительных вирусов. Их комбинируют с антигеном возбудителя болезни человека. Подобные исследования с использованием вируса табачной мозаики уже проводятся в отношении краснухи, COVID, сибирской язвы.
Сколько времени требуется для создания препарата
Длительность разработки и производства вакцин зависит от многих факторов: штамма возбудителя, антигенных свойств, того, насколько он изучен. В среднем, этапы занимают следующее количество времени:
Суммарно на разработку одной вакцины уходит примерно 10-15 лет (без мониторинга на практике после внедрения в производство).
То же происходит, если свойства, присущие семейству возбудителя, хорошо известны. Например, ежегодные мутации вируса гриппа не являются препятствием для быстрого производства новой вакцины.
Особенности контроля
Каждый этап производства вакцин жестко контролируется. Стандарты и положения, регулирующие нормы качества препаратов, изложены в сборнике – фармакопее. Она имеет юридическую силу и находится под государственным контролем.
Люди-добровольцы, которые участвуют в испытаниях, обязательно должны дать на это свое согласие на основании утвержденного этическим комитетом протокола. Непосредственно на производстве надзору подвергается каждая серия выпущенного препарата. Контролируется не только состав вакцины, но и стерильность, концентрация, требования к фасовке, упаковке и так далее.
На фоне вышесказанного утверждения противников вакцинации выглядят, по меньшей мере, смешными. А если вы запутались в современных вакцинах, раздумываете – делать прививки или нет, наши специалисты всегда придут на помощь: проконсультируют, объяснят, посоветуют.

Обзор
Делать прививку каждый год — это так неудобно
Автор
Редакторы
Грипп ложится на человечество ежегодным тяжким бременем, и его сезонные эпидемии заставляют нас с неприятной регулярностью брать больничные. Такая систематичность вызвана высокой изменчивостью вирусных серотипов, которые очень быстро мутируют и вследствие этого год за годом проскакивают мимо кордонов иммунитета неузнанными. Почему это так, и будет ли возможно в обозримом будущем остановить сезонные вспышки гриппа с помощью универсальной вакцины — об этом и пойдет речь в статье, оригинал которой был опубликован в недавнем выпуске Nature Outlook.

Грипп
Вакцина на все случаи жизни
В поиске неподвижной мишени
Похоже, в конце туннеля забрезжил-таки свет: например, с помощью таких технологий у одного больного были выявлены антитела, способные блокировать все 16 подтипов вируса гриппа типа А (так называемые F16-антитела). Чтобы найти их, команде швейцарских иммунологов под руководством Антонио Ланцавеккья (Antonio Lanzavecchia) пришлось просканировать 104 тысячи В-лимфоцитов, полученных от восьми доноров, пока они не обнаружили нужные клоны.
Вирус гриппа
Впервые вирус был выделен в 30-е года XX века. Вирусы гриппа относятся к семейству Ortomyxoviridae, которое включает роды Influenza A, B, C, принадлежность к которым определяется антигенными свойствами внутренних белков вириона (M1 и NP). Дальнейшее деление проводится согласно подтипам (серотипам) поверхностных белков гемагглютинина (HA) и нейраминидазы (NA). В настоящее время известно 16 подтипов HA и 9 — NA.
Эпидемиологическое значение для людей имеют вирусы, содержащие три подтипа гемагглютинина (H1, H2, H3) и два подтипа нейраминидазы (N1, N2). Основные антигенные компоненты вирионов гриппа A и B — это NA и HA; у вируса гриппа C нет нейраминидазы. Антитела, вырабатываемые в ответ на гемагглютинин, составляют основу иммунитета против определённого подтипа возбудителя гриппа.
Для вирусов сероварианта А (реже В) характерно частое изменение антигенной структуры при пребывании их в естественных условиях. Эти изменения обусловливают множество названий подтипов, которые включают место первичного появления, номер и год выделения и характеристику HN — например A/Moscow/10/99 (H3N2), A/New Caledonia/120/99 (H1N1), B/Hong Kong/330/2001.

Зри в корень
Исследователи по всему миру работают, не покладая рук. В 2008 году группа ученых из датской компании Crucell нашла свой вариант универсальных человеческих антител против вируса гриппа, используя новейшие высокопроизводительные технологии скрининга лимфоцитов.
Дыра в кармане
В другой плоскости
Многие компании ищут идеальную мишень на поверхности частицы вируса гриппа. VaxInnate — биотехнологическая фирма из Кренбери (Нью-Джерси, США) — создала гибридный белок, состоящий из четырех копий M2e (поверхностного фрагмента ионного канала M2) и бактериального белка флаггелина. По их данным, созданная вакцина Vax102 безопасна и вызывает развитие иммунитета против всех разновидностей вируса гриппа А.
Другая компания того же профиля — Dyna Vax, расположенная в Беркли (Калифорния, США), — создала аналогичную рекомбинантную вакцину (получившую название N895), состоящую из M2e и рибонуклеопротеина. Теоретически предсказанное действие вакцины — запустить атаку антител на вирусный белок M2, а Т-клеток — на нуклеокапсид.
Биотехнологическая фирма Acambis (Кембридж, Великобритания) проводит испытания собственной вакцины на основе белка M2, показав ее хорошую переносимость и эффективность против вирусов гриппа типа А. Исследование на хорьках (их гортань чрезвычайно напоминает человеческую) показало выработку иммунитета против птичьего гриппа у 70% животных. Купившая Acambis французская компания Sanofi Pasteur собирается продолжать испытания, однако, по словам ее представителей, белок M2 сам по себе вряд ли будет лучшей вакциной, чем уже существующие, и поэтому требуются дополнительные активные факторы, поиск которых сейчас и ведется.
Зайти с двух сторон
Читайте также:

