Как добиться стойкой ремиссии при герпесе при планировании беременности
Обновлено: 25.04.2024
Здравствуйте. Стоит пройти супрессивную терапию Валацикловиром. Иммуноглобулины нет смысла пересдавать - они у вас всегда будут. Потому что организм знаком с вирусом герпеса. И знает как от него защищаться. Он никак не влияет на планирование беременности.
Вам сейчас необходимо сдать другие анализы:
- Гемоглобин и ферритин. Исключаем анемию. Если у вас сказочный гемоглобин, но вот ферритин менее 1/2 цифры вашего веса - у вас разовьется анемия во втором триместре. Ни к какой гадалке не надо. Потому что запасов железа в вашем организме нэма. Пока он работает только на себя, ему достаточно того, что поступает с пищей. Как только ему надо будет снабжать двоих - он просядет.
- Коагулограмма. Повышенная свертываемость часто в негативном ключе влияет как на зачатие, так и на процесс питания эмбриона, а в дальнейшем плода. "Густая кровь" является одной из причин, приводящих к замиранию беременности в 1 триместре, нарушению маточно-плацентарного кровотока и задержке роста плода во 2 и 3 триместрах. Поэтому если у вас есть значимые отклонения (совсем с ума сходить не надо - если у вас фибриноген, например 3,56 при референсной границе 3,52), то надо скорректировать их с терапевтом или гематологом. К кому пробьетесь.
- ТТГ. Перед планированием беременности про него как-то забывают, а он очень важен. Идеальный ТТГ при беременности не должен превышать 2,5. В небеременном состоянии норма до 4,0. Если показатель выше, то это гипотиреоз, при котором в большинстве всех случаев, возникшая беременность завершится самопроизвольным выкидышем до 12 недель.
- Мазок на онкоцитологию. Сдать его надо обязательно. Как минимум потому, что в ближайший год вы этого сделать не сможете (9 месяцев беременности + 2 месяца послеродового периода.В идеальном мире ещё и 3 месяца прегравидарной подготовки. Итого 14 месяцев) - а его надо сддавать 1 раз в год.
- Мазок на флору, ПЦР на ИППП, бак.посев из влагалища. Смотрим, есть ли воспалительные процессы и агенты во влагалище. Если что-то нас смущает - лечим. Тут надо сказать, что я рекомендую при планировании пролечить уреаплазму и гарднереллу (в норме при титре 10:4 и менее их не лечат). Дело в том, что из-за смены гормонального статуса, меняется ph влагалища + при беременности всегда снижается иммунитет. Что в совокупности даёт зелёный свет для размножения условно-патогенной микрофлоры во влагалище. Которую при беременности гораздо сложнее вылечить, чем вне её.
- ФЛГ. Опять же, вы на целый год остаётесь без этого исследования. А туберкулёза у нас гуляет будь здоров. Так что не поленитесь, обновите
Также начните прием витаминов:
Прежде всего, фолиевая кислота 400 мкг/сут. Фолаты - это вся нервная система вашего ребёнка. Дефицит в дальнейшем выливается в список проблем длинной с великую китайскую стену: начиная от пороков развития и заканчивая межпозвоночными грыжами
- Мы живём в зоне, эндемичной по дефициту йода. Поэтому для профилактики умственных растройстви проблем с щитовидной железой, всем беременным и кормящим рекомендован Калия йодид в дозировке 200 мкг/сут
- Витамин Д. Рекомендован приём витамина D в профилактической дозе 800–2000 МЕ/сут. Дефицит витамина д - это проблемы с нервной, костно-мышечной, сердечно-сосудистой и иммунными системами у ребёнка.
- Омега-3 ПНЖК. Можно любой препарат. Это может быть как копеечный рыбий жир, так и стоимостью как чугунный мост препараты типа Солгар и пр. Это нервная и иммунная система, а также профилактика метаболических нарушений в будущем.
Для цитирования: Михайлова О.И., Карапетян Т.Э. Прегравидарная подготовка и профилактика рецидивов у женщин с герпетической инфекцией. РМЖ. Мать и дитя. 2014;22(19):1402.
Анализ медицинской литературы последних лет показывает неослабевающий интерес акушеров-гинекологов к проблеме вирусной инфекции вообще и герпетической инфекции в частности. По данным различных авторов, вирус простого герпеса (ВПГ) является одной из основных причин осложненного течения беременности, внутриутробной и перинатальной инфекции [2, 8, 13]. Несмотря на неоднозначное мнение различных исследователей относительно роли этого вируса в частоте перинатальных осложнений, бесспорным является тот факт, что в современных условиях ВПГ представляет весьма многогранную медико-социальную проблему [1, 3, 6].
По-прежнему у практикующих врачей часто возникают определенные сложности при ведении беременности и родов у женщин с герпетической инфекцией [4, 12]. Одним из решающих этапов в комплексе профилактических мероприятий у данного контингента пациенток является их адекватная прегравидарная подготовка с правильным подбором всех современных методов медикаментозной коррекции.
Возбудителем герпетических заболеваний половых органов является ВПГ – облигатный внутриклеточный паразит, принадлежащий к подсемейству α-вирусов в семействе герпес-вирусов. Идентифицировано два серотипа данного вируса: первый тип (ВПГ-1) поражает преимущественно кожу и слизистую оболочку губ, глаз, носа и др.; второй тип (ВПГ-2) является возбудителем генитального герпеса. Развитие последнего возможно также и при возникновении смешанной инфекции ВПГ первого и второго типов [2, 3, 23].
Единственным резервуаром ВПГ являются зараженные им люди, которые распространяют его среди населения. Генитальный герпес относится к заболеваниям, в 99,9% случаев передаваемых половым путем. Это так называемый горизонтальный путь передачи инфекции от носителей вируса к здоровым людям. Вертикальный путь передачи возможен в случае трансплацентарного инфицирования плода [3, 9].
По данным литературы, частота встречаемости генитального герпеса варьирует от 7 до 40%. Причиной большинства случаев генитального и, соответственно, неонатального герпеса является ВПГ-2 (70–80%), однако в 20–30% случаев эта инфекция может быть вызвана ВПГ-1 [2, 19].
Попав в организм человека, ВПГ сохраняется в нем на протяжении всей жизни, периодически вызывая рецидивы заболевания различной степени тяжести. Прослеживается определенная тенденция к фиксированности очагов высыпания, что объясняется поражением только нескольких ганглиев, которые иннервируют ограниченную зону кожи и слизистых. Первичное заражение сопровождается репликацией (размножением) вируса в месте инвазии с последующим его перемещением либо по нервному стволу, либо гематогенным путем. При гематогенном пути распространения инфекции вирусемия является обязательным этапом как первичного, так и рецидивирующего генитального герпеса. Установлено, что ВПГ оседает в виде элементарных телец в строме эритроцитов, он также обнаруживается в лейкоцитах, тромбоцитах и лимфоцитах [2, 7, 11]. Вирус герпеса может находиться и в лимфатической системе, в свободном состоянии или связанном с лимфоцитами, при определенных условиях размножается в Т- и В-лимфоцитах. При персистенции инфекции данный вирус может длительно находиться в коже, слизистых и половых секретах.
К особенностям герпетической инфекции следует относить:
• высокий уровень инфицированности населения;
• пожизненную персистенцию возбудителя в организме человека;
• системность процесса, а также полиморфизм клинических проявлений;
• трудности лабораторной диагностики атипичных и стертых форм заболевания;
• торпидность к имеющимся методам терапии (ни один из противогерпетических препаратов не приводит к полной элиминации вируса из организма, а только подавляет его репликацию).
При определении формы генитального герпеса выделяют первичную инфекцию или первичный эпизод инфекции и рецидивирующее ее течение. Первично инфицированными считаются пациентки с серонегативными результатами, которые ранее не сталкивались с ВПГ и не имеют к нему антител. Инкубационный период колеблется в широких пределах и составляет в среднем 3–9 дней, в течение которых экспрессия вируса минимальна. В 50–80% случаев появлению типичных повреждений предшествуют локальные продромальные симптомы в виде парестезии, зуда или боли, локального лимфаденита, невралгии в ягодичной, паховой, бедренной областях, дизурии, а также нарушения общего состояния пациенток. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением. Как правило, первичный эпизод заболевания характеризуется обширными высыпаниями, тяжелой общей симптоматикой и длительной экспрессией вируса [1, 3].
Существует несколько подходов к диагностике герпетической инфекции. Алгоритмы обследования основаны на клинических симптомах и лабораторных тестах. Наиболее распространенным в клинической практике является метод быстрой диагностики герпетической инфекции – полимеразная цепная реакция [2, 21]. Также для постановки диагноза герпетической инфекции часто используется иммуноферментный анализ.
Анализ литературных данных показал, что беременность, как правило, не влияет на частоту возникновения и тяжесть герпетической инфекции. В то же время имеется и противоположное мнение, указывающее на изменение клиники генитального герпеса на фоне физиологического иммунодефицита, имеющего место при беременности [1, 6].
Следует отметить, что пути проникновения вируса к эмбриону и плоду могут быть различными. Первый путь – трансплацентарный, возникает при наличии вирусемии у беременной, когда вирус из межворсинчатого пространства плаценты проникает в сосудистую систему плода с дальнейшей диссеминацией в его органах [3, 9, 13].
Резко увеличивает потенциальную опасность трансплацентарной передачи ВПГ плоду первичное инфицирование женщины во время беременности. Риск увеличивается и при активации латентной герпетической инфекции, однако он значительно ниже, чем при первой встрече организма с вирусом. Возможность трансплацентарной передачи инфекции значительно возрастает на фоне снижения иммунологической реактивности организма и при всех сопутствующих состояниях, увеличивающих проницаемость плаценты. Однако, по мнению ряда авторов [1, 13], вирусы могут проникать в организм плода даже через неповрежденную плаценту.
При восходящем инфицировании основными факторами, повышающими риск заражения плода, являются патологические изменения шейки матки, снижение защитных свойств цервикальной слизи, а также акушерские вмешательства и манипуляции, возможность проникновения вируса в околоплодные воды через плодные оболочки [3].
Бесспорно, как отечественными [1, 6], так и зарубежными авторами [9, 13] лидирующее место (до 90% случаев) отводится контактному механизму заражения плода, возникающему при прохождении ребенка через инфицированные родовые пути матери. При этом передача инфекции возможна как при наличии очагов повреждения в области шейки матки и вульвы, так и при бессимптомном выделении вируса.
В I триместре гестации риск инфицирования плода ВПГ резко возрастает при наличии первичного эпизода инфекции или стадии обострения хронической рецидивирующей формы заболевания, что может явиться причиной возникновения пороков развития плода, неразвивающейся беременности, спонтанных абортов и др. [2, 23]. Эмбриональные ткани с их высоким уровнем метаболизма и энергетики являются идеальной средой для репликации вирусов. При этом вирусная нуклеиновая кислота может включаться в состав клеточного генома, передающего генетическую информацию в аппарат, воспроизводящий клеточный белок, что в конечном итоге приводит к гибели зародыша или нарушению процессов органогенеза и возникновению пороков развития [3].
По данным литературы, при инфицировании беременной после 20 нед. гестации возрастает частота поздних самопроизвольных выкидышей, преждевременных родов, внутриутробного инфицирования плода. В этот период у плода могут развиться воспалительные заболевания головного мозга, глаз, легких, анемия, гепатоспленомегалия и т. д. Генитальная герпетическая инфекция, ввиду частых воспалительных изменений последа, может явиться причиной преждевременного или раннего излития околоплодных вод (с высоким риском восходящего инфицирования плода), нарушений сократительной активности матки с развитием первичной и/или вторичной слабости родовой деятельности, аномалий прикрепления и отделения плаценты с кровотечением в последовом и раннем послеродовом периодах [2, 3, 13].
Внедрение в практику противовирусной терапии привело к значительному снижению заболеваемости и смертности, однако до настоящего времени проблема герпетической инфекции во время беременности и ее влияние на организм ребенка являются одной из наиболее острых проблем в перинатологии [5, 14, 16, 17].
В работах зарубежных авторов было показано, что среди женщин с рецидивирующим генитальным герпесом примерно в 75% случаев следует ожидать по крайней мере один рецидив ВПГ во время беременности и в 14% – клинические проявления на момент родоразрешения [22, 25]. Данные систематического обзора 7 рандомизированных контролируемых испытаний с 1249 участниками выявили, что женщины с первичным эпизодом или рецидивом ВПГ-инфекции, которые получали антивирусную профилактику ацикловиром (400 мг 3 р./сут) или валацикловиром (500 мг 2 р./сут) начиная с 36 нед. беременности, значительно реже имели рецидивы инфекции к моменту родоразрешения (OR=0,28; CI=0,18–0,43), а проведение супрессивной терапии данными препаратами привело к снижению частоты выполнения кесарева сечения в связи с обострением ВПГ-инфекции (OR=0,30; CI=0,20–0,45) [15].
Как известно, во время родоразрешения при рецидивирующей генитальной ВПГ-инфекции происходит заражение плода. В крупном проспективном исследовании (58 362 беременные женщины), проведенном с целью оценки влияния метода родоразрешения на частоту передачи ВПГ-инфекции новорожденным, было показано, что инфицирование новорожденных практически в 6 раз ниже при операции кесарева сечения, чем при самопроизвольных родах (1,2% по сравнению 7,7% соответственно; ОR=0,14; CI=0,02–1,08) [10].
Также в исследованиях было показано, что у беременных с рецидивирующим генитальным герпесом проведение антивирусной профилактики ацикловиром после 36 нед. гестации для снижения риска передачи инфекции новорожденному является более экономически выгодной мерой, чем проведение кесарева сечения в связи с активацией ВПГ-инфекции на момент родоразрешения. Однако в настоящий момент недостаточно исследований, оценивающих экономическую эффективность противовирусной профилактики валацикловиром [18].
С учетом полученных данных, Американский колледж акушеров и гинекологов (AGOG) и общество акушеров и гинекологов Канады (SOGC) рекомендуют женщинам с рецидивирующей генитальной ВПГ-инфекцией проводить супрессивную терапию ацикловиром или валацикловиром после 36 нед. гестации, а также осуществлять родоразрешение путем операции кесарева сечения пациенткам с наличием активных герпетических высыпаний на половых органах и продромальных симптомов инфекции к моменту родов. SOGC предлагает пациенткам с первичной генитальной ВПГ-инфекцией в третьем триместре проводить кесарево сечение вне зависимости от наличия или отсутствия поражения кожных покровов половых органов в связи с высоким риском (до 60%) вертикальной передачи [8, 20].
Осложненное течение гестационного периода у женщин с герпетической инфекцией, тяжесть неонатального герпеса и неблагоприятный прогноз для новорожденного делают весьма актуальной разработку рациональных подходов к диагностике, профилактике и лечению этого заболевания. В профилактике неонатального герпеса большое значение приобретает правильная тактика ведения беременности и родов, однако реальным малоиспользуемым до настоящего времени резервом в решении проблемы рождения здорового ребенка является правильная прегравидарная подготовка пациенток с герпетической инфекцией, которая включает ее лечение с последующей профилактикой рецидивов. При генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисной (противовирусной) терапии, так и лечение сопутствующих заболеваний.
К базисным видам лечения относится:
• Блокада репродукции ВПГ в режиме эпизодической или супрессивной терапии. Применяют ацикловир по 0,2 г 5 р./сут в течение 5 дней при легком течении инфекции (обострения 1 раз в 6–8 мес.) и по 0,2 г 4 р./сут в непрерывном режиме в течение 3–6 мес. и более – при ее частых рецидивах (обострения 1 раз в 30–90 дней).
• Проведение стимуляции неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.).
• Местное применение специфических мазей.
В настоящее время наиболее широко используемыми для купирования обострения различных форм герпеса являются препараты из группы ациклических нуклеотидов. Многочисленными наблюдениями показано, что применение ацикловира в дозе 200 мг 5 р./сут или валацикловира – 500 мг 2 р./сут в течение 5 дней значительно уменьшает клинические проявления заболевания, сокращает время рецидива и период вирусовыделения. Были отмечены абсолютная безопасность, хорошая переносимость препаратов и отсутствие значимых побочных эффектов [6, 14, 16].
Как показывает клиническая практика, эффективность ациклических нуклеозидов зависит от биодоступности препарата, чувствительности герпес-вируса к конкретному препарату, адекватности применяемой дозы, продолжительности и кратности лечения, сроков начала лечения. Назначение валацикловира в дозе 500 мг 2 р./сут в течение 5 дней в продромальном периоде или сразу после появления симптомов рецидива заболевания способствует быстрому купированию проявлений вирусной инфекции. Препарат для системного лечения герпетической инфекции Валцикон сочетает в себе эффективность и безопасность ацикловира при отсутствии его недостатков – таких как ограниченная биодоступность, связанная с недостаточно эффективным всасыванием препарата при пероральном применении. Применение Валцикона дает возможность снизить количество приемов лекарства до 2 р./сут в отличие от 5 р./сут – при назначении ацикловира и повысить приверженность пациентов к проводимой терапии.
В ряде случаев среди пациентов, получавших хотя бы короткие курсы валацикловира в момент рецидива, тенденция к нарастанию частоты клинических проявлений ВПГ-инфекции ниже, чем среди пациентов, получавших только местное лечение, что во многом зависит от исходного состояния противовирусной защиты и продолжительности вторичного иммунодефицита у больных с ВПГ-инфекцией. Супрессивную терапию рекомендуют людям с частыми рецидивами. Для пациентов с сохраненным иммунитетом назначают препарат в дозе 500 мг 1 р./сут, с иммунодефицитом – 500 мг 2 р./сут. Прием препаратов ежедневно в течение 12 и более месяцев в 80% случаев предотвращает рецидивы герпеса и обеспечивает психологическое преимущество над лечением, проводимым во время обострений; при такой терапии рецидивы заболевания становятся достаточно редкими, а у некоторых пациентов возможна ремиссия в течение нескольких лет. Анализ рандомизированного исследования [26] подтвердил высокую клиническую эффективность применения валацикловира в профилактике рецидивирующей ВПГ-инфекции. Супрессивная терапия в прегравидарном периоде и перед родоразрешением может снизить частоту рецидивов ВПГ, риск бессимптомного выделения вируса и частоту кесарева сечения вследствие активации герпетической инфекции. Валцикон с фармакоэкономической точки зрения наиболее оптимально подходит для супрессивной терапии. Учитывая наличие большой упаковки (42 капсулы), доступную стоимость и 2–кратное применение в сутки, препарат Валцикон позволяет достичь очень высокой комплаентности лечения.
Таким образом, следует подчеркнуть, что проведение ранней диагностики, профилактики и лечения ВПГ-инфекции у женщин до наступления беременности, прегравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, предупредить тяжелые формы неонатальной инфекции, уменьшить перинатальную заболеваемость и смертность.
Для цитирования: Тютюнник В.Л. Подготовка к беременности при инфекционной патологии репродуктивной системы женщин. РМЖ. 2002;18:816.
Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
В настоящее время частота гнойно–воспалительных заболеваний в акушерстве и гинекологии не имеет явной тенденции к снижению. Во многих странах мира, в том числе и в России, отмечен рост инфекций, передаваемых половым путем, которые прочно занимают ведущее место в структуре акушерско–гинекологической заболеваемости. Внедрение современных технологий в клиническую практику позволило расширить исследования и показать, что отрицательное воздействие факторов внешней среды на микрофлору макроорганизма ведет к разнообразной патологии как воспалительного, так и невоспалительного генеза. Несмотря на значительные успехи, достигнутые в диагностике, терапии и профилактике инфекций, передаваемых половым путем, их частота не имеет отчетливой тенденции к снижению. Последнее связано также с ростом иммунодефицитных состояний на фоне ухудшения экологической обстановки, неправильного питания, частых стрессов, фармакологического бума с бесконтрольным применением лекарственных средств, в первую очередь антибиотиков и др. Чаще всего половая инфекция бывает обусловлена несколькими патогенными факторами – вирусами, микробами, грибами, простейшими, которые вызывают похожие по клиническому течению, но различные по патогенезу и методам лечения заболевания.
Участие в формировании воспалительных заболеваний органов малого таза, сопровождающихся не только дисбиозом влагалища, но и аналогичными изменениями со стороны желудочно–кишечного тракта и мочевыделительной системы; психоэмоциональные нарушения; формирование иммуно– и интерферонодефицитных состояний – вот далеко не полный перечень проблем, характерных для пациенток с урогенитальными инфекциями. Эти особенности одновременно являются предгравидарным фоном, который не в состоянии обеспечить развитие адекватных компенсаторно–приспособительных реакций, необходимых для гестационного процесса у большинства этих больных.
Однако работы, посвященные вопросам подготовки к беременности женщин с бактериальной и/или вирусной инфекцией, крайне малочисленны и направлены, как правило, на коррекцию отдельных звеньев патологического состояния.
Исходя из вышеизложенного, важнейшим и неотъемлемым этапом является правильная предгравидарная подготовка женщин. Поэтому проведение мероприятий по борьбе с инфекцией необходимо начинать до наступления беременности. Они должны включать:
I. Выявление пациенток с инфекцией, составляющих группу риска по развитию акушерских осложнений. В данную группу необходимо включать женщин, имеющих в анамнезе:
- хронические воспалительные заболевания придатков и матки, эктопию шейки матки, частые рецидивирующие кольпиты;
- аномалии развития и хронические воспалительные заболевания органов мочевыделения, дизурические расстройства неустановленной этиологии;
- заболевания, передающиеся половым путем (герпес, цитомегаловирус, хламидиоз, микоплазмоз, уреаплазмоз, кандидоз и т.д.);
- хронические экстрагенитальные очаги инфекции с частыми рецидивами;
- склонность к частым острым респираторным вирусным инфекциям;
- нарушения репродуктивной функции (бесплодие, дисфункция яичников, самопроизвольные выкидыши, неразвивающиеся беременности);
- осложненное течение предыдущих беременностей, родов, послеродового периода (хроническая плацентарная недостаточность, хроническая гипоксия и/или задержка внутриутробного развития плода, преждевременные роды, антенатальная гибель плода, аномалии прикрепления и отделения последа, гнойно–воспалительные заболевания пуэрперия и т.д.);
- неблагоприятные перинатальные исходы (внутриутробная или неонатальная инфекция, гипотрофия или пороки развития новорожденного, нарушение процессов ранней неонатальной адаптации и/или последующего физического и нервно–психического развития ребенка).
II. Тщательное клинико–лабораторное обследование женщин группы риска для верификации генитальной или экстрагенитальной инфекции независимо от уровня поражения репродуктивной системы не менее, чем двумя современными методами лабораторной диагностики, исследованием иммунного и интерферонового статуса и др.
III. Проведение комплексного лечения, которое должно включать как этиотропные виды терапии (комплекс антибактериального или противовирусного лечения), так и лечение сопутствующих заболеваний.
IV. Планирование и подготовка к беременности.
При выявлении герпес–вирусной инфекции проводится ее лечение с последующей профилактикой рецидивов. При генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисной (противовирусной) терапии, так и лечение сопутствующих заболеваний.
Базисные виды лечения:
а) Блокада репродукции вируса простого герпеса в режиме эпизодической или супрессивной терапии. Применяют ацикловир по 0,2 г 5 раз в сутки в течение 5 дней при легком течении инфекции (обострения 1 раз в 6–8 месяцев) и по 0,2 г 4 раза в сутки в непрерывном режиме в течение 2–2,5 месяцев – при ее частых рецидивах (обострения 1 раз в 30–90 дней).
Наиболее современным и эффективным противовирусным препаратом является валацикловир. Валацикловир представляет собой пролекарство – L–валиновый эфир ацикловира. После всасывания в кровь валацикловир почти полностью превращается в ацикловир под влиянием печеночного фермента валацикловир–гидролазы. Образовавшийся ацикловир проникает в пораженные вирусом клетки, где под влиянием вирусного фермента тимидинкиназы превращается в монофосфат, затем – в дифосфат и активный трифосфат. Трифосфат ацикловира угнетает ДНК–полимеразу и тем самым нарушает репликацию ДНК вируса простого герпеса. Следовательно, высокая избирательность валацикловира в отношении тканей, пораженных вирусом, объясняется тем, что первый этап цепи реакций фосфорилирования опосредуется ферментом, вырабатываемым самим вирусом. Валацикловир назначают по 0,5 г 2–3 раза в день в течение 5–10 дней. Длительность и дозу препарата подбирают индивидуально с учетом формы и тяжести вирусного заболевания;
б) На фоне блокады репликации вируса – стимуляция неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.);
в) Одновременное или последовательное использование специфического противогерпетического иммуноглобулина по 3,0 мл внутримышечно 1 раз в 3–5 дней, на курс 5 инъекций;
г) Стимуляция специфической резистентности организма (при условии увеличения межрецидивного периода в 1,5–2 раза) герпетической вакциной по 0,25 мл внутрикожно в руку 1 раз в 3 дня (всего 5 инъекций), после чего перерыв в лечении 2 недели и затем еще 5 инъекций по 0,25 мл 1 раз в 7 дней. Курс ревакцинации – через 6 месяцев;
д) Местное применение специфических мазей (зовиракс, алпизарин, мегосин, бонафтон).
При диагностике цитомегаловирусной инфекции проводится этиотропная противовирусная терапия. Четких рекомендаций по профилактике и лечению ЦМВ–инфекции нет. Идеальный противовирусный препарат должен иметь высокую клиническую эффективность, селективность по отношению к вирусу, полную безопасность для организма человека, вирусоцидное действие. Из–за отсутствия в настоящее время препаратов, которые полностью отвечали бы вышеуказанным требованиям по отношению к ЦМВ, профилактика и лечение данной инфекции представляет определенные трудности. Обязательной является коррекция показателей иммунитета, интерферонового статуса. При ЦМВ–инфекции рекомендуют проводить курсовую пассивную иммунизацию противоцитомегаловирусным иммуноглобулином по 3 мл внутримышечно 1 раз в 3 дня, на курс 5 инъекций. Более эффективен нормальный человеческий иммуноглобулин по 0,25 г/кг через день внутривенно капельно, 3 введения на курс. Можно назначать иммуномодуляторы (Т–активин, циклоферон, иммунофан), критерием их эффективности служит положительная динамика показателей клеточного звена иммунитета. Применяют также цитотект (в виде 10% раствора иммуноглобулина с высоким содержанием анти–ЦМВ IgG) внутривенно капельно по 2 мл/кг каждые 2 дня до 8–10 раз под контролем серологических показателей. Перспективно использование интерферонов – виферона по 0,5–1 млн. МЕ 2 раза в день в ректальных свечах в течение 15–20 дней. В профилактику и лечение ЦМВ–инфекции целесообразно включать системную энзимотерапию (вобэнзим по 5 драже 3 раза в день или флогэнзим по 2–3 таблетки 3 раза в день за 30 мин до еды в течение 1–1,5 месяцев).
Помимо лечения герпес–вирусной инфекции, показано проведение дополнительной терапии. Лечение скрыто протекающего хронического воспалительного процесса в эндометрии (вирусно–бактериальной этиологии) должно проводиться на фоне базисной терапии и быть этиотропным и патогенетически обоснованным. Учитывая превалирование анаэробно–аэробных ассоциаций, а также мико–, уреаплазменной и хламидийной инфекций, показано использование антибиотиков широкого спектра действия. При обнаружении урогенитального хламидиоза, микоплазмоза и уреаплазмоза назначают: спирамицин по 1 таблетке (3 млн. МЕ) 3 раза в день в течение 5–7 дней; джозамицин по 500 мг 3 раза в сутки в течение 5–7 дней; азитромицин по 1 капсуле (250 мг) 1 раз в день в течение 6 дней.
Этиотропную терапию при инфекционной патологии репродуктивной системы целесообразно сочетать с использованием антиоксидантов – аскорбиновой кислоты (витамин С) по 50 мг и витамина Е по 100 мг 3 раза в сутки. Возможно также использование эфферентных методов лечения (плазмаферез, эндоваскулярное лазерное облучение крови).
Особое внимание следует уделять восстановлению микроэкологии половых путей, так как к осложнениям гестационного периода и родов, связанным с различными нарушениями микроценоза влагалища, относят угрозу прерывания, самопроизвольные выкидыши, преждевременные роды, хориоамнионит, несвоевременное излитие околоплодных вод, рождение детей с малой массой тела, хронической гипоксией и/или признаками внутриутробной инфекции, в послеродовом периоде возникновение раневой инфекции родовых путей, эндометрита.
Нарушение микроценоза влагалища наиболее часто связано с бактериальным вагинозом и/или кандидозной инфекцией. По данным литературы, 75% женщин репродуктивного возраста имеют, по крайней мере, один эпизод вагинального кандидоза. В настоящее время известно 196 видов грибов рода Candida. Из них со слизистых оболочек человека выделяют более 27 видов. По сводным данным, Candida albicans обнаруживают в кишечнике у 20–50% здоровых людей, на слизистой оболочке полости рта – у 20–60%, во влагалище – у 10–17% небеременных женщин. Вагинальный кандидоз у беременных встречается в среднем в 30–40% случаев. Перед родами этот показатель может достигать 44,4%.
Цель лечения бактериального вагиноза и вагинального кандидоза – восстановить нормальную микрофлору влагалища, задержать рост микроорганизмов, не свойственных этому микроценозу. Существует множество препаратов и схем лечения дисбиозов влагалища. Однако нет оптимального препарата, который бы отвечал всем требованиям и имел стопроцентную эффективность.
При бактериальном вагинозе применяют следующие препараты: далацин вагинальный крем (2% вагинальный крем, содержащий 100 мг клиндамицина фосфата) 1 раз в сутки в течение 3 дней или тантум роза – вагинальный душ – 2 раза в сутки в течение 7–10 дней.
Препараты для лечения вагинального кандидоза подразделяются на следующие группы:
1. Антибиотики (нистатин, леворин, натамицин, амфотерицин В).
2. Имидазолы (клотримазол, кетоконазол, миконазол).
3. Триазолы (флуконазол (Дифлюкан, Фунголон), итраконазол).
4. Комбинированные препараты (полижинакс, клион Д, пимафукорт, макмирор комплекс).
5. Другие препараты (дафнеджин, иодатполивинилпироллидон, гризеофульвин, флуцитозин, нитрофунгин).
При острой форме вагинального кандидоза антимикотики назначают по 1 влагалищной свече (таблетке) 1 раз на ночь в течение 6 дней, а при рецидиве хронической инфекции – в той же дозировке в течение 9 дней. Одновременно соблюдается половой покой в течение 2–3 недель, проводится лечение супруга (местно 1% мазь канизона или другое противогрибковое средство).
Эволюция новых антимикотиков идет по пути разработки более коротких курсов лечения. В связи с этим новая эра в лечении микозов началась с внедрения в клиническую практику одно– или двукратно применяемых пероральных противогрибковых препаратов, активным веществом которых является флуконазол. Один из таких препаратов – Фунголон, который является одним из наиболее эффективных и высокобезопасных противогрибковых препаратов, ввиду его метаболической стабильности, быстрого всасывания за счет хорошей растворимости, минимального влияния на ферментные процессы в печени. Фунголон относится к классу триазольных соединений, которые угнетают биосинтез стеролов мембраны грибов, нарушают синтез эргостерола, в результате чего ингибируется рост грибов. Установлено, что препарат активен при микозах, вызываемых условно–патогенными (оппортунистическими) грибами, в том числе рода Candida. При этом фунголон избирательно действует на клетку гриба и в отличие от других антимикотических средств не оказывает влияния на метаболизм гормонов, не изменяет концентрацию тестостерона в крови у мужчин и содержание стероидов у женщин, что исключает развитие побочных реакций. Препарат принимают однократно в дозе 100–150 мг. В случае отсутствия эффекта через 5 дней назначают повторную дозу – 100–150 мг. Особо следует подчеркнуть, что в отличие от других антимикотиков однократный прием фунголона перорально позволяет достичь терапевтического эффекта в 90–100% случаев.
Санация очагов экстрагенитальной инфекции проводится с учетом чувствительности возбудителей к антибактериальным препаратам.
Планирование и подготовка к беременности возможны только при стойкой и длительной (более 6 месяцев) ремиссии герпес–вирусной инфекции, а также после устранения нарушений в репродуктивной системе с учетом основных факторов прерывания беременности. Важным условием правильной подготовки к беременности является нормализация иммунного и интерферонового статусов пациенток с использованием энзимотерапии. Так как практически любая инфекция сопровождается нарушением процессов энергетики и метаболизма на клеточном, тканевом и органном уровнях человеческого организма, предгравидарная подготовка должна также включать метаболическую терапию. При этом используют комплекс препаратов, стимулирующих биоэнергетические процессы в клетках и тканях – рибофлавин–мононуклеотид, липоевая кислота, пантотенат кальция, токоферола ацетат, рибоксин, оротат калия, пиридоксальфосфат, фитин, троксевазин. Метаболическую терапию назначают в течение 7 дней с 2–3 недельным перерывом, в виде комплексов. Показана также поливитаминная терапия с комплексом микроэлементов.
Проведение ранней диагностики, профилактики и лечения инфекционной патологии репродуктивной системы женщин до наступления беременности, предгравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, предупредить тяжелые формы неонатальной инфекции, уменьшить перинатальную заболеваемость и смертность.
Генитальным герпесом называют склонную к рецидивированию инфекционную патологию кожных и слизистых покровов, а иногда и других органов.
Данная патология может иметь серьезные последствия.
В числе прочего неблагоприятно сказывается на протекании беременности и здоровье родившихся детей.
Примерно каждый пятый человек – носитель этого вируса, но симптомы генитального поражения обнаруживаются всего лишь у 5% зараженных.

Возбудитель генитального герпеса
Различают ВПГ 1-го и 2-го серотипа.
Около 80% генитальных герпесных поражений обусловлено ВПГ-2, также возможно инфицирование обоими типами.
Вследствие генитально-оральных контактов встречается ВПГ-2-обусловленные поражения ротоглотки.
Специфические особенности этого возбудителя:
- располагается и размножается в нервных и лимфатических узлах
- распространяется по организму с током крови
- может вызывать лимфоцитарные, нейтрофильные и макрофагальные изменения, ослабляя иммунитет на клеточном уровне
Как передается генитальный герпес
Возбудитель легко проникает через слизистые покровы.
Взрослые, как правило, заражаются при поцелуях и половых контактах.
Вероятность передачи при контакте гениталий составляет 75%, если у партнера имеются проявления болезни.
Частота обнаружения вируса зависит от целого ряда факторов – возрастной категории, специфики половой жизни, уровня социально-культурного и пр.
Среди девочек возраста до 15-ти лет положительные результаты анализов выявляются меньше, чем в 1% случаев.
Тогда как у женщин с имеющимися ЗППП данный показатель может достигать 60%.
Дети чаще заражаются через контакт с предметами, загрязненными выделениями больного.
Генитальный герпес при беременности – частая причина инфицирования детей внутриутробно (ВПГ попадает в детский организм с материнской кровью).
Также происходит заражение малышей в процессе рождения через пораженные родовые пути.

Первичный генитальный герпес при беременности, развившийся за месяц до родоразрешения, может приводить к плодному заражению с вероятностью 50%.
Если же при беременности диагностируется рецидив генитального герпеса или инфекция имеет асимптомное течение, то риск инфицирования составляет до 4%.
Статистически пути инфицирования ребенка распределяются так:
- 5% приходится на внутриутробное заражение (пренатальный путь)
- 75-90% ‑ на заражение в процессе естественных родов (интранатальный)
- остальные случаи – на результат контакта с инфицированным ухаживающим лицом (постнатальный)
Также существует возможность передачи при переливании крови, медицинских манипуляциях, трансплантации органов.
Симптомы генитального герпеса
Инкубационный период варьируется от двух до 12-ти суток, в течение которых возбудитель размножается в кожных слоях.
Болезнь протекает в несколько стадий.
При инфицировании первичном появляются герпесные проявления (типичные или атипичные).
Варианты развития болезни:
Скрытая инфекция характеризуется отсутствием следов ВПГ в анализируемых биологических образцах, но сохранением возбудителя в нервных узлах.
Подобное состояние бывает итогом инфицирования первичного или развивается после первых симптоматических проявлений.
Рецидивирование – возобновление симптоматики после бессимптомного периода.
Для типичной формы заболевания характерны:
- начальный период, длящийся до двух суток, характеризуется болезненностью, ощущениями жжения, покалываний, зуда, иногда нарушениями мочеиспускания
- период высыпаний – на отекших и покрасневших половых органах появляются пузырьки, которые самопроизвольно лопаются с формированием эрозий; больные жалуются на усиление болей, зуда, появление мокнутий (длительность около недели)
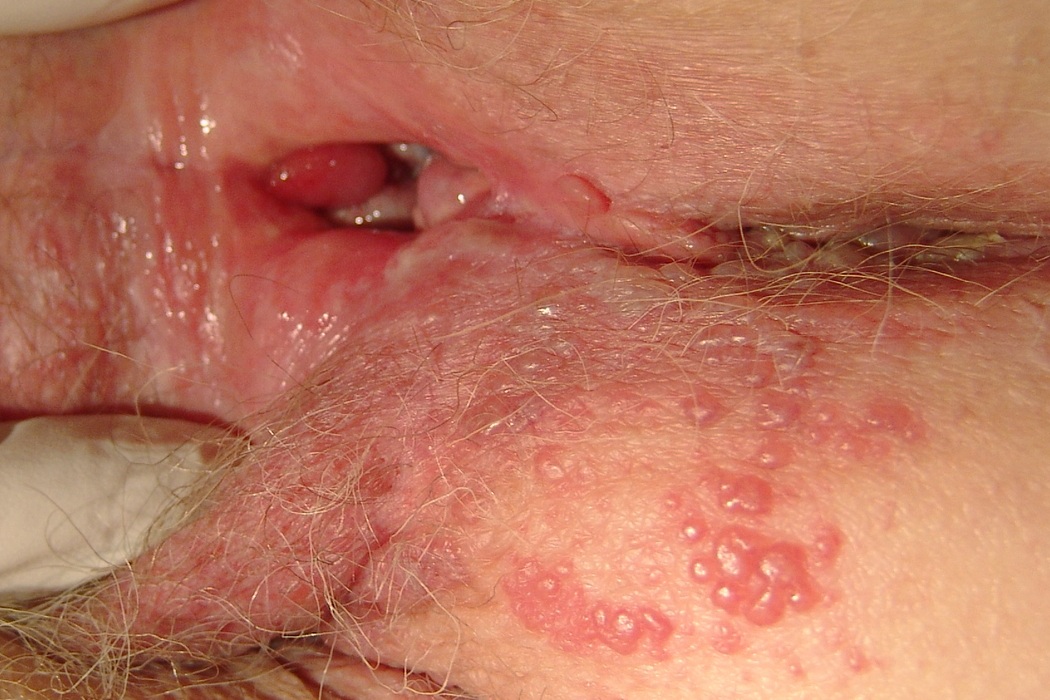
- регресс – на месте эрозий образуются корочки, после отпадания которых некоторое время сохраняются окрашенные участки (длительность около одной – двух недель)
Зачастую заболевание протекает без характерной сыпи.
При этом могут предъявляться жалобы только на умеренные отечность, покраснение.
Выраженные боли иррадиируют в близрасположенные органы и кожные участки без особых внешних проявлений.
Общая продолжительность проявлений при первичном заражении может достигать 6 недель.
Рецидив инфекции протекает менее выраженно.
Длительность до 15 суток, тяжесть симптомов менее интенсивная, корочки сходят примерно за 4 дня.
Помимо наружных половых органов вирус может поражать у женщин:
- влагалищные стенки с придатками (яичники, трубы)
- уретру
- мочевой пузырь
- лоханки почек
До 80% женщин с первичным инфицированием ВПГ-2 имеют проявления цервицита, в виде обширной эрозии (ярко-алой, с язвами) на шейке матки.

Особо сложное течение приобретает болезнь на фоне имеющегося состояния иммунодефицита (физиологического у новорожденных или приобретенного).
Какие особенности имеет генитальный герпес во время беременности
В общем случае, где-то у трети всех репродуктивного возраста женщин обнаруживаются антитела к ВПГ-2.
Но особую проблему представляет собой такой вариант болезни, как генитальный герпес, первичное заражение которым имело место во время беременности.
Такая форма обнаруживается у 2% инфицированных беременных.
Пациентки врача-гинеколога часто интересуются, опасен ли генитальный герпес при беременности?
Согласно статистическим данным каждый год регистрируется до 2000 эпизодов герпеса у новорожденных (неонатального герпеса).
Это состояние может стать причиной серьезных неврологических проблем и даже летального исхода.
Генитальный герпес опасен при беременности, вызывая:
- нарушения ее нормального протекания (прерывание/невынашивание/многоводие)
- патологические отклонения у плода: аборт самопроизвольный – например, в связи с такой причиной, как замершая беременность, которая может произойти в числе прочих причин и при генитальном герпесе (ответы врачей на консультациях часто включают подобный вариант); инфекцию внутриутробную; мертворожденность
- патологические отклонения у новорожденного: недоношенность; герпес врожденный; низковесность при рождении
Герпетическая инфекция у новорожденных может иметь следующие исходы:
- в 45% диагностируется локализованная форма (не приводит к смертельному исходу, может проявляться поражениями глаз, полости рта, кожи, вероятность заболеваний порядка 5%);
- в 35% обнаруживается поражение ЦНС (смертность при этой форме достигает 15%, вероятность проявлений болезни – 65%, может проявляться в виде менингоэнцефалитов, задержки умственного развития);
- в 20% выявляется диссеминированная (распространенная) форма (смертность составляет 60-80%, риск заболеваний – 40%, болезни – хориоретинит, микроцефалия, кальцификации внутричерепные, микрофтальмия).
Изучив все вышеуказанные моменты, становится ясным, почему при такой патологии, как генитальный герпес, планирование беременности играет весьма существенную роль.
Генитальный герпес: как устанавливают диагноз
Для исследования на герпес подходит практически любой материал:
- соскоб из влагалища, мочеиспускательного канала, маточной шейки
- слюна
- содержимое высыпаний
- моча
- кровь и др.
Для обнаружения вируса применяют:
- бакпосев – достаточно информативен, но в практических целях используется не рутинно из-за дороговизны и длительности проведения
- иммуноферментный анализ (ИФА) – применяют для обнаружения в крови антител к возбудителю (иммуноглобулинов классов M, G), не распространен широко, так как IgG – маркер контакта организма в прошлом с вирусом – обнаруживается у большинства взрослых здоровых людей
- полимеразная цепная реакция (ПЦР) – наиболее эффективный вариант с чувствительностью 95% и специфичностью около 100%
- цитологическое исследование – обнаруживает в образцах с зон высыпаний характерные клетки (многоядерные гигантские клетки Тцанка, продуцирующие антитела клетки Унна), в период обострения выявляет вирус у 75% больных
Исследование на антитела к ВПГ в рутинной практике не применяют.
Однако такое обследование проводится, если:
- на фоне отрицательных данных ПЦР, посева имеются симптомы болезни
- диагноз поставлен ранее по клиническим признакам и не имел лабораторного подтверждения
- болезнь обнаружена у полового партнера
Инфицирование вирусом простого герпеса увеличивает риск заражения ВИЧ.
В то же время ВИЧ может способствовать частому рецидивированию герпетической инфекции.
Поэтому при наличии свыше 6 обострений герпеса в год показано дополнительное обследование на ВИЧ.
Для подтверждения иммунодефицита, обусловленного ВИЧ, онкологией, аутоиммунными патологиями или болезнями крови, используется иммунограмма.
Как лечится генитальный герпес при беременности
Лечение генитального герпеса при беременности – прерогатива врача акушера-гинеколога.
Ведением инфицированных новорожденных занимаются педиатры и неонатологи.
В ситуации с регулярным рецидивированием и в случае иммунодефицитных состояний показана консультация иммунолога.
Первичный генитальный герпес на ранних сроках беременности – весьма серьезная проблема.
Его проявления весьма ярки из-за отсутствия в материнском организме защитных антител.
Состояние может закончиться плодной гибелью, выкидышем, патологическим изменением формирующихся органов ребенка.
Также опасно первичное заражение и в третьем семестре, чреватое патологиями печени, нервной системы, кожных покровов, селезенки у плода.
Все это определяет необходимость экстренной медицинской помощи в подобной ситуации.
При беременности единственными реально действующими препаратами при генитальном герпесе являются представители аномальных нуклеозидов: ацикловир и его производные.

Также назначаемый по жизненным показаниям, фармцикловир.
Врач определяет, чем лечить генитальный герпес при беременности и по каким схемам.
Принимается во внимание ряд факторов (иммунный статус пациентки, частота рецидивов, срок беременности и пр.).
Во время постановки на учет проводится подробнейший сбор анамнеза на предмет наличия у женщины и ее партнера генитального герпеса.
Если на стадии планирования у женщины обнаруживается обострение болезни, требуется подтверждение вирусологическое (культуральным методом) возбудителя.
К сожалению, выявить всех лиц с инфекцией, протекающей бессимптомно, невозможно даже лабораторными методами.
Поэтому тактика медицинской помощи определяется ситуацией.
Первичное заражение генитальным герпесом
Если первичный генитальный герпес возник во втором триместре беременности (также, как и в первом) или в прошлом имелась высокая частота обострений заболевания (свыше 6 эпизодов за год) назначается ацикловир в последние 4 недели перед родами.
Это позволяет снизить риск рецидива болезни.
Когда первичный генитальный герпес проявился после 34-й недели, например, на 37 неделе, беременности, с целью профилактики неонатальной инфекции планируется кесарево сечение.
Из-за того, что на момент родов может прийтись значительное выделение вируса, приводящее к заражению ребенка.
Если же первичный генитальный герпес возник при беременности (3 триместр, окончание периода) и невозможно избежать естественного родоразрешения, проводится лечение и матери и ребенка:
- матери назначается внутрь ацикловир в дозировке 200 мг 5 раз/сутки, периодом до 10 дней или по 400 мг, 3 раза/сутки
- новорожденному ацикловир назначается из расчета 20 мг/кг тела внутривенно 3 раза/сутки сроком до трех недель
Альтернативно может использоваться аналог ацикловира – валацикловир.

Кроме того, если при беременности произошло проявление такой патологии, как генитальный герпес, мази с ацикловиром в составе могут облегчить состояние беременной.
Поскольку средства наружного применения не всасываются в кровь, то они и не влияют на плод.
Согласно недавним исследованиям было установлено, что прием ацикловира и валацикловира в первом триместре беременности не повышает риск серьезных врожденных дефектов.
Признано, что ацикловир безопасен во время беременности и может назначаться по медицинским показаниям.
Относительным недостатком препарата является то, что он, возможно, снижает выработку антител на первичную вирусную инфекцию.
Также, как и любое лекарство, нуклеозиды могут приводить к развитию нежелательных эффектов (аллергическим реакциям, головным болям, нарушениям стула и др.).
При проявлении побочного действия необходимо обсудить с врачом дальнейшую тактику лечения.
Применение ацикловира строго обязательно в ситуациях с диссеминированными вариантами заболевания, сопровождающихся развитием у будущей матери энцефалита, гепатита и пр.
Использование иных медикаментозных средств (например, иммуномодуляторов и т.п.) не является оправданным.
Так как на сегодняшний день нет препаратов альтернативных по эффективности нуклеозидным производным.
Контроль после завершения лечения не требуется.
Рецидив генитального герпеса во время беременности
Инфицирование, эпизоды заболевания женщины могли иметь место задолго до задержки менструации (первого признака нового состояния организма).
Тогда при беременности вследствие физиологического снижения иммунитета генитальный герпес может обостриться.
Отличить рецидив ранее бессимптомной формы болезни от первичного инфицирования позволяет анализ крови на антитела.
При обнаружении IgG можно быть уверенным в том, что женщина встречалась с ВПГ ранее.
В ее организме есть защитные антитела, и угроза для будущего ребенка практически отсутствует.
В противной ситуации женщине необходима безотлагательная помощь специалиста.
Таким образом, если у беременной (либо ее партнера) имелся в анамнезе герпес генитальный, перед родами следует провести культуральное исследование.
А родоразрешение рекомендуется осуществлять без применения кесарева сечения.
В отсутствие симптоматики герпеса никаких мер, кроме стандартной профилактики ИППП, не принимается.
Если же у женщины инфекция в добеременный период носила бессимптомное течение, то риск заражения новорожденных достигает 0, 01%.
Хотя при этом составляет 2/3 всех эпизодов неонатального герпеса.
В связи с отсутствием достоверных данных предсказать развитие подобной ситуации весьма сложно.
В таком случае также рекомендуются лишь общие меры профилактики.
Особую категорию составляют беременные с ВИЧ.
Согласно исследованиям инфицирование герпесом увеличивает риск передачи ВИЧ ребенку.

Если инфицирование герпесом было первичным во время беременности, женщинам проводится в дополнение к антиВИЧ-терапии лечение против герпетической инфекции с 36-й недели.
Если же женщина была инфицирована до зачатия, решение о необходимости медикаментозного вмешательства принимает врач.
Профилактика генитального герпеса
На сегодняшний имеется экспериментальная вакцина Герпевак.
Проходит стадию клинических исследований и демонстрирует у женщин хорошую переносимость и высокую эффективность в отношении защиты от ВПГ.
Специфических методов профилактики инфицирования в период беременности не существует.
Рекомендуется придерживаться моногамных отношений, использовать презерватив.

Если установлено, что партнер женщины инфицирован, а сама беременная нет, то следует воздерживаться от половых отношений.
Либо постоянно пользоваться презервативом с одновременным приемом мужчиной 1 таблетки валацикловира каждый день на протяжении всей беременности (риск заражения снижается на 75%).
Следует также исключить орально-генитальные контакты.
Профилактика рецидивов при беременности проводится после 36й недели курсом ацикловира или валацикловира.
При подозрении на генитальный герпес при беременности обращайтесь к опытным специалистам нашего медицинского центра.
Читайте также:

