Как развести на вирусы
Обновлено: 25.04.2024
Чем можно заразиться от орального секса? Меры профилактики
К сожалению, далеко не всегда секс может быть безопасным для обоих партнеров, ведь никогда нельзя быть на 100% уверенным в человеке, с которым вы вступаете в половую связь. Некоторые заболевания на начальных порах невозможно даже диагностировать, поэтому очень важно защищать себя и предотвращать неприятные ситуации. Многие знают, чем можно заразиться, занимаясь сексом. Если говорить конкретно об оральном сексе, то многие люди информацией в полной мере не владеют. Давайте же рассмотрим основные заболевания, которые передаются от партнера к партнеру, если говорить об оральном сексе.
Чем можно заразиться от орального секса?
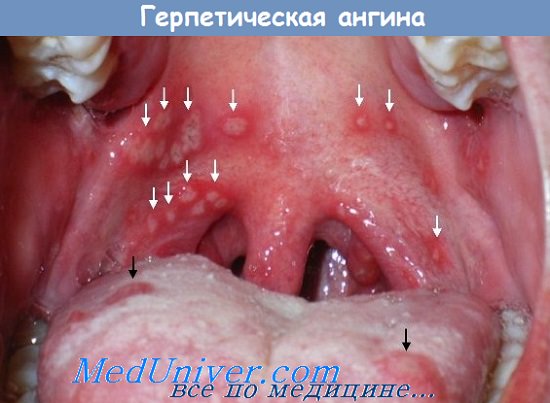
1. Герпетическая ангина (ВПГ, вирус простого герпеса). Это неприятное инфекционное заболевание знакомо многим. Характеризуется оно расстройством глотания, тошнотой и даже повышением температуры тела. На небе образуются мелкие высыпания, которые охватывают также стенки глотки. Безусловно, если иммунитет у человека крепкий, то вирус простого герпеса отторгается организмом, и заражение не возникает. Так как заражение происходит через слизистую оболочку полости рта, стоит внимательно относиться к выбору партнера.
Симптомы герпетической ангины:
- Слабость и общее недомогание
- Температура тела 39-40 градусов
- Боль в мышцах, в животе и спине.
- Рвота, понос, боль в голове.
- Резкая боль при глотании.
- Кашель.
Безусловно, перечень данных симптомов не обязательно свидетельствует о наличии герпетической ангины, часто они схожи с симптомами гриппа. В любом случае пройдите обследование, чтоб своевременно начать лечение.
2. Хламидийная инфекция. Хламидиоз передается через эякулят. Группой риска являются люди, которые часто вступают в половые связи с множеством разных партнеров. Передается инфекция через анальное отверстие и во время орального секса. Лечится это неприятное заболевание только антибиотиками, но уже вскоре после полного выздоровления можно заразиться вновь от распространяющего вирус человека. Симптомы хламидийной инфекции могут появиться через 5-30 дней после полового акта, поэтому диагностировать заболевание на первых порах не так просто.
Симптомы хламидийной инфекции:
- У женщин возможны межменструальные кровотечения.
- Боль внизу живота.
- У мужчин прозрачные выделения из мочевого канала.
- Болезненное мочеиспускание.
3. Кандидозная инфекция. Также известна как молочница. Еще одно заболевание, которое кажется не особо опасным, однако, в запущенном виде может привести даже к бесплодию. Принято считать, что молочница - заболевание исключительно женское, но это не так, микроорганизмы поражают также головку полового члена. Заражение происходит во время орального и вагинального секса, также кандидоз распространен среди тех, кто часто меняет партнеров.
Симптомы кандидозной инфекции:
- Болезненные ощущения во время полового акта.
- Белый налет на головке полового члена, белые выделения из влагалища у женщин.
- Сильный зуд в области половых губ у женщин и головки полового члена у мужчин.
- Густые выделения мутного цвета во время мочеиспускания.
- В ротовой полости она проявляет себя белым налетом на деснах, небе и их болезненностью после снятия налета.
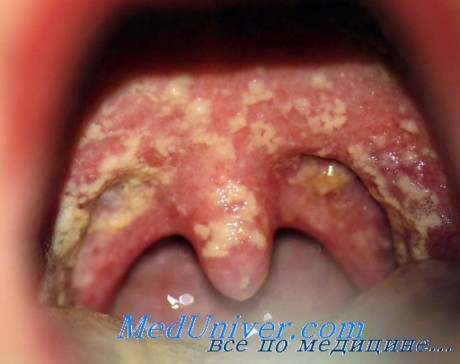
Молочница (кандидоз ротовой полости)
4. Гонорея. От орального секса передается данное заболевание крайне редко, но небольшая вероятность существует. Гонорея является гнойным заболеванием, характеризующимся воспалениями. Группа риска - это молодые люди 19-35 лет, которые ведут активную половую жизнь. Передается гонорея вагинально, анально и даже орально. В начальной форме заболевание практически незаметно, а в запущенной форме может привести даже к развитию сепсиса. Бытует мнение, что гонореей можно заразиться через полотенце в душе или в бане, но зафиксированных случаев было не более 1%.
Симптомы гонореи:
- Выделение гноя, зуд, жжение половых органов.
- Болезненное частое мочеиспускание.
- Воспаление головки полового члена у мужчин, покраснение и воспаление слизистой у женщин.
- Возможно повышение температуры тела.
- Отек половых губ у женщин.
5. Сифилис. Данное заболевание также крайне редко передается оральным путем. Суть в том, что в случае заражения нужен достаточно большой объем жидкостями, а это не всегда происходит во время орального секса. Статистика показывает, что частота заражения сифилисом приблизительно одинакова как во время орального секса, так и через зубную щетку больного человека. Сегодня специалисты в области медицины достаточно быстро лечат данное заболевание, однако, а запущенной форме оно может привести даже к смерти.
Симптомы сифилиса.
- Образование наростов округлой формы (шанкра), к которой в дальнейшем крепится сифилитическая цепь. Выглядит как небольшая язва красного или даже синюшного цвета
- Припухлость и воспаление шанкра.
- Воспаление одной миндалины. Этим сифилис отличается от герпетической ангины, потому как инфекция поражает локально одну из миндалин, также воспаляется один из лимфоузлов.
- Сложности при глотании и употреблении пищи.
Можно ли заразиться от орального секса СПИДом?
Существует миф, что заразиться СПИДом во время орального секса достаточно просто, но статистика показывает обратное. Вирус может инфицировать только в том случае, если у одного партнера кровоточащие десна, а у второго повреждения на половых органах, но как часто встречаются в жизни такие совпадения? Даже если пользоваться одной иглой с инфицированным человеком, вероятность сводится к 0,67%. Если делать минет мужчине, который болен СПИДом, вероятность равна 0.04%. Самым опасным методом передачи ВИЧ является анальный секс. Поэтому смело можно утверждать, что очень сложно стать ВИЧ положительным, занимаясь оральным сексом.
Видео о мирамистине и половых инфекциях
- Рекомендуем посетить библиотеку "Бесплатных книг по сексологии"
- Рекомендуем посетить наш раздел с интересными материалами на аналогичные тематики "Психология отношений"
Выращивание вирусов. Методика выращивания вирусов.
Развитие специфической профилактики инфекционных заболеваний человека и животных создало необходимость разработки методов массового получения вирусного сырья.
В течение многих лет заражение животных оставалось единственным методом культивирования вирусов, что служило серьезным препятствием для получения высококачественных вирусных вакцин и в достаточном количестве. До сих пор не удалось культивировать in vitro некоторые вирусы (папилломы человека и др.).
Использование куриных эмбрионов — важный шаг на пути разработки вирусных вакцин. В силу высокой производительности и отличного накопления некоторых вирусов этот метод не потерял своей актуальности. Его и сейчас с успехом применяют для изготовления вакцин против ряда заболеваний человека и животных.
Большое накопление некоторых вирусов в организме составляет серьезную конкуренцию методам их размножения в клеточных культурах. Это, прежде всего, относится к вирусу гепатита В, который накапливается в плазме крови человека в высоком титре (1012—1013 частиц/мл) и является прекрасным источником вирусного антигена для приготовления инактивированной вакцины.
Другим примером может служить вирус миелобластоза птиц, который при экспериментальном заражении цыплят накапливается в плазме крови в титре 5х10 12 вирусных частиц/мл и является хорошим источником препаративного получения ре-вертазы.
Значительные успехи в области выращивания вирусов животных вне организма прежде всего связаны с открытием возможности выращивания полиовируса в экстраневральных тканях (Эндерс и сотр., 1949) и усовершенствованием метода тканевых культур (Дульбекко и др., 1952). Этому в огромной степени способствовало также открытие антибиотиков и создание синтетических и полусинтетических питательных сред. Указанные достижения обеспечили возможность обновить методы получения ранее существовавших препаратов и создать новые эффективные вакцины против ряда вирусных болезней.
В производстве вирусных препаратов широкое применение нашли первичные культуры и линии клеток. Для приготовления живых и инактивированных вакцин человека, а также животных, часто используют вирус, выращенный в первичных культурах клеток животных. В последнее время инактивированные вакцины, предназначенные для вакцинации людей, все чаще готовят с использованием клеточных линий. Для некоторых вакцин, применяемых в животноводческой практике, вирус выращивают в культурах постоянных клеточных линий. Перспектива использования постоянных линий клеток особенно заманчива в плане крупномасштабного суспензионного культивирования.
Выбор метода получения вирусного сырья в каждом конкретном случае определяется специфическими требованиями, предъявляемыми к готовому препарату.
Получение большого количества вирусного сырья с выраженной антигенной активностью особенно необходимо для инактивированных вакцин. Изготовление некоторых из них, применяемых в животноводческой практике, достигло огромных масштабов. С точки зрения технологии крупномасштабного производства вирусных препаратов, метод культивирования вируса должен основываться на потреблении доступных, недорогих, максимально стандартизированных клеточных субстратов и питательных сред, обеспечивать достаточное накопление вируса или вирусного антигена и иметь высокую производительность.
В настоящее время разработаны и широко применяются методы производственного выращивания ряда вирусов человека и животных с целью изготовления вирусных препаратов. Однако, учитывая исключительную практическую важность исследований и разработок в этой области, они постоянно направлены на поиски новых принципов и технологических решений.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Культивирование вирусов. Биотехнологии в вирусологии.
Массовое выращивание клеток в культуре является центральным звеном любого технологического процесса, основанного на использовании клеток животных, и, в первую очередь, производства вирусных препаратов. Эта стадия определяет массу и качество клеток и, тем самым, в целом технологию получения вирусного сырья. Выбор способа культивирования вируса в значительной мере определяется способностью клеток размножаться на поверхности плотного субстрата или в суспензионной культуре. Трудно определить верхние и нижние границы крупномасштабного или промышленного выращивания вирусов в клеточных культурах. Все зависит от масштабов производства вирусных препаратов. В одних случаях речь идет о получении сотен литров, в других — десятков и даже сотен тысяч литров культурального вируса в год. Это зависит от вида вакцин и масштабов их применения. Изготовление живых вакцин при прочих равных условиях всегда требует меньших объемов вирусного сырья, нежели приготовление инактивированных, в особенности концентрированных вакцин.
Отсутствие эффективных вакцин для профилактики некоторых заболеваний объясняется, прежде всего, отсутствием экономичного способа получения иммуногенного материала в достаточном количестве.
В отличие от инактивированных вакцин против ящура и полиомиелита, выпускаемых в больших количествах, при многих заболеваниях человека и животных применяют живые вакцины, для изготовления которых не требуется большого количества вирусного сырья. Это, прежде всего, относится к тем вакцинам, которые перед применением разводят. Ежегодно производство таких вакцин, связанное с получением сотен литров культурального вируса, удовлетворяется использованием статических или вращающихся культуральных сосудов. Однако такие методы культивирования вирусов не могут удовлетворить крупномасштабное производство ряда вирусных вакцин. Например, при изготовлении противоящурной вакцины перевиваемые клетки выращивают в суспензии в реакторах с рабочим объемом более 1000 л. Крупные научно-производственные центры Южной Америки ежегодно вырабатывали до 600 млн. доз моновалентной инактивированной противоящурной вакцины. Для этой цели необходимо еженедельно получать около 20 000 л суспензионной культуры клеток ВНК-21.
До недавнего времени производство большинства вирусных препаратов основывалось на использовании первичных культур клеток из нормальных тканей различных видов домашних и лабораторных животных. Кроме того, в качестве клеточных субстратов для производства вакцин, применяемых в медицине, использовали немногие линии диплоидных клеток с ограниченной жизненной потенцией. Широкое применение таких препаратов в медицине и ветеринарной практике дало возможность достичь больших успехов в борьбе со многими опасными вирусными болезнями человека и животных. Однако первичные культуры клеток во многих отношениях не являются перспективными клеточными субстратами. Их приготовление связано с периодическим убоем животных и необходимостью выделения клеток из тканей.
Первичные культуры отличаются нестандартностью, таят в себе опасность в отношении эндогенной контаминации различными вирусами и микроорганизмами. Наконец, их сложно выращивать в условиях крупносерийного производства. Отмеченные трудности значительно возрастают в связи с тенденцией постоянного увеличения масштабов изготовления противовирусных препаратов. Кроме того, в последнее время все более широкое развитие получает разработка концентрированных и субъединичных вакцин, при изготовлении которых требуется большое количество вирусного материала. Естественно, что стоящая задача может быть решена лишь путем использования постоянных (перевиваемых) линий клеток, отличающихся способностью к бесконечной пересеваемости вне организма, высокой стандартностью, низкой стоимостью, относительной простотой трансфекции рекомбинантной ДНК и последующего клонирования высокоэффективных продуцентов, высокой вероятностью правильного посттрансляционного процессинга вновь синтезируемых белков, кодируемых трансфецирующей ДНК.
Ветеринарная наука в течение последней четверти века накопила большой опыт в изготовлении вирусных вакцин с использованием в качестве субстрата для размножения вирусов культур постоянных линий клеток животных. Особый успех достигнут в изготовлении инактивированной противоящурной вакцины. Производство вакцин против ящура имеет наиболее цитируемую технологию. Она основана на использовании линии трансформированных клеток новорожденного хомяка, выращиваемых в суспензии. Эта технология достаточно экономична, ее выполняют в биореакторах большой емкости. Накоплены определенные доказательства безопасности некоторых постоянных клеточных линий, используемых в качестве субстрата в производстве ряда биологических препаратов. Например, инактивированную противоящурную вакцину готовят из вируса, выращенного в культуре постоянной линии клеток почки новорожденного хомяка (линия ВНК-21). Более чем за 20-летний период этой вакциной привито свыше 100 млн. голов крупного рогатого скота и не обнаружено каких-либо нарушений у привитых животных, по крайней мере, в течение 2—4 лет после введения вакцины. Имеется много других примеров безопасности применения инактивированных и даже живых вакцин против ряда болезней животных, приготовленных из вирусов, размноженных в культурах различных постоянных линий клеток. Применение биологических препаратов, полученных на основе перевиваемых клеточных линий, в медицине началось намного позже, чем в ветеринарной практике.
Несмотря на очевидные преимущества постоянных линий клеток, медицинская практика до недавнего времени воздерживалась от их применения в производстве вирусных вакцин. Причина заключалась в том, что, согласно существовавшему мнению, для изготовления медицинских вирусных вакцин можно было использовать клетки из тканей только клинически здоровых животных. Производство таких вакцин ограничивалось использованием первичных и диплоидных культур клеток. В диплоидных линиях клеток человека никогда не были обнаружены латентные вирусы или спонтанная трансформация клеток. Основное возражение против использования постоянных клеточных линий для репликации вирусов и векторных рекомбинатов в производстве вирусных вакцин медицинского назначения заключалось в их возможной онкогенности из-за контаминации вакцин клеточной ДНК или генными продуктами (регуляторными белками). Интеграция гетерогенной ДНК может привести к предзлокачественным изменениям в результате активации протоонкогенов, запуску онкогенов и инактивации генов опухолевой супрессии. В процессе репродукции вакцинных штаммов для живых вакцин с использованием клеточных линий, латентно контаминированных другими вирусами, могут появляться вирусные гибриды с неожиданными свойствами.
Этот вопрос рассматривался неоднократно на различных научных форумах в Европе и Северной Америке. Ценность постоянных клеточных линий в качестве субстратов стала особенно очевидной благодаря успехам, достигнутым в последнее время в области фундаментальных биологических исследований, а также в связи с перспективой их использования в рекомбинантной ДНК-технологии и получении генно-инженерных биопрепаратов. Общая тенденция к применению постоянных клеточных линий в производстве медицинских иммунобиологических препаратов наметилась на рубеже 70—80-х годов. Так, в 1978 г. в Лейк-Плесиде (США) было предложено использовать лимфобластоидные клетки человека для крупномасштабного производства альфа-интерферона. В 1981 г. Комитет экспертов ВОЗ по стандартизации биологических препаратов одобрил применение неопухолевых и неконтаминированных вирусами постоянных клеточных линий для производства инактивированной полиомиелитной вакцины, а затем также для инактивированной вакцины против бешенства. Такое решение дало возможность в короткий срок разработать методы крупномасштабного выращивания вирусов с использованием микроносителей и создать высокоэффективные вирусные вакцины.
В истории создания биологических препаратов ключевая роль всегда принадлежала выбору приемлемо безопасных вариантов. Решение о применении людям биопрепаратов, полученных с использованием постоянных клеточных линий, основывалось на оценке различными комитетами выгод и риска, связанных с созданием новых препаратов, по сравнению с существующими. Важнейшие потенциальные факторы риска, связанные с биологическими препаратами, производимыми на постоянных клеточных линиях, можно разделить на три категории: примесь гетерогенной ДНК, вирусы и трансформирующие белки.
Одним из основных вопросов, требующих самого пристального внимания, является потенциальная долгосрочная опасность, связанная с присутствием в препаратах примесей гетерогенных ДНК, особенно в тех случаях, когда последние могли содержать потенциально онкогенные кодирующие или регуляторные последовательности.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Культивирование вирусов представляет собой их выращивание в искусственных условиях. Для этого культиваторы заражают животных, либо ткани и клетки. Такое мероприятие проводят в целях диагностики, при проведении экспериментов, с целью изготовления противовирусных вакцин.
Культивирование вируса впервые было совершено Гальтье в 1879 году. Он культивировал вирус бешенства, заразив мозг кролика вирусом бешенства, полученным у больной собаки. Ученым Левенштейном была обнародована информация о возможности передачи вируса герпеса от человека кролику.
Репродуцирование вирусом осуществляется исключительно в живых клетках. По этой причине для того, чтобы они накопились, их заражают вирусами. После заражения вирус адаптируется к новому организму. Адаптация вируса проходит тем легче, чем ближе новая среда.
Чтобы репродукция прошла на лучшем уровне используют чувствительную систему, а заражение проводят свежим, но разведенным материалом. Это объясняется тем, что инактивированный вирус может приостанавливать скорость размножения вирионов. Система, в которой осуществляется репродукция, называется пермиссивной. Но, однако для каждого вируса пермиссивная система может приобрести статус непермиссивной. Это будет возможно в случае изменения условий культивирования. К примеру, таким условием являются температурные скачки.
Культивирование вируса на животных осуществляется только в том случае, ели эти вирусы приводят к формированию ясной и понятной клинической картины, либо патологоанатомической картины. Например, во время заражения мышей вирусом бешенства у них случается паралич. Большое количество вирусов хорошо вырастают в птичьих эмбрионах либо теле новорожденных млекопитающих. Реже в организме половозрелых особей.
Культивируют вирус в организмах мышей, крыс, кроликов, кур. На взрослых особях мышей выращивают вирусы гриппа и бешенства.
На белых крысах и хомяках испытывают онкогенные вирусы. Вирус ящура и маргбурской болезни культивируют на морских свинках. Ученые смогли изучить вирусы полиомиелита и желтой лихорадки только после того, как изучили их рост на макаках.
Возбудителей некоторых инфекций ученые смогли определить только после заражения шимпанзе. К таковым относят вирусы гепатита А и В.
Чтобы ученые получили верные результаты все животные, в организме которых культивируют вирусы, должны быть генетически однородными. Для достижения этой цели осуществляют скрещивание лабораторных особей. Результатом такого действия становится растущая степень гомозиготности.
Чтобы культивирование прошло успешно, мало выбора правильного вида и возраста животного. Очень важно, какой будет использован путь для введения материала. Чаще всего вирусы вводят в чувствительные ткани. Лишь малая часть вирусов патогенна для животных независимо от способов введения.
Большая часть нейротропных вирусов выращивают путем введения их в левое и правое полушарие головного мозга животных. Так происходит дело с культивированием вируса у мышей. Кроликам, мышам, овцам, собакам и другим животным аналогичным образом вводят вирус бешенства. Очень часто для культивирования вирусов использую и другой путь: через брюшную полость. Но по чувствительности такой способ уступает введению в головной мозг. Респираторные вирусы чаще вводят в организм интраназальным путем, то есть закапывают в нос или распыляют в виде аэрозоля.
На сирийских хомячках культивируют аденовирус. Вводят его под кожу или в слизистую. В мышцу, через рот, в вену и через анальное отверстие вирусы вводят изредка. Внутривенное заражение произвести с грызунами и другими маленькими животными очень сложно. Вместо этого вирусы вводят прямо в сердечную мышцу.
Осложняется культивирование вирусов в организме животных наличием внутри иных вирусов и бактерий. Иногда случается такое, что вирус в организме животного вырабатывает иммунитет к новому культивируемому.
Чтобы снизить вероятность загрязнения культивируемых вирусов для введения материала используют выращенных в изоляции животных. Для этого выбирают животных, у матерей которых нет в организме инфекций, передающихся от матери к плоду. Новорожденных детенышей извлекают из тела матери, вводят в кишечник специальные молочнокислые бактерии. Для вскармливания таких малышей необходимы SPF самки. Затем уже между такими животными размножение осуществляется тем же путем. Содержатся малыши в закрытых помещениях, в которых осуществляется подача воздуха, свежей пищи и воды.
Животные, в организме которых не имеется никаких возбудителей, содержатся в специально отведенных боксах, в строгой изоляции.
Для культивирования вирусов подходят эмбрионы птиц. Для того, чтобы получить нужные результаты, необходимо правильно выбрать особь, ее вид и возраст, путь заражения и дозу. Температура инкубации играет также немаловажную роль. Из эмбрионов птиц чаще всего используют кур. Их организм до 13 дня отличается повышенной чувствительностью. Хорошо размножаются вирусы в желточном мешке, трахее и легких.
Независимо от пути заражения эмбрионы могут быть травмированы. По этой причине гибель эмбрионов в течение суток после заражения вирусов, ученые не расценивают, как особенную. Обычно для размножения вируса в эмбрионе необходима температура от 36 до 37 градусов. Но для некоторых вирусных клеток необходима температура 40 градусов и выше.
Размножаясь в организме эмбрионов вирусы могут приводить к гибели первых. Большую часть известных науке вирусов выращивают не только в организмах животных, но и в культурах клеток и тканей. В большинстве случаев для этих целей используют клеточные культуры на стекле. Суспензионные культуры используют очень редко. Адаптация вируса проходит легче к первичным культурам клеток, нежели к прививаемым. Для размножения человеческих вирусов лучше всего подходят клетки человека или почечные клетки обезьян.
Доза для вируса при заражении должна составлять от 0,1 до 0,001 пятидесяти процентов тканевой цитопатической дозы вируса на клетку. При это объем вводимого материала должен быть невелик. Через пару часов адсорбируют вирус, только после этого в случае токсичности инокулят удаляют.
При размножении большинства вирусов наблюдаются цитопатические изменения. При дегенерации ¾ клеток в культуре наблюдают максимальное содержание вируса. Размножение вирусов, которые не обладают таким свойством, можно установить при помощи реакции гемадсорбции, путем проведения опытов на животных.
Большая часть вирусных клеток после размножения выходят в культуральную среду, другие же так и остаются связаны с клетками. Некоторые герпетические вирусы пересевают наравне с неповрежденными клетками. Это обусловлено тем, что при разрушении последних осуществляется их инактивация. В некоторых случаях взаимодействие вируса и клетки приводит к развитию хронической болезни.
Чтобы вырастить коронавирус человека, а также другие вирусы берут тканевые культуры. Чаще всего для этих целей используют ткани трахеи кролика. Понять о том, что вирус размножается можно по прекращению движения ресничек культуры ткани.
Нельзя забывать о том, что в культурах клеток и тканей могут быть вирусы и микоплазмы. Попасть туда они могут различным способом.
Для того, чтобы произошла адаптация вируса в искусственно созданных условиях, необходимо проведение нескольких пассажей. Чаще всего они последовательны при введении небольшого количества материала. Во время такой процедуры интенсивность культивирования вируса только растет. Адаптировавшись к одной системе, вирусы часто приобретают возможность размножаться в других системах. Те вирусы, которые выделены недавно, обладают повышенной пластичностью, нежели те, которые долго культивировались в других условиях.
Следствием культивирования вируса в искусственных условиях становится уменьшение их патогенности для естественных владельцев. Такое их свойство положено в основу вакцинации. Если условия культивирования неблагоприятны, то в результате процесса могут появляться дефектные вирусные частицы. В них может содержаться лишь некоторая часть генома. Существуют вирусы, которые в искусственной среде культивировать и вовсе нельзя. После нескольких пассажей их репродукция прекращается.
Вирусы сохраняют в особых условиях. Температура среды не должна быть меньше 4 градусов, а кислотность должна быть равна 7.0. При низкой температуре -70 и ниже вирусы сохраняются отлично. Для этого их помещают в плотно закрытые сосуды. При таких условиях хранения многие из них могут живут годами.
Вирус оспы и энтеровирус хорошо хранится при температуре -20 градусов. Замораживают их быстро. Для их сохранения к среде добавляют стабилизаторы, которые на каждый вирус действуют неоднозначно.
После лиофилизации вирусы могут жить на протяжении длительного промежутка времени. Стабилизаторы, которые применяют: молоко, пептон или куриный желток. Сохранение лиофилизированного вируса должно осуществляться в вакууме или нейтральном газе.
Внимание! Компания Медика Групп занимается продажей автоматических микробиологических анализаторов и флаконов с питательными средами, но не оказывает услуги по сбору или расшифровке результатов анализов крови.

Но и Дженнер не имел представления о том, что является причиной заболевания оспой. В XIX веке все болезнетворные организмы и вещества без разбора называли вирусами. Лишь благодаря опытам отечественного биолога Дмитрия Иосифовича Ивановского прекратилась эта путаница! Он пропускал экстракт заражённых табачной мозаикой 1 растений через бактериальные фильтры, сквозь которые не проходят даже самые мелкие бактерии. Выяснилось, что экстракт оставался по-прежнему заразным для других растений. Значит, возбудителями табачной мозаики были организмы, меньшие по размеру, чем бактерии; их назвали фильтрующимися вирусами. Вскоре бактерии перестали называть вирусами, а сами вирусы выделили в отдельное царство живых организмов. Дмитрий Ивановский же во всём мире по праву считается основателем вирусологии — науки о вирусах.

Рис. 2. Дженнер прививает Джеймса Фиппса от оспы
Но что мы пока поняли про вирусы? Только то, что они меньше бактерий. Чем же вирусы так не похожи на другие организмы? И почему понадобилось вдруг их выделять в отдельное царство? А вот почему. В отличие от других живых организмов, вирусы не имеют клеточного строения, а значит, и всех характерных для клетки структур. А ещё они единственные, кто не умеет самостоятельно производить белок, главный строительный материал всего живого. Поэтому их размножение невозможно вне заражённой клетки. Из-за этого многие учёные не без оснований считают вирусы внутриклеточными паразитами.
Жертвами различных вирусов становятся представители всех без исключения существующих царств живых организмов! Так, есть вирусы растений — вирус табачной мозаики (рис. 3, слева), вирус мозаики костра (это растение изображено на рисунке 3, справа), вирус желтухи свёклы, вызывающий иногда даже эпидемии. Кстати, в растение вирус просто так не проникнет. Заражение происходит при травмах растительных тканей. Типичный пример: тля пьёт сок из стебля и для этого протыкает покровные ткани — а вирус тут как тут.

Рис 3. Слева: листья табака, поражённые вирусом табачной мозаики. Справа: костёр (лат. Brómus) — род многолетних травянистых растений семейства Злаки. Если посмотреть на заросли костра в ветреную погоду, его крупные метёлки, склоняясь под ветром то в одну, то в другую сторону, отсвечивают красноватым светом в солнечных лучах, очень напоминая языки пламени. Отсюда, вероятно, и произошло русское название этого растения
Грибы тоже поражаются вирусами, вызывающими, например, побурение плодовых тел у шампиньонов или изменение окраски у зимнего опёнка. Причиной многих опасных заболеваний животных и человека тоже служат вирусы: вирус гриппа, ВИЧ (вирус иммунодефицита человека), вирус Эбола, вирус бешенства, герпеса, клещевого энцефалита и т. д.
Есть даже вирусы, поражающие бактерии, их называют бактериофагами 2 . Так, в конце XIX века исследователи из Института Пастера заметили, что вода некоторых рек Индии обладает бактерицидным действием, то есть способствует снижению роста бактерий. И достигалось это благодаря присутствию в речной воде бактериофагов.

Рис. 4. Слева: вирус табачной мозаики. В центре: вирус мозаики костра похож на футбольный мяч (справа)

Рис. 5. Слева направо: вирус герпеса, аденовирус А человека, бактериофаг

Рис. 6. Маленькие вирусы-спутники внутри гигантского мимивируса
Но не стоит думать, что вирусы причиняют исключительно вред другим организмам! Так, исследователи из Пенсильванского университета показали, что безвредный для человека вирус AAV2, встречающийся почти у всех людей, убивает самые разные виды раковых клеток. При этом здоровые клетки организма вирус не заражает.
А совсем недавно стало известно, что вирусы тоже болеют. Мимивирус, поражающий амёбу Acanthamoeba polyphaga, сам страдает от другого вируса-спутника (рис. 6). Он, кстати, так и называется — Спутник. Этот вирус-спутник использует механизмы воспроизводства мимивируса для собственного размножения, мешая ему нормально развиваться в клетке амёбы. По аналогии с бактериофагами, он был назван вирофагом, то есть пожирающим вирусы. Можно сказать, что присутствие вируса-спутника в амёбе обеспечивает ей больше шансов на выживание в борьбе с мимивирусом.
Читайте также:

