Как вирусы прикрепляются к клетке
Обновлено: 12.05.2024
В 2007 году сотрудники биологического факультета МГУ Лидия Нефедова и Александр Ким описали, как мог появиться один из видов вирусов, ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. Melanogaster и её эндосимбионта (т.е. микроорганизма, живущего внутри дрозофилы), бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома, ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена, env, который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы к её симбионту, Wolbachia. Мы не случайно упомянули здесь об этом открытии. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий, в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на далёкие расстояния людьми, и опустошали целые города. И также внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и которым заражалось, а затем погибало, большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских учёных, И. Дэймона и его коллег, которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же работе учёные недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков.
В поле зрения учёных вирусы попали в начале XVIII века. Тогда европейские врачи заинтересовались феноменом непроизвольной вакцинации, когда заражённые в лёгкой форме коровьей оспой люди были не подвержены оспе натуральной, то есть человеческой. Прорыв в этом вопросе произошёл в 1796 году, когда английский врач и учёный Эдвард Дженнер произвёл публично первую прививку от оспы. После этого прошло без малого двести лет, когда в 1892 году впервые был описан первый вирус. Звание первооткрывателя вирусов по праву принадлежит российскому микробиологу Дмитрию Иосифовичу Ивановскому, который в конце XIX века сумел описать вирус, вызывавший мозаичную болезнь растения табака. И вслед за этим открытием началось лавинообразное изучение вирусов, которые не перестают нас удивлять и преподносить неожиданные сюрпризы.
После детального изучения вирусов, которые получили своё название от латинского слова virus (яд), стало известно, как именно они устроены. Полноценная вирусная частица, вирион, состоит из белковой оболочки, капсида, и внутреннего содержимого: нуклеиновой кислоты, кодирующей вирусные гены. Вирусы бывают двух видов: ДНК- и РНК-вирусы.
Рис. 1 Строение вируса ВИЧ.
Почти все из известных сегодня науке вирусов имеют свою специфическую мишень в живом организме – определённый рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от вируса. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам, и потому поражает именно их, вирусы гепатита – к клеткам печени и т.д. Некоторые вирусы, такие как вирус гриппа А-типа и риновирус, прикрепляются к рецепторам гликофорин А и ICAM-1, которые присутствуют у нескольких видов клеток. Вирус иммунодефицита избирает своей мишенью целый ряд клеток: в первую очередь, клетки иммунной системы (Т-лимфоциты-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор.
Рис. 2. Процесс инфицирования ВИЧ клеток-лимфоцитов.
Одновременно с этим в организме реализуется ещё один, молекулярный, защитный механизм: поражённые вирусом клетки начинают производить специальные белки, интерфероны, о которых многие слышали в связи с гриппозной инфекцией. Существует три вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки, Т-хелперы и С08+Т-лимфоциты, что придаёт ему свойство иммунномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности репликации (размножения).
В 2008 году американцы открыли ещё один интерферон-зависимый антивирусный механизм. Выяснилось, что он стимулирует синтез белка BST-2 (тетерина), блокирующего выход вирионов из клетки. Но некоторые вирусы научились обходить действие интерферона. Так, вирус Эбола с помощью своего белка eVP24 не даёт ядерному фактору PY-STAT1 проникнуть в ядро и запустить действие интерферона[3].
Рис.3 Рисунок и фото вируса Эбола.
Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирус Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается ещё несколькими сопутствующими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда, Джеп Гудсмит с коллегами, изучая иммунный ответ на ВИЧ-вакцину, обнаружили т.н. феномен антигенного импринтинга[5]. Он был описан ещё в далёком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд учёных, стоит препятствием перед созданием эффективной вакцины против ВИЧ.
Открытие биологов из МГУ, Нефёдовой и Кима, о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной версии.
Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, от которых быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов и даже Эболы. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году. А ведь по всему миру сейчас насчитывается 150 млн. человек, носителей этого вируса! И, по данным ВОЗ, каждый год от этой инфекции умирает 350 000-500 000 человек[7]. Для сравнения – от лихорадки Эбола в 2014-2015 гг. погибло 11 184 человека[8].
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению учёных, главные из них – это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие грязной экологии и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой.
Наш эксперт: Евгений Комаровский, врач-педиатр, инфекционист, телеведущий:
Главная сложность лечения вирусных инфекций состоит в том, что некий лекарственный препарат должен проникнуть внутрь клетки человеческого организма и уничтожить вирус, не повредив при этом саму клетку и её соседей. Поэтому действие противовирусных препаратов направлено, как правило, на замедление размножения вируса и активацию собственного иммунитета. Лучшая стратегия противодействия вирусам – профилактика.
Популярная механика, №9, 2015.
[1] Коронавирусы – РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку лёгочных альвеол), повышая проницаемость клеток, что приводит к нарушению баланса воды-электролитов и развитию пневмонии.
[2] Информационный бюллетень ВОЗ N°401. Июнь 2015 г.
[4] Robinson W. et al. Antibody-dependent enhancement of human immunodeficiency virus type 1 (HIV-1) infection in vitro by serum from HIV-1-infected and passively immunized chimpanzees. Proc Natl Acad Sci USA. 1989, 86(12):4710-4.
[5] Nara P., Garrity R., Goudsmit J. Neutralization of HIV-1: a paradox of humoral proportions. FASEB J. 1991. № 5, р. 2437–2455.
[6] Супотницкий М.В. ВИЧ/СПИД-пандемия – проблема, требующая переосмысления. К 30-летию открытия вируса иммунодефицита человека. Актуальная инфектология. 2014, № 3, с. 45-63.
[7] Информационный бюллетень ВОЗ №164, апрель 2014 г.
[8] WHO. Ebola Situation Report, 17.06. 2015 г.
[9] Reid A. et al. Characterization of the 1918 "Spanish" influenza virus neuraminidase gene. Proc Natl Acad Sci USA. 2000, 6;97(12):6785-90.
Мы кратко рассмотрели структуру вирионов гриппа и процесс кодирования вирусными РНК одного и более белков. Теперь обратимся к размножению вирусов гриппа.
Вирусы – это исключительно внутриклеточные паразиты, они не могут воспроизводиться вне клетки. Появление новых инфекционных частиц должно протекать внутри клетки. Войдя в клетки, вирусы начинают паразитировать в структуре хозяина для воспроизводства вирусного потомства. Все события, происходящие в инфицированной вирусом клетке, называются инфекционным циклом, или вирусной репликацией. Вирусологи искусственно разделяют инфекционный цикл на несколько стадий, чтобы проще было его изучить. Эти стадии включают прикрепление и вхождение вириона, трансляцию мРНК в белок, репликацию генома (создание большего количества РНК или ДНК), скопление новых частиц и выход частиц из клетки. Мы рассмотрим каждую из названных стадий, а затем обсудим, как вирус гриппа инфицирует нас и вызывает болезнь.
Остановимся на первой стадии – прикреплении вириона к клетке. Возьмем обычную клетку, с которой, я уверен, знаком каждый. Но не будет лишним повториться.
Рисунок 10.
Слева показан клеточный белок, прикрепленный к цитоплазматической мембране. Снизу изображена внутренняя часть клетки – цитоплазма. Часть белка пересекает мембрану, и также видны части цитоплазматической и внеклеточной сторон. Сферы – это сахара, прикрепленные ко множеству белков (белок + сахар = гликопротеин). Сиаловая кислота всегда является последним сахаром в цепи, которая прикрепляется к белку. Справа показана химическая структура сиаловой кислоты; следующий сахар (справа) – галактоза. Вирионы гриппа прикрепляются к клеткам, когда HA захватывает очень маленькую сиаловую кислоту.
Сахар в сравнении с HA в действительности очень мал – он подходит к небольшому кармашку на острие шипа. На рис. 11 изображена молекулярная модель, демонстрирующая, как HA прикрепляется к аналогу сиаловой кислоты. Шаровидный конец HA показан в верхней части рис. 11. Маленькие красные и белые сферы показывают места будущего прикрепления сиаловой кислоты – кармашки на верхнем конце HA.
Рисунок 13.
Процесс вхождения вируса гриппа в клетки – наиболее понятный из всех известных механизмов проникновения вирусов. После прикрепления вириона к сиаловой кислоте, имеющей рецепторы на поверхности клетки, вирус-рецепторный комплекс входит в клетки посредством эндоцитоза – процесса, в ходе которого клетки обычно берут молекулы из внеклеточной жидкости. Пока эндосомальные везикулы, содержащие частицы вируса, движутся к ядру клетки, их pH понижается. Это изменение в pH завершает клеточный канал, закачивающий протоны (H+) в везикулу. Когда эндосомальная pH достигает 5,0, вирусный белок HA подвергается конформационной перестройке. Это изменение подвергает пептид слияния на HA короткой гидрофобной последовательности, вставляющей его в эндосомальную мембрану, которая от этого сливается с вирусной оболочкой. Когда это происходит, вирусные РНК проникают в цитоплазму. Затем они транспортируются в ядро клетки, где начинается размножение.
В вирионе гриппа вирусные РНК не оголены, поскольку к ним прикреплены вирусные белки, включая белок M1. Этот белок образует оболочку, лежащую в основе липидной мембраны вириона. К сожалению, если вирусные РНК прикрепляются к белку M1, когда выходят из вириона, они не могут достичь ядра. Для решения этой проблемы вирион гриппа имеет в своей мембране несколько копий белка, называемого M2. Этот вирусный белок образует канал в мембране, который активно закачивает протоны из эндосомы во внутреннюю часть вириона. Данные протоны понижают pH внутри вириона, освобождая вирусные РНК от M1. В этом случае РНК могут войти в ядро.
Ионный канал M2, являющийся мишенью для противовирусных адамантанов, показан на рис. 14. Эти образования забивают канал и не позволяют протонам закачиваться в вирион. В присутствии адамантанов вирусным РНК нужно прикрепляться к M1, отчего они не могут достичь ядра. Поэтому вирусная репликация подавляется. Устойчивость к адамантанам возможна при изменении в аминокислотах, прокладывающих канал M2. Такие изменения не дают лекарству забить канал.
Рисунок 15.
На рис. 15 сферический конец белка HA, который прикрепляется к рецепторам клетки, изображен сверху, а вирусная мембрана – снизу. Для наглядности помечен только сайт расщепления HA. Нерасщепленная форма белка называется HA0; после расщепления клеточным ферментом образуются два белка, называемые HA1 (синий) и HA2 (красный). Две субъединицы остаются вместе на поверхности вирусной частицы. Новая амино(N)-концевая область HA2, образовавшегося при расщеплении, содержит последовательность гидрофобных аминокислот, называемых пептидом слияния. Во время вхождения вируса гриппа в клетки пептид слияния вставляется в эндосомальную мембрану и вызывает слияние вирусной и клеточной оболочек. Следовательно, вирусные РНК гриппа могут войти в цитоплазму. Процесс слияния описан в предыдущем параграфе.
Если белок HA не расщеплен, чтобы образовать HA1 и HA2, слияния не происходит. Поэтому вирусы гриппа с нерасщепленным HA не заразны. Расщепление вирусного HA происходит после того, как вновь синтезированные вирионы выходят из клетки. Вирусы гриппа эффективно размножаются в яйцах из-за присутствия протеазы в аллантоисной жидкости, способной расщеплять HA. Однако репликация многих штаммов вируса гриппа в культурах клеток требует добавления в среду соответствующей протеазы (как привило, трипсина).
У людей репликация вируса гриппа ограничена дыхательными путями, потому что это единственный участок, где производится протеаза, расщепляющая HA. Однако белок HA высокопатогенных штаммов H5 и H7 вируса птичьего гриппа может расщепляться протеазами, производимыми во многих различных тканях. В результате эти вирусы способны размножаться во многих органах птиц, включая селезенку, печень, легкие, почки и мозг. Это свойство объясняет способность штаммов H5N1 вируса птичьего гриппа размножаться вне дыхательных путей человека.
Подобно белкам HA высокопатогенных вирусов H5 и H7, HA штамма вируса гриппа 1918 г. может также расщепляться повсеместно присутствующими клеточными протеазами. Следовательно, вирус может размножаться в культурах клеток без добавления трипсина.
Белки HA H5 и H7 имеют множество основных аминокислотных остатков на сайте расщепления HA1-HA2, которые делают возможным расщепление посредством широко представленных протеаз. Но HA вируса гриппа H1 1918 г. не обладал этим свойством. Также N1 1918 г. не был в состоянии привлечь протеазы, которые расщепляли бы HA, т. е. не было механизма, позволяющего штамму A/WSN/33 вируса гриппа размножаться в клетках без трипсина. Понимание того, как белок HA вируса H1 1918 г. мог быть расщеплен протеазами – основной в понимании высокой патогенности данного штамма.
Рекомендуемая литература.
Chaipan, C., Kobasa, D., Bertram, S., Glowacka, I., Steffen, I., Solomon Tsegaye, T., Takeda, M., Bugge, T., Kim, S., Park, Y., Marzi, A., &Pohlmann, S. (2009). Proteolytic Activation of the 1918 Influenza Virus Hemagglutinin Journal of Virology, 83 (7), 3200-3211 DOI:10.1128/JVI.02205-08.
Перед развитием в культуре клеток многие вирусы культивируются в куриных яйцах с развивающимся эмбрионом. На сегодняшний день этот метод в большинстве случаев используется для выращивания вируса гриппа. Превосходный урожай вируса из куриных яиц привел к их широко распространенному использованию в исследовательских лабораториях и при производстве вакцин. В действительности подавляющее большинство противогриппозных вакцин, как инактивированных, так и инфекционных, производится в куриных яйцах. Как вирус гриппа размножается в яйцах?
Рис. 41 демонстрирует срез куриного яйца с развивающимся эмбрионом. Показаны различные пути инокуляции в яйцо, так же как и различные отделения, где размножаются вирусы.
Рисунок 41.
Для размножения вируса гриппа используются свободные от патогена яйца 11 – 12-го дня после оплодотворения. Яйцо располагают перед источником света для определения области аллантоисной полости без прожилок, расположенной под воздушным мешком. Она помечается карандашом. После того, как все яйца просвечены таким образом, делается небольшая зарубка в скорлупе в этой позиции с использованием ювелирного резца. Затем просверливается отверстие сверху яйца при помощи моторизированного инструмента Дремеля (Dremel). Если этого не сделать, то после введения вируса давление в воздушном мешке просто вытеснит посевной материал.
После того как на всех яйцах поставлена зарубка и они просверлены, в них вводится вирус при помощи шприца для инъекций туберкулина – шприц на 1 мл, заполненный на ½ дюйма, стрелка указателя в позиции 27. Игла проходит через отверстие в скорлупе, сквозь хориоаллантоисную мембрану, и вирус помещается в аллантоисной полости, заполненной аллантоисной жидкостью. Два отверстия в скорлупе запечатываются расплавленным парафином, и яйца помещают на 48 часов в термостат, установленный на 37°С.
В течение инкубационного периода вирус размножается в клетках, составляющих хориоаллантоисную мембрану. Так как новые вирусные частицы образуются почкованием (см. 4.1.), они выходят в аллантоисную жидкость. Чтобы собрать вирус, удаляют верхушку яичной скорлупы – часть, покрывающую воздушный мешок. Для этого когда-то мы пользовались специальным инструментом, который располагался над яйцом. Было легко удалить эту часть скорлупы пинцетом. Скорлуповая оболочка и хориоаллантоисная мембрана протыкались пипеткой, которая использовалась для удаления аллантоисной жидкости – примерно 10 мл в каждой яйце. Достаточное количество вируса для производства 15 мкг дозы вакцины могло быть собрано из одного или двух яиц (в зависимости от штамма вируса).
Когда-то мы выращивали так много вируса гриппа, что большая термальная комната с отдельным входом использовалась как инкубатор для яиц. Когда вы открывали дверь инкубатора и слышали писк, это значило, что кто-то оставил неиспользованные яйца на слишком долгое время и они вывелись. В этом случае вам предстояло поймать неуловимых цыплят.
Взрослые обладают перекрестно-реагирующими антителами к A/California/04/2009 (H1N1)
[Главы нет в содержании, но есть ссылка на нее из глав 7.2. и 7.3.]
Дает ли предыдущее знакомство с вирусами гриппа H1N1, обусловленное заражением или вакцинацией, какую-либо защиту против заражения новыми штаммами H1N1? Ответ на этот вопрос может прояснить, почему свыше 60% подтвержденных случаев гриппа были вызваны вирусами, подобными вирусам свиного гриппа H1N1, в США у людей от 5 до 24 лет, как сообщалось на пресс-конференции CDC.
Для ответа на этот вопрос CDC проанализировал образцы сыворотки, собранные в течение предыдущих исследований вакцины. Эти сыворотки собрали от детей и взрослых до и поле того, как их привили вакциной против гриппа, в сезоны гриппа 2005 – 2006, 2006 – 2007, 2007 – 2008 и 2008 – 2009 гг. Применялись методы нейтрализации вируса и торможения гемагглютинации для определения того, содержат ли эти сыворотки антитела, перекрестно-реагирующие с новым штаммом H1N1. В качестве образца новых изолятов вируса H1N1 использовался A/California/04/2009.
Результаты показали, что предварительная вакцинация детей (в возрасте от 6 месяцев до 9 лет, всего 79 образцов) или сезонной тривалентной инактивированной вакциной, или инфекционной аттенуированной противогриппозной вакциной в предыдущие 4 года не вызвала перекрестно-реагирующих антител для ответа на A/California/04/2009 у взрослых. Среди людей возраста от 18 до 64 лет был двукратный рост перекрестной реактивности антител к вирусу в сравнении с 12 – 19-кратным ростом в титрах антител против сезонных штаммов. У людей старше 60 лет не было роста кросс-реактивности антител. Эти данные показывают, что иммунизация сезонной противогриппозной вакциной, содержащей прежние штаммы H1N1 (2005 – 2009 гг.), похоже, не дает защиты против инфицирования новыми штаммами H1N1.
Важным является вопрос, содержат ли сыворотки, полученные до введения вакцины, перекрестно-реагирующие титры антител против A/California/04/2009. Такой анализ показал бы, дает ли естественное заражение штаммами H1N1 некоторую защиту против новых изолятов. У 79 детей в возрасте от 6 месяцев до 9 лет до вакцинирования не было обнаружено перекрестно-реагирующих антител в сыворотке к A/California/04/2009. Однако 6% взрослых в возрасте от 18 до 40 лет, 9% – от 18 до 64 лет и 33% старше 60 лет имели перед вакцинацией нейтрализующие титры антител к A/California/04/2009 выше 160 или равные этому значению. Эти антитела, скорее всего, были приобретены с инфицированием вирусом H1N1, по антигенным свойствам более близким к A/California/04/2009, чем к другим штаммам сезонного H1N1. Неизвестно, могут ли эти антитела дать защиту против заражения, но они могут уменьшить тяжесть симптомов болезни.
Я подозреваю, что не все знакомы с методами микронейтрализации и торможения гемагглютинации, используемыми в этом исследовании. Впоследствии я объясню механизм действия этих методов и важность их результатов.
Рекомендуемая литература.
- J Katz, PhD, K Hancock, PhD, V Veguilla, MPH, W Zhong, PhD, XH Lu, MD, H Sun, MD, E Butler, MPH, L Dong, MD, PhD, F Liu, MD, PhD, ZN Li, MD, PhD, J DeVos, MPH, P Gargiullo, PhD, N Cox, PhD (2009). Serum Cross-Reactive Antibody Response to a Novel Influenza A (H1N1) Virus After Vaccination with Seasonal Influenza Vaccine Morbid.Mortal. Weekly Rep., 58 (19), 521-524.
7.2. Метод торможения гемагглютинации гриппа
Центры по контролю и профилактике заболеваний определили, что некоторые взрослые имеют сывороточные перекрестно-реагирующие антитела к новому вирусу гриппа H1N1. Чтобы сделать такой вывод, использовали одну из методик, называемую методом торможения гемагглютинации. Как он действует?
7.3. Анализ микронейтрализации гриппа
Анализ микронейтрализации – другой метод, с помощью которого Центры по контролю и профилактике заболеваний определили, что некоторые взрослые имеют перекрестно-реагирующие антитела к новому вирусу гриппа H1N1. Рассмотрим, как действует этот метод.
Репликация вируса часто исследуется в лаборатории путем инфицирования клеток, выращиваемых в пластмассовых планшетах или колбах, которые обычно называются клеточными культурами. На рис. 43 – пример клеток HeLa, убиваемых полиовирусом.
Рисунок 43.
Верхний левый квадрат показывает неинфицированные клетки, а другие части показывают клетки в течение определенного времени после заражения. По мере размножения вируса зараженные клетки округляются и отделяются от планшета с культурой клеток. Эти видимые изменения называются цитопатическим эффектом.
Есть и другой путь сделать видимым уничтожение клеток вирусом без использования микроскопа – окрашивание клеток красителем. На рис. 44 клетки были расположены в маленьких лунках 96-луночного планшета. В одну лунку добавили вирус, а в другие – нет. После периода инкубации клетки окрасились в кристаллический фиолетовый, который окрашивает только живые клетки. Видно, какие клетки были поражены вирусом, а какие нет.
7.4. Определение вирусов: анализ бляшкообразования
Одним из наиболее важных процессов в вирусологии при измерении титра вируса является концентрация вирусов в образце. Широко используемый подход для определения количества инфекционного вируса – это анализ бляшкообразования. Данная методика впервые была разработана для подсчета титров линии бактериофагов. Р. Дульбекко (Renato Dulbecco) модифицировал этот процесс в 1952 г. для использования в вирусологии животных, и с тех пор он используется для надежного определения титров многих различных вирусов.
Рисунок 46.
Для проведения анализа бляшкообразования приготавливают 10-кратные разведения линии вирусов и вводят 0,1 мл аликвоты в чувствительные клеточные монослои. После инкубационного периода, во время которого вирус прикрепляется к клеткам, монослои покрываются питательной средой, содержащей вещество (обычно агар), способствующее образованию геля. Когда планшеты инкубируют, в изначально зараженных клетках выводится вирусное потомство. Распространение новых вирусов ограничено гелем до соседних клеток. Следовательно, каждая инфекционная частица производит круговую зону зараженных клеток, называемую бляшкой. В итоге бляшка становится достаточно большой, чтобы стать видимой невооруженным глазом. Краситель, помечающий живые клетки, часто используется для усиления контраста между живыми клетками и бляшками. Этим способом пригоден для анализа только тех вирусов, которые причиняют видимый ущерб клеткам. Пример бляшек, образованных полиовирусом на монослое клеток HeLa, показан на рис. 46. Клетки окрашены кристаллическим фиолетовым, а бляшки без труда видны там, где клетки разрушены вирусной инфекцией.
Титр линии вируса может быть подсчитан в бляшкообразующих единицах (PFU) на миллиметр. Для определения титра вируса подсчитываются бляшки. В целях снижения погрешности подсчитываются только планшеты, содержащие от 10 до 100 бляшек, в зависимости от размера используемого планшета с культурой клеток. Согласно правилам статистики, при подсчете 100 бляшек титр образца будет варьироваться в пределах ± 10%. Каждое разведение проводится дважды для повышения точности. На рис. 47 показано 17 бляшек на планшете, сделанном из разведения 10 -6 . Поэтому титр вируса составит 1,7 × 10 8 PFU/мл.
Рисунок 47.
Впоследствии мы обсудим, как анализ бляшкообразования может использоваться для приготовления клональных линий вирусов – очень важной стадии в исследовании вирусной генетики.
Рекомендуемая литература.
- Dulbecco, R., & Vogt, M. (1953). Some problems of animal virology as studied by the plaque technique. Cold Spring Harbor Symp. Quant. Biol., 18, 273-279.
7.5. Сколько вирусов требуется для образования бляшки?
Анализ бляшкообразования – главный инструмент для определения титров вируса. Идея проста: вирусная инфекция ограничивается до соседних клеток полутвердым верхним слоем. Подсчитывая количество бляшек, можно вычислить титр вируса в PFU на мл. Основной вопрос: сколько нужно вирусов для формирования одной бляшки?
Для большинства вирусов животных одной инфекционной частицы бывает достаточно для начала инфекции. К этому выводу можно прийти, изучая отношения между количеством вирусных частиц и подсчетом бляшек. Линейная зависимость означает, что бляшку может образовать одна инфекционная частица. Считается, что в этом случае вирус заразил клетку с динамикой в один удар. Эта концепция продемонстрирована на рис. 48. Количество бляшек, образованных с динамикой одного или двух ударов показано на графике в сравнении с относительной концентрацией вируса.
Рисунок 48.
Есть некоторые примеры вирусов с динамикой в два удара, другими словами, два различные типа вирусных частиц должны заразить клетку для запуска инфекционного цикла. Примеры включают геномы некоторых РНК вирусов растений с (+) нитью, состоящие из двух молекул РНК, упакованных в различные частицы. Кривая зависимости от дозы подобных вирусов, скорее, параболическая, чем линейная.
Когда единичная вирусная частица способна образовать бляшку, вирусное потомство внутри бляшки представляет собой клоны. Вирусная линия, приготовленная из единичной бляшки, называется очищенной линией вирусов из бляшки. Чтобы приготовить такую линию вирусов, наконечник маленькой пипетки вставляют в верхний слой агара над бляшкой. Пробка агара удаляется и помещается в буферный раствор. Вирусы в пробке агара перемещаются в буферный раствор, который затем можно использовать для заражения клеточных культур. Для обеспечения чистоты этот процесс обычно повторяют как минимум еще раз. В значительной степени очищение бляшки используется в вирусологии для основания клональных линий вирусов. Способность подготовки клональных линий вирусов было важным шагом, позволившим проводить генетический анализ вирусов.
7.6. Измерение вирусов методом конечного разведения
Анализ бляшкообразования – замечательный метод определения титров вируса, но он не применим для всех вирусов. К счастью, доступно несколько альтернативных методов, включая метод конечного разведения.
Метод конечного разведения использовался для измерения титра вируса до развития метода бляшкообразования и все еще применяется для вирусов, не образующих бляшек. Подготавливаются последовательные разведения линии вируса, которые вносятся в копируемые культуры клеток, часто в многолуночных форматах (например, в 96-луночный пластмассовый планшет). Количество заражаемых культур клеток определяется впоследствии для каждого разведения вируса, обычно путем поиска цитопатического эффекта.
В данном примере метода конечного разведения каждый из 10 монослоев клеточных культур был инфицирован разведением вируса. После инкубационного периода планшеты, показавшие цитопатические эффекты, были помечены +. При высоких разведениях ни одна из клеточных культур не была заражена, так как не было частиц. При низких разведениях каждая культура клеток была инфицирована. Половина клеточных культур показала цитопатические эффекты при разведении 10 -5 . Это и есть конечная точка: разведение вируса, при котором 50% клеточных культур оказалось заражено. Это количество может быть высчитано на основании данных и выражено как 50% инфекционной дозы (ИД50) на миллилитр. Линия вирусов в приведенном примере содержит 10 5 ИД50 на мл.
Рисунок 49.
В реальной жизни конечная точка со значением 50% обычно не встречается, как мы показали на примере разведения. Поэтому привлекаются статистические методы подсчета конечной точки титрования.
Методы конечного разведения также могут использоваться при определении вирулентности вируса у животных. Применяется тот же подход: производятся последовательные разведения вирусов и вводятся в ряд подопытных животных. Заражение животного можно определить по его смерти или клиническим симптомам, таким как повышенная температура, потеря веса или паралич. Результаты выражаются в виде 50% летальной дозы (LD50) на мл или 50% паралитической дозы (PD50) на мл, когда смертность или паралич используются как конечные точки.
Следующий пример поясняет использование конечного разведения при подсчете смертности от полиовируса у мышей. Восьми мышам ввели разведение вируса, а конечной точкой была смерть. Статистический метод Рида – Мюнха использовался для определения конечной точки со значением 50%. В этом методе объединены результаты, и смертность подсчитана для каждого разведения. Конечная точка в 50%, которая находится между пятым и шестым разведениями, подсчитана как 10 -6,5 . Поэтому образец вируса содержит 10 6,5 LD50 единиц.
Цикл размножения вирусов. Прикрепление или адсорбция вируса.
Цикл репродукции вирусов при продуктивной инфекции представляет собой специфическую последовательность событий, приводящих к образованию нового потомства вирионов. Его можно разделить на несколько стадий: адсорбция вирионов на поверхности клетки, проникновение вируса или вирусного нуклеопротеида внутрь клетки, депротеинизация генома, синтез вирусных компонентов, формирование и выход из клетки зрелых вирионов. Иногда не все стадии протекают последовательно и полностью даже при продуктивной инфекции. При заражении вирусной нуклеиновой кислотой отсутствует стадия депротеинизации. Цикл репродукции вируса может прерываться на какой-либо промежуточной стадии, и в этом случае инфекционные вирионы не образуются (абортивная инфекция).
Классическое изучение кривой роста вируса в одном цикле репродукции предполагает одновременное инфицирование клеток культуры с использованием высокой множественности заражения (М=10—100) и определение накопления вируса через определенные промежутки времени.
Прикрепление (адсорбция) вирионов к поверхности клетки - первая стадия вирусной инфекции. Для того, чтобы началась инфекция, вирионы должны быть способны прикрепляться к клетке. Безусловно, этот процесс в организме является более сложным, чем в культуре клеток.
Детальное изучение процесса адсорбции вирусов показало, что он состоит из двух быстро следующих друг за другом периодов — обратимого и необратимого. В период обратимой адсорбции вирус можно удалить с поверхности клетки при обработке версеном, хемотрипсином и другими химическими веществами. При необратимой адсорбции вирус удалить с поверхности клетки не удается.
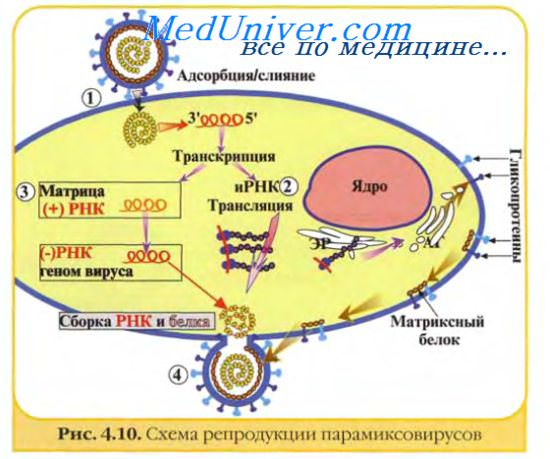
Первичный контакт с клеткой происходит в результате случайных столкновений вирионов с поверхностью клетки. Количество стабильных прикреплений вириона к клетке во много раз меньше количества случайных столкновений.
В основе прикрепления вируса к клетке лежат два механизма — неспецифический и специфический. Первый из них определяется силами электростатического взаимодействия, возникающими между разноименно заряженными группами, расположенными на поверхности клетки и вируса. В этом процессе, прежде всего, могут участвовать положительно заряженные аминные группы вирусного белка и отрицательно заряженные группы клеточной поверхности. В пользу электростатического взаимодействия между клеткой и вирусом свидетельствуют данные о зависимости присоединения вирионов к клеткам от ионной силы раствора и его рН, наличия в среде одно- и двухвалентных катионов и присутствия отрицательно заряженных групп на поверхности клетки.
Наиболее важным механизмом прикрепления вируса является специфическое взаимодействие рецепторов вируса с комплементарными рецепторами клетки.
Прикрепление происходит за счет связи между вирионными прикрепительными белками на поверхности вирионов и рецепторами на плазматической мембране клеток.
На поверхности вирионов многих семейств вирусов (все РНК-содержащие оболочечные вирусы и аденовирусы) имеются пепломеры (выступы и шипы) длиной от 10 до 30 нм, которые принимают непосредственное участие в прикреплении вируса к клетке. Отщепление пепломеров с помощью протеолитических ферментов приводит к потере вирионами способности адсорбироваться на клетках. На поверхности вирионов, не имеющих пепломеров, находятся участки связывания с клеточной поверхностью, которые отличаются сложным строением и, вероятно, состоят из нескольких полипептидов.
Спектр чувствительности клеток к вирусам в значительной мере определяется наличием соответствующих рецепторов. Рецепторный барьер может быть преодолен при заражении инфекционной нуклеиновой кислотой.
На поверхности клетки может находиться большое количество различных видов рецепторов. Полагают, что каждая клетка может адсорбировать от десятков до нескольких тысяч вирионов. На поверхности одной клетки находится около 10000 рецепторов для полиовируса. Каждый рецептор специфичен для одного или нескольких вирусов, как родственных между собой, так и относящихся к различным таксономическим группам. Например, аденовирус типа 2 и вирус Коксаки ВЗ связываются с одними и теми же клеточными рецепторами.
У герпесвирусов прикрепительными белками могут служить гликопротеины оболочки, которые соединяются с некоторыми рецепторами клетки. Клеточным рецептором для многих ортомиксовирусов являются концевые сиаловые кислоты олигосахаридов, входящих в структуру гликопротеринов или гликолипидов, экспонированных на поверхности клетки. Рецепторами для многих риновирусов являются иммуноглобулины. У вируса ВИЧ в прикреплении первоначально участвуют молекулы СД4, расположенные на поверхности клеток, особенно макрофагов и Т-хелперных лимфоцитов. Подобные взаимодействия рецептор-лиганд свойственны другим лентивирусным инфекциям.
Рецепторы для одних вирусов имеются на клетках нескольких или многих тканей, тогда как для других вирусов они обнаружены на клетках одного вида тканей или в один из периодов онтогенеза (новорожденные или взрослые животные).
Рецепторы клеток способны к регенерации после удаления их протеолитическими ферментами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Типы инфицирования клеток вирусами. Репродуктивный цикл вирусов. Основные этапы репродукции вирусов. Адсорбция вириона к клетке.
По характеру взаимодействия генома вируса с геномом клетки выделяют автономное (геном вируса не интегрирован в геном клетки) и интеграционное (геном вируса интегрирован в геном клетки) инфицирование. Особую форму составляют латентное и персистирующее инфицирование.
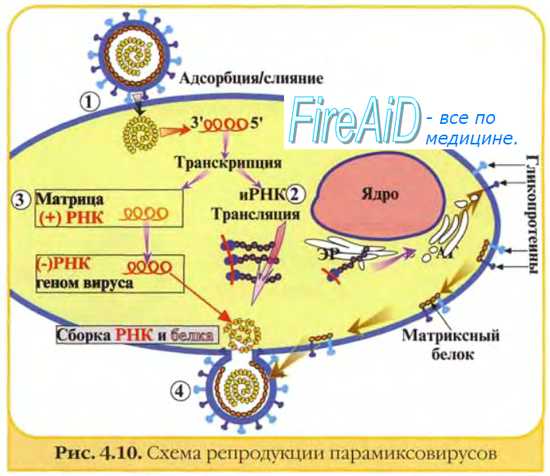
Персистирующее инфицирование клеток вирусам. Некоторые РНК-вирусы могут вызывать персистиру-ющие инфекции, проявляющиеся образованием дочерних популяций возбудителя после завершения острой фазы болезни. При этом происходит постепенное выделение вирусных частиц, но инфицированная клетка не лизируется. Нередко дочерние популяции вирионов дефектны (часто наблюдают у лиц с иммунодефицитами). Иногда такие хронические поражения протекают без клинических проявлений. В частности, вирус гепатита В способен вызывать персистирующее поражение гепатоцитов с развитием хронического гепатита; в дальнейшем возможна малигнизация клеток.
Репродуктивный цикл вирусов
Изображённые на рис. 2-3 этапы репродукции (от адсорбции вирионов до высвобождения дочерней популяции) происходят при продуктивном взаимодействии вируса с клеткой.
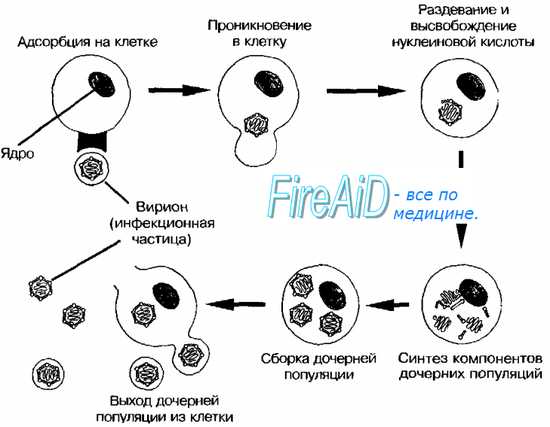
Рис. 2-3. Основные этапы репродукции вирусов.
Адсорбция вириона к клетке
• Процесс адсорбции не зависит от температуры (то есть не требует энергетических затрат) и протекает в две фазы; фаза ионного притяжения обусловлена неспецифическим взаимодействием, фаза прикрепления происходит благодаря структурной гомологии либо комплемен-тарности взаимодействующих молекул.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

